银鲫(Carassius auratus gibelio)属于鲫的近缘亚种,喜好以水草、藻类、小虾等为食,属于杂食性淡水鱼[1],肉质细嫩,营养价值丰富,具有高蛋白低脂肪的特点[2]。自古以来就享有“鱼之美者,洞庭之鲋”的美誉[3]。但是,银鲫喜好栖息在泥塘底层靠近水草、海藻的水域,体内酶系活跃,生命活动旺盛,致使其存在典型的鱼腥味、土霉味[3],不被消费者接受,从而影响其深加工和经济价值。
水产品的腥味会极大影响消费者的可接受度,严重威胁水产养殖业的拓展和未来发展前景[4-5]。腥味物质种类繁多,组成复杂。腥味物质可由水环境中积累[6]、鱼体内脂类氧化或酶促反应形成[7]。JENSE等[8]曾报道,辛醛、癸醛和2,4-癸二烯醛等羰基化合物是造成鲑鱼肉腥味的重要原因。己醛、(Z)-4-庚烯醛和其他低分子质量醛、醇、酮以及少量呋喃、硫醚和萘等都对腥味有贡献[9]。
土腥味是淡水养殖中最严重的异味问题。目前认为淡水养殖环境中能产生土腥味的物质主要包括2,4,6-三氯代茴香醚(2,4, 6-trichloroanisole,TCA)、2-异丁基-3-甲氧基吡嗪(2-isobutyl-3-methoxypyrazine,IBMP)、2-异丙基-3-甲氧基吡嗪(2-isopropyl 3-methoxypyrazine,IPMP)、土臭素(geosmin,GSM)、2-甲基异莰醇(2-methyl isobenol,2-MIB)等[10-11]。其中,JENSE等[8]认为GSM和2-MIB是构成土腥味的关键化合物,前一种有泥土味,而后一种则带有霉味[12]。GSM和2-MIB都属于烯萜醇类化合物,具有亲脂性,半挥发性,微溶于水,它们在水环境中的嗅闻阈值分别为0.015、0.035 μg/L[8]。这2种土腥味物质由蓝藻菌、放线菌和某些真菌代谢产生随后被排泄到水环境中,通常情况下,鱼很容易通过鳃吸收这些异味化合物,然后通过血液运输,最后囤积在富含脂质的组织器官中[13]。GSM和2-MIB的阈值很低,在鱼肉中的嗅觉阈值分别为0.6、0.9 μg/kg[14],因此相较于其他腥味物质更难检测。前人[13]采用固相微萃取-气相色谱/质谱联用(solid phase microextraction combined with gas chromatography/mass spectrometry,SPME-GC-MS)鉴定出鲫鱼肉中的鱼腥味物质,包括己醛、1-戊烯-3-酮、1-戊烯-3-醇、1-辛烯-3-醇,采用微波蒸馏-固相微萃取-气相色/质谱联用(microwave distillation-solid phase microextraction-gas phase color/mass spectrometry,MAD-SPME-GC-MS)仅检测出鲫鱼体内的2-MIB。
近年来检测腥味物质的主要方法有:感官评价法、电子鼻法、顶空-气相色谱质谱联用法、气相色谱-嗅闻测量法、气相色谱-离子迁移谱法等。刘安军等[15]采用CG-MS分别对鲤鱼皮、血、肌肉的腥味进行检测,共发现8种重合的物质;章超桦等[16]采用GC-MS检测鲫鱼皮、内脏、肌肉3部分的腥味物质,结果表明内脏腥味最强,其中己醛为鱼体的特征腥味物质。已有研究主要集中于鱼类不同部位腥味物质的共同点,鲜有对差异的详细分析;同时内脏、血等很少作为食用部位,前人也未对不同部位的肌肉进行细分。
本研究采用固相萃取整体捕集-气相色谱/质谱联用(solid phase extraction and gas chromatography/mass spectrometry,MMSE-GC-MS)分析比较银鲫鱼皮、腹部肌肉、背部肌肉、尾部肌肉的鱼腥味和土腥味物质囤积情况,对4个部位腥味物质差异情况和原因进行较为详细的叙述,同时使用微波蒸馏-固相微萃取-气相色谱/飞行时间质谱联用(microwave distillation-solid-phase microextraction-gas chromatography/time-of-flight mass spectrometry,MAD-SPME-GC-TOFMS)、固相微萃取-全二维气相色谱/飞行时间质谱联用(solid-phase microextraction coupled with full two-dimensional gas chromatography/time-of-flight mass spectrometry,SPME-GC×GC-TOFMS)测定鱼肉腥味物质的含量,比较不同检测方法之间的异同,为探究鱼体不同部位土腥味物质分布规律提供理论支撑,为研究脱腥效果和机制奠定理论基础。
1 材料与方法
1.1 实验材料
银鲫,购自上海荣真水产养殖专业合作社。银鲫捕捞上岸装于放有冰袋的泡沫箱中,2 h内运回实验室。随机抽取6条健康鲜活的银鲫,测定其生物学指数,见表1。急杀、去头及内脏,分背、腹、尾、皮4个部位取样。冰浴条件下捣碎混匀,分装于自封袋中,于-80 ℃冰箱中贮藏待用。
表1 银鲫生物学指数(湿重)
Table 1 Biochemical indicator C. auratus gibelio
鱼质量/g鱼体长/cm鱼体宽/cm745±17.3235.23±0.2512.93±0.40
1.2 试剂与仪器
主要试剂:C7~C30正构烷烃标品,Sigma-Aldrich公司;土臭素和2-甲基异莰醇混标,美国Supelco公司;2,4,6-三甲基吡啶(纯度>98.0%),东京化成株式会社。
主要仪器:Mono-Trap RCC18固相萃取整体捕集剂 (2.9 mm×5 mm×1 mm),日本GL sciences公司;萃取头2 cm, 50/30 μm DVB/CAR on PDMS SPME,美国Supelco公司;7890-5977A气质联用仪、7890B-5977B气相色谱-飞行时间质谱仪、890-PEGSUS 4D全二维气相色谱-飞行时间质谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 MMSE-GC-MS检测
采用固相萃取整体捕集技术结合气质联用仪检测银鲫不同部位挥发性风味物质,参考张晶晶等[17]的方法,称取5.00 g样品于顶空瓶,加入5 mL 0.18 g/mL NaCl溶液,均质后,取5个吸附子固定在顶空瓶上方,50 ℃水浴条件下萃取45 min,将吸附子装入衬管中进行GC-MS分析。
色谱条件:DB-5MS色谱柱(60 m×0.32 mm×1 μm)。程序升温:40 ℃保持1 min;5 ℃/min升至100 ℃;3 ℃/min升至180 ℃;5 ℃/min升至220 ℃;7 ℃/min升至240 ℃,保持5 min。不分流进样。
质谱条件:离子源温度230 ℃;电子能量70 eV;接口温度280 ℃。
定性方法:与NIST2008谱库比对,仅报道正反匹配度均大于800的化合物。
相对气味活度值(relative odor activity value,ROAV)是对腥味物质的含量以及阈值综合评估计算所得,能够更高效合理地确定各化合物对样品总体风味的贡献[18]。规定样品中气味贡献最大的组分ROAVmax=100,其他挥发性风味成分的ROAV按公式(1)计算:一般认为0.1≤ROAV≤1的对整体风味有修饰作用,ROAV>1的为特征性风味化合物。
(1)
式中,Ci,各物质的相对含量,%;Ti,各物质的阈值,μg/kg;Cmax,对整体气味贡献最大组分的相对含量,%;Tmax,对整体气味贡献最大组分的感觉阈值,μg/kg。
1.3.2 全二维气相色谱-飞行时间质谱检测
SPME萃取:准确称取5.00 g样品于顶空瓶中,采用2 cm DVB/CAR/PDMS萃取头顶空吸附样品。50 ℃下平衡10 min,萃取45 min。按照设定参数进行GC×GC-TOFMS分析。
GC×GC-TOFMS条件:第一维柱为DB-5MS非极性柱(30 m×250 μm×0.25 μm);进样温度250 ℃;升温程序:初温40 ℃保留3 min,以3 ℃/min升至160 ℃,再以5 ℃/min升至220 ℃,最后以10 ℃/min升至240 ℃,保留3 min。进样口采用分流进样模式,分流比5∶1。第二维柱为DB-17MS中等极性柱(2 m×100 μm×0.10 μm),柱温比第一维柱高15 ℃,调制解调器温度比第二维柱高15 ℃,全二维分析时调制周期4.0 s。质谱条件:检测器接口温度290 ℃;离子源温度230 ℃;电子轰击源70 eV;检测器1 710 v;采集率50张/s;质谱扫描范围m/z 20~450。
数据处理:原始数据由Chroma TOF软件处理,峰提取(信噪比S/N>50)、峰积分、解卷积、峰对齐等操作后与NIST14和Wiley9谱库检索比对,生成临时鉴定化合物列表,再根据“惰性柱按沸点大小出峰,极性柱按极性大小出峰”的基本原则,对上述初步比对结果进行人工筛选,参考ZHU等[19]选择正反匹配度均大于800的化合物。
定量方法:将内标三羟甲基丙烷(trimethylolpropane,TMP)用甲醇稀释至10 mg/L,迅速将10 μL 10 mg/L的TMP加入到5.00 g均质鱼样品基质中进行顶空萃取。本研究中,假定校准因子均为1.00,每种挥发性化合物的估计质量分数按公式(2)计算:
(2)
式中:CX,各挥发性化合物的浓度,ng/g;AX,各挥发性化合物的峰面积;AS,TMP的峰面积;mS代表TMP的质量,ng;m0,鱼肉的质量,g。
关键风味成分的确定:采用气味活度值法(odor activity value method,OAV),通过各组分浓度(Cx)与其气味阈值(odor thresholds,OTx)之比计算得到,计算方法如公式(3)。一般认为,OAV≥1时,该物质为特征性风味化合物[20]。
(3)
1.3.3 土臭素和2-甲基异莰醇含量的测定
采用微波蒸馏装置,提取银鲫腹肌和背肌中的GSM和2-MIB。前处理及微波参数参照张凯[21]的方法略作修改,取5 g碎肉,添加50 mL 200 g/L NaCl溶液,充分混匀,加入沸石。微波炉参数设置为560 W、5 min,异味组分气化后由N2带出,冷凝管冷凝后,收集微波蒸馏液(图1)。
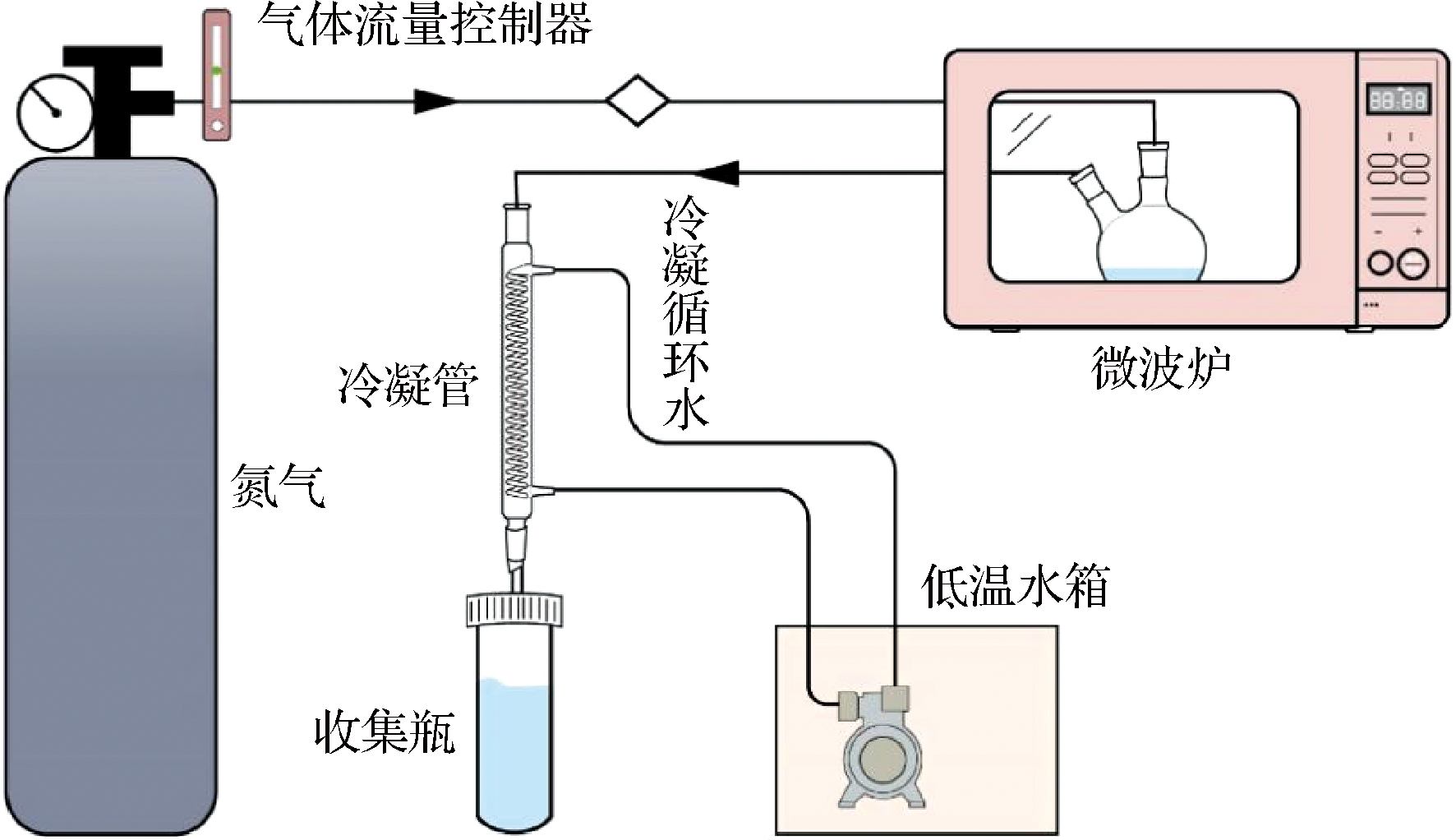
图1 微波蒸馏装置简图
Fig.1 Diagram of microwave-assisted distillation device
顶空固相微萃取条件:吸取5 mL上述收集的馏分于顶空瓶中。采用2 cm DVB/CAR/PDMS SPME萃取头,50 ℃下孵育15 min,萃取40 min。按照设定参数进行GC-MS分析。
GC-TOFMS条件:色谱柱DB-WAX(30 m×250 μm×0.25 μm);不分流进样。升温程序:初温60 ℃保留2.5 min,8 ℃/min升至250 ℃,保留5 min。质谱条件:离子源温度230 ℃;电子轰击电压70 eV;质谱扫描范围m/z 20~400。采用选择性离子扫描模式(selective ion scanning mode,SIM)对GSM和2-MIB进行监测,确定其定量特征性离子质荷比(m/z)分别为95和112。
标准曲线的建立:用色谱级甲醇逐级稀释GSM和2-MIB混标(100 μg/mL)。横坐标为目标物浓度,纵坐标为定量离子峰面积,绘制标曲。
1.4 数据分析
结果以平均值±标准差表示。SPSS 23.0分析显著性差异,不同的字母表示有统计学差异(P<0.05)。Origin 2018用于处理和生成图像。采用Alphasoft V12.44软件进行主成分分析。
2 结果与分析
2.1 银鲫不同部位挥发性风味物质分析
采用MMSE-GC-MS分析发现银鲫的挥发性风味物质主要为醛类、醇类、酮类、芳香族化合物、烃类、呋喃类。由表2可知,银鲫背部、腹部、尾部和鱼皮分别检测出31、34、42、29种挥发性风味物质。
表2 银鲫不同部位挥发性风味物质种类
Table 2 Types of volatile components in different parts of C. auratus gibelio by MMSE-GC-MS

挥发性风味物质背肉腹肉尾肉鱼皮醛类99117醇类7683酮类1253呋喃类0021芳香族化合物1212119碳氢化合物2544其他0012总计31344229
其中尾部鉴定出了最高的挥发性风味物质含量,其原因可能是尾部为红色肉,更易富集挥发性物质。据报道,在新鲜淡水鱼中发现的挥发性风味物质主要由羰基化合物和醇类组成[22]。GC-MS结果如表3所示,本研究中羰基化合物和醇类化合物在银鲫肌肉中的占比约为70%,其中,背部、腹部、尾部的占比分别为70.83%、69.96%、69.17%,而鱼皮中仅占51.39%。分析其原因,可能是鱼体内风味物质主要是通过从水环境和食物中摄入,再经体内代谢富集,而鱼皮中参与体内物质代谢的酶等物质含量少,因此富集的风味物质相对较少。
表3 银鲫不同部位主要挥发性风味物质MMSE-GC-MS分析结果
Table 3 Results of MMSE-GC-MS analysis of volatile flavor compounds in different parts of C. auratus gibelio
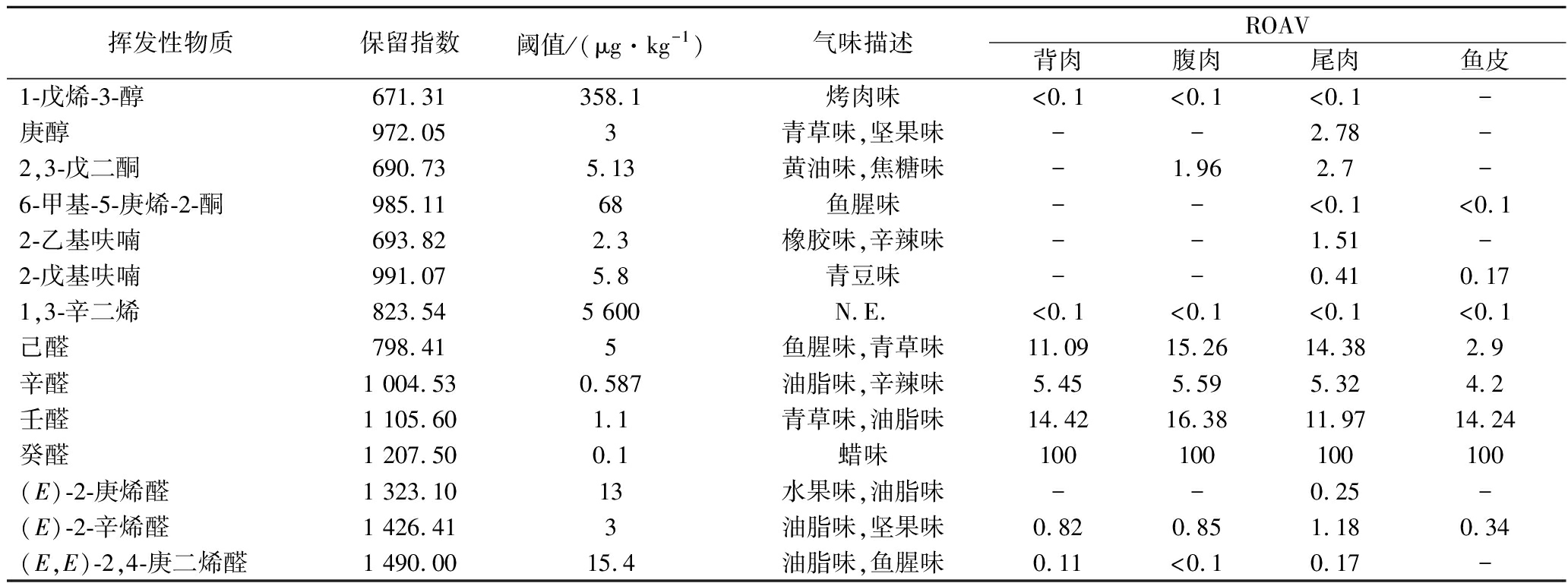
挥发性物质保留指数阈值/(μg·kg-1)气味描述ROAV背肉腹肉尾肉鱼皮 1-戊烯-3-醇671.31 358.1 烤肉味<0.1<0.1<0.1- 庚醇972.05 3 青草味,坚果味 --2.78- 2,3-戊二酮690.73 5.13 黄油味,焦糖味-1.962.7-6-甲基-5-庚烯-2-酮985.11 68 鱼腥味--<0.1<0.1 2-乙基呋喃693.82 2.3 橡胶味,辛辣味--1.51- 2-戊基呋喃991.07 5.8 青豆味--0.410.17 1,3-辛二烯823.54 5 600 N.E.<0.1<0.1<0.1<0.1 己醛798.41 5 鱼腥味,青草味11.0915.2614.382.9 辛醛1 004.53 0.587 油脂味,辛辣味5.455.595.324.2 壬醛1 105.60 1.1 青草味,油脂味14.4216.3811.9714.24 癸醛1 207.50 0.1 蜡味 100100100100 (E)-2-庚烯醛1 323.10 13 水果味,油脂味--0.25- (E)-2-辛烯醛1 426.41 3 油脂味,坚果味0.820.851.180.34 (E,E)-2,4-庚二烯醛 1 490.00 15.4 油脂味,鱼腥味0.11<0.10.17-
注:N.E.表示未查阅到气味描述;-表示未检出
醛类化合物作为肉制品中重要的挥发性化合物,其来源和对食品气味的贡献已得到广泛研究[23]。由于醛类化合物相较于醇类、酮类的气味阈值更低,因此具有强烈特征性气味,并对样品整体气味轮廓产生决定性影响。据报道,C3~C4的醛类化合物具有强烈的刺激气味;C5~C9的醛类化合物具有青草味;C10~C12的醛类化合物具有愉快的柑橘味、香甜味[24]。如图2所示,本研究在银鲫背部、腹部、尾部和鱼皮中分别检测出9、9、11和7种醛类化合物,腹部和鱼皮醛类化合物含量最高,均显著高于背部和尾部,其中己醛、辛醛、壬醛、癸醛是背部、腹部、鱼皮和尾部共有的特征挥发性化合物。上述醛类活性化合物在许多鱼类中都被报道过[25-27],并被认为是脂质氧化的产物[28]。己醛可通过n-9单不饱和脂肪酸,如亚油酸氧化产生[25],该物质在银鲫不同部位都被大量检出,与章超桦等[16]研究鲫中挥发性风味物质的结果具有较好的一致性,说明己醛是鲫鱼体内典型的腥味物质。从图3可以看出,银鲫腹部的己醛含量最多,显著高于其余部位,背部中含量次之,鱼皮中含量最少。银鲫体内检出的其他重要醛类化合物,如辛醛、壬醛和癸醛可由n-9单不饱和脂肪酸,如油酸氧化形成[8],它们一般具有“青草味、脂肪味”,也是重要的腥味物质。此外,辛醛、壬醛和癸醛在鱼皮中的含量显著高于其他部位,可能与鱼皮中的脂肪含量较高有关。(E)-2-庚烯醛、(E)-2-辛烯醛可通过n-6不饱和脂肪酸,如亚油酸、花生四烯酸氧化产生[29],具有“鱼腥味、油脂味”的气味特征,在银鲫背部、尾部、鱼皮均有检出,对其背部和鱼皮整体气味起修饰作用,而对尾部整体风味贡献大。(E,E)-2,4-庚二烯醛由n-3不饱和脂肪酸,如亚麻酸、二十碳五烯酸氧化生成,具有“青草味、脂肪味”,对腥味起增强作用。(E,E)-2,4-庚二烯醛未在鱼皮中检出,其在背部和尾部中的含量显著高于腹部,并对背部和尾部风味有影响。

图2 银鲫不同部位挥发性风味物质总量
Fig.2 Total areas of the volatile components in different parts of C. auratus gibelio

图3 银鲫不同部位腥味物质含量
Fig.3 Peak areas of fishy off-odors in different parts of C. auratus gibelio
醇类是由脂肪酸的氢过氧化物分解产生的次级产物[30],其在银鲫背部、腹部和尾部大量检出,相对百分含量分别为47.07%、37.23%、40.91%,鱼皮中的醇类化合物仅为17.16%。银鲫体内一共检出了9种醇类,包括6种不饱和醇和3种饱和醇。不饱和醇的阈值普遍低于饱和醇,对鱼肉的整体气味影响较大。据报道,1-辛烯-3-醇是由n-6不饱和脂肪酸被12-脂氧合酶(12-lipoxygenase,12-LOX)氧化形成的[31],具有青草、泥土和蘑菇的气味特征[32],气味阈值很低(1.5 μg/L),是导致鱼体异味的重要因素。1-辛烯-3-醇还能作为脂质氧化的标志物,IGLESIAS等[25]利用HS-SPME-GC-MS监测大西洋马鲛鱼肌肉氧化过程中挥发性化合物的变化发现,1-辛烯-3-醇的含量与过氧化值(peroxide value,POV)、硫代巴比妥酸值(thiobarbituric acid value,TBARS)等与鱼脂氧化有关的化学指标高度相关。水产品风味研究中也经常报道1-辛烯-3醇的存在,尤其是在鲑科鱼类中。本研究中也被大量检出(6%~8%),并对银鲫整体风味贡献较大。本研究检测到的另一种对腥味有贡献的醇类化合物是1-戊烯-3-醇,它被认为是多不饱和脂肪酸最典型的氧化标志产物之一[33],该物质在鱼类风味的研究中广泛存在[25, 34]。但因其阈值较高(358.1 μg/L),对银鲫整体风味贡献程度较小。庚醇是本研究中发现的又一种重要的醇类化合物,仅在银鲫尾部检测到,它有助于产生青草味、发酵味、坚果味,可能衍生于n-9单不饱和脂肪酸,如油酸[31]。
酮类可能由脂质氧化、氨基酸降解或微生物作用形成[28]。本研究共检测出了6种酮类物质,其中属于特征性气味的酮类化合物为2,3-戊二酮和1-戊烯-3-酮。2,3-戊二酮有助于产生“黄油味、焦糖味和水果味”,仅在银鲫腹部和尾部被检测到,并在大菱鲆[35]及虹鳟鱼[36]等多种鱼类中都能检测到。张晶晶[37]在探究白姑鱼和小黄鱼气味差异时,通过MMSE-GC-MS-O鉴定出了6-甲基-5-庚烯-2-酮,结合嗅闻确定该化合物金属味和血腥味的气味属性,对腥味贡献大。本研究在银鲫尾部和鱼皮中也鉴定出了该物质,但由于含量少,对整体气味影响不大。
本研究共检测出13种芳香族化合物和7种碳氢化合物。然而这2类化合物中没有属于气味活性的物质,因为它们的阈值很高,对整体气味轮廓贡献小。萘的气味阈值很低(6 μg/L),呈现樟脑味,有研究表明,萘能和其他典型腥味物质一起加强异味[12]。在本实验中,银鲫的各个部位均检测到了萘的存在,对整体气味起修饰作用。芳香族化合物可能来源于鱼类的新陈代谢或环境污染[28]。银鲫背部、腹部、尾部和鱼皮检测出的含量分别为24.79%、24.17%、18.62%和40.73%,鱼皮中的芳香族化合物含量显著高于其余部位。造成这种现象的原因可能是与皮肤长期直接接触养殖环境中的污染物有关。碳氢化合物可能是脂质自动氧化生成或类胡萝卜素分解产生[28]。1,3-辛二烯有着腐败味、霉味的气味特征,因为阈值较高,对整体风味贡献程度较小。
银鲫鱼皮和尾部检测出2-乙基呋喃和2-戊基呋喃这2种呋喃类物质,它们也存在于马鲛鱼[25]、白姑鱼[38]等鱼类中。2-乙基呋喃来自于n-3不饱和脂肪酸的氧化作用[28],具有橡胶味、刺激性的气味特征,对腥味有贡献。呋喃类物质具有较强的挥发性和亲脂性,吸收进入鱼体后在细胞色素p-450酶的作用下迅速代谢,主要在肝脏和肾脏中累积[39]。鱼皮脂肪含量远高于其他3个部位,而尾部肉为红肉,细胞色素p-450酶含量较其他部位含量高,因此仅在皮和尾检测到呋喃类物质。
风味是影响鱼类及其制品食用品质的重要因素。异味,如泥土味,会使鱼类及其制品变得不易接受[40]。如图3所示,本研究共检出了11种腥味物质。从相对气味活度值方面来看,除被定义为ROAVmax=100的癸醛外,对整体风味贡献大的腥味物质为:己醛、辛醛、壬醛和1-辛烯-3-醇。己醛和1-辛烯-3-醇是含有肌红蛋白的漂洗鱼糜中的主要挥发性化合物,增强了腥味和腐臭味[41]。近年来,LIU等[42]和ROBERTSON等[14]一致认为,己醛和1-辛烯-3-醇与2-MIB之间存在潜在的协同作用,可将己醛、1-辛烯-3-醇与淡水鱼类的泥土味联系起来。本研究在银鲫体内检测到了高含量的己醛、1-辛烯-3-醇,腹部含量尤其高。采用MMSE-GC-MS并未检测到银鲫体内的典型泥土味物质GSM和2-MIB,原因可能并不是因为完全没有这些物质,而是因为相关物质痕量存在且与鱼肉结合紧密。
2.2 全二维气相色谱-飞行时间质谱分析
全二维气相色谱-飞行时间质谱可以通过调制器将一维色谱柱中的馏分聚焦,以脉冲的形式送到第二根色谱柱上进一步分离,因而具有峰容量大、分辨率高和灵敏度高[43]等优势,目前已经用于多组分复杂样品分析领域,如白酒[44]、石油[45]等。
采用SPME-GC×GC-TOFMS分析银鲫腹肌中的挥发性风味成分,共检测出约1 600个物质峰,总离子流色谱图和三维色谱如图4所示。
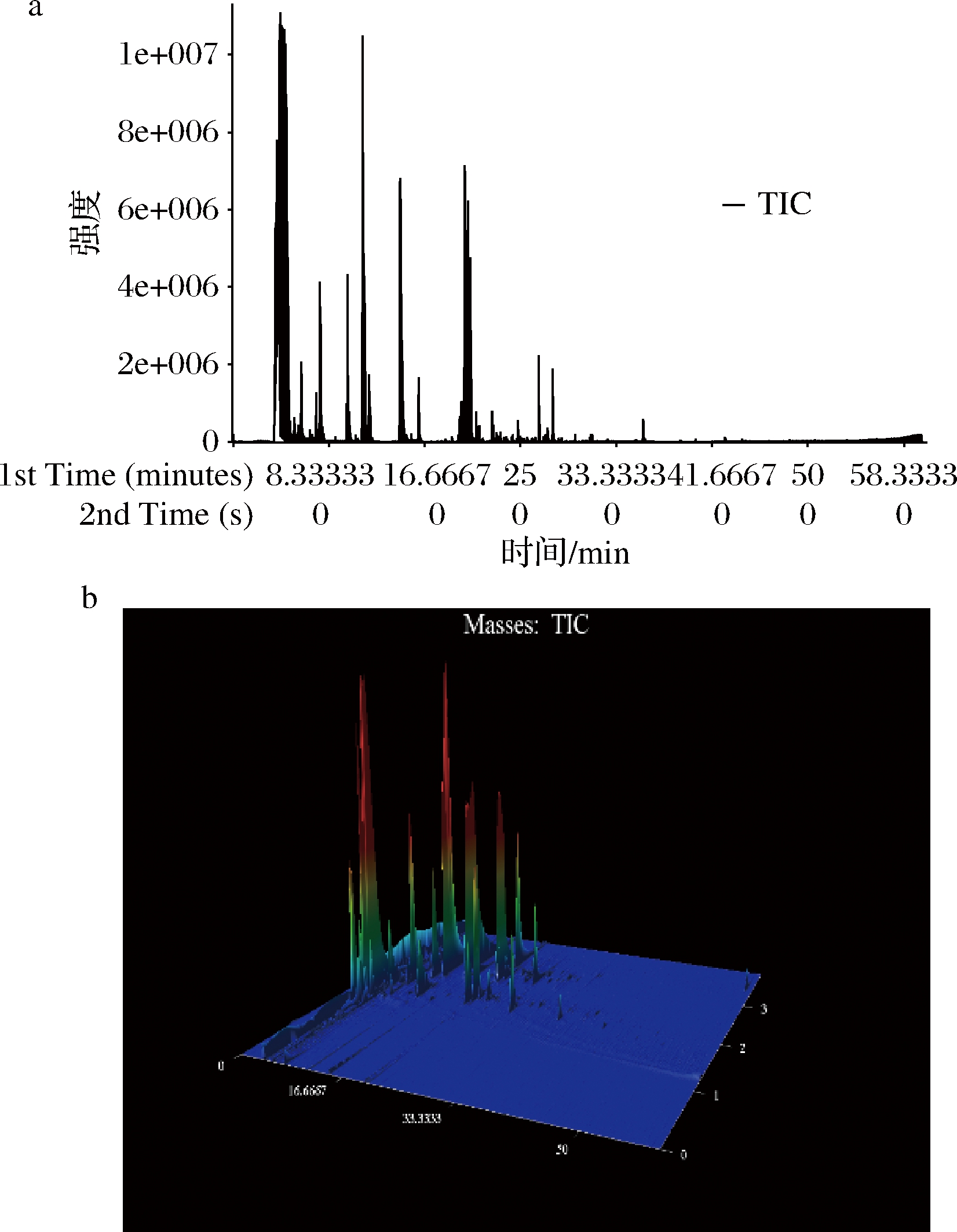
a-一维;b-三维
图4 SPME-GC×GC-TOFMS总离子流色谱图
Fig.4 Total ion flow chromatogram of SPME-GC×GC-TOFMS
经过比对相似度、可能性并剔除杂质峰,共鉴定出101种有效挥发性化合物。采用相对气味活度值来评估对整体气味有贡献的挥发性化合物。根据测得的挥发性有机化合物,从所有101种挥发性风味物质中选出了16种气味活性化合物,由此认为它们是银鲫腹肌气味的主要来源。16种气味活性化合物是:乙酸乙酯、正己醇、2,3-戊二酮、1-辛烯-3-酮、2-乙基呋喃、2-戊基呋喃、反式-2-壬烯醛、己醛、庚醛、(Z)-4-庚烯醛、(Z)-4-癸烯醛、庚醇、辛醛、壬醛、癸醛和1-辛烯-3-醇。OAV越大对整体风味的贡献程度越大,在这些特征性气味化合物中,1-辛烯-3-酮、(Z)-4-癸烯醛和(Z)-4-庚烯醛等对整体风味具有决定性的影响。
对比分析可知,GC-MS检测出的物质绝大多数都能被GC×GC-TOFMS检测到。与GC-MS相比,GC×GC-TOFMS鉴定出更多的挥发性风味物质,同时也能检测出更多的腥味物质如表4所示,如庚醛、(Z)-4-庚烯醛、(E)-2-壬烯醛、(Z)-4-癸烯醛、2-庚酮、6-甲基-2-庚酮和(E,E)-3,5-辛二烯-2-酮等。其中,庚醛、(Z)-4-庚烯醛、(E)-2-壬烯醛和(Z)-4-癸烯醛属于特征性腥味物质。因此,全二维气相色谱技术在风味分析或腥味分析上具有很好的应用前景。
另外,全二维还能鉴定出更多的同分异构体,如(Z)-2-庚烯醛和(Z)-4-庚烯醛、1-辛烯和2-辛烯、1,2-二甲苯和1,3-二甲苯,这些物质沸点和极性相似,在GC-MS分析中容易出现色谱峰重叠现象,而GC×GC-TOFMS通过内部多种不同的分离机制很容易将这些物质分离开[46],提高了分离能力和定性准确度。
表4 GC×GC-TOFMS和GC-MS鉴定银鲫挥发性 风味物质种类的比较
Table 4 Comparison of the volatile components in C. auratus gibelio identified by GC×GC-TOFMS and GC-MS
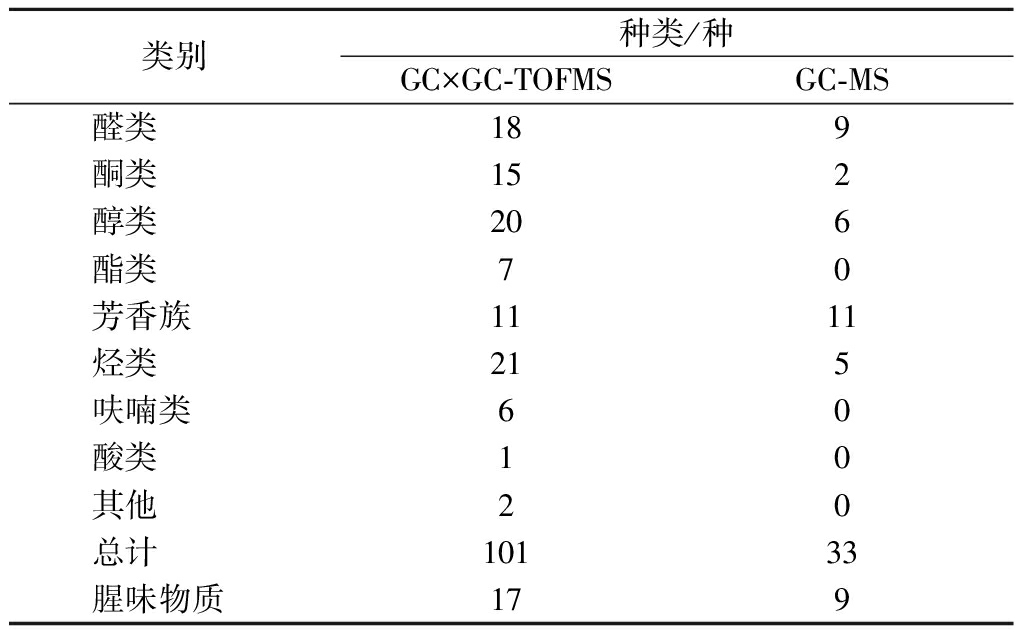
类别种类/种GC×GC-TOFMSGC-MS醛类189酮类152醇类206酯类70芳香族1111烃类215呋喃类60酸类10其他20总计10133腥味物质179
2.3 银鲫鱼肉泥土味物质含量的测定
由表5可知,GSM和2-MIB分别在0.1~10 μg/kg和0.02~4 μg/kg线性关系较好,且R2分别为0.998 1和0.997 5。根据得到的线性方程,将峰面积转换为浓度,计算出银鲫腹肌和背肌的泥土味物质GSM和2-MIB的含量。
表5 土臭素和二甲基异莰醇标准曲线方程
Table 5 Standard curvilinear equation of GSM and 2-MIB

土味物质标准曲线方程R2线性范围/(μg·kg-1)GSMy=2 411.5x+429.790.998 10.10~10.002-MIBy=2 968.6x+58.9150.997 50.02~4.00
如图5所示,GSM含量高于2-MIB。GSM在腹肌和背肌含量分别为 (6.21±0.80)、(2.07±0.03)μg/kg,2-MIB在腹肌和背肌含量分别为(2.32±0.33)、(0.53±0.06)μg/kg。GSM和2-MIB在腹部中积累的含量显著高于背部。原因可能是银鲫腹肌脂肪含量显著高于背肌,GSM和2-MIB具有亲脂性,脂肪含量高的部位泥土味物质含量也高。YARNPAKDEE等[47]在比较研究尼罗河罗非鱼和宽头鲶鱼不同部位泥土味物质差异时发现腹部脂肪和磷脂含量较高,GSM和2-MIB含量也较高。
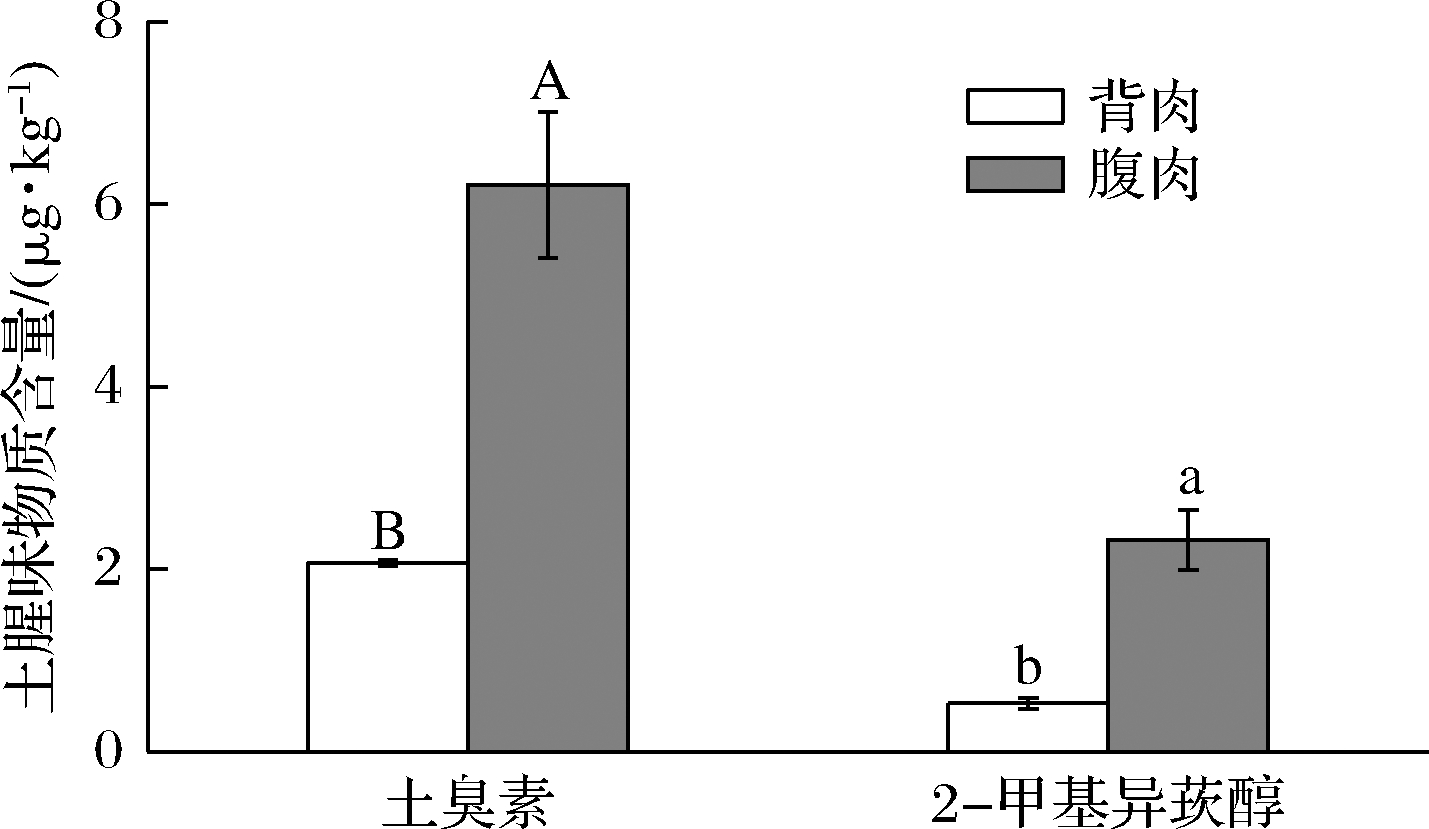
图5 银鲫不同部位土臭素和2-甲基异莰醇的含量
Fig.5 Contents of GSM and 2-MIB in different parts of C. auratus gibelio
注:不同大写字母表示GSM含量在银鲫不同部位差异 显著(P<0.05),不同小写字母表示2-MIB含量在 银鲫不同部位差异显著(P<0.05)
土霉味是水产养殖业中最严重的异味问题[48]。鱼体一旦吸附了GSM和2-MIB后,通常会因其独特的土霉味难以售出。有研究表明,当养殖系统水环境中的GSM和2-MIB的浓度分别达到0.015和0.018 μg/L[2],就会使鱼体带有泥土味。消费者对于鱼肉中土臭素和2-甲基异莰醇的最高可接受浓度约为0.7 μg/kg[13],超过此浓度的鱼被视为不可销售。除了银鲫背肌中的2-MIB含量,其余GSM和2-MIB含量远超0.7 μg/kg的标准,因此有必要对银鲫探究有效的脱腥技术。
通过对3种风味物质检测方法的比较发现,全二维气相色谱比一维气相色谱检测出的挥发性物质更多,效果更好,但未检测出2种典型的土腥味物质。结合大量前人研究以及对本实验过程的深入分析发现,典型土腥味物质不能与其他风味物质一同检出的2个重要原因可能是:(1)固相萃取时萃取头的材质,不同的材质对不同的挥发性物质吸附效果有所不同;(2)样品进行GC-MS分析时的进样方式,应选择不分流进样,以保证更多种类的挥发性物质进入气相进行检测。
3 结论
银鲫不同部位共有的ROAV≥1的特征性腥味物质主要有己醛、辛醛、壬醛、癸醛和1-辛烯-3-醇。(E)-2-辛烯醛对银鲫背部、腹部和鱼皮的风味起修饰作用(0.1≤ROAV≤1),其对尾部整体风味贡献大(ROAV≥1)。(E,E)-2,4-庚二烯醛仅在鱼皮中未检出,在背部和尾部中的含量显著高于腹部,并对背部和尾部风味起修饰作用(0.1≤ROAV≤1)。2-乙基呋喃仅在尾部中检测出,并对尾部风味贡献大(ROAV≥1)。GSM和2-MIB在银鲫背部和腹部均检出,在腹部中的含量显著高于背部(P<0.05),GSM和2-MIB具有亲脂性,易在脂肪含量高的部位囤积。比较3种风味物质测定方法可知,微波蒸馏前处理可以更有效地富集挥发性物质,不需要全二维气相色谱的辅助,只需一维气相色谱就能检测出含量低且难检测的土腥味物质。此研究结果为更高效更全面的测定风味物质,尤其是土腥味物质提供新思路;为提升脱腥效果提供理论支持,有助于水产工业更高效地发展。
[1] 王甜甜. 鲫鱼生物活性肽的制备及其应用研究[D].天津:天津科技大学, 2016.
WANG T T.Research on the preparation of bioactive peptides from Carassius auratus and its application[D].Tianjin:Tianjin University of Science & Technology, 2016.
[2] 王汉玲. 鲫鱼汤的加工工艺及风味物质研究[D].南昌:江西科技师范大学, 2020.
WANG H L.Study on the processing technology and flavor substances of crucian carp soup[D].Nanchang:Jiangxi Science and Technology Normal University, 2020.
[3] 王方. 酸碱处理对鲫鱼糜腥味脱除效果及凝胶特性影响的研究[D].武汉:华中农业大学, 2014.
WANG F.Effects of acid-and alkali-aided processing on the removal of off-flavors and gel properties of surimi from crucian carp(Carastius auratus)[D].Wuhan:Huazhong Agricultural University, 2014.
[4] SMITH J L.A review of cyanobacterial odorous and bioactive metabolites:Impacts and management alternatives in aquaculture[J].Aquaculture, 2008, 280(1-4):5-20.
[5] HOWGATE P.Tainting of farmed fish by geosmin and 2-methyl-iso-borneol:A review of sensory aspects and of uptake/depuration[J].Aquaculture, 2004, 234(1-4):155-181.
[6] WANG R, LI D,JIN C X,et al.Seasonal occurrence and species specificity of fishy and musty odor in Huajiang Reservoir in winter, China[J].Water Resources and Industry, 2015, 11:13-26.
[7] ZHANG Z P, NIU L H, SUN L, et al.Effects of powdered activated carbon, diatomaceous earth and β-cyclodextrin treatments on the clarity and volatile compounds of tilapia (Oreochromis niloticus) skin gelatin[J].Journal of Food Measurement and Characterization, 2017, 11(2):894-901.
[8] JENSEN M T, HANSEN L L,ANDERSEN H J.Transfer of the meat aroma precursors (dimethyl sulfide, dimethyl disulfide and dimethyl trisulfide) from feed to cooked pork[J].LWT - Food Science and Technology, 2002, 35(6):485-489.
[9] VARLET V, KNOCKAERT C, PROST C, et al.Comparison of odor-active volatile compounds of fresh and smoked salmon[J].Journal of Agricultural and Food Chemistry, 2006, 54(9):3 391-3 401.
[10] 韩萃, 魏发奕, 李丽, 等.养殖虹鳟体内土腥味物质分布及其与水质关系的研究[J].中国海洋大学学报(自然科学版), 2021, 51(1):23-30.
HAN C, WEI F Y, LI L, et al.The distribution of off-flavor compounds in farmed rainbow trout (Oncorhynchus mykiss) and their influence factors[J].Periodical of Ocean University of China, 2021, 51(1):23-30.
[11] 杨玉平, 熊光权, 程薇, 等.水产品异味物质形成机理、检测及去除技术研究进展[J].食品科学, 2009, 30(23):533-538.
YANG Y P, XIONG G Q, CHENG W, et al.Review on formation mechanism, analysis and removal technologies of fishy off-odor[J].Food Science, 2009, 30(23):533-538.
[12] ROBIN J.Off flavor characterization and origin in French trout farming[J].Aquaculture, 2006, 260(1-4):128-138.
[13] 刘利平, 李慷, 闫莉.水产动物体内土腥味物质的来源、检测及其防控与去除的研究进展[J].水产学报, 2021, 45(5):813-829.
LIU L P, LI K, YAN L.Sources, determination, prevention and elimination of off-flavour compounds in aquatic animals[J].Journal of Fisheries of China, 2021, 45(5):813-829.
[14] ROBERTSON R F.Depuration rates and the sensory threshold concentration of geosmin responsible for earthy-musty taint in rainbow trout, Onchorhynchus mykiss[J].Aquaculture, 2005, 245(1-4):89-99.
[15] 刘安军, 褚兰玲, 郑婕, 等.鲤鱼土腥味成分的检测与去除[J].现代食品科技, 2011, 27(2):219-223.
LIU A J, CHU L L, ZHENG J, et al.Determination and removal of muddy fish odour from common carp[J].Modern Food Science and Technology, 2011, 27(2):219-223.
[16] 章超桦, 平野敏行, 铃木健,等.鲫的挥发性成分[J].水产学报, 2000, 24(4):354-358.
ZHANG C H,HIRANO T,SUZUKI T, et al.Identification of volatile compounds in Carassius auratus[J].Journal of Fisheries of China, 2000, 24(4):354-358.
[17] 张晶晶, 王锡昌, 施文正.白姑鱼和小黄鱼肉中挥发性风味物质的鉴定[J].食品科学, 2019, 40(14):206-213.
ZHANG J J, WANG X C, SHI W Z.Identification of volatile compounds in white croaker and small yellow croaker[J].Food Science, 2019, 40(14):206-213.
[18] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学, 2008, 29(7):370-374.
LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[19] ZHU S K,LU K,JI K L,et al.Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Analytica Chimica Acta, 2007, 597(2):340-348.
[20] ZHU J C, NIU Y W,XIAO Z B,et al.Characterization of the key aroma compounds in Laoshan green teas by application of odour activity value (OAV), gas chromatography-mass spectrometry-olfactometry (GC-MS-O) and comprehensive two-dimensional gas chromatography mass spectrometry (GC×GC-qMS)[J].Food Chemistry, 2021, 339:128136.
[21] 张凯. 不同系统对养殖水体和罗非鱼肌肉异味物质含量的影响[D].上海:上海海洋大学, 2017.
ZHANG K.Impact of different cultivation systems on the accumulation of off-flavor compounds in tilapia flesh[D].Shanghai:Shanghai Ocean University, 2017.
[22] FU X J, XU S Y, WANG Z.Kinetics of lipid oxidation and off-odor formation in silver carp mince:The effect of lipoxygenase and hemoglobin[J].Food Research International, 2009, 42(1):85-90.
[23] OLIVARES A.Effect of fat content on aroma generation during processing of dry fermented sausages[J].Meat Science, 2011, 87(3):264-273.
[24] ZENG X F, XIA W S, JIANG Q X, et al.Contribution of mixed starter cultures to flavor profile of Suanyu - A traditional Chinese low-salt fermented whole fish[J].Journal of Food Processing and Preservation, 2017, 41(5):e13131.
[25] IGLESIAS J, MEDINA I.Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J].Journal of Chromatography A, 2008, 1 192(1):9-16.
[26] GUAN W L, REN X C, LI Y J, et al.The beneficial effects of grape seed, sage and oregano extracts on the quality and volatile flavor component of hairtail fish balls during cold storage at 4 ℃[J].LWT, 2019, 101:25-31.
[27] LU Q, LIU F F, BAO J Q.Volatile components of American silver carp analyzed by electronic nose and MMSE-GC-MS-O[J].Journal of Food Biochemistry, 2019, 43(11):e13006.
[28] VIDAL N P, MANZANOS M J, GOICOECHEA E, et al.Farmed and wild sea bass (Dicentrarchus labrax) volatile metabolites:A comparative study by SPME-GC/MS[J].Journal of the Science of Food and Agriculture, 2016, 96(4):1 181-1 193.
[29] DUFLOS G, COIN V M, CORNU M, et al.Determination of volatile compounds to characterize fish spoilage using headspace/mass spectrometry and solid-phase microextraction/gas chromatography/mass spectrometry[J].Journal of the Science of Food and Agriculture, 2006, 86(4):600-611.
[30] GIRARD B, DURANCE T.Headspace volatiles of sockeye and pink salmon as affected by retort process[J].Journal of Food Science, 2000, 65(1):34-39.
[31] HSIEH R J, KINSELLA J E.Lipoxygenase generation of specific volatile flavor carbonyl compounds in fish tissues[J].Journal of Agricultural and Food Chemistry, 1989, 37(2):279-286.
[32] ZHANG J J, XU D L, ZHAO X H, et al.Effect of Zanthoxylum bungeanum Maxim on the lipid oxidation and fatty acid composition of dry-cured fish during processing[J].Journal of Food Processing and Preservation, 2017, 41(3):e12894.
[33] ROBERTS D D, POLLIEN P, MILO C.Solid-phase microextraction method development for headspace analysis of volatile flavor compounds[J].Journal of Agricultural and Food Chemistry, 2000, 48(6):2 430-2 437.
[34] ZHOU X X,CHONG Y Q, DING Y T, et al.Determination of the effects of different washing processes on aroma characteristics in silver carp mince by MMSE-GC-MS, e-nose and sensory evaluation[J].Food Chemistry, 2016, 207:205-213.
[35] SÉROT T, REGOST C, PROST C, et al.Effect of dietary lipid sources on odour-active compounds in muscle of turbot (Psetta maxima)[J].Journal of the Science of Food and Agriculture, 2001, 81(14):1 339-1 346.
[36] MA R, LIU X H, TIAN H N, et al.Odor-active volatile compounds profile of triploid rainbow trout with different marketable sizes[J].Aquaculture Reports, 2020, 17:100312.
[37] 张晶晶. 白姑鱼和小黄鱼气味特征及影响因素的差异探究[D].上海:上海海洋大学, 2020.
ZHANG J J.Differences of odor characteristics and influencing factors between white croaker and small yellow croaker[D].Shanghai:Shanghai Ocean University, 2020.
[38] GIOGIOS I, GRIGORAKIS K, KALOGEROPOULOS N. et al.Organoleptic and chemical quality of farmed meagre (Argyrosomus regius) as affected by size[J].Food Chemistry, 2013, 141(3):3 153-3 159.
[39] 谢明勇, 黄军根, 聂少平.热加工食品中呋喃的研究进展[J].食品与生物技术学报, 2010, 29(1):1-8.
XIE M Y, HUANG J G, NIE S P.Recent progress of furan in heat-processed foods[J].Journal of Food Science and Biotechnology, 2010, 29(1):1-8.
[40] GANEKO N, SHODA M, HIROHARA I, et al.Analysis of volatile flavor compounds of sardine (Sardinops melanostica) by solid phase microextraction[J].Journal of Food Science, 2008, 73(1):S83-S88.
[41] THIANSILAKUL Y, BENJAKUL S, RICHARDS M P.Effect of myoglobin from Eastern little tuna muscle on lipid oxidation of washed Asian seabass mince at different pH conditions[J].Journal of Food Science, 2011, 76(2):C242-C249.
[42] LIU S Y, LIAO T, MCCRUMMEN S T, et al.Exploration of volatile compounds causing off-flavor in farm-raised channel catfish (Ictalurus punctatus) fillet[J].Aquaculture International, 2017, 25(1):413-422.
[43] CORDERO C, KIEFL J, REICHENBACH S E,et al.Characterization of odorant patterns by comprehensive two-dimensional gas chromatography:A challenge in omic studies[J].TrAC Trends in Analytical Chemistry, 2019, 113:364-378.
[44] 刘志鹏. 全二维气相色谱-飞行时间质谱技术在白酒挥发性风味组分定性、定量分析中的应用[D].无锡:江南大学, 2019.
LIU Z P.The application of comprehensive two-dimensional gas chromatography/time of flight mass spectrometry in the qualitative and quantitative analysis of volatile flavor components in Chinese liquor[D].Wuxi:Jiangnan University, 2019.
[45] FRYSINGER G S, GAINES R B.Separation and identification of petroleum biomarkers by comprehensive two-dimensional gas chromatography[J].Journal of Separation Science, 2001, 24(2):87-96.
[46] ZHANG L, ZENG Z D, ZHAO C X, et al.A comparative study of volatile components in green, oolong and black teas by using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry and multivariate data analysis[J].Journal of Chromatography A, 2013, 1 313:245-252.
[47] YARNPAKDEE S, BENJAKUL S, PENJAMRAS P, et al.Chemical compositions and muddy flavour/odour of protein hydrolysate from Nile tilapia and broadhead catfish mince and protein isolate[J].Food Chemistry, 2014, 142:210-216.
[48] YANG M, HU J M, LIU L M, et al.Accumulation and elimination kinetics of 2-methylisoborneol in crucian carp (Carassius carassius)[J].Wuhan University Journal of Natural Sciences, 2019, 24(1):57-63.