饮料酒种类繁多、风格各异,具有良好的风味和口感,适量地饮用饮料酒对人体健康具有一定的益处[1]。饮料酒的风味组成逐渐受到关注,其中手性物质的研究已成为热点,徐浩等[2]总结了饮料酒中已报道的手性风味物质,包括酯类11种、醇类5种、酸类7种、醛酮类4种、硫醇类2种、萜烯类12种。
手性分子在化学和生物学中普遍存在,手性化合物的测定在医药、生物医学、农药和食品等领域都是非常重要的课题。如在香料和葡萄酒领域,手性化合物不同构型在体系中的分布情况可能会影响体系的风味[3-5]。手性对映体的研究可以用于质量控制,检测样品是否掺假,确定产品基质的地理来源等[6]。如LANGEN等[7]对不同产地的葡萄酒中α-紫罗兰酮的2种构型进行分析,结果发现α-紫罗兰酮的R-构型占有很大的优势,超过99%,此结论可用作葡萄酒中潜在的掺假标记。1,2-丙二醇在工业上通常以外消旋的形式存在,其对映体的比例可以作为区分白酒香气风格的潜在标志,可能是鉴别白酒品质和香气风格的一种新途径[8]。有研究表明,对映体可以以不同的方式与受体、转运系统或酶相互作用,从而产生不同的味道、香气或不同的生物活性等[9]。如葡萄酒中(S)-(-)-α-松油醇有针叶树香气,(R)-(+)-α-松油醇有花香,类似丁香花的气味;(R)-(+)-柠檬烯,具有令人愉快的、新鲜的柑橘香气,而(S)-(-)-柠檬烯具有微弱的薄荷和松油味[10-12]。氨基酸对人体来说是一类重要的化合物,对于含有苯丙氨酸、酪氨酸和色氨酸的食品添加剂,只允许使用L-氨基酸,这是它们的天然构型。它们相关的D-构型可能具有不同的生物学或生理学特性,并且可能无法有效代谢。因此,食品中存在的D-氨基酸可能会导致营养不良和不安全的产品[13]。
饮料酒中大部分手性风味物质含量都较低,将其高效地提取出来在整个分析过程中极为重要,关系到工作效率及分析结果的可靠性。本文总结了饮料酒手性风味物质提取方法以及分析方法,为以后饮料酒中手性风味物质的研究提供理论基础和技术指导。
1 饮料酒手性风味物质提取方法
研究饮料酒中的手性风味物质,首先要对其进行富集。饮料酒中手性风味物质的萃取技术主要有液-液萃取(liquid-liquid extraction, LLE)、顶空-固相微萃取(headspace solid phase microextraction, HS-SPME)、溶剂辅助风味蒸发技术(solvent-assisted flavor evaporation, SAFE)以及直接进样(direct injection, DI)等。表1总结了常见手性风味物质提取方法以及饮料酒中适用范围。
表1 常见手性风味物质提取方法及适用范围
Table 1 Extraction methods and application scope of common chiral flavor substances
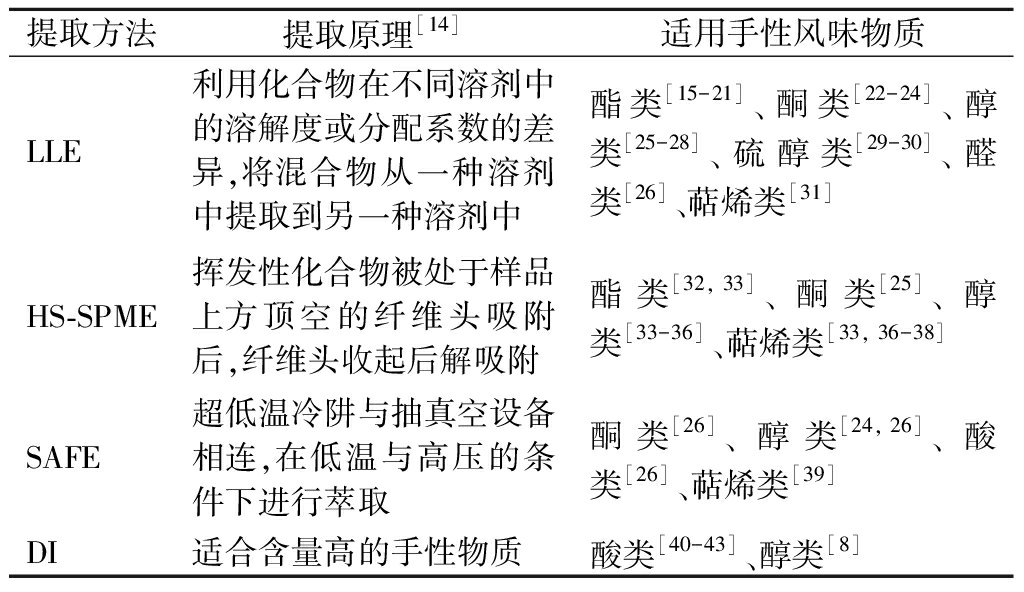
提取方法提取原理[14]适用手性风味物质LLE利用化合物在不同溶剂中的溶解度或分配系数的差异,将混合物从一种溶剂中提取到另一种溶剂中酯类[15-21]、酮类[22-24]、醇类[25-28]、硫醇类[29-30]、醛类[26]、萜烯类[31]HS-SPME挥发性化合物被处于样品上方顶空的纤维头吸附后,纤维头收起后解吸附酯类[32, 33]、酮类[25]、醇类[33-36]、萜烯类[33, 36-38]SAFE超低温冷阱与抽真空设备相连,在低温与高压的条件下进行萃取酮类[26]、醇类[24, 26]、酸类[26]、萜烯类[39]DI 适合含量高的手性物质酸类[40-43]、醇类[8]
1.1 液液萃取
液液萃取技术是一种利用有机化合物在2种互不相溶或微溶的溶剂中溶解度或分配比不同而进行分离的一种方法,它具有回收率较好,萃取效率高,操作简单等优点,是饮料酒前处理方式中常用的一种[14]。LYTRA等[15]通过LLE和GC-MS分析了87种不同年份和来源的商业葡萄酒中3-羟基丁酸乙酯对映体。PONS等[22]通过LLE处理样品后进行GC-MS 分析,成功定量了3-羟基-4,5-二甲基-2(5H)-呋喃酮及其前体2-酮丁酸。
1.2 固相微萃取
固相微萃取技术是利用聚合物膜包裹熔融硅纤维来收集样品中的挥发性组分,现在已经有极性、非极性以及混合型的纤维涂层,SPME可分为2种,一种是顶空固相微萃取,一种是浸入式固相微萃取[44-45]。固相微萃取有快速、易于使用和无溶剂等优点,但样品的萃取依赖萃取头的性质。SONG等[38]利用HS-SPME结合二维气相色谱-质谱联用(two dimensional gas chromatography-mass spectrometry,MDGC-MS)对白葡萄酒中手性单萜进行定量分析,结果显示在分析的葡萄酒中检测到的每种手性化合物都有显著差异。表2总结了固相微萃取不同萃取头类型以及适用范围等。
1.3 其他方法
DI操作简单快速,但是无法检测出饮料酒中含量较低的化合物[47],XU等[8]通过DI成功从酱香型、浓香型、清香型3种不同香型白酒中提取出了1,2-丙二醇对映体。SAFE利用超低温的冷阱与真空泵相连接,溶剂萃取物在低温和高压的条件下被分离,MATHEIS等[26]对发酵食品进行SAFE处理后,成功对样品中L-异亮氨酸通过Ehrlich途径降解得到的代谢物进行定量以及测定了2-甲基丁醛、2-甲基-1-丁醇对映体比例。
表2 不同萃取头及其应用[14, 46]
Table 2 Different extraction heads and their applications
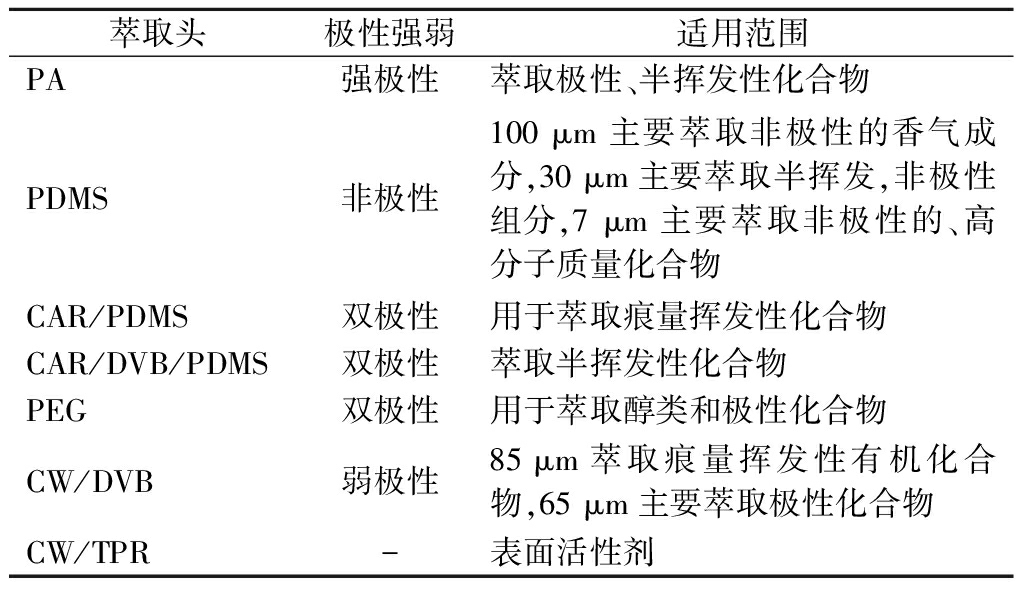
萃取头极性强弱适用范围PA强极性萃取极性、半挥发性化合物PDMS非极性100 μm主要萃取非极性的香气成分,30 μm主要萃取半挥发,非极性组分,7 μm主要萃取非极性的、高分子质量化合物CAR/PDMS双极性用于萃取痕量挥发性化合物CAR/DVB/PDMS双极性萃取半挥发性化合物PEG双极性用于萃取醇类和极性化合物CW/DVB弱极性85 μm萃取痕量挥发性有机化合物,65 μm主要萃取极性化合物CW/TPR-表面活性剂
注:PA,聚丙烯酸酯;PDMS,聚二甲基硅氧烷;PEG,聚甲基苯基;CAR,碳分子筛;CW,聚乙二醇;DVB,二乙烯基苯;TPR,模化树脂
2 手性物质分析方法
手性化合物具有相似的理化性质,这类化合物不能利用常规介质分离,只有引入手性环境,才能分离此类化合物。手性分离有2种方式,一种是手性异构体与手性选择剂形成稳定的非手性异构体,通过常规固定相分离;另一种是基于手性异构体与手性选择剂形成不稳定的手性异构体进行分离[48]。手性选择剂作为手性柱的一个重要部分,它可以粘接在毛细管柱内壁的固定相上,形成手性固定相。手性固定相的种类很多,选择手性固定相的类型时,要了解对映异构体的化学结构和物理化学性质[49]。
目前已有几种分析方法用于饮料酒中手性风味物质的检测,包括手性气相色谱(gas chromatography,GC)[13-14]、HPLC[50]、超临界流体色谱(supercritical fluid chromatography,SFC)[51-53]、毛细管电泳(capillary electrophoresis, CE)[54]和毛细管电色谱(capillary electrochromatography, CEC)[55-56]等。选择不同的分离方法时,应考虑手性异构体的理化性质,LC、HPLC、CE和SFC适用于分析热不稳定性对映异构体,GC适用于分析挥发性对映异构体,SFC基于高于其临界点温度和压力下用作流动相的溶剂使用,可以采用高流速并实现快速传质,从而实现快速高效的分离,CE和CEC是小型化技术,由于它们的微流体性质和较低的样品容量,主要用于分析[57]。饮料酒中手性风味物质的研究大多采用手性气相色谱法和液相色谱法。
手性固定相是手性风味物质检测最重要的一部分,选择合适的手性色谱柱对目标手性化合物的拆分至关重要。然而,找到合适的手性固定相仍然是一个试错过程,目前已报道了一系列的环糊精、衍生多糖、糖肽类抗生素手性固定相用于气相色谱和液相色谱等。有关手性固定相种类及其相关应用如表3所示。表4概括了文献中饮料酒中手性风味化合物常用的分析色谱柱,包括色谱柱型号、固定相、适用的手性风味化合物。
表3 不同手性固定相及其应用
Table 3 Different chiral stationary phases and their applications

手性固定相作用机制适用范围应用技术优点局限性环糊精类基于对映体疏水部分的包合络合与外界(羟基或改性基团)的手性相互作用[3,57]酯类、醇类、酸类、酮类、萜烯类[3]GC、LC、CE可直接分析挥发性手性化合物固定相温度范围较低蛋白质类蛋白质的多个位点相互作用[48]适用于碱性、中性手性化合物[3]LC、CE、HPLC、CEC分离效果与pH、温度、离子强度有关聚合物类氢键[48]药物和除草剂[3]LC、MEKC应用范围较小糖肽类抗生素氢键、离子键、偶极作用等[3,57]氨基酸衍生物HPLC、CEC、nano-LC对特定的对映体具有较高识别能力[3,9]倾向于吸附在毛细管壁上,并在紫外区具有吸收波长[58]“刷型”手性固定相氢键参与了拆分,取代基在其中起了重要的作用[48]磺胺类化合物、内酯、胺衍生物、氨基酸、醇、硫化物等[59]UPLC分离速度快、效率高[3]衍生多糖类氢键作用、偶极作用以及多糖主链引入的取代基与对映体的作用[57,60]氨基酸、药物[3]HPLC、SFC使用范围广、分离速度较快[3,9]
注:MEKC,胶束电动色谱;nano-LC,纳米液相色谱;UPLC,超高效液相色谱
表4 饮料酒中手性风味物质分析常用色谱柱
Table 4 Common chromatographic columns for analysis of chiral flavor substances in alcoholic beverages

色谱柱型号固定相耐受温度范围/℃适用手性风味物质气相色谱柱CHIRALDEX B-DM2,3-二-O-甲基-6-叔丁基硅衍生物β-环糊精10~2003-羟基丁酸乙酯[15]、2-甲基丁酸乙酯[32]CHIRALDEX G-TA2,6-二-O-戊基-3-三氟乙酸衍生物γ-环糊精10~1802-羟基-3-甲基丁酸乙酯[16]、2-羟基-4-甲基戊酸乙酯[17-18,61]、乙酸2-甲基丁酯[19]、2-甲基丁酸、3-羟基丁酸、2-羟基-4-甲基戊酸[28]MEGA DEX DAC-Beta二乙酰叔丁基二甲基硅基化β-环糊精30~230γ-壬内酯、2-壬烯-4-内酯、3-甲基-4-辛内酯[21]、3-羟基-4,5-二甲基-2(H)-呋喃酮[22-23]、薄荷酮[31]、香茅醇、松油醇、柠檬烯、γ-癸内酯[33]MEGA DEX DMT-Beta6-叔丁基二甲基甲硅烷基-2,3-二-O-甲基-β-环糊精< 230威士忌内酯、2,3-丁二醇、苹果酸二乙酯[11]VARIAN CP-CHIRASIL-DEX CB二甲基聚硅氧烷β-环糊精< 2002,3-丁二醇[27]SLB-IL 59庚基-(6-O-叔丁基二甲基甲硅烷基-2,3-二O-乙酰基)-β-环糊精 < 3001,2-丙二醇[25]CYCLOSIL-B七-(2,3-二-O-甲基-6-O-叔丁基二甲基硅基)-β-环糊精35~2502-丁醇、2,3-丁二醇[34]、1,2-丙二醇[8]LIPODEX C庚基-(2,3,6-三-O-戊基)-α-环糊精30~2403-巯基-1-己醇、3-巯基己酸乙酯[30]Rt®-β DEXsm2,3-二-O-甲基-6-O-叔丁基二甲基硅烷基β-环糊精+14%氰丙基苯基86%二甲基聚硅氧烷40~230柠檬烯、松油醇、芳樟醇、玫瑰醚、芳樟醇氧化物、香茅醇[38]Rt®-β DEXsa2,3-二乙酰-6-O-叔丁基二甲基硅基β-环糊精+14%氰丙基苯基86%二甲基聚硅氧烷40~230芳樟醇、香茅醇、松油醇、香叶醇[36]Rt®-β DEXse2,3-二-O-乙基-6-O-叔丁基二甲基硅烷基β-环糊精+14%氰丙基苯基86%二甲基聚硅氧烷40~230柠檬烯、松油醇、芳樟醇、玫瑰醚、芳樟醇氧化物、香茅醇[38]CHIRASIL-Β-DEX全甲基-β-环糊精固定在硅酮聚合物上 < 200柠檬烯、α-松油醇、胡三烯醇[11-12]、玫瑰醚[10]BGB-17630%-2,3-二甲基-6-叔丁基二甲基硅基-β-环糊精芳樟醇[39]液相色谱柱Chirex3126(D)-penicillamine(D)-青霉胺乳酸[40]CHIRALPAK AS-H硅胶表面涂覆有直链淀粉-三[(S)-α-苯乙基氨基甲酸酯]3-甲基-4-辛内酯、γ-壬内酯、2-壬烯-4-内酯[21]、芳樟醇、乙偶姻[24]Lux Amylose-1直链淀粉-三-(3,5-二甲基苯基氨基甲酸酯)3-硫基-1-己醇、3-硫基己酸乙酯[29]
在分析样品时,应充分考虑到不同的手性化合物具有不同的性质,从而选择合适的手性柱。环糊精类手性固定相是商业化最广泛的一类固定相,适用于多种手性化合物的分离,其中,CHIRALDEX G-TA(γ-环糊精)对短链有机酸表现出良好的分离效果,CYCLOSIL-B能分离开1,2-丙二醇、2-丁醇以及2,3-丁二醇等醇类手性物质,MEGA DEX DAC-Beta和MEGA-DEX DMT-Beta上粘接的β-环糊精对内酯类手性物质具有很好的分离能力,Rt®-β DEX系列(sm、sa、se)的手性柱更适用于芳樟醇、松油醇、柠檬烯、香茅醇等萜烯类手性化合物的分离。
2.1 手性气相色谱
气相色谱是一种新型的分离、分析技术,通常情况下,所需进样量较少,因此在众多领域都得到了广泛的应用。GC-MS、MDGC-MS等都已成为风味分析领域的重要技术手段。气相色谱通常与检测器相结合,包括氢火焰离子检测器(flame ionization detector, FID), 火焰光度检测器(flame photometric detector, FPD)等[62]。本文综述的手性风味化合物在气相色谱分析中较多选择的是FID和质谱。
2.1.1 气相色谱技术
气相色谱技术出现于20世纪50年代,ASTRID等[63]利用手性GC-FID分离了葡萄酒中乳酸乙酯对映体。余书奇等[27]建立了手性GC-FID分离辐照酒中(2S, 3S)-(+)-丁二醇、(2R, 3R)-(-)-丁二醇以及meso-(R, S)-丁二醇的分离方法,为鉴别白酒是否经过辐照提供了依据。
2.1.2 气相色谱-质谱联用技术
气相色谱-质谱联用技术出现于20世纪60年代,气相色谱与质谱通过接口连接,样品经色谱柱被分离成单一组分后进入质谱进行检测,由于分离能力较好、灵敏度较高,非常适用于挥发性手性风味成分的分析[64]。手性GC-MS通过手性固定相(通常为改性环糊精)与对映体强弱不一的相互作用来实现对映体分离的[65]。王明等[4]运用固相支撑-液液萃取(solid-supported liquid-liquid extraction, SLE)方法和GC-MS对酱香型、浓香型和清香型白酒中D-乳酸乙酯、L-乳酸乙酯和(S)-2,3丁二醇、(R)-2,3丁二醇、meso-2,3-丁二醇进行了定性与定量分析。LYTRA等[15]利用GC-MS技术实现了葡萄酒中3-羟基丁酸乙酯的手性分离,同时还指出3-羟基丁酸乙酯在葡萄酒中具有特征的对映体分布,而随着葡萄酒陈酿过程的增加,其对映体的分布也会发生变化。乙酸2-甲基丁酯广泛存在于各种饮料和水果中,其S-构型带有黑莓和香蕉的香气,乙酸2-甲基丁酯常出现在乙烯产生的前几周。因此,根据其浓度可以预测收获期,有报道利用手性GC-MS技术成功分离定量了78种红葡萄酒和28种白葡萄酒中乙酸2-甲基丁酯对映体[19]。STEINHAUS等[39]采用SIDA结合手性GC-MS对5种不同类型啤酒中2种芳樟醇对映体进行定量分析,结果显示,2种芳樟醇的R/S比值存在显著差异。
2.1.3 二维气相色谱-质谱联用技术
饮料酒风味物质种类繁多,难以实现满意的分离,通常需要大幅提高常规使用的一维色谱技术的分辨率,因此,MDGC-MS逐渐成为热门技术,通过第一根非手性柱对样品进行预分离。
ZHANG等[66]利用HS-SPME-MDGC-MS在用香菇发酵的饮料中观察到高达35%的(R)-2-甲基丁酸甲酯(M2MB)。PONS等[31]选择手性MDGC-MS技术研究了不同年份葡萄酒中的香气化合物,并在葡萄酒中发现了萜烯类化合物薄荷酮。LANGEN等[25]利用手性MDGC-MS技术实现了1,2-丙二醇的对映体分离,研究了1,2-丙二醇在各种葡萄酒中的天然浓度和对映体分布,在所研究的葡萄酒中,1,2-丙二醇的R-构型占优势。SONG等[38]利用HS-SPME-MDGC-MS建立了一种有效的白葡萄酒中手性单萜的定量方法,结果显示在分析的葡萄酒中检测到的每种手性化合物都有显著差异,该方法能够将不同对映体的质量浓度量化到1 ng/L。为了对“贵腐”葡萄和葡萄酒中的主要手性挥发有机物进行定量分析,MACHY
 KOV
KOV 等[11]将葡萄酒和葡萄汁通过SPME处理后,一维GC为DB-FFAP色谱柱,二维GC选用涂抹了二甲基聚硅氧烷环糊精的CHIRASIL-DEX色谱柱或者涂抹了6-叔丁基二甲基硅基-2,3-二-O-甲基-β-环糊精的MEGA-DEX DMT-Beta色谱柱,在未感染的葡萄中检测到近100个挥发性有机化合物,而它们的数量与葡萄品种有着巨大的关系。
等[11]将葡萄酒和葡萄汁通过SPME处理后,一维GC为DB-FFAP色谱柱,二维GC选用涂抹了二甲基聚硅氧烷环糊精的CHIRASIL-DEX色谱柱或者涂抹了6-叔丁基二甲基硅基-2,3-二-O-甲基-β-环糊精的MEGA-DEX DMT-Beta色谱柱,在未感染的葡萄中检测到近100个挥发性有机化合物,而它们的数量与葡萄品种有着巨大的关系。
GC、GC-MS和MDGC-MS都各有优势和不足,GC在对组分直接进行分析时,必须用已知物纯样品与相应的色谱峰进行对比。GC-MS在风味分析检测领域一直以来都炙手可热,但随着科技的发展,对分析的要求越来越高,GC-MS由于其峰容量较小、分析时间长等缺点,对手性分析的研究有一定的限制,但是,由于其经济性和可操作性,该技术仍然起着重要的作用。MDGC-MS灵敏度高,分析获得的风味物质较GC-MS更多、更精确,然而只能对被预分离后的一小部分物质进行再次分离,且也有可能出现峰重叠的现象,若要实现对多种手性化合物的分析,需要进行多次中心切割,操作较为繁琐。因此,在实际的样品分析中,应根据分析的目标和要求选择适合的分析方法。
2.2 手性液相色谱
混合物中各个组分的性质不同,对液相色谱中两相的亲和力也有所差异,液相色谱正是根据这种差异将混合物中各组分进行分离。手性液相色谱法常用来分析手性风味化合物。常用技术有:HPLC、UPLC、LC-MS/MS等。手性HPLC大多使用多糖类手性固定相对手性立体异构体进行拆分[67]。
2.2.1 HPLC及UPLC
HPLC法是手性拆分中使用最为普遍的方法,主要包括3种方法:手性衍生化试剂法、手性流动相添加剂法和手性固定相法[68]。LASEKAN等[24]利用手性HPLC带UV检测器对3种不同棕榈酒中的3种关键挥发物的对映体进行了鉴别,选用CHIRALPAK AS-H色谱柱成功分离了芳樟醇的消旋体。另外,STAMATOPOULOS等[21]利用上述同型号的色谱柱成功分离了2-壬烯-4-内酯。UPLC分离化合物的原理与HPLC基本相同,但其效率更高,能够实现快速检测[69]。江锋等[40]利用超高效液相色谱仪带二极管阵列检测器和手性分离柱(Chirex 3126 (D)-penicillami(4.6 mm ×250 mm, 5 μm))对20种市售的不同香型白酒中D-乳酸、L-乳酸成功进行了分离测定。
2.2.2 液相色谱-串联质谱法
液相色谱-串联质谱法(liquid chromatography tandem mass spectrometry, LC-MS/MS)在分离对映体方面占有一席之地,是一种结合了液相与质谱的分析方法,液相色谱法用于分离组分的混合物;通过质谱法,我们可以根据其分子质量确定具有较高特异性和灵敏度的单个组分的结构[70]。近年来,该技术在临床医药和食品工业领域引起了广泛关注,NAKANO等[71]曾报道了一种使用LC-MS/MS进行手性氨基酸对映体分离的高灵敏度分析方法,无需任何衍生过程。该方法可同时分析18种D-氨基酸,灵敏度高,重现性好。CHEN等[29]利用 LC-MS/MS法分析了葡萄酒中的3-硫基-1-己醇、3-硫基-1-己酸乙酯对映体。
UV检测器是目前HPLC应用最广泛的检测器,其检测要求被检测样品组分具有紫外吸收,通常选择在被分析物有最大吸收的波长处进行检测,但是这会导致样品中其他组分在该通道下的吸收变弱甚至无紫外吸收。因此,单通道紫外检测器不适用于多种手性化合物的检测。二极管阵列检测器是一种新型的光吸收检测器,它能形成多通道并行工作,可得任意波长的色谱图。但相对来说,专门的紫外检测器灵敏度能高一些。
2.3 其他方法
手性化合物其他的分析方法主要有超临界流体色谱、毛细管电泳、毛细管电色谱。SFC是以超临界流体为流动相的一种色谱方法,具有气相和液相所没有的优点,并能分离气相色谱和液相色谱不能解决的一些对象,发展十分迅速。CE是一类以毛细管为分离通道、以高压直流电场为驱动力的新型液相分离技术;CEC以内含色谱固定相的毛细管为分离柱,兼具毛细管电泳以及高效液相色谱的双重分离机理,既可分离带电物质也可分离中性物质。KODAMA等[41]利用CE法测定日本18个不同品牌的清酒酿造过程中的D-乳酸、L-乳酸的含量,D-乳酸(140~274 mg/L)含量大于L-乳酸(61~461 mg/L)。MIAO等[72]建立了一种新型的手性毛细管电泳方法对6种氨基酸对映体进行了分离,并测定了黄酒中D-谷氨酸和D-天冬氨酸,在确定了电解质的pH、硼酸浓度、D-果糖和异丙醇的加入以及新的二元手性选择器对电泳图的影响后,该方法成功应用于7份黄酒样品中D/L-谷氨酸和D/L-天冬氨酸的浓度分析。
3 总结
饮料酒中不同手性风味化合物的分布、含量对饮料酒的品质、风格等具有一定的影响,经过不断的研究与创新,饮料酒中手性风味物质的提取和分离方法也得到了革新。本文总结了饮料酒手性风味物质提取、分离及检测方法,旨在为以后饮料酒中手性风味物质的研究提供理论基础和技术指导。
对饮料酒中手性风味物质的提取方法主要有液液萃取、固相微萃取、超临界流体萃取等,样品的前处理方法对后续分离检测十分重要,应根据样品的种类,选择不同的提取方法。分析手性风味物质最常用的技术有手性气相色谱法和手性液相色谱法,不同的固定相对异构体的分离效果不一样,固定相的选择对高效分离异构体具有重要意义,手性气相色谱法多使用环糊精类手性固定相对目标化合物进行拆分,而手性HPLC大多使用多糖类手性固定相对手性立体异构体进行分离。目前,某些含量较低的化合物提取起来较困难,过程中造成的误差也较大,对于立体异构体的检测技术还不够成熟,没有一种技术能够完全分离出所有的手性物质。因此,在未来的研究中,应对上述问题进行更加深入的探索与研究。
[1] XU Y Q, ZHAO J R, LIU X, et al. Flavor mystery of Chinese traditional fermented Baijiu: The great contribution of ester compounds[J]. Food Chemistry, 2022, 369:130920.
[2] 徐浩, 戴怡凤, 田露琴, 等. 饮料酒中手性风味物质研究进展[J]. 食品科学, 2022, 43(7):281-288.
XU H, DAI Y F, TIAN L Q, et al. Progress in research on chiral flavor substances in alcoholic beverages[J]. Food Science, 2022, 43(7):281-288.
[3] D’ORAZIO G, FANALI C, ASENSIO-RAMOS M, et al. Chiral separations in food analysis[J]. TrAC Trends in Analytical Chemistry, 2017, 96:151-171.
[4] 王明, 王逍, 陈嘉杰, 等.白酒中特征手性物质的SLE-GC-MS识别方法[J].食品与发酵工业, 2021, 47(5):180-185.
WANG M, WANG X, CHEN J J, et al.SLE-GC-MS recognition method of characteristic chiral substances in Baijiu[J].Food and Fermentation Industries, 2021, 47(5):180-185.
[5] ENGEL K H.Chirality:An important phenomenon regarding biosynthesis, perception, and authenticity of flavor compounds[J].Journal of Agricultural and Food Chemistry, 2020, 68(38):10 265-10 274.
[6] BICCHI C, CAGLIERO C, LIBERTO E, et al.New asymmetrical per-substituted cyclodextrins (2-O-methyl-3-O-ethyl- and 2-O-ethyl-3-O-methyl-6-O-t-butyldimethylsilyl-β-derivatives) as chiral selectors for enantioselective gas chromatography in the flavour and fragrance field[J].Journal of Chromatography.A, 2010, 1 217(7):1 106-1 113.
[7] LANGEN J, WEGMANN-HERR P, SCHMARR H G.Quantitative determination of α-ionone, β-ionone, and β-damascenone and enantiodifferentiation of α-ionone in wine for authenticity control using multidimensional gas chromatography with tandem mass spectrometric detection[J].Analytical and Bioanalytical Chemistry, 2016, 408(23):6 483-6 496.
[8] XU H, DAI Y F, QIU S Y, et al.Distribution and quantification of 1, 2-propylene glycol enantiomers in baijiu[J].Foods (Basel, Switzerland), 2021, 10(12):3039.
[9] ALVAREZ-RIVERA G, BUENO M, BALLESTEROS-VIVAS D, et al.Chiral analysis in food science[J].TrAC Trends in Analytical Chemistry, 2020, 123:115761.
[10] CHIGO-HERNANDEZ M M, DUBOIS A, TOMASINO E.Aroma perception of rose oxide, linalool and α-terpineol combinations in gewürztraminer wine[J].Fermentation, 2022, 8(1):30.
[11] MACHY
 KOV
KOV A, KHVALBOTA L,
A, KHVALBOTA L,  P
P NIK I.Enantiomer distribution of major chiral volatile organic compounds in botrytized grapes and wines[J].European Food Research and Technology, 2021, 247(9):2 321-2 331.
NIK I.Enantiomer distribution of major chiral volatile organic compounds in botrytized grapes and wines[J].European Food Research and Technology, 2021, 247(9):2 321-2 331.
[12] FURD KOV
KOV K, KHVALBOTA L, MACHY
K, KHVALBOTA L, MACHY
 KOV
KOV A, et al.Volatile composition and enantioselective analysis of chiral terpenoids in Tokaj varietal wines[J].Journal of Chromatography B, 2021, 1167:122565.
A, et al.Volatile composition and enantioselective analysis of chiral terpenoids in Tokaj varietal wines[J].Journal of Chromatography B, 2021, 1167:122565.
[13] XIE S M, YUAN L M. Recent progress of chiral stationary phases for separation of enantiomers in gas chromatography[J]. Journal of Separation Science, 2017, 40(1): 124-137.
[14] 范文来, 徐岩.酒类风味化学[M].北京:中国轻工业出版社, 2014.
FAN W L, XU Y. Wine Flavor Chemistry[M]. Beijing: China Light Industry Press, 2014.
[15] LYTRA G, CAMELEYRE M, TEMPERE S, et al.Distribution and organoleptic impact of ethyl 3-hydroxybutanoate enantiomers in wine[J].Journal of Agricultural and Food Chemistry, 2015, 63(48):10 484-10 491.
[16] GAMMACURTA M, TEMPERE S, MARCHAND S, et al.Ethyl 2-hydroxy-3-methylbutanoate enantiomers:Quantitation and sensory evaluation in wine[J].OENO One, 2018, 52(1):57-65.
[17] FALCAO L D, LYTRA G, DARRIET P, et al.Identification of ethyl 2-hydroxy-4-methylpentanoate in red wines, a compound involved in blackberry aroma[J].Food Chemistry, 2012, 132(1):230-236.
[18] LYTRA G, TEMPERE S, DE REVEL G D, et al.Distribution and organoleptic impact of ethyl 2-hydroxy-4-methylpentanoate enantiomers in wine[J].Journal of Agricultural and Food Chemistry, 2012, 60(6):1 503-1 509.
[19] CAMELEYRE M, LYTRA G, TEMPERE S, et al.2-Methylbutyl acetate in wines:Enantiomeric distribution and sensory impact on red wine fruity aroma[J].Food Chemistry, 2017, 237:364-371.
[20] 刘刚军. 纯粮固态发酵白酒中乳酸乙酯的手性分析[J].食品与发酵科技, 2017, 53(5):103-105;111.
LIU G J.Lactic acid ethyl ester in solid state fermentation of pure grain chiral analysis[J].Food and Fermentation Sciences & Technology, 2017, 53(5):103-105;111.
[21] STAMATOPOULOS P, BROHAN E, PREVOST C, et al.Influence of chirality of lactones on the perception of some typical fruity notes through perceptual interaction phenomena in Bordeaux dessert wines[J].Journal of Agricultural and Food Chemistry, 2016, 64(43):8 160-8 167.
[22] PONS A, LAVIGNE V, LANDAIS Y, et al.Identification of a sotolon pathway in dry white wines[J].Journal of Agricultural and Food Chemistry, 2010, 58(12):7 273-7 279.
[23] PONS A, LAVIGNE V, LANDAIS Y, et al.Distribution and organoleptic impact of sotolon enantiomers in dry white wines[J].Journal of Agricultural and Food Chemistry, 2008, 56(5):1 606-1 610.
[24] LASEKAN O.Enantiomeric differentiation of three key volatile compounds in three different palm wines (Elaeis guineensis, Borassus flabellifer and Nypa fruticans)[J].CyTA - Journal of Food, 2018, 16(1):70-75.
[25] LANGEN J, FISCHER U, CAVALAR M, et al.Enantio differentiation of 1, 2-propanediol in various wines as phenylboronate ester with multidimensional gas chromatography-mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2016, 408(10):2 425-2 439.
[26] MATHEIS K, GRANVOGL M, SCHIEBERLE P.Quantitation and enantiomeric ratios of aroma compounds formed by an Ehrlich degradation of L-isoleucine in fermented foods[J].Journal of Agricultural and Food Chemistry, 2016, 64(3):646-652.
[27] 余书奇, 奚星林, 陈文锐, 等.手性柱分离气相色谱法测定辐照酒中2, 3-丁二醇异构体[J].分析测试学报, 2012, 31(7):877-880.
YU S Q, XI X L, CHEN W R, et al.Determination of 2, 3-butanediol isomers in irradiated liquor using chiral capillary column with gas chromatography[J].Journal of Instrumental Analysis, 2012, 31(7):877-880.
[28] LYTRA G, FRANC C, CAMELEYRE M, et al.Study of substituted ester formation in red wine by the development of a new method for quantitative determination and enantiomeric separation of their corresponding acids[J].Journal of Agricultural and Food Chemistry, 2017, 65(24):5 018-5 025.
[29] CHEN L, CAPONE D L, JEFFERY D W.Chiral analysis of 3-sulfanylhexan-1-ol and 3-sulfanylhexyl acetate in wine by high-performance liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta, 2018, 998:83-92.
[30] TOMINAGA T, NICLASS Y, FRÉROT E, et al.Stereoisomeric distribution of 3-mercaptohexan-1-ol and 3-mercaptohexyl acetate in dry and sweet white wines made from Vitis vinifera (Var.Sauvignon Blanc and Semillon)[J].Journal of Agricultural and Food Chemistry, 2006, 54(19):7 251-7 255.
[31] PONS A, LAVIGNE V, DARRIET P, et al.Identification and analysis of piperitone in red wines[J].Food Chemistry, 2016, 206:191-196.
[32] LYTRA G, TEMPERE S, DE REVEL G D, et al.Distribution and organoleptic impact of ethyl 2-methylbutanoate enantiomers in wine[J].Journal of Agricultural and Food Chemistry, 2014, 62(22):5 005-5 010.
[33] VYVIURSKA O, ZVR KOVCOVA H,
KOVCOVA H,  P
P NIK I.Distribution of enantiomers of volatile organic compounds in selected fruit distillates[J].Chirality, 2017, 29(1):14-18.
NIK I.Distribution of enantiomers of volatile organic compounds in selected fruit distillates[J].Chirality, 2017, 29(1):14-18.
[34] EBELER S E, SUN G M, VICKERS A K, et al.Gas chromatographic analysis of chiral aroma compounds in wine using modified cyclodextrin stationary phases and solid phase microextraction[M].//ACS Symposium Series.Washington, DC:American Chemical Society, 2001:45-56.
[35] BARBA C, FLORES G, HERRAIZ M.Stereodifferentiation of some chiral aroma compounds in wine using solid phase microextraction and multidimensional gas chromatography[J].Food Chemistry, 2010, 123(3):846-851.
[36] 刘翔, 江伟, 王露, 等.采用手性色谱柱对啤酒中12种酒花香气及异构体的分析研究[J].酿酒科技, 2015(1):106-110.
LIU X, JIANG W, WANG L, et al.Analysis of 12 kinds of hop flavoring components and the stereoisomers in beer by a chiral column[J].Liquor-Making Science & Technology, 2015(1):106-110.
[37] SCHIPILLITI L, BONACCORSI I, COTRONEO A, et al.Evaluation of gas chromatography-combustion-isotope ratio mass spectrometry (GC-C-IRMS) for the quality assessment of Citrus liqueurs[J].Journal of Agricultural and Food Chemistry, 2013, 61(8):1 661-1 670.
[38] SONG M, XIA Y, TOMASINO E.Investigation of a quantitative method for the analysis of chiral monoterpenes in white wine by HS-SPME-MDGC-MS of different wine matrices[J].Molecules (Basel, Switzerland), 2015, 20(4):7 359-7 378.
[39] STEINHAUS M, FRITSCH H T, SCHIEBERLE P.Quantitation of (R)- and (S)-linalool in beer using solid phase microextraction (SPME) in combination with a stable isotope dilution assay (SIDA)[J].Journal of Agricultural and Food Chemistry, 2003, 51(24):7 100-7 105.
[40] 江锋, 赵振宇, 聂叶, 等.高效液相色谱法对白酒中的L-乳酸和D-乳酸的手性分离和测定[J].酿酒科技, 2019(9):93-97.
JIANG F, ZHAO Z Y, NIE Y, et al.Chiral separation and determination of L-and D-lactic acid in baijiu by high-performance liquid chromatography[J].Liquor-Making Science & Technology, 2019(9):93-97.
[41] KODAMA S, YAMAMOTO A, MATSUNAGA A, et al.Behaviors of D- and L-lactic acids during the brewing process of sake (Japanese rice wine)[J].Journal of Agricultural and Food Chemistry, 2002, 50(4):767-770.
[42] KNOB R, PETR J, SEV
 K J, et al.Enantioseparation of tartaric acid by ligand-exchange capillary electrophoresis using contactless conductivity detection[J].Journal of Separation Science, 2013, 36(20):3 426-3 431.
K J, et al.Enantioseparation of tartaric acid by ligand-exchange capillary electrophoresis using contactless conductivity detection[J].Journal of Separation Science, 2013, 36(20):3 426-3 431.
[43] KAMENCEV M, KOMAROVA N, MOROZOVA O.Enantioseparation of tartaric and malic acids in wines by ligand exchange capillary electrophoresis using uncoated fused silica capillary[J].Chromatographia, 2016, 79(13-14):927-931.
[44] 唐平, 山其木格, 王丽, 等.白酒风味化学研究方法及酱香型白酒风味化学研究进展[J].食品科学, 2020, 41(17):315-324.
TANG P, SHAN Q M G, WANG L, et al.A review of research methods in Baijiu flavor chemistry and recent progress in the flavor chemistry of Maotai-flavored baijiu[J].Food Science, 2020, 41(17):315-324.
[45] 孙宝国, 吴继红, 黄明泉, 等.白酒风味化学研究进展[J].中国食品学报, 2015, 15(9):1-8.
SUN B G, WU J H, HUANG M Q, et al.Recent advances of flavor chemistry in Chinese liquor spirits(Baijiu)[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(9):1-8.
[46] 杜洁. 聚吡咯复合固相微萃取涂层的制备及应用[D].武汉:武汉大学, 2021.
DU J.Preparation and application of polypyrrole composite solid phase microextraction coating[D].Wuhan:Wuhan University, 2021.
[47] 张晓婕, 邱树毅, 王晓丹, 等.白酒挥发性风味物质气相分析方法及研究进展[J].食品与发酵工业, 2021, 47(14):313-320.
ZHANG X J, QIU S Y, WANG X D, et al.Gas chromatography methods and research progress of volatile flavor substances in Chinese liquor(Baijiu)[J].Food and Fermentation Industries, 2021, 47(14):313-320.
[48] 袁黎明. 制备色谱技术及应用[M].2版.北京:化学工业出版社, 2012.
YUAN L M. Preparative chromatography and its Application[M]. 2nd Ed. Beijing: Chemical Industry Press, 2012.
[49] ELBASHIR A A, ABOUL-ENEIN H Y.Multidimensional gas chromatography for chiral analysis[J].Critical Reviews in Analytical Chemistry, 2018, 48(5):416-427.
[50] XIE S M, YUAN L M.Recent development trends for chiral stationary phases based on chitosan derivatives, cyclofructan derivatives and chiral porous materials in high performance liquid chromatography[J].Journal of Separation Science, 2019, 42(1):6-20.
[51] DESFONTAINE V, TARAFDER A, HILL J, et al.A systematic investigation of sample diluents in modern supercritical fluid chromatography[J].Journal of Chromatography A, 2017, 1511:122-131.
[52] NOV KOV
KOV L, DOU
L, DOU A M.General screening and optimization strategy for fast chiral separations in modern supercritical fluid chromatography[J].Analytica Chimica Acta, 2017, 950:199-210.
A M.General screening and optimization strategy for fast chiral separations in modern supercritical fluid chromatography[J].Analytica Chimica Acta, 2017, 950:199-210.
[53] 张晶, 陈晓东, 李丽群, 等.超临界流体色谱与高效液相色谱分离手性化合物的比较[J].色谱, 2016, 34(3):321-326.
ZHANG J, CHEN X D, LI L Q, et al.Comparative separation of chiral compounds by supercritical fluid chromatography and high performance liquid chromatography[J].Chinese Journal of Chromatography, 2016, 34(3):321-326.
[54] GARC A-CA
A-CA AS V, CIFUENTES A.Recent advances in the application of capillary electromigration methods for food analysis and Foodomics[J].Electrophoresis, 2008, 29(1):294-309.
AS V, CIFUENTES A.Recent advances in the application of capillary electromigration methods for food analysis and Foodomics[J].Electrophoresis, 2008, 29(1):294-309.
[55] FANALI S.An overview to nano-scale analytical techniques:Nano-liquid chromatography and capillary electrochromatography[J].Electrophoresis, 2017, 38(15):1 822-1 829.
[56] HERRERO M, SIM C, GARC
C, GARC A-CA
A-CA AS V, et al.Chiral capillary electrophoresis in food analysis[J].Electrophoresis, 2010, 31(13):2 106-2 114.
AS V, et al.Chiral capillary electrophoresis in food analysis[J].Electrophoresis, 2010, 31(13):2 106-2 114.
[57] 李莉, 字敏, 任朝兴, 等.气相色谱手性固定相研究进展[J].化学进展, 2007, 19(S1):393-403.
LI L, ZI M, REN C X, et al.The development of chiral stationary phase in gas chromatography[J].Progress in Chemistry, 2007, 19(S1):393-403.
[58] STAVROU I J, AGATHOKLEOUS E A, KAPNISSI-CHRISTODOULOU C P.Chiral selectors in CE:Recent development and applications (mid-2014 to mid-2016)[J].Electrophoresis, 2017, 38(6):786-819.
[59] 陈娇, 石浩.键合型手性固定相的研究进展[J].色谱, 2017, 35(12):1 229-1 239.
CHEN J, SHI H.Research progress of bonded chiral stationary phases[J].Chinese Journal of Chromatography, 2017, 35(12):1 229-1 239.
[60] ROCCO A, ATURKI Z, FANALI S. Chiral separations in food analysis[J]. Trac-Trends in Analytical Chemistry, 2013,52(SI):206-225.
[61] LYTRA G, TEMPERE S, DE REVEL G, et al. Enantiomeric distribution of ethyl 2-hydroxy-4-methylpentanoate in wine, a natural enhancer of fruity aroma[J]. Abstracts of Papers of the American Chemical Society, 2013,245.
[62] WANG J, CHEN H, WU Y, et al. Uncover the flavor code of strong-aroma baijiu: Research progress on the revelation of aroma compounds in strong-aroma baijiu by means of modern separation technology and molecular sensory evaluation[J]. Journal of Food Composition and Analysis, 2022,109:104499.
[63] ASTRID KAUNZINGER M W, HELMUT GRBMILLER S B H, ARMIN DIETRICH T U, et al. Enantiomer distribution of ethyl lactate-a new criterion for quality assurance of wine[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung,1996, 203(6):499-500
[64] 邓高琼, 陈亨业, 刘瑞, 等. 气相色谱-质谱联用技术在食药检测中的应用与发展[J]. 化学试剂, 2021,43(5):555-562.
DENG G Q, CHEN H Y, LIU R, et al. Application and Development of Gas Chromatography-Mass Spectrometry in Food and Chinese Herbal Medecine Testing[J]. Chemical Reagents, 2021,43(5):555-562.
[65] 穆兵, 吕海鹏, 朱荫, 等. 茶叶中挥发性成分对映异构体研究进展[J]. 食品科学, 2018,39(11):309-315.
MU B, LV H P, ZHU Y, et al. Research Progress on Enantiomers of Volatile Components in Tea[J]. Food Science, 2018,39(11):309-315.
[66] ZHANG Y, FRAATZ M A, BIRK F, et al. Enantiomeric ratios of 2-methylbutanoic acid and its methyl ester: Elucidation of novel biogenetic pathways towards (R)-methyl 2-methylbutanoate in a beverage fermented with shiitake[J]. Food Chemistry, 2018,266:475-482.
[67] 沈军, 李庚, 李平, 等. 新型直链淀粉类手性固定相的制备与手性拆分性能[J]. 色谱, 2016,34(1):50-56.
SHEN J, LI G, LI P, et al. Preparation and enantioseparation property of novel amylose-based chiral stationary phases for high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2016,34(1):50-56.
[68] 杜江波, 陈笑艳, 钟大放. 蛋白质类手性固定相的研究进展及其在药物手性拆分中的应用[J]. 中国医药工业杂志, 2015,46(10):1 122-1 130.
DU J B, CHEN X Y, ZHONG D F. Research progress of protein-based chiral stationary phases and their applications to chiral drug resolution[J]. Chinese Journal of Pharmaceuticals, 2015,46(10):1 122-1 130.
[69] 陈奕捷. 超高效液相色谱法对白酒乳酸含量的检测[J]. 食品安全导刊, 2021(12):55-57.
CHEN Y J. Determination of lactic acid content in Baijiu by UPLC[J]. China Food Safety Magazine, 2021(12):55-57.
[70] GUNJAL P, SINGH S K, KUMAR R, et al. Role of Chromatograph-based Analytical Techniques in Quantification of Chiral Compounds: An Update[J]. Current Analytical Chemistry, 2021,17(3):355-373.
[71] NAKANO Y, TANIGUCHI M, FUKUSAKI E. High-sensitive liquid chromatography-tandem mass spectrometry-based chiral metabolic profiling focusing on amino acids and related metabolites[J]. Journal of Bioscience and Bioengineering, 2019,127(4):520-527.
[72] MIAO Y, LIU Q, WANG W, et al. Enantioseparation of amino acids by micellar capillary electrophoresis using binary chiral selectors and determination of D-glutamic acid and D-aspartic acid in rice wine[J]. Journal of Liquid Chromatography & Related Technologies, 2017,40(15):783-789.