丙氨酸,又名氨基丙酸,其化学式为C3H7NO2,分子质量为89.09,呈白色结晶粉末状,无毒无臭,在水中易溶,在乙醇中微溶,在乙醚和丙醇中不溶,熔点为297 ℃,密度为1.432 g/cm3[1-2],化学性能稳定。丙氨酸分子内包括羧基、氨基,是组成人体蛋白质结构的一类中性氨基酸。丙氨酸有2种同分异构体,分别为α型和β型,其中α型丙氨酸分子又存在L型、D型立体镜像[3],DL-丙氨酸为α-丙氨酸的外消旋体。丙氨酸具有重要的生理学功能,如参与糖代谢活动,它在转氨反应中提供氨基,并参与体内的代谢循环,将氨基酸转化为糖原。化学法是生产丙氨酸的传统方法。然而,丙氨酸生产的化工流程温度高、压力大、酸碱强,环境污染严重。因此,工业化生产丙氨酸采用发酵法和微生物酶法代替了原有的化学合成法。根据目前丙氨酸的国际市场调查,丙氨酸产业在世界分布广泛,以美国、欧洲、中国为主,我国是最大的生产国,我国境内丙氨酸公司主要生产L-丙氨酸、D-丙氨酸和DL-丙氨酸,尽管β-丙氨酸等占比较低,但发展环境较稳定,对该领域的需求也在不断增长,在未来市场非常有发展前景。
1 丙氨酸的应用
1.1 丙氨酸在食品领域中的应用
在食品领域,丙氨酸是一种兼具甜味与鲜味的氨基酸,是天然的食品添加剂,是我国许可使用的9种增味剂之一[4],可缓和酸辣苦涩等味道,柔和食品口感,提高食物营养价值,也能用于饮料中,既可以补充氨基酸的含量,也可以利用丙氨酸的碱性来降低酸度,从而调节饮料的口感。郭媛等[5]研究表明,在日常饮食中加入适量的L-丙氨酸可以让人们更容易接受豆制品和蔬菜汁的口感,降低了令人不舒服的味道,同时也提升了产品的营养价值,扩展了此类饮品的消费市场。添加L-丙氨酸到鱼露中能有效减少含硫化合物的相对含量,改善产品风味[6]。L-丙氨酸和DL-丙氨酸可以使酒的味道更加醇正浓厚,增加了酒的甜味,抑制了美拉德反应,还可防止发泡酒老化,并减少酵母气味等。DL-丙氨酸还可用于改善浸渍品的风味,防止油类及油类食品氧化,提高腌制效果,同时缩短腌制的时间[7]。DL-丙氨酸具有缓冲酸碱、螯合重金属和抑制其他氨基酸褐化的功能。
1.2 丙氨酸在医药领域中的应用
在医药领域中,L-丙氨酸作为营养剂和生糖氨基酸的成分之一[5],可以用来检测肝脏功能,制作生物化学药剂等。也可用作术前、术后的营养剂[7];L-丙氨酸作为一种原料,可用于生产多种药物,例如作为前体物质合成某些抗癌药物,用于治疗宫颈癌、喉癌等,也可以用于生产索非布韦,治疗慢性肝炎感染,及生产依那普利治疗高血压等;此外,血液保存剂中还包含L-丙氨酸,其代谢及丰度与氨基糖苷抗生素耐药性有关[8]。L-丙氨酸还是维生素B6的重要原料,合成氨基丙醇用来制造氧氟沙星等高效抗菌药,也可以增强吡啶酮酸等抗菌药的杀菌效果,增加细胞内活性氧的产生,起到协同抗分枝杆菌的作用,为抵抗结核病做出贡献[9]。结核分枝杆菌引起的结核病仍然是一个主要的全球卫生问题,结核分枝杆菌的耐药性和持久性进一步加剧了这种情况。在保健品行业,L-丙氨酸是一种护肝配方成分,可以有效地减少酒精中毒程度,还可以制成预防疲劳的营养品[10];在生理医学上研究发现D-丙氨酸能防止机体的脂质受到氧化损害。可以抑制N-亚硝基二甲胺等致癌物质,在肿瘤细胞质中使体内的氨基酸氧化酶异位表达,从而消除细胞内的毒素,可以作为一种抗癌药物[11];在制药方面,D-丙氨酸是抗生素维吉尼亚霉素系列药物的原料[3],也是合成二肽阿力甜的重要原料[12];D-丙氨酸在精神分裂症、阿尔兹海默症和肾脏疾病等多种人类疾病中具有相关性,为各种神经和精神疾病以及许多其他疾病的新生物标志物和治疗策略铺平道路[13]。β-丙氨酸合成巴柳氮后可用在治疗直肠炎以及结肠炎等肠胃疾病,也可以合成泛酸钙或帕米磷酸二钠减轻肿瘤性骨痛和高血钙症。
1.3 丙氨酸在日化及其他领域中的应用
L-丙氨酸作为温和的氨基酸表面活性剂表现出良好的去污、乳化及渗透能力,在护理品中具有美白保湿、延缓衰老等功能,更适用于敏感性肌肤,生物降解性好并且绿色环保;在化妆品中,D-丙氨酸不但有抗菌效果,而且是天然的保湿成分,起到了保持角质层水分的作用[14]。在用于生产新型螯合剂如甲基甘氨酸二乙酸时,L-丙氨酸避免了一些传统磷酸盐对生态系统的破坏,可以自然降解,减少了对人类和环境的损害。古户波等[15]将L-丙氨酸和鸟嘌呤组合作为原料,合成了鸟嘌呤-氨基酸衍生物缓蚀剂,具有新型、绿色和无毒性的特点。β-丙氨酸晶体还可增强大肠杆菌的抑菌活性并用于废水处理[16]。
2 丙氨酸的合成
2.1 L-丙氨酸的合成
2.1.1 传统方法制备L-丙氨酸
生产L-丙氨酸的传统制备方法主要有提取法、蛋白质水解法和化学合成法。提取法可采用酸水解或酶解法,将玉米蛋白或者明胶等L-丙氨酸含量高的原料进行分解,再经过手性拆分可以获得L-丙氨酸。然而该工艺成本较高,不利于大规模的工业化生产。早期在我国应用蛋白质水解法比较广,因为原料来源普遍、价格低廉,并且工艺也简单。但其生产效率低,易造成三废污染,难以在工业化生产中占有优势,目前该方法已经被淘汰。化学合成法有3种途径,可通过溴丙酸、氨水和碳酸氢铵混合作用,经过蒸发、去溴化铵、过滤、脱色等一系列步骤生成丙氨酸;亦可将乙醛和氢氰酸与氨反应制备氨基丙酸钠,最后采用离子交换法生成终产物;也可通过丙酸氯化法进行合成,但存在产量低、质量差和环境污染等问题,目前基本不采取该方法。
2.1.2 微生物发酵法合成L-丙氨酸
在大肠杆菌中L-丙氨酸和α-酮戊二酸通过谷丙转氨酶的催化生成丙酮酸和谷氨酸,且此反应为可逆反应,如图1所示。

图1 L-丙氨酸和α-酮戊二酸的转氨反应式
Fig.1 The transamination reaction formula of L-alanine and α-ketoglutarate
虽然谷丙转氨酶可以催化L-丙氨酸的生物合成,但其效率很低。D-乳酸、乙醇和乙酸等经由丙酮酸进一步代谢产生[17],诸如此类的代谢途径与L-丙氨酸代谢途径争夺碳源,不利于其生物合成,细胞内产生的部分L-丙氨酸通过膜转运蛋白运输到胞外,另一部分L-丙氨酸在消旋酶的催化下变成D-丙氨酸,用作细胞壁的生成,ZHANG等[18]通过敲除甲基乙二醛合成酶基因(mgsA)以减少生成乳酸的途径,敲除分解性丙氨酸外消旋酶基因(dadX)以减少L-丙氨酸到D-丙氨酸的转化,进而提高L-丙氨酸的产量。通过选择改善糖酵解途径以利于丙氨酸生产。结果表明,菌株XZ132在无机盐培养基中发酵48 h,L-丙氨酸的产率为95%。曹杰[19]研究了以价格低廉的葡萄糖为原料发酵制备L-丙氨酸,将丙氨酸合成的支路代谢基因L-乳酸脱氢酶ldh从枯草芽孢杆菌IBL23染色体上敲除,提升了丙氨酸产率。周丽等[20]探究删除了支路代谢产物合成途径,将源于嗜热脂肪芽孢杆菌的丙氨酸脱氢酶基因alaD取代菌株染色体上的丙氨酸消旋酶基因dadX,以甘油作为唯一碳源进行发酵,促进了L-丙氨酸的合成水平。孙金凯[21]在产酸克雷伯氏菌上敲除了甲基乙二醛合成酶基因mgs,并在此基础上将丙氨酸脱氢酶基因alaD替换乳酸脱氢酶编码基因ldh,以葡萄糖为原料,有效提升了丙氨酸的转化。潘海亮等[22]研究所用的碳源是10%混合糖(5%葡萄糖和5%木糖),敲除转运葡萄糖的关键基因ptsG以大幅减弱了葡萄糖效应,为以木质纤维素为原料制取丙氨酸奠定了良好的工业应用基础。王灿等[23]研究通过敲除关键基因ptsG以及mglB抑制葡萄糖作用,采用葡萄糖60 g/L、木糖30 g/L、水稻秸秆水解液作为碳源,提高水解液对L-丙氨酸的发酵效果。发酵法生产用到的原料葡萄糖供应充足,价格低廉,但丙氨酸的产量不高,工业化生产效率低。发酵法是当前研究的热点,随着技术的不断发展,其优越性将得到进一步的发展。
2.1.3 酶催化法合成L-丙氨酸
汪芳[24]将来源于德阿昆哈假单胞菌中编码L-天冬氨酸β-脱羧酶的基因aspD克隆至大肠杆菌BL21(DE3)中,通过诱导表达重组菌,使蛋白的可溶性表达提升。利用定点突变技术改善酶在酸性条件下的酶活力,构建组合突变株,在优化后的条件下进行全细胞转化,结果表明,突变株N34D/L484M在12 h内摩尔转化率达99.6%,L-丙氨酸生成速率为4.17 g/(L·h)。发酵转化27 h时,L-丙氨酸产量为371.05 g/L,摩尔转化率达到92.3%。于佳印[25]研究筛选到Acinetobacter radioresistens来源L-天冬氨酸β-脱羧酶(ArAsd)并通过分子改造提高ArAsd的酸稳定性。构建一系列突变体,其中N35D、A179E突变体显示出比较好的酸稳定性。构建了ArAsd-N35D与EcAspA双酶偶联重组菌,通过全细胞催化底物富马酸生成L-丙氨酸达971.26 mmol/L,转化率为97.3%。通过表1对比微生物发酵法与酶催化法的国内外研究水平,可知该工艺较其他方法具有高效、绿色、环保的特点,但原料价格偏高。
表1 微生物发酵法与酶催化法合成L-丙氨酸的国内外研究水平对比
Table 1 Comparison of domestic and foreign research levels on the synthesis of L-alanine by microbial fermentation and enzymatic catalysis
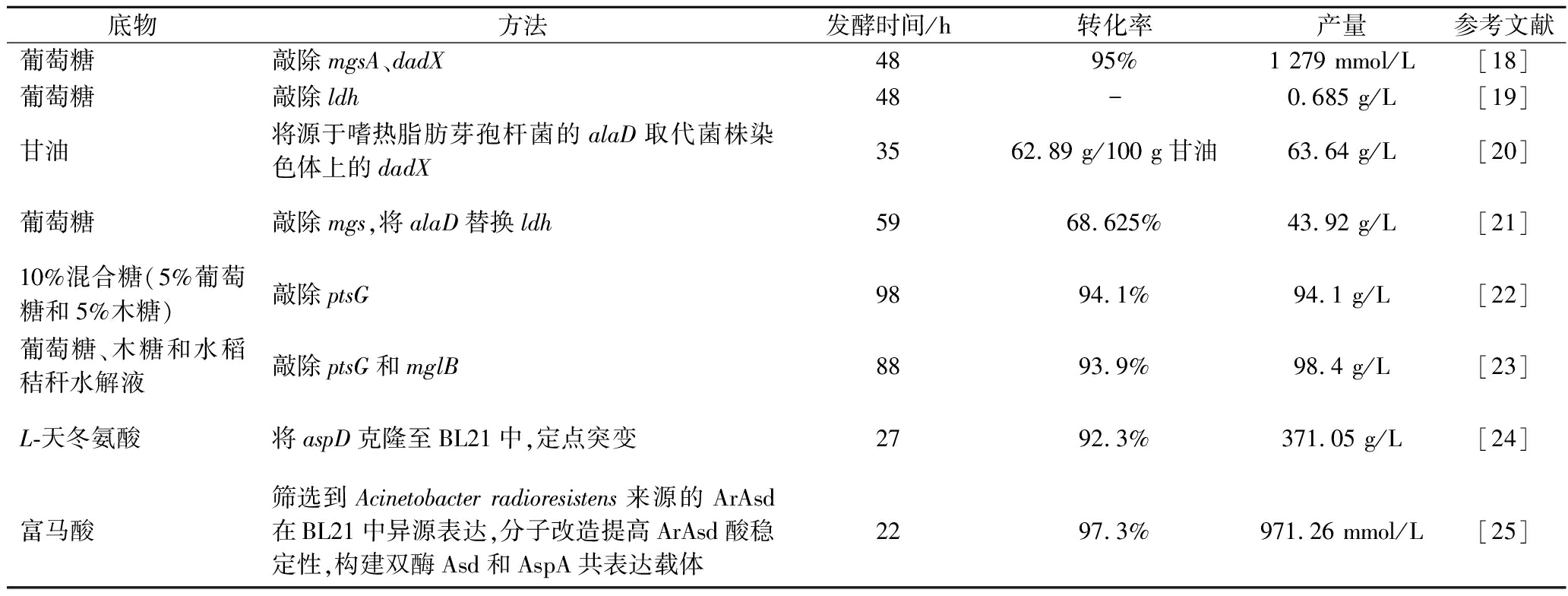
底物方法发酵时间/h转化率产量参考文献葡萄糖敲除mgsA、dadX4895%1 279 mmol/L[18]葡萄糖敲除ldh48-0.685 g/L[19]甘油将源于嗜热脂肪芽孢杆菌的alaD取代菌株染色体上的dadX3562.89 g/100 g甘油63.64 g/L[20]葡萄糖敲除mgs,将alaD替换ldh5968.625%43.92 g/L[21]10%混合糖(5%葡萄糖和5%木糖)敲除ptsG9894.1%94.1 g/L[22]葡萄糖、木糖和水稻秸秆水解液敲除ptsG和mglB8893.9%98.4 g/L[23]L-天冬氨酸将aspD克隆至BL21中,定点突变2792.3%371.05 g/L[24]富马酸筛选到Acinetobacter radioresistens来源的ArAsd在BL21中异源表达,分子改造提高ArAsd酸稳定性,构建双酶Asd和AspA共表达载体2297.3%971.26 mmol/L[25]
2.2 D-丙氨酸的合成
2.2.1 化学合成法合成D-丙氨酸
不对称合成法和手性拆分法是化学合成的主要方法。不对称合成法是直接利用化学原料合成D-丙氨酸,而手性拆分法则是先合成中间产物DL-丙氨酸,再通过光学方法对其进行分离,得到纯品的D-丙氨酸[26]。由于该反应所需的手性试剂或金属络合物的价格昂贵,且存在诸多不足如反应机制复杂、生产周期长等,限制了这些方法推广与应用。ZHANG等[27]利用枯草芽孢杆菌HLZ-68固定化细胞不对称降解DL-丙氨酸生产D-丙氨酸,用聚乙烯醇和海藻酸钙等不同的化合物对枯草杆菌HLZ-68细胞进行固定化并具有更高的降解活性。采用阳离子交换树脂可方便地从反应液中提取D-丙氨酸,其化学纯度和光学纯度分别为99.1%和99.6%。该方法不仅提高了固定化细胞的利用率,而且满足了工业化生产的要求。王传磊[28]根据微生物降解机理不对称性,在一定条件下培养,使菌体Ala-D45产生氨基酸氧化酶,具有强氧化性,氧化DL-丙氨酸中的L-丙氨酸,从而获得D-丙氨酸。丁兆伟[29]研究获得了一株能够迅速彻底降解L-丙氨酸而对D-丙氨酸几乎不降解的菌株Ala-D45。优化培养条件后通过发酵分析得到:D-丙氨酸的总回收率为67.72%,纯度达99.86%。
2.2.2 微生物发酵法合成D-丙氨酸
张学礼等[30]敲除了大肠杆菌XZ-A26的乳酸脱氢酶、乙醇脱氢酶、甲基乙二醛合成酶等支路途径基因,减少了副产物的积累,并将源于枯草芽孢杆菌的L-丙氨酸脱氢酶基因和丙氨酸消旋酶基因转化到宿主内,构建获得工程菌株大肠杆菌XZ-A30,以葡萄糖等糖类为原料进行发酵,产物DL-丙氨酸产量达114.6 g/L,D-丙氨酸产量达57.3 g/L。微生物发酵技术是安全、简单、应用广泛的工业化生产方法,但生产菌株的选育难度大、培养周期长及反应能量消耗大,分离技术也有待进一步突破。
2.2.3 生物酶法合成D-丙氨酸
王胜锋等[14]以乳酸为原料通过两步法生产D-丙氨酸,先利用乳酸氧化酶催化乳酸生产丙酮酸,然后通过D-氨基酸脱氢酶还原成D-丙氨酸,在此过程中加入辅酶,条件优化后,D-丙氨酸的转化总摩尔收率能达到64.9%,产品的对映体过量(enantiomeric excess, ee)值达到99.9%。与传统方法相比,该法制备工艺具有环保、成本低、质量好等特点,适合于工业化生产。张卫卫等[31]利用天冬氨酸消旋酶全细胞催化L-天冬氨酸消旋得到DL-天冬氨酸,先通过离心去除天冬氨酸消旋酶全细胞,经升温使残留的天冬氨酸消旋酶灭活,再加入纯化后的D-氨基酸转氨酶酶液,催化D-天冬氨酸和丙酮酸发生转氨反应得到D-丙氨酸。在优化条件下,D-天冬氨酸转化率达94%,D-丙氨酸收率为84%,ee值达98%。LI等[32]采用共固定化来自嗜热共生杆菌的二氨基庚氨酸脱氢酶和来自嗜热假丝酵母的甲酸脱氢酶催化丙酮酸钠制备D-丙氨酸。优化固定化和生物转化条件后,D-丙氨酸平均产率为75.7%,ee值为99.5%。这表明共固定化酶系统是一种很有前途的生物催化剂,可用于丙酮酸的绿色生产。如表2所示,生物酶法合成D-丙氨酸质量品质好,但收率还有提高的空间。
表2 生物酶法合成D-丙氨酸国内外研究水平
Table 2 Research level of bioenzymatic synthesis of D-alanine at home and abroad

底物方法ee值/%收率/%参考文献乳酸通过乳酸氧化酶,D-氨基酸脱氢酶两步酶法催化99.964.9[14]L-天冬氨酸利用天冬氨酸消旋酶,D-氨基酸转氨酶双酶催化9884[31]丙酮酸钠利用二氨基庚氨酸脱氢酶和甲酸脱氢酶催化丙酮酸钠99.575.7[32]
2.3 DL-丙氨酸的合成
2.3.1 化学法合成DL-丙氨酸
化学合成法存在反应过程复杂、工艺周期长、生产成本高及环境污染大等问题。毛建卫等[33]通过研究提出了将多元溶剂循环合成与离子膜分离技术结合的新工艺。在反应的过程中除了生成所需产品DL-α-丙氨酸外还得到了高附加值的氯化铵结晶副产物,再经膜过滤,将反应后的母液回收用作多元溶剂循环利用,母液里含有反应体系所需的催化剂以及没有反应完全的合成原料,进行新一轮合成反应时,不用再另外添加催化剂,未反应完全的原料可以进行下次反应。利用这种方法合成的产物是混合物,利用新型反馈式离子膜分离技术,获到DL-丙氨酸产物,并同步获得副产品。此方法减少了有毒溶剂-甲醇的使用,可极大降低能耗,减少了生产成本,提高了产品质量,基本消除了三废。
2.3.2 生物酶法合成DL-丙氨酸
生物法合成DL-丙氨酸目前主要以生物酶法催化为主。孙洪露[7]将大肠杆菌K-12的丙氨酸消旋酶Alr基因通过载体质粒pET-28a克隆到大肠杆菌BL21(DE3)中,并表达出重组丙氨酸消旋酶。减压蒸馏结晶后,可以得到90.6 g的DL-丙氨酸,回收率为90.6%。这种制备DL-丙氨酸的方法产率较低但成本低,简单易操作,且污染小,可以应用于工业化生产。焦庆才等[34]利用富马酸为原料,配制成一定浓度的富马酸氨水溶液,再将含有天冬氨酸-β-脱羧酶、天冬氨酸酶以及丙氨酸消旋酶的菌体细胞或者是表达后3种酶的粗酶液与富马酸氨水溶液混合,再利用等电点结晶与阴阳离子交换树脂相结合的方式进行分离,再经过干燥最后得固体DL-丙氨酸31.5 g,结晶母液利用乙醇回收后循环利用,2次结晶共得DL-丙氨酸132 g,收率89.6%。该方案的主要技术创新点是使用多酶偶联技术生产DL-丙氨酸,具有高生产效率且原材料来源广、生产工艺操作简单、酶促时间短和生产成本低。
2.4 β-丙氨酸的合成
2.4.1 化学合成法合成β-丙氨酸
丙烯腈法、β-氨基丙腈法、琥珀酰亚铵降解法存在成本高、污染较严重等问题,在工业生产中已较少使用。
2.4.2 微生物发酵法合成β-丙氨酸
虽然微生物发酵是工业化生产β-丙氨酸的一种很有前途的方法,但目前还缺乏高效的微生物细胞,ZOU等[35]通过敲除3个天冬氨酸激酶的基因,来防止天冬氨酸的支路丢失,从而促进β-丙氨酸的合成。以L-天冬氨酸脱氢酶基因代替天冬氨酸氨基转移酶基因,同时优化启动子来过表达天冬氨酸脱氢酶基因,增加天冬氨酸的含量,进一步提高了β-丙氨酸的产量。通过高效表达天冬氨酸脱氢酶基因和导入丙酮酸脱羧酶,提高了草酰乙酸的生物合成。陈可泉等[36]构建重组菌株E.coli BL-pET28a-aspC,构建E.coli BL-pET28a-panD葡萄糖代谢缺陷型菌株;选取重组菌株加入发酵培养基中,以葡萄糖和甘油为碳源生产β-丙氨酸。通过在2个细胞中分别表达aspC和panD,利用混合细菌发酵的方法,降低了生产成本,相比于利用E.coli BL-pET28a-panD单一发酵生产,β-丙氨酸的收率提高了40%。
2.4.3 生物酶法合成β-丙氨酸
β-丙氨酸是一种重要的L-天冬氨酸衍生氨基酸,在酶法合成β-丙氨酸过程中,通常以L-天冬氨酸为底物,在L-天冬氨酸-α-脱羧酶催化下,经过脱羧作用生成β-丙氨酸。酶催化法在过去的几十年里受到越来越多的关注。目前研究较多的天冬氨酸脱羧酶主要来源于大肠杆菌、谷氨酸棒杆菌、枯草芽孢杆菌和结核分枝杆菌。范文超等[37]通过分子改造得到了一种天冬氨酸脱羧酶的突变体,具有较高的酶活力,能高效催化反应使天冬氨酸脱羧生成β-丙氨酸,之后对反应条件进行了优化,最终将天冬氨酸的底物浓度改良到250 g/L,经过24 h转化后,转化率可以达到98.3%以上,具有工业应用前景。QIAN等[38]利用位点饱和和C-末端缺失,产生变异体Q5。变异体Q5与L-天冬氨酸在15 L生物反应器中偶联,以富马酸为底物,形成线性级联反应体系,产率为118.6 g/L β-丙氨酸,产物/催化剂为5.9 g/g,转化率>99%。结果表明,重塑PAND的质子化构象可以有效地解除机理失活,提高催化稳定性。
3 总结与展望
化学合成法等传统方法由于存在原料价格高、生产工艺复杂、效率低下、产量低以及环境污染严重等问题,工业生产丙氨酸已经逐步淘汰这些方法,取而代之的是微生物发酵法和酶转化法。从20世纪中期就开始研究发酵法生产丙氨酸,但是由于当时技术水平有限,发酵法存在诸多弊端。进入21世纪后,随着发酵设备的升级以及生物技术的发展,带动了发酵法的技术进步,葡萄糖是发酵法制备丙氨酸的原材料,近年来葡萄糖的市场化程度越来越高,供应充足,价格低廉。微生物发酵法不仅提升了产酸率,还促进了提取及分离的水平,使生物发酵法相对其他合成方法具有非常明显的竞争优势,开拓了发展前景。但丙氨酸的产量不高,工业化生产效率低。发酵法是目前研究的热点,随着技术的进步,发酵法的优势将会得到进一步发展。酶催化技术是目前工业上应用最为广泛的丙氨酸合成方法,它的优势在于采用生物酶作催化剂,反应条件温和,同时避免了化学催化剂的污染,也大大降低了成本。近几十年来,随着对更绿色、可持续化制造需求的增加,生物酶法制备丙氨酸已成为替代传统化学法生产的有效替代方案。但此过程中酶的用量较大,L-天冬氨酸或富马酸等原料资源紧张、价格高涨,同时此法生产的效率也较低,所以酶转化法难以用于工业化生产。若对酶催化法进一步优化,使用物美价廉的原料,利用双酶法提升表达量及效率,进一步扩大产量应用在工业化生产中,未来在丙氨酸市场中会有非常好的发展前景。
[1] 田宋魁, 郭恒华, 张冬竹, 等.L-丙氨酸生产工艺的研究进展[J].精细与专用化学品, 2017, 25(8):12-14.
TIAN S K, GUO H H, ZHANG D Z, et al.Progress in production technology of L-alanine[J].Fine and Specialty Chemicals, 2017, 25(8):12-14.
[2] 钱研, 张雪娇, 刘芳, 等.水液相下两性α-丙氨酸Mg2+配合物旋光异构的理论研究[J].复旦学报(自然科学版), 2020, 59(6):769-778.
QIAN Y, ZHANG X J, LIU F, et al.Theoretical study on the optical isomerization of amphotericα-alanine·Mg2+ complex in waterliquid phase environment[J].Journal of Fudan University (Natural Science), 2020, 59(6):769-778.
[3] 孙丽曼. 大肠杆菌丙氨酸产生菌的构建及转录组分析[D].保定:河北大学, 2020.
SUN L M.Construction and transcriptomic analysis of E.coli alanine producing strains[D].Baoding:Hebei University, 2020.
[4] 冯佳婷, 陆震鸣, 李恒, 等.L-丙氨酸对腌渍蔬菜风味的影响[J].中国调味品, 2020, 45(6):20-23;36.
FENG J T, LU Z M, LI H, et al.Effect of L-alanine on the flavor of pickled vegetables[J].China Condiment, 2020, 45(6):20-23;36.
[5] 郭媛, 王丽娟, 邱婷, 等.L-丙氨酸在食品工业中的应用潜力[J].中国调味品, 2017, 42(7):177-180.
GUO Y, WANG L J, QIU T, et al.Application potential of L-alanine in food industry[J].China Condiment, 2017, 42(7):177-180.
[6] 王丽娟, 邱婷, 陆震鸣, 等.L-丙氨酸对鱼露风味的影响[J].食品工业科技, 2018, 39(14):186-189;204.
WANG L J, QIU T, LU Z M, et al.Effect of L-alanine on the flavor of fish sauce[J].Science and Technology of Food Industry, 2018, 39(14):186-189;204.
[7] 孙洪露.丙氨酸消旋酶法制备DL-丙氨酸研究[D].南京:南京师范大学,2014.
SUN H L.Study on preparation of DL-alanine by alanine racemase[D].Nanjing:Nanjing Normal University,2014.
[8] JIANG M, KUANG S F, LAI S S, et al.Na+-NQR confers aminoglycoside resistance via the regulation of L-alanine metabolism[J].mBio, 2020, 11(6):e02086-e02020.
[9] ZHEN J F, YAN S Q, LI Y Z, et al.L-Alanine specifically potentiates fluoroquinolone efficacy against Mycobacterium persisters via increased intracellular reactive oxygen species[J].Applied Microbiology and Biotechnology, 2020, 104(5):2 137-2 147.
[10] HAN M L, XIE M Y, HAN J, et al.Development and validation of a rapid, selective, and sensitive LC-MS/MS method for simultaneous determination of D- and L-amino acids in human serum:Application to the study of hepatocellular carcinoma[J].Analytical and Bioanalytical Chemistry, 2018, 410(10):2 517-2 531.
[11] 何鹏辉. 通过调节D-丙氨酸代谢节点促地衣芽胞杆菌异源蛋白高效表达和聚γ-谷氨酸高产[D].武汉:湖北大学, 2018.
HE P H.Improving heterologous protein expression and poly-γ-glutamic acid production by regulating D-alanine metabolic nodes in Bacillus licheniformis[D].Wuhan:Hubei University, 2018.
[12] 郭笑, 杜信眉, 程磊, 等.D-丙氨酸在细菌中的功能和代谢研究进展[J].口腔疾病防治, 2019, 27(4):264-267.
GUO X, DU X M, CHENG L, et al.Research progress on the function and metabolism of D-alanine in bacteria[J].Journal of Prevention and Treatment for Stomatological Diseases, 2019, 27(4):264-267.
[13] LEE C J, QIU T A, JONATHAN V SWEEDLER.D-Alanine:Distribution, origin, physiological relevance, and implications in disease[J].Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2020, 1868(11):140482.
[14] 王胜锋, 黄毅, 廖芬艳, 等.酶法催化转化乳酸生产D-丙氨酸[J].中国新技术新产品, 2019(4):5-7.
WANG S F, HUANG Y, LIAO F Y, et al.Enzymatic conversion of lactic acid to produce D-alanine [J].New Technology & New Products of China, 2019(4):5-7.
[15] 古户波, 庄稼, 严丽, 等.鸟嘌呤-L-丙氨酸衍生物的合成及缓蚀性能[J].应用化工, 2014, 43(8):1 423-1 427.
GU H B, ZHUANG J, YAN L, et al.Synthesis and anti-corrosion performance of guanine-L-alanine derivative[J].Applied Chemical Industry, 2014, 43(8):1 423-1 427.
[16] ZHOU L, DENG C, CUI W J, et al.Efficient L-alanine production by a thermo-regulated switch in Escherichia coli[J].Applied Biochemistry and Biotechnology, 2016, 178(2):324-337.
[17] JINI D, ARAVIND M, JOTHI NIRMAL L,et al.Structural, optical, and biological properties of L-alanine single crystal by slow evaporation method[J].Materials Today:Proceedings,2021,43(P2):2 032-2 035.
[18] ZHANG X L, JANTAMA K, MOORE J C, et al.Production of L-alanine by metabolically engineered Escherichia coli[J].Applied Microbiology and Biotechnology, 2007, 77(2):355-366.
[19] 曹杰. 枯草芽孢杆菌ldh基因的敲除及丙氨酸生产[D].合肥:安徽大学, 2013.
CAO J.Knock-out of L-lactate dehydrogenase gene from Bacillus subtilis and production of alanine[D].Hefei:Anhui University, 2013.
[20] 周丽, 邓璨, 崔文璟, 等.利用重组大肠杆菌发酵甘油合成L-丙氨酸[J].现代食品科技, 2016, 32(6):163-169.
ZHOU L, DENG C, CUI W J, et al.L-alanine production through glycerol fermentation by recombinant Escherichia coli[J].Modern Food Science and Technology, 2016, 32(6):163-169.
[21] 孙金凯. 代谢工程改造产酸克雷伯氏菌生产D/L-乳酸与丙氨酸[D].济南:山东大学, 2018.
SUN J K.Metabolic engineering of Klebsiella oxytoca for the production of D/L-lactic acid and alanine[D].Jinan:Shandong University, 2018.
[22] 潘海亮, 王灿, 赵筱, 等.大肠杆菌ptsG基因缺陷菌株的构建及其发酵混合糖产L-丙氨酸[J].中国酿造, 2019, 38(11):160-164.
PAN H L, WANG C, ZHAO X, et al.Construction of ptsG gene-deficient strain of Escherichia coli and L-alanine production by mixed sugars fermentation[J].China Brewing, 2019, 38(11):160-164.
[23] 王灿, 潘海亮, 梁泉喜, 等.大肠杆菌工程菌mglB基因的敲除及水稻秸秆水解液发酵L-丙氨酸[J].安徽农业科学, 2020, 48(7):113-117.
WANG C, PAN H L, LIANG Q X, et al.The knockout of mglB gene of Escherichia coli engineering strain and L-alanine fermentation with rice straw hydrolysate[J].Journal of Anhui Agricultural Sciences, 2020, 48(7):113-117.
[24] 汪芳. Pseudomonas dacunhae L-天冬氨酸β-脱羧酶的耐酸性分子改造及催化合成L-丙氨酸研究[D].无锡:江南大学, 2018.
WANG F.Improving the acidic stability of L-aspartate β-decarboxylase from Pseudomonas dacunhae and its application for biosynthesis of L-alanine[D].Wuxi:Jiangnan University, 2018.
[25] 于佳印. L-天冬氨酸β-脱羧酶的基因挖掘与分子改造[D].无锡:江南大学, 2020.
YU J Y.Gene mining and molecular modification of L-aspartate β-decarboxylase[D].Wuxi:Jiangnan University, 2020.
[26] 陈哲, 何广正, 徐书景, 等.生物合成D-丙氨酸研究进展[J].河北师范大学学报(自然科学版), 2022, 46(1):76-83.
CHEN Z, HE G Z, XU S J, et al.Research progress in biosynthesis of D-alanine[J].Journal of Hebei Normal University (Natural Science), 2022, 46(1):76-83.
[27] ZHANG Y Y, LI X P, ZHANG C F, et al.Production of D-alanine from DL-alanine using immobilized cells of Bacillus subtilis HLZ-68[J].World Journal of Microbiology & Biotechnology, 2017, 33(9):176.
[28] 王传磊. 微生物不对称降解生产D-丙氨酸发酵机理及动力学的研究[D].大连:大连工业大学, 2014.
WANG C L.Study on the fermentation mechanism and kinetics of D-alanine production by microbial asymmetric degradation[D].Dalian:Dalian Polytechnic University, 2014.
[29] 丁兆伟. 利用微生物的不对称降解原理筛选D-丙氨酸菌种及发酵工艺[D].大连:大连工业大学, 2014.
DING Z W.Using asymmetric degradation principle of microorganism isolate D-alanine strains and fermentation process[D].Dalian:Dalian Polytechnic University, 2014.
[30] 张学礼, 张冬竹.生产DL-丙氨酸的工程菌及利用该工程菌生产DL-丙氨酸的方法:CN103045528B[P].2014-05-07.
ZHANG X L, ZHANG D Z.Engineering bacteria for producing DL-alanine and method for producing DL-alanine using the engineering bacteria:CN103045528B[P].2014-05-07.
[31] 张卫卫, 魏宇, 张宏娟, 等.双酶连续催化生物合成D-丙氨酸[J].精细化工, 2017, 34(10):1 132-1138;1160.
ZHANG W W, WEI Y, ZHANG H J, et al.Double enzyme continuous catalytic biosynthesis of D-alanine[J].Fine Chemicals, 2017, 34(10):1 132-1138;1160.
[32] LI J J, CHEN X, CUI YF, et al.Enzymatic synthesis of D-alanine from a renewable starting material by co-immobilized dehydrogenases[J].Process Biochemistry,2018, 66:126-132.
[33] 毛建卫, 崔艳丽, 王桂仙.DL-α-丙氨酸合成工艺的新进展及其应用[J].科技通报, 2002, 18(2):93-95;99.
MAO J W, CUI Y L, WANG G X.The advances of preparation technologies of DL-α-alanine and its application[J].Bulletin of Science and Technology, 2002, 18(2):93-95;99.
[34] 焦庆才, 刘均忠, 吴四平, 等.一种以富马酸为原料多酶偶联制备DL-丙氨酸的方法:CN104531820B[P].2018-04-24.
JIAO Q C, LIU J Z, WU S P, et al.A method for preparing DL-alanine by using fumaric acid as raw material by multi-enzyme coupling:CN104531820B[P].2018-04-24.
[35] ZOU X Y, GUO L X, HUANG L L, et al.Pathway construction and metabolic engineering for fermentative production of β-alanine in Escherichia coli[J].Applied Microbiology and Biotechnology, 2020, 104(6):2 545-2 559.
[36] 陈可泉, 许晟, 冯娇, 等.一种混菌发酵生产β-丙氨酸的方法:CN111411130A[P].2020-07-14.
CHEN K Q, XU S, FENG J, et al.A kind of method for mixed bacteria fermentation to produce β-alanine:CN111411130A[P].2020-07-14.
[37] 范文超, 王金刚, 梁岩, 等.酶法制备β-丙氨酸:CN108546697B[P].2020-07-24.
FAN W C, WANG J G, LIANG Y, et al.Enzymatic preparation of β-alanine:CN108546697B[P].2020-07-24.
[38] QIAN Y Y, LU C, LIU J, et al.Engineering protonation conformation of L-aspartate-α-decarboxylase to relieve mechanism-based inactivation[J].Biotechnology and Bioengineering, 2020, 117(6):1 607-1 614.