2型糖尿病作为世界公共卫生难题,其发病率占糖尿病总发病率的95%,严重威胁人类健康[1-3]。除胰岛细胞功能受损导致胰岛素分泌不足之外,因组织对胰岛素敏感性降低而引起的胰岛素抵抗是2型糖尿病发病的最根本原因[4-5]。胰岛素抵抗主要发生在肝脏、肌肉和脂肪等组织中,其中肝脏是摄取、合成及代谢葡萄糖的主要场所,其在维持机体血糖平衡中发挥着直接作用[6]。胰岛素抵抗不仅会进一步加剧胰岛细胞功能损害,引起骨质疏松、周围神经病变等并发症,而且还往往与非酒精性脂肪肝、肝纤维化、肝癌的发生发展息息相关[5,7]。
壳寡糖(chitooligosaccharides,COS)是由海洋生物甲壳提取而成的低聚寡糖,其在抗炎、降血脂、提高免疫力及保肝等方面具有良好疗效[8]。COS能够显著降低糖尿病小鼠血糖水平,改善胰岛细胞功能并抑制肠道对葡萄糖的摄取[9],但作用机制并不完全明晰。鉴于COS的药理作用往往与其聚合度息息相关[10]。因此,本研究旨在探究COS及其组成单体对胰岛素诱导的HepG2细胞胰岛素抵抗的改善作用,为COS的降糖、保肝等生物活性应用提供理论依据。
1 材料与方法
1.1 材料与试剂
HepG2细胞由本实验室保存;COS(成分为壳二糖、壳三糖和壳四糖,占比分别为28.4%、50.07%和21.53%),扬州日兴生物科技股份有限公司;壳二糖、壳三糖、壳四糖标准品,青岛博智汇力公司;胰岛素、二甲双胍、DMEM培养基及葡萄糖检测试剂盒,Sigma公司;CCK-8试剂盒,日本同仁化学;抗体胰岛素受体(insulin receptor,IR)、胰岛素受体底物(insulin receptor substrate,IRS-1),Abcam公司;磷酸化蛋白激酶B(phosphate protein kinase B,p-PKB/p-Akt)、蛋白激酶B(protein kinase B,PKB/Akt)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH),Cell Signaling Technology公司。
1.2 主要仪器
SpectraMaxM2e多功能酶标仪,美国molecular devices公司;T100型PCR分析仪、CFX96TMTouch荧光定量PCR分析仪,美国Bio-Rad公司;Tanon 4800 Multi化学发光图像分析仪,上海天能科技公司。
1.3 实验方法
1.3.1 细胞活力检测
HepG2细胞在含体积分数10%血清和1%青霉素-链霉素双抗的DMEM培养基中,于37 ℃、5% CO2的湿润环境中培养。
HepG2细胞(2×104个/孔)培养于96孔板中至完全贴壁后,更换添加待测药物(干预组)的新鲜培养基继续孵育24 h,不添加药物的培养孔为对照组,无细胞的培养孔为空白组。然后,再次吸去每孔培养基,并用pH 7.5的PBS洗3遍后,加入含有10% CCK-8溶液的等体积无血清培养基,避光孵育2 h后于450 nm波长下测OD值(n=3)。根据公式(1)计算细胞活力。
细胞活力![]()
(1)
1.3.2 HepG2细胞胰岛素抵抗模型的建立
HepG2细胞(2×104个/孔)于96孔板中培养贴壁后,更换不含或含不同浓度胰岛素(0.1 ~ 50 μmol/L)的DMEM培养基,分别设为对照组和模型组,继续培养24、36或48 h,无细胞的培养孔为空白组。漂洗3遍后更换新鲜无血清培养基继续孵育12 h,检测培养基中葡萄糖含量及细胞活力情况(n=3)。葡萄糖消耗量按公式(2)计算。
葡萄糖消耗量/(μmol·L-1)=c(空白)-c(对照/模型)
(2)
1.3.3 COS对葡萄糖消耗量的影响
参照1.3.2建立胰岛素抵抗模型,PBS洗3遍并更换含有不同浓度COS或其组分的DMEM培养基继续培养24 h。低剂量组100 μg/mL,高剂量组200 μg/mL,阳性组二甲双胍2 mmol/L,对照组则给予相同体积的DMEM培养基。之后,更换无血清培养基继续孵育12 h。取培养基上清液对其进行葡萄糖水平检测(n=3)。
1.3.4 RT-PCR分析
通过TRIzol法提取细胞总RNA[11],1 μg总RNA逆转录为cDNA,反应体系:200 ng cDNA,5 nmol/L上下游引物,5 μL SYBR Green混合物,并在95 ℃、15 s,60 ℃、30 s条件下运行40个循环。通过RT-PCR系统测定靶基因的相对表达水平,并用2-(△△CT)方法进行分析。测定的目标基因为IR、IRS-1、GLUT4、过氧化物酶体增生物激活受体-γ辅激活子-1α(peroxisome proliferator activated receptor γ coactivator 1α,PGC-1α)、叉头转录因子1(fork head transcription factor,Foxo1)、白细胞介素6(interleukin,IL-6)和β-肌动蛋白(β-actin)(表1)。
表1 引物序列
Table 1 Primer sequences
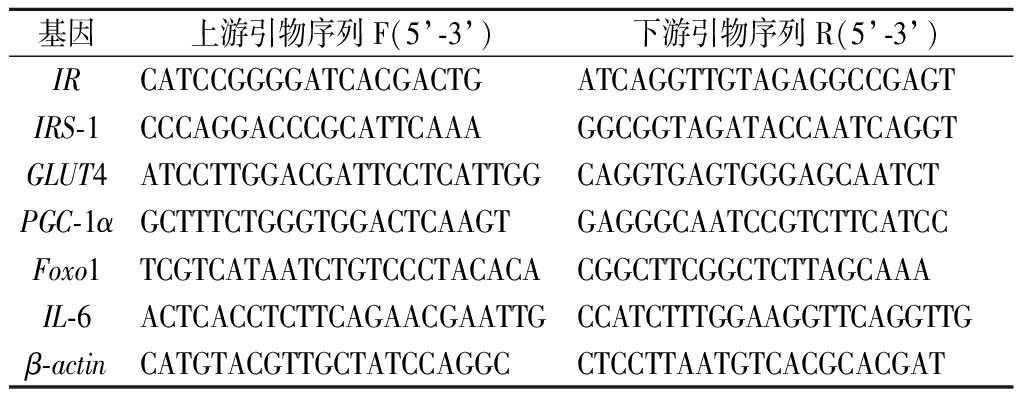
基因上游引物序列F(5’-3’)下游引物序列R(5’-3’)IRCATCCGGGGATCACGACTGATCAGGTTGTAGAGGCCGAGTIRS-1CCCAGGACCCGCATTCAAAGGCGGTAGATACCAATCAGGTGLUT4ATCCTTGGACGATTCCTCATTGGCAGGTGAGTGGGAGCAATCTPGC-1αGCTTTCTGGGTGGACTCAAGTGAGGGCAATCCGTCTTCATCCFoxo1TCGTCATAATCTGTCCCTACACACGGCTTCGGCTCTTAGCAAAIL-6ACTCACCTCTTCAGAACGAATTGCCATCTTTGGAAGGTTCAGGTTGβ-actinCATGTACGTTGCTATCCAGGCCTCCTTAATGTCACGCACGAT
1.3.5 Western Blot分析
细胞重悬于添加了磷酸酶抑制剂和蛋白酶抑制剂的裂解液中,冰上涡旋10 s,静置1 min,反复操作3次。4 ℃、12 000 r/min离心20 min,取上清液,获得总蛋白。蛋白定量后,与Loading buffer混匀沸水浴10 min。蛋白通过SDS-PAGE分离后,凝胶迅速转移到聚偏氟乙烯膜上,并进行电转。封闭2 h后,一抗4 ℃孵育过夜。洗涤缓冲液荡洗3遍后二抗室温孵育1~2 h,通过化学发光法对目标蛋白显影,并通过image J软件定量分析。
1.4 统计学分析
数据用平均值±标准差表示,采用单向方差分析法进行分析,通过GraphPad Prism 5软件作图分析。P<0.05为具有显著性差异。与对照组比较,#P<0.05,##P<0.01,###P<0.001,与模型组比较,*P<0.05,**P<0.01,***P<0.001,ns为无统计学差异。
2 结果与分析
2.1 HepG2细胞胰岛素抵抗模型的建立
高浓度胰岛素刺激是建立胰岛素抵抗模型的常用方法之一,如图1-a所示,50 μmol/L胰岛素孵育细胞24 h即能够显著降低其葡萄糖消耗量(P<0.05);在刺激36 h和48 h后,5 μmol/L胰岛素也能够明显抑制HepG2细胞的葡萄糖消耗量(P<0.05)(图1-b,图1-c)。同时,为了评估胰岛素对HepG2细胞的毒性作用,通过CCK-8法检测细胞增殖情况,如图1-d所示,孵育24 h时,胰岛素刺激无细胞毒性(P>0.05);孵育36 h时,50 μmol/L胰岛素显著引起细胞毒性(P<0.05)(图1-e);图1-f显示,孵育48 h时,10和50 μmol/L的胰岛素均可以明显引起细胞毒性(P<0.05)。综合考虑,选择5 μmol/L胰岛素对HepG2细胞刺激36 h为诱导胰岛素抵抗的造模条件。

a-胰岛素刺激细胞24 h葡萄糖消耗量;b-胰岛素刺激细胞36 h葡萄糖消耗量;c-胰岛素刺激细胞48 h葡萄糖消耗量; d-胰岛素刺激细胞24 h细胞存活率;e-胰岛素刺激细胞48 h细胞存活率;f-胰岛素刺激细胞36 h细胞存活率
图1 HepG2细胞的胰岛素抵抗模型建立
Fig.1 Establishment of insulin-resistant HepG2 cell model
2.2 COS对HepG2细胞增殖活性影响
为探究COS对HepG2细胞的毒性作用,CCK-8法检测结果显示,与对照组比较,COS在15.625~1 000 μg/mL质量浓度下对HepG2细胞无毒性作用(P>0.05)(图2)。
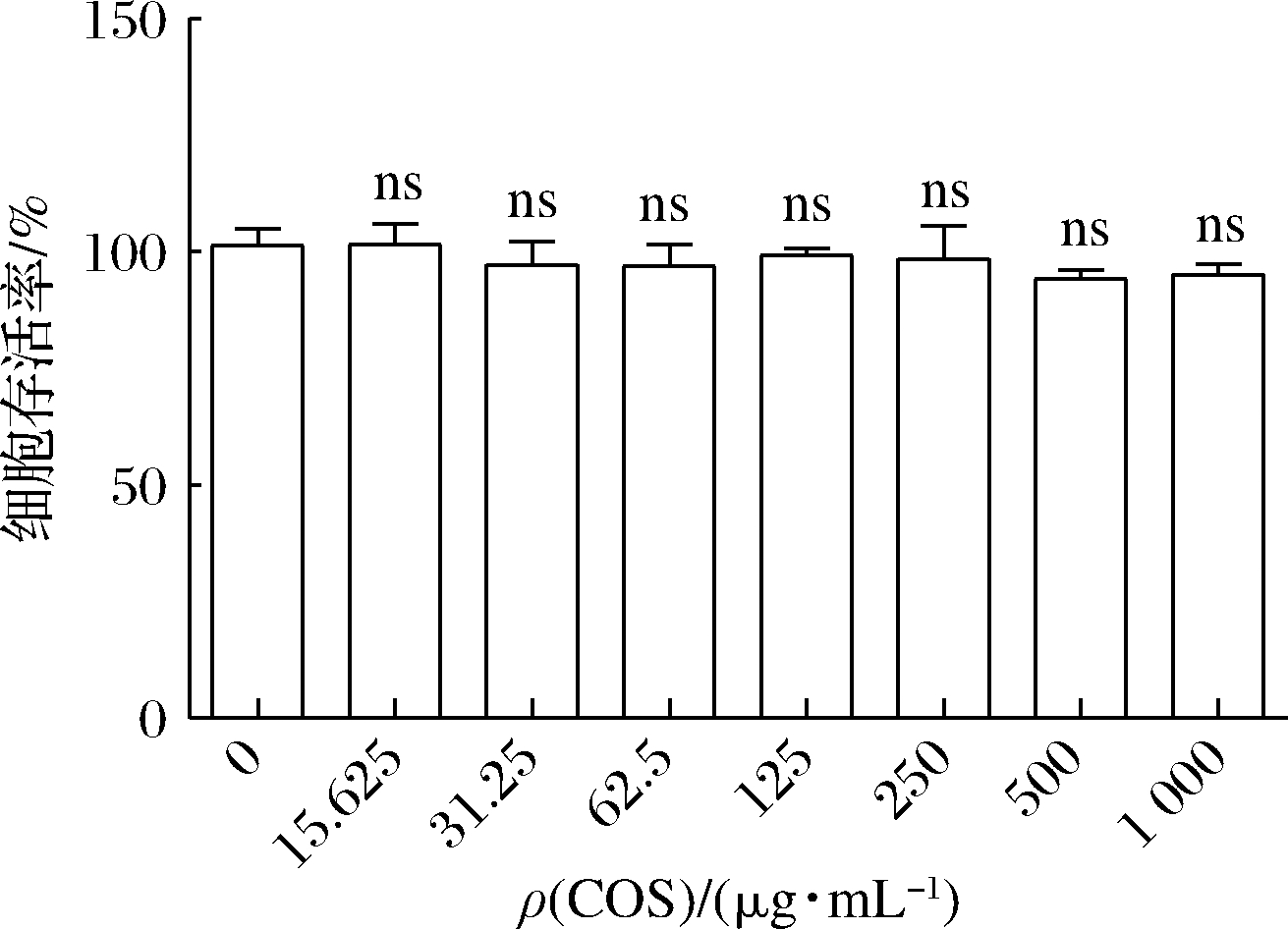
图2 COS对HepG2细胞毒性分析
Fig.2 Cytotoxicity analysis of COS and chitotriose on HepG2 cells
2.3 COS对HepG2细胞胰岛素抵抗的改善作用
如图3所示,高剂量组的COS能够显著促进胰岛素抵抗HepG2细胞的葡萄糖消耗量(P<0.05)。COS能够改善2型糖尿病小鼠空腹血糖水平、口服糖耐量、饮水量和体重等[12]。细胞水平上,COS可以逆转胰岛细胞损伤、提高肝细胞和小肠上皮中糖转运蛋白水平以促进葡萄糖吸收[13]。虽然COS改善葡萄糖代谢的详细机制并未完全清楚,但是以上结果体现了COS确实具有显著的降血糖、促进葡萄糖代谢作用。
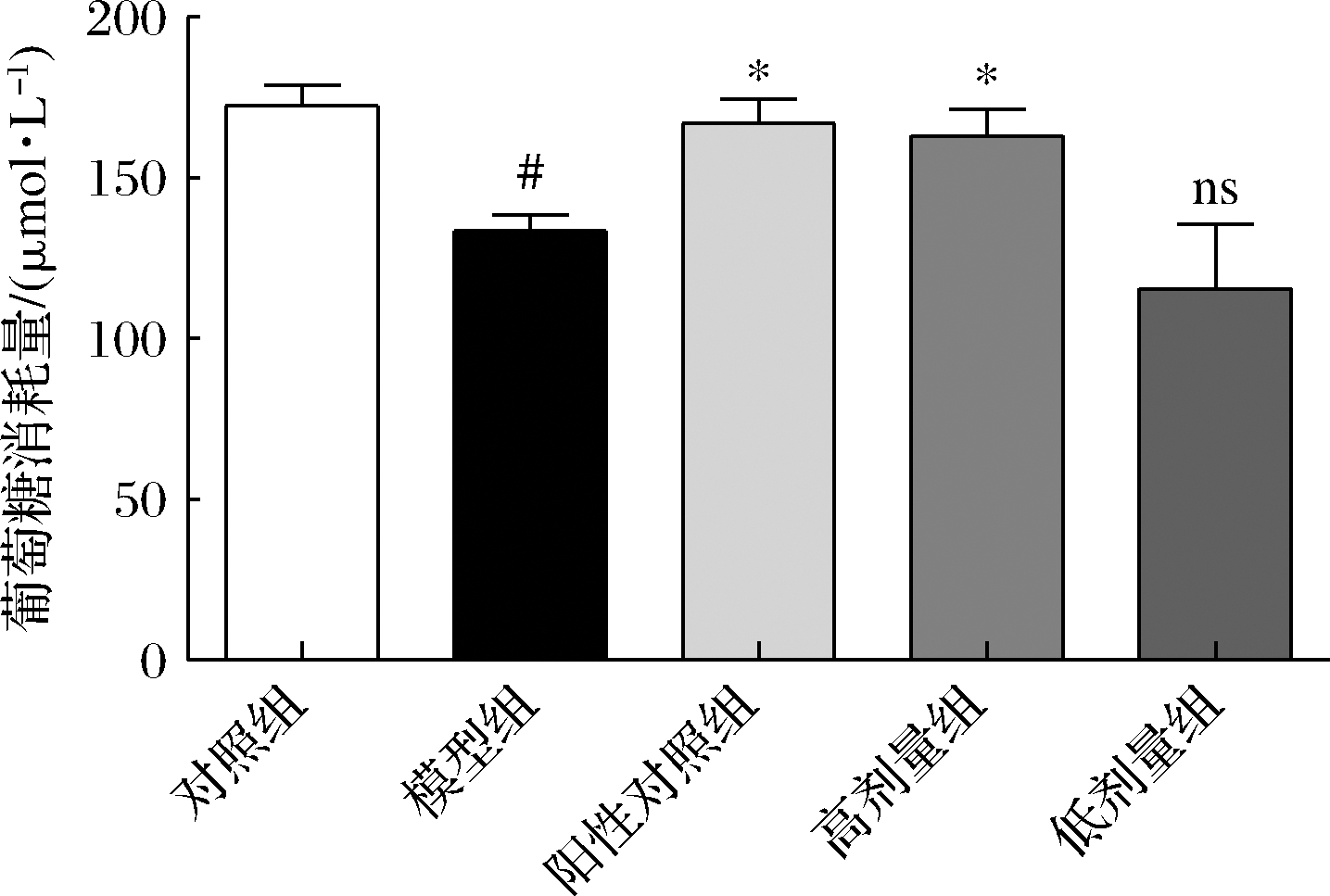
图3 COS对胰岛素抵抗HepG2细胞的缓解作用
Fig.3 Alleviative effect of COS on insulin resistant HepG2 cells
2.4 不同COS单体对胰岛素抵抗HepG2细胞的作用
为进一步探讨不同COS单体对HepG2细胞胰岛素抵抗的作用,对壳二糖、壳三糖和壳四糖的作用进行评价。如图4所示,不同浓度下的壳二糖和壳四糖对胰岛素抵抗的HepG2细胞葡萄糖消耗量并无明显的改善效果(P>0.05),而壳三糖可以明显地提高胰岛素抵抗细胞的葡萄糖消耗量(P<0.05)。不同聚合度COS因携带的电荷量、与作用受体亲和力等差异而具有不同的生物活性[14]。本研究中,壳三糖对胰岛素抵抗HepG2细胞的改善作用表现出最优效果,这可能与其相关受体具有更高的亲和力等原因有关。综上,COS组分中的壳三糖对胰岛素抵抗HepG2细胞具有显著的改善效果。
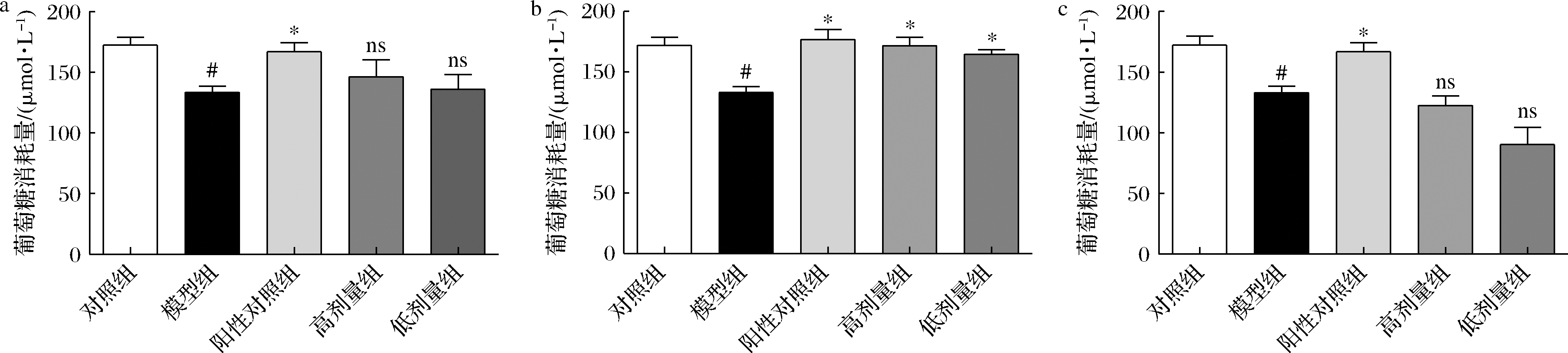
a-壳二糖;b-壳三糖;c-壳四糖
图4 不同COS单体对HepG2细胞胰岛素抵抗的改善作用
Fig.4 Improvement of insulin resistance of HepG2 cells by COS with different degree of polymerization
2.5 HepG2细胞胰岛素抵抗相关基因转录水平
正常情况下,胰岛素的主要作用方式为与下游IR结合,结合胰岛素后的IR与下游IRS-1进一步发生酪氨酸磷酸化反应,活化后的IR/IRS-1复合体进一步与Akt结合,促使其磷酸化[15-16]。磷酸化的Akt会进一步使下游靶蛋白磷酸化引起一系列级联反应,最终引起GLUT4移位到细胞膜表面,促进葡萄糖从胞外向胞内转运,从而降低胞外的葡萄糖水平[15-16]。然而,在胰岛素抵抗状态下,IR对胰岛素产生耐受,该通路表达下调,导致葡萄糖转运下降,血糖水平继而升高。为分析COS和壳三糖缓解HepG2细胞胰岛素抵抗的作用机制,首先对IR、IRS-1和GLUT4等基因转录水平进行评估。结果显示,COS(200 μg/mL)和壳三糖(100 μg/mL)孵育后可以显著提高其转录水平(P<0.05),其改善效果与阳性对照组基本保持一致的趋势(图5-a~图5-c)。Foxo1是胰岛素通路下游的重要转录因子,受Akt磷酸化的调节,过度活化Foxo1可以导致胰岛素敏感性降低[17-19]。另外,PGC-1α与胰岛素抵抗形成密切相关,其可加速肝脏糖异生进程,诱发肝内胰岛素抵抗[19]。因此,为进一步评估COS及其壳三糖对IR/Akt/GLUT4通路下游基因的影响情况,分别探究了Foxo1和PGC-1α基因转录水平的变化情况。如图5-d,图5-e所示,COS和壳三糖可以显著降低Foxo1和PGC-1α基因的转录水平(P<0.05),COS和壳三糖也逆转了胰岛素抵抗模型中的IL-6基因转录水平(P<0.05)(图5-f)。
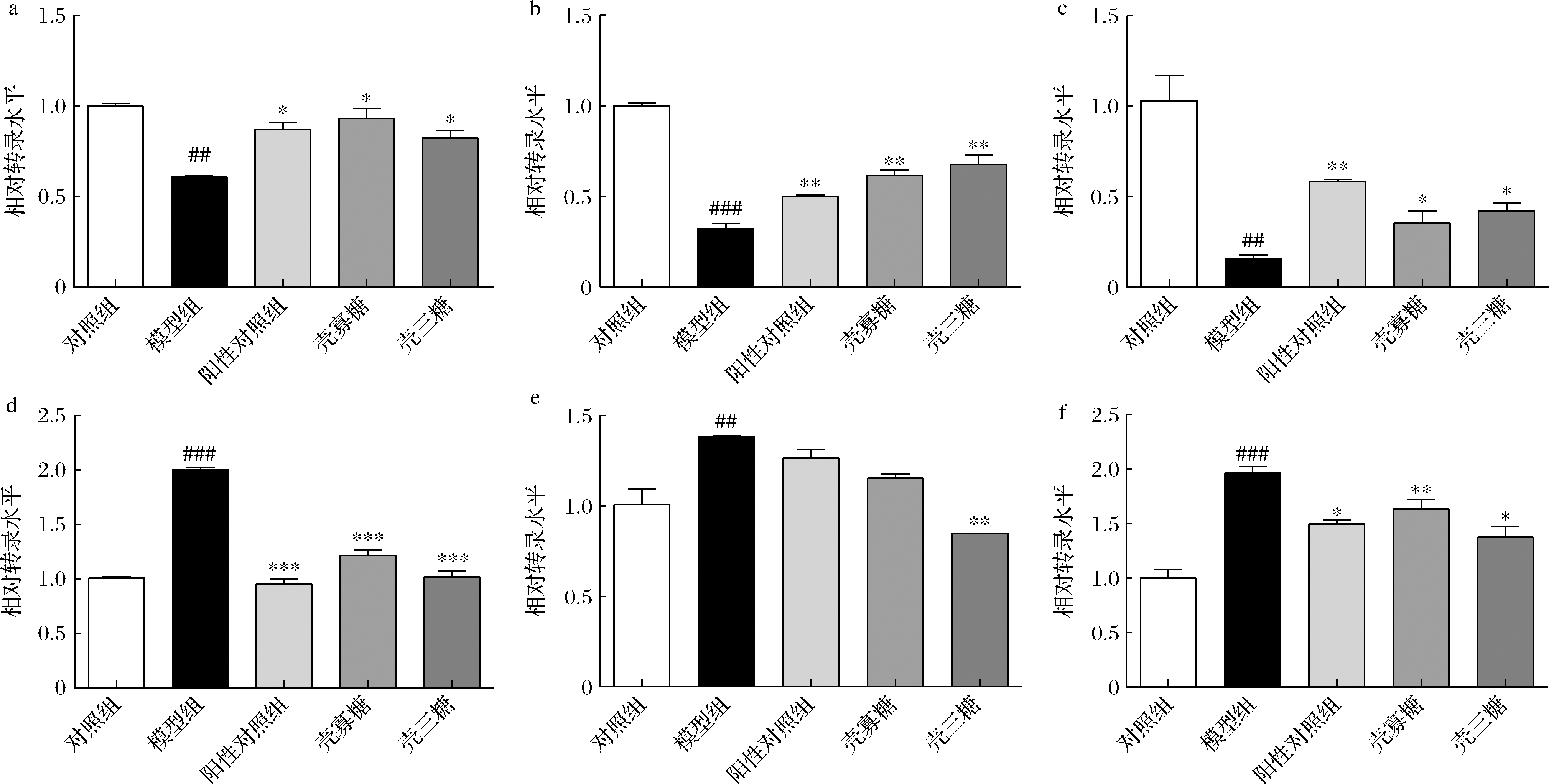
a-IR;b-IRS-1;c-GLUT4;d-FOXO1;e-PGC-1α;f-IL-6
图5 HepG2细胞胰岛素抵抗相关基因转录水平变化
Fig.5 Amelioration of insulin resistance related mRNA levels in HepG2 cells
2.6 HepG2细胞胰岛素抵抗Akt/GLUT4蛋白水平变化
如图6所示,模型组细胞中IR、IRS-1、GLUT4及p-Akt水平显著低于对照组(P<0.05),COS(200 μg/mL)和壳三糖(100 μg/mL)处理后可以显著上调IR、IRS-1、GLUT4和Akt的蛋白水平(P<0.05)。

a-凝胶电泳条带;b-IR;c-IRS-1;d-GLUT4;e-P-AKT
图6 HepG2细胞胰岛素抵抗Akt/GLUT4蛋白水平变化
Fig.6 The protein levels of Akt/GLUT4 in insulin resistance of HepG2 cells
报道显示,COS对多种细胞系均可以显著调控其Akt的磷酸化水平,尤其在2型糖尿病疾病中,能够通过激活Akt蛋白促进胰岛素分泌、提高胰岛素敏感性和胰高血糖素样肽1水平,改善机体血糖水平,降低胆固醇及血清甘油三酯水平等,被认为是一种理想的糖尿病食品[20-21],与本文结果基本一致。综上,COS和壳三糖通过上调Akt/GLUT4通路改善HepG2细胞的胰岛素抵抗情况,作用机制如图7所示。
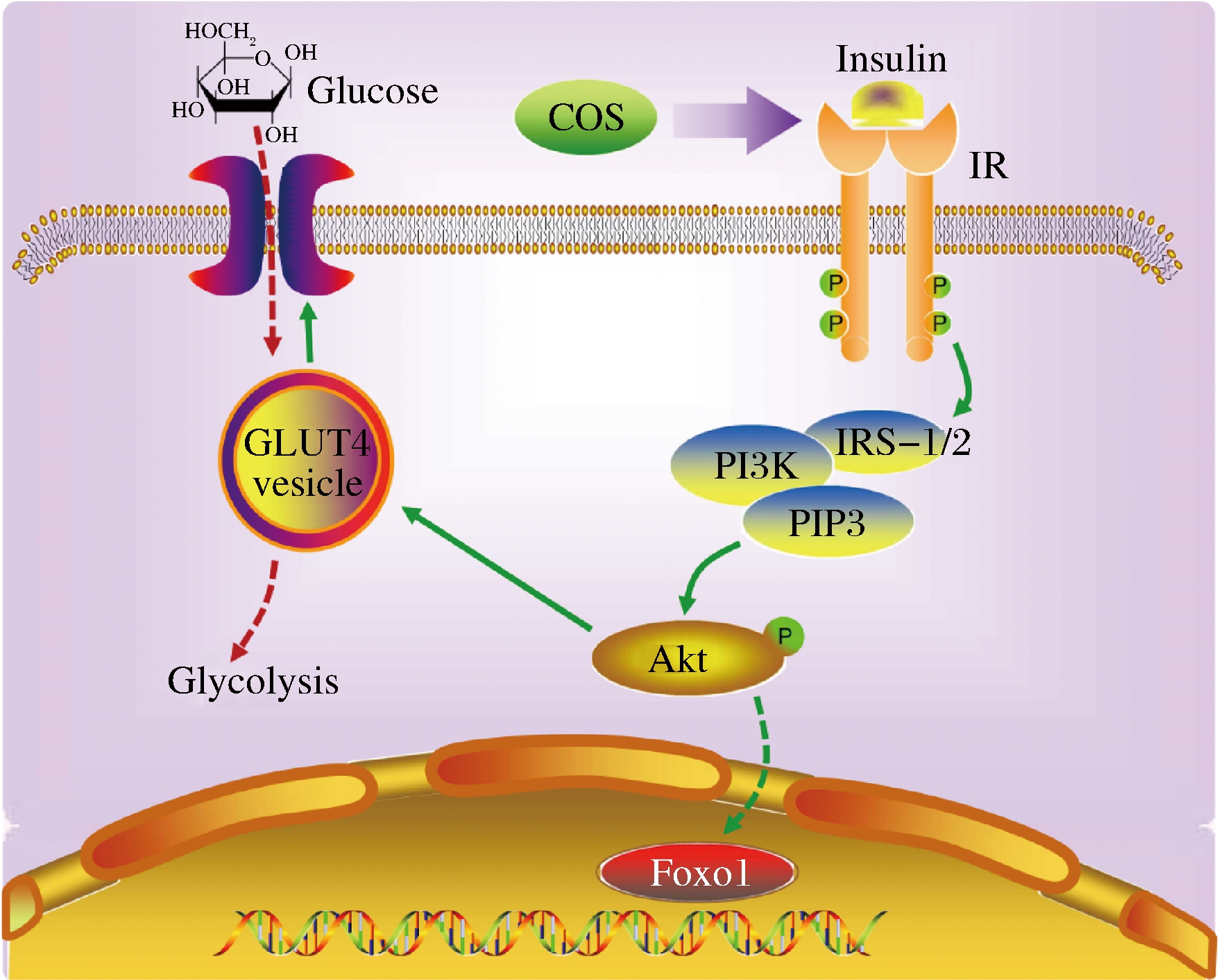
图7 COS改善胰岛素抵抗的作用机制
Fig.7 Mechanism of COS ameliorating insulin resistance
3 结论
COS具有广泛的生物活性,其中,降糖作用一直是研究热点,但由于COS组成及聚合度的复杂性,以及评价所用细胞类型和造模方式等差异,其降糖作用机制尚未完全阐明。研究结果表明,COS作用于胰岛素抵抗的HepG2细胞可显著促进葡萄糖代谢作用,其中壳三糖的作用显著高于壳二糖和壳四糖。COS和壳三糖通过上调Akt/GLUT4通路从而改善胰岛素抵抗。
[1] DE OLIVEIRA FILGUEIRA G C, FILGUEIRA O A S, CARVALHO D M, et al.Effect of type 2 diabetes mellitus on the pharmacokinetics and transplacental transfer of nifedipine in hypertensive pregnant women[J].British Journal of Clinical Pharmacology, 2017, 83(7):1 571-1 579.
[2] BASKA A, LEIS K, GA
![]() ZKA P.Berberine in the treatment of diabetes mellitus:A review[J].Endocrine, Metabolic & Immune Disorders Drug Targets, 2021, 21(8):1 379-1 386.
ZKA P.Berberine in the treatment of diabetes mellitus:A review[J].Endocrine, Metabolic & Immune Disorders Drug Targets, 2021, 21(8):1 379-1 386.
[3] 叶彪. 全科医学治疗Ⅱ型糖尿病的效果观察[J].全科口腔医学电子杂志, 2018, 5(15):66-67.
YE B.Observation on effect of general medicine in treating type Ⅱ diabetes mellitus [J].General Journal of Stomatology, 2018, 5(15):66-67.
[4] XU B G, WANG H, WANG S L, et al.Effects of acupoint thread-embedding therapy on serum apelin and GLP-1 in type 2 diabetes mellitus patients with obesity due to dampness-heat encumbering spleen[J].Journal of Acupuncture and Tuina Science, 2021, 19(2):123-128.
[5] KAC
 OV
OV M, ŽELEZN
M, ŽELEZN B, BLAŽKOV
B, BLAŽKOV M, et al.Aging and high-fat diet feeding lead to peripheral insulin resistance and sex-dependent changes in brain of mouse model of tau pathology THY-Tau22[J].Journal of Neuroinflammation, 2021, 18(1):141.
M, et al.Aging and high-fat diet feeding lead to peripheral insulin resistance and sex-dependent changes in brain of mouse model of tau pathology THY-Tau22[J].Journal of Neuroinflammation, 2021, 18(1):141.
[6] RAHMAN M H, HJELJORD L G, AAM B B, et al.Antifungal effect of chito-oligosaccharides with different degrees of polymerization[J].European Journal of Plant Pathology, 2015, 141(1):147-158.
[7] ZHOU J L, LIN Y, LIU Y, et al.Response to Antibiotic exposure and risk of type 2 diabetes mellitus:A systematic review and meta-analysis by Maryam et al.(2021) by J Zhou and K Chen (2021)[J].Environmental Science and Pollution Research International, 2022, 29(12):18 298-18 299.
[8] LIAQAT F, ELTEM R.Chitooligosaccharides and their biological activities:A comprehensive review[J].Carbohydrate Polymers, 2018, 184(12):243-259.
[9] KUMAR S G, RAHMAN M A, LEE S H, et al.Plasma proteome analysis for anti-obesity and anti-diabetic potentials of chitosan oligosaccharides in ob/ob mice[J].Proteomics, 2009, 9(8):2 149-2 162.
[10] YARULLINA L G, SOROKAN A V, BURKHANOVA G F, et al.Influence of chitooligosaccharides with different acetylation degrees on the H2O2 content and the activity of pathogenesis-related proteins in potato plants infected with Phytophthora infestans[J].Applied Biochemistry and Microbiology, 2018, 54(5):528-534.
[11] 于伟, 董霁, 王丽峰, 等.单层培养细胞总RNA两种提取方法的比较[J].中国体视学与图像分析, 2014, 19(4):387-391.
YU W, DONG J, WANG L F, et al.Comparison of the cell collection by two methods for total RNA extraction from monolayer cultured cells[J].Chinese Journal of Stereology and Image Analysis, 2014, 19(4):387-391.
[12] JU C X, YUE W, YANG Z H, et al.Antidiabetic effect and mechanism of chitooligosaccharides[J].Biological & Pharmaceutical Bulletin, 2010, 33(9):1 511-1 516.
[13] MENG Q Y, WANG H, CUI Z B, et al.Chitosan oligosaccharides attenuate amyloid formation of hIAPP and protect pancreatic β-cells from cytotoxicity[J].Molecules (Basel, Switzerland), 2020, 25(6):1314.
[14] QIN H N, WANG K.Study on preparation and performance of PEG-based polyurethane foams modified by the chitosan with different molecular weight[J].International Journal of Biological Macromolecules, 2019, 140(9):877-885.
[15] YANG H, LING J, MENG P, et al.Activation of hippocampal IR/IRS-1 signaling contributes to the treatment with Zuogui Jiangtang Jieyu Decoction on the diabetes-related depression[J].Evidence-Based Complementary and Alternative Medicine:ECAM,2021:6688723.
[16] HUANG Y T, HUANG T M, ZHEN X N, et al.A selective sphingomyelin synthase 2 inhibitor ameliorates diet induced insulin resistance via the IRS-1/Akt/GSK-3β signaling pathway[J].Die Pharmazie, 2019, 74(9):553-558.
[17] ZHONG C, PU L Y, FANG M M, et al.ATRA regulates innate immunity in liver ischemia/reperfusion injury via RARα/Akt/Foxo1 signaling[J].Biological & Pharmaceutical Bulletin, 2018, 41(4):530-535.
[18] LEE Y K, DIAZ B, DEROOSE M, et al.FOXO1 inhibition synergizes with FGF21 to normalize glucose control in diabetic mice[J].Molecular Metabolism, 2021, 49:101187.
[19] GU L P, DING X Y, WANG Y F, et al.Spexin alleviates insulin resistance and inhibits hepatic gluconeogenesis via the FoxO1/PGC-1α pathway in high-fat-diet-induced rats and insulin resistant cells[J].International Journal of Biological Sciences, 2019, 15(13):2 815-2 829.
[20] LIU S H, CHEN R Y, CHIANG M T.Effects of chitosan oligosaccharide on plasma and hepatic lipid metabolism and liver histomorphology in normal Sprague-Dawley rats[J].Marine Drugs, 2020, 18(8):408-416.
[21] JEONG S, MIN CHO J, KWON Y I, et al.Chitosan oligosaccharide (GO2KA1) improves postprandial glycemic response in subjects with impaired glucose tolerance and impaired fasting glucose and in healthy subjects:A crossover, randomized controlled trial[J].Nutrition & Diabetes, 2019, 9:1-9.