葡萄糖氧化酶(glucose oxidase,EC 1.1.3.4 GOD)是一种二聚体的蛋白酶,可以高度专一地催化β-D-葡萄糖转化为葡萄糖酸,同时生成过氧化氢 [1-2]。GOD最早在黑曲霉的无细胞培养液中被发现,并由MULLER进行了报道[3]。在随后的研究中,多种微生物培养液都检测到GOD,并且以曲霉属和青霉属为主,近年来基因工程技术的发展,也有助于高产GOD菌株的培育[4]。20世纪70年代,我国成立研究协作组,对GOD开展系统深入研究,内容涉及到菌种选育、发酵工艺优化、酶的分离纯化以及特性研究等[5]。GOD在食品工业、畜禽养殖业和医药行业中有着广泛的应用[6]。
多种动物、植物、昆虫、红藻和微生物的体内都有GOD存在,而微生物(黑曲霉属和青霉菌属)具有生长繁殖快、成本低等优势,常被用作GOD发酵生产的主要菌种[7]。黑曲霉(Aspergillus niger)满足美国食品药品监督管理局(Food and Drug Administration,FDA)在食品工业中的安全性要求[5],并且我国农业部在2013年12月发布的《饲料添加剂品种目录(2013)》中,明确了饲料中的GOD可以使用青霉和黑曲霉进行工业生产[8]。在过去的几十年里,黑曲霉常被用于制酱、酿酒、制醋、抗生素、生产酶制剂和有机酸等有价值的生化产品的生产中[9]。
黑曲霉丝状真菌是一种形态复杂的微生物,在整个生命周期中会表现出不同的生长形式:高度游离的菌丝、菌丝缠绕紧密的颗粒球和菌丝发散的菌丝团[10]。不同的菌丝形态有利于不同发酵产物的积累,如菌丝颗粒球形态适宜生产糖化酶,发散菌丝团适于生产柠檬酸[11]。除了菌体自身的特性之外,许多环境因素也会影响真菌的形态,比如孢子接种量和pH的调整,会影响菌体的群体效应,有效控制黑曲霉的生长特征[12];溶氧系数和搅拌条件的改变,可以控制菌丝球的结构,增加发酵效率[13]。这些培养条件的调整都会间接导致渗透压的改变,但是直接研究外部渗透压对真菌菌丝形态影响的报道还很少。因此,本文深入研究了培养基中不同种类的底物所产生的渗透压对菌丝体形态的影响,通过光学显微镜的图像分析,得到了渗透压和丝状真菌形态之间的关系,采用分光光度法测定了不同渗透压下葡萄糖氧化酶的活力。
1 材料与方法
1.1 菌株
黑曲霉(Aspergillus niger)FF11-01,为实验室保藏菌种。
1.2 培养基成分与试剂
合成培养基组成(g/L):葡萄糖 25,KCl 0.2,KH2PO4 0.15,MgSO4·7H2O 0.24,(NH4)2HPO4 0.6,酵母膏 3.0,蛋白胨4.0,琼脂 20。吖啶橙染色剂、邻联茴香胺、辣根过氧化物酶、GOD标准品,Sigma公司。磷酸钠缓冲液、葡萄糖、盐酸(均为分析纯),国药集团。
1.3 主要仪器设备
SW-CJ标准洁净工作台,苏净集团安泰空气技术有限公司;STY-1A型渗透压测定仪,天大天发科技有限公司;SW-CJ-1F回转式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;501型恒温水浴锅,巩义市予华仪器有限责任公司;7200型分光光度计,尤尼柯上海仪器有限公司;DM-500型光学显微镜,徕卡显微系统(上海)贸易有限公司。
1.4 发酵培养
使用合成培养基在30 ℃下培养72 h,以保证孢子悬浮液浓度达到107 孢子/mL。活化后的黑曲霉孢子液转移至盛有100 mL底液的500 mL三角瓶中继续培养,接种量5%(体积分数),温度30 ℃,摇床转速220 r/min,培养时间48 h。菌体外部渗透压通过渗透压测定仪测定,并采用生理盐水作为对照组。
1.5 酶活力测定方法
根据葡萄糖氧化酶的催化反应机制,酶活力的测定主要有以下3种方法:电化学法[14]、滴定法[15]和分光光度法[16]。分光光度法样品处理简便,反应时间短,满足快速实验的要求,是目前最普遍使用的酶活力测定方法。利用邻联茴香胺作为显色供体,待测样品的吸光值可以反映GOD酶活力的大小,且该方法得到了众多科研工作者的认可[16-18]。
1单位量的GOD指的是在25 ℃、pH 6.0条件下每分钟氧化1 μmol葡萄糖需要的酶量。反应液的体积为300 μL,其中包括20 mmol/L磷酸钠缓冲液(pH 6.0)、0.7 mmol/L 邻联茴香胺、100 mmol/L D-葡萄糖、20 μg/L辣根过氧化物酶和20 μL待测样品。微体系在25 ℃下反应10 min,用等体积的4 mol/L盐酸溶液停止反应。反应结束后的上清液测定波长540 nm的吸光值,根据标准曲线换算得到葡萄糖氧化酶的活力[16]。
1.6 吖啶橙染色和菌丝形态观察
将待测样品与96%的乙醇混合,80 ℃条件下,混合液在显微镜的载玻片上固定1 h,再用吖啶橙溶液染色[19],蒸馏水清洗多余的染色剂,并在室温下干燥。使用DM-500型光学显微镜观察黑曲霉的菌丝形态,经吖啶橙染色后,核糖核酸(RNA)丰富区和贫乏区,分别会表现出橘黄色和绿色[20]。
2 结果与讨论
2.1 渗透压对黑曲霉生长形态的影响
能源物质在微生物发酵培养过程中起到了至关重要的作用,选取葡萄糖、果糖、蔗糖、甘油和聚乙二醇(polyethylene glycol,PEG)作为碳源[21],NaCl为对照,探讨了渗透压对黑曲霉生长形态的影响。以质量分数0.9%的生理盐水模拟菌体内环境,产生的渗透压值OS为 287.28 mOsmol/(kg·H2O)。由于基质组分、温度等因素,渗透压测定值会出现一定范围内的波动,较难推算出准确的碳源浓度,因此以葡萄糖梯度增长的浓度值作为参考,对不同底物的渗透压(OT)进行了测定,结果见表1。可以发现,对于每一种底物而言,渗透压与浓度都会呈现出明显的正相关性,并且同一浓度不同底物会表现出差异性的结果。因此,液体培养基的渗透压可以通过添加不同种类和剂量的底物来控制。
表1 不同培养基底物引起的渗透压变化
Table 1 Osmotic pressures by different compounds in substrate
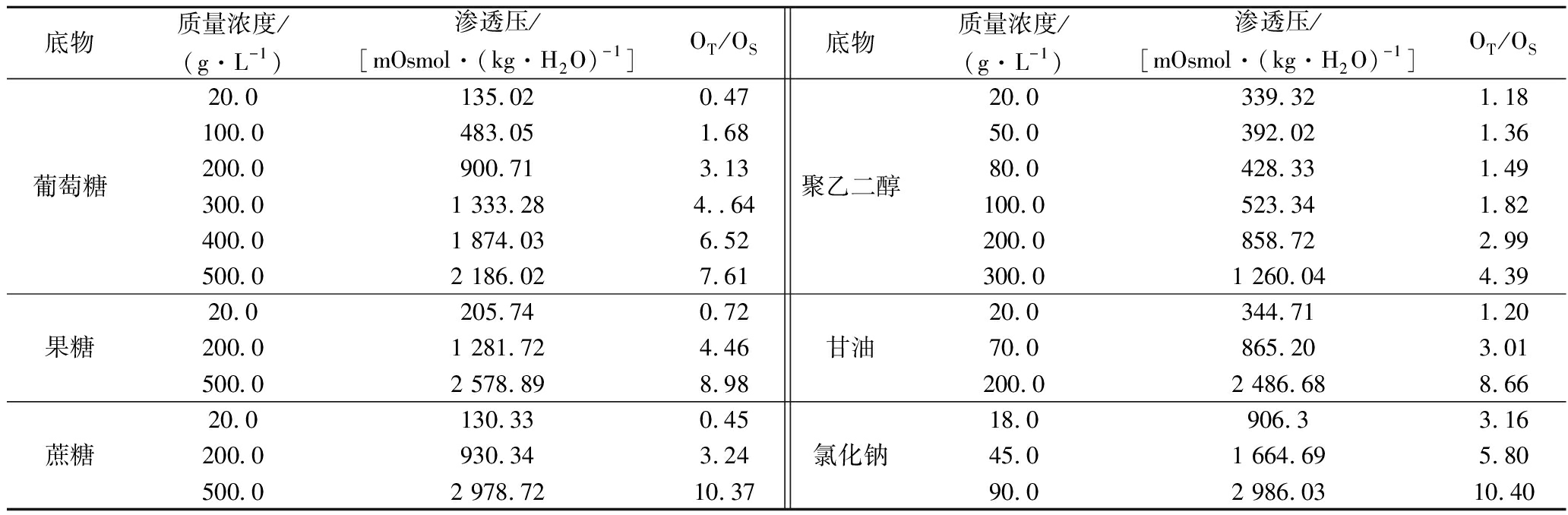
底物质量浓度/(g·L-1)渗透压/[mOsmol·(kg·H2O)-1]OT/OS底物质量浓度/(g·L-1)渗透压/[mOsmol·(kg·H2O)-1]OT/OS葡萄糖20.0135.020.47100.0483.051.68200.0900.713.13300.01 333.284..64400.01 874.036.52500.02 186.027.61聚乙二醇20.0339.321.1850.0392.021.3680.0428.331.49100.0523.341.82200.0858.722.99300.01 260.044.39果糖20.0205.740.72200.01 281.724.46500.02 578.898.98甘油20.0344.711.2070.0865.203.01200.02 486.688.66蔗糖20.0130.330.45200.0930.343.24500.02 978.7210.37氯化钠18.0906.33.1645.01 664.695.8090.02 986.0310.40
参考表1中的渗透压,以葡萄糖作为底物碳源,黑曲霉生长过程中菌体呈现出了图1-a~1-f的多种形态。当培养基渗透压为900.71 mOsmol/(kg·H2O)时,黑曲霉菌丝团开始逐渐形成,继续增大渗透压菌丝会出现明显的扩散现象。此外,其他5种底物的培养过程呈现出了图1-g~x的多种形态,可以发现无论在哪种底物实验中,黑曲霉在低浓度的剂量下都会呈现出菌丝缠绕的颗粒球状的生长形态,而随着浓度的增加,会向着发散的菌丝团状转变。除聚乙二醇(PEG)外,其他5种底物渗透压大于2 000 mOsmol/(kg·H2O)时,菌落数量明显下降,出现了畸形生长甚至死亡的现象。在90 g/L NaCl的平板培养基中(图1-x),未发现存活的菌株,而同样高渗透压(OT/OS =10.40)条件下,500 g/L蔗糖平板中(图1-l),却有少量的丝状菌体生长,这可能是因为蔗糖可以作为碳源用于黑曲霉的生长,而NaCl却不能作为能源物质。这些结果说明黑曲霉在低渗透压和高渗透压下,会表现出菌丝缠绕的颗粒球状和发散的菌丝团状的形态差异,可能也会进一步影响到菌体的新陈代谢途径[22],导致葡萄糖氧化酶活力的改变。
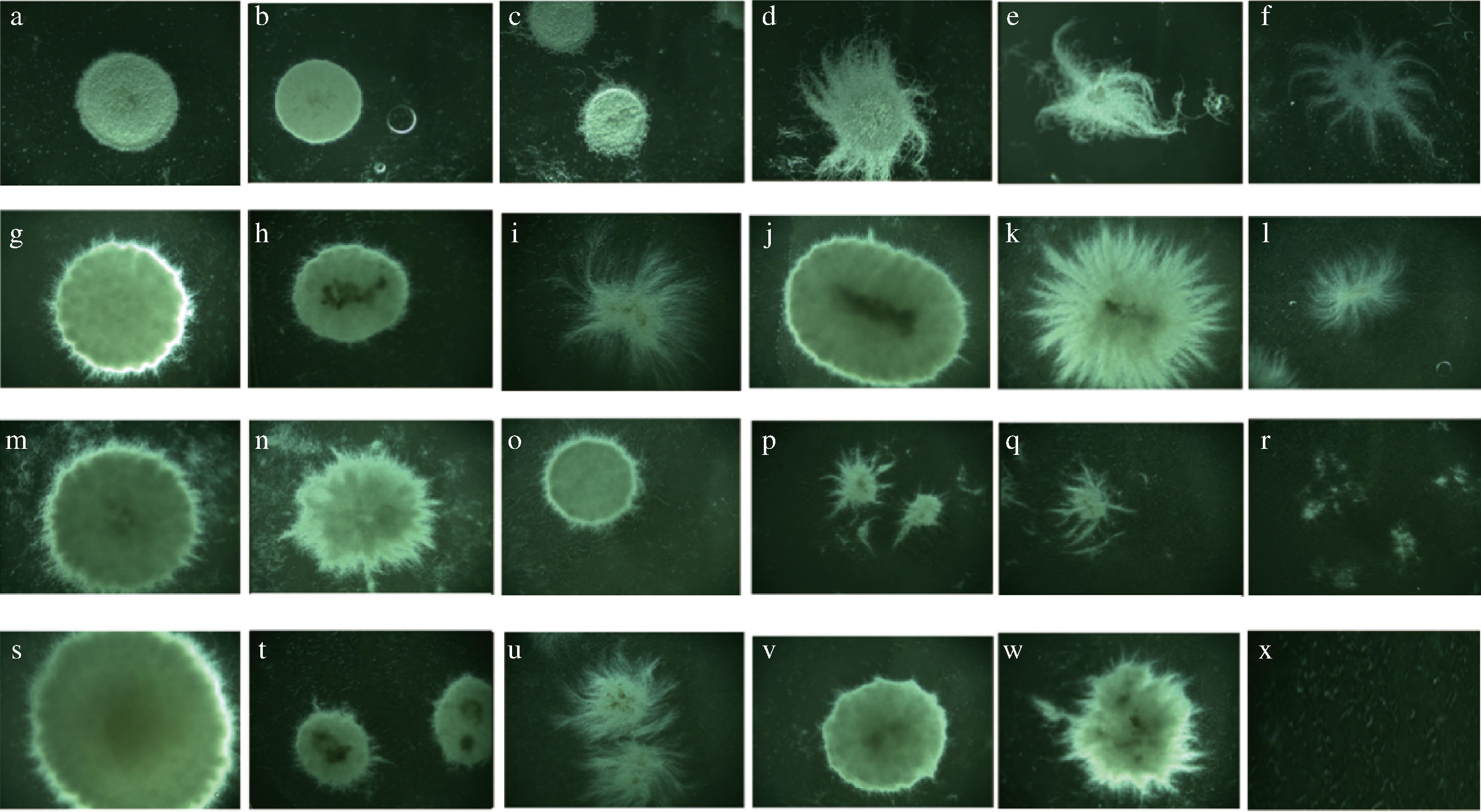
a-20 g/L葡萄糖;b-100 g/L葡萄糖;c-200 g/L葡萄糖;d-300 g/L葡萄糖;e-400 g/L葡萄糖;f-500 g/L葡萄糖; g-20 g/L果糖;h-200 g/L果糖;i-500 g/L果糖;j-20 g/L蔗糖;k-200 g/L蔗糖;l-500 g/L蔗糖; m-20 g/L PEG;n-50 g/L PEG;o-80 g/L PEG;p-100 g/L PEG;q-200 g/L PEG;r-300 g/L PEG; s-20 g/L甘油;t-70 g/L甘油;u-200 g/L甘油;v-18 g/L NaCl;w-45 g/l NaCl;x-90 g/L NaCl
图1 渗透压变化对黑曲霉形态的影响
Fig.1 Effects of osmotic pressure changes on the morphology of Aspergillus niger
2.2 吖啶橙染色确定活性区域的分布
吖啶橙染色剂与单链的RNA和双链的DNA相互作用时,会发出橘黄色和绿色的荧光。GOD等活性蛋白质主要由单链RNA的翻译合成,而吖啶橙可以鉴别出真菌微生物RNA的丰富区和贫乏区,因此可以确定出活性蛋白的分布区域。
选取浓度20和500 g/L葡萄糖培养的黑曲霉菌体,经过吖啶橙染色可以明确区分菌体中的RNA丰富区(橘黄色)和RNA贫乏区(绿色)[20]。图2和图3分别展示了低渗透压作用下菌丝缠绕的颗粒球状和高渗透压作用下发散菌丝团状的染色结果。低渗透压作用下黄色荧光区域集中在球团的外部边缘,表明丝状区域主要用来分泌GOD等活性蛋白,而球心绿色区域证实了菌体繁殖产生大量DNA的分布。高渗透压作用下菌丝团发散体积明显膨胀,虽然活性区域仍然出现在丝状的表面,但是贫乏区却没有明显显示效果。此外,溶解在培养基中游离的菌丝体上(图3-d)没有明显的RNA丰富区和贫乏区的界限。由此可见,菌株形态的不同将会导致活性蛋白分布区域的不同,菌丝球芯越小,菌体的活性体积就越大。
2.3 葡萄糖调控渗透压对菌体形态参数和GOD活力的影响
葡萄糖是黑曲霉培养的最佳碳源[5],但是适宜的添加浓度以及相应的渗透压需要进一步验证。表2总结了不同浓度葡萄糖控制的渗透压导致菌体形态变化的参数。随着渗透压的增大,微球的直径减小,相应边缘部位的菌丝长度增加。同时,菌丝体微球的数量也有明显的增长。总表面积和总体积均呈现出了先下降后上升的趋势,最低点出现在了渗透压值OT/OS =3.13(质量浓度为200 g/L)的实验组中,而值得注意的是,比表面积最大值也出现在该组实验中。结合本文之前得到渗透压变化影响细胞形态的结论,可以进一步确认,渗透压的增大会引起黑曲霉菌丝体生长形貌由大球团状向发散网状的转变。

a-×40,颗粒球状;b-×100,颗粒球外层; c-×200,颗粒球外层;d-×200,颗粒球核心
图2 在低渗透压下生长的颗粒球状形态活性区域检测
Fig.2 Morphologically active regions of pellets grown of A.niger under low osmotic pressure

a-×40,发散菌丝团状;b-×100,丝状外层; c-×200,丝状外层;d-×200,培养基中游离菌丝
图3 在高渗透压下生长的菌丝团状形态活性区域检测
Fig.3 Morphologically active regions of filamentous mass grown of A.niger under high osmotic pressure
表2 葡萄糖培养基控制的菌丝球团参数
Table 2 Summary of the key parameters of A.niger pellets obtained by different glucose concentration in substrate
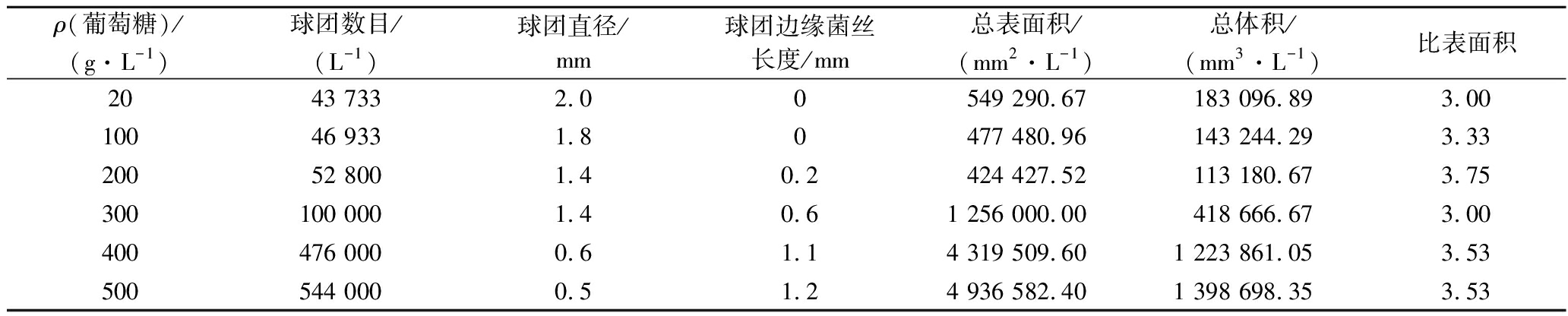
ρ(葡萄糖)/(g·L-1)球团数目/(L-1)球团直径/mm球团边缘菌丝长度/mm总表面积/(mm2·L-1)总体积/(mm3·L-1)比表面积2043 7332.00549 290.67183 096.893.0010046 9331.80477 480.96143 244.293.3320052 8001.40.2424 427.52113 180.673.75300100 0001.40.61 256 000.00418 666.673.00400476 0000.61.14 319 509.601 223 861.053.53500544 0000.51.24 936 582.401 398 698.353.53
图4展示了与表2相应梯度的葡萄糖浓度(相应的渗透压值列举在表1中)对黑曲霉生物量和GOD活力的影响。经过48 h的发酵培养,最低的GOD活力3.82 U/mL出现在渗透压值OT/OS = 0.47实验组中,这可能是由于较低含量的葡萄糖不能为菌体生长和代谢提供充足的营养造成的。在渗透压值OT/OS为3.13和4.64的实验组中,得到较高的GOD活力11.23和11.01 U/mL,菌体生物量为43.2和44.7 g/L,两组实验的结果无明显差异,为节约生产工艺的成本,选取200 g/L葡萄糖实验组数据作为后续实验的参考依据。当渗透压值超过OT/OS=4.64时,菌丝体的生物量和GOD活力均呈现出明显下降的趋势。因此,葡萄糖不仅可以作为GOD基因转录的主要诱导剂,而且可以通过改变菌体形态来决定GOD的活力[23]。
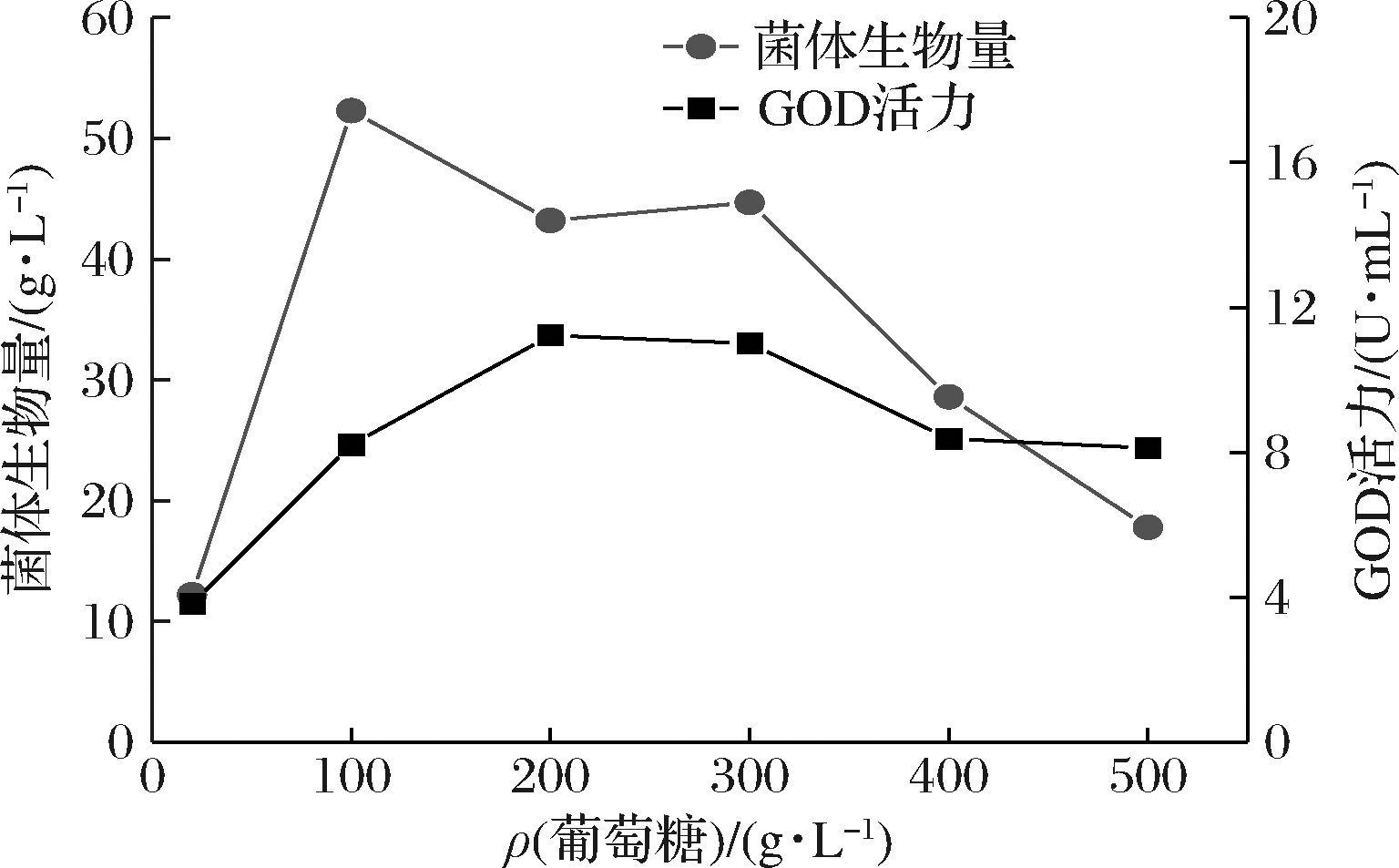
图4 不同渗透压葡萄糖培养基的GOD活力和菌体生物量
Fig.4 GOD activity and cell concentration of A. niger under different osmotic pressures regulated by glucose concentration in initial substrate
2.4 渗透压对GOD活力影响
采用2种方法评估了渗透压对GOD活力的影响,即不同浓度底物相似渗透压实验和相同浓度底物不同渗透压实验。
首先,确保渗透压的一致性,以200 g/L葡萄糖产生的渗透压900.71 mOsmol/(kg·H2O)为参考依据,底物中葡萄糖被果糖、蔗糖、甘油、PEG和NaCl替代后,5种替换底物的质量浓度依次为100.0、200.0、70.0、200.0和18.0 g/L,相应的渗透压变化范围在850~950 mOsmol/(kg·H2O)。通过分光光度法测定的GOD活力见图5,果糖、蔗糖和甘油作为底物得到的GOD活力分别为 10.32、9.14和10.21 U/mL,与葡萄糖为底物的GOD活力最高值11.23 U/mL相比,大约下降了10%~20%,下降趋势并不明显,这也进一步说明了发酵液渗透压对菌丝体形态的影响是决定GOD活力的关键因素。然而,在PEG和NaCl为底物的实验中,GOD活力显著下降,仅为3.29和0.48 U/mL,与葡萄糖为底物的GOD活力相比,分别下降了70.70%和95.73%。这可能是因为PEG和NaCl对黑曲霉的代谢起到了严重的抑制作用[24],这也与本文前面描述的菌体不能在高浓度NaCl培养基上生存相一致。

图5 不同底物相似渗透压培养的GOD活力
Fig.5 GOD activity by A.niger under similar osmotic pressure maintained by different additions
其次,选取木糖、果糖和葡萄糖为底物,评估相同底物浓度控制的不同渗透压对GOD活力的影响。底物中分别添加200 g/L的木糖、果糖和葡萄糖,得到渗透压值依次为543.52、1 281.72和900.71 mOsmol/(kg·H2O)。如图6所示,在木糖和果糖的实验组,GOD的活力仅为2.21和3.09 U/mL,而添加葡萄糖的实验组则表现出了较强的酶活力10.91 U/mL,大约提升了3~5倍。同时菌丝体生物量在葡萄糖作用下可以达到24.33 g/L,比木糖和果糖的实验组分别增加了59.87%和10.70%。这一现象与HATZINIKOLAOU等[23]报道的结果相一致,葡萄糖作为GOD转录基因的主要诱导物可能是造成这种显著差异的主要原因。由此可见,培养基中的渗透压对GOD的活力起到非常关键的控制作用。
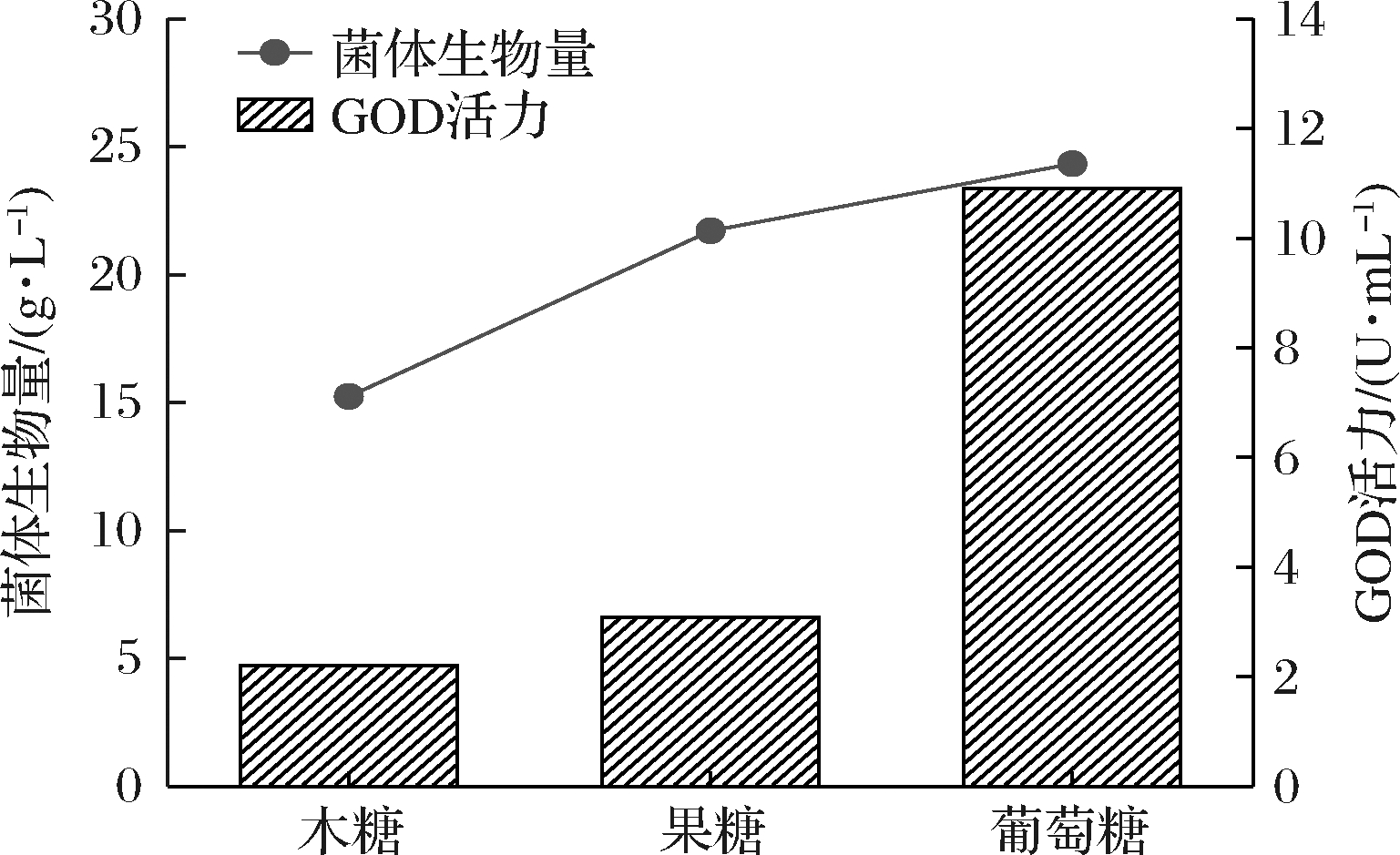
图6 相同浓度底物不同渗透压培养的GOD活力
Fig.6 GOD activity by A.niger using different carbon sources under different osmotic pressure
2.5 讨论
黑曲霉自身生长特性与细菌和酵母不同,在液态发酵培育中传质和传氧与菌体生长呈负相关性[25]。有研究表明,真菌生命周期中的颗粒化会导致培养基黏度的降低,进而有助于底物混合效率和传质效果[26],也有利于简化下游的固液分离工艺流程。但是在颗粒球状生长阶段,由于质量传递的局限性,微生物对溶解氧和营养物质的吸收受到抑制,会导致菌体内部的自溶[27-29]。相比之下,在微球嵌入到丝状真菌的网状结构的生长阶段,培养基的黏度会发生改变,菌丝吸收营养物质的接触面积将会增大[30]。
丝状真菌在发酵培养过程中会呈现出菌丝球状、发散网状和游离丝状的多种形态,形态学分析手段为控制菌丝特性,发酵液流变特性和代谢产物的研究提供了良好的依据。很多学者在黑曲霉产葡萄糖氧化酶的研究中,关注于常见工艺参数的优化,如:培养基组成、pH、温度、溶解氧和二氧化碳等[12],这些因素都会间接影响菌体生长环境的渗透压。本文通过直接控制渗透压的方法,研究了黑曲霉菌丝体生长形态和GOD活力的变化。在一定渗透压范围内,菌丝体呈现发散丝状的生长形态并分泌较高活力的GOD。此项研究工作为GOD生产工艺放大和其他生物制品的发酵生产提供了参考依据。在今后的研究中,将以此为基础继续探究其他底物种类、pH、搅拌等引发的渗透压改变对菌丝体形态和GOD活力的影响。
3 结论
培养基中的渗透压会严重影响黑曲霉的生长形态和GOD活力。随着渗透压的增长,菌丝体形态呈现出了从菌丝缠绕的颗粒球状向发散菌丝团状的转变。吖啶橙染色的结果表明,RNA丰富的蛋白活性区域分布在丝状形态中和颗粒球团的外层上。菌丝体生长形态的改变会导致内部代谢途径的改变,进而影响到GOD的活力。在200 g/L葡萄糖培养基中产生的渗透压为900.71 mOsmol/(kg·H2O),可以获得最高的GOD活力(11.23 U/mL)。发酵工艺优化研究中渗透压参数通常被忽视,不同微生物对环境的适应能力也存在着差异,在大规模工业生产中,稳定适宜的渗透压环境可以提高目标物产量和增加经济效益。
[1] 郭贺楠, 杨勇智, 董冰, 等.葡萄糖氧化酶研究进展[J].中国畜牧杂志, 2018, 54(4):10-14.
GUO H N, YANG Y Z, DONG B, et al.Research progress on glucose oxidase[J].Chinese Journal of Animal Science, 2018, 54(4):10-14.
[2] 惠瑶瑶, 郑斐, 王倩楠, 等.一种检测葡萄糖氧化酶活力的新方法[J].食品与发酵工业, 2020, 46(9):255-259.
HUI Y Y, ZHENG F, WANG Q N, et al.An innovative iodine-starch spectrophotometry method for quantitative detection of glucose oxidase[J].Food and Fermentation Industries, 2020, 46(9):255-259.
[3] MULLER D.Oxidation von glukose mit extrakten aus Aspegillus niger[J].Biochem Z, 1928, 199(1):136-170.
[4] 李蓉, 张庆芳, 迟乃玉.微生物葡萄糖氧化酶的研究进展[J].中国酿造, 2018, 37(3):1-5.
LI R, ZHANG Q F, CHI N Y.Research advance of glucose oxidase from microorganisms[J].China Brewing, 2018, 37(3):1-5.
[5] 廖兆民, 蔡俊, 林建国.微生物葡萄糖氧化酶的研究进展[J].食品与发酵工业, 2018, 44(7):308-315.
LIAO Z M, CAI J, LIN J G.Research progress of microbial glucose oxidase[J].Food and Fermentation Industries, 2018, 44(7):308-315.
[6] 杨久仙, 曹靖.葡萄糖氧化酶的应用进展[J].山西农业大学学报(自然科学版), 2013, 33(1):88-92.
YANG J X, CAO J.The application progression of the glucose oxidase[J].Journal of Shanxi Agricultural University (Natural Science Edition), 2013, 33(1):88-92.
[7] 付长涛. 发酵法生产葡萄糖氧化酶[D].北京:北京化工大学, 2017.
FU C T.Production of glucose oxidase by fermentation[D].Beijing:Beijing University of Chemical Technology, 2017.
[8] 方军成, 宋聪, 尤瑞祺, 等.葡萄糖氧化酶的生产及其在动物生产中的应用[J].畜牧与兽医, 2016, 48(10):125-129.
FANG J C, SONG C, YOU R Q, et al.Production of glucose oxidase and its application in animal production [J].Animal Husbandry & Veterinary Medicine, 2016, 48(10):125-129.
[9] MEYER V, ANDERSEN M R, BRAKHAGE A A, et al.Current challenges of research on filamentous fungi in relation to human welfare and a sustainable bio-economy:A white paper[J].Fungal Biology and Biotechnology, 2016, 3:6.
[10] 王宝石, 李林波, 谭凤玲, 等.剪切力敏感型微生物形态塑造及其在柠檬酸发酵中的应用[J].食品与发酵工业, 2018, 44(12):267-273.
WANG B S, LI L B, TAN F L, et al.Shape sensing of shear-sensitive filamentous microorganisms and its application in the citric acid fermentation[J].Food and Fermentation Industries, 2018, 44(12):267-273.
[11] 唐文俊, 夏建业, 储炬, 等.黑曲霉发酵过程中菌体形态的分析方法建立及应用[J].生物工程学报, 2015, 31(2):291-299.
TANG W J, XIA J Y, CHU J, et al.Development and application of morphological analysis method in Aspergillus niger fermentation[J].Chinese Journal of Biotechnology, 2015, 31(2):291-299.
[12] PAPAGIANNI M.Fungal morphology and metabolite production in submerged mycelial processes[J].Biotechnology Advances, 2004, 22(3):189-259.
[13] BIZUKOJC M, LEDAKOWICZ S.Physiological, morphological and kinetic aspects of lovastatin biosynthesis by Aspergillus terreus[J].Biotechnology Journal, 2009, 4(5):647-664.
[14] 刘洋汝, 李忠海, 任佳丽.电化学法测量黑曲霉孢子萌发过程中葡萄糖氧化酶的活性[J].食品与机械, 2017, 33(5):87-90;94.
LIU Y R, LI Z H, REN J L.Detection of GOD activity during the germination of Aspergillus niger spores by electrochemical method[J].Food & Machinery, 2017, 33(5):87-90;94.
[15] LU T B, PENG X Y, YANG H Y, et al.The production of glucose oxidase using the waste myceliums of Aspergillus niger and the effects of metal ions on the activity of glucose oxidase[J].Enzyme and Microbial Technology, 1996, 19(5):339-342.
[16] LUQUE R, OREJAS M, PEROTTI N I, et al.pH Control of the production of recombinant glucose oxidase in Aspergillus nidulans[J].Journal of Applied Microbiology, 2004, 97(2):332-337.
[17] 贺玉兰, 毛淑红, 魏萍萍, 等.葡萄糖氧化酶与过氧化氢酶的共固定化研究[J].食品科技, 2015, 40(4):34-37.
HE Y L, MAO S H, WEI P P, et al.The co-immobilization of glucose oxidase and catalase[J].Food Science and Technology, 2015, 40(4):34-37.
[18] 李丕武, 刘瑜, 李瑞瑞, 等.两种葡萄糖氧化酶活力测定方法的比较[J].食品工业科技, 2013, 34(12):71-75;80.
LI P W, LIU Y, LI R R, et al.Comparison of two kinds of glucose oxidase activity determination methods[J].Science and Technology of Food Industry, 2013, 34(12):71-75;80.
[19] EL-ENSHASY H, KLEINE J, RINAS U. Agitation effects on morphology and protein productive fractions of filamentous and pelleted growth forms of recombinant Aspergillus niger[J].Process Biochemistry, 2006, 41(10):2 103-2 112.
[20] FREUDENBERG S.Fluorescence microscopic investigation of Aspergillus awamori growing on synthetic and complex media and producing xylanase[J].Journal of Biotechnology, 1996, 46(3):265-273.
[21] SEMASHKO T V, MIKHA LOVA R V, LOBANOK A G.Growth characteristics and glucose oxidase production by mutant Penicillium funiculosum strains[J].Mikrobiologiia, 2004, 73(3):343-349.
LOVA R V, LOBANOK A G.Growth characteristics and glucose oxidase production by mutant Penicillium funiculosum strains[J].Mikrobiologiia, 2004, 73(3):343-349.
[22] SINHA J, BAE J T, PARK J P, et al.Effect of substrate concentration on broth rheology and fungal morphology during exo-biopolymer production by Paecilomyces japonica in a batch bioreactor[J].Enzyme and Microbial Technology, 2001, 29(6-7):392-399.
[23] HATZINIKOLAOU D G, MACRIS B J.Factors regulating production of glucose oxidase by Aspergillus niger[J].Enzyme and Microbial Technology, 1995, 17(6):530-534.
[24] 朱运平, 伍少明, 李秀婷, 等.微生物葡萄糖氧化酶的生产及其在食品工业中应用的研究进展[J].中国食品添加剂, 2013(5):165-172.
ZHU Y P, WU S M, LI X T, et al.Study on the production of microbial glucose oxidase and its application in the food industry[J].China Food Additives, 2013(5):165-172.
[25] 杨儒文. 黑曲霉菌球形态对产酸影响[J].当代化工, 2020, 49(8):1 689-1 693.
YANG R W.Effect of the morphology of Aspergillus niger on acid production[J].Contemporary Chemical Industry, 2020, 49(8):1 689-1 693.
[26] PAPAGIANNI M, NOKES S, FILER K.Submerged and solid-state phytase fermentation by Aspergillus niger:Effects of agitation and medium viscosity on phytase production, fungal morphology and inoculum performance[J].Food Technology and Biotechnology, 2001, 39:319.
[27] RINAS U, EL-ENSHASY H, EMMLER M, et al.Model-based prediction of substrate conversion and protein synthesis and excretion in recombinant Aspergillus niger biopellets[J].Chemical Engineering Science, 2005, 60(10):2 729-2 739.
[28] HILLE A, NEU T R, HEMPEL D C, et al.Oxygen profiles and biomass distribution in biopellets of Aspergillus niger[J].Biotechnology and Bioengineering, 2005, 92(5):614-623.
[29] EL-ENSHASY H, HELLMUTH K, RINAS U.Fungal morphology in submerged cultures and its relation to glucose oxidase excretion by recombinant Aspergillus niger[J].Applied Biochemistry and Biotechnology, 1999, 81(1):1-11.
[30] KRULL R.Characterization and control of fungal morphology for improved production performance in biotechnology[J].Journal of Biotechnology, 2013, 163(2):112-123.