细菌纤维素(bacterial cellulose,BC)是一种主要由驹形氏杆菌属(Komagataeibacter)细菌(旧称葡糖醋杆菌属或木醋杆菌属)生产的胞外多糖[1]。在食品工业中,BC常被应用于椰果、增稠剂、食品包装等相关产品[2]。BC具有与植物纤维素相同的化学组成,都是由β-1,4-糖苷键连接的大量葡萄糖基单元形成的高分子聚合物[3]。与主要来源于细胞壁的植物纤维素相比,BC不含半纤维素、木质素等其他多糖杂质,具有较高的纯净度和结晶度。高度结晶的纤维素微纤丝在氢键作用下形成纳米级别的纤维束,相互缠绕形成多孔状纤维网络结构[4]。这种结构给BC提供了良好的持水性和黏弹性,赋予了椰果类食品产品多汁的特点和优良的咀嚼性[5]。BONILLA等[6]利用流变学测试方法分析了BC凝胶的模量特性,发现凝胶的弹性模量主要由纤维网络密度决定。也有研究发现,菌种和发酵条件等因素都会对纤维素凝胶流变特性产生较大影响,最终影响产品品质[7]。
木糖驹形氏杆菌生产BC为好氧发酵过程,通常使用表面静置发酵法进行生产[8]。补料分批发酵法是发酵工业中常用的补充发酵底物及菌种、分批获取发酵产品的方法,适用于连续生产并提高产品转化率[9]。对于以表面静置发酵法生产BC,补料时加入液态培养基、搅动等过程可能会给发酵液施加一定剪切力,影响BC的产量、微观结构、流变学特性等,进而影响产品品质[10]。本研究利用表面静置发酵法,对比了分批补料(碳源、氮源、种子液)发酵法对木糖驹形氏杆菌菌株ATCC 53582和ATCC 700178生产BC的影响。重点讨论了木糖驹形氏杆菌在发酵过程中的碳源、氮源和菌体数目的变化,及分批补充碳源、氮源和种子液对BC凝胶产量、微观结构及流变学特性的影响。以期为提高BC产量及保证产品品质的稳定性提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及培养基
木糖驹形氏菌(Komagataeibacter xylinus)ATCC 53582和ATCC 700178,美国模式培养物集存库(American Type Culture Collection,ATCC)。文中均以保藏编号表示。
培养基(g/L):葡萄糖20、Na2HPO4 2.7、一水合柠檬酸1.26、酵母提取物5、蛋白胨5、去离子水。使用1 mol/L盐酸调节pH至5.0,115 ℃高压灭菌25 min冷却至室温后使用。
1.1.2 实验试剂
酵母提取物、蛋白胨,赛默飞世尔科技公司;琼脂粉,广东环凯微生物科技有限公司;葡萄糖、Na2HPO4、一水合柠檬酸、浓盐酸、NaOH、山梨酸钾(均为分析纯),天津市大茂化学试剂厂;去离子水,实验室制备。
1.2 仪器与设备
ME104E万分之一分析天平,梅特勒-托利多国际贸易(上海)有限公司;Smart-Q15去离子纯水机,上海和泰仪器有限公司;PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;YM50立式压力蒸汽灭菌器,上海三申医疗器械有限公司;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;DNP-9162电热恒温培养箱,上海精宏实验设备有限公司;MCR702流变仪,奥地利安东帕公司;ME104E液氮罐,成都查特低温设备有限公司;Scientz-10 ND冷冻干燥机,宁波新芝冻干设备股份有限公司;MiniFlex 600台式X射线衍射仪,日本理学公司;Spark 96孔板酶标仪,瑞士Tecan公司;ETD-2000离子溅射仪,北京博远微纳科技有限公司;EM-30 PLUS台式扫描电镜,韩国库赛姆公司。
1.3 实验方法
1.3.1 BC的培养条件和菌体光密度测定
木糖驹形氏菌菌株(Komagataeibacter)ATCC 53582和ATCC 700178以10%(体积分数)的接种量接种于总体积为20 mL的培养基中。使用直径为40 mm的圆柱形无菌塑料杯为发酵容器,以7 d为一个周期,在30 ℃下静置培养4个周期,共28 d。为了比较2株菌在发酵过程中的单位菌体葡萄糖消耗和纤维素产量的关系,测定发酵过程1个周期内(7 d)每天的菌体数以OD值表示。
1.3.2 BC的培养条件和菌体光密度测定
发酵开始后的第1、2、3、4个周期结束时(第7、14、21、28天),分别取0.1 mL木糖驹形氏菌培养液于离心管中,4 000 r/min离心10 min,获得上清液。取50 μL上清液于试管中,加入950 μL去离子水稀释,获得样品。将蒸馏水、标准品、样品与工作液加入96孔板酶标仪中。将酶标仪升温至37 ℃,设定振荡孔板时间为5 s,37 ℃孵育10 min。在505 nm波长下测定各孔吸光值。将吸光值代入葡萄糖标准曲线得出残留碳源浓度,并计算第1~3周期结束时需要的碳源补料量(补充至原培养基碳源浓度的所需量)。
1.3.3 发酵过程培养基残留氮源测定
使用考马斯亮蓝法测定。将上述获得的1 mL上清液与1 mL去离子水混合,加入5 mL的考马斯亮蓝染色液,混匀后室温静置3 min。以空白溶液作为对照,于595 nm处测定吸光值。将测得的吸光度值代入蛋白质标准曲线得出残留氮源浓度,并计算第1~3周期结束时需要的氮源补料量(补充至原培养基氮源浓度的所需量)。
1.3.4 发酵过程中的分批补料
将培养的木糖驹形氏菌样品根据补料次数(0~4次)分别分成4组。为了探究收获样品后残留碳源和氮源是否能继续使木糖驹形氏菌合成BC,每组样品统一保持发酵4个周期(28 d)。具体的补料次数、残留碳氮源测定时间和BC样品收获时间详见表1。补料方法为在移除气液界面已有BC凝胶后,使用移液枪,将枪头贴紧发酵容器内壁缓慢将补充培养基加入,以尽量减少新引入培养基产生的剪切力。
表1 分批补料设计及残留碳源氮源测定时间
Table 1 The design of fed batch fermentation and measurement time of residual carbon and nitrogen source

发酵时间A组B组C组D组1个周期(第7天)收获BC;测定残余碳源、氮源含量补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)2个周期(第14天)/收获BC;测定残余碳源、氮源含量补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)3个周期(第21天)//收获BC;测定残余碳源、氮源含量补充碳源、氮源及种子液分别至20 g/L、10 g/L和10%(质量分数)4个周期(第28天)计算总BC产量计算总BC产量计算总BC产量收获BC;计算总BC产量;测定残余碳源、氮源含量
1.3.5 BC的浓度和产率测定
将收获的BC凝胶使用去离子水在120 r/min的搅拌条件下水洗3~5次,直至凝胶从黄棕色变成浅白色。使用浓度为0.1 mol/L的NaOH溶液于100 ℃煮沸30 min以除去残余的培养基和菌体。将收获的BC膜置于烘箱中105 ℃烘干至恒重,称量记录干重,定义为产量。进行3次平行实验,取算术平均值和标准差。
1.3.6 BC的流变学性能测定
使用旋转流变仪在25 ℃下,通过振荡模式(动态模式)测量BC凝胶的流变性能。使用40 mm不锈钢平行板,平板间距设置为与BC凝胶高度一致(根据样品不同,范围在1~4 mm)。振幅扫描测试:通过设定角频率为1 rad/s,剪切应变振幅扫描范围为0.001~10。以安东帕RheoCompass 1.2.3分析数据以确定小振幅振荡剪切中线性黏弹区的振幅值。频率扫描测试:将角频率变化范围设定为0.1~100 rad/s,应变振幅设定为0.1(软件推荐的振幅值)以进行频率扫描实验,记录弹性模量(G′)和黏性模量(G″)的值。每次试验进行3次平行测定并取算术平均值。
1.3.7 发酵过程中的分批补料
BC微观形貌结构使用扫描电子显微镜观察。将收获的BC凝胶使用液氮迅速冻结,然后放入-50 ℃的冷冻干燥机中冻干至恒重。将干燥好的BC凝胶从冷冻干燥机中取出后,使用小刀以垂直方向将其切成约为3 mm×3 mm的小块,放于离子溅射仪中喷金处理1 min。观测电压设置为15 kV,对于BC从不少于3个不同的随机位置进行观察,放大倍数设定为10 000倍。
2 结果与分析
2.1 木糖驹形氏菌ATCC 53582和ATCC 700178的菌体数目和产量关系
由图1-a可见,在1个发酵周期(7 d)内,木糖驹形氏菌的菌体从第2天进入对数生长期,在第5天时达到最高峰,而在第5~7天出现下降。相对的,BC在第1~3天缓慢合成,第4~5天时合成速度加快,第6~7天进入合成高峰期。在发酵第6~7天菌体数目下降时,BC产量却达到最高值,可能存在2种原因。首先,根据一般规律,BC作为木糖驹形氏菌的一种次级代谢产物,更倾向于在菌体生长的稳定期之后进行合成[11];此外,先前研究表明,木糖驹形氏菌在合成BC的过程中,菌体倾向于存在于BC凝胶之中,而分布在液体培养基中的菌体较少[12]。因此,在发酵的第6~7天时除应该补充碳源和氮源外,也应该及时补充活力更高的新种子液以弥补液体培养基中菌体的损失。

图1 发酵1个周期内木糖驹形氏菌ATCC 53582和 ATCC 700178的OD值、BC产量(a) 及BC干重与OD比值(b)
Fig.1 The OD value, yields of BC (a) and the ratio of BC dry weight/OD (b) produced by Komagataeibacter genus bacterial strain ATCC 53582 and ATCC 700178
经过对比,菌株ATCC 53582的菌体生长速度和BC产量均高于ATCC 700178。2株菌的OD值在发酵第5天时分别为(0.091±0.015)和(0.073±0.015),在第7天时分别下降到(0.064±0.006)和(0.030±0.003),说明ATCC 53582菌体的整体生长情况优于ATCC 700178。同时,在发酵第7天时,菌株ATCC 53582的BC产量为(0.17±0.01)g,以发酵液总体积20 mL计算,产率为8.5 g/L,而ATCC 700178的产量仅为(0.014±0.004)g,产率为0.7 g/L,ATCC 53582的BC产量约是ATCC 700178的12倍。通过计算单位OD值菌体的产量可以发现,在BC产量最高的发酵第7天,ATCC 53582每单位OD菌体可以合成BC约3.33 g,而ATCC 700178单位OD的BC合成能力仅为0.47 g(图1-b)。这也与先前对于木糖驹形氏菌BC生产能力的研究报道结果一致[13]。ATCC 53582高产的原因可能与其基因组中含有比一般木糖驹形氏菌菌株多的纤维素合成酶相关基因有关[14]。因此,ATCC 53582可能更适合作为BC合成的生产用菌株[15]。
2.2 补料分批发酵中碳源及氮源残留量
在不补充任何碳源和氮源时,菌株ATCC 53582和ATCC 700178培养基中的碳源均几乎消耗殆尽(图2-a)。而在补料1次后,ATCC 53582仍然可以用尽几乎所有添加的碳源,而ATCC 700178则残留有(1.49±0.87) g/L的碳源。但在第2、第3次补料之后,2株木糖驹形氏菌对碳源的利用率均出现下降。在第3次补料之后,ATCC 53582残留有(9.42±1.03) g/L的碳源,而ATCC 700178残留约(8.42±1.91) g/L。而ATCC 53582的残留氮源浓度则较为稳定,始终保持在0.03~0.05 g/L,而ATCC 700178对氮源的消耗量相对更高(图2-b)。因此,此实验结果证实了在1次补料后发酵底物利用效率,尤其是对碳源的利用效率较高[16]。而增加补料次数可能会造成碳源原料的浪费。

a-碳源残留量;b-氮源残留量
图2 不同补料次数后培养基中碳源及氮源残留量
Fig.2 The residual of carbon and nitrogen source in the medium after different number of batch-fed
2.3 补料分批发酵对BC产量的影响
图3展示了2株木糖驹形氏菌通过补料分批发酵法生产的不同批次BC的产量(以干重记)。菌株ATCC 53582在补料3次后生产的BC总产量为(0.34±0.032)g,3次补料后以发酵液总体积26 mL计算,产率为13.08 g/L,对比补料0次时的产量(0.17±0.018)g,0次补料发酵液总体积20 mL,产率8.5 g/L总产量增加了约1倍(图3-a)。而ATCC 700178通过补料后产量增加得更多,从0次补料时产量(0.016±0.002)g,即产率0.8 g/L,增长到3次补料的(0.11±0.048)g,即产率4.23 g/L,总产量约增长了5.9倍(图3-b)。因此,分批补料法可以显著增加BC产量。但先前结果发现3次补料后的培养基中残留了大量未被利用的碳源[17],因此应该综合考虑碳源成本和BC产量以确定所需最优工艺条件。
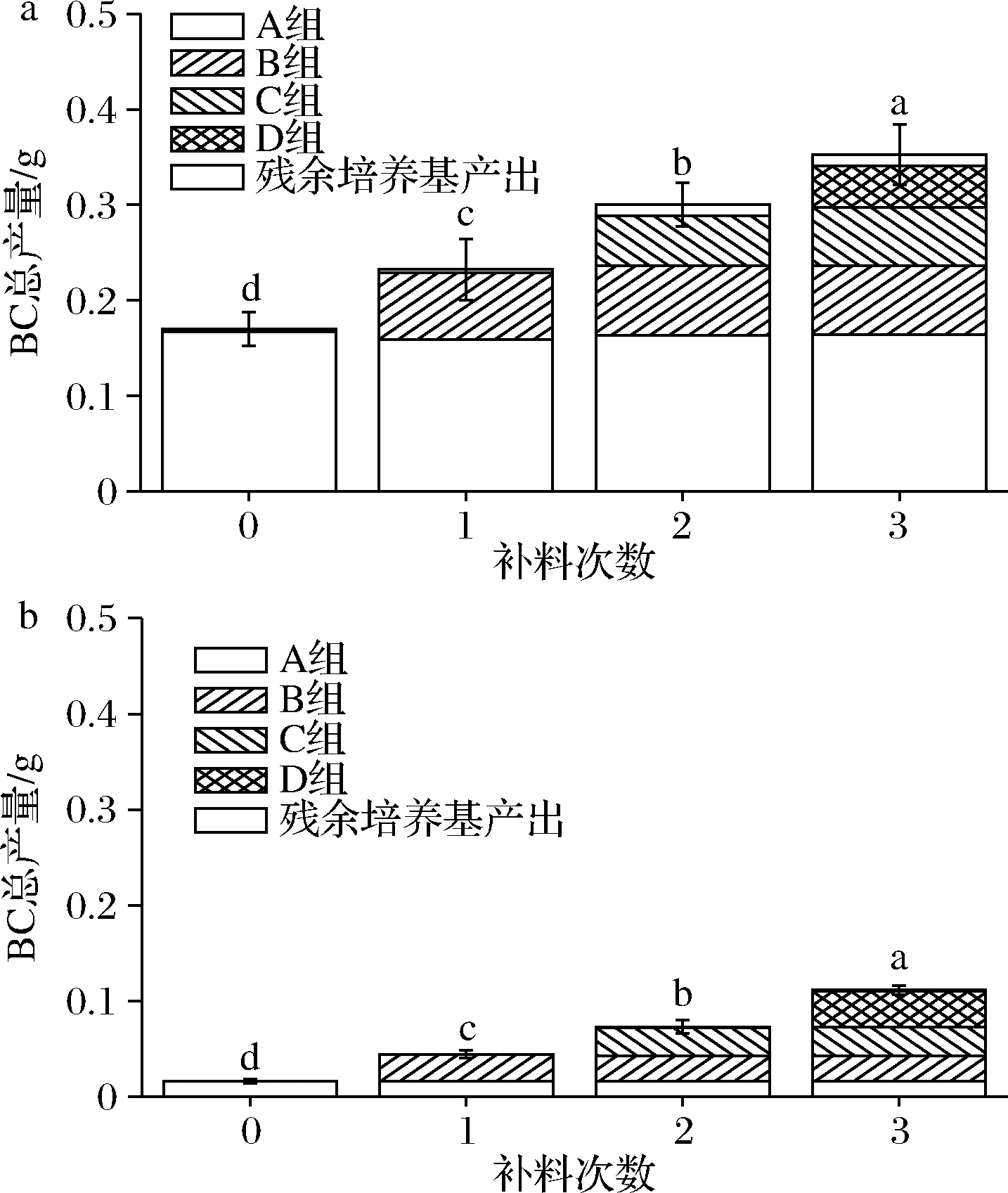
a-菌株ATCC 53582;b-菌株ATCC 700178
图3 分批补料生产BC总产量和分批收获BC产量
Fig.3 The total yields of BC and the BC harvested in each batch in fed batch fermentation
此外,在每次补料后1个周期发酵结束后收获的BC产量有所差异。ATCC 53582的产量随补料次数增加而分批收获的BC干重逐渐减少,从0次补料的0.17 g(产率8.5 g/L)下降到第3次补料后的0.043 g(产率1.65 g/L)。而ATCC 700178在补料后分批收获的BC干重出现逐渐增加的趋势,从0次补料的0.016 g(产率0.8 g/L)增加到第3次补料后的0.043 g(产率1.65 g/L)。此结果说明ATCC 700178可能更适合以补料分批发酵法的培养基环境。据报道,菌株ATCC 700178是在振荡培养环境下筛选出的耐高剪切力菌株,因此可以适应补料时产生的剪切力而合成更高产量的BC[18]。但ATCC 53582更适宜在静置环境下合成BC[19],因而在补料时引入的高剪切力可能会对其BC合成能力造成一定影响[20]。此外,在收获BC后,残留的培养基和菌体仍可以合成一部分BC,但总体产量非常低(<0.001 g)因此对培养基补充氮源、碳源和种子液是实现连续生产的必须手段。
2.4 补料分批发酵对BC凝胶流变性能的影响
为了研究补料分批发酵法对BC凝胶流变学特性的影响,使用小振幅振荡剪切试验,通过剪切频率扫描测定了发酵中不同菌株及批次收获的BC凝胶的黏弹特性[21]。由图4可见,菌株ATCC 53582和ATCC 700178生产的BC凝胶都为弹性(储能)模量G′大于黏性(损耗)模量G″的凝胶体,与先前报道一致[22]。其G′与G″在0.1~100 rad/s的角频率范围内呈几乎平行的关系,说明是弹性特征较强的胶体[23]。由ATCC 53582生产的BC凝胶的凝胶强度总体高于ATCC 700178生产的BC凝胶。在角频率100 rad/s时,通过0次补料,由ATCC 53582生产的BC凝胶(A组,图4-a)具有最高的弹性模量(12 825±3 980)Pa,而通过0次补料,由ATCC 700178生产的BC凝胶的弹性模量最低(936±266)Pa。BC凝胶的弹性模量主要由振荡剪切时纤维的交联数量决定[24],因此ATCC 53582生产的凝胶可能具有更高的纤维密度,这也与其拥有较高的干重一致。此外,同一菌种在不同补料批次中收获的BC凝胶的凝胶强度存在一定差异[25],因此,利用补料分批发酵法获取具有不同弹性模量的BC凝胶是一种可行的手段。
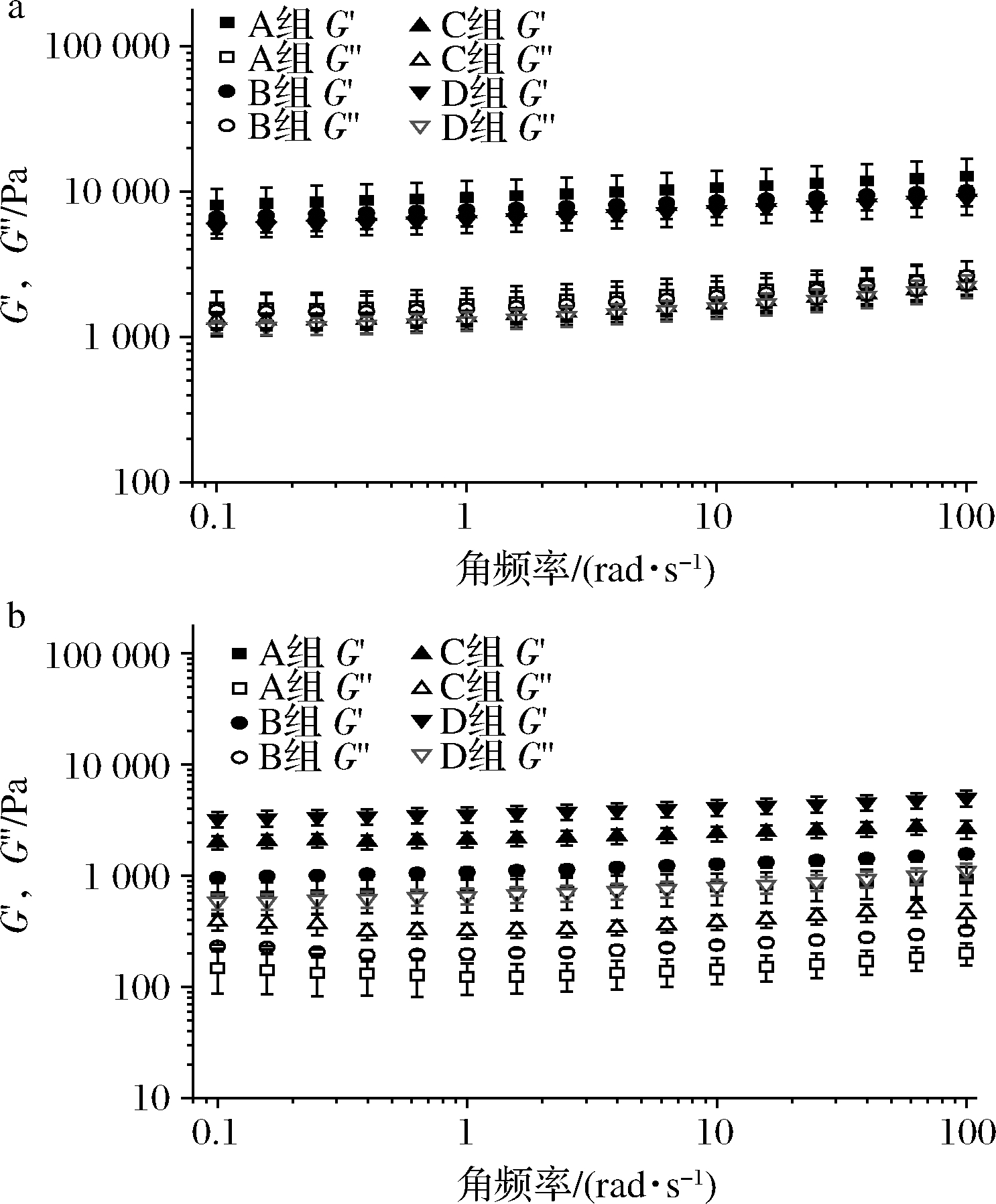
a-菌株ATCC 53582;b-菌株ATCC 700178
图4 补料分批发酵生产BC凝胶在频率扫描测试中的 弹性模量G′与黏性模量G″
Fig.4 Elastic modulus (G′) and viscous modulus (G″) in the frequency sweep of BC gels produced in the fed batch fermentation
2.5 补料分批发酵对BC微观结构的影响
由图5可知,不同菌株和补料批次中生产的BC都展现出明显的无规则纤维网络结构[26]。纤维的直径分布在1 nm~1 μm,与先前报道一致[27]。

a-53582 A组;b-53582 B组;c-53582 C组;d-53582 D组;e-700178 A组;f-700178 B组;g-700178 C组;h-700178 D组
图5 补料分批发酵法生产BC的微观结构(×10 000倍)
Fig.5 Microstructure of BC produced in fed batch fermentation (×10 000)
以ATCC 53582为发酵菌株,通过0次补料收获的BC样品(图5-a)的纤维网络密度最高,孔径最小[28]。而由ATCC 700178为发酵菌株,通过0次和1次补料收获的BC(图5-e、5-f)纤维缠绕成较粗的纤维束,且平均孔径较大,密度较小。先前研究发现,这样的大孔径结构减少了BC凝胶在液体培养基中的浮力,不利于BC凝胶的进一步合成[29]。而随着补料次数的增加,补料2次和3次的ATCC 700178菌株生产的BC网络变得更加致密。这也与先前的产量结果和流变特性结果一致,高纤维密度的BC样品在流变测试中表现出更高的弹性模量[30]。因此,补料分批发酵法可以显著增加ATCC 700178的BC网络密度和凝胶强度,但对ATCC 53582生产的BC凝胶影响有限。
3 结论与讨论
研究考察了2株木糖驹形氏菌ATCC 53582和ATCC 700178在补料分批发酵法生产中的碳源氮源利用率、BC产量、结构及流变学特性。结果表明ATCC 53582的单位OD菌株生产效率远高于ATCC 700178,BC在发酵第7天左右进入高峰期,但菌体数出现下降。在发酵第7天时补充碳源、氮源和种子液时,可以使发酵继续进行,菌株ATCC 53582和ATCC 700178经3次补料后生产的BC总干重分别为0.34和0.11 g,对比单次发酵总产量增加显著,但第3次补料后残留的碳源较多,无法被细菌充分利用。相比ATCC 53582,菌株ATCC 700178表现出更加适合补料分批发酵的特性,生成的BC产量随补料次数增加而增加。BC凝胶为弹性特性为主的强凝胶,由多孔状的纳米纤维网络构成。补料分批发酵法对BC凝胶的流变学特性影响较小。本研究为连续生产品质稳定的BC凝胶产品提供了经验和方法。
[1] 朱晓东, 杜昀怡, 原续波, 等. 细菌纤维素的最新研究进展[J]. 高分子通报, 2022(5):17-26.
ZHU X D, DU Y Y, YUAN X B, et al. Recent progress on bacterial cellulose[J]. Polymer Bulletin, 2022(5):17-26.
[2] LIN D H, LIU Z, SHEN R, et al. Bacterial cellulose in food industry: Current research and future prospects[J]. International Journal of Biological Macromolecules, 2020, 158:1 007-1 019.
[3] 苏玉玉. 玉米水解液发酵合成细菌纤维素[J]. 化学工程与装备, 2022(2):30-31.
SU Y Y. Fermentation of corn hydrolysate to synthesize bacterial cellulose[J]. Chemical Engineering & Equipment, 2022(2):30-31.
[4] GREGORY D A, TRIPATHI L, FRICKER A T R, et al. Bacterial cellulose: A smart biomaterial with diverse applications [J]. Materials Science and Engineering: R: Reports, 2021, 145: 100623.
[5] 郑梅霞, 肖荣凤, 陈梅春, 等. 不同干燥方式对细菌纤维素复水性能的影响[J]. 福建农业学报, 2021, 36(12):1 499-1 505.
ZHENG M X, XIAO R F, CHEN M C, et al. Effect of drying methods on rehydration of bacterial cellulose[J]. Fujian Journal of Agricultural Sciences, 2021, 36(12):1 499-1 505.
[6] BONILLA M R, LOPEZ-SANCHEZ P, GIDLEY M J, et al. Micromechanical model of biphasic biomaterials with internal adhesion: Application to nanocellulose hydrogel composites[J]. Acta Biomaterialia, 2016, 29:149-160.
[7] ESA F, TASIRIN S M, RAHMAN N A. Overview of bacterial cellulose production and application[J]. Agriculture and Agricultural Science Procedia, 2014, 2:113-119.
[8] 余瞻, 赵福权, 徐成龙, 等. 红茶菌中细菌纤维素产生菌的筛选、鉴定及其发酵动力学模型构建[J]. 食品与发酵工业, 2021, 47(6):92-98.
YU Z, ZHAO F Q, XU C L, et al. Screening, identification of bacterial cellulose producing bacteria and establishment of fermentation kinetics[J]. Food and Fermentation Industries, 2021, 47(6):92-98.
[9] 傅亮, 易九龙, 陈思谦, 等. 木醋杆菌分批补料发酵法生产广式米醋[J]. 食品与机械, 2013, 29(1):202-204.
FU L, YI J L, CHEN S Q, et al. Fed-batch fermentation by Gluconacetobacter xylinus to produce Guangdong rice vinegar[J]. Food & Machinery, 2013, 29(1):202-204.
[10] CAZ N P, V
N P, V ZQUEZ M. Improving bacterial cellulose films by ex-situ and in-situ modifications: A review[J]. Food Hydrocolloids, 2021, 113:106514.
ZQUEZ M. Improving bacterial cellulose films by ex-situ and in-situ modifications: A review[J]. Food Hydrocolloids, 2021, 113:106514.
[11] 韩意红. 木醋杆菌合成细菌纤维素原位絮凝微藻的研究[D]. 武汉: 中南民族大学, 2020.
HAN Y H. Study on the In-situ flocculation of microalgae by bacterial cellulose synthesized by Gluconacetobacter xylinus[D]. Wuhan: South-central University for Nationalities, 2020.
[12] FU L, CHEN S Q, YI J L, et al. Effects of different fermentation methods on bacterial cellulose and acid production by Gluconacetobacter xylinus in Cantonese-style rice vinegar[J]. Food Science and Technology International, 2014, 20(5):321-331.
[13] LI Z F, CHEN S Q, CAO X, et al. Effect of pH buffer and carbon metabolism on the yield and mechanical properties of bacterial cellulose produced by Komagataeibacter hansenii ATCC 53582[J]. Journal of Microbiology and Biotechnology, 2021, 31(3):429-438.
[14] FLOREA M, REEVE B, ABBOTT J, et al. Genome sequence and plasmid transformation of the model high-yield bacterial cellulose producer Gluconacetobacter hansenii ATCC 53582[J]. Scientific Reports, 2016, 6:23635.
[15] 沈彧骏, 洪枫. 五株木醋杆菌机械搅拌培养结果的比较[J]. 广东化工, 2016, 43(16):96-97.
SHEN Y J, HONG F. Comparison of submerged and agitated culture of five strains of Acetobacter xylinum[J]. Guangdong Chemical Industry, 2016, 43(16):96-97.
[16] YASSINE F, BASSIL N, FLOUTY R, et al. Culture medium pH influence on Gluconacetobacter physiology: Cellulose production rate and yield enhancement in presence of multiple carbon sources[J]. Carbohydrate Polymers, 2016, 146:282-291.
[17] ZENG X B, SMALL D P, WAN W. Statistical optimization of culture conditions for bacterial cellulose production by Acetobacter xylinum BPR 2001 from maple syrup[J]. Carbohydrate Polymers, 2011, 85(3):506-513.
[18] FANG L, CATCHMARK J M. Characterization of water-soluble exopolysaccharides from Gluconacetobacter xylinus and their impacts on bacterial cellulose crystallization and ribbon assembly[J]. Cellulose, 2014, 21(6):3965-3978.
[19] JACEK P, KUBIAK K, RYNGAJ
 O M, et al. Modification of bacterial nanocellulose properties through mutation of motility related genes in Komagataeibacter hansenii ATCC 53582[J]. New Biotechnology, 2019, 52:60-68.
O M, et al. Modification of bacterial nanocellulose properties through mutation of motility related genes in Komagataeibacter hansenii ATCC 53582[J]. New Biotechnology, 2019, 52:60-68.
[20] 傅亮, 陈思谦, 易九龙, 等. 细菌纤维素膜对木醋杆菌发酵生产广式米醋的影响[J]. 食品与发酵工业, 2012, 38(4):123-126.
FU L, CHEN S Q, YI J L, et al. Effect of bacterial cellulose pellicle on Gluconacetobacter xylinus fermentation producing Guangdong rice vinegar[J]. Food and Fermentation Industries, 2012, 38(4):123-126.
[21] CHEN S Q, MELDRUM O W, LIAO Q D, et al. The influence of alkaline treatment on the mechanical and structural properties of bacterial cellulose[J]. Carbohydrate Polymers, 2021, 271:118431.
[22] 李昭锋, 曹潇, 朱杰, 等. 利用不同碳源调控椰果凝胶产品的结构和质构特性[J]. 现代食品科技, 2021, 37(5):145-152; 219.
LI Z F, CAO X, ZHU J, et al. Using different carbon sources to control the structure and textural characteristics of coconut gel(Nata jelly) products[J]. Modern Food Science and Technology, 2021, 37(5):145-152; 219.
[23] CHEN S Q, LOPEZ-SANCHEZ P, WANG D J, et al. Mechanical properties of bacterial cellulose synthesised by diverse strains of the genus Komagataeibacter[J]. Food Hydrocolloids, 2018, 81:87-95.
[24] LOPEZ-SANCHEZ P, CERSOSIMO J, WANG D J, et al. Poroelastic mechanical effects of hemicelluloses on cellulosic hydrogels under compression[J]. PLoS One, 2015, 10(3): e0122132.
[25] LOPEZ-SANCHEZ P, RINCON M, WANG D, et al. Micromechanics and poroelasticity of hydrated cellulose networks[J]. Biomacromolecules, 2014, 15(6):2 274-2 284.
[26] GROMOVYKH T I, PIGALEVA M A, GALLYAMOV M O, et al. Structural organization of bacterial cellulose: The origin of anisotropy and layered structures[J]. Carbohydrate Polymers, 2020, 237:116140.
[27] CHEN S Q, MIKKELSEN D, LOPEZ-SANCHEZ P, et al. Characterisation of bacterial cellulose from diverse Komagataeibacter strains and their application to construct plant cell wall analogues[J]. Cellulose, 2017, 24(3):1 211-1 226.
[28] SHAO W, WU J M, LIU H, et al. Novel bioactive surface functionalization of bacterial cellulose membrane[J]. Carbohydrate Polymers, 2017, 178:270-276.
[29] NGUYEN V T, FLANAGAN B, MIKKELSEN D, et al. Spontaneous mutation results in lower cellulose production by a Gluconacetobacter xylinus strain from Kombucha[J]. Carbohydrate Polymers, 2010, 80(2):337-343.
[30] LOPEZ-SANCHEZ P, SCHUSTER E, WANG D J, et al. Diffusion of macromolecules in self-assembled cellulose/hemicellulose hydrogels[J]. Soft Matter, 2015, 11(20):4 002-4 010.