蛋白酶是一类能够催化水解肽键的酶,广泛存在于动物内脏、植物茎叶及果实和微生物中[1]。因具有催化条件温和、效率高及能提升蛋白质生物功能等优点而被广泛用于环保、化工、医药、饲料、食品加工等行业,是目前应用最广泛的工业化酶制剂[2]。根据蛋白酶的来源不同,又可以将蛋白酶分为动物蛋白酶、植物蛋白酶以及微生物蛋白酶,与动植物蛋白酶相比,微生物蛋白酶种类丰富、提取工艺简单,不受原料限制,易于实现工业化生产[3],且微生物具有生长条件简单、生长速度快、代谢过程特殊和分布广等特点,由此成为生物酶的重要来源,工业上较多的蛋白酶均来自于微生物发酵法[4-5]。目前广泛用于工业蛋白酶生产的主要有细菌中的乳酸菌、地衣芽孢杆菌以及真菌中的青霉菌、镰刀菌、曲霉菌和酵母等[6]。生产上为获得具有更好产酶能力的菌株,常采用基因工程技术、诱变及遗传育种进行菌株重构,但会存在产物活性不高、性质差异性大以及菌株不稳定等问题[7-8]。因此挖掘新型蛋白酶、筛选高产、产物活性高、催化条件要求低且稳定的菌株成为研究的热点。
隶属于子囊菌门和担子菌门的酵母,可在深海、沼泽、土壤、冰川和植物体等环境中栖居与生活[9-11],同时也可寄生在植物的分生组织茎、花、叶、和果实中作为内生菌,并对宿主植物的生长发育、健康、适应性和物质代谢等方面产生重要的影响[12]。目前对内生酵母菌的研究多集中于群落多样性、可培养菌株的抑菌、促生功能物质生产和发酵特性等方面,如VAZ等[13]在巴西兰花内生真菌的研究中发现,有3株内生酵母具有抗菌活性;NASSAR等[14]从玉米中分离到8株能产生生长素IAA和IPYA的内生酵母菌;一些从杨树中分离的内生酵母则对常见发酵抑制剂具有抗性[15]。高健等[16]从茎用莴苣中分离出一株能利用麦芽汁产生柠檬烯的内生酵母。一些研究也指出,内生酵母多通过进行相应的新陈代谢与分泌胞外酶以适应宿主植物体内特殊环境[17],且这些胞外酶可能在常温等环境条件内稳定,并具有广泛的底物特异性和更高的催化效率,因而在生产应用中具有诸多优势,目前,一些研究人员已对产不同胞外酶的内生酵母进行了分离筛选和生产应用[18],但对产蛋白酶内生酵母菌的分离鉴定和发酵特性研究较为缺乏。而且,除菌株外,产酶类型和产酶发酵条件是决定菌株胞外酶产量高低及生产应用的主要因素,基于此,本研究以从3个糯红高粱品种不同器官中分离的内生酵母为研究对象,利用筛选培养基,分离、筛选并鉴定具有产蛋白酶功能内生酵母菌株,同时以在食品、药品和饲料行业应用广且催化速度快、催化过程温和、无污染等优点的中性蛋白酶为切入点[19],对产蛋白酶菌株的氮源利用能力以及产酶发酵条件进行筛选和分析,以期为寻找不同领域所需蛋白酶提供参考依据并奠定理论基础。
1 材料与方法
1.1 试验材料
分离内生酵母的糯红高粱品种为杂交高粱金糯粮1号和地方品种青壳洋。分离培养基为YPD培养基,酵母鉴定用WL营养琼脂培养基,产蛋白酶菌株初筛用脱脂乳营养培养基[10 g/L脱脂乳,20 g/L琼脂(pH 6.6)]。不同氮源利用功能筛选培养基分别为干酪素培养基、明胶培养基、胶原蛋白培养基、黄豆粉培养基、菜籽饼粕培养基等。
1.2 试验方法
1.2.1 内生酵母菌的分离
将糯红高粱不同时期不同器官表面消毒后用接组织块的方法接种到YPD培养基上。在22 ℃下培养,当组织块伤口出现菌落时,及时用接种环挑出菌落进一步连续划线至WL培养基上,进行形态鉴定,获得纯化的内生酵母菌株。
1.2.2 产中性蛋白酶功能菌株及不同氮源利用能力筛选
利用脱脂乳培养基初筛具有产蛋白酶功能的内生酵母菌,再将初筛得到的内生酵母菌采用三点点样法分别于常用产蛋白酶功能培养基(干酪素培养基、明胶培养基、胶原蛋白培养基、黄豆粉培养基、菜籽饼粕培养基)上接种,后置于25 ℃恒温培养箱中培养36 h左右观察菌落生长状况,查看是否生长透明圈,并拍照记录。用直尺测量菌落直径和透明圈大小。
1.2.3 产中性蛋白酶菌株分子生物学鉴定
将筛选出的具产蛋白酶特性的酵母菌接种至WL培养基上,置于25 ℃培养2 d。取50 μL Lysis Buffer裂解液于无菌离心管内,挑少许纯化菌株于管内,于80 ℃恒温水浴锅热变性15 min,取出进行低速离心,保留上清液作为PCR扩增所需模板。利用通用引物对内生酵母菌用26S rDNA D1/D2基因进行通用引物(NL1、NL2)PCR扩增,进行分子鉴定。PCR反应体系包括:5 μL DNA模板、1 μL NL1(10 mmol/L)、1 μL NL2(10 mmol/L)、25 μL 2×Taq PCR Master Mix、18 μL ddH2O。PCR扩增程序为:94 ℃预变性4 min, 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,32个循环,72 ℃再延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳进行检测。扩增产物检测合格后送上海生工生物工程技术服务有限公司测序,再将结果提交到NCBI-BLAST网站(http://blast.ncbi.nlm.nih.gov),应用BLAST先在GenBank上进行相似序列检索。
1.2.4 中性蛋白酶酶活力的测定
将上述筛选的酵母菌分别接种至YPD液体培养基中,25 ℃培养至对数生长期,调整菌液浓度至OD600=1,分别吸取上述培养液0.5 mL,接种至50 mL YPD液体培养基中,培养48 h后取菌液于10 000 r/min、4 ℃ 的条件下离心 15 min,上清液即为粗酶液。蛋白酶活力参照SB/T 10317—1999《蛋白酶活力测定法》进行测定[20],以酪氨酸为标准品绘制标准曲线,酶活力单位(U)定义为:每毫升酶液在 40 ℃、pH 7.5下,每分钟水解酪蛋白产生1 μg酪氨酸所需的酶量为1个蛋白酶活力单位。酶活力按公式(1)计算:
蛋白酶的活力![]()
(1)
式中:A,样品平行试验的平均吸光度;K,吸光常数;4,反应试剂总体积,mL;10,反应时间10 min;n,稀释倍数。
1.2.5 产中性蛋白酶菌株发酵条件的优化
以1.2.4筛选的产蛋白酶活力最高的2株菌为研究对象,分析不同碳源(葡萄糖、蔗糖、淀粉,添加量为1%);氮源(干酪素、牛肉膏、硫酸铵,添加量为1%);温度(25、30、35 ℃);pH(培养基初始pH值为5.0、7.0、9.0);接种量(1%、2%、3%)等培养条件对其中性蛋白酶活性的影响,筛选最佳发酵条件。
2 结果与分析
2.1 糯红高粱产蛋白酶内生酵母筛选与分子鉴定
从糯红高粱不同时期(花期、苗期)不同器官(根、茎、叶、花、种子)中分离筛选出33株产蛋白酶内生酵母(表1), 根据形态特征和26S rDNA D1/D2区基因序列分析技术,得出33株产蛋白酶内生菌隶属于1门、4目、13属,优势目为银耳目(Tremellales)占总数的57.62%;优势种属为Papiliotrema rajasthanensis,占总数的27.3%。
表1 糯红高粱产蛋白酶内生酵母分布
Table 1 Distribution of protease-producing endophyte endophytic yeasts in waxy sorghum

菌株编号目属NCBI数据库中相似度最高的菌种相似性/%登录号J2-14J11J13、J159、J214、J34J69、J145J132、J84、J71J4-52J1-187J6J1-174、J3-78、J3-72、J3-74、J3-75J25TremellalesPapiliotremaCryptococcusSymmetrosporaCryptococcusFilobasidium Papiliotrema aurea culture CBS:1207799.67KY108729.1Papiliotrema rajasthanensis strain DMKU-CE41100LC178733.1Papiliotrema rajasthanensis strain DMKU-CE11499.50~99.67LC178805.1Papiliotrema rajasthanensis strain LE078 99.18~99.67JQ672620.1Cryptococcus rajasthanensis strain YM25830 99.66~99.67KC494731.1Cryptococcus flavescens strain TDZJJ-499.83KC783404.1Symmetrospora sp.6/2-499.34KT933355.1Symmetrospora sp.strain N10-199.01MF979203.1Cryptococcus luteolus strain WOct07D (1)X-Y14 99.50~99.83GQ328025.1Filobasidium magnum isolate lhWW14199.84MF462769.1J2-52J2-245、J4-8J2-242J35、J4-9、J4-48UstilaginalesPseudozymaMoesziomycesPseudozyma aphidis strain JNHXSL-199.67JX049426.1Pseudozyma aphidis strain PH-M15 99.67~99.83GU373766.1Pseudozyma hubeiensis strain BSS 12299.5MT445004.1Moesziomyces aphidis CBS 517.8399.35~99.67NG_069796.1J1-2、J32J1-46J24J3-40SporidiobolalesRhodotorulaSporobolomycesRhodotorula mucilaginosa isolate MCZ4599.48~99.49MT001280.1Rhodotorula mucilaginosa strain GXZJP34100KC160605.1Rhodotorula sp.isolate 399.82MK720182.1Sporobolomyces arnicolor CBS 4215100NG_067316.1J1-31FilobasidialesNaganishiaNaganishia albida strain TC20-399.32MF377349.1
注:J2-14来源于金糯粮1号花期花;J11、J13、J25、J32、J34、J35、J69、J71、J84、J132、J145、J159、J214来源于金糯粮1号种子;J4-52来源于青壳洋花期花;J1-46、J1-187来源于青壳洋苗期叶;J6、J2-52、J4-8、J4-9来源于金糯粮1号花期茎;J24、J1-174、J3-72、J3-74、J3-75、J3-78来源于金糯粮1号苗期叶;J2-245来源于青壳洋花期根;J2-242、J4-48来源于青壳洋花期茎;J1-2、J1-31来源于青壳洋苗期茎;J3-40来源于金糯粮1号苗期茎
2.2 产蛋白酶内生酵母对不同氮源利用能力研究
2.2.1 以干酪素为氮源筛选功能内生酵母菌
以干酪素为氮源对33株产蛋白酶酵母菌筛选发现:其中7株酵母菌能分解利用干酪素,对该7株酵母菌的产酶能力分析表明,菌株J3-J78、J3-75和J24的产酶能力和活性较高,其中J3-78菌株产酶能力最优,J4-48、J4-52菌株产分解利用干酪素蛋白酶能力较差(表2,图1)。
表2 酵母菌株产利用干酪素的蛋白酶活力测定
Table 2 Protease vitality of casein produced by yeast strain

菌株编号透明圈直径和菌落直径比(D/d)蛋白酶活力/(U·mL-1)J61.59b181bJ3-781.63a211aJ4-481.56c177cJ3-751.6b181bJ4-521.55c176cJ241.61a184bJ1-311.58b179b
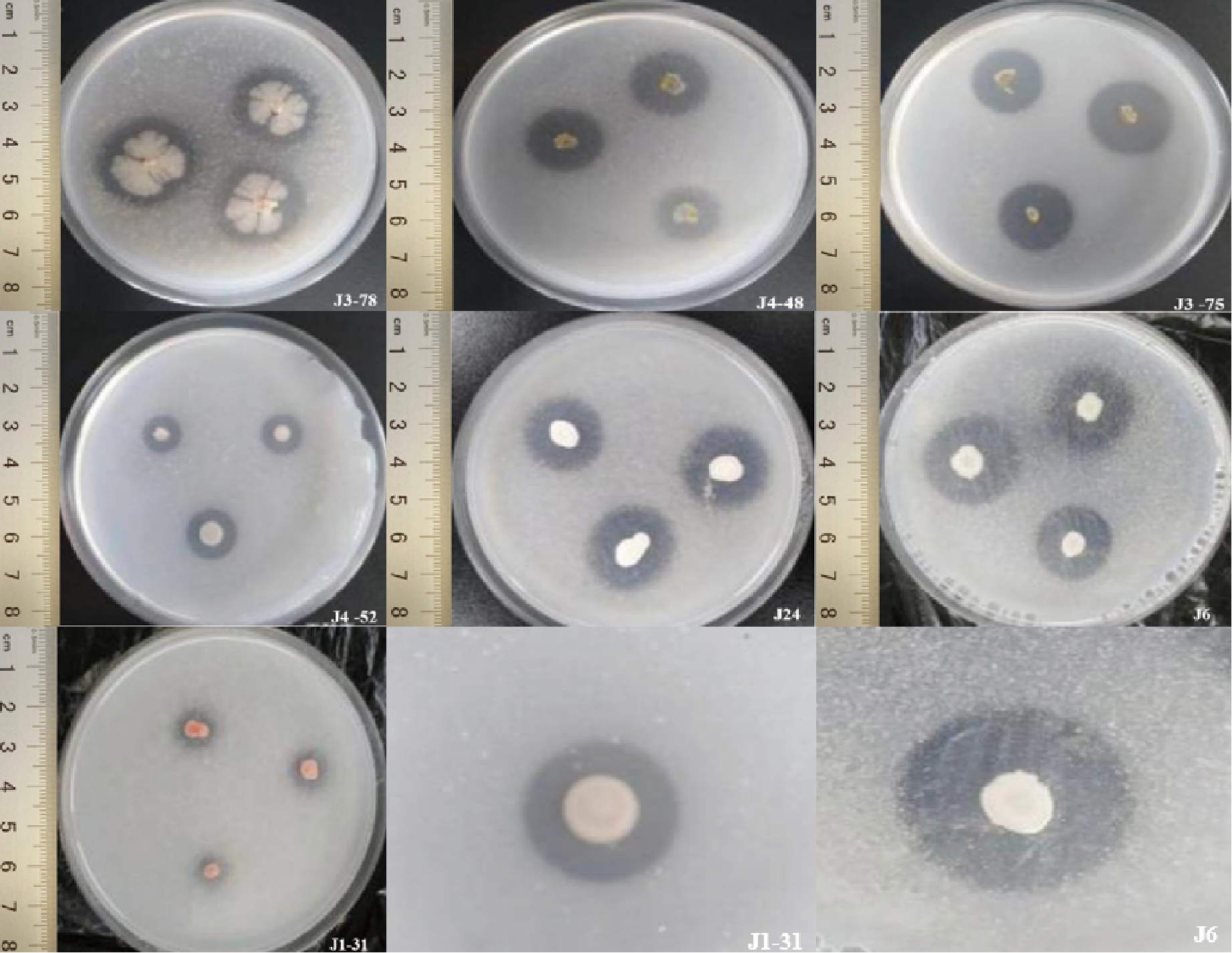
图1 筛选能利用干酪素产蛋白酶内生酵母(部分)
Fig.1 Screening of protease-prodcucing endophytic yeasts from casein (portion)
2.2.2 以明胶为氮源筛选功能内生酵母菌
以明胶为氮源对33株产蛋白酶酵母菌筛选发现:33株测试菌株中有5株能分解利用明胶,对该5株酵母菌产酶能力分析表明,菌株J6、J25和J2-52的产酶能力和活性较高,以J6菌株的产酶能力最高,J2-245和J159菌株产分解利用明胶蛋白酶能力较低(表3和图2)。
表3 酵母菌株产利用明胶的蛋白酶活力测定
Table 3 Protease vitality of gelatin produced by yeast strain
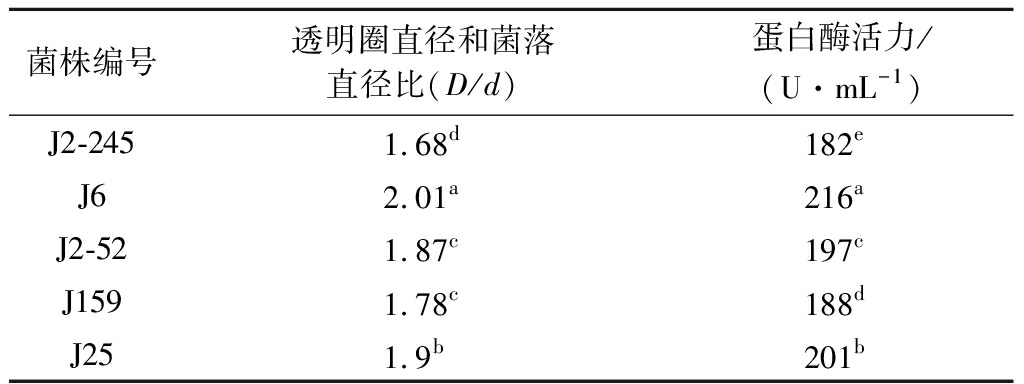
菌株编号透明圈直径和菌落直径比(D/d)蛋白酶活力/(U·mL-1)J2-2451.68d182eJ6 2.01a216aJ2-521.87c197cJ159 1.78c188dJ25 1.9b201b

图2 筛选能利用明胶产蛋白酶内生酵母(部分)
Fig.2 Screening of protease-prodcucing endophytic yeasts from gelatin (portion)
2.2.3 以菜籽饼粕为氮源筛选功能内生酵母
以菜籽饼粕为氮源对33株产蛋白酶内生酵母筛选发现:其中7株能分解利用菜籽饼粕中的氮源,对其产酶能力分析表明,菌株J214和J3-74产酶能力较高,以J3-74菌株产酶能力最优,J4-52、J84和J145菌株产分解利用菜籽饼粕蛋白酶的能力较低(表4和图3)。
表4 酵母菌株利用菜籽饼粕的蛋白酶活力测定
Table 4 Determination of protease vitality of yeast strain utilizing rapeseed meal

菌株编号透明圈直径和菌落直径比(D/d)蛋白酶活力/(U·mL-1)J321.33c159cJ1451.28d154dJ111.31c156dJ2141.48b164bJ841.32c133fJ4-521.21e142eJ3-741.56a170a
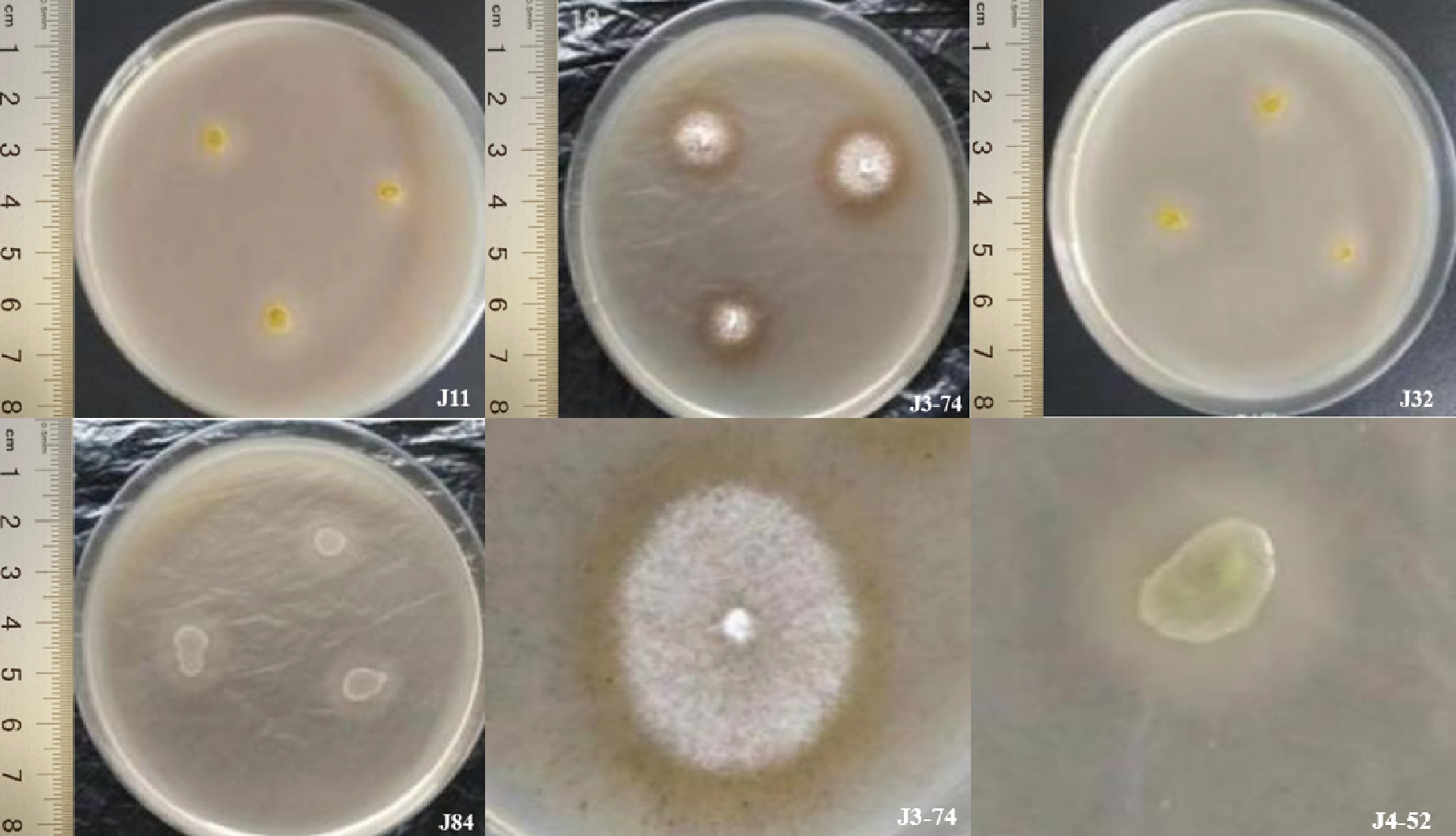
图3 筛选能利用菜籽饼粕产蛋白酶内生酵母(部分)
Fig.3 Screening of protease-prodcucing endophytic yeasts from rapeseed cake meal (portion)
2.2.4 以黄豆粉、胶原蛋白为氮源筛选功能内生酵母
以黄豆粉、胶原蛋白为氮源对33株产蛋白酶酵母菌筛选发现,以黄豆粉、胶原蛋白为氮源培养酵母的培养基中未长出透明圈,表明该33株酵母菌中未有可以利用这两类氮源的菌株(图4)。

图4 酵母菌株在含黄豆粉、胶原蛋白培养基生长情况
Fig.4 Growth of yeasts in medium using soybean powder and collagen as nitrogen source
2.3 高产蛋白酶内生酵母菌株发酵条件优化
根据2.2的结果,对J6和J24两株酵母进行发酵条件优化,结果表明,J6菌株产蛋白酶能力随着接种量的增加逐步降低,在接种量为1%时,蛋白酶活力最高,与接种量1%处理相比,2%和3%接种量条件下其产蛋白酶活力分别降低0.02%和0.05%;其产蛋白酶活性随pH值的上升而增高,培养条件为pH 7.0与pH 9.0较pH 5.0条件下的蛋白酶活力分别增加3%和4%;以温度为35 ℃作为对照组时,J6菌株随着培养温度的降低其产蛋白酶活力逐渐增加,在培养环境温度为30与25 ℃下该菌株所产蛋白酶活力分别增加1%和2%;以葡萄糖为碳源、牛肉膏为氮源较以麦芽糖或淀粉为碳源及以干酪素或硫酸铵为氮源的条件下,J6菌株产蛋白酶的活力更佳(图5)。J24菌株产蛋白酶能力随着接种量的增加呈现先上升后降低的趋势,在接种量为2%时,蛋白酶活力最高,较接种量为1%时的蛋白酶活力增加0.4%、较接种量为3%条件下的蛋白酶活力增加0.3%;其产蛋白酶活力随pH值的上升而降低,培养条件为pH 7.0与pH 9.0较pH 5.0条件下的蛋白酶活力分别减少3%和7%;以35 ℃作为对照组,J24菌株随着培养温度的降低其产蛋白酶活力逐渐增加,培养环境温度为30与25 ℃条件下,该菌株所产蛋白酶活力分别增加0.05%和1%;在以葡萄糖为碳源、牛肉膏为氮源时较以麦芽糖或淀粉为碳源及以干酪素或硫酸铵为氮源条件下,J24菌株产蛋白酶的活力更佳。因此,J6菌株在接种量为1%、pH为9.0、温度为25 ℃、葡萄糖为碳源、牛肉膏为氮源时产蛋白酶的活力最高(图5)。而J24菌株在接种量在2%、pH为5.0、温度为25 ℃、葡萄糖为碳源、牛肉膏为氮源时产蛋白酶的活力最高。

a-接种量;b-pH;c-温度;d-氮源;e-碳源
图5 高产蛋白酶内生酵母菌株发酵条件优化
Fig.5 Optimization of fermentation conditions for protease-producing endophytic yeasts
3 结论与讨论
内生菌几乎存在于所有植物组织中,其与植物之间存在复杂的微生态关系,是一种新的微生物资源,具有丰富的多样性[21-22]。目前,有关内生菌中的内生酵母的研究鲜少,大部分都集中在对多年生木本植物的研究上,且分离出的内生酵母极少。ZHAO [23]以30棵不同的北京油松松枝为材料,用麦芽提取物平板仅分离出3个酵母菌落;MIDDELHOVEN[24]从红杉的嫩枝中分离出4种酵母菌种;李亚辉等[25]从枸杞中筛选出6株酵母菌。本文是首次分析糯红高粱中产蛋白酶内生菌多样性的研究,结果显示,分离得到的33株产蛋白酶内生菌隶属于1门、4目、13属,优势目为银耳目(Tremellales),占总数的57.62%;优势种属为P.rajasthanensis,占总数的27.3%。该结果丰富了内生酵母资源,同时也为功能菌株的开发和利用提供参考依据。
内生菌的许多代谢物具有与其宿主产生的代谢产物相似的功能,可作为新的资源来替代短缺的药用植物并保护濒临灭绝的天然植物物种[26]。内生酵母对植物生长具有显著的影响,在农业生产中,利用这些天然酵母以改善农业和生物能源的物质生产,也是植物内生酵母的重要研究方向[12]。内生酵母具有产生植物激素、抗菌活性、作为生物催化剂、生物合成等优点[12-15]。因此对内生酵母菌的功能特性研究具有重大意义。YANG等[27]从大豆中分离出了1株脂质含量高达56%、脂肪酸甲酯含量高达 98%的可用作生产生物柴油的内生菌株F.equiseti UMN-1,并对其培养工艺进行了优化,使其最高脂质产量达到了3.89 g/L;JAGANNATH等[28]在斑籽根、叶、茎、花和种子中均分离出内生真菌可以产生纤维素酶。本研究对初筛选出的33株糯红高粱产蛋白酶内生酵母经过不同氮源利用能力筛选发现,其中有7株内生菌能产利用菜籽饼粕氮源的蛋白酶,J3-74菌株产酶能力最强;有5株能产利用明胶的蛋白酶,J6菌株产酶能力最优;有7株能产利用干酪素的蛋白酶,J3-78菌株利用干酪素产蛋白酶能力最佳。该结果可为植物内生酵母菌在工业生产上的应用提供参考依据,对在农业生产中,利用这些天然酵母以改善农业和生物能源的生物质生产同样具有重要参考价值。
不同内生菌的生境不同,其生长情况也会不同。有研究结果显示,胰蛋白胨是菊异茎点霉的最适氮源[29];葡萄糖是Phialophoramustea、Exophiala salmois、Paraphoma chrysanthemicola的最优碳源,乳糖是Cladosporium cladosporioids的最适碳源[29],蔗糖是Handkea utriformis的最适碳源[30]。磷酸氢二铵是Amanita caesarea的最适氮源 [31]。Umbelopsis dimorpha的最佳碳源为乳糖,最佳氮源为蛋白胨,适宜生长温度为30 ℃,适宜生长pH为6.0~7.0[24]。因此探索不同菌株适宜培养条件尤为重要,可提高菌株培养效率。本研究对J6与J24菌株进行了接种量、温度、pH、碳源、氮源的生物学特性研究,优化了该2株内生酵母菌的培养条件,结果显示,J6菌株在接种量为1%、pH为9.0、温度为25 ℃、葡萄糖为碳源、牛肉膏为氮源时所产蛋白酶的活力最高。而J24菌株在接种量为2%、pH为5.0、温度为25 ℃、葡萄糖为碳源、牛肉膏为氮源时所产蛋白酶的活力最高。该结果可为提高工业与农业上生产特定蛋白酶效率提供理论依据。
[1] 万文结, 薛芷筠, 张泽文, 等.一株产碱性蛋白酶菌株的筛选鉴定及酶学特性研究[J].微生物学报, 2017, 57(5):737-747.
WAN W J, XUE J X, ZHANG Z W, et al.Isolation and identification of an alkaline protease producing strain and study on enzymatic properties[J].Acta Microbiologica Sinica, 2017, 57(5):737-747.
[2] 郑津辉. 产碱性蛋白酶菌株的筛选与诱变育种[J].华北农学报, 2015, 30(5):122-124.
ZHENG J H.Selection and mutation breeding of alkaline protease-producing strains[J].Acta Agriculturae Boreali-Sinica, 2015, 30(5):122-124.
[3] GURUMALLESH P, ALAGU K, RAMAKRISHNAN B, et al.A systematic reconsideration on proteases[J].International Journal of Biological Macromolecules, 2019, 128:254-267.
[4] 张文杰, 高翔, 孙静, 等.地衣芽孢杆菌A产碱性蛋白酶的研究[J].食品科学, 2011, 32(1):199-202.
ZHANG W J, GAO X, SUN J, et al.Study on alkaline protease from Bacillus licheniformis A[J].Food Science, 2011, 32(1):199-202.
[5] 胡学智, 王俊.蛋白酶生产和应用的进展[J].工业微生物, 2008, 38(4):49-61.
HU X Z, WANG J.Advances in protease production and its applications[J].Industrial Microbiology, 2008, 38(4):49-61.
[6] 代玉梅. 蛋白酶高产菌株的筛选鉴定及酶学性质研究[D].青岛:青岛大学, 2008.
DAI Y M.Screening and enzymatic properties of a protease-hyperproducing strain from the digestive tract of Perinereis aibuhitensis grube[D].Qingdao:Qingdao University, 2008.
[7] 王东, 钟涛, 孙荣, 等.枯草芽孢杆菌中性蛋白酶基因的克隆与表达[J].基因组学与应用生物学, 2017, 36(3):906-910.
WANG D, ZHONG T, SUN R, et al.Cloning and expression of neutral protease gene from Bacillus subtilis[J].Genomics and Applied Biology, 2017, 36(3):906-910.
[8] LI Q, LI Y, MAREK P, et al.Commercial proteases:Present and future[J].FEBS Letters, 2013, 587(8):1 155-1 163.
[9] 张瑞蕊, 薛梅, 李宁宁, 等.天山一号冰川表面冰尘和底部沉积层中可培养酵母菌系统发育类群的分布及生态生理特征[J].微生物学报, 2019, 59(2):334-348.
ZHANG R R, XUE M, LI N N, et al.Phylogeny and diversity of culturable yeasts in supraglacial cryoconite and subglacial sediments of the Glacier No.1 in Tianshan Mountains[J].Acta Microbiologica Sinica, 2019, 59(2):334-348.
[10] 何曼, 刘畅, 朱凤妹, 等.昌黎产区产酶酵母多样性及其应用潜力分析[J].食品与发酵工业, 2020, 46(5):59-67.
HE M, LIU C, ZHU F M, et al.Diversity and application potential of enzyme producing yeasts in Changli[J].Food and Fermentation Industries, 2020, 46(5):59-67.
[11] SOLIS M J L, YURKOV A, CRUZ T E, et al.Leaf-inhabiting endophytic yeasts are abundant but unevenly distributed in three Ficus species from botanical garden greenhouses in Germany[J].Mycological Progress, 2014, 14(1):1-10.
[12] 慕丽琴, 冯汉青.植物内生酵母研究简况[J].生物学通报, 2021, 56(2):1-4.
MU L Q, FENG H Q.Diversity of endophytic yeasts in plants[J].Bulletin of Biology, 2021, 56(2):1-4.
[13] VAZ A B M, MOTA R C, BOMFIM M R Q, et al.Antimicrobial activity of endophytic fungi associated with Orchidaceae in Brazil[J].Canadian Journal of Microbiology, 2009, 55(12):1 381-1 391.
[14] NASSAR A H, EL-TARABILY K A, SIVASITHAMPARAM K.Promotion of plant growth by an auxin-producing isolate of the yeast Williopsis saturnus endophytic in maize (Zea mays L.) roots[J].Biology and Fertility of Soils, 2005, 42(2):97-108.
[15] BURA R, VAJZOVIC A, DOTY S L.Novel endophytic yeast Rhodotorula mucilaginosa strain PTD3 I:Production of xylitol and ethanol[J].Journal of Industrial Microbiology and Biotechnology, 2012, 39(7):1 003-1 011.
[16] 高健, 许爱清, 唐新科.一株莴苣内生产香酵母菌的分离、鉴定及挥发性香气成分分析[J].食品科学, 2011, 32(23):162-166.
GAO J, XU A Q, TANG X K.Isolation, identification and volatile compound analysis of an aroma-producing endophytic yeast from romaine lettuce[J].Food Science, 2011, 32(23):162-166.
[17] VALE H M M D, REIS J B A D, DE OLIVEIRA M, et al.Yeasts in native fruits from Brazilian neotropical savannah:Occurrence, diversity and enzymatic potential[J].Biota Neotropica, 2021, 21(4):e20201184.
[18] BHADRA B, RAO R S, SINGH P K, et al.Yeasts and yeast-like fungi associated with tree bark:Diversity and identification of yeasts producing extracellular endoxylanases[J].Current Microbiology, 2008, 56(5):489-494.
[19] 李娜, 附俊杰, 刘军, 等.一株产中性蛋白酶菌株的筛选及其发酵产酶条件优化[J].食品工业科技, 2023,44(1):189-199.
LI N, FU J J, LIU J, et al.Screening of a neutral protease-producing strain and optimization of fermentation conditions[J].Science and Technology of Food Industry, 2023,44(1):189-199.
[20] 上海市酿造科学研究所. 蛋白酶活力测定法:SB/T 10317—1999[S].北京:中国标准出版社, 1999.
[21] NASCIMENTO T L, OKI Y, LIMA D M, et al.Biodiversity of endophytic fungi in different leaf ages of Calotropis procera and their antimicrobial activity[J].Fungal Ecology, 2015, 14:79-86.
[22] 徐林琳, 张一彤, 于小倩, 等. 植物内生真菌活性成分及生物功能研究进展[J/OL]. 分子植物育种, 2021. https://kns.cnki.net/kcms/detail/46.1068.S.20210716.1504.010.html
XU L L, ZHANG Y T, YU X Q, et al. Research Progress in Bioactive Components and Biological Functions of Endophytes[J/OL]. Molecular Plant Breeding, 2021. https://kns.cnki.net/kcms/detail/46.1068.S.20210716.1504.010.html
[23] ZHAO J H.Rhodotorula pinicola sp.nov., a basidiomycetous yeast species isolated from xylem of pine twigs[J].FEMS Yeast Research, 2002, 2(2):159-163.
[24] MIDDELHOVEN W J.The yeast flora of the coast redwood, Sequoia sempervirens[J].Folia Microbiologica, 2003, 48(3):361-362.
[25] 李亚辉, 梁颖, 王英, 等.枸杞内生酵母菌的筛选及其发酵特性研究[J].中国酿造, 2019, 38(4):121-125.
LI Y H, LIANG Y, WANG Y, et al.Screening and fermentation performances of endogenous yeast from wolfberry[J].China Brewing, 2019, 38(4):121-125.
[26] YE K, AI H L, LIU J K.Identification and bioactivities of secondary metabolites derived from endophytic fungi isolated from ethnomedicinal plants of Tujia in Hubei Province:A review[J].Natural Products and Bioprospecting, 2021, 11(2):185-205.
[27] YANG Y, HU B.Investigation on the cultivation conditions of a newly isolated Fusarium fungal strain for enhanced lipid production[J].Applied Biochemistry and Biotechnology, 2019, 187(4):1 220-1 237.
[28] JAGANNATH S, KONAPPA N, LOKESH A, et al.Bioactive compounds guided diversity of endophytic fungi from Baliospermum montanum and their potential extracellular enzymes[J].Analytical Biochemistry, 2021, 614:114024.
[29] 宋瑛瑛. 深色有隔内生真菌培养条件的优化及铅吸附特性的研究[D].杨凌:西北农林科技大学, 2015.
SONG Y Y.Optimization of culture conditions and adsorption property for lead of dark septate endophyte[D].Yangling:Northwest A & F University, 2015.
[30] 张好强, 余红霞, 唐明.油松根际外生菌根真菌龟裂秃马勃的分离鉴定及培养[J].西北植物学报, 2016, 36(2):419-425.
ZHANG H Q, YU H X, TANG M.Isolation, identification and cultivation of ectomycorrhizal fungus Handkea utriformis in the rhizosphere of Pinus tabulaeformis[J].Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(2):419-425.
[31] DAZA A, MANJ N J L, CAMACHO M, et al.Effect of carbon and nitrogen sources, pH and temperature on in vitro culture of several isolates of Amanita caesarea (Scop.:Fr.) Pers[J].Mycorrhiza, 2006, 16(2):133-136.
N J L, CAMACHO M, et al.Effect of carbon and nitrogen sources, pH and temperature on in vitro culture of several isolates of Amanita caesarea (Scop.:Fr.) Pers[J].Mycorrhiza, 2006, 16(2):133-136.