中国白酒根据酿造工艺、原料和风味特征等差异可将其分为浓香型、酱香型、清香型和米香型等多种香型[1]。其中浓香型白酒因其具有窖香浓郁、绵柔醇厚、香味协调、回味悠长的风格特点而深受广大消费者的青睐[2]。酒醅是浓香型白酒酿造微生物的主要载体,微生物群落多样性及组成是影响浓香型白酒独特风味和品质的主要因素之一[3]。
近年来,高通量测序技术的广泛应用极大地丰富了人们对白酒酿造微生物的认识。胡晓龙等[3]发现酒醅中微生物主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)等,其中厚壁菌门在酒醅和窖泥微生物中占绝对优势,其相对丰度能达到50%以上。梭菌纲细菌(梭菌)是浓香型白酒酿造过程中一类重要的功能菌,隶属于厚壁菌门,具有多种代谢活动,包括将淀粉转化为己酸(己酸乙酯的前体物质)、丁酸、醇等[4]。早在20世纪60年代梭菌就被认为是浓香型白酒重要风味物质己酸乙酯的重要贡献菌[5]。近年来已经从不同酒企的窖泥中分别分离得到克鲁氏梭菌(Clostridium kluyveri)[6]、耳蜗形梭菌(C.luticellarii)[7]和丁酸梭菌(C.butyrieum)[8]等,并证明和产己酸、丁酸密切相关。尽管梭菌是酒醅中的优势微生物之一,但是目前关于梭菌的研究主要集中在窖泥样品及梭菌的代谢物分析中[9-11],而对酒醅样品中梭菌群落多样性及其演替规律研究鲜有报道。
因此,本研究采用高通量测序技术结合实时荧光定量方法对酒醅梭菌群落的多样性、组成及其含量动态变化进行解析。同时,通过结合酒醅理化性质的变化,探索了梭菌群落和酒醅理化性质的关联性,有助于进一步揭示梭菌群落在整个酿造周期内的演替规律及其影响因素。
1 材料与方法
1.1 材料与试剂
样品采集:随机选取正常发酵的3口平行窖池,对每口窖池中发酵第3、7、15、25、45、60天的酒醅进行跟踪取样。对每口窖池下层(距窖底约50 cm)平面上任一对角线的1/2、1/4及其距窖壁20 cm处3个不同位置的酒醅分别采集并混匀作为该窖池的代表性酒醅样品。因此,本研究共选取了18个样品,采集完成后装入已标记编号的无菌袋中并保存于-30 ℃备用,其编号分别为B3-1、B3-2、B3-3、B7-1、B7-2、B7-3、B15-1、B15-2、B15-3、B25-1、B25-2、B25-3、B45-1、B45-2、B45-3、B60-1、B60-2、B60-3。以编号B3-1、B3-2、B3-3为例,其中B代表下层酒醅,第一个数字3代表发酵时间为3 d,-1、-2和-3代表3个平行样品。
主要试剂:浓硫酸、酒石酸钾钠、苯酚、KCl、亚硝基铁氰化钠、NaClO、NH4Cl,天津市科密欧化学试剂有限公司;K2Cr2O7,天津市安吉瑞化工有限公司;酚酞、邻苯二甲酸氢钾、(NH4)2SO3,上海生工生物工程有限公司;DNS,上海麦克林生化科技有限公司。
1.2 仪器与设备
MP200A精密电子天平,上海良丰仪器仪表有限公司;C1000温度梯度PCR仪,伯乐生命医学产品(上海)有限公司;TGL-20M高速离心机,上海卢湘仪离心机仪器有限公司;DYY-8C电泳仪,北京市六一仪器厂;Mixer4K微型涡旋混合仪,生工生物工程(上海)股份有限公司;PHS-3C型pH计,雷磁上海仪电科学仪器股份有限公司;Multiskan FC酶标仪,赛默飞世尔科技公司;电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 酒醅理化测定
含水量测定:采用105 ℃干燥箱烘干恒重法测定。pH检测:将酒醅按料液比1∶3(g∶mL)与超纯水混合均匀,然后用pH计检测。还原糖、乙醇、铵态氮、总酸、总酯均参照文献[12] 的方法进行测定。
1.3.2 酒醅样品DNA提取
按照Powersoil® DNA Isolation Kit 试剂盒说明书提取酒醅DNA,然后利用1%琼脂糖凝胶电泳检测提取DNA质量。
1.3.3 酒醅DNA检测
使用引物338F:5′-ACTCCTACGGGAGGCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′扩增合格总DNA样品,并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina HiSeq 2500进行测序。
1.3.4 生物信息分析
首先使用Trimmomatic v0.33软件对测序得到的Raw Reads进行过滤,然后使用cutadapt 1.9.1软件进行引物序列的识别与去除,得到不包含引物序列的高质量Reads;使用 FLASH v1.2.7软件,通过overlap对每个样品高质量的Reads进行拼接,得到的拼接序列即Clean Reads;使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(effective reads)。其中相似性≥97%的序列归为1个操作分类单元(operational taxonomic unit,OTU),将OTU代表序列与Silva数据库进行比对和物种注释。挑选梭菌纲细菌结果用于后续分析。
1.3.5 实时荧光定量PCR
以细菌通用引物 对27F/1492R扩增菌株Clostridium butyricum D9(本实验室保存)的16S rRNA序列全长,将该PCR扩增产物连接pMD19-T载体,转化大肠杆菌JM109,培养后挑选出阳性克隆子。提取阳性克隆子质粒测定其吸光值并换算为质粒拷贝数(copies),10倍梯度稀释为DNA模板。采用细菌通用引物对515F/806R和梭菌引物对SJ-F/SJ-R分别对上述模板进行实时荧光定量PCR扩增,以lg(copies/μL)为横坐标,对应的Ct值为纵坐标,分别绘制细菌和梭菌的荧光定量标准曲线,其中细菌和梭菌荧光定量PCR扩增体系及条件分别参照文献[13]和 [14]的方法。
以每个酒醅样品的DNA为模板利用上述引物和方法并测定其Ct值,分别根据细菌和梭菌荧光定量标准曲线计算每个样品中的细菌及梭菌的含量。
1.3.6 数据处理
使用SPSS 26进行理化因子显著性分析,选择Duncan’s多重比较方法,不同小写字母表示处理之间存在显著差异(P<0.05)。Shannon指数的计算如公式(1)所示。
(1)
式中:H,Shannon多样性指数;s,微生物属的总数;Pi,第i个属的数量占总数的比例。
柱状图、标准曲线均使用Origin 9.0绘制。采用HemI软件绘制热图,Canoco 5软件绘制主成分分析(principal component analysis,PCA)图和冗余分析(redundancy analysis, RDA)图。Shannon指数箱线图和相关性热图使用TUtool云平台完成。
2 结果与分析
2.1 理化性质分析
如表1所示,根据发酵过程中酒醅的温度变化可以将整个发酵周期分为3个阶段,即升温期(3~7 d)、稳定期(7~25 d)和降温期(25~60 d),这与HU等[15]的研究结果一致。这主要是由于发酵前期酒醅营养充足,有利于微生物的生长繁殖,从而产生大量发酵热[16]。随着发酵时间的延长,酒醅中的营养成分逐渐减少,微生物生长和代谢减缓,酒醅温度在34 ℃保持18 d左右。在发酵后期,酒醅中可利用养分基本耗尽,加上乙醇和酸的增加,部分不适应环境的微生物逐渐死亡或者休眠[17],发酵作用和微生物活动均减小,酒醅温度下降。
在发酵前7 d,酒醅中除含水量下降外,其余理化指标均上升;在发酵7~25 d,乙醇、总酸含量和含水量上升,还原糖和总酯含量开始下降铵态氮略微上升后下降;在发酵25~60 d,含水量和总酸均在45 d时达到最大值,分别为(63.76±3.43)%和(24.63±2) mg/g,然后下降,铵态氮和总酯在45 d时略微上升而后下降;还原糖和pH则在45 d时下降至最低值 (6.08±5.82) mg/g和 3.36;乙醇在45 d时略微下降,然后在60 d时升至最高值(126.42±10.37) mg/g。酒醅pH在发酵前45 d均呈现下降趋势,发酵结束时略有回升。在发酵过程中,水分是保障酒醅中微生物生长代谢的重要因素,并为其代谢产物提供有效溶剂[18]。还原糖含量能间接反应白酒的发酵进程[19],发酵开始时,原料中的淀粉被分解为还原糖,但此时微生物生长代谢尚不活跃,对还原糖的利用率还不高,导致其含量积累增加,随着发酵进行不断减少直到发酵结束。乙醇是白酒发酵的重要产物,平均生成速率为0.57 mg/(g·d),其质量分数在3~7 d时增加最快,为2.11 mg/(g·d),在发酵至45 d时略微减少,这主要是由于在发酵后期酸和醇等合成脂类的前体物质大量积累,进而发生酯化反应生成酯类,加上酒醅含水量增加,稀释了乙醇的浓度,导致乙醇减少。另外在封闭的发酵环境中,微生物不断代谢积累有机酸,酒醅中总酸快速上升,pH开始下降。
表1 不同酒醅样品中理化性质变化
Table 1 Changes of physicochemical properties in different Jiupei samples

发酵时间/d温度/℃含水量/%还原糖/(mg·g-1)乙醇/(mg·g-1)铵态氮/(mg·kg-1)pH总酸/(mg·g-1)总酯/(mg·g-1)327±1.63a58.24±2.66a33.63±21.16ab93.06±9.03a12.47±3.09a3.61±0.06a11.43±1.65a45.43±10.49ab733.5±1.08b57.21±0.2a36.73±19.59a101.49±9.18ab12.56±2.7a3.57±0.01ab11.84±0.84a52.64±20.21b1534±1.63b58.73±1.37ab21.19±20.76ab109.57±5.62abc12.86±2.3a3.5±0.03b16.77±2.86b30.88±9.33ab2534±0.82b61.78±0.86ab8.56±10.8ab124.84±11.77c7.57±1.8a3.42±0.05c21.23±0.16c19.81±9.2a4529±1.41a63.76±3.43b6.08±5.82b120.6±7.81bc8.8±1.61a3.36±0.02c24.63±2c22.46±7.9a6027.33±0.47a61.35±2.54ab6.54±5.83ab126.42±10.37c8.17±1.16a3.41±0.02c23.14±0.95c20.27±7.08a
注:组间不同字母表示差异显著(P<0.05)
2.2 梭菌群落α多样性分析
Shannon指数可以用来表示酒醅中物种多样性,指数越大,多样性越高。如图1所示,梭菌Shannon指数的范围在0.01~0.27,呈现先减少(3~7 d),后稳定(7~25 d),增加(25~45 d),再下降(45~60 d)的趋势,梭菌群落的多样性在不断发生变化,且在第7天达到最低,第45天最高,这可能与酒醅中氧含量有关。在发酵前7 d,酒醅中氧含量较多,有利于芽孢杆菌等好氧菌的生长繁殖;在发酵中后期(25~45 d),酒醅溶氧量被消耗,更适合于梭菌等厌氧菌的生长,同时好氧菌生物量减少,进而导致梭菌群落多样性显著增加。

图1 不同酒醅样品中梭菌群落Shannon指数变化
Fig.1 Shannon index of clostridial community in different Jiupei samples
注:*代表具有显著变化(P<0.05)
2.3 酒醅中梭菌群落β-多样性解析
在属水平上,共注释到39个梭菌纲中的属。基于上述39个属进行PCA,探究不同发酵节点之间梭菌的群落差异,结果如图2所示。18个样品整体上可分为4类,即3、45、60 d的样品分别聚为一类,7、15、25 d样品聚在一起,每一类样品之间具有类似的梭菌群落。由此可知,酒醅梭菌群落变化与发酵时间有较好的关联性,其中发酵3、45、60 d的酒醅分别具有独特的梭菌群落,而7、15、25 d酒醅具有相似的梭菌群落。尽管不同发酵时间的酒醅梭菌群落能区分开,但是B3平行样品之间具有较大的离散度,这可能是由于:白酒酿造实际生产中的物料混合(大曲、粮食、酒醅等)多为人工拌和,很难保证不同平行窖池中物料拌匀程度完全一致,这也导致不同平行样品之间接入的微生物群落自身存在差异;此外,白酒酿造为固态发酵,平行样品间的酒醅微环境(如酒醅营养成分含量、含水量和溶氧等)可能也会存在差异,使得平行窖池之间酒醅微生物发酵进度不一,进而导致部分平行样品不能很好地聚类[20-21]。
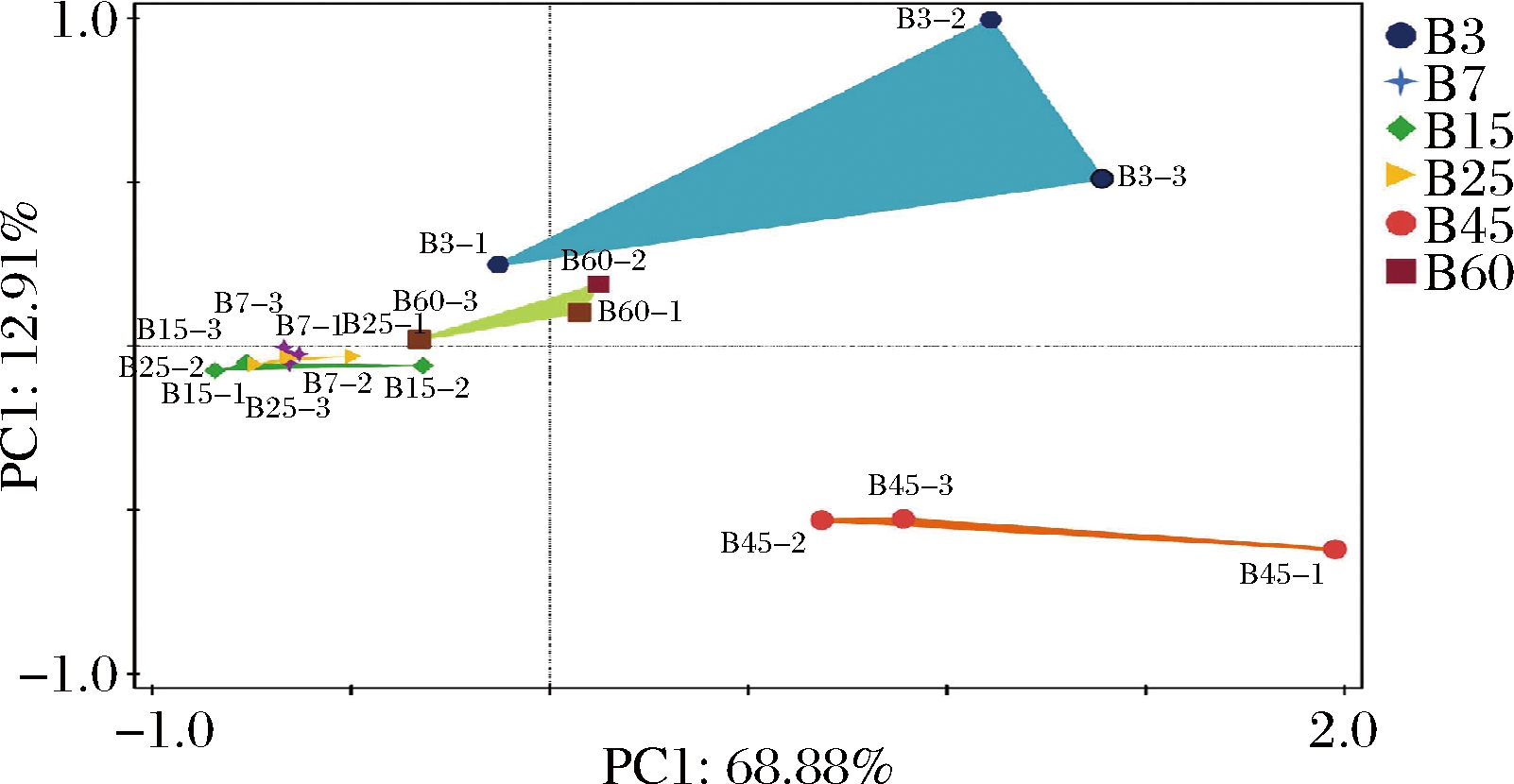
图2 不同酒醅样品中梭菌组成的PCA图
Fig.2 PCA plot based on the clostridia community structures in different Jiupei samples
2.3.1 酒醅梭菌群落组成
根据分类学注释结果(图3-a),酒醅中共检测到6个优势菌纲(>1%):Bacilli(芽孢杆菌纲,平均相对丰度78.12%)、Gammaproteobacteria(γ-变形菌纲,5.96%)、Bacteroidia(拟杆菌纲,5.33%)、Alphaproteobacteria(α-变形菌纲,2.97%)、Clostridia(梭菌纲,1.71%)和Actinobacteria(放线菌纲,1.11%)。其中Clostridia由1个目、13个科和39个属组成。
在目水平上,仅鉴定到单一的Clostridiales(梭菌目)。在13个科中,平均相对丰度>0.1%的科有Ruminococcaceae(瘤胃菌科,0.71%)、Clostridiaceae(梭菌科,0.35%)和Lachnospiraceae(毛螺菌科,0.35%)。表明在酒醅发酵过程中梭菌变化主要集中在上述3个科,与钱玮等[10]的结果一致。在属水平上,共检测到39个可鉴定的属,平均相对含量>0.1%的仅有Caproiciproducens(己酸菌属0.4%)和Clostridium_sensu_stricto_1(狭义梭菌属1,0.1%)。与窖泥中梭菌相比[10],酒醅中的梭菌群落多样性较低,所检测到的梭菌数量较少,如常见的Heliobacteriaceae(太阳杆菌科)在酒醅中也并未检测到。导致这一结果的原因可能有:酒醅中乳杆菌的相对丰度较高,其主要终产物乳酸会抑制没有耐酸特性的梭菌生长,加上乳酸链球菌素和乳酸菌素等细菌素会抑制革兰氏阳性菌的生长,导致酒醅中梭菌较少[14,22];本研究使用细菌通用引物进行测序分析,可能会因其扩增偏好性导致部分梭菌或含量低梭菌的无法检测到[23]。
2.3.2 酒醅梭菌群落组成的演替规律
梭菌的平均相对丰度为0.12%~5.58%,在发酵过程中呈先减少(3~25 d)后增加(25~45 d)再减少(45~60 d)的趋势。在发酵第7天含量最低(0.12%),其次为15 d和25 d,在发酵45 d时占比最高(5.58%)(图3-b)。在科水平上,Ruminooccaceae(0.71%)和Clostridiaceae(0.35%)和Lachnospiraceae(0.35%)为主要优势科,其总平均相对丰度占梭菌纲的73.18%。酒醅梭菌群落的变化主要由上述3个科驱动,其中Ruminococcaceae在前25 d呈现减少的趋势,在发酵25~45 d大幅增加,随后又减少。Clostridiaceae呈现和Ruminococcaceae相反的规律。Lachnospiraceae则呈现不稳定的变化过程。

a-细菌纲水平;b-梭菌纲水平
图3 不同酒醅样品中细菌纲和梭菌纲水平相对丰度
Fig.3 Relative abundance of bacteria and clostridia at class level in different Jiupei samples
在属水平上,挑选相对丰度前20个梭菌纲中的属进行热图分析(图4)。聚类分析结果表明,整个发酵过程可分为3类,B3为①类,B7、B15和B25为②类,B45和B60为③类。说明在发酵过程中,梭菌会随着发酵时间发生整体性的变化,也与图2的结果存在一定的一致性。在发酵7~25 d,所有梭菌的相对丰度均不同程度地减少,发酵至45 d时,除Saccharofermentans(产乙酸糖发酵菌)和Acetanaerobacterium(延长厌氧醋菌)外,其余18个属的相对含量均增加,其中,Caproiciproducens、Clostridium_sensu_stricto_1、Sedimentibacter、Fonticella、Anaerofilum、Ruminiclostridium_1(瘤胃梭菌属1)和Butyrivibrio_2(丁酸弧菌属2)的相对丰度在发酵至45 d时增加至最高。在这7个属中,Caproiciproducens含量最多,达到2.29%。GAO等[24]研究发现Caproiciproducens为浓香型白酒窖泥中的主要产己酸细菌,因此推测该属中的某些物种在酒醅中合成己酸起着重要的作用。

图4 不同酒醅样品中梭菌属水平组成
Fig.4 Clostridial composition in different Jiupei samples at the genus level
2.4 梭菌荧光定量分析
实时荧光定量PCR结果进一步研究了发酵过程酒醅中梭菌纲微生物的基因拷贝数以及在总细菌中的占比变化(图5)。以浓度对数为横坐标,Ct值为纵坐标,拟合绘制总细菌拷贝数标准曲线为:y=-3.033 3x+39.561,R2=0.997 3,梭菌纲拷贝数标准曲线为:y=-3.093 2x+37.519,R2=0.998 7,标准曲线均绘制良好。按上述标准曲线计算各样本中总细菌及梭菌微生物的16S rRNA基因拷贝数(图5-a),梭菌纲的基因拷贝数呈现先减少后增加的动态变化,第25天时最低(基因拷贝数为5.21 lg个/g窖泥),第45天升至最高(7.13 lg个/g窖泥),发酵结束时(6.01 lg个/g窖泥)较发酵开始时有所减少。这也与16S rRNA所得梭菌相对含量的变化规律一致。通过定量发现酒醅中梭菌和总细菌的基因拷贝数比值为0.17%~4.28%(图5-b),与16S rRNA测序结果类似,梭菌的占比同样在发酵45 d时最高。

a-荧光定量结果;b-基因拷贝数比值
图5 不同酒醅样品中总细菌及梭菌纲细菌实时 荧光定量结果
Fig.5 Real-time PCR results of total contents of bacteria and clostridia in different Jiupei samples
2.5 理化因子与梭菌之间的相关性
RDA展示了酒醅中相对丰度前10的梭菌(平均相对丰度>0.04%)与理化因子之间的关系(图6-a),2个主成分的总解释度为64.68%,主要集中Aixs1(59.76%)(图6-a)。理化因子与梭菌之间的相关性贡献率由大到小依次为温度(45.5%)>含水量(17.8%)>铵态氮(11.0%)>还原糖(10.3%)>乙醇(8.0%)>pH(5.2%)>总酯(1.5%)>总酸(0.6%),其中温度与梭菌群落结构呈极显著关系(P<0.01)。不同发酵节点的酒醅样品能有效地被区分开来,再次说明酒醅中梭菌群落的变化受到发酵时间的影响,同时也受酒醅理化性质的影响。18个酒醅样品分布在不同的象限,例如,发酵3 d和7 d的样品分别存在于第1和第2象限中,与铵态氮、总酯、pH和还原糖呈现较强的正相关;第3象限主要有发酵15 d和25 d的样品,与温度呈正相关;发酵45 d和60 d的样品主要在第4象限,与乙醇、总酸和含水量呈正相关。综上,在不同的发酵节点酒醅中驱动梭菌群落变化的理化因子不一样,温度、含水量和铵态氮是影响较大的环境因子。
通过计算相对丰度前10的梭菌和理化因子之间的Pearson相关性系数进一步分析酒醅理化因子对梭菌的影响。如图6-b所示,除Christensenellaceae_R-7_group外,其他9个梭菌均与总酸和含水量呈正相关。其中,总酸与Caproiciproducens、Fonticella、Anaerofilum和Butyrivibrio_2呈显著正相关(0.01<P<0.05)。含水量与Ruminidostridium_1呈显著正相关(0.001<P<0.01),与Caproiciproducens、Fonticella、Anaerofilu呈极显著正相关(0.000 1<P<0.001),与Butyrivibrio_2的相关性更强(0.000 1<P<0.001)。pH仅与Christensenellaceae_R-7_group呈正相关,与Caproiciproducens呈显著负相关(0.01<P<0.05)。此外,温度与所选梭菌均呈负相关,乙醇、总酯、还原糖和铵态氮对梭菌均无显著性影响。综上,通过明晰酒醅梭菌群落与理化因子相关性,有助于通过监控酒醅理化因子(如含水量、pH值等)间接了解酒醅中梭菌的状态,进而为提高酒醅中梭菌含量提供理论基础。

a-RDA;b-Pearson相关性分析
图6 理化因子与梭菌前10属相关性分析
Fig.6 The correlation analysis between the top 10 genera of Clostridia and physicochemical factors in Jiupei samples
注:*:0.01<P<0.05;**:0.001<P<0.01; ***:0.000 1<P<0.001
3 结论
本研究中,供试酒醅样品梭菌群落由39个梭菌纲中的属组成,梭菌群落的相对丰度在发酵至7 d时减少,然后保持稳定至25 d,在25~45 d发酵中又增加,然后减少至发酵结束。其群落Shannon指数、丰度和基因拷贝数均在发酵45 d达到最高。在梭菌群落的演替过程中,Caproiciproducens和Clostridium_sensu_stricto_1主要的优势梭菌。RDA结果表明,在发酵3~7 d,铵态氮、总酯、pH和还原糖是驱动梭菌演替的主要因素;发酵15~25 d时温度成为了主要的驱动因素;到发酵45~60 d乙醇、总酸和含水量成为新的影响因素。Pearson相关性分析表明,总酸和含水量具有较大影响,温度与相对丰度前10的梭菌呈负相关,pH仅与Christensenellaceae_R-7_group呈正相关,与Caproiciproducens呈显著负相关。乙醇、总酯、还原糖对梭菌群落均无显著性影响。总的来说,尽管高通量测序能全面地认识酒醅中梭菌的多样性,但由于使用细菌通用引物导致梭菌信息丢失导致梭菌数量较少。在进一步的研究中,应考虑设计使用梭菌特异性引物,并选择更深层次的测序方法检测酒醅中梭菌的具体代谢途径及产物。
[1] ZHENG X W, HAN B Z.Baijiu (白酒), Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[2] XU Y Q, ZHAO J R, LIU X, et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chemistry, 2022, 369:130920.
[3] 胡晓龙, 王康丽, 余苗, 等.浓香型窖泥原核微生物群落多样性及其在窖池中的空间异质性[J].食品与发酵工业, 2020, 46(11):77-84.
HU X L, WANG K L, YU M, et al.Biodiversity and spatial heterogeneity of prokaryote community in strong-flavor Baijiu fermentation pit muds[J].Food and Fermentation Industries, 2020, 46(11):77-84.
[4] DÜRRE P.Physiology and sporulation in Clostridium[J].Microbiology Spectrum, 2014, 2(4):TBS-0 010-2 012.
[5] ZOU W, YE G B, ZHANG K Z.Diversity, function, and application of Clostridium in Chinese strong flavor Baijiu ecosystem:A review[J].Journal of Food Science, 2018, 83(5):1 193-1 199.
[6] HU X L, DU H, XU Y.Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].International Journal of Food Microbiology, 2015, 214:116-122.
[7] WANG Q, WANG C D, LI C H, et al.Clostridium luticellarii sp.nov., isolated from a mud cellar used for producing strong aromatic liquors[J].International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12):4 730-4 733.
[8] 袁华伟, 赵猛, 蒋君, 等.窖泥中产丁酸菌的筛选、鉴定及生长性能研究[J].酿酒科技, 2017(5):35-40.
YUAN H W, ZHAO M, JIANG J, et al.Isolation and identification of a butyric acid-producing strain from pit mud and study on its growth performance[J].Liquor-Making Science & Technology, 2017(5):35-40.
[9] 蒲秀鑫, 柴丽娟, 徐鹏翔, 等.泸型酒窖泥中梭菌的分离及代谢产物分析[J].微生物学报, 2019, 59(12):2 427-2 436.
PU X X, CHAI L J, XU P X, et al.Isolation and metabolic characters of Clostridium strains from pit mud of Luzhou-flavor baijiu[J].Acta Microbiologica Sinica, 2019, 59(12):2 427-2 436.
[10] 钱玮, 陆震鸣, 柴丽娟, 等.泸型酒酒醅与窖泥中梭菌群落结构、演替和功能差异[J].生物工程学报, 2020, 36(6):1 190-1 197.
QIAN W, LU Z M, CHAI L J, et al.Differences of the structure, succession and function of Clostridial communities between Jiupei and pit mud during Luzhou-flavour Baijiu fermentation[J].Chinese Journal of Biotechnology, 2020, 36(6):1 190-1 197.
[11] 李聪聪. 浓香型白酒窖泥梭菌群落多样性及高产丁酸梭菌发酵特性研究[D].郑州:郑州轻工业学院, 2018.
LI C C.Diversity of Clostridia communities and fermentation characteristics of Clostridia with high yield of butyric acid in Chinese strong-flavor liquor pit muds[D].Zhengzhou:Zhengzhou University of Light Industry, 2018.
[12] 沈怡方. 白酒生产技术全书[M].中国轻工业出版社, 1998.
SHEN Y F.Baijiu Production Technology[M].China Light Industry Press, 1998.
[13] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu [J].Applied and Environmental Microbiology, 2017, 83(23):e01 550-01 517.
[14] HU X L, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82(8):2 506-2 515.
[15] HU X L, TIAN R J, WANG K L, et al.The prokaryotic community, physicochemical properties and flavors dynamics and their correlations in fermented grains for Chinese strong-flavor Baijiu production[J].Food Research International (Ottawa, Ont.), 2021, 148:110626.
[16] 陈雪, 张永利, 闫宗科, 等.凤香型酒醅微生物群落演替及其与理化指标的相关性分析[J].食品科学, 2020, 41(22):200-205.
CHEN X, ZHANG Y L, YAN Z K, et al.Correlation analysis of microbial community succession in fermented grains of Xifeng-flavor Chinese liquor with its physicochemical indexes[J].Food Science, 2020, 41(22):200-205.
[17] YAN S B, WANG S C, WEI G G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].Journal of the Institute of Brewing, 2015, 121(1):145-154.
[18] 李璇, 戚居胜, 韩四海, 等.浓香型白酒杜康酒醅发酵过程中理化指标变化规律[J].食品与发酵工业, 2019, 45(11):52-57.
LI X, QI J S, HAN S H, et al.Changes in physicochemical properties of fermented grains of strong-aroma liquor ‘Dukang’ during fermentation[J].Food and Fermentation Industries, 2019, 45(11):52-57.
[19] 黄治国, 侯海波, 罗惠波, 等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造, 2012, 31(7):107-110.
HUANG Z G, HOU H B, LUO H B, et al.Changes of starch and reducing sugars of fermented grains in fermentation of strong-flavor liquor[J].China Brewing, 2012, 31(7):107-110.
[20] ZHANG Y Y, ZHU X Y, LI X Z, et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J].BMC Microbiology, 2017, 17(1):196.
[21] WANG X S, DU H, XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].International Journal of Food Microbiology, 2017, 244:27-35.
[22] CINTAS L M, CASAUS M P, HERRANZ C, et al.Review:Bacteriocins of lactic acid bacteria[J].Food Science and Technology International, 2001, 7(4):281-305.
[23] WANG Y, QIAN P Y.Conservative fragments in bacterial 16S rRNA genes and primer design for 16S ribosomal DNA amplicons in metagenomic studies[J].PLoS One, 2009, 4(10):e7401.
[24] GAO Z Z, WU Z Y, ZHANG W X.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of Chinese strong-flavor liquor[J].Foods (Basel, Switzerland), 2020, 9(3):372.