传统由表面活性剂稳定的乳液,存在表面活性剂用量较多、成本高、生物毒性较大和不稳定等问题。由固体颗粒不可逆地吸附在两相界面上以改变空间位阻来实现稳定的Pickering乳液,具有优良的抗聚集、抗絮凝和奥氏成熟等优点,近年来被广泛应用于生物医药、食品、化妆品等领域[1-2]。目前,Pickering乳液的研究多集中在无机颗粒上,这些无机或合成的固体颗粒存在着潜在的健康风险,大多被应用于石油、化工等领域。当前,研究人员致力于研发以广泛来源于动植物、低/无毒可食、可生物降解和生物相容性好的胶体粒子稳定的Pickering乳液[3]。明胶是一种蛋白质生物聚合物,由天然胶原部分水解得到。它价格低廉,具有良好的生物相容性、生物降解性,在制备食品级胶体粒子方面具有很大的潜力。然而,明胶具有强亲水性且能与水形成可逆凝胶,难以制备稳定且单分散的明胶纳米颗粒[4]。此外,在先前大多数的研究中,制备明胶基Pickering乳液往往需要加入对人体有毒害的戊二醛[5]等交联剂对明胶进行疏水改性,大大限制了其在食品、化妆品等领域的应用。京尼平是一种天然环烯醚萜类化合物,在中药中广泛用作利胆剂和消炎剂[6]。据报道,京尼平的毒性较戊二醛的毒性低5 000~10 000倍,常被用来替代传统的小分子醛交联剂,是一种生物相容性好和低毒性的蛋白质交联剂[7]。因此,京尼平可被用于制备安全无毒的明胶纳米颗粒。
基于此,本研究以明胶为基料,通过2次去溶剂结合京尼平交联固化明胶法制备得到明胶纳米颗粒,并表征其微观形貌、三相接触角、粒径和Zeta电位。然后以明胶纳米颗粒为乳化剂制备Pickering乳液,研究了明胶纳米颗粒的浓度、乳化转速、乳化时间、pH值和盐浓度对制备的Pickering乳液的影响,获得明胶纳米颗粒稳定的Pickering乳液的最佳制备工艺。
1 材料与方法
1.1 材料与试剂
B型明胶(医用级,胶强度为Bloom 240 g)、玉米油(AR级),上海阿拉丁生化科技股份有限公司;丙酮(AR级)、NaOH(AR级)、盐酸(AR级)、NaCl(AR级),成都市科隆化学品有限公司;京尼平(HPLC, >98%),临川之信生物科技有限公司。
1.2 仪器与设备
Ultra Turrax T25均质乳化机,德国IKA公司;FE 28-XX pH计,梅特勒-托利多(上海)有限公司;ST 16R高速冷冻离心机、Nicolet iS10傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;Helios G4 UC扫描电子显微镜,美国FEI公司;SPM-9600原子力显微镜,日本Shimadzu公司;Nano-ZS ZEN3600激光粒度仪,英国Malvern公司;OCAH光学接触角测量仪,德国DATAPHYSICS公司;PH-100-DB800U-1PL光学显微镜,凤凰光学集团有限公司;MCR302模块化智能型旋转流变仪,奥地利Anton Paar公司。
1.3 明胶纳米颗粒的制备
将1.250 g明胶于45 ℃下溶解于25.0 mL去离子水中得到明胶溶液。然后缓慢加入25.0 mL丙酮,静置以待溶液分层。取上层乳白色液体复溶于25.0 mL去离子水中,之后使用NaOH溶液将其pH值调为12.0。将上述混合液于50 ℃下持续搅拌,并以1.0 mL/min的速度滴加75.0 mL丙酮。接着加入0.125 0 g京尼平粉末,于50 ℃下继续搅拌5 h。将混合液于10 000 r/min下离心35 min后使用去离子水清洗下层沉淀3次。最后将明胶纳米颗粒分散于去离子水中,缓慢挥发掉残余的丙酮。
1.4 明胶纳米颗粒的表征
1.4.1 扫描电子显微镜(scanning electron microscope, SEM)观察
将明胶纳米颗粒悬浮液滴加到导电胶上,真空干燥24 h,在样品表面喷金后使用扫描电子显微镜观察明胶纳米颗粒的微观形貌。
1.4.2 原子力显微镜(atomic force microscope, AFM)观察
将10 μL明胶纳米颗粒悬浮液滴于云母片上,真空干燥24 h后使用原子力显微镜观察明胶纳米颗粒的微观形貌。
1.4.3 三相接触角测定
将1片干净的玻璃片浸入100 mg/L的明胶纳米颗粒悬浮液中,静置10 s后取出,于真空干燥箱中缓慢蒸发掉液体,重复操作3次。将干燥后的玻璃片放置于正己烷中,利用光学接触角测量仪测定明胶纳米颗粒的三相接触角。
1.4.4 红外光谱分析
分别将2 mg明胶和冷冻干燥的明胶纳米颗粒与200 mg KBr充分研磨,压片后利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)仪测定其FTIR光谱。设置扫描的波数范围为400~4 000 cm-1,扫描频率为4 cm-1/s。
1.4.5 粒径分布和Zeta电位测定
配制质量浓度为100 mg/L的明胶纳米颗粒悬浮液,然后使用激光粒度仪于25 ℃下测定明胶纳米颗粒的粒径。配制质量浓度为100 mg/L的明胶纳米颗粒悬浮液,使用0.1 mol/L的HCl溶液和NaOH溶液将其pH值分别调至2.0、4.0、6.0、8.0、10.0、12.0后使用激光粒度仪于25 ℃下测定明胶纳米颗粒在不同pH值下的Zeta电位。
1.5 明胶纳米颗粒稳定的Pickering乳液的制备
以明胶纳米颗粒为乳化剂,分别研究明胶纳米颗粒的浓度、乳化时间、乳化转速、水相pH值和盐浓度对制备的Pickering乳液的影响。
1.5.1 明胶纳米颗粒浓度的影响
分别配制质量浓度为10.0、15.0、20.0 mg/mL的明胶纳米颗粒悬浮液,按照明胶纳米颗粒悬浮液与玉米油体积比为1∶4加入玉米油,然后使用均质机于13 000 r/min下乳化90 s,制备得到明胶纳米颗粒稳定的Pickering乳液。
1.5.2 乳化时间的影响
将质量浓度为20.0 mg/mL的明胶纳米颗粒悬浮液与玉米油按体积比为1∶4混合,然后使用均质机于13 000 r/min下乳化30、60、90、120 s,制备得到明胶纳米颗粒稳定的Pickering乳液。
1.5.3 乳化转速的影响
将质量浓度为20.0 mg/mL的明胶纳米颗粒悬浮液与玉米油按体积比为1∶4混合,然后使用均质机于7 000、10 000、13 000、16 000 r/min下乳化90 s,制备得到明胶纳米颗粒稳定的Pickering乳液。
1.5.4 水相pH值的影响
配制质量浓度为20.0 mg/mL的明胶纳米颗粒悬浮液,分别调节其pH值为6.0、8.0、10.0、12.0。按照明胶纳米颗粒悬浮液与玉米油体积比为1∶4加入玉米油,然后使用均质机于13 000 r/min下乳化90 s,制备得到明胶纳米颗粒稳定的Pickering乳液。
1.5.5 盐浓度的影响
配制质量浓度为20.0 mg/mL的明胶纳米颗粒悬浮液,分别加入0、25、50、75 mmol/L的NaCl溶液,调节其pH值为8.0。按照明胶纳米颗粒悬浮液与玉米油体积比为1∶4加入玉米油,然后使用均质机于13 000 r/min下乳化90 s,制备得到明胶纳米颗粒稳定的Pickering乳液。
1.6 明胶纳米颗粒稳定的Pickering乳液的表征
1.6.1 Pickering乳液的微观形貌观察及粒径统计
将制备的Pickering乳液分散在去离子水中,取少量滴在载玻片上,然后使用光学显微镜观察Pickering乳液的微观形貌,并通过Nano-measure软件统计其粒径。
1.6.2 Pickering乳液的流变性能测试
使用模块化智能型旋转流变仪测定Pickering乳液的流变性能。采用平行板流变模式(plate-plate mode, PP25),并在1 Hz下对样品进行应变扫描,测量温度为25 ℃。
2 结果与讨论
2.1 明胶纳米颗粒的制备及表征
通过2次去溶剂结合京尼平交联固化明胶法制备得到的明胶纳米颗粒呈光滑且致密的球形,分散性好,直径约为150 nm,如图1-a和图1-b所示。由原子力显微镜的三维高度图可知,明胶纳米颗粒的平均垂直高度约为15 nm,明显小于其直径,表明明胶纳米颗粒为软颗粒,有利于制备稳定的Pickering乳液[8]。

a-SEM图;b-AFM图;c-接触角测量图;d-FT-IR图;e-粒径分布图;f-Zeta电位
图1 明胶纳米颗粒的SEM图,AFM图,接触角测量图,FT-IR图,粒径分布图,Zeta电位
Fig.1 SEM images, AFM images, contact angel, FT-IR spectra, size distribution and Zeta potential characterization of gelatin nanoparticles
固体颗粒的表面润湿性直接影响Pickering乳液的类型和稳定性,根据WILLIAMS等[9]提出的“液滴捕获法”测得明胶纳米颗粒的三相接触角θow为76.6°。表明明胶纳米颗粒具有较强的亲水性能,适合用于制备水包油(O/W)型Pickering乳液[10],如图1-c所示。
由图1-d可知,明胶在3 422、2 923、1 633、1 543、1 455、1 240 cm-1处的特征峰分别归属为酰胺A带O—H或N—H的伸缩振动、酰胺B带—CH2—的反对称伸缩振动、酰胺I带C![]() O或C
O或C![]() N伸缩振动、酰胺II带的N—H面内弯曲振动与C—N伸缩振动的耦合、—CH2—的面内弯曲振动、酰胺III带的N—H弯曲振动和C—N伸缩振动[11-14]。然而,经京尼平交联制备的明胶纳米颗粒的酰胺A带、B带和I带分别移动到3 307、2 940、1 643 cm-1处。明胶纳米颗粒的酰胺A带向较低波数移动,说明交联过程中N—H基团参与形成了更多的氢键[15]。明胶纳米颗粒的酰胺B带向高波数移动,表明京尼平的化学交联促使肽链中形成的氢键有所增加[16]。明胶纳米颗粒的酰胺I带向高波数移动可以证明京尼平与明胶分子间发生了席夫碱反应[17]。结果表明,京尼平通过席夫碱化学交联反应和氢键作用固化明胶液滴以制备得到光滑且致密的明胶纳米颗粒。
N伸缩振动、酰胺II带的N—H面内弯曲振动与C—N伸缩振动的耦合、—CH2—的面内弯曲振动、酰胺III带的N—H弯曲振动和C—N伸缩振动[11-14]。然而,经京尼平交联制备的明胶纳米颗粒的酰胺A带、B带和I带分别移动到3 307、2 940、1 643 cm-1处。明胶纳米颗粒的酰胺A带向较低波数移动,说明交联过程中N—H基团参与形成了更多的氢键[15]。明胶纳米颗粒的酰胺B带向高波数移动,表明京尼平的化学交联促使肽链中形成的氢键有所增加[16]。明胶纳米颗粒的酰胺I带向高波数移动可以证明京尼平与明胶分子间发生了席夫碱反应[17]。结果表明,京尼平通过席夫碱化学交联反应和氢键作用固化明胶液滴以制备得到光滑且致密的明胶纳米颗粒。
由图1-e可知,利用激光粒度仪测定新制备的明胶纳米颗粒的粒径为(186.7±0.065) nm,其略大于SEM和AFM的测试结果。主要是因为分散在水中的明胶纳米颗粒充分溶胀,导致其粒径增大。储存6个月后的明胶纳米颗粒的粒径为(186.9±0.028) nm,结果表明2次去溶剂结合京尼平交联固化明胶法能制备出稳定的明胶纳米颗粒。
纳米颗粒的Zeta电位影响着其自身的储存稳定性,也决定着其制备的乳液稳定性[18]。明胶纳米颗粒在不同pH值下的Zeta电位如图1-f所示。当pH≤4.0时,明胶纳米颗粒带6.0 mV的正电荷;随着pH值的不断增加,明胶纳米颗粒所带的正电荷减少,当pH值为6.0左右时,明胶纳米颗粒表面所带的净电荷为0,即达到明胶纳米颗粒的等电点;随着pH值的继续增大,明胶纳米颗粒带负电荷,且所带的负电荷随着pH值的增加而逐渐增大。当pH值为12时,明胶纳米颗粒的Zeta电位为-28.5 mV。因此明胶是1种两性电解质,含有大量酸性氨基酸(含有羧基)和碱性氨基酸(含有氨基)。明胶分子中的氨基和羧基等官能团通过得失电子以分别在较高pH值溶液中带负电荷,而在较低pH值溶液中带正电荷。
2.2 明胶纳米颗粒的浓度对Pickering乳液的影响
不同浓度明胶纳米颗粒稳定的Pickering乳液的直观图如图2-a所示。当明胶纳米颗粒的质量浓度大于15.0 mg/mL时,制备的Pickering乳液在倒置后仍然能够承受自身质量而不流动,表明其形成了半固体凝胶状Pickering乳液。由图2-b和图2-c可知,10.0、15.0、20.0 mg/mL明胶纳米颗粒稳定的Pickering乳液的液滴直径分别为(92.50±3.62)、(74.53±4.53)和(43.67±3.37) μm。随着明胶纳米颗粒浓度的增加,制备的Pickering乳液液滴尺寸不断减小,液滴的均匀性不断提高。随着颗粒浓度的增大,油水界面吸附的固体颗粒数量增多,多余的颗粒可以在水相中轻微絮凝,形成三维网络结构,进而增强乳液的稳定性。综合乳液的稳定性及其液滴直径,确定制备Pickering乳液的最佳颗粒质量浓度为20.0 mg/mL。

a-稳定的Pickering乳液;b-Pickering乳液的光学显微镜图;c-平均粒径
图2 不同浓度的明胶纳米颗粒稳定的Pickering乳液,Pickering乳液的光学显微镜图及平均粒径
Fig.2 Images, optical micrographs and average emulsion particle size of Pickering emulsions prepared using different concentration of gelatin nanoparticles
2.3 乳化时间对Pickering乳液的影响
在不同乳化时间下制备的Pickering乳液如图3所示。仅有乳化90 s制备的Pickering乳液在倒置情况下能够承受自身质量而不流动。当乳化时间从30增加到90 s时,乳液液滴尺寸不断减小,与文献报道的情况相符[19]。乳化时间的增加有利于颗粒在体系中的分散,同时能帮助其迁移到油水界面上进行铺展,形成的液滴尺寸也有所减小[20]。继续增加乳化时间至120 s时,液滴的尺寸增大。这可能是由于持续的能量输入造成已吸附在界面处的颗粒的重排,乳液发生相反转或形成多重乳液[21],进而破坏了乳液的稳定性。因此,确定乳化的最佳时间为90 s。

a-稳定的Pickering乳液;b-Pickering乳液的光学显微镜图;c-平均粒径
图3 明胶纳米颗粒在不同乳化时间下稳定的Pickering乳液,Pickering乳液的光学显微镜图及平均粒径
Fig.3 Images, optical micrographs and average emulsion particle size of Pickering emulsions prepared under different emulsification time
2.4 乳化转速对Pickering乳液的影响
低乳化转速下制备的Pickering乳液有油相析出,高乳化转速下制备的乳液在倒置后不能承受自身质量而发生流动,均不能形成稳定的乳液。由图4可知,在13 000 r/min乳化转速下能够制备稳定的Pickering乳液。

a-稳定的Pickering乳液;b-Pickering乳液的光学显微镜图;c-平均粒径
图4 明胶纳米颗粒在不同乳化转速下稳定的Pickering乳液,Pickering乳液的光学显微镜图及平均粒径
Fig.4 Images, optical micrographs and average emulsion particle size of Pickering emulsions prepared under different emulsification speed
当均质乳化转速小于13 000 r/min时,乳液的液滴尺寸较大。表明均质转速过低,输入体系的能量小,很难打破两相界面使纳米颗粒吸附在油水界面,形成稳定的乳液。然而,当乳化转速提高到16 000 r/min时,制备的乳液液滴分散不均匀,很多固体颗粒发生堆叠形成聚集体。转速过大使得颗粒间的外力增强,将原来已吸附于两相界面处的颗粒发生异动并重排,部分颗粒游离于水相中,发生聚集及堆叠。在乳化转速为13 000 r/min下制备的乳液的液滴分散相对均一,尺寸为(41.71±0.86) μm。综合乳液的稳定性和液滴的显微镜图确定乳化的最佳转速为13 000 r/min。
2.5 水相pH值对Pickering乳液的影响
如图5所示,当水相pH为12.0时制备的乳液发生了油水相分离。明胶纳米颗粒在界面上的吸附效率强烈依赖其表面所带电荷或溶液的离子强度。在pH值较高的条件下,过多NaOH的加入极大程度地改变了体系的离子强度,屏蔽了颗粒表面的电荷量,影响其溶胀程度[22]。而颗粒在界面处的溶胀程度会影响到其是否能稳定吸附,故pH过高时无法形成稳定的Pickering乳液,由此可见颗粒的溶胀性能与乳液的稳定性关联较大。当水相pH值为6时,接近明胶纳米颗粒的等电点,均质乳化后制备的乳液立即发生大范围的相分离。此外,通过京尼平与明胶发生席夫碱反应制备的明胶纳米颗粒在酸性条件下由于席夫碱的断裂而遭到不同程度的破坏,从而影响明胶纳米颗粒的表面润湿性。结果表明,酸性及过碱性环境不利于制备明胶纳米颗粒稳定的Pickering乳液。然而,在pH为8时能够制备乳液液滴直径为(55.00±5.06) μm的稳定的Pickering乳液。带电的软颗粒在界面上表现出类似软凝胶的行为,从而导致更加稳定的乳液的形成。而电中性软颗粒包覆液滴表面所形成的吸附层非常脆弱,因而不能依此制备出稳定的乳液。稳定的Pickering乳液的制备依赖水相pH值,本研究最佳的水相pH值为8.0。

a-稳定的Pickering乳液;b-Pickering乳液的光学显微镜图;c-平均粒径
图5 明胶纳米颗粒在不同pH下稳定的Pickering乳液,Pickering乳液的光学显微镜图及平均粒径
Fig.5 Images, optical micrographs and average emulsion particle size of Pickering emulsions prepared under different pH
2.6 盐浓度对Pickering乳液的影响
水相中的电解质会在一定程度上影响颗粒的聚沉,从而影响到乳液的形成[23]。由图6可知,在NaCl浓度为0、25、50和75 mmol/L下制备的Pickering乳液液滴直径分别为(42.51±1.91)、(50.81±1.75)、(44.43±1.05)、(47.99±1.45) μm。乳液液滴直径随着体系中NaCl浓度的增加而略微增加,这归因于离子官能团的水合作用。当水化斥力与范德华引力相比较弱时,粒子就会聚集,从而影响乳液的稳定性[24]。从图6-b可以看出,当NaCl浓度为50 mmol/L时,制备的Pickering乳液液滴的粒径分布相对较均匀。基于以上研究结果,明胶纳米颗粒稳定的Pickering乳液的最佳制备工艺参数为:颗粒质量浓度20.0 mg/mL,乳化时间90 s,乳化转速13 000 r/min,水相pH 8.0,NaCl浓度50 mmol/L。

a-稳定的Pickering乳液;b-Pickering乳液的光学显微镜图;c-平均粒径
图6 明胶纳米颗粒在不同浓度的NaCl中稳定的Pickering乳液,Pickering乳液的光学显微镜图及平均粒径
Fig.6 Images, optical micrographs and average emulsion particle size of Pickering emulsions prepared under different concentration of NaCl aqueous solution
2.7 Pickering乳液的流变性能研究
由于乳液的流变性可作为食品结构感知的指示,因此对最佳工艺下制备的Pickering乳液的流变性能进行测试,如图7所示。
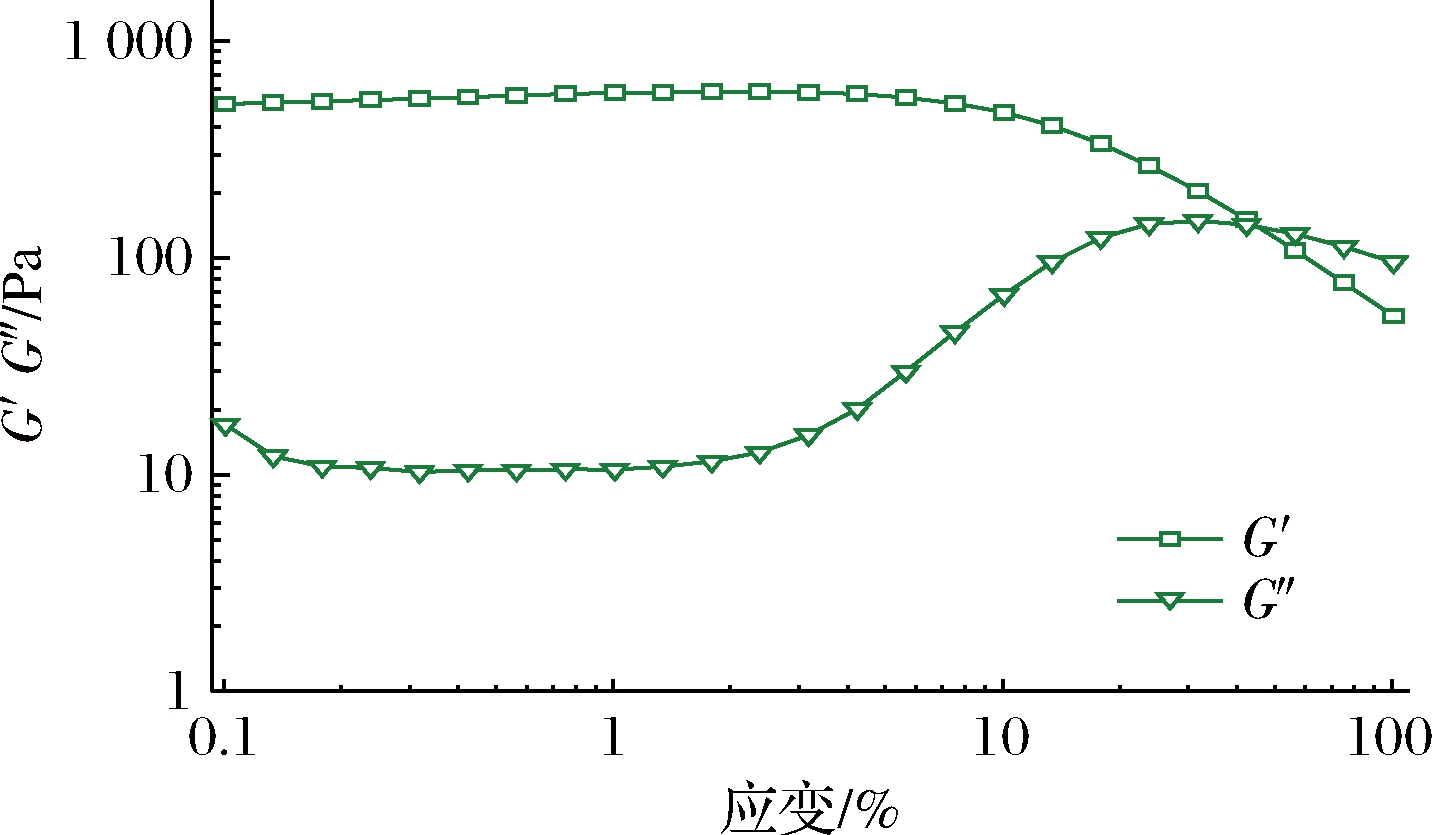
图7 最佳工艺下制备的Pickering乳液的储能模量(G′)和损失模量(G″)的应变依赖性曲线
Fig.7 Storage modulus (G′) and loss modulus (G″) of Pickering emulsion prepared under the optimum process
在低剪切应变时,Pickering乳液的储能模量(G′)大于损耗模量(G″),表明Pickering乳液在此阶段具有弹性或类似固体的行为;随着剪切应变力的增加,G′不断减小,G″不断增大。当剪切应变大于40%时,G″与G′相交,表明已达到液体和固体的临界点。对Pickering乳液施加的应变继续增大时,G″高于G′。这是由于Pickering乳液在高剪切应变力下,乳液内部结构发生重组或乳液液滴发生了流动[25]。结果表明,在最佳工艺下制备的Pickering乳液具有良好的稳定性,其添加到食品中可以为食物提供形态可塑性和感官特性,在食品领域具有广阔的应用前景。
3 结论
通过二次去溶剂结合京尼平交联固化明胶法制备得到的明胶纳米颗粒的粒径为(186.7±0.065) nm,等电点约为6,三相接触角为76.6°。以明胶纳米颗粒为乳化剂,通过均质乳化技术制备稳定的Pickering乳液的最佳制备条件为:明胶纳米颗粒的质量浓度为20.0 mg/mL,乳化时间为90 s,乳化转速为13 000 r/min,水相pH值为8.0,NaCl浓度为50 mmol/L。最优条件下制备的Pickering乳液的液滴粒径为(44.43±1.05) μm。最佳工艺下制备的Pickering乳液具有良好的稳定性,在食品领域具有广阔的应用前景。
[1] 周君, 乔秀颖, 孙康.Pickering乳液的制备和应用研究进展[J].化学通报, 2012, 75(2):99-105.
ZHOU J, QIAO X Y, SUN K.Advance in the investigations of the preparation and application of Pickering emulsion[J].Chemistry, 2012, 75(2):99-105.
[2] XIAO J, LI Y Q, HUANG Q R.Recent advances on food-grade particles stabilized Pickering emulsions:Fabrication, characterization and research trends[J].Trends in Food Science & Technology, 2016, 55:48-60.
[3] 唐瑜婉, 王启明, 杨雅轩, 等.玉米醇溶蛋白-多酚纳米颗粒对Pickering乳液稳定性的调控[J].食品与发酵工业, 2019, 45(11):280-285.
TANG Y W, WANG Q M, YANG Y X, et al.Regulation of the stability of Pickering emulsion by zein-polyphenol nanoparticles:A review[J].Food and Fermentation Industries, 2019, 45(11):280-285.
[4] OSORIO F A, BILBAO E, BUSTOS R, et al.Effects of concentration, bloom degree, and pH on gelatin melting and gelling temperatures using small amplitude oscillatory rheology[J].International Journal of Food Properties, 2007, 10(4):841-851.
[5] 薛万波, 王春华, 谭欢, 等.用于稳定Pickering乳液的氨基化明胶纳米颗粒的制备[J].精细化工, 2019, 36(1):31-36;43.
XUE W B, WANG C H, TAN H, et al.Preparation of aminated gelatin nanoparticles used to stabilize Pickering emulsion[J].Fine Chemicals, 2019, 36(1):31-36;43.
[6] AKAO T, KOBASHI K, ABURADA M.Enzymic studies on the animal and intestinal bacterial metabolism of geniposide[J].Biological & Pharmaceutical Bulletin, 1994, 17(12):1 573-1 576.
[7] BIGI A, COJAZZI G, PANZAVOLTA S, et al.Stabilization of gelatin films by crosslinking with genipin[J].Biomaterials, 2002, 23(24):4 827-4 832.
[8] WANG P J, CHEN C, GUO H Y, et al.Casein gel particles as novel soft Pickering stabilizers:The emulsifying property and packing behaviour at the oil-water interface[J].Food Hydrocolloids, 2018, 77:689-698.
[9] WILLIAMS M, WARREN N J, FIELDING L A, et al.Preparation of double emulsions using hybrid polymer/silica particles:New Pickering emulsifiers with adjustable surface wettability[J].ACS Applied Materials & Interfaces, 2014, 6(23):20 919-20 927.
[10] FENG X, DAI H J, MA L, et al.Food-grade gelatin nanoparticles:Preparation, characterization, and preliminary application for stabilizing Pickering emulsions[J].Foods (Basel, Switzerland), 2019, 8(10):479.
[11] ALBU M G, GHICA M V, LECA M, et al.Doxycycline delivery from collagen matrices crosslinked with tannic acid[J].Molecular Crystals and Liquid Crystals, 2010, 523(1):97-105.
[12] HE L R, MU C D, SHI J B, et al.Modification of collagen with a natural cross-linker, procyanidin[J].International Journal of Biological Macromolecules, 2011, 48(2):354-359.
[13] LI B, KENNEDY J F, JIANG Q G, et al.Quick dissolvable, edible and heatsealable blend films based on konjac glucomannan - Gelatin[J].Food Research International, 2006, 39(5):544-549.
[14] MUYONGA J H, COLE C G B, DUODU K G.Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J].Food Chemistry, 2004, 85(1):81-89.
[15] AHMAD T, ISMAIL A, AHMAD S A, et al.Characterization of gelatin from bovine skin extracted using ultrasound subsequent to bromelain pretreatment[J].Food Hydrocolloids, 2018, 80:264-273.
[16] TEIMOURI S, MORRISH C, PANYOYAI N, et al.Diffusion and relaxation contributions in the release of vitamin B6 from a moving boundary of genipin crosslinked gelatin matrices[J].Food Hydrocolloids, 2019, 87:839-846.
[17] KHAN H, SHUKLA R N, BAJPAI A K.Genipin-modified gelatin nanocarriers as swelling controlled drug delivery system for in vitro release of cytarabine[J].Materials Science and Engineering:C, 2016, 61:457-465.
[18] 谭天仪, 李璟, 夏锐, 等.超细化豆渣作为皮克林乳液稳定剂的特性研究[J].食品与发酵工业, 2020, 46(2):47-54.
TAN T Y, LI J, XIA R, et al.Preparation of ultrafine okara and its characteristics as a stabilizer for Pickering emulsion[J].Food and Fermentation Industries, 2020, 46(2):47-54.
[19] BINKS B P, FLETCHER P D I, HOLT B L, et al.Phase inversion of particle-stabilised perfume oil-water emulsions:Experiment and theory[J].Physical Chemistry Chemical Physics:PCCP, 2010, 12(38):11 954-11 966.
[20] DESTRIBATS M, WOLFS M, PINAUD F, et al.Pickering emulsions stabilized by soft microgels:Influence of the emulsification process on particle interfacial organization and emulsion properties[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2013, 29(40):12 367-12 374.
[21] SAWIAK L, BAILES K, HARBOTTLE D, et al.Mixing time, inversion and multiple emulsion formation in a limonene and water Pickering emulsion[J].Frontiers in Chemistry, 2018, 6:132.
[22] BRUGGER B, RÜTTEN S, PHAN K H, et al.The colloidal suprastructure of smart microgels at oil-water interfaces[J].Angewandte Chemie (International Ed.in English), 2009, 48(22):3 978-3 981.
[23] 杨飞, 王君, 蓝强, 等.Pickering乳状液的研究进展[J].化学进展, 2009, 21(S2):1 418-1 426.
YANG F, WANG J, LAN Q, et al.Research progress on Pickering emulsions[J].Progress in Chemistry, 2009, 21(S2):1 418-1 426.
[24] 陈雅琪, 陈玲, 雷芬芬, 等.南瓜籽油Pickering乳液的制备及其稳定性研究[J].粮食与油脂, 2021, 34(11):52-56.
CHEN Y Q, CHEN L, LEI F F, et al.Study on the preparation and stability of pumpkin seed oil Pickering emulsion[J].Cereals & Oils, 2021, 34(11):52-56.
[25] SULTANA N, WANG M.PHBV/PLLA-based composite scaffolds fabricated using an emulsion freezing/freeze-drying technique for bone tissue engineering:Surface modification and in vitro biological evaluation[J].Biofabrication, 2012, 4(1):015003.