酪蛋白是牛乳中含量最高的蛋白质,是一类结构相近且磷酸化的蛋白总称,主要包括αs1-、αs2-、β-和κ-酪蛋白4种单体。牛乳中,4种酪蛋白单体通过疏水、静电等相互作用形成直径大小为80~400 nm的近球形粒子,称为酪蛋白胶束[1]。酪蛋白胶束结构独特,内部由αs-、β-酪蛋白及矿物元素组成,形成多个疏水空腔,κ-酪蛋白覆盖在胶束表面形成毛发层,具有较好的亲水性;因此,酪蛋白胶束具有疏水内部和亲水表面,易溶于水,且结构较为稳定[2]。酪蛋白胶束可通过膜分离技术提取,其来源广泛、成本低廉、营养价值高,且具有可降解和生物相容性高等优点。
果胶是一种天然水溶性阴离子多糖,其中半乳糖醛酸含量超过65%,结构多样,来源广泛,价格低廉[3]。果胶具有降低胆固醇和血糖水平等功效,其抗结肠癌的效果尤为明显[3]。在食品工业领域中,果胶作为一种食品添加剂,可用于改善食品的口感、质地、外观等特性。近年来,众多研究发现,果胶作为天然大分子亲水性多糖,可以用来提高乳液的稳定性[4]。
乳液凝胶是一类具有特殊三维网络结构的凝胶,内部具有乳液的O/W或W/O结构,甚至可以是多相乳液结构,外观表现为凝胶。乳液凝胶不仅给予产品顺滑的口感,还可以用于负载活性分子,将其均匀分散在凝胶质地中,实现功能成分靶向输送[5]。乳化剂是乳液及乳液凝胶制备的关键成分之一。目前,食品工业用乳化剂多为化学合成的小分子物质,其食用安全性及添加量备受消费者关注。因此,选用具有一定乳化功能的天然大分子作为基质,是乳液及乳液凝胶的研究热点,其中以蛋白质-多糖复合物为基质的乳液及乳液凝胶制备倍受研究者青睐[6]。果胶不仅具有优良的乳化性,而且黏度较高,可通过位阻效应、静电斥力等作用稳定油滴,可显著提高乳液的稳定性,因此成为制备乳液及凝胶的常用多糖[7]。另外,还可通过Ca2+交联以促使果胶凝胶,提升其稳定性[3]。有研究指出,以玉米醇溶蛋白-果胶复合物为基质制备的O/W乳液稳定性高于单一基质制备的乳液[8]。酪蛋白具有较好的乳化性和凝胶性,是乳液及凝胶制备的主要蛋白质基材之一[5]。酪蛋白在乳液凝胶制备过程中不仅可用于乳化油滴,还可作为凝胶基质用于制备酸诱导和酶诱导凝胶[9]。另外,添加一定量的多糖可缩短酪蛋白凝胶时间[5]。然而,以酪蛋白胶束-果胶复合物为基质的乳液凝胶制备及性质研究鲜为报道。
乳液及乳液凝胶不仅可作为食品原料,赋予食品特殊质地和品质,还可用于活性分子负载和递送,提高其生物利用度。有研究指出,将姜黄素负载于以酪蛋白-大豆可溶性多糖为基质的O/W型乳液中,有效减缓了其降解,且乳剂组的姜黄素口服生物利用度比姜黄素/吐温-20混悬液组的生物利用度高11倍[10]。而且,酪蛋白酸钠-果胶复合基质的乳剂可用于负载表没食子儿茶素,有效减少了唾液黏蛋白诱导的乳液聚集,实现了对表没食子儿茶素的保护[11]。大黄素是一种从植物中提取的天然药物分子,具有多种药理活性,如抗炎、抗肿瘤、抗应激等[12]。还有研究表明,大黄素可以通过抑制HIF-1α、VEGF-α、EphA2、MMP-2蛋白的表达,抑制前列腺癌的血管拟态形成,从而抑制前列腺癌的发生[13]。然而,大黄素的水溶性较差,在加工、储藏和胃肠道环境中易氧化降解,因此口服大黄素的生物利用度很低。近年来,有研究表明,经脂质纳米粒负载后,大黄素稳定性提高[14]。另外,聚乳酸微球负载的大黄素肝肾毒性降低,缓释效果显著[15]。然而,乳液凝胶对大黄素的负载研究鲜有报道。
本文以胶束态酪蛋白-果胶复合物为基质,以溶解了姜黄素的大豆油作为油相,采用均质法制备出不同酪蛋白-果胶比例的乳液凝胶,系统分析了乳液凝胶的结构、理化性质及稳定性,通过体外模拟消化评价了凝胶中大黄素的释放过程,并研究了凝胶载体中大黄素的细胞毒性。研究结果可为大黄素凝胶剂型的开发提供参考依据。
1 材料与方法
1.1 材料与设备
酪蛋白胶束:巴氏灭菌牛乳,兰州天天鲜乳制品有限责任公司,采用离心机于4 000×g离心脱脂20 min后过100 kDa有机膜浓缩4倍;浓缩液经冷冻干燥即得胶束态酪蛋白。经测定,酪蛋白胶束中蛋白质质量分数为(83.26±1.87)%。
果胶、大黄素、脂肪酶(10万U/g)、胃蛋白酶(15 000 U/mg)、胰蛋白酶(2 500 U/mg)、猪胆盐、尼罗红、罗丹明B,上海麦克林生化科技有限公司;Cell Counting Kit-8,北京索莱宝科技有限公司;其余试剂均为分析纯。
AD500S-H均质机,上海昂尼仪器仪表有限公司;Bettersize 2000激光粒度分布仪,丹东百特仪器有限公司;Nicolet iS50 FTIR红外光谱仪,美国赛默飞世尔科学公司;XD3 X射线多晶衍射仪,北京浦肯氏通用仪器有限公司;STA 449 F5 TG-DSC热分析仪,德国耐驰仪器制造有限公司;H1850离心机,湖南湘仪有限责任公司。
1.2 实验方法
1.2.1 乳液凝胶的制备
参考宁雪莹等[16]的方法并稍做修改。将果胶溶解分散至pH 6.86、0.5 mol/L的磷酸盐缓冲溶液中,37 ℃恒温水浴下充分搅拌过夜至完全溶解(约15 h),质量浓度为0.2 g/L,备用。
将酪蛋白胶束溶解于pH 6.86、0.5 mol/L的磷酸盐缓冲溶液中,使酪蛋白胶束质量浓度为0.4 g/L。添加质量浓度0.2 g/L的叠氮化钠,备用。
将配制好的酪蛋白溶液和果胶溶液分别按照5∶5、6∶4、7∶3、8∶2、9∶1的体积比混合,在37 ℃恒温水浴锅内搅拌3 h,备用[不同体积比的酪蛋白-果胶复合物下文分别用M-P(5/5)、M-P(6/4)、M-P(7/3)、M-P(8/2)、M-P(9/1)表示]。将大黄素分散至食用大豆油中,室温下充分搅拌过夜至完全溶解(约15 h),使大黄素质量浓度为0.5 mg/mL,备用。取9 mL酪蛋白-果胶混合液与21 mL油相于烧杯中,均质机探头伸至液面下2/3处,室温下以14 000 r/min的转速均质3 min,之后储藏于4 ℃冰箱待用[不同比例的酪蛋白-果胶复合物所制备的乳液凝胶下文分别用M-P-O(5/5)、M-P-O(6/4)、M-P-O(7/3)、M-P-O(8/2)、M-P-O(9/1)、M-P-O(10/0)表示]。
1.2.2 乳液凝胶的CaCl2处理
在制备好的凝胶中添加适量0.05 mol/L的CaCl2溶液,使乳液凝胶完全浸泡其中静置6 h,之后将CaCl2溶液倒出,蒸馏水清洗凝胶表面,备用。
1.2.3 荧光显微镜观察
于酪蛋白-果胶混合液中添加0.1 μg/mL罗丹明B并搅拌均匀,油相中添加0.1 μg/mL尼罗红并搅拌均匀,采用1.2.1的方法制备凝胶,在荧光显微镜下观察微观结构。
1.2.4 粒径测量
采用激光粒度分布仪分别测定酪蛋白胶束溶液、果胶溶液以及不同配比下酪蛋白-果胶复合物的粒径,使用前仪器进行清洗和校零,水作为分散剂,平衡时间120 s,样品折射率1.35,介质折射率1.33。
乳液凝胶无法在水中均匀分散,故粒径测量采用光学显微镜观察并且拍照,然后使用软件ImageJ对显微镜照片中的油滴进行粒径统计分析。
1.2.5 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测量
使用衰减全反射(attenuated total refraction,ATR)模式单元的红外光谱仪,记录各样品的红外光谱。
1.2.6 X射线衍射(X-ray diffraction,XRD)测量
使用X射线多晶衍射仪在Cu Ka辐射下连续扫描,扫描速率为5 °/min,分别记录各样品的X射线衍射谱图。
1.2.7 热稳定性分析
用TG-DSC热分析仪测定各样品的热稳定性。称量样品15~20 mg,置于氧化铝坩锅中,以5 ℃/min的升温速率从25 ℃加热至500 ℃,用空坩埚作空白对照。
1.2.8 贮藏稳定性
将制备好的乳液凝胶贮藏于4 ℃冰箱中,每隔一定时间取出观察并拍照记录;在光学显微镜下观察微观结构。
1.2.9 大黄素体外模拟释放分析
参考MOHAMMADIAN等[17]的方法并稍作修改。将1 g凝胶样品(或与凝胶中所含大黄素等量标品)置于3 mL pH 1.2模拟胃液(simulated gastric fluid,SGF)中(由2 g/L NaCl、7 mL/L HCl、3.2 g/L胃蛋白酶和5 g/L脂肪酶组成,最终pH值为1.2),装于透析袋(截留分子质量1 kDa)中。将透析袋置于含有150 mL释放介质的烧杯中,释放介质由75 mL乙醇和75 mL无酶SGF组成。在37 ℃、100 r/min下振荡2 h。将溶液的pH调至7.5,加入6 mL模拟肠液(simulated intestinal fluid,SIF),由6.8 g/L KH2PO4、10 g/L胰蛋白酶、5 g/L脂肪酶和12 g/L猪胆盐组成,最终pH为7.5。然后将透析袋置于含有150 mL释放介质的烧杯中,释放介质由75 mL乙醇和75 mL无酶SIF组成,并在37 ℃、100 r/min下振荡4 h。在每个特定时间点收集3 mL透析袋外溶液,并添加等体积新鲜介质。采用紫外-可见分光光度计在311 nm处测定透析液的吸光值,以同一释放介质中绘制的大黄素标准曲线为依据计算大黄素浓度,进而计算释放率。
1.2.10 细胞毒性评价
将大黄素标品及酪蛋白-果胶复合凝胶M-P-O(7/3)制备成不同质量浓度(5、10、20、40、80 μg/mL,培养基稀释)备用。在96孔板中配制100 μL的293T细胞悬液。将培养板在培养箱预培养24 h(37 ℃,5% CO2的条件下)。向培养板加入10 μL不同浓度的样品,在培养箱培育6 h。向每孔加入10 μL CCK-8溶液。在加CCK-8之前更换新鲜培养基(除去培养基,并用培养基洗涤细胞2次,然后加入新的培养基),去除药物影响。将培养板在培养箱内培育4 h后用酶标仪测定450 nm处的吸光度,计算细胞活力,如公式(1)所示。
细胞活力![]()
(1)
式中:A加药,具有细胞、CCK-8溶液和药物溶液的孔的吸光度;A空白,具有培养基和CCK-8溶液而没有细胞的孔的吸光度;A0加药,具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
1.2.11 数据统计分析
所有实验重复3次,数据以平均值±标准偏差表示。采用SPSS 26进行单因素方差分析,P<0.05差异显著。采用Origin 9软件进行作图。
2 结果与分析
2.1 凝胶显微结构及粒径分析
图1-a为采用粒度仪测定的不同比例下酪蛋白-果胶复合物粒径。酪蛋白胶束平均粒径为(190.72±6.04)nm,果胶平均粒径为(5 180.66±136.09)nm。当酪蛋白胶束与果胶以一定比例混合后,复合物粒径随着果胶添加量的增加逐渐增大,但依然为纳米级粒子。由此可见,与酪蛋白胶束混合后,果胶结构改变,粒径减小。果胶上的羧基基团pKa为3.5,酪蛋白胶束等电点为4.6,果胶与酪蛋白在不同pH条件下相互作用不同,形成的复合物类型不同[18]。研究指出,当体系pH接近中性时,酪蛋白胶束和果胶均带负电荷,二者发生排斥作用,可能形成相容的单相体系,2个大分子分布均匀,体系稳定;也可能形成两相,互不相容;二者形成的体系类型与其浓度有关[3]。本研究中,果胶浓度较低,当与酪蛋白胶束溶液混合时,在静电斥力作用下,果胶分子结构变化,形成粒径较小的粒子,充斥在酪蛋白胶束粒子之间,从而形成稳定的单相体系。因此,复合物粒径显著低于果胶粒径。随着果胶添加量的增大,混合物中果胶粒子数量增加,而果胶粒径大于酪蛋白胶束粒径,所以混合体系粒径随果胶添加量的增加而增大。

a-酪蛋白-果胶复合物粒径;b-乳液凝胶中油滴粒径分布;c-乳液凝胶M-P-O(7/3)荧光显微结构
图1 酪蛋白-果胶复合物及乳液凝胶油滴粒径和显微镜照片
Fig.1 Particle size of casein-pectin mixture and oil droplets in emulsion gels and optical micrographs of emulsion gels
图1-b为不同比例酪蛋白-果胶复合物乳液凝胶中油滴的粒径分布图。凝胶中油滴粒径随着果胶添加量的增加而减小。其中,酪蛋白胶束乳液凝胶油滴粒径为80 μm,当酪蛋白-果胶体积比为9∶1时,油滴粒径减小至60 μm,酪蛋白-果胶体积比为7∶3时,粒径降至40 μm,这与酪蛋白-果胶复合物的粒径变化趋势相反,说明酪蛋白-果胶复合体系的乳化性较单一酪蛋白胶束好,可以更好地降低油水界面的表面张力[19]。当酪蛋白-果胶体积比为5∶5、6∶4时,复合物黏度过大,难以与大豆油形成均一稳定的凝胶,因此后续实验不再考虑该比例。研究指出,油滴粒径减小不仅有利于增加乳液的稳定性,而且可缩短油滴间距离,从而增加乳滴间相互作用,进而赋予乳液更高的黏度[16]。因此,适量添加果胶可提升酪蛋白胶束乳液凝胶的稳定性。
乳液凝胶M-P-O(7/3)的荧光显微镜照片如图1-c所示,乳液类型为O/W,油滴粒径分布较为均匀。由于果胶浓度较小,且与酪蛋白胶束间形成静电斥力;而且果胶的乳化活性较酪蛋白差,因此酪蛋白胶束覆盖在油滴表面,果胶粒子充斥在油滴之间。酪蛋白胶束与果胶在静电斥力作用下,油滴粒径有所减小,有利于乳液稳定。另外,果胶增加了凝胶的黏度,从而提高了凝胶的稳定性。由此推断,酪蛋白胶束-果胶复合乳液凝胶稳定性高于酪蛋白胶束乳液凝胶。
2.2 乳液凝胶的红外光谱分析
酪蛋白、果胶及其不同比例复合物的红外光谱如图2-a所示。

a-酪蛋白-果胶复合物;b-乳液凝胶
图2 酪蛋白-果胶复合物及乳液凝胶的红外光谱图
Fig.2 FTIR spectra of casein-pectin mixture and emulsion gels
酪蛋白胶束在3 301 cm-1处存在O—H伸缩振动峰,在1 651 cm-1处存在C![]() O伸缩振动(酰胺吸收带Ⅰ),在1 539 cm-1处存在N—H(酰胺吸收带Ⅱ)伸缩振动峰,这些都是蛋白质中的典型结构[20]。在果胶FTIR曲线中,3 407 cm-1处强而宽的吸收峰是由O—H伸缩振动引起的;1 645 cm-1处的吸收峰是由于O—H的弯曲振动引起的;在1 076、1 036 cm-1处的吸收峰为呋喃糖的特征吸收峰[21]。形成酪蛋白-果胶复合物之后,酰胺Ⅰ带和酰胺Ⅱ带的峰波数并未发生明显偏移,说明蛋白质的二级结构没有发生明显变化,但峰强度随着果胶添加量的增加而降低,这是由于酪蛋白-果胶复合物中蛋白浓度降低,并且果胶的存在遮盖了部分酪蛋白胶束粒子所致。不同比例酪蛋白-果胶复合物乳液凝胶的红外光谱如图2-b所示,酪蛋白在酰胺Ⅰ带和酰胺Ⅱ带的特征吸收峰消失,这可能是由于复合物凝胶M-P-O中的大豆油含量太高,蛋白的特征吸收峰被遮蔽。此外,经过CaCl2处理过的凝胶与未处理的凝胶红外光谱图一致。可见,CaCl2交联并不会改变乳液凝胶的结构。
O伸缩振动(酰胺吸收带Ⅰ),在1 539 cm-1处存在N—H(酰胺吸收带Ⅱ)伸缩振动峰,这些都是蛋白质中的典型结构[20]。在果胶FTIR曲线中,3 407 cm-1处强而宽的吸收峰是由O—H伸缩振动引起的;1 645 cm-1处的吸收峰是由于O—H的弯曲振动引起的;在1 076、1 036 cm-1处的吸收峰为呋喃糖的特征吸收峰[21]。形成酪蛋白-果胶复合物之后,酰胺Ⅰ带和酰胺Ⅱ带的峰波数并未发生明显偏移,说明蛋白质的二级结构没有发生明显变化,但峰强度随着果胶添加量的增加而降低,这是由于酪蛋白-果胶复合物中蛋白浓度降低,并且果胶的存在遮盖了部分酪蛋白胶束粒子所致。不同比例酪蛋白-果胶复合物乳液凝胶的红外光谱如图2-b所示,酪蛋白在酰胺Ⅰ带和酰胺Ⅱ带的特征吸收峰消失,这可能是由于复合物凝胶M-P-O中的大豆油含量太高,蛋白的特征吸收峰被遮蔽。此外,经过CaCl2处理过的凝胶与未处理的凝胶红外光谱图一致。可见,CaCl2交联并不会改变乳液凝胶的结构。
2.3 乳液凝胶的XRD分析
酪蛋白、果胶及复合物的XRD图如图3-a所示。酪蛋白、果胶为大分子,没有特征衍射峰,这与文献报道一致[22]。酪蛋白和果胶混合后,复合物的衍射峰有所偏移,说明果胶和酪蛋白胶束之间产生了物理作用,果胶结构发生改变,与粒径研究结果一致(图1-a);但复合物依然表现为大分子特征。酪蛋白-果胶复合物乳液凝胶的XRD图如图3-b所示。
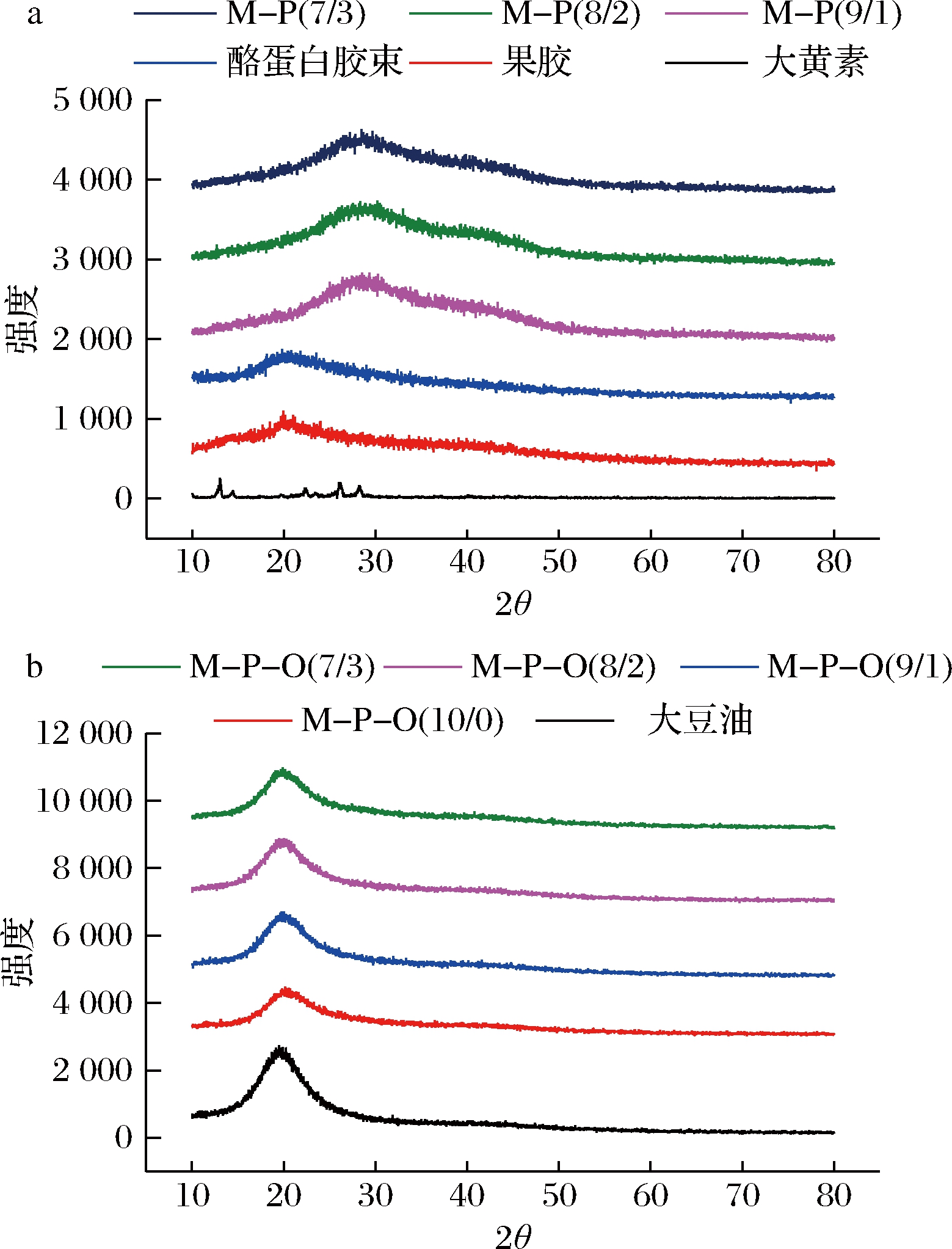
a-酪蛋白-果胶复合物;b-乳液凝胶
图3 酪蛋白-果胶复合物及乳液凝胶的XRD图
Fig.3 X-ray diffraction spectra of casein-pectin mixture and emulsion gels
凝胶衍射峰与油的衍射峰位置基本一致,说明油滴均匀分布于凝胶内部。与大黄素标品XRD图谱相比,凝胶中大黄素的特征衍射峰消失,表明大黄素被完全包裹在乳液凝胶之中,处于内相,再次证实了乳液的O/W结构。
2.4 乳液凝胶的热稳定性分析
酪蛋白胶束、果胶及大豆油的热重(thermogravimetric,TG)曲线如图4-a所示。油的热稳定性最高,其主要失重出现在350~450 ℃,为油的汽化和分解温度。果胶和酪蛋白胶束第一失重阶段在70~100 ℃,为水分蒸发阶段。果胶第二失重阶段出现在200~300 ℃,为果胶的分解所致[23]。酪蛋白胶束的第二失重阶段为250~350 ℃,为胶束解离及酪蛋白分解阶段。可见,酪蛋白胶束热稳定性高于果胶。乳液凝胶的TG曲线如图4-b所示,乳液凝胶的失重曲线相似,说明各凝胶微观结构相似。乳液凝胶的第一失重阶段出现在70~100 ℃,主要原因为凝胶中水分汽化。随着果胶添加量的增加,第一阶段失重率增大,这是因为果胶浓度低于酪蛋白,所以水分含量增加,因此水分汽化引起的失重率随着果胶添加量的增加而增大。当温度升高至350~450 ℃,食用豆油开始汽化和分解,酪蛋白和果胶也开始分解,此时凝胶质量迅速降低。温度高于450 ℃之后,质量损失速度减缓,剩余残渣碳化,这与曹庆龙等的研究结果一致[24]。综上所述,酪蛋白-果胶复合乳液凝胶具有较高的热稳定性。
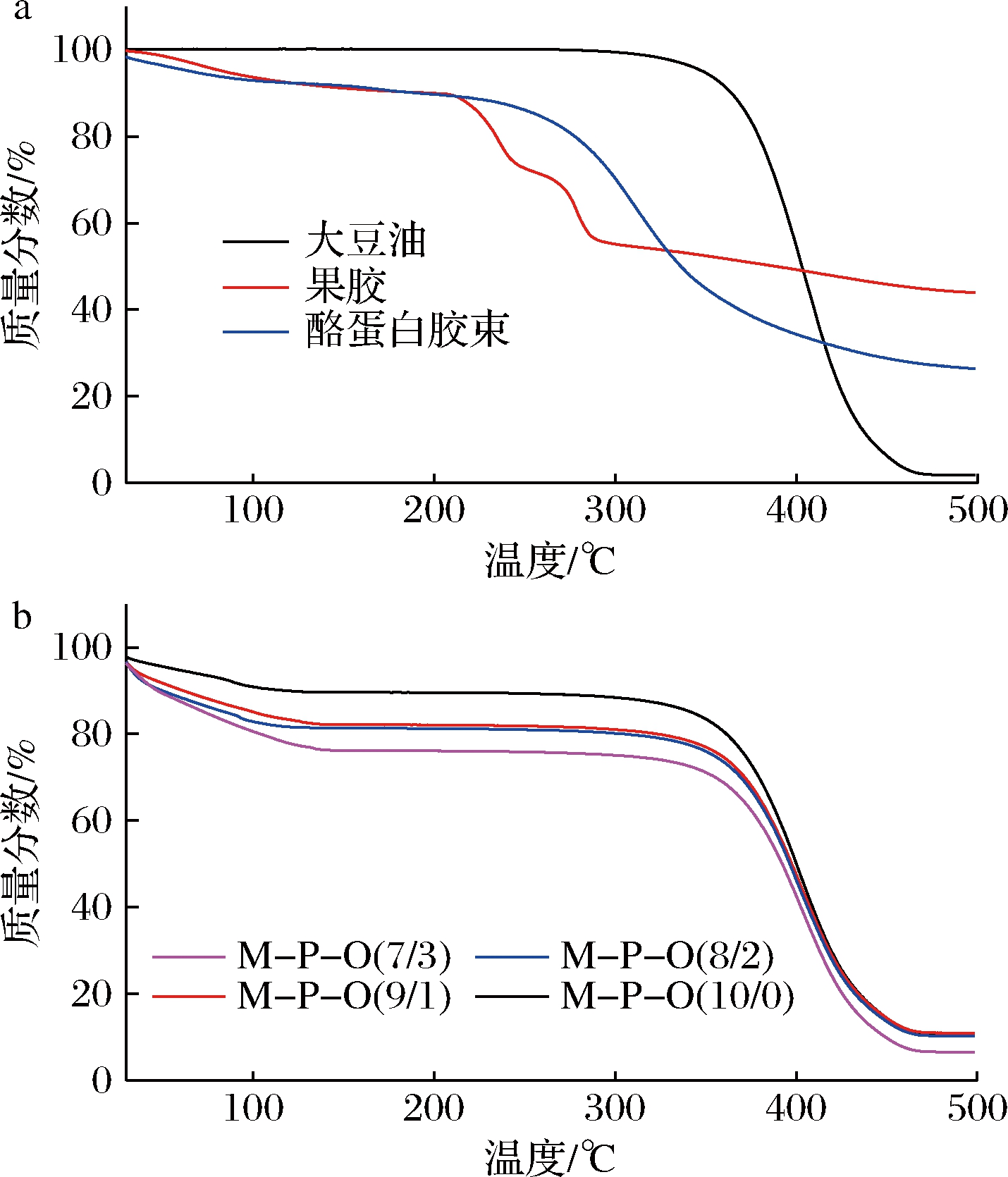
a-酪蛋白、果胶和大豆油的TG曲线;b-乳液凝胶的TG曲线
图4 酪蛋白-果胶乳液凝胶的热稳定性
Fig.4 Thermal stability of casein-pectin emulsion gel
2.5 乳液凝胶的贮藏稳定性分析
由图5-a可以看出,贮藏7 d后,乳液凝胶M-P-O(10/0)发生轻微分层现象,底层有少量水相析出;贮藏90 d后,乳液凝胶M-P-O(9/1)也出现乳析,而M-P-O(8/2)、M-P-O(7/3)尚未分层。贮藏240 d后,乳液凝胶M-P-O(8/2)、M-P-O(7/3)依旧未分层,说明这2个样品稳定性较高。由此可见,添加果胶提高了乳液凝胶的稳定性。

a-外观照片;b-显微镜照片
图5 贮藏期间酪蛋白-果胶乳液凝胶外观和显微镜照片
Fig.5 Apperance and optical micrographs of casein-pectin emulsion gel
酪蛋白胶束带有负电荷,形成乳液时胶束粒子覆盖在油滴表面,使其表面带上负电荷,在乳滴间形成静电斥力,起到稳定油滴的作用;添加果胶后,果胶充斥在油滴之间,与油滴表面酪蛋白胶束间形成静电斥力,进而增加油滴间斥力;另外,果胶黏度较大,也有利于阻止油滴聚集。因此,添加果胶后,乳液凝胶稳定性提升,且其稳定性随果胶添加量增加而增大。吕思伊等[4]研究证实,添加果胶有利于提高核桃蛋白乳液的稳定性,与本文研究结果一致。
由图5-b可以看出,酪蛋白胶束乳液凝胶油滴粒径大于酪蛋白-果胶复合乳液凝胶中油滴粒径,且油滴大小随着果胶添加量的增大而减小。贮藏7 d后,酪蛋白胶束乳液凝胶中油滴粒径略微增大,该现象在贮藏30 d时更加明显。贮藏90 d后,乳液凝胶M-P-O(9/1)的油滴粒径明显增大,这是由于小分子的油滴聚集所致。贮藏240 d后,乳液凝胶M-P-O(8/2)、M-P-O(7/3)的油滴粒径仍然未发生明显改变,这与凝胶的外观变化一致。由此可见,添加适量果胶后,酪蛋白胶束乳液凝胶稳定性显著提高,酪蛋白-果胶复合乳液凝胶的贮藏期较长,可用作药物载体。
2.6 乳液凝胶中大黄素的胃肠模拟释放分析
如图6所示,在模拟胃液中,大黄素溶解性差,释放率极低,而将其分散于凝胶中有利于提高其分散性和溶解性,因此凝胶中大黄素释放率高于游离大黄素。在模拟肠道消化中,随着消化时间的延长,大黄素的释放率呈上升趋势。累积消化240 min后,凝胶中大黄素释放率大于游离大黄素,这是因为凝胶中大黄素分散较好,溶解性增大,更易于扩散,而游离大黄素溶解性差,在肠液中难以分散,其扩散速率较低。肠液环境中,未添加果胶的凝胶中大黄素释放最快,因为其黏度较低,大黄素在凝胶内部扩散较快。

图6 酪蛋白-果胶乳液凝胶中大黄素的胃肠模拟释放曲线
Fig.6 Simulated gastrointestinal release of emodin from casein-pectin emulsion gels
就CaCl2处理的凝胶而言,当果胶含量较低时,凝胶中大黄素释放速率与未交联凝胶相当。然而,当酪蛋白与果胶体积比达到8∶2时,大黄素释放率显著降低,且低于游离大黄素的释放率。当消化时间为360 min时,游离大黄素的释放率为(53.97±4.42)%,而CaCl2交联的M-P-O(8/2)和M-P-O(7/3)中大黄素的释放量分别为(50.21±4.14)%和(38.40±6.89)%。由于Ca2+可交联果胶,形成致密的网络结构,不仅提升了乳液凝胶系统的稳定性,而且减缓了大黄素在凝胶网络中的扩散速率。因此,乳液凝胶中大黄素的释放速率减缓[20,25]。综上所述,适宜的Ca2+交联有利于延缓酪蛋白-果胶复合凝胶中大黄素的释放。
2.7 乳液凝胶的细胞毒性分析
如图7所示,当大黄素质量浓度低于20 μg/mL时,细胞活力均大于90%,这说明低浓度大黄素标品对细胞的毒性较小。当大黄素质量浓度为40 μg/mL时,细胞活力下降至45%以下,且随着大黄素浓度的继续升高,细胞活力逐渐降低,表明高浓度大黄素对细胞有明显毒性。当大黄素被负载于乳液凝胶后,大黄素质量浓度≤80 μg/mL时,细胞活力均在85%以上。由此可见,酪蛋白-果胶复合乳液凝胶体系负载可显著降低大黄素的细胞毒性。
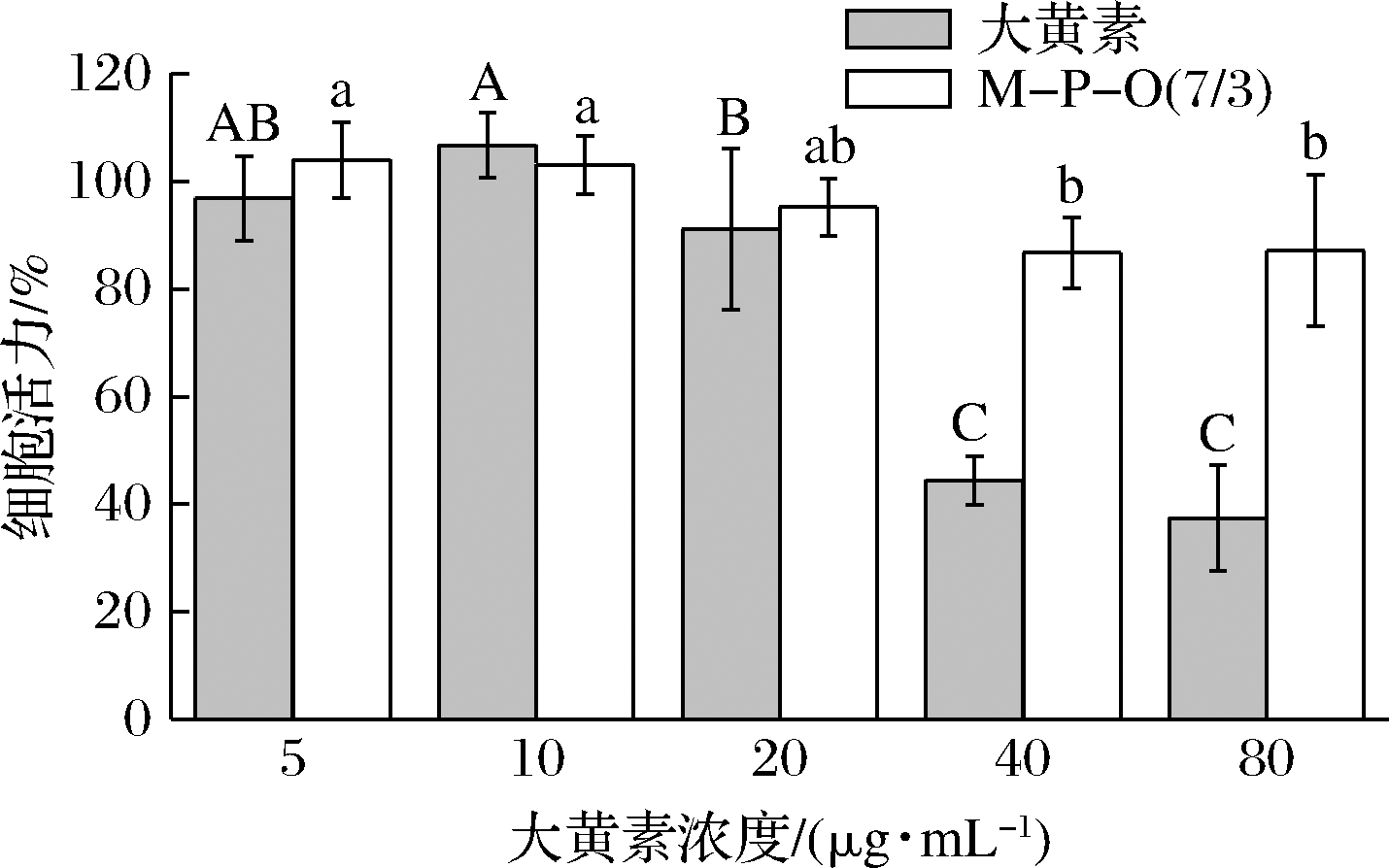
图7 乳液凝胶中大黄素的细胞毒性分析
Fig.7 Cell cytotoxic analysis of emodin in emulsion gel
注:不同字母代表差异显著,P<0.05
3 结论
以不同配比酪蛋白-果胶复合物为基质,将大黄素负载于油相,制备了含油量70%的乳液凝胶。通过显微镜观察发现,乳液凝胶为O/W型;添加适量果胶,降低了乳液凝胶中油滴粒径。而且,果胶与酪蛋白胶束间产生静电斥力作用,提高了乳液凝胶的稳定性。果胶-酪蛋白胶束体积比为8∶2和7∶3时,凝胶在贮藏240 d时依旧稳定,其油滴粒径未发生明显改变。热重分析发现,乳液凝胶具有较高的热稳定性。经负载后,大黄素在模拟肠液环境中释放速率发生改变,适量Ca2+交联有利于延缓大黄素的释放。细胞毒性实验表明,负载于酪蛋白胶束-果胶复合乳液凝胶中的大黄素细胞毒性显著低于游离大黄素。综上所述,酪蛋白-果胶复合乳液凝胶制备简单,凝胶稳定性高,可实现大黄素的有效负载,并有利于降低其细胞毒性。
[1] MCMAHON D J, OOMMEN B S.Supramolecular structure of the casein micelle[J].Journal of Dairy Science, 2008, 91(5):1 709-1 721.
[2] LUCEY J A, HORNE D S.Perspectives on casein interactions[J].International Dairy Journal, 2018, 85:56-65.
[3] WUSIGALE, LIANG L, LUO Y C.Casein and pectin:Structures, interactions, and applications[J].Trends in Food Science & Technology, 2020, 97:391-403.
[4] 吕思伊, 卢琪, 潘思轶.包封姜黄素的果胶-核桃蛋白复合物乳液稳定性及体外消化[J].食品科学, 2021, 42(8):1-9.
LYU S Y, LU Q, PAN S Y.Stability and in vitro digestion of pectin-walnut proteins stabilized emulsions encapsulating curcumin[J].Food Science, 2021, 42(8):1-9.
[5] LI P Y, GUO C, LI X F, et al.Preparation and structural characteristics of composite alginate/casein emulsion gels:A microscopy and rheology study[J].Food Hydrocolloids, 2021, 118:106792.
[6] BALAKRISHNAN G, NGUYEN B T, SCHMITT C, et al.Heat-set emulsion gels of casein micelles in mixtures with whey protein isolate[J].Food Hydrocolloids, 2017, 73:213-221.
[7] NGOUÉMAZONG E D, CHRISTIAENS S, SHPIGELMAN A, et al.The emulsifying and emulsion-stabilizing properties of pectin:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(6):705-718.
[8] PIRIYAPRASARTH S, JUTTULAPA M, SRIAMORNSAK P.Stability of rice bran oil-in-water emulsions stabilized by pectin-zein complexes:Effect of composition and order of mixing[J].Food Hydrocolloids, 2016, 61:589-598.
[9] NASCIMENTO L G L, CASANOVA F, SILVA N F N, et al.Use of a crosslinked casein micelle hydrogel as a carrier for jaboticaba (Myrciaria cauliflora) extract[J].Food Hydrocolloids, 2020, 106:105872.
[10] XU G R, WANG C N, YAO P.Stable emulsion produced from casein and soy polysaccharide compacted complex for protection and oral delivery of curcumin[J].Food Hydrocolloids, 2017, 71:108-117.
[11] SABOURI S, WRIGHT A J, CORREDIG M.In vitro digestion of sodium caseinate emulsions loaded with epigallocatechin gallate[J].Food Hydrocolloids, 2017, 69:350-358.
[12] 金丽霞, 金丽军, 栾仲秋, 等.大黄的化学成分和药理研究进展[J].中医药信息, 2020, 37(1):121-126.
JIN L X, JIN L J, LUAN Z Q, et al.Research progress on chemical constituents and pharmacology of rhubarb[J].Information on Traditional Chinese Medicine, 2020, 37(1):121-126.
[13] 李志清, 王善龙, 郭巍, 等.异丹叶大黄素对前列腺癌细胞血管生成相关蛋白的影响[J].辽宁中医杂志, 2021, 48(10):155-158.
LI Z Q, WANG S L, GUO W, et al.Effect of isodansophylline on angiogenesis-related proteins in prostate cancer cells[J].Liaoning Journal of Traditional Chinese Medicine, 2021, 48(10):155-158.
[14] 张洪, 成蓓.大黄素固体脂质纳米粒的制备及理化性质研究[J].中国药师, 2010, 13(3):326-329.
ZHANG H, CHENG B.Preparation and physico-chemical property of emodin solid lipid nanoparticles[J].China Pharmacist, 2010, 13(3):326-329.
[15] CHEN X H, YANG Z F, SUN R S, et al.Preparation of lung-targeting, emodin-loaded polylactic acid microspheres and their properties[J].International Journal of Molecular Sciences, 2014, 15(4):6 241-6 251.
[16] 宁雪莹, 陈小威, 马传国.乳滴粒径和皂皮皂苷浓度对高内相乳液凝胶及其模板油凝胶构建的影响[J].中国油脂, 2021, 46(7):27-33;40.
NING X Y, CHEN X W, MA C G.Effect of emulsion droplet size and Quillaja saponin concentration on the fabrication of high internal phase emulsion gels and oleogels[J].China Oils and Fats, 2021, 46(7):27-33;40.
[17] MOHAMMADIAN M, SALAMI M, MOMEN S M, et al.Fabrication of curcumin-loaded whey protein microgels:Structural properties, antioxidant activity, and in vitro release behavior[J].LWT, 2019, 103:94-100.
[18] 张璐璐, 谭慧林, 张春兰.环境条件对果胶/酪蛋白复合物的影响[J].中国果菜, 2018, 38(4):1-4;8.
ZHANG L L, TAN H L, ZHANG C L.Effects of environmental conditions on pectin-casein complex[J].China Fruit & Vegetable, 2018, 38(4):1-4;8.
[19] WILLIAMS P A, SAYERS C, VIEBKE C, et al.Elucidation of the emulsification properties of sugar beet pectin[J].Journal of Agricultural and Food Chemistry, 2005, 53(9):3 592-3 597.
[20] 樊永康, 项婷, 崔心禹, 等.负载槲皮素的酪蛋白-果胶纳米粒子的构建[J].精细化工, 2019, 36(7):1 308-1 315.
FAN Y K, XIANG T, CUI X Y, et al.Construction of casein-pectin nanoparticles loaded with quercetin[J].Fine Chemicals, 2019, 36(7):1 308-1 315.
[21] 王擎宇, 王梦遥, 黄慧敏, 等.果胶/酪蛋白酸钠复合运载体系的构建及对番茄红素的控释机理[J].食品科学, 2020, 41(19):83-89.
WANG Q Y, WANG M Y, HUANG H M, et al.Construction of pectin/sodium caseinate composite delivery system and controlled release mechanism of incorporated lycopene from it[J].Food Science, 2020, 41(19):83-89.
[22] MUHOZA B, ZHANG Y T, XIA S Q, et al.Improved stability and controlled release of lutein-loaded micelles based on glycosylated casein via Maillard reaction[J].Journal of Functional Foods, 2018, 45:1-9.
[23] 刘昕, 张驰, 薛艾莲, 等.超声-酶法提取的豆腐柴低酯果胶理化性质及结构表征[J].食品与发酵工业, 2021, 47(8):108-115.
LIU X, ZHANG C, XUE A L, et al.Physicochemical properties and structure characterization of low-methoxy pectin from Premna microphylla Turcz extracted by ultrasound-enzyme treatment[J].Food and Fermentation Industries, 2021, 47(8):108-115.
[24] 曹庆龙, 雷桥, 吴浩, 等.乳清分离蛋白-普鲁兰多糖复合气凝胶的制备及性能优化[J].食品与发酵工业, 2021, 47(16):181-187.
CAO Q L, LEI Q, WU H, et al.Preparation and performance optimization of whey protein isolate pullulan composite aerogel[J].Food and Fermentation Industries, 2021, 47(16):181-187.
[25] 王撼辰, 丑述睿, 崔慧军, 等.钙离子添加量对苹果果胶-苹果多酚复配物体系流变、凝胶及质构特性的影响[J].食品科学, 2019, 40(24):46-52.
WANG H C, CHOU S R, CUI H J, et al.Impacts of calcium ion addition on rheological, gel and textural properties of apple pectin-apple polyphenol compound[J].Food Science, 2019, 40(24):46-52.