双酚A(bisphenol A, BPA),又名二酚基丙烷,是一种具有雌激素效应的环境污染物,微量的BPA就可对水体生物和人类健康产生极大的危害,该物质与许多疾病的发生有着密切的关系[1]。然而,在现实生活中BPA与人们的生活又紧密相关,是制造婴儿奶瓶、食品包装盒以及微波炉饭盒的起始材料。伴随着BPA生产规模的不断扩大,制造与应用过程中产生的废水排放以及BPA制品分解导致的环境污染越来越引起人们的重视[2]。目前人们采取了多种方法来消除水体中BPA的污染,包括化学氧化[3]、物理吸附[4]、光催化[5]及生物降解等手段[6-7]。
漆酶(laccase, E.C.1.10.3.2)是一种含有铜离子的多酚氧化酶,该酶能利用分子氧为最终电子受体,实现多种化合物的高效氧化,在治理环境污染方面具有广阔的应用前景[8-10]。漆酶能够催化BPA形成苯氧自由基的中间体,而后这些具有活性的中间体在酶促反应位点外发生共价耦合,生成不同形态的多聚体,其往往是高分子质量和低分子质量的混合物,高分子质量的不溶性低聚物常沉淀在水溶液中,可以采用过滤、沉淀或者离心等方法与水相分离,低分子质量的化合物一般可以进一步代谢成为有机酸,总体上看,所降解产物的毒性都较低或者无毒,且后期易于处理,具有去除效果显著和环境友好的优点[11-13]。然而由于漆酶的稳定性差,难以重复使用,使其在含BPA废水的处理中的应用受到了限制。
提高酶稳定性最有效的方法是酶的固定化,包埋法是常用的技术手段之一,通过将酶蛋白限制在高聚物的网格之中实现酶的固定化。其制备过程较为简单,酶蛋白本身的特性改变小,固定化颗粒适合在多种反应器中进行催化反应。海藻酸钠是一种常用的固定化材料,是由古洛糖酸与甘露糖醛酸为单元结构连接而成的一种多糖,其与二价阳离子反应时可以很快形成多孔凝胶从而实现对酶的包埋[14]。为了有利于物质的传递,扩大胶体颗粒的内部的固定化空间,提高其机械强度,人们往往采用海藻酸钠和明胶进行协同固定化,目前在果糖转移酶[15]、L-阿拉伯糖异构酶[16]、S-腺苷甲硫氨酸合成酶[17]等酶的固定化中都有应用的报道,然而由于其孔径的增大,会造成反应过程中酶的泄露,从而使酶活力损失、催化效率下降。
本文采用戊二醛预先处理漆酶溶液,使酶分子预先交联形成较大的体积,然后以海藻酸钠-明胶为材料进行包埋,所制备的固定化交联酶颗粒具有不易泄露、稳定性好的优点,而且底物和产物的传递受到的阻遏作用较小,有助于酶对底物的快速降解。重点研究了影响固定化交联酶制备的主要因素,探究了固定化交联酶的稳定性,考察了固定化交联酶在鼓泡式反应器中对BPA的降解能力,为漆酶在治理内分泌干扰物污染方面提供了理论依据。
1 材料与方法
1.1 材料与试剂
漆酶,来源于Trametes sp.LS-10C(CCTCC NO:M2015191)通过固态发酵制得[18];BPA(分析纯)阿拉丁试剂有限公司;海藻酸钠、明胶、戊二醛、愈创木酚、醋酸和醋酸钠等其他试剂,均为分析纯,国药集团上海化学试剂有限公司。
1.2 实验方法
1.2.1 固定化交联酶的制备
海藻酸钠-明胶协同固定化交联漆酶制备的过程见图1,具体过程如下:将一定质量分数的戊二醛溶液加入10 mL的粗漆酶溶液中,在25 ℃下磁力搅拌反应2 h后,然后在4 ℃下透析去除未反应的戊二醛,得到交联的漆酶溶液;分别称取明胶0.4 g、海藻酸钠0.4 g于100 mL烧杯中加入20 mL纯净水,85 ℃加热搅拌溶解,待溶解完全后,冷却至室温,将上述得到的交联漆酶溶液以10%(体积分数)的量加入其中,充分搅拌无气泡后用注射器通过16号针头将明胶-海藻酸钠和交联漆酶混匀的溶液滴入500 mL的质量浓度为15 g/L CaCl2溶液中,过程中采用磁力搅拌使颗粒之间不黏连在一起,并保持固化1 h后过滤洗涤,得到固定化交联酶的颗粒,所制备的固定化酶称为固定化交联酶;作为对照,以不经过戊二醛处理后的酶而直接制备的固定化酶称为固定化游离酶。
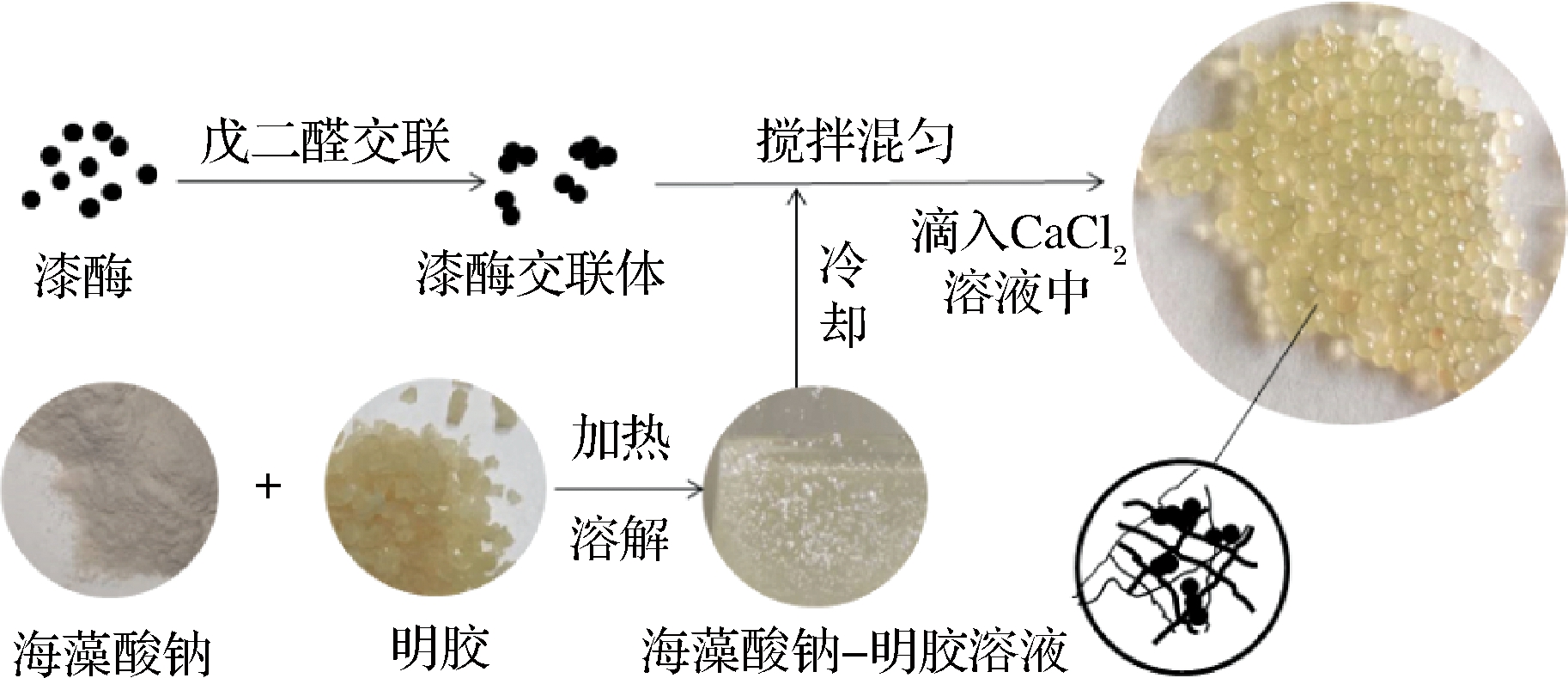
图1 海藻酸钠-明胶协同固定化交联漆酶的过程
Fig.1 Process of immobilized cross-linked laccase by sodium alginate-gelatin
1.2.2 固定化交联酶稳定性的研究
pH稳定性:取一定量的固定化酶和游离酶分别放置在pH 3.0(50 mmol/L柠檬酸盐)缓冲液和pH 8.0(50 mmol/L醋酸盐)缓冲液中,静置不同的时间后取样测定酶活力,计算其剩余的催化活力。
温度稳定性:取一定量的固定化酶和游离酶放置在40~70 ℃的恒温水浴中,静置60 min后取样测定酶活力,计算其剩余的催化活力。
操作稳定性:将固定化酶置于pH 4.0的醋酸盐缓冲溶液中室温下进行振荡,定时取样,然后过滤洗涤,考察其剩余的催化活力。
1.2.3 BPA的降解
固定化酶降解BPA的反应在鼓泡式反应器中进行,反应器规格为高22 cm,直径9 cm,置于水浴锅中保持温度恒定,空气用压缩机通过滤膜从底部打入,采用空气流量计控制进气的速率。反应体系中含有1 L的质量浓度为10 μg/mL的BPA溶液,20 g固定化酶颗粒,反应pH为4.0,温度30 ℃,通气量0.5 L/min。
1.2.4 分析检测
漆酶活力的测定采用比色法,以愈创木酚为底物[19],固定化率的计算如公式(1)所示:
固定化率![]()
(1)
BPA的含量采用4-氨基安替吡啉显色法检测[20],降解率的计算如公式(2)所示:
降解率![]()
(2)
2 结果与分析
2.1 固定化交联漆酶条件的选择
2.1.1 戊二醛的浓度对固定化的影响
图2显示了戊二醛对固定化酶制备的影响,随着戊二醛浓度的增加,固定化酶的活力和固定化率都是逐渐增加的,当戊二醛的质量分数为2.0%时,固定化酶的活力和固定化率都达到最高。但是由于戊二醛的活性较强,进一步增加戊二醛的浓度会使酶蛋白过度交联,影响活性中心的构象,造成酶的活力有较大的损失[21]。通常包埋法是直接将游离酶与固定化的载体材料混合在一起,由于单个酶分子直径较小,很容易从固定化凝胶颗粒的网格中游离出去,因此在反应的过程中会有酶的泄露,从而造成酶活力的损失,在本实验中利用戊二醛与酶蛋白反应形成席夫碱可以使酶分子之间形成交联,从而增大了酶分子的体积,这样就降低了酶蛋白从固定化颗粒中泄露的几率[22]。戊二醛作为一种交联剂常用在酶的固定化中,其常规操作是在酶被包埋以后,再加入戊二醛进行交联,这种方法虽然能够增加酶与载体的结合强度,但是在固定化过程中酶的流失依然无法避免[23]。

图2 戊二醛浓度对固定化的影响
Fig.2 Effect of glutaraldehyde concentration on immobilization
2.1.2 载体对固定化的影响
图3显示了海藻酸钠和明胶的质量比对固定化效果的影响,添加一定量的明胶对于改善固定化的效果是比较明显的,但是明胶的含量不能太高,否则会使固定化凝胶的网格过大和凝胶的强度下降,当两者质量比为1∶1时效果最好。近年来,复配材料越来越多地应用在酶和细胞的固定化中,复配可结合各种固定化载体材料的优点,使固定化效果达到最佳[24]。包埋法固定化酶由于聚合物的阻遏作用,使其难以有效调控传质,影响底物、产物和氧的传递,特别是漆酶降解BPA以及其他化合物过程中会形成大分子的聚合体,必须要及时地从固定化酶凝胶颗粒内部扩散出来。添加明胶可以在保持固定化颗粒完整性和强度的基础上减少海藻酸钠的使用量,相应地增大了凝胶网格的孔径,有利于提高固定化酶的催化效率[25]。

图3 海藻酸钠和明胶质量比对固定化酶的影响
Fig.3 Effect of the mass ratio of sodium alginate to gelatin on immobilized enzyme
2.1.3 CaCl2浓度对固定化的影响
图4显示了CaCl2浓度对固定化的影响,多孔隙网状空间的海藻酸钙凝胶结构形成的过程是Na+与溶液中Ca2+在羧基部位进行离子交换,随后Ca2+将两侧海藻酸分子链上的羧酸基团相连从而形成交联,当CaCl2质量浓度达到15 g/L时,固定化率与固定化酶活力趋于稳定,表明此时形成的海藻酸钙致密网格结构能够将酶蛋白迅速包埋,酶的流失较少。Ca2+浓度不足,其与Na+不能实现有效的交换而导致交联的程度不高,固定化颗粒整体的机械强度较低,无法耐受后期反应过程中剪切力的作用;随着Ca2+浓度的增加,固定化颗粒的交联度也随之上升,机械强度也逐步增强;但是过高的Ca2+浓度使滴入海藻酸钠液珠的表面迅速交联形成致密的凝胶层,造成后续的Ca2+较难进一步渗入到凝胶内部,形成外硬内软的空心结构[26]。
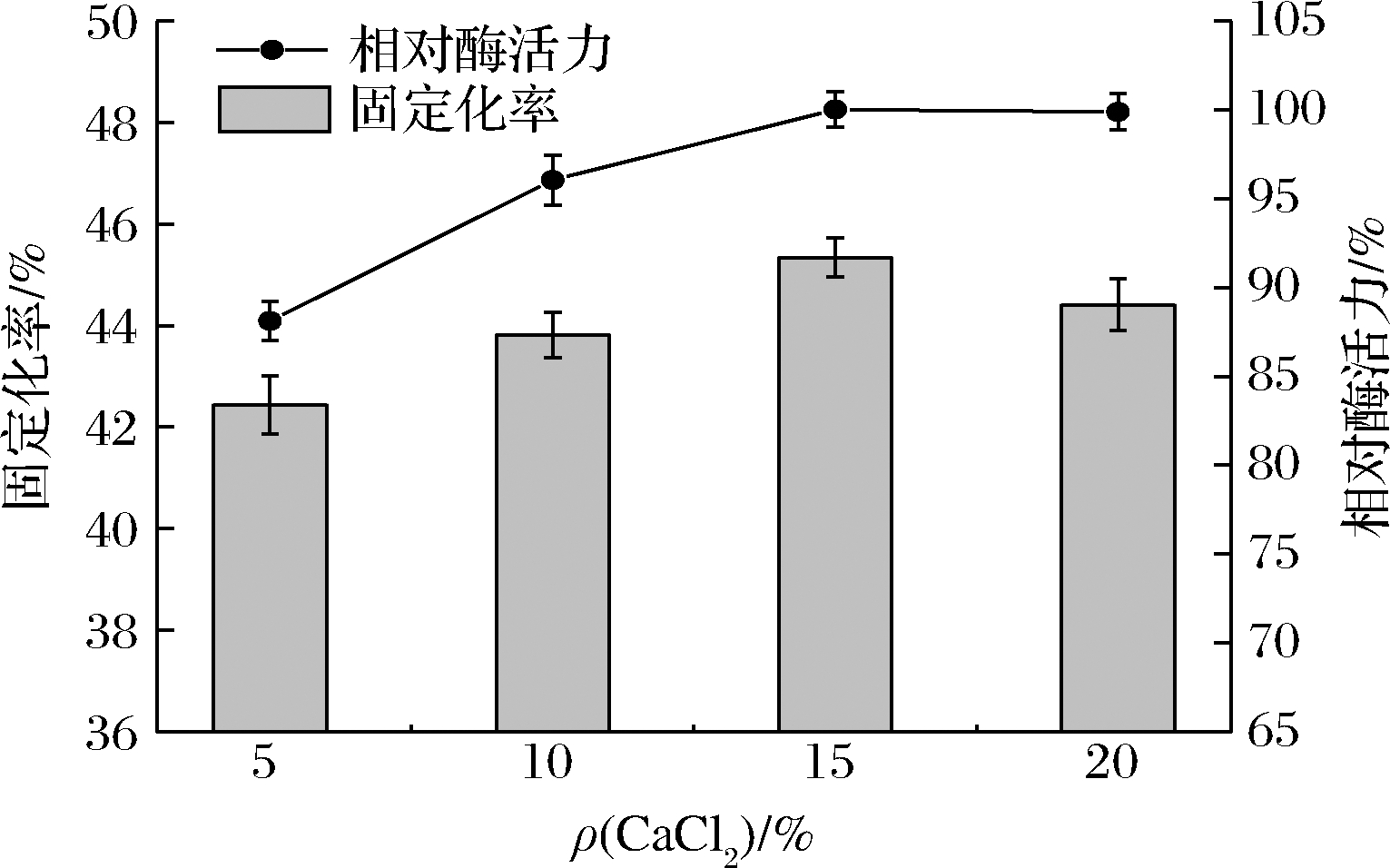
图4 CaCl2浓度对固定化酶的影响
Fig.4 Effect of CaCl2 concentration on immobilized enzyme
综上,固定化交联漆酶时戊二醛的质量分数为2.0%、m(海藻酸钠)∶m(明胶)=1∶1、CaCl2质量浓度为15 g/L时的效果最好,固定化酶的酶活力为0.13 U/g。
2.2 固定化交联酶稳定性的研究
2.2.1 pH稳定性
图5为固定化酶的pH稳定性。

a-pH 3.0;b-pH 8.0
图5 固定化酶的pH稳定性
Fig.5 pH stability of immobilized enzyme
经固定化的处理后,酶对酸碱的耐受性得到了一定程度的提高,这得益于载体所构建的微环境的保护作用,相比较而言固定化交联漆酶的稳定性要好于固定化游离酶,这可能是由于戊二醛的交联作用增强了酶的刚性结构,使其更能抵抗环境中的pH的变化。
2.2.2 温度稳定性
由图6可知,固定化交联酶对高温的耐受性更强,在70 ℃时处理60 min后游离酶活力损失较大,固定化酶耐热性较强,还剩余58.84%的酶活力,而固定化交联酶剩余68.75%的酶活力,这可能是一方面戊二醛交联增加了酶分子的稳定性,另一方面可能是海藻酸钠作为多糖本身就可以提高酶蛋白的抗逆性[27]。
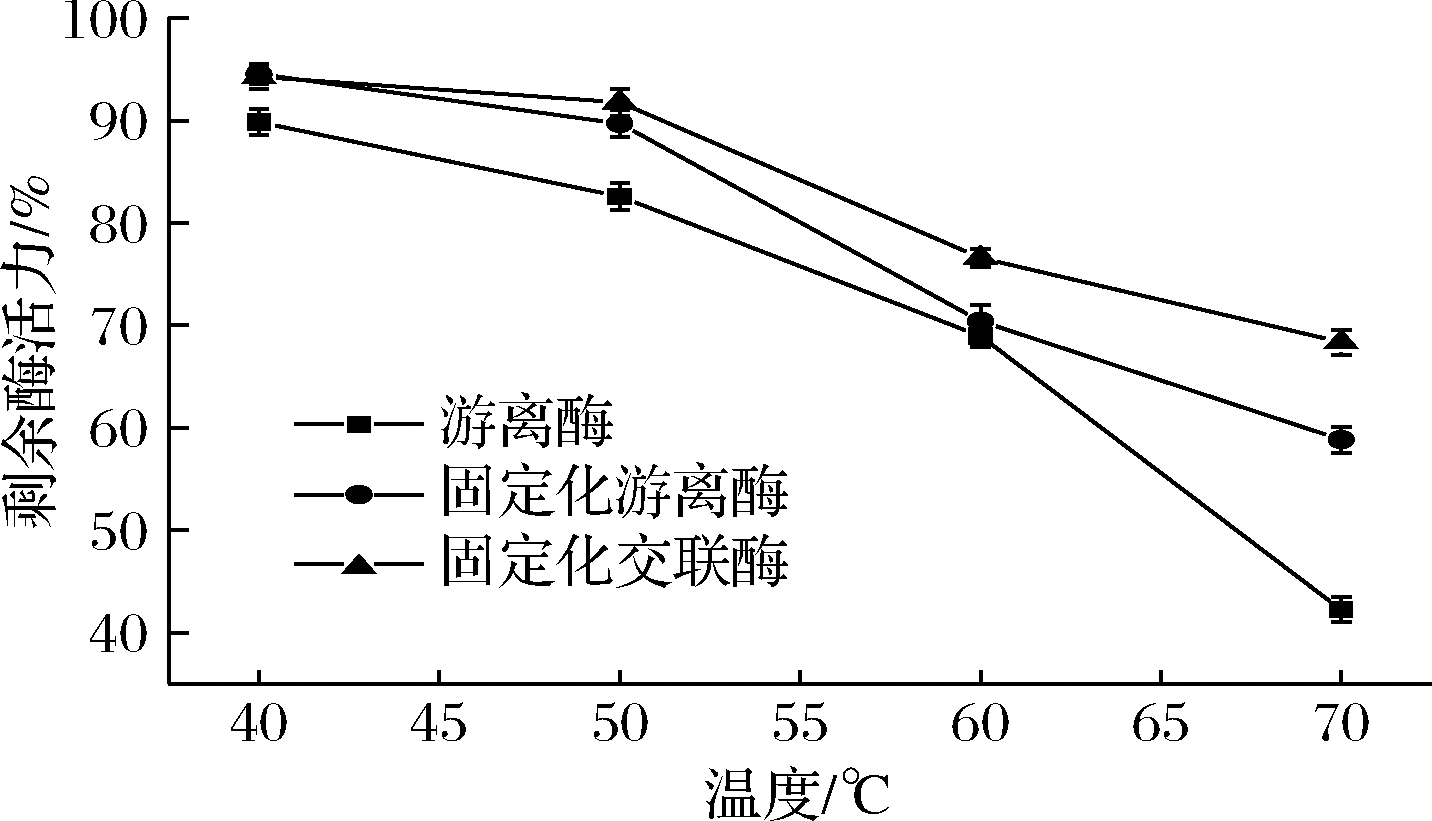
图6 固定化酶的温度稳定性
Fig.6 Temperature stability of immobilized enzyme
2.2.3 操作稳定性
图7显示了固定化酶在连续振荡的操作条件下酶活力保留情况。
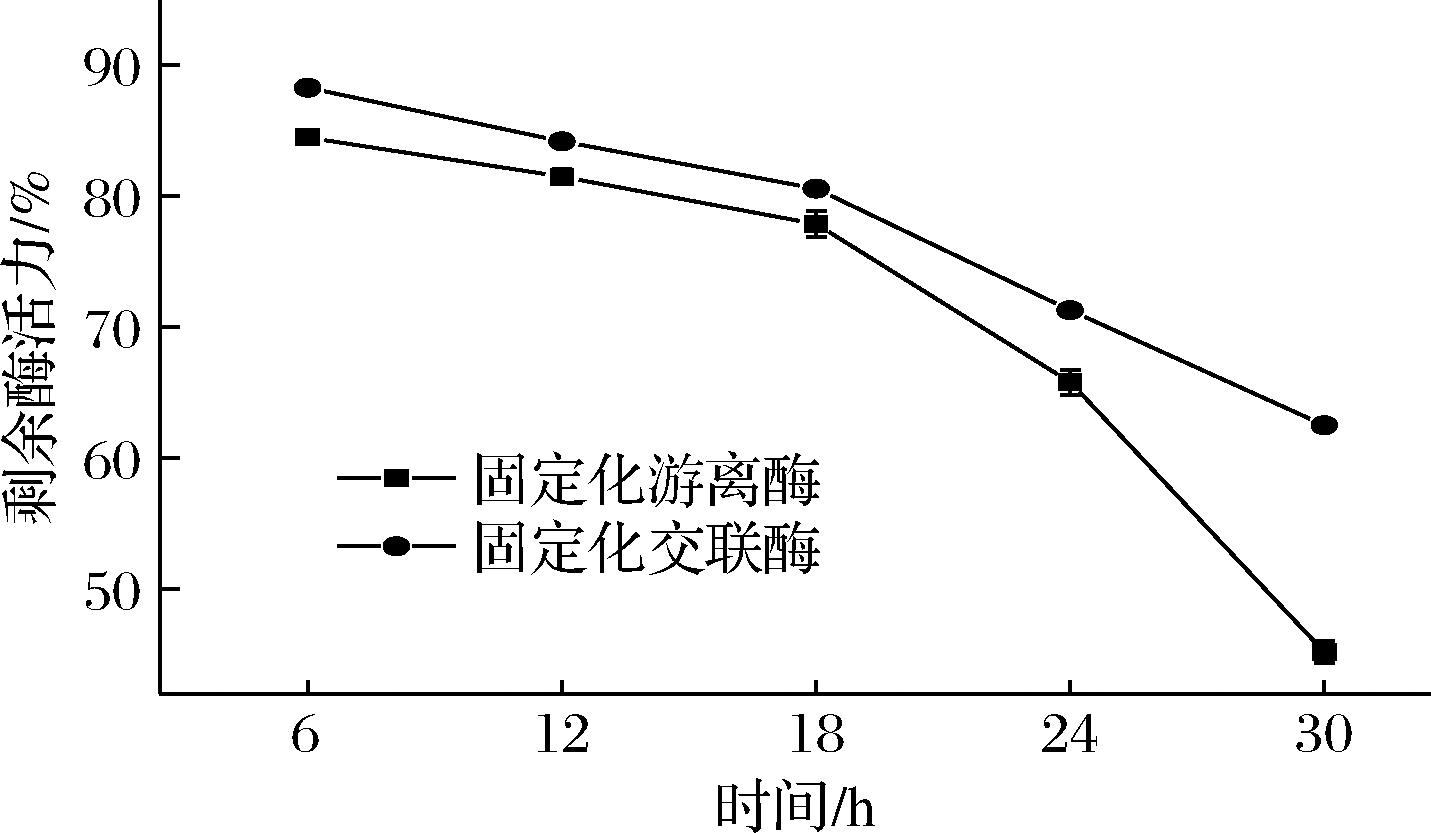
图7 固定化酶的操作稳定性
Fig.7 Operation stability of immobilized enzyme
通过振荡作用可以加速凝胶内部的酶分子向颗粒外部扩撒,长时间的振荡会使固定化酶活力降低,在固定化颗粒保持完整的情况下,这只能是振荡作用使酶的扩散泄露所造成的结果。随着时间的延长,酶的泄露也会越多,从而造成酶活力的进一步降低。但与固定化游离酶相比,固定化交联酶的剩余酶活力相对要高些,说明其酶蛋白的泄露较少。在30 h的振荡后,固定化交联酶的剩余酶活力为62.52%,高于固定化游离酶的45.28%,显示其操作的稳定性得到了进一步地提高。
2.3 鼓泡式反应器中降解BPA
鼓泡式反应器具有传质效果好、剪切力小,反应过程中固定化颗粒不易破裂的优点,特别适用于机械强度一般的固定化酶的颗粒[28]。如图8所示,固定化交联酶和固定化游离酶的催化性能基本相似,反应3 h后的降解率达到85%以上。
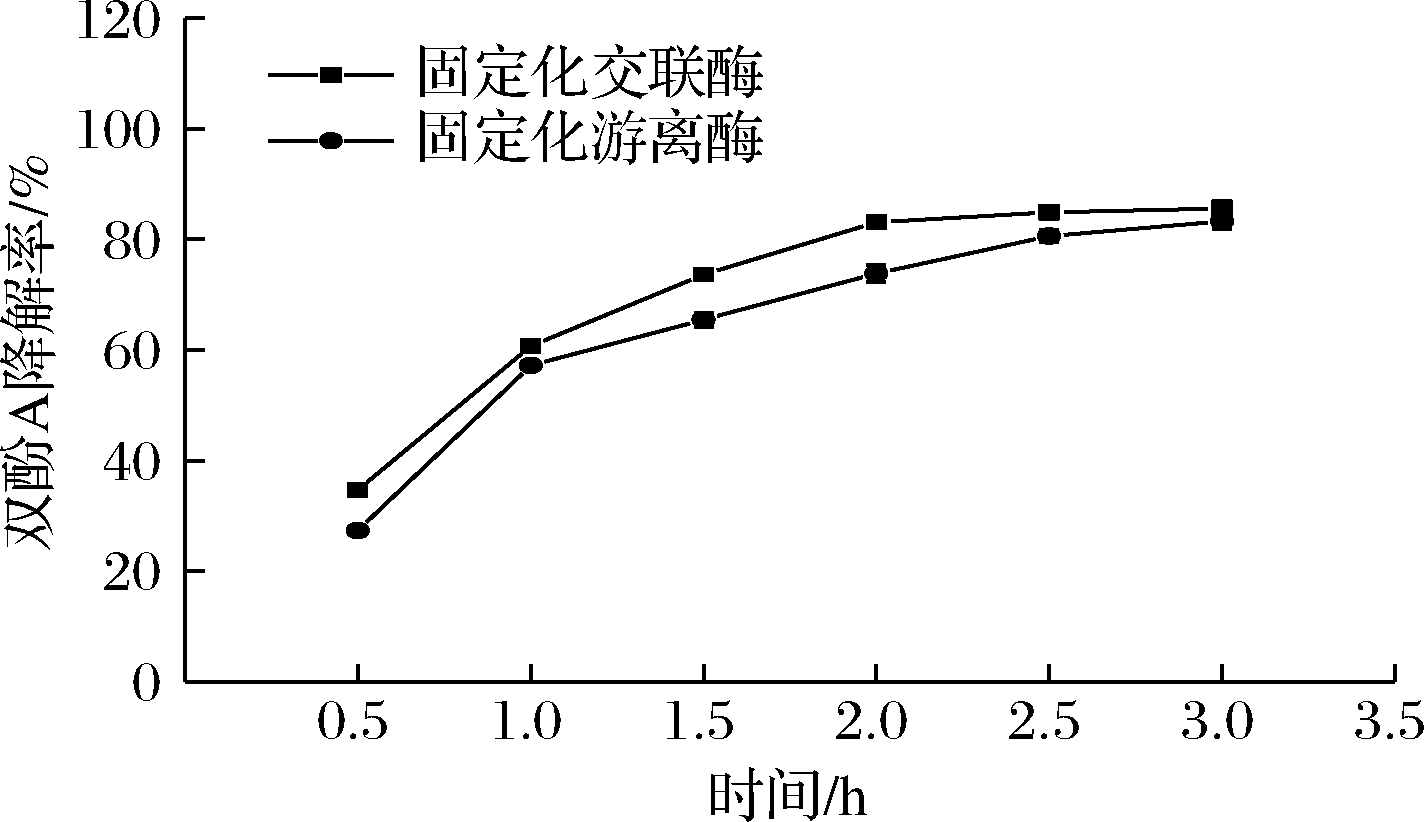
图8 BPA的降解过程
Fig.8 Degradation process of BPA
图9显示了固定化酶在连续批次反应中的情况, 2种固定化酶的稳定性差别较大,连续5个批次的反应以后固定化交联酶剩余酶活力为34.93%,BPA的降解率仍能达到71.13%,分别是固定化游离酶的7.97倍和4.43倍,这说明采用先交联后包埋的固定化策略,可以有效地解决酶的泄露,保持固定化酶的稳定性,有利于催化剂的反复使用。
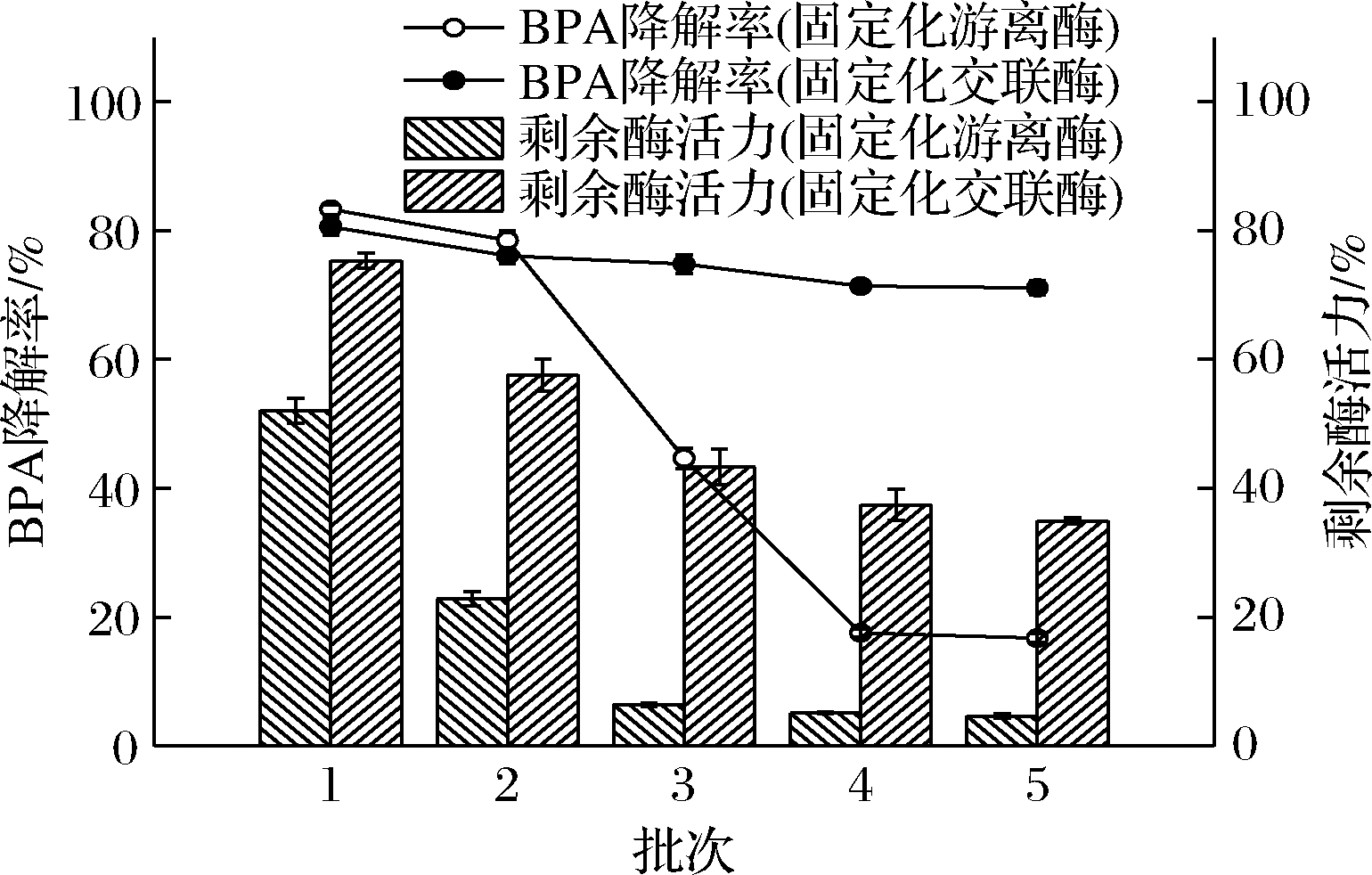
图9 固定化酶重复使用的性能
Fig.9 Reusability of immobilized enzyme
3 结论
本文以海藻酸钠与明胶按照1∶1的质量比例为载体材料协同固定化漆酶,吸取了2种固定化材料的优点,通过添加明胶,增大了固定化酶凝胶颗粒的孔径,克服了常规的海藻酸钠固定化酶中由于凝胶孔径较小而对传质的阻遏。
在常规的包埋法固定化的基础上,通过预先将酶用质量分数为2.0%的戊二醛经过适当的处理,使酶聚集在一起,增大酶蛋白的体积,有效地解决了现有的酶在固定化以及反应过程中,由于酶流失造成的活力下降,使固定化酶的操作稳定性得以提高,而且酶分子所形成的较大体积更适用于大孔径的固定化凝胶,有利于大分子物质的进出。
通过对固定化酶的各项稳定性研究表明,所制备的固定化交联漆酶在稳定性上较固定化游离酶有了较大的提高;在鼓泡式反应器中对BPA进行降解试验,结果表明,连续5个批次的反应以后固定化交联酶剩余酶活力为34.93%,BPA的降解率仍能达到71.13%,分别是固定化游离酶的7.97倍和4.43倍,表明本文所建立的海藻酸钠-明胶协同固定化交联漆酶的方法适合重复性和连续性的操作,具有一定的应用潜力。
[1] ABRAHAM A, CHAKRABORTY P.A review on sources and health impacts of bisphenol A[J].Reviews on Environmental Health, 2020, 35(2):201-210.
[2] PAHIGIAN J M, ZUO Y G.Occurrence, endocrine-related bioeffects and fate of bisphenol A chemical degradation intermediates and impurities:A review[J].Chemosphere, 2018, 207(9):469-480.
[3] DU J K, TANG S G, FAHEEM, et al.Insights into periodate oxidation of bisphenol A mediated by manganese[J].Chemical Engineering Journal, 2019, 369(8):1 034-1 039.
[4] WANG L C, NI X J, CAO, Y H, et al.Adsorption behavior of bisphenol A on CTAB-modified graphite[J].Applied Surface Science, 2018, 428(2):165-170.
[5] NGUYEN T B, HUANG C P, DOONG R A.Photocatalytic degradation of bisphenol A over a ZnFe2O4/TiO2 nanocomposite under visible light[J].Science of the Total Environment, 2019, 646(1):745-756.
[6] BABATABAR S, ZAMIR S M, SHOJAOSADATI S A, et al.Cometabolic degradation of bisphenol A by pure culture of Ralstonia eutropha and metabolic pathway analysis[J].Journal of Bioscience and Bioengineering, 2019, 127(6):732-737.
[7] BRUGNARI T, CONTATO A G, PEREIRA M G, et al.Characterisation of free and immobilised laccases from Ganoderma lucidum:Application on bisphenol a degradation[J].Biocatalysis and Biotransformation, 2021, 39(1):71-80.
[8] GARCIA L F, LACERDA M F A R, THOMAZ D V, et al.Optimization of laccase-alginate-chitosan-based matrix toward 17 α-ethinylestradiol removal[J].Preparative Biochemistry & Biotechnology, 2019, 49(4):375-383.
[9] ZHUANG M J, REN D J, GUO H W, et al.Degradation of 2,4-dichlorophenol contaminated soil by ultrasound-enhanced laccase[J].Environmental Technology, 2021, 42(9):1 428-1 437.
[10] SENTHILVELAN T, KANAGARAJ J, PANDA R C.Effective bioremoval of syntan using fungal laccase to reduce pollution from effluent[J].International Journal of Environmental Science and Technology, 2018, 15(7):1 429-1 440.
[11] UCHIDA H, FUKUDA T, MIYAMOTO H, et al.Polymerization of bisphenol A by purified laccase from Trametes villosa[J].Biochemical and Biophysical Research Communications, 2001, 287(2):355-358.
[12] ZDARTA J, ANTECKA K, FRANKOWSKI R, et al.The effect of operational parameters on the biodegradation of bisphenols by Trametes versicolor laccase immobilized on Hippospongia communis spongin scaffolds[J].Science of the Total Environment, 2018, 615(1):784-795.
[13] OLAJUYIGBE F M, ADETUYI O Y, FATOKUN C O.Characterization of free and immobilized laccase from Cyberlindnera fabianii and application in degradation of bisphenol A[J].International Journal of Biological Macromolecules, 2019, 125:856-864.
[14] GÜR S D,  DIL N, AKSÖZ N.Optimization of enzyme co-immobilization with sodium alginate and glutaraldehyde-activated chitosan beads[J].Applied Biochemistry and Biotechnology, 2018, 184(2):538-552.
DIL N, AKSÖZ N.Optimization of enzyme co-immobilization with sodium alginate and glutaraldehyde-activated chitosan beads[J].Applied Biochemistry and Biotechnology, 2018, 184(2):538-552.
[15] 杨玎玲, 杭华, 黄敏, 等.明胶-海藻酸钠固定化菊糖果糖转移酶[J].食品与发酵工业, 2014, 40(11):132-136.
YANG D L, HANG H, HUANG M, et al.Effect of immobilization with gelatin and sodium alginate on the inulin fructotransferase[J].Food and Fermentation Industries, 2014, 40(11):132-136.
[16] 李晓卉,程丽芳,沐万孟,等.交联海藻酸钠-明胶固定化L-阿拉伯糖异构酶的研究[J].食品工业科技, 2011, 32(8):198-201.
LI X H, CHENG L F, MU W M, et al.Research on the immobilization of L-arabinose isomerase with cross-linked sodium alginate-gelatin[J].Science and Technology of Food Industry, 2011, 32(8):198-201.
[17] 尹春丽, 许乐, 曹珊珊,等.海藻酸钠明胶协同固定S-腺苷甲硫氨酸合成酶[J].精细化工, 2013, 30(5):513-517.
YIN C L, XU L, CAO S S, et al.Research on the immobilization of S-adenosylmethionine synthetase with sodium alginate-gelatin[J].Fine Chemicals, 2013, 30(5):513-517.
[18] 郭良昊, 陈海秀, 李松, 等.Trametes sp.LS-10C固态发酵产漆酶培养基优化及其对双酚A的降解[J].菌物学报, 2020, 39(10):1 948-1 959.
GUO L H, CHEN H X, LI S, et al.Optimization of laccase production by Trametes sp.LS-10C under solid-state fermentation and bisphenol A degradation by the laccase product[J].Mycosystema, 2020, 39(10):1 948-1 959.
[19] 魏胜华, 汤中勋, 张威, 等.转谷氨酰胺酶为交联剂固定化漆酶及其在苹果汁澄清中的应用[J].食品与发酵工业, 2021, 47(21):185-190.
WEI S H, TANG Z X, ZHANG W, et al.Immobilized laccase by transglutaminase and its application in apple juice clarification[J].Food and Fermentation Industries, 2021, 47(21):185-190.
[20] FATHALI Z, REZAEI S, FARAMARZI M A, et al.Catalytic phenol removal using entrapped cross-linked laccase aggregates[J].International Journal of Biological Macromolecules, 2019, 122(2):359-366.
[21] NASEER S, OUYANG J, CHEN X, et al.Immobilization of β-glucosidase by self-catalysis and compared to crosslinking with glutaraldehyde[J].International Journal of Biological Macromolecules, 2020, 154:1 490-1 495.
[22] LASSOUANE F, AÏT-AMAR H, AMRANI S, et al.A promising laccase immobilization approach for Bisphenol A removal from aqueous solutions[J].Bioresource Technology, 2019, 271:360-367.
[23] KUMAR S, HAQ I, PRAKASH J, et al.Improved enzyme properties upon glutaraldehyde cross-linking of alginate entrapped xylanase from Bacillus licheniformis[J].International Journal of Biological Macromolecules, 2017, 98(2):24-33.
[24] DONG Y W, ZHANG Y Q, TU B J.Immobilization of ammonia-oxidizing bacteria by polyvinyl alcohol and sodium alginate[J].Brazilian Journal of Microbiology, 2017, 48(3):515-521.
[25] 张国睿,雷爱祖,童张法.海藻酸钠明胶协同固定化酵母生产ATP[J].食品与发酵工业, 2008, 34(4):16-20.
ZHANG G R, LEI A Z, TONG Z F.Biosynthesis of adenosine 5′-triphosphate by using sodium alginate-gelatin immobilized yeast cells[J].Food and Fermentation Industries, 2008, 34(4):16-20.
[26] NAHAKPAM S, SINGH P, SHAH K.Effect of calcium on immobilization of rice (Oryza sativa L.) peroxidase for bioassays in sodium alginate and agarose gel[J].Biotechnology and Bioprocess Engineering, 2008, 13(5):632-638.
[27] WANG L N, ZHANG H J, LIU X Q, et al.A physically cross-linked sodium alginate-gelatin hydrogel with high mechanical strength[J].ACS Applied Polymer Materials, 2021, 3(6):3 197-3 205.
[28] 魏胜华, 王卫军, 孟娜, 等.氧化葡萄糖酸杆菌的固定化及在鼓泡式反应器中制备乙醇酸[J].精细化工, 2014, 31(4):442-446.
WEI S H, WANG W J, MENG N, et al.Immobilization of Gluconobacter oxydans cells for the preparation of glycolic acid in bubbling reactor[J].Fine Chemicals, 2014, 31(4):442-446.