近来亚麻籽胶引起了人们的广泛研究,亚麻籽胶(flaxseed gum, FSG)是一种亲水胶体,具有良好的乳化性、凝胶性和抗氧化性等功能特性,还具有降血糖、降胆固醇和调节肠道菌群等生理功能,常作为食品配料添加到乳制品、肉制品和果冻制品等食品中来改善食品品质[1-2]。而传统上亚麻子主要用作榨油,榨油副产物亚麻籽饼粕一般用作动物饲料或作为废物处理,造成了很大的资源浪费。
乳清蛋白(whey protein, WP)是干酪加工过程中的副产品,廉价易得,具有良好的生物活性和功能特性,营养价值和安全性很高[3]。然而,其稳定性容易受到外部环境(pH值、盐分、加热等)的影响,为了解决这些问题,目前已有几种提高稳定性的方法,其中糖基化改性法相比其他方法具有绿色、温和、安全等优势[4]。
糖基化反应是指碳水化合物通过共价键的形式与蛋白质结构中的α-或ε-氨基相结合的非酶促反应。反应中会产生还原酮、类黑精等产物,具有较显著的抗氧化性[5]。近期研究显示,此种改性方法可以提高WP抗氧化活性[6-7],除此之外,还具有免疫调节能力、抗过敏及降血压作用等[8]生物活性,对人体健康有一定积极意义。
目前,虽然关于WP的改性研究较多,如FAN等[9]将不同分子质量的葡聚糖与乳清分离蛋白进行糖基化并研究其理化性质;WANG等[10]分别将葡萄糖和果糖与WP进行美拉德反应并研究温度和pH对其凝胶性、流变性等的影响,但与FSG结合的相关研究很少。本研究以FSG与WP为原料,采用湿法糖基化改性法制备亚麻籽胶-乳清蛋白产物(FSG-WP),在单因素及正交试验基础上得出最佳制备条件,并探究FSG蛋白的脱除及不同FSG添加量对FSG-WP抗氧化能力的影响。
1 材料与方法
1.1 材料与试剂
亚麻籽饼粕(冷榨),内蒙古益善园生物科技有限责任公司;WP,恒天然合作社集团有限公司。
抗坏血酸,深圳乐芙生物科技有限公司;DPPH,上海源叶生物科技有限公司;ABTS,上海翌圣生物科技有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS),北京偶和科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、无水亚硫酸钠、KBr(光谱纯)等其他所用试剂均为国产分析纯。
1.2 仪器与设备
Scientz-IID触摸式超声波细胞粉碎机,宁波新芝生物科技股份有限公司;T6-新悦可见分光光度计,北京普析通用仪器有限责任公司;K9860全自动凯氏定氮仪,海能未来技术集团股份有限公司;TM4000扫描电镜,日本株式会社日立高新技术那珂事业所;IRAffinity-1傅里叶变换红外光谱仪,日本岛津公司;荧光分光光度计,上海天美科学仪器有限公司。
1.3 实验方法
1.3.1 FSG制备的操作要点
向原料中以料液比1∶175(g∶mL)加入蒸馏水,250 W超声50 min,过300目滤布取上清液,旋转蒸发进行浓缩然后加入4倍体积乙醇,醇沉12 h后6 000 r/min离心10 min取沉淀,沉淀复溶于5倍体积蒸馏水中,Sevag法除蛋白然后旋蒸除有机溶剂,透析12 h后冷冻干燥。
1.3.2 FSG-WP制备的操作要点[11]
称取0.15 g WP与0.075 g FSG于45 mL蒸馏水中,调节反应pH、温度与时间进行糖基化反应,反应完成后立刻置于冰水中以中断反应并冷却至室温,10 000 r/min离心5 min,取上清液,抽滤后冷冻干燥。
1.3.3 接枝度测定[12]
取0.25 mL样品于2 mL磷酸盐缓冲液(pH 8.2,0.212 5 mol/L)中,混匀后加入1 mL质量分数0.01% TNBS溶液,于50 ℃水浴避光加热反应30 min,加入2 mL的0.1 mol/L无水亚硫酸钠终止反应,室温下静置15 min后,测定波长420 nm下的吸光值,接枝度根据公式(1)计算。
接枝度![]()
(1)
式中:A0,未反应时TNBS所测蛋白的自由氨基数;A,反应完成后TNBS所测蛋白的自由氨基数。
1.3.4 褐变指数测定
取2 mL亚麻籽胶溶液,加入2 mL混合试剂(含质量分数10%的SDS及0.05 mol/L硼砂),在420 nm下测定吸光值,A420即为其褐变指数。
1.3.5 单因素试验
当蛋白质分子中的游离氨基与多糖的羰基缩合时,游离态的氨基转变为结合态,通过测定反应前后体系中游离氨基的含量,可以计算出游离氨基的变化,以反映糖基化反应的程度,故选择接枝度作为指标以进行单因素及正交试验。
以FSG-WP的接枝度为指标,分别调节反应pH值为8、9、10、11、12、13;反应温度为90、100、110、120、130 ℃;反应时间为30、60、90、120、150、180 min进行糖基化反应。
1.3.6 正交试验
以单因素试验结果为基础,选择反应pH值、反应温度、反应时间为3个因素,以FSG-WP的接枝度为指标,进行L9(33)正交试验。
1.3.7 扫描电镜(scanning electron microscopy, SEM)
样品用导电双面胶带固定在样品台上,吹掉多余的粉末,观察其表面微观结构,扫描功率为10 kV。
1.3.8 傅里叶红外光谱(Fourier transform infrared, FT-IR)
称取1 mg样品与100 mg KBr,研磨使其充分混合并压片,在4 000~400 cm-1进行扫描,扫描64次,测定样品前先进行KBr背景的红外光谱测定。
1.3.9 荧光光谱
配制1 mg/mL样品,对于荧光激发光谱,发射波长设定为420 nm,激发波长250~400 nm。对于荧光发射光谱,激发波长设定为280 nm,发射波长300~420 nm,狭缝为2.5 nm,扫描速度为240 nm/min[13-14]。
1.3.10 抗氧化能力测定
·OH清除能力参照王德才等[15]的方法测定;DPPH自由基清除能力参照VON等[16]的方法测定;总还原力参照轩滋等[17]的方法测定;ABTS阳离子自由基清除能力参照THAIPONG等[18]的方法测定。
1.4 数据处理及分析
用Excel 2010、Origin 2019b和SPSS 26进行作图与数据分析。实验结果均以平均值±标准差表示,采用单因素方差分析法进行显著性差异分析,当P<0.05时,表示差异显著。
2 结果与讨论
2.1 亚麻籽胶基础指标含量
原料亚麻籽饼粕水分含量(0.92±0.01)%、蛋白质含量(34.28±0.52)%、灰分含量(5.12±0.17)%、脂肪含量(0.61±0.04)%、膳食纤维含量(59.07±0.72)%。FSG蛋白含量32.44%,多糖含量57.01%。Sevag法脱除蛋白后的FSG蛋白含量26.03%,多糖含量64.50%。
2.2 糖基化反应的单因素及正交试验
2.2.1 pH值对反应接枝度的影响
由图1所示,pH值对反应的接枝度有显著影响(P<0.05)。随着pH值的增加,接枝度呈现先增加后降低的趋势。可能原因是糖基化反应本质上为碱催化反应,故选取碱性环境有利于反应进行,但碱性过强会导致蛋白质的结构发生改变。因此本试验选取pH 11进行反应。

图1 pH值对FSG-WP接枝度的影响
Fig.1 The influence of pH on the grafting degree of FSG-WP
2.2.2 反应温度对反应接枝度的影响
如图2所示,反应温度对FSG-WP接枝度的影响显著(P<0.05),且随反应温度的增加先增高后降低,当温度为100 ℃时,反应接枝度达到最大值,这可能是一定的热处理使蛋白质分子中的ε-氨基基团暴露于表面,有利于FSG与其进行反应[19],而温度过高导致蛋白质分子之间发生聚集,不利于反应的进行,故接枝度降低。因此选取反应温度为100 ℃进行试验。
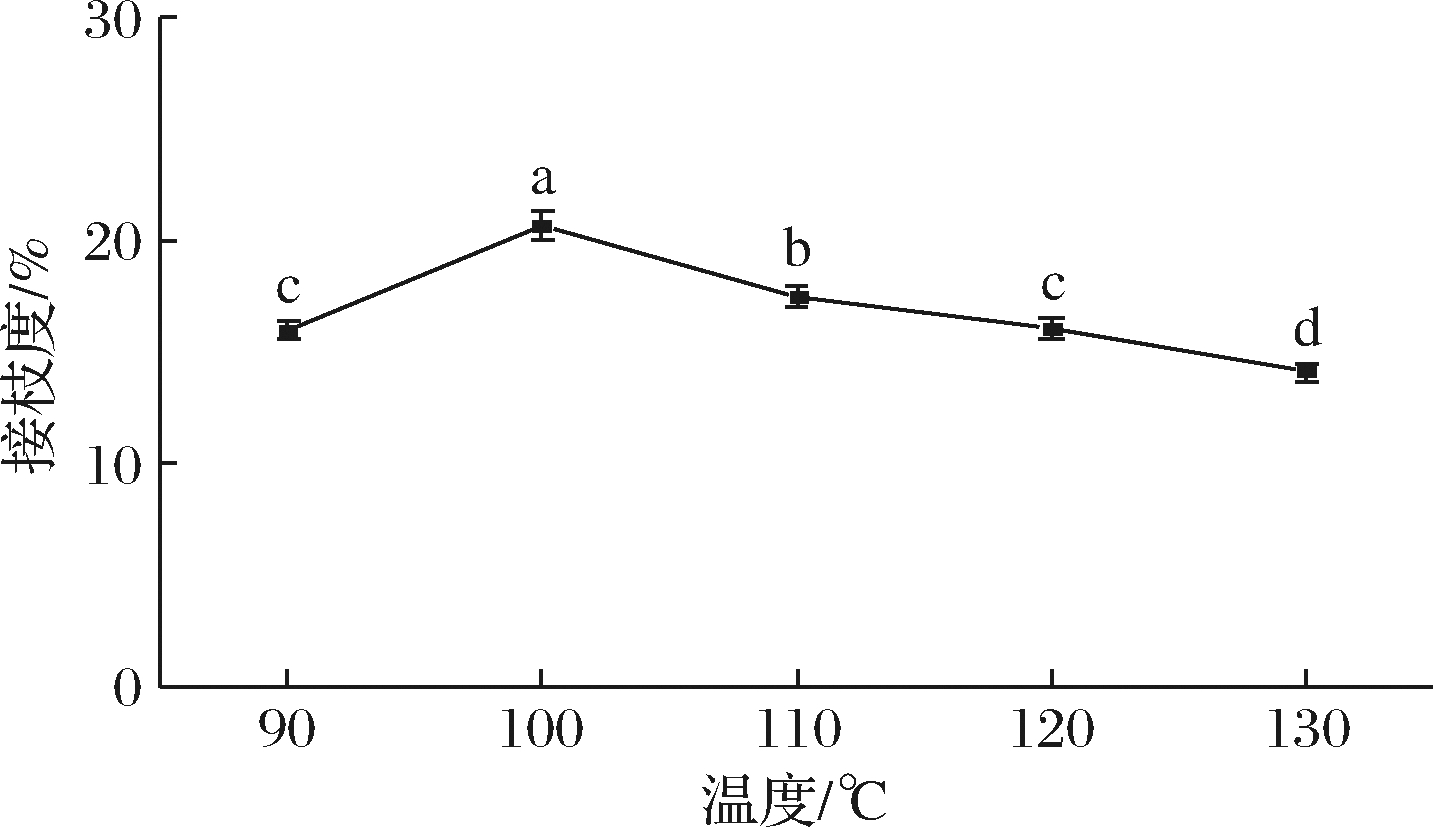
图2 反应温度对FSG-WP接枝度的影响
Fig.2 The effect of reaction temperature on the grafting degree of FSG-WP
2.2.3 反应时间对反应接枝度的影响
由图3可以看到,反应时间对FSG-WP接枝度的影响显著(P<0.05),接枝度随着反应时间的增加先增高后降低,在反应时间为60~90 min,反应接枝度达到最大(P>0.05)。这可能是由于反应初期适当的加热导致蛋白质分子结构伸展,FSG与WP逐渐结合,接枝度升高,但随着受热时间的增加,可能会导致色氨酸被破坏[20],另外反应时间过长部分已接枝的结合物可能发生降解,导致接枝度降低。因此本试验选取反应时间为60 min为宜。
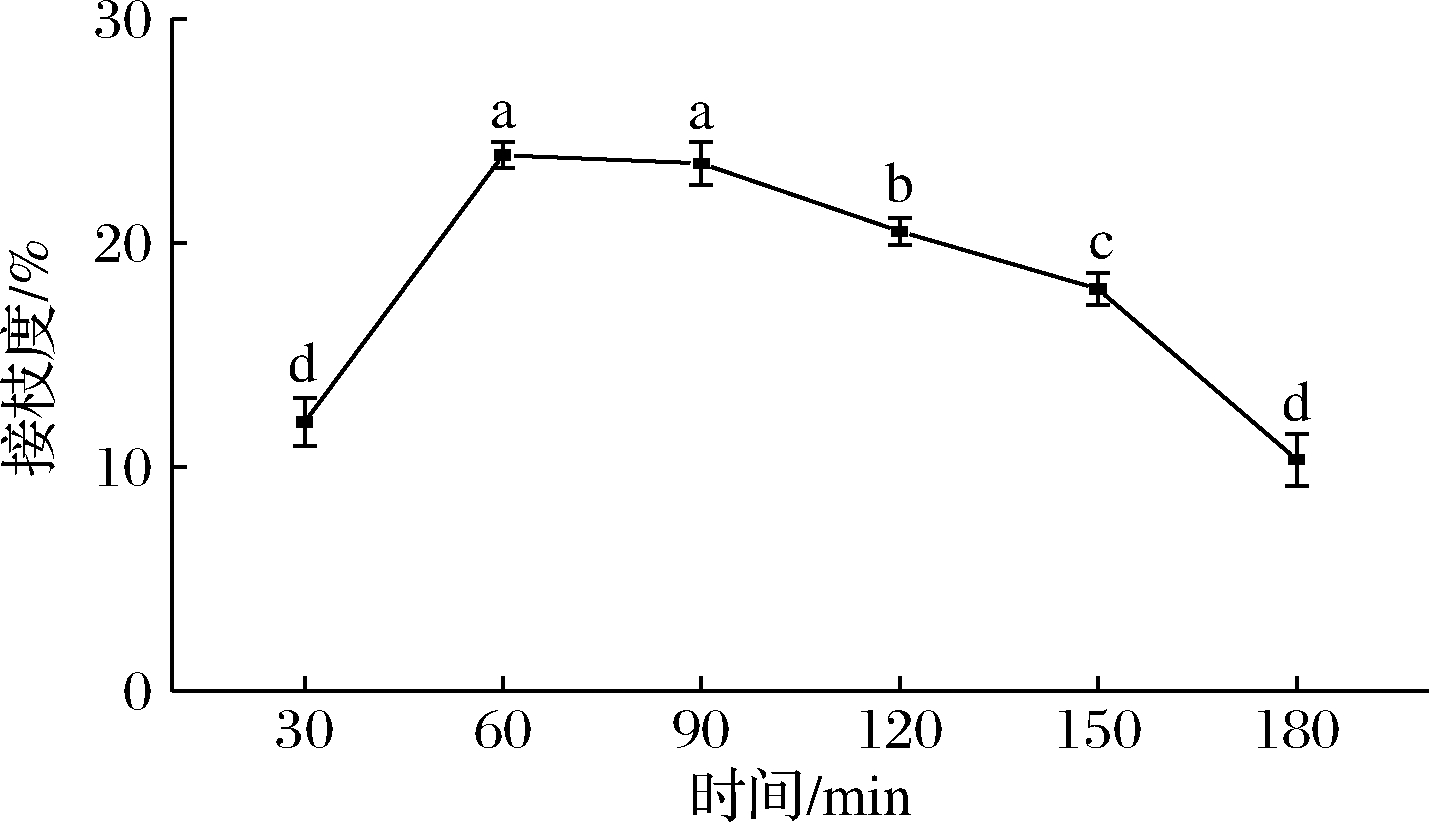
图3 反应时间对FSG-WP接枝度的影响
Fig.3 Effect of reaction time on the grafting degree of FSG-WP
2.2.4 正交试验结果
表1为各个因素的水平设定。由表2可知,空列(D因素)的极差值为4.44,A,B,C各因素的极差Rj值均大于空列极差值,可以看出A、B、C各因素的水平效应是存在差异的,说明试验具有可靠性。3个因素主次关系为B(反应温度)>C(反应时间)>A(pH值),从9个处理组中可以直观地找出最优水平组合为6组,即A2B3C1,接枝度为25.07%,而正交优化最佳水平组合也为A2B3C1,故得出最佳条件为pH 11、110 ℃、60 min。
表1 L9(33)正交设计因素水平表
Table 1 Factors and levels table of orthogonal test

因素A(pH)B(反应温度)/℃C(反应时间)/min110906021110090312110120
表2 正交试验结果
Table 2 Results of orthogonal experiment

序号A(pH)B(反应温度)/℃C(反应时间)/minD(空列)接枝度/%1111115.61212229.073133316.934212315.13522313.316231225.07731328.558321310.399332110.45K1j13.8713.1017.029.79K2j14.507.5911.5514.23K3j9.8017.489.6014.15Rj4.709.897.424.44最优组合A2B3C1
2.3 扫描电镜测定结果
图4-a和4-b分别为WP与热处理WP的微观结构图,其中热处理WP是在与FSG-WP同等制备条件下处理制备得到的,可以看到WP为球状,表面凹凸不平,而高温使WP发生自凝聚,凝聚后的WP呈现片状,表面相对平整光滑。由图4-c可以看到,FSG呈立体的多网孔片状结构,其孔洞的产生归因于高超声波能量及超声处理可能会导致大量的空化气泡,将大聚集体碎裂成小的颗粒,故FSG呈碎片状。从图4-d可以看到FSG-WP呈现出有嵌入、结合的结构状态,且可以明显观察到FSG-WP的微观表面结构较高温后的WP呈更立体、有序排列的片型结构,这可能是WP与FSG反应后,结构发生改变,反应后的FSG-WP具有了部分FSG微观表面的特征。

a-WP;b-热处理WP;c-FSG;d-FSG-WP
图4 WP、热处理WP、FSG、FSG-WP的微观表面结构图
Fig.4 Scanning electron microscopy data of WP, heated WP, FSG, FSG-WP
2.4 红外光谱测定结果
由图5可知,FSG-WP在3 700~3 200 cm-1和1 700~1 000 cm-1的吸收峰对比WP都有所增加,它们分别是—OH和—CO键的吸收峰,3 200~2 800 cm-1是—CH的特征伸缩振动吸收峰,另外,FSG-WP在1 250~900 cm-1处的吸收峰有明显的增强和变化,这可能是由于—CN和—CO键的伸缩振动加强所致[21]。这进一步说明了FSG与WP发生了糖基化反应。此外,FSG-WP在酰胺III(1 450~1 240 cm-1)处的吸收峰发生改变,这是因为糖基化反应消耗了一些羰基和氨基,并生成了Amadori化合物(C![]() O),席夫碱(C
O),席夫碱(C![]() N)和吡嗪(C—N),从而导致了峰强度和位置的改变。
N)和吡嗪(C—N),从而导致了峰强度和位置的改变。
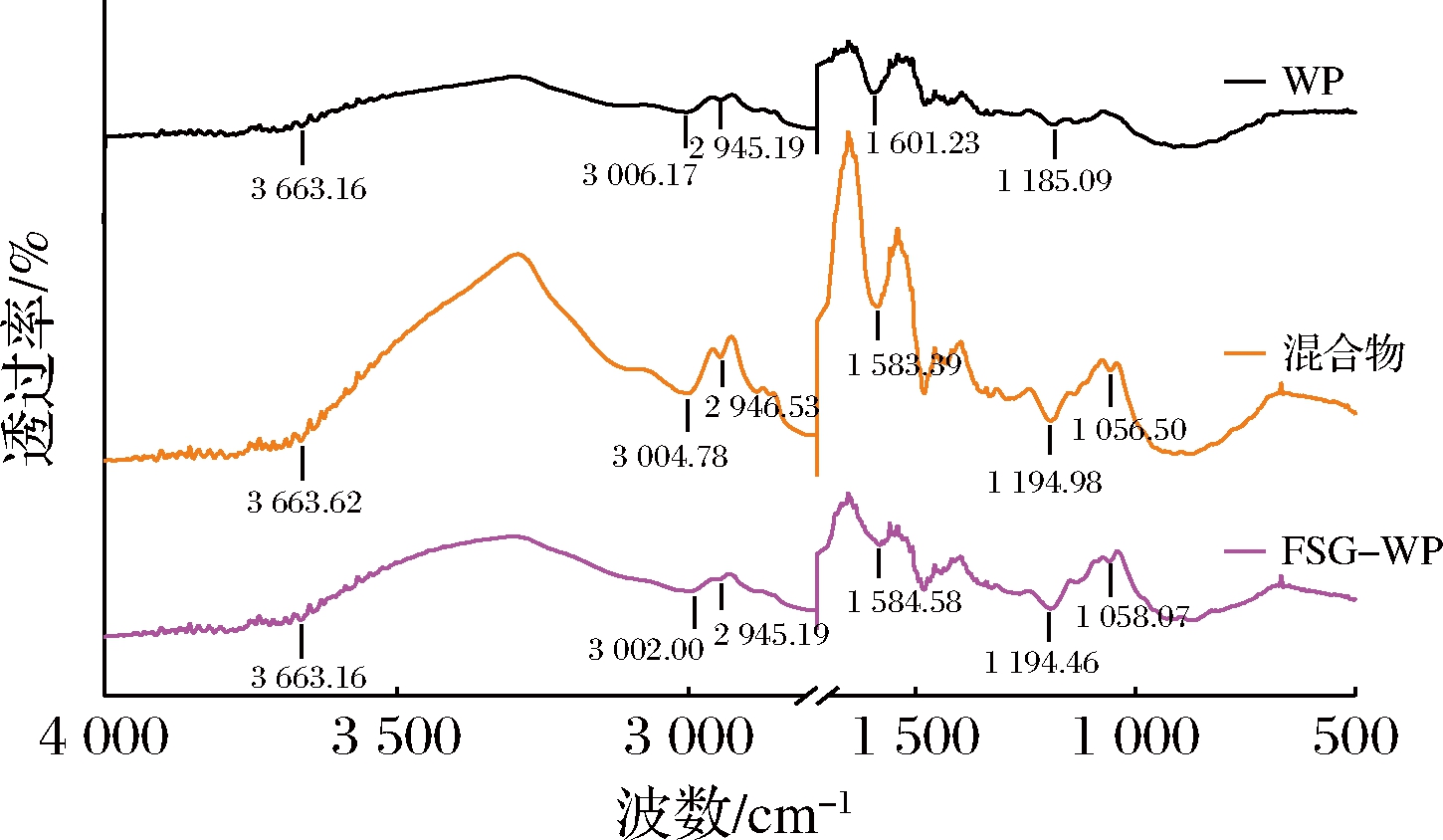
图5 WP、FSG与WP的物理混合物、FSG-WP的红外光谱图
Fig.5 FT-IR spectra of native WP,mixture,and FSG-WP conjugate
2.5 荧光光谱测定结果
已有研究表明,当蛋白质与多糖发生糖基化反应时会产生荧光物质,这些带有荧光发色基团的产物是通过席夫碱和给电子基团之间的共轭反应形成的,可以作为糖基化反应发生的指标[22]。糖基化反应中产生的荧光物质的最大激发波长在340~370 nm,最大发射波长在420~450 nm。内源性荧光光谱可以用来反映芳香族氨基酸荧光强度的变化,通常是色氨酸的荧光发射被用作蛋白质构象变化的指示剂[23],以此间接反映蛋白质三级结构的变化,进而反映糖基化反应的进行,天然蛋白质荧光的最大激发波长和最大发射波长分别为290和336 nm[13,22]。
由图6-a可以观察到,它们的荧光发射最大值(λmax)分别在328、334、340 nm。

a-荧光发射光谱;b-荧光激发光谱
图6 WP、热处理WP、FSG-WP的荧光发射光谱与WP、FSG、FSG-WP的荧光激发光谱
Fig.6 Fluorescence emission spectra of WP, heated WP, FSG-WP,and fluorescence excitation spectra of WP, FSG, FSG-WP
与WP相比,加热后WP的最大荧光强度增加,这表明内部的色氨酸残基在加热处理后逐渐暴露在分子表面上。与WP相比FSG-WP的荧光强度降低,以前的研究也出现了类似的结果[7],且其λmax向更高波长轻微偏移,这可能归因于多糖链的屏蔽效应[24]。从图6-b可以看出,所有样品在290 nm左右具有最大激发波长,而FSG-WP在341 nm处具有另一个高峰,这表明FSG和WP之间形成了共价结合[25]。
2.6 FSG添加量及蛋白的脱除对产物接枝度及褐变指数的影响
考虑到FSG蛋白的脱除可能会对FSG-WP的形成有影响,故分别制备产物并进行比较。由图7-a可以看到,随着2种FSG添加量的增加其接枝度亦有不同程度增加。可能原因是当反应体系中FSG浓度增大,其与蛋白之间碰撞的几率大大增加,促进反应的进行。当FSG和脱蛋白后的FSG与WP质量比为3∶1时,接枝度分别达到(40.56±0.51)%、(45.95±2.01)%,可能的原因是FSG脱除自身结合的蛋白分子后,暴露出更多的结合位点,有利于反应的进行。

a-接枝度;b-褐变指数
图7 不同FSG与WP质量比下FSG-WP的接枝度及褐变指数
Fig.7 Grafting degree and browning degree of FSG-WP at different FSG and WP mass ratios
根据图7-b所示,随着2种FSG添加量的增加,其褐变指数均有不同程度增加,褐变指数升高的主要原因是底物浓度提高导致体系黏度增大、水分含量降低,这种情况下长时间受热可能使焦糖化反应更加剧烈,颜色加深[20]。FSG-WP的褐变程度高于脱蛋白后的FSG-WP,蛋白的脱除减少了FSG-WP产物中褐色物质的产生,这种褐色物质为反应末期的产物类黑精,类黑精具有很强的抗氧化性[26],故推测未脱蛋白的FSG-WP抗氧化能力更强。
2.7 FSG-WP抗氧化能力的测定与比较分析
2.7.1 FSG-WP抗氧化能力的测定
由图8可以看出,随着FSG添加量的增加,其3种自由基清除能力亦有不同程度增加,且皆在m(FSG)∶m(WP)=1∶1后增加趋势减慢。FSG-WP清除·OH能力与清除DPPH自由基能力均高于脱蛋白后的FSG-WP,而清除ABTS阳离子自由基的能力基本一致。如图9所示,FSG添加量对FSG-WP的总还原力有影响,且存在量效关系,总还原力随FSG添加量增加而增加,其中脱除蛋白后的FSG-WP在FSG添加量达到200%后增加趋势减缓,而未脱蛋白的FSG-WP在最高添加量为300%的范围内均呈现较高的上升趋势,可以看出FSG-WP的总还原力高于脱蛋白后的FSG-WP。

a-·OH清除活性;b-DPPH自由基清除活性;c-ABTS阳离子自由基清除活性
图8 FSG-WP的·OH、DPPH自由基、ABTS阳离子自由基的清除能力
Fig.8 ·OH radical, DPPH radical, and ABTS cation radical scavenging ability of FSG-WP

图9 FSG-WP的总还原力
Fig.9 Reducing power of FSG-WP
2.7.2 抗氧化能力的比较分析
对WP、热处理WP、脱蛋白前后的FSG和FSG-WP的抗氧化能力比较分析如图10所示。
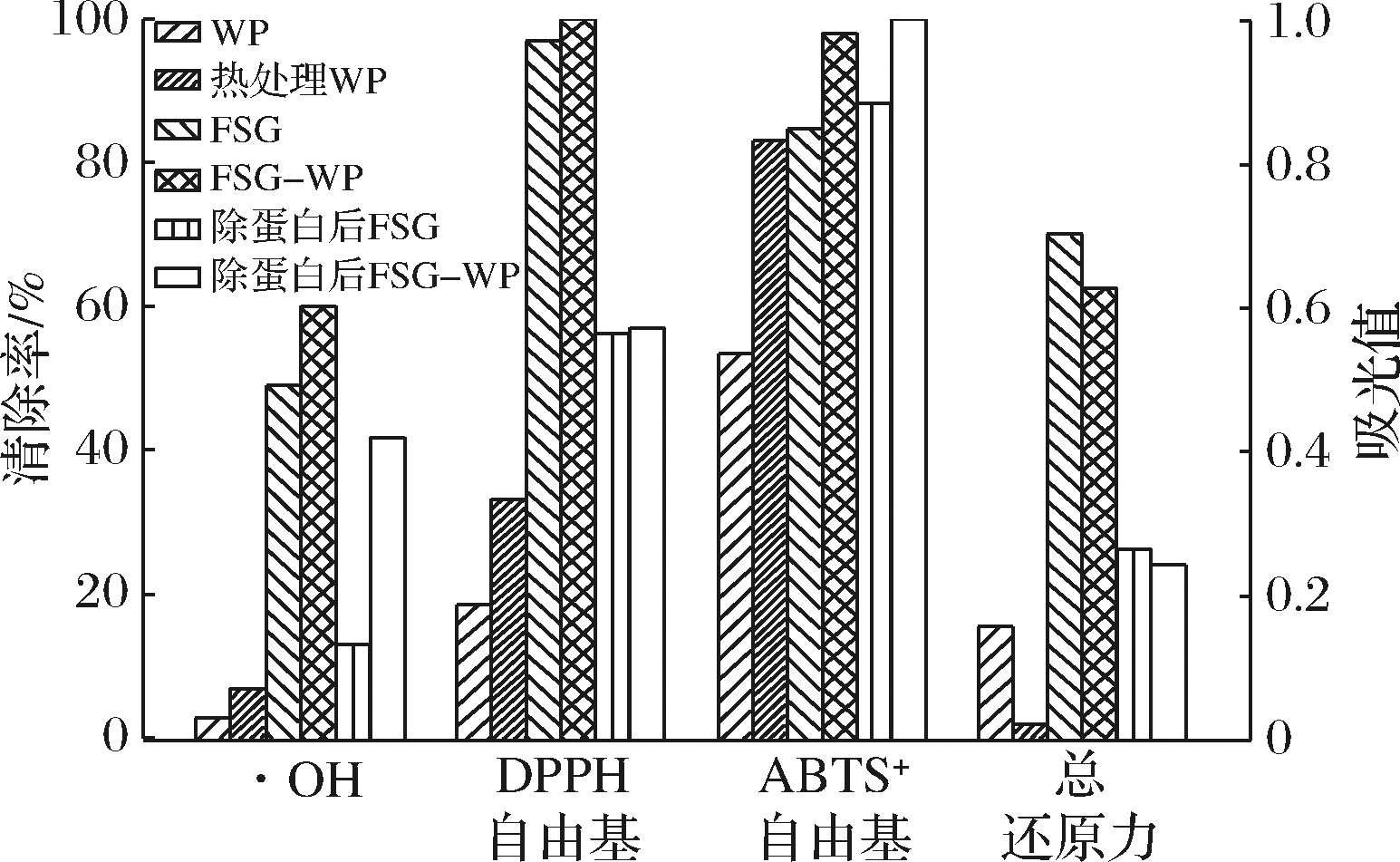
图10 抗氧化能力比较
Fig.10 Comparison of antioxidant capacity
对比WP与热处理WP的抗氧化能力可知,热处理WP的·OH、DPPH自由基、ABTS阳离子自由基清除率均高于WP,而总还原力低于WP。因热处理后WP结构发生改变,形成聚合乳清蛋白,而聚合乳清蛋白已有研究证明其具有良好的持水力和稳定性等一系列性能[27],FSG-WP的制备也是在高温下进行,故将其与WP及FSG-WP改性物做对比,比较其抗氧化性能。热处理的WP总还原力较WP低,FSG-WP的总还原力较FSG降低,脱蛋白后的FSG-WP总还原力较脱蛋白后的FSG降低,其原因可能是产物中的还原酮类物质因长时间的加热被分解,导致产物总还原力下降,这与TAN等[28]研究结果相似。
分别对比脱除蛋白前后的FSG-WP与热处理WP的抗氧化能力发现,2种FSG-WP的抗氧化能力均高于高温处理WP,由此可见,脱蛋白前后FSG-WP抗氧化能力的升高是FSG与WP相互作用的结果,并非是WP或高温处理下形成的聚合乳清蛋白单独起作用。
对脱蛋白前后的FSG-WP的抗氧化能力进行分析,可以看到FSG-WP的·OH、DPPH自由基清除率、总还原力均高于脱蛋白的FSG-WP,ABTS阳离子自由基清除率低于脱蛋白FSG-WP,对脱蛋白前后FSG的抗氧化能力进行分析也得到同样的结果。由此可以看出,产物与反应底物间的抗氧化能力有一定的联系,底物的抗氧化能力可能决定了产物的抗氧化能力。这一结果也证实了上述推测。
对比FSG与脱蛋白FSG-WP的抗氧化能力发现,FSG的·OH、DPPH自由基清除率及总还原力均高于脱蛋白FSG-WP,ABTS阳离子自由基清除率低于脱蛋白FSG-WP。由此分析得出,将FSG进行脱蛋白后又通过糖基化反应引入外源蛋白质(WP),所得产物抗氧化能力不及FSG,这可能与蛋白脱除过程中对胶体造成的某些破坏有关,也可能与引入蛋白质的种类有关,具体原因有待进一步研究。
综合来看,本试验制备的FSG-WP较反应底物FSG和WP而言,具有更好的抗氧化能力。与辛小丽等[11]制备的FSG-WP产物相比,本实验制备的FSG-WP和脱蛋白后FSG-WP具有更好的清除DPPH自由基能力,这可能是由FSG原料来源、提取工艺或产物制备方法不同所导致的。
2.7.3 相关性分析
如表3所示,FSG添加量与FSG-WP接枝度、褐变程度和总还原力均呈极显著正相关(P<0.01),FSG添加量与清除·OH、DPPH自由基、ABTS阳离子自由基能力均呈显著正相关(P<0.05);FSG-WP接枝度与其褐变指数、总还原力、清除ABTS阳离子自由基能力呈极显著正相关(P<0.01)。
表3 相关性分析
Table 3 Correlation analysis

指标12345671120.931**131.000**0.932**140.811*0.771*0.804*150.998**0.938**0.997**0.830*160.775*0.864*0.770*0.835*0.809*170.863*0.922**0.862*0.889**0.887**0.965**1
注:1-FSG添加量;2-接枝度,3-褐变指数;4-清除·OH能力;5-总还原力;6-清除DPPH自由基能力;7-清除ABTS阳离子自由基能力;*和**分别表示在P<0.05水平显著相关和P<0.01水平极显著相关
如表4所示,脱蛋白后FSG添加量与脱蛋白后FSG-WP接枝度、褐变程度、清除·OH能力、总还原力和清除DPPH自由基能力均呈极显著正相关(P<0.01),与清除ABTS阳离子自由基能力呈显著正相关(P<0.05);脱蛋白后FSG-WP接枝度与其褐变指数、清除·OH能力、总还原力和清除DPPH自由基能力均呈极显著正相关(P<0.01),与清除ABTS阳离子自由基能力呈显著正相关(P<0.05)。以上结果进一步证实了2.7.2中的比较分析结果。
表4 相关性分析
Table 4 Correlation analysis

指标12345671120.928**130.987**0.887**140.876**0.877**0.799*150.971**0.908**0.932**0.958**160.969**0.934**0.924**0.967**0.995**170.844*0.869*0.756*0.987**0.935**0.941**1
注:1-脱蛋白后FSG添加量;2-接枝度;3-褐变指数;4-清除·OH能力;5-总还原力;6-清除DPPH自由基能力;7-清除ABTS阳离子自由基能力;*和**分别表示在P<0.05水平显著相关和P<0.01水平极显著相关
3 结论
本研究旨在探讨糖基化反应生成的FSG-WP的功能特性,以探索FSG与WP在食品工业中的潜在应用。在单因素及正交试验的基础上制备了FSG-WP产物,采用扫描电镜、傅里叶红外光谱与荧光分析结合接枝度测定证实了FSG-WP结合物的形成。抗氧化性比较分析可得,FSG抗氧化性高于脱蛋白后的FSG,与此相应,FSG-WP抗氧化性高于脱蛋白后的FSG-WP;FSG-WP较单一FSG和WP而言具有更好的抗氧化能力,这说明FSG与WP的成功结合增强了两者的功能性质。进行相关性分析得到脱蛋白前后的FSG添加量与其产物的接枝度、抗氧化能力均呈正相关。本研究为开发扩大FSG和WP在食品中的应用提供了参考。
[1] 禹晓, 黄沙沙, 聂成镇, 等.亚麻籽胶结构及功能应用研究进展[J].食品研究与开发, 2020, 41(1):212-217.
YU X, HUANG S S, NIE C Z, et al.Research progress of the structure and functional application of flaxseed gum[J].Food Research and Development, 2020, 41(1):212-217.
[2] HU Y X, SHIM Y Y, REANEY M J T.Flaxseed gum solution functional properties[J].Foods (Basel, Switzerland), 2020, 9(5):681.
[3] DE CASTRO R J S, DOMINGUES M A F, OHARA A, et al.Whey protein as a key component in food systems:Physicochemical properties, production technologies and applications[J].Food Structure, 2017, 14:17-29.
[4] ZHAO C B, YIN H H, YAN J N, et al.Structure and acid-induced gelation properties of soy protein isolate-maltodextrin glycation conjugates with ultrasonic pretreatment[J].Food Hydrocolloids, 2021, 112:106278.
[5] 艾正文, 于鹏, 桂敏.糖基化反应对乳清蛋白功能特性影响的研究进展[J].食品科技, 2020, 45(10):248-252.
AI Z W, YU P, GUI M.Research progress on the effect of glycosylation on the functional properties of whey protein[J].Food Science and Technology, 2020, 45(10):248-252.
[6] 杜玲玲, 刘璐, 李晓东, 等.美拉德反应对乳清分离蛋白及其水解物抗氧化性的影响[J].食品科学, 2017, 38(1):171-176.
DU L L, LIU L, LI X D, et al.Effect of Maillard reaction on antioxidant activity of whey protein isolate and its hydrolysate[J].Food Science, 2017, 38(1):171-176.
[7] LIU Q, KONG B H, HAN J C, et al.Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions[J].Food Structure, 2014, 1(2):145-154.
[8] MUSCAT S, PELKA J, HEGELE J, et al.Coffee and Maillard products activate NF-κB in macrophages via H2O2 production[J].Molecular Nutrition & Food Research, 2007, 51(5):525-535.
[9] FAN Y T, YI J, ZHANG Y Z, et al.Physicochemical stability and in vitro bioaccessibility of β-carotene nanoemulsions stabilized with whey protein-dextran conjugates[J].Food Hydrocolloids, 2017, 63:256-264.
[10] WANG W Q, YUAN P P, ZHOU J Y, et al.Effect of temperature and pH on the gelation, rheology, texture, and structural properties of whey protein and sugar gels based on Maillard reaction[J].Journal of Food Science, 2021, 86(4):1 228-1 242.
[11] 辛小丽, 张炜, 雷蕾, 等.乳清蛋白-亚麻籽胶体系抗氧化产物的制备[J].化学世界, 2020, 61(5):328-335.
XIN X L, ZHANG W, LEI L, et al.Preparation of anti-oxidation products of whey protein-flaxseed gum mixing system[J].Chemical World, 2020, 61(5):328-335.
[12] 刘娟, 卢蓉蓉.酪蛋白湿法糖基化改性研究[J].食品与发酵工业, 2008, 34(10):49-52.
LIU J, LU R R.Study of casein-dextran graft reaction by wet-heating[J].Food and Fermentation Industries, 2008, 34(10):49-52.
[13] GUO X B, GUO X M, YU S J, et al.Influences of the different chemical components of sugar beet pectin on the emulsifying performance of conjugates formed between sugar beet pectin and whey protein isolate[J].Food Hydrocolloids, 2018, 82:1-10.
[14] PIRESTANI S, NASIRPOUR A, KERAMAT J, et al.Structural properties of canola protein isolate-gum Arabic Maillard conjugate in an aqueous model system[J].Food Hydrocolloids, 2018, 79:228-234.
[15] 王德才, 高丽君, 高艳霞.杭白芷多糖体外抗氧化活性的研究[J].时珍国医国药, 2009, 20(1):173-174.
WANG D C, GAO L J, GAO Y X.Antioxidative effects of polysaccharide from Radix angelicae dahurica in vitro[J].Lishizhen Medicine and Materia Medica Research, 2009, 20(1):173-174.
[16] VON STASZEWSKI M, PILOSOF A M R, JAGUS R J.Antioxidant and antimicrobial performance of different Argentinean green tea varieties as affected by whey proteins[J].Food Chemistry, 2011, 125(1):186-192.
[17] 轩滋, 李华, 郭艳艳.EGCG对美拉德反应产物抗氧化性能的影响[J].河南工业大学学报(自然科学版), 2021, 42(1):22-26;55.
XUAN Z, LI H, GUO Y Y.Effect of EGCG on antioxidant properties of Maillard reaction products[J].Journal of Henan University of Technology(Natural Science Edition), 2021, 42(1):22-26;55.
[18] THAIPONG K, BOONPRAKOB U, CROSBY K, et al.Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis, 2006, 19(6-7):669-675.
[19] 陈正军, 张文斌, 杨瑞金, 等.美拉德反应产物的制备及在混合油脂微胶囊中的应用[J].食品工业科技, 2020, 41(19):166-171;178.
CHEN Z J, ZHANG W B, YANG R J, et al.Preparation of Maillard reaction products and its application on microencapsulation of mixed oil[J].Science and Technology of Food Industry, 2020, 41(19):166-171;178.
[20] GUO Y, BAO Y H, CHAI Y Y.Preparation of microcapsule antioxidative wall materials of pine nut oil by the Maillard reaction[J].Journal of the Science of Food and Agriculture, 2019, 99(6):2 793-2 801.
[21] 刘兴丽, 杨龙松, 张艳艳, 等.多糖对马铃薯蛋白糖基化产物乳化特性及结构的影响[J].食品科技, 2020, 45(12):208-214.
LIU X L, YANG L S, ZHANG Y Y, et al.Effect of polysaccharides on emulsification characteristics and structure of potato protein glycosylation products[J].Food Science and Technology, 2020, 45(12):208-214.
[22] MATIACEVICH S B, BUERA M P.A critical evaluation of fluorescence as a potential marker for the Maillard reaction[J].Food Chemistry, 2006, 95(3):423-430.
[23] LI Y, LIU B H, JIANG L Z, et al.Interaction of soybean protein isolate and phosphatidylcholine in nanoemulsions:A fluorescence analysis[J].Food Hydrocolloids, 2019, 87:814-829.
[24] SPOTTI M J, MARTINEZ M J, PILOSOF A M R, et al.Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems[J].Food Hydrocolloids, 2014, 39:223-230.
[25] WANG W D, LI C, BIN Z, et al.Physicochemical properties and bioactivity of whey protein isolate-inulin conjugates obtained by Maillard reaction[J].International Journal of Biological Macromolecules, 2020, 150:326-335.
[26] 戚繁. 美拉德反应在食品工业中的研究进展[J].现代食品, 2020(19):44-46.
QI F.Research progress of Maillard reaction in food industry[J].Modern Food, 2020(19):44-46.
[27] 张雪飞. 热诱导聚合乳清蛋白功能特性及其机理研究[D].长春:吉林大学, 2019.
ZHANG X F.Systematical characterization of functional properties and mechanisms ofthermal-induced polymerized whey protein[D].Changchun:Jilin University, 2019.
[28] TAN J E, LIU T T, YAO Y, et al.Changes in physicochemical and antioxidant properties of egg white during the Maillard reaction induced by alkali[J].LWT, 2021, 143:111151.