豌豆蛋白是一种新兴的优质植物蛋白[1-3],因其高蛋白含量、高消化率、低致敏性且富含促进人体肌肉增长的赖氨酸而越来越受欢迎[4]。豌豆分离蛋白(pea protein isolate, PPI)可添加到饮料、肉制品以及面点等食品中,不仅可以提高产品性能[5],还可以作为营养强化剂,补充人体谷物蛋白质,均衡营养[6]。豌豆蛋白可作为传统动物蛋白及大豆蛋白的替代品应用于食品开发,提高食品的营养价值和功能特性,因此有良好的发展潜力。
在我国,目前豌豆蛋白主要是作为豌豆加工的副产物应用于饲料加工中,造成了利用率低和蛋白资源浪费的问题[7]。豌豆蛋白具有强烈的且不易消除和掩盖的不良风味,风味是豌豆蛋白产品开发的关键技术问题之一。豌豆低聚肽在制备过程中往往会产生苦味,严重影响其口感品质。水解过程中,在肽链末端产生的疏水性氨基酸通常会使肽呈现苦味,且多数苦味肽是由2~10个氨基酸组成的小分子肽[8]。
酶水解是目前降低肽类苦味的有效方法[9-12]。羧肽酶(carboxypeptidases)是一类外切蛋白酶,能够从蛋白质或多肽链的C端特异性切割产生游离羧基酸,在蛋白水解产品的脱苦及风味改善中起重要作用[13]。然而目前尚未有成熟的商品羧肽酶应用于食品中,关于羧肽酶的研究仍主要集中在异源表达、分离纯化及性质表征等方面[14-15]。因此,开发可应用于食品的新型羧肽酶能有效填补市场空白。本研究利用前期已获得的一种新型羧肽酶M32制备低苦味豌豆低聚肽,该酶具有较好的耐热性(最适温度为60 ℃),与已报道的羧肽酶A、羧肽酶B和羧肽酶Y相比,对C末端氨基酸具有更高的广谱性,偏好水解疏水性较强的氨基酸残基,且该酶的最适pH为8.0,可直接在碱性环境中与内切酶(碱性蛋白酶)复配使用。本研究采用碱性蛋白酶和新型羧肽酶M32制备低苦味豌豆低聚肽,并评价其溶解性、水解度、分子质量分布、风味变化及抗氧化活性等,以探究该酶在低聚肽制备中的潜在能力,为植物蛋白的深加工提供理论依据。
1 材料与方法
1.1 原料与试剂
PPI,上海源叶生物科技有限公司;FeSO4、三氯乙酸、Na2HPO4、碱性蛋白酶,北京索莱宝科技有限公司;DPPH自由基、底物Z-Glu-Tyr,上海麦克林生化科技有限公司。
1.2 仪器与设备
HH-60恒温水浴锅,苏州威尔实验仪器;TU-1810紫外分光光度计,北京普析通用公司;SA402B味觉分析系统,日本INSENT公司;H1850R高速冷冻离心机,湖南湘仪公司。
1.3 试验方法
1.3.1 羧肽酶M32的获得
利用本实验室构建的1株羧肽酶M32重组枯草芽孢杆菌WB600表达菌株。发酵液通过盐析,Ni柱纯化后得到羧肽酶M32(5 000 U/mL)。
1.3.2 豌豆低聚肽的制备
配制50 mg/mL的PPI溶液,沸水浴10 min,迅速放入冷水中冷却至室温,在温度50 ℃,pH 7.0的条件下,加入酶底比4%的碱性蛋白酶,水解1.5 h,得到豌豆多肽(pea protein isolate hydrolysed by alkaline protease, PPIA),然后100 ℃水浴灭酶10 min,冷却至室温,加入酶底比4%的羧肽酶M32继续酶解,依次在不同温度(30、40、50、60、70 ℃),不同pH(5、6、7、8、9),不同酶解时间(0.5、1、1.5、2、2.5 h),不同底物质量浓度下(20、40、60、80、100 g/L)进行单因素优化,获得豌豆分离蛋白双酶酶解液(pea protein isolate hydrolysed by alkaline protease and carboxypeptidase M32, PPIACP),沸水浴10 min灭酶。8 000 r/min,离心15 min,取上清液,冻干后-20 ℃冷冻备用。
1.3.3 水解度测定
采用邻苯二甲醛(O-phthalaldehyde, OPA)法测定酶解液的水解度,按照公式(1)计算:
水解度![]()
(1)
式中:n(SerNH2),每克PPI的氨基当量,mmol;α,常数0.97;β,常数0.34;htot,常数7.80。
1.3.4 溶解性测定
配制1%的样品溶液,调节pH为7.0,混合振荡1 min,10 000 r/min,离心15 min取上清液。溶解性按照公式(2)计算:
溶解性![]()
(2)
1.3.5 DPPH自由基清除活性的测定
采用比色法,用无水乙醇将DPPH配成0.01 mg/mL溶液,与样品均匀混合,避光处理30 min,在517 nm下测定样品的吸光度,DPPH自由基清除率按照公式(3)计算:
DPPH自由基清除率![]()
(3)
式中:Ai,100 μL蛋白水解液+100 μL 0.01 mg/mL DPPH无水乙醇溶液的吸光度;Aj,100 μL蛋白水解液+100 μL空白试剂(无水乙醇)的吸光度;A0,100 μL 0.01 mg/mL DPPH无水乙醇溶液+空白试剂(无水乙醇)的吸光度。
1.3.6 ·OH清除活性的测定
采用Fenton反应,利用H2O2与Fe2+混合产生·OH,在该体系中加入水杨酸捕捉·OH并产生有色物质,该物质在510 nm处有最大吸收。加入不同含量PPI酶解液50 μL,50 μL 9 mmol/L FeSO4,50 μL 10 mmol/L水杨酸,50 μL 8.8 mmol/L H2O2混匀,37 ℃反应30 min后,于510 nm处测定样品吸光度Ai,将体系中的样品改为加入50 μL蒸馏水,测定空白对照吸光度A0,向体系中加入50 μL蒸馏水代替8.8 mmol/L H2O2时,测定样品本底吸光度Aj,其中每个质量的样品浓度做3个平行,以维生素C作阳性对照。·OH清除率按照公式(4)计算:
·OH清除率![]()
(4)
1.3.7 氨基酸的测定
采用氨基酸高效液相色谱仪测定。
1.3.8 电子舌
使用味觉传感系统对PPI酶解液风味进行评估。以标准液为对照液,采用电子舌味觉传感器CTO(咸味)、AAE(鲜味)和COO(苦味)分别对PPI酶解产物的咸、鲜、苦、苦余味和丰富度进行分析。
1.3.9 统计分析
以上测定均为3组平行试验,结果取3组试验数据的平均值。利用SPSS 24.0软件进行数据统计计算,P<0.05表示具有显著性差异。试验数据图均利用Origin 2021软件绘制。
2 结果与分析
2.1 羧肽酶M32酶解PPIA最适条件优化
PPI经碱性蛋白酶初步水解后,以水解度为初步考察指标,分别对影响羧肽酶M32酶解效果的温度、pH、酶解时间和底物浓度进行优化。由图1可知,羧肽酶M32酶解PPIA的最适条件为60 ℃,pH 7,酶解时间2 h,底物质量浓度60 g/L,此时水解度可达15.4%。羧肽酶M32属于耐热蛋白酶,其最适酶解温度是60 ℃,较高的酶解温度有利于提高酶活力,而水解度的提高有利于打开PPI的结构,使更多的基团暴露,有利于后续的羧肽酶M32发现更多的酶解位点。
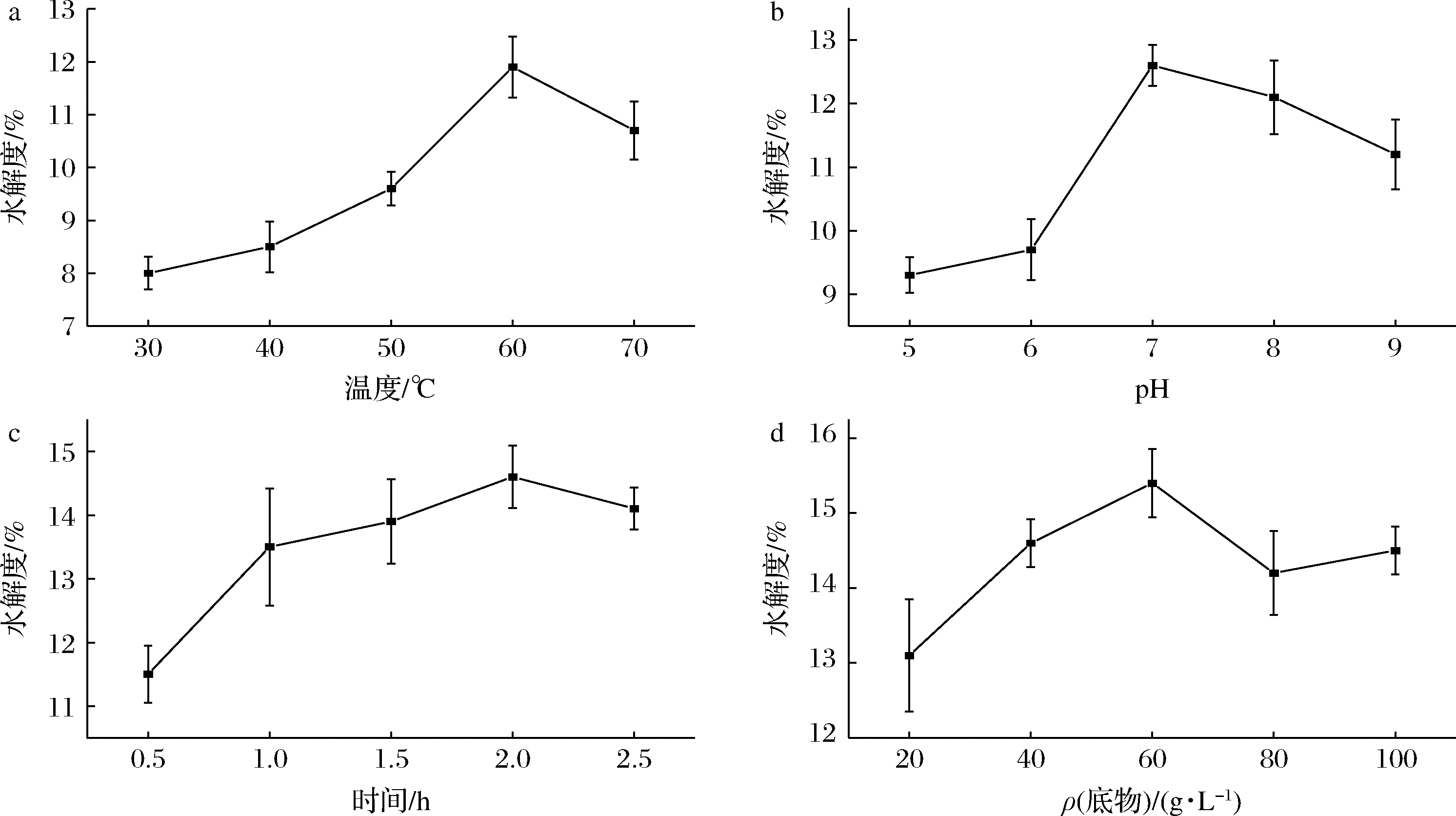
a-温度;b-pH;c-酶解时间;d-底物质量浓度
图1 PPIA最适酶解条件优化
Fig.1 Optimum hydrolysis conditions for PPIA
2.2 豌豆低聚肽的溶解性和水解度
豌豆低聚肽的高溶解性是其工艺上使用的关键特征之一,可以对其后期工艺处理产生深远影响[16]。水解程度也能够从侧面体现出小分子多肽的浓度以及功能活性上的改变。如图2所示,双酶酶解能显著提高PPI的溶解性和水解度。

图2 PPI、PPIA、PPIACP的溶解性和水解度
Fig.2 Solubility and hydrolysis degree of PPI, PPIA, PPIACP
注:*表示PPIACP在溶解性上与PPIA的显著性差异(P<0.05),#表示PPIACP在水解度上与PPIA的显著性差异(P<0.05)
PPI的溶解性为32.2%;PPIA溶解性58.6%,水解度11.6%;碱性蛋白酶和羧肽酶M32双酶解制备得到的PPIACP溶解性80.5%,水解度15.4%,与PPIA相比,分别提高了37.4%和33.4%。随着酶解的进行,PPI的溶解性和水解度显著提高,与碱性蛋白酶相比,羧肽酶M32可进一步水解PPIA,让肽链从外部展开,降低分子质量,增加了极性基团的数目,小分子多肽在水解度提高的同时,也更易得到分子质量更小的肽和氨基酸。范海茹等[17]以高温豆粕为原料,利用内切酶中性蛋白酶和外切酶连续酶解的方式制备鲜味肽,获得了水解度显著提高的酶解产物与本研究结果一致。上述结果表明羧肽酶M32在提高水解度方面具有较大优势。
2.3 豌豆低聚肽的分子量分布
酶解会将蛋白质水解成短肽和氨基酸,从而改变分子质量分布,蛋白质分子质量分布的变化也会影响功能及其感官特性[18]。对PPI水解液中分子质量占比进行分析,结果如图3所示。PPI中90%以上是分子质量>5 kDa的大分子质量多肽,小分子质量多肽组分很低。碱性蛋白酶属于内切蛋白酶,可从蛋白质内部切割肽键,经碱性蛋白酶水解后,PPIA水解液中0.2~1 kDa的短肽显著增加(P<0.05),分子质量>5 kDa的多肽含量大大降低。羧肽酶M32属于外切蛋白酶,可特异地从蛋白质的C端切割氨基酸,经羧肽酶M32水解后的PPIACP,分子质量>1 kDa的多肽进一步水解成更短的短肽,分子质量在0.2~1 kDa的短肽,与PPIA相比显著增加(P<0.05),增加了36.2%。分子质量<200 Da的部分主要是游离氨基酸,PPIA占比是7.6%,PPIACP占比是13.8%,提高了6.2%。可见,羧肽酶M32可有效提高PPI水解液中的短肽和氨基酸含量,使更多的大分子多肽水解成小分子的寡肽和氨基酸,小分子物质人体更容易吸收,这有利于豌豆多肽发挥功能。

图3 PPI、PPIA、PPIACP的分子质量分布
Fig.3 Molecular weight distribution of PPI, PPIA, PPIACP
注:#表示PPIA在0.2~1 kDa区间上的分子量分布与<0.2 kDa区间上的显著性差异(P<0.05),*表示PPIACP在0.2~1 kDa区间上的分子量分布与<0.2 kDa区间上的显著性差异(P<0.05)
2.4 豌豆低聚肽中游离氨基酸组成
为进一步探究影响酶解产物呈味的因素,对豌豆低聚肽中的游离氨基酸组成进行了测定,以比较双酶解前后鲜味氨基酸(Glu、Asp、Ala、Phe、Gly、Tyr)和苦味氨基酸(Ser、His、Arg、Val、Met、Ile、Leu)含量的变化。如图4所示,经碱性蛋白酶水解后,多肽链末端的氨基酸被大量暴露出来,加入羧肽酶M32后,位于C端的氨基酸被释放出来,呈游离状态,其中苦味氨基酸His、Arg、Val、Leu含量显著增加了17.4%(P<0.05),鲜味氨基酸提高了3.8%。C端苦味氨基酸的脱除有利于减少苦味肽的平均疏水性,降低苦味肽的苦味。

图4 PPI、PPIA、PPIACP中游离氨基酸含量热图
Fig.4 Heat map of free amino acid content in PPI, PPIA and PPIACP
PPI经碱性蛋白酶水解后,大分子蛋白逐渐被水解,相对分子质量降低,酶解液中的肽含量升高,也造成了肽链末端的疏水性基团暴露,酶解液中苦味肽的含量亦增加,再加入羧肽酶M32后,可将苦味肽C端的疏水性氨基酸释放出来,使其呈游离状态,苦味降低。研究发现,水解物的呈味特性与氨基酸的组成有关,黄百祺等[19]比较了4种龟肉酶解液氨基酸与呈味的关系,发现以疏水性氨基酸为主的龟肉酶解液与其他组相比会有较大的味道强度差。本研究根据酶解产物呈现苦味的问题,利用羧肽酶M32将碱性蛋白酶酶解产物进行二次酶解,从而降低苦味,改善风味。
2.5 豌豆低聚肽风味分析
为研究不同酶解产物的呈味特性,利用电子舌技术分别对PPI、PPIA、PPIACP进行检测,将检测结果进行分析[20-21]。由图5可知,与PPIA相比,PPIACP的苦味、鲜味、甜味较为显著(P<0.05),在苦的回味、咸味、丰富度方面也表现出差异,但不显著。其中,苦味值由5.09变为3.93,降低了22.8%;鲜味由18.9变为21.7,提高了20.9%。总的来说,PPIACP风味变化明显,这表明羧肽酶M32具有抑苦增鲜的作用,这是因为它可以在肽链末端切断氨基酸,并释放出C端的氨基酸,特别是疏水性氨基酸、短肽及氨基酸含量和组成的变化使得PPIACP的风味发生改变。而碱性蛋白酶的主要降解位点则是芳香族氨基酸残基的羧基端肽键,在酶解后会使肽链C端的疏水性氨基酸增多,增加了不良风味的强度。以上结果表明,碱性蛋白酶+羧肽酶M32复合酶解的水解产物比单酶解的水解产物呈味特性更丰富,羧肽酶M32在植物蛋白水解物脱苦中具有很大的应用潜力。
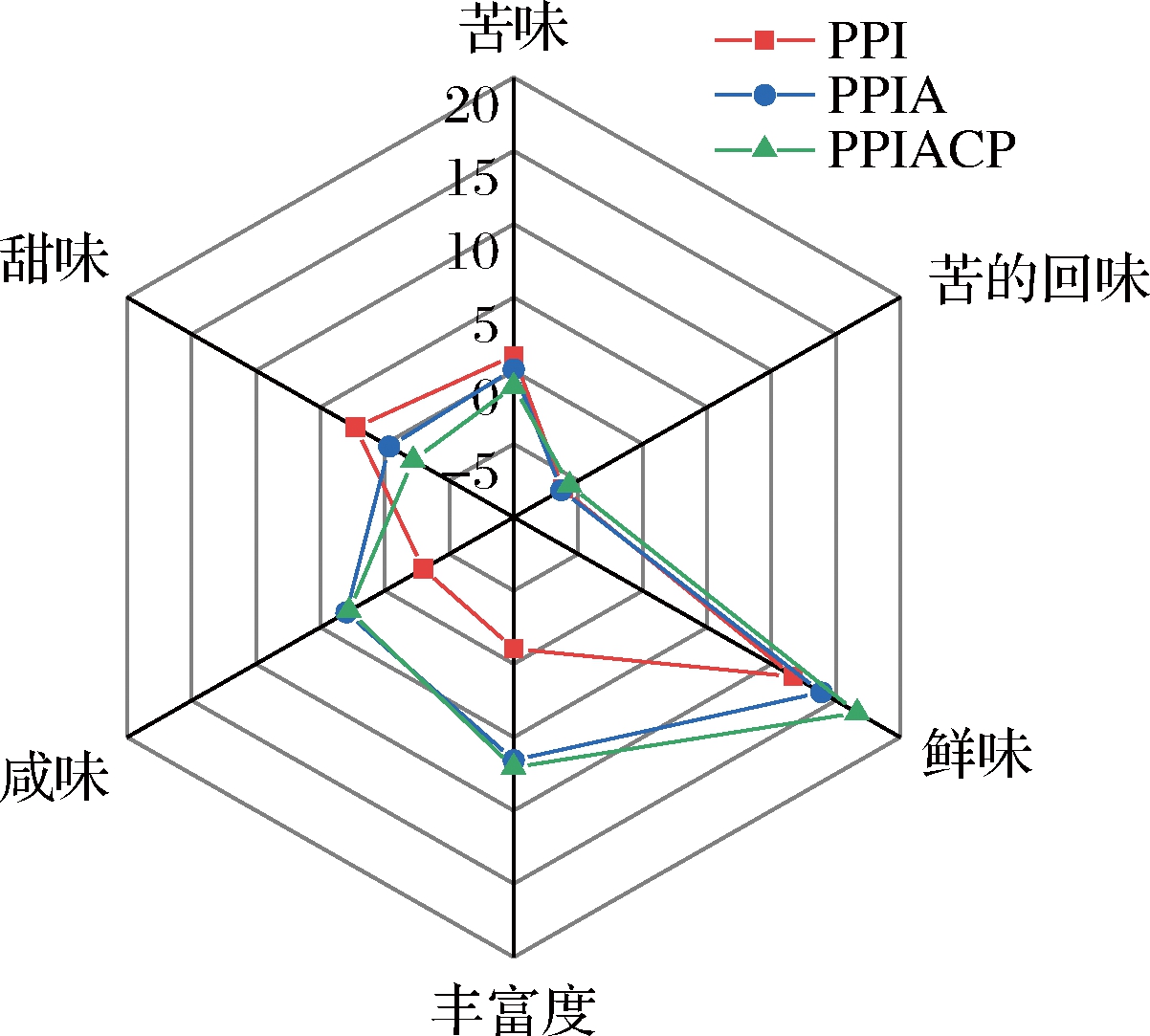
图5 电子舌风味图
Fig.5 Electronic tongue flavour radar chart
2.6 豌豆低聚肽抗氧化能力分析
分别从DPPH自由基清除率,·OH清除率2个方面评价豌豆低聚肽PPIA和PPIACP的抗氧化能力。如图6-a所示,PPIACP的DPPH自由基清除率98%,与PPIA相比提高了32.4%。PPIACP的·OH清除率90%,与PPIA相比提高了25.1%(图6-b)。结果表明,结合羧肽酶M32双酶法制备的豌豆低聚肽的抗氧化活性明显优于单酶法制备的豌豆低聚肽。抗氧化活性在某种程度上依赖于小分子物质的数量,小分子肽的数量越多,抗氧化活性越强。根据图3的结果,PPIACP中,分子质量<1 kDa的组分占82.6%,与PPIA相比提高了25.3%,含有更多10肽以下的小肽,而目前所研究的抗氧化寡肽大多是少于10个氨基酸残基的小肽,小肽更容易形成良好的抗氧化物质[22-23],而羧肽酶M32可以使PPIA进一步水解产生更多的小分子肽来作为供体,提供更多的电子,与自由基反应将其转化为不容易氧化的产物,进而停止自由基的链式反应,通过羧肽酶水解释放的一系列疏水性氨基酸也会提高多肽的抗氧化能力[24]。

a-DPPH自由基清除率;b-·OH清除率
图6 PPI、PPIA和PPIACP的抗氧化活性
Fig.6 Antioxidant activities of PPI, PPIA, and PPIACP
3 结论
本研究利用一种新型羧肽酶M32制备低苦味豌豆低聚肽并对其功能进行了评价。通过单因素实验确定了羧肽酶M32酶解PPIA的最优条件为酶解温度60 ℃,pH 7,酶解时间2 h,底物质量浓度60 g/L。羧肽酶M32结合碱性蛋白酶制备的豌豆低聚肽PPIACP的溶解性和水解度分别为80.6%和15.4%,与碱性蛋白酶单酶制备的豌豆低聚肽PPIA相比,分别提高了37.4%和33.4%。小分子短肽(0.2~1 kDa)增加了36.2%。苦味显著降低(P<0.05),鲜味值提高了20.9%,有利于制备高鲜味低苦味的豌豆低聚肽;PPIACP的DPPH自由基清除率和·OH清除率分别可达98%和90%,具有很好的抗氧化活性。综上所述,羧肽酶M32结合碱性蛋白酶双酶解制备的豌豆低聚肽PPIACP苦味降低,鲜味增加,且抗氧化效果较好,羧肽酶M32在植物蛋白生物活性肽制备中具有良好的应用前景。
[1] 郭顺堂, 徐婧婷, 刘欣然, 等.我国植物蛋白资源高效利用途径与技术创新[J].食品科学技术学报, 2019, 37(6):8-15.
GUO S T, XU J T, LIU X R, et al.Efficient utilization and technological innovation of plant-based protein resources in China[J].Journal of Food Science and Technology, 2019, 37(6):8-15.
[2] 孙冬阳, 呼鑫荣, 薛文通.豌豆功效成分及其生理活性的研究进展[J].食品工业科技, 2019, 40(2):316-320.
SUN D Y, HU X R, XUE W T.Research progress of efficacy components and physiological activity of pea[J].Science and Technology of Food Industry, 2019, 40(2):316-320.
[3] 张守文, 程宇.豌豆的营养成分及在食品工业中的应用:有待进一步深入开发的食品配料[J].中国食品添加剂, 2014(4):154-158.
ZHANG S W, CHENG Y.The nutritional ingredient of pea and and its application in food industry[J].China Food Additives, 2014(4):154-158.
[4] SHA L, KOOSIS A O, WANG Q L, et al.Interfacial dilatational and emulsifying properties of ultrasound-treated pea protein[J].Food Chemistry, 2021, 350:129271.
[5] YUE Y, PANG S J, LI N N, et al.Interactions between pea protein isolate and carboxymethylcellulose in neutral and acid aqueous systems[J].Foods (Basel, Switzerland), 2021, 10(7):1560.
[6] 梁晗妮, 唐传核.豌豆蛋白的功能特性研究[J].现代食品科技, 2012, 28(12):1 640-1 644.
LIANG H N, TANG C H.Study on functional properties of pea protein[J].Modern Food Science and Technology, 2012, 28(12):1 640-1 644.
[7] 郝曦煜, 李雪, 陈博, 等.我国豌豆产业发展特征及趋势分析[J].农业科技通讯, 2022(2):10-15.
HAO X Y, LI X, CHEN B, et al.Analysis on development characteristics and trend of pea industry in China[J].Bulletin of Agricultural Science and Technology, 2022(2):10-15.
[8] 冯红霞, 陆兆新, 尤华.苦味肽的形成及脱苦方法的研究[J].食品科学, 2002, 23(5):151-154.
FENG H X, LU Z X, YOU H.Study on forming mechanism and debittering methods of bitter peptides[J].Food Science, 2002, 23(5):151-154.
[9] 薛园园. 豌豆蛋白的酶水解及其产物抗氧化性能研究[D].郑州:河南工业大学, 2011.
XUE Y Y.Enzymatic hydrolysis of pea protein and antioxidative activity of the hydrolysates[D].Zhengzhou:Henan University of Technology, 2011.
[10] 郭兴凤, 薛园园, 吴欣欣.风味蛋白酶水解制备豌豆蛋白抗氧化酶解产物工艺条件优化[J].粮食与油脂, 2011, 24(9):44-47.
GUO X F, XUE Y Y, WU X X.Optimum of enzymatic hydrolysis parameters of pea protein with flavorzyme for preparing enzymatic hydrolysates[J].Cereals & Oils, 2011, 24(9):44-47.
[11] 郭兴凤, 崔会娟, 胡婷婷, 等.Alcalase改性豌豆蛋白功能性研究[J].粮食与油脂, 2014, 27(2):42-44.
GUO X F, CUI H J, HU T T, et al.Research on functional properties of pea proteins modified by alcalase[J].Cereals & Oils, 2014, 27(2):42-44.
[12] 杨雪, 李云亮, 王禹程, 等.酶解法制备豌豆抗氧化肽及其稳定性的研究[J].粮食与油脂, 2018, 31(1):16-18.
YANG X, LI Y L, WANG Y C, et al.Preparation and stability of pea antioxidant peptides by enzymatic hydrolysis[J].Cereals & Oils, 2018, 31(1):16-18.
[13] SONG P, XU W, ZHANG Y, et al.A new carboxypeptidase from Aspergillus niger with good thermostability, pH stability and broad substrate specificity[J].Scientific Reports, 2021, 11:18745.
[14] 喻豆, 潘力, 王斌.黑曲霉丝氨酸羧肽酶的重组表达及其水解大豆蛋白的效果分析[J].现代食品科技, 2022, 38(1):173-180;158.
YU D, PAN L, WANG B.Recombinant expression of serine carboxypeptidase in Aspergillus niger and analysis of hydrolysis effect on soybean protein[J].Modern Food Science and Technology, 2022, 38(1):173-180;158.
[15] 石慧. 羧肽酶在大豆蛋白水解中的脱苦作用[J].食品安全导刊, 2020(18):183-184.
SHI H.Effect of carboxypeptidase on soybean protein hydrolysis[J].China Food Safety Magazine, 2020(18):183-184.
[16] STRAUCH R C, LILA M A.Pea protein isolate characteristics modulate functional properties of pea protein-cranberry polyphenol particles[J].Food Science & Nutrition, 2021, 9(7):3 740-3 751.
[17] 范海茹, 李淑英, 许斌, 等.内外切蛋白酶连续酶解制备豆粕鲜味肽的研究[J].中国调味品, 2021, 46(1):77-82.
FAN H R, LI S Y, XU B, et al.Study on preparation of soybean meal umami peptides by continuous enzymatic hydrolysis[J].China Condiment, 2021, 46(1):77-82.
[18] DA CHEN, CAMPANELLA O H.Limited enzymatic hydrolysis induced pea protein gelation at low protein concentration with less heat requirement[J].Food Hydrocolloids, 2022, 128:107547.
[19] 黄百祺, 黄创成, 吴巨贤, 等.4种龟肉酶解液的氨基酸及呈味特性比较[J].食品研究与开发, 2021, 42(8):12-17.
HUANG B Q, HUANG C C, WU J X, et al.Comparison of amino acids and taste characteristics in four kinds of Emydidae meat enzymatic hydrolysate[J].Food Research and Development, 2021, 42(8):12-17.
[20] BAKHSH A, LEE S J, LEE E Y, et al.Characteristics of beef patties substituted by different levels of textured vegetable protein and taste traits assessed by electronic tongue system[J].Foods (Basel, Switzerland), 2021, 10(11):2811.
[21] 王琼, 徐宝才, 于海, 等.电子鼻和电子舌结合模糊数学感官评价优化培根烟熏工艺[J].中国农业科学, 2017, 50(1):161-170.
WANG Q, XU B C, YU H, et al.Electronic nose and electronic tongue combined with fuzzy mathematics sensory evaluation to optimize bacon smoking procedure[J].Scientia Agricultura Sinica, 2017, 50(1):161-170.
[22] 郑淋. 抗氧化肽的构效关系及定向制备的研究[D].广州:华南理工大学, 2015.
ZHENG L.Structure-activity relationship and directional preparation of antioxidant peptide[D].Guangzhou:South China University of Technology, 2015.
[23] GAO J X, LI T G, CHEN D D, et al.Identification and molecular docking of antioxidant peptides from hemp seed protein hydrolysates[J].LWT, 2021, 147:111453.
[24] 吴文煜, 周婧, 宗红, 等.利用一种新型三肽酶制备低苦味大豆低聚肽及其功能研究[J].食品与发酵工业, 2020, 46(13):55-61.
WU W Y, ZHOU J, ZONG H, et al.Functional properties of low-bitter soybean oligopeptides prepared by a novel tripeptidase[J].Food and Fermentation Industries, 2020, 46(13):55-61.