糖尿病是一种以高血糖为主要特征的代谢性疾病,因其发病率高、危害性大,现已成为继恶性肿瘤、心血管疾病之后的世界第三大慢性疾病,是21世纪患病人数增长最多的疾病之一。其中II型糖尿病患病人数占患病总人数的90%~95%[1],患者体内出现胰岛素拮抗作用或胰岛素分泌异常而导致血糖持续增加[2]。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性促胰岛素释放肽(glucose-dependent insulinotropic polypeptide,GIP)是2种肠促胰岛素激素,二者在抑制胰高血糖素产生的同时刺激胰岛β细胞的增值和分化,促进胰岛素的分泌[3],对维持血糖稳态有着十分重要的作用。二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)是一种在生物体内普遍存在的脯氨酰寡肽酶,可参与人体多种生理功能,主要能够快速代谢GLP-1和GIP,从而升高血糖,所以人们发现可以通过抑制DPP-IV的酶活性来达到降血糖的作用。目前,西格列丁(Sitagliptin)等人工合成的DPP-IV抑制剂在治疗糖尿病的过程中会产生诸多轻微不良反应,从天然蛋白质中提取得到的食源性DPP-IV抑制肽无毒副作用和选择性降血糖作用等突出优势,因而备受关注。
中国毛虾(Acetes chinensis)又称为虾米、海米等,是我国沿海地区特有的一种虾类品种,广泛分布于中国渤海、黄海以及东南沿岸的浅海近海水域。毛虾形体偏小、甲壳较薄,不易贮存,主要经晾晒、发酵、蒸煮等简单加工制作成虾皮、虾酱等低值加工食品,部分毛虾因在捕捞后易腐而被丢弃,造成水产资源浪费,同时也对水体环境产生一定污染。然而,中国毛虾富含蛋白质和矿物元素,其蛋白质中疏水性氨基酸含量较高[4],具有制备生物活性肽的良好基础。王海涛等[5]以中国毛虾为原料,通过精准酶解和分离纯化制备出了具有抑制流感病毒神经氨酸酶的高活性多肽。付雪艳等[6]对中国毛虾经碱性蛋白酶和中性蛋白酶水解所得多肽的降血压作用进行初探,结合体外血管紧张素转化酶抑制活性测定和大鼠体内试验表明中国毛虾酶解多肽具有显著的降血压作用。这些结果表明基于中国毛虾的生物活性肽可以作为一种潜在的功能性配料应用于食品药品行业。
本研究以中国毛虾为原料,通过使用动物蛋白酶水解和膜分离、色谱分离等纯化制备DPP-IV抑制肽,并对活性多肽的氨基酸组成和结构进行鉴定,通过探究其对DPP-IV的抑制作用机理,为中国毛虾的高值化利用和功能性食品开发等提供理论基础。
1 材料与方法
1.1 材料与试剂
材料:中国毛虾,浙江省舟山国际水产城;10 kDa超滤膜(MSC 80010)、3 kDa(MSC 80001)超滤膜,上海摩速科学器材有限公司;制备型C18柱(XBridge Prep,19 mm×250 mm,5 μm),沃特世科技(上海)有限公司。
试剂:动物蛋白水解酶(20 U/mg,食品级),南宁东恒华道生物科技有限公司;葡聚糖凝胶Sephadex G-15、DPP-IV抑制剂筛查检测试剂盒、乙腈、三氟乙酸、甲酸(HPLC级),美国Sigma-Aldrich公司。
1.2 仪器与设备
MSC 300超滤杯,上海摩速科学器材有限公司;HDB-7 L核酸蛋白检测仪、CBA-A程控多功能全自动部分收集器,上海沪西分析仪器有限公司;CHRIST ALPHA1-2真空冷冻干燥机,德国Marin Christ公司;WATERS E2695高效液相色谱仪,沃特世科技有限公司;P 270制备型高效液相色谱仪,大连依利特分析仪器有限公司;FLEXSTATION 3多功能读板机,美国Molecular Devices公司;RE-52AA真空旋转蒸发仪,上海予华仪器有限公司;ULTIMATE 3000毛细管高效液相色谱仪、Q EXACTIVE四级杆-静电场轨道阱高分辨质谱联用仪,赛默飞世尔科技有限公司;ZORBAX300SB C18peptide traps,安捷伦科技有限公司。
1.3 实验方法
1.3.1 中国毛虾酶解液的制备
中国毛虾4 ℃自然解冻后使用破碎机打成虾糜,与pH 7.5的0.2 mol/L磷酸盐缓冲液以1∶10.5(g∶mL)比例混合,首先在90 ℃水浴中加热15 min除去内源酶,冷却后加入动物蛋白酶5 100 U/g(原料),55 ℃水解5.1 h。酶解结束后经90 ℃水浴灭酶15 min,冷却至室温后在4 ℃、10 000 r/min离心20 min。经4层纱布过滤取上清液,即为中国毛虾酶解液(Acetes chinensis hydrolysates,ACH),储存于4 ℃冰箱。
1.3.2 ACH的超滤分离
将ACH导入超滤杯中,在冰浴下分别通过10和3 kDa的超滤膜,在最大工作压力0.2 MPa的条件下,经超滤得到3个不同分子质量范围的组分。收集各超滤组分冷冻干燥后测定DPP-IV抑制活性。
1.3.3 葡聚糖凝胶色谱分离
使用超纯水将多肽冻干粉复溶为30 mg/mL的溶液,经0.22 μm水相膜过滤后上样至经过平衡的Sephadex G-15凝胶柱(80 cm×1.6 cm)。样品上样量1 mL,以去离子水为流动相,0.5 mL/min流速洗脱分离,使用核酸蛋白检测仪测定洗脱液在检测波长为254 nm处的吸光值。收集各洗脱组分冷冻干燥备用,测定各洗脱组分的DPP-IV抑制活性。
1.3.4 反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)分离
使用RP-HPLC将经Sephadex G-15凝胶色谱柱分离得到的体外DPP-IV抑制活性最高的组分进行进一步分离纯化。液相分离条件如下:流动相A为含0.1%(体积分数,下同)三氟乙酸的水溶液,流动相B为含0.1%三氟乙酸的乙腈。梯度洗脱设置为:0~5 min为20%乙腈;5~15 min为45%乙腈;15~20 min为20%乙腈。样品质量浓度40 mg/mL,进样量2 mL,流动相流速4 mL/min,检测波长214 nm。按照出峰时间和分离程度收集各峰洗脱液,经真空旋转蒸发仪浓缩后冷冻干燥,测定各洗脱组分DPP-IV抑制率。
1.3.5 质谱鉴定
参考LANG等[7]的方法,使用液相色谱-质谱联用仪(liquid chromatography tandem mass spectrometry,LC-MS/MS)鉴定DPP-IV抑制肽的氨基酸序列。样品经高效液相色谱分离后使用四级杆-静电场轨道阱高分辨质谱联用仪进行分析。电喷雾离子源采用正离子模式,使用全扫描(Full MS)和数据依赖二级扫描(dd-MS2),分析时间60 min,母离子扫描范围300~1 800 m/z。其中一级质谱分辨率为7 000;静电轨道阱离子捕获器门限值(AGC target)为1×106;一级最大注入捕获时间为10 ms。二级质谱分辨率为17 500,二级最大注入捕获时间为60 ms;归一化碰撞能量27 eV;底部填充率0.1%。
1.3.6 DPP-IV抑制率的测定
采用荧光底物法测定DPP-IV抑制率。利用DPP-IV催化底物生成带有荧光基团的7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)或7-氨基-4-三氟甲基香豆素,测定样品在激发波长360 nm和发射波长460 nm处的荧光强度,以此计算样品对DPP-IV的抑制程度。采用DPP-IV抑制剂筛查检测试剂盒,具体操作如下:首先在96孔板中加入50 μL DPP-IV酶和10 μL样品混匀,在37 ℃反应10 min后加入25 μL底物,再经37 ℃孵育15 min后检测荧光强度记为F样品。DPP-IV抑制率(WDPP-IV)的计算如公式(1)所示:
(1)
式中:F对照,对照组的荧光强度;F样品,样品组的荧光强度;F空白,空白组的荧光强度。
1.3.7 DPP-IV抑制肽的合成及活性验证
经LC-MS/MS鉴定和多肽结构特征筛选所得的5条DPP-IV抑制肽委托武汉丹港生物科技有限公司使用固相合成法进行合成,多肽纯度均大于95%。
按照1.3.6的方法对合成肽DPP-IV抑制率进行测定,并计算合成多肽对DPP-IV的半数抑制浓度(half inhibitory concentration,IC50)。
1.3.8 DPP-IV抑制肽的抑制动力学实验
参照陈宏[8]的方法使用酶抑制动力学方法探究DPP-IV抑制肽对DPP-IV的抑制作用类型。DPP-IV酶活力为10 U/L,使用缓冲液配制不同质量浓度(0、0.1、0.2 mg/mL)的DPP-IV抑制肽和不同浓度(2、2.5、5、10 mmol/L)Gly-Pro-AMC底物溶液,测定在不同抑制剂浓度和不同底物浓度的水平下吸光度的变化率。绘制Lineweaver-Buck双倒数图,并计算动力学参数,以此判断不同DPP-IV抑制肽的抑制作用类型。
1.3.9 分子对接
参考WANG等[9]的方法,通过同源对比和检索从Protein Data Bank数据库(http://www.rcsb.org/pdb)获取DPP-IV(PDB ID:5 J3 J)的三维晶体结构,使用Pymol软件删除DPP-IV结构中的水分子和配体。使用ChemOffice软件搭建能量最小化的多肽结构,然后使用AutoDock软件对DPP-IV受体蛋白进行添加氢、平衡电荷等处理,AutoGrid程序下设置网格间距为0.375 Å,将多肽配体和DPP-IV受体进行对接并寻找稳定结构。
1.4 数据分析
所有测定进行3次平行。各组数据采用SPSS 23进行方差分析,以Duncan多重比较法进行显著性分析(P<0.05)。采用Origin 2018进行绘图。
2 结果与讨论
2.1 ACH的超滤分离
超滤是以具有不同大小孔径的超滤膜为介质,依靠膜两侧的压力差对混合物质进行分离和浓缩的分子级膜分离技术[10],在多肽分离纯化过程中可以使用超滤膜将蛋白酶解产物分成分子质量不同的组分,并分别探究各组分的生物活性。ACH经10 kDa和3 kDa超滤膜分离后得到分子质量不同的3个组分ACH-1(>10 kDa)、ACH-2(3~10 kDa)和ACH-3(<3 kDa),各组分在20 mg/mL质量浓度下的DPP-IV抑制率如图1所示。

图1 中国毛虾酶解产物超滤组分的DPP-IV抑制率
Fig.1 DPP-IV inhibition rate of each ultrafiltration fraction of the enzymatic hydrolysate of Acetes chinensis
注:不同字母代表在P<0.05水平上的显著性差异(下同)
3个超滤组分DPP-IV抑制活性均高于原始酶解液,其中分子质量<3 kDa的ACH-3组分DPP-IV抑制率为(53.14±1.10)%,与ACH相比提高了8.82个百分点,并且显著高于ACH-1的(46.81±1.39)%和ACH-2的(50.36±0.54)%。研究表明,生物活性肽的分子质量大小与其DPP-IV抑制活性之间存在一定联系,即超滤后得到的分子质量较低的组分往往对DPP-IV的抑制作用较大。JIN等[11]使用胰蛋白酶水解三文鱼皮凝胶制备DPP-IV抑制肽,超滤结果显示分子质量<3 kDa的组分抑制效果更好;尹剑等[12]使用木瓜蛋白酶水解鲟鱼皮胶原蛋白,发现通过超滤得到的F-IV(<3 kDa)具有更高的DPP-IV抑制活性。这些结果均表示超滤有助于富集低分子质量多肽并提高酶解产物的DPP-IV抑制活性,因此选择ACH-3组分进行下一步分离。
2.2 葡聚糖Sephadex-G15分离
凝胶过滤层析是一种分子筛技术,基于凝胶内部网孔能够分离不同分子质量的蛋白质,已被广泛用于不同种类生物活性肽的分离纯化[13]。超滤得到的ACH-3组分通过葡聚糖凝胶Sephadex G-15分离后得到F1、F2、F3、F4和F5组分的凝胶色谱图见图2-a。各组分DPP-IV抑制率见图2-b,在5个组分中F2抑制DPP-IV的效果最好,抑制率达到(53.76±0.57)%,与ACH-3组分的抑制率相近,显著高于其他4个组分。F4和F5组分对DPP-IV的抑制作用较弱,抑制率均小于20%。在凝胶色谱中分子质量较大的组分最先被分离出来,可知F2的分子质量大于F3-F5组分,其中F4和F5被洗脱的时间更久,可能存在大量游离氨基酸从而降低DPP-IV抑制率。LANG等[7]使用Sephadex G-15凝胶色谱分离南极磷虾粉酶解液分子质量<3 kDa的组分(C4)后得到了3个分离组分,其中分子质量较高的C4-2组分DPP-IV抑制活性高于C4-3。陈宏等[14]将牡蛎蛋白酶解液3 kDa超滤组分经Sephadex G-15分离后得到的4个不同组分,其中分子质量最小的F4组分IC50值反而较高。这些实验结果证明了DPP-IV抑制活性与分子质量不完全呈负相关关系,可能还受氨基酸组成和序列等其他因素影响,所以有必要对凝胶分离组分进行下一步分离纯化和结构鉴定。为此,在Sephadex G-15凝胶层析分离后选择F2组分进行RP-HPLC分离纯化。
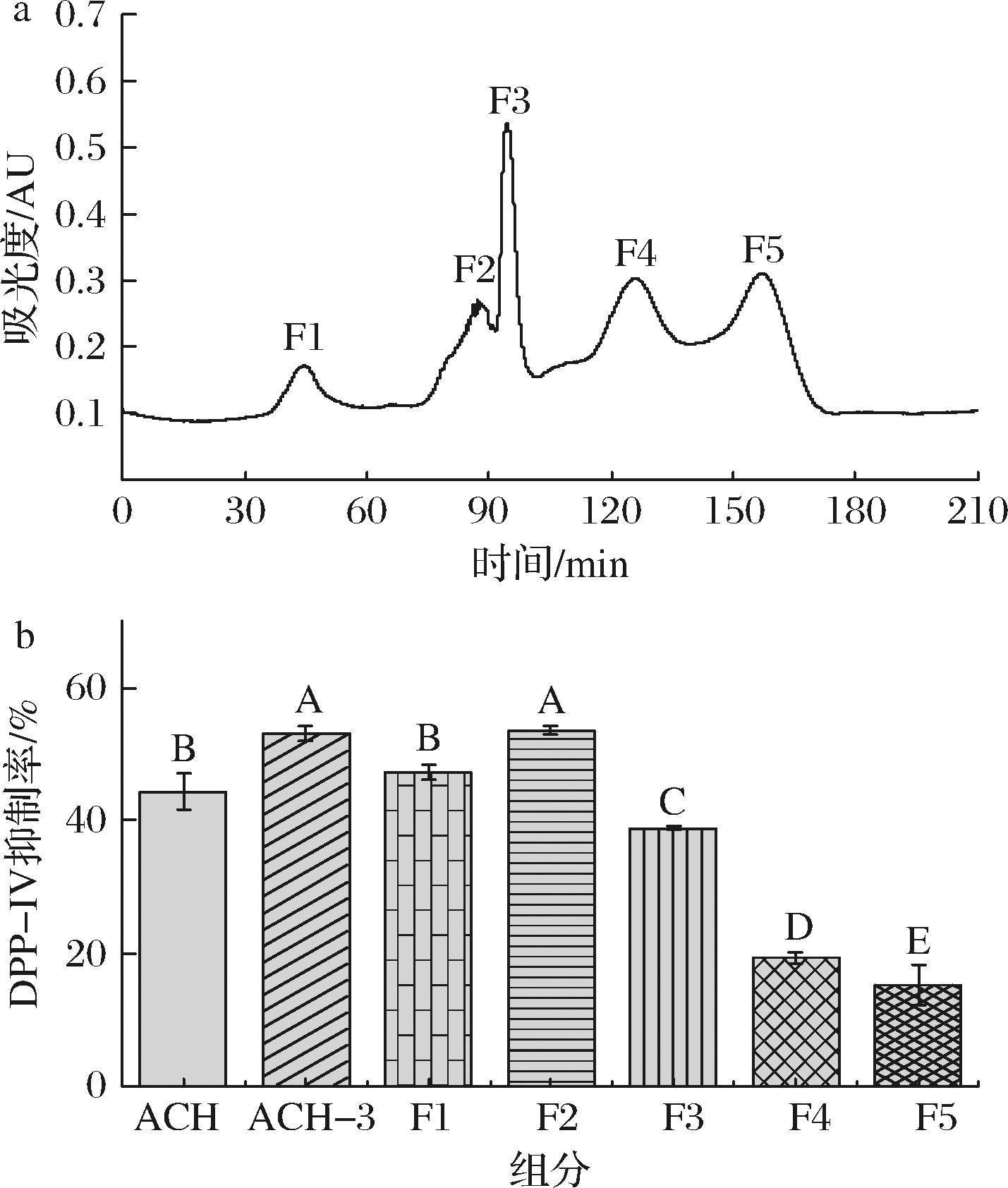
a-Sephadex G-15凝胶色谱分离结果;b-各组分的DPP-IV抑制率
图2 Sephadex G-15凝胶色谱分离结果及各组分的DPP-IV抑制率
Fig.2 Sephadex G-15 gel chromatography separation results and DPP-IV inhibition rate of each component
2.3 RP-HPLC分离
RP-HPLC具有柱效高、分离效果好、灵敏度高等优点,是分析蛋白质和多肽的常用方法之一。多肽通过流动相进入反相色谱柱后,利用肽段的疏水性,根据不同分配系数依次流出,达到分离多肽的目的[15]。F2组分经RP-HPLC进行离纯化,如图3-a所示,F2组分按照分离时间和分离程度被分为F2-1、F2-2和F2-3。3个分离组分在20 mg/mL时DPP-IV抑制率如图3-b所示,可知F2-3组分对DPP-IV的抑制率最高,为(75.17±1.06)%,显著高于其他2个组分,证明RP-HPLC对多肽分离纯化和增强活性效果比较明显。GU等[16]以小米蛋白为原料制备DPP-IV抑制肽,对未超滤的酶解液直接采用Sephadex G-25分离,再经RP-HPLC纯化后得到2条新型降血糖肽。AMINI SARTESNIZI等[17]通过超滤和RP-HPLC分离纯化沙丁鱼不同蛋白酶水解物分离出具有抗氧化和抗糖尿病的组分。这些实验结果表明生物活性肽需要进行多次分离纯化,可以明显提高多肽的生物活性。
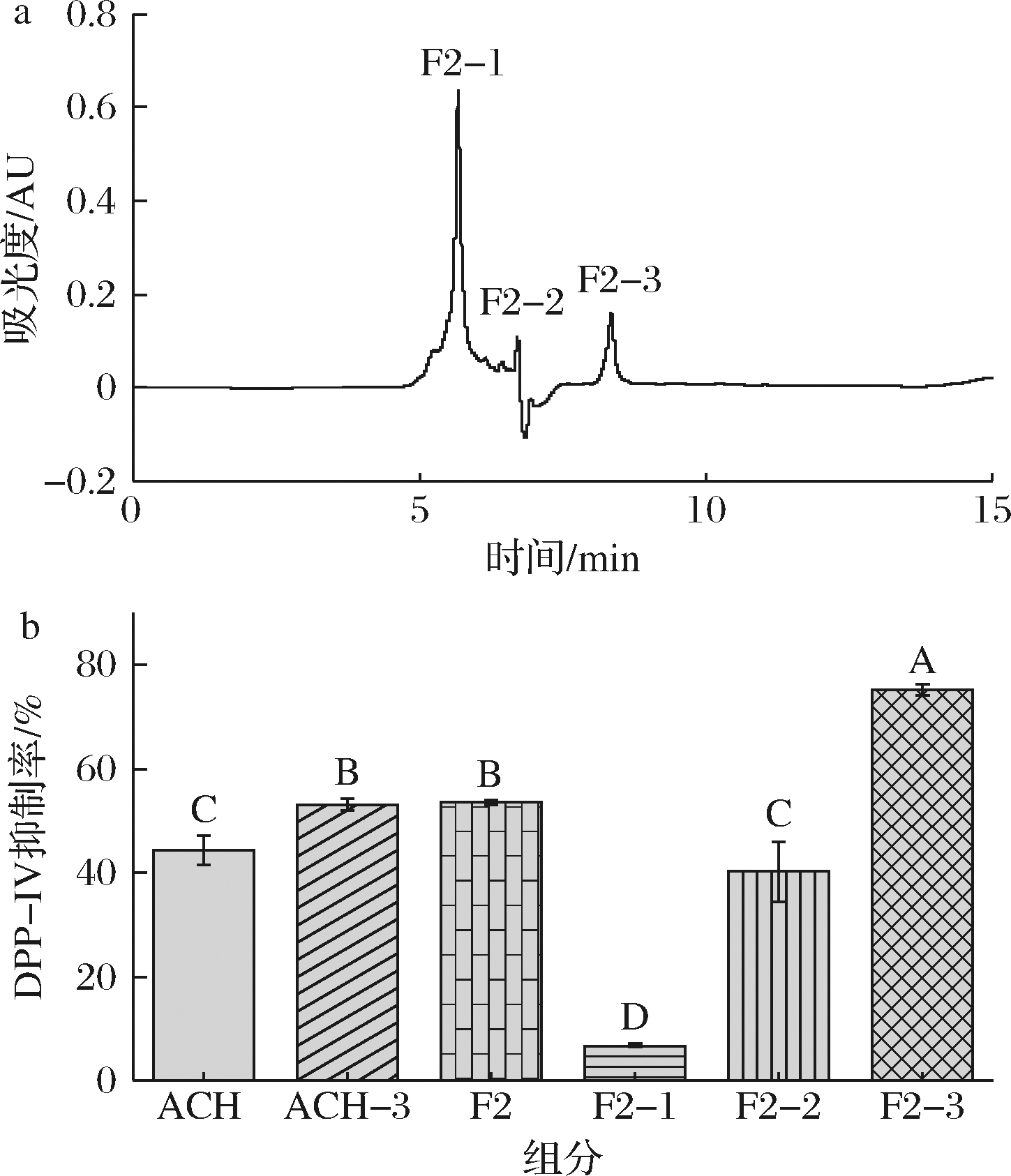
a-F2组分RP-HPLC图;b-各组分的DPP-IV抑制率
图3 F2组分RP-HPLC图和各组分的DPP-IV抑制率
Fig.3 RP-HPLC chromatogram of F2 component and DPP-IV inhibition rate of each component
2.4 LC-MS/MS鉴定
LC-MS/MS是一种分离分析复杂混合物质的有效方法,常用于鉴定生物活性肽的结构序列。采用LC-MS/MS对反相液相色谱柱分离得到体外DPP-IV抑制活性最高的F2-3组分进行结构鉴定,将获得的质谱信息与蛋白质数据库进行对比后得到42条多肽,多肽长度从8~23个氨基酸不等。研究表明,高活性食源性DPP-IV抑制肽一般由10个以内氨基酸组成[18]且具有一定的结构特征,即N末端有疏水性氨基酸,N末端第二为Pro或Ala,且C末端为Pro[19]。根据这些结构特征,从已鉴定出的42条多肽序列中筛选出5条DPP-IV抑制肽,5条多肽的二级质谱图如图4所示。

a-YGGQFPTRPD;b-PALPSIPH;c-IFTAPQVP;d-PAFPHPLP;e-LGDAPGEVP
图4 DPP-IV抑制肽的MS/MS图谱
Fig.4 The MS/MS spectra of DPP-IV inhibitory peptides
在二级质谱中,母离子发生碰撞使得肽链中的肽键断裂形成不同离子,在使用质谱分子多肽结构的过程中,N端离子碎片用b表示,C端离子碎片用y表示。根据二级质谱图分析可知5条多肽的氨基酸序列分别为(a)YGGQFPTRPD、(b)PALPSIPH、(c)IFTAPQVP、(d)PAFPHPLP和(e)LGDAPGEVP。
2.5 合成肽的活性验证
固相合成所得的5条中国毛虾DPP-IV抑制肽之间氨基酸组成和结构存在不同程度的差异,可能导致多肽的生物活性不同。为验证合成多肽对DPP-IV抑制作用的强弱,测定5条多肽在不同浓度下的DPP-IV抑制率,并以此计算多肽的半抑制浓度(IC50值)。由表1可知,5条DPP-IV抑制肽均含有Pro残基且具有一定的DPP-IV抑制活性,IC50值分别为(188.63±0.25) mg/mL(YGGQFPTRPD,1 136.5 Da),(2.68±0.06) mg/mL(PALPSIPH,830.5 Da),(157.82±0.71) mg/mL(IFTAPQVP,871.5 Da),(1.61±0.06) mg/mL(PAFPHPLP,874.5 Da),(10.45±0.26) mg/mL(LGDAPGEVP,853.4 Da),其中PALPSIPH和PAFPHPLP的IC50值较小,表明二者对DPP-IV的抑制作用较好。而阳性对照抑二肽素Ile-Pro-Ile(Diprotin A)的IC50值为1.25×10-2 mmol/mL,比合成肽的IC50值低,这说明中国毛虾DPP-IV抑制肽的活性与IPI相比较低。
表1 中国毛虾DPP-IV抑制肽序列及对DPP-IV的IC50
Table 1 Sequences and IC50 of DPP-IV inhibitory peptides from A. chinensis
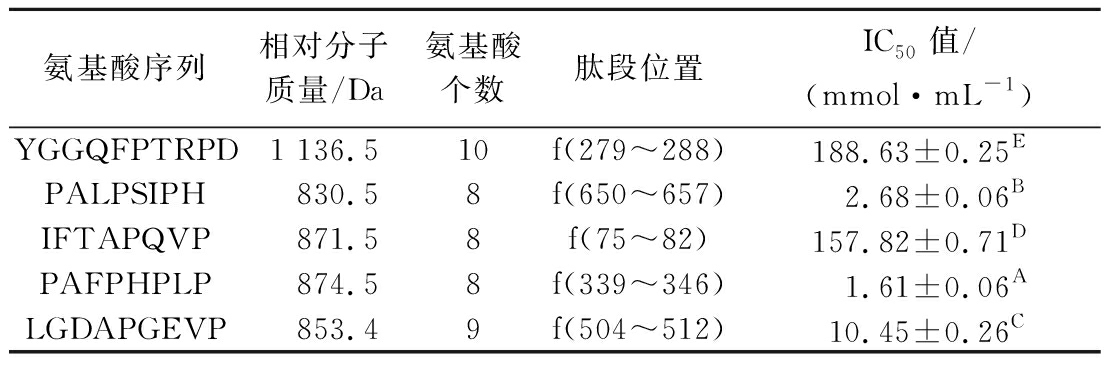
氨基酸序列相对分子质量/Da氨基酸个数肽段位置IC50值/(mmol·mL-1)YGGQFPTRPD1 136.510f(279~288)188.63±0.25EPALPSIPH830.58f(650~657)2.68±0.06BIFTAPQVP871.58f(75~82)157.82±0.71DPAFPHPLP874.58f(339~346)1.61±0.06ALGDAPGEVP853.49f(504~512)10.45±0.26C
PALPSIPH和PAFPHPLP相对较高的DPP-IV抑制活性可能归因于其特殊的氨基酸序列,可以看出二者的N末端第二位氨基酸均为Ala,这一特征与肠促胰岛素激素GLP-1的多肽结构相似[20],说明它们可能具有DPP-IV的酶切位点易与DPP-IV结合,保护GLP-1不被降解,从而有效调节机体血糖。在对方鲷蛋白DPP-IV抑制肽的研究中,经RP-HPLC分离纯化得到的22条序列中N端第二位氨基酸为Pro或Ala的多肽显示出比较强的潜在DPP-IV抑制活性[21]。GARZ N等[22]从高粱酒糟蛋白质水解物中分离得到的6条DPP-IV抑制肽中也有4条多肽具有该结构特征,且特征结构抑制肽与DPP-IV的结合能力更强,因而具有更好的DPP-IV抑制能力。此外,研究表明N末端前2位氨基酸对DPP-IV抑制特性起着决定性作用,而其他位置的氨基酸残基则起到次要作用,所以PALPSIPH和PAFPHPLP的DPP-IV抑制活性相近,且DPP-IV抑制作用也显著高于其他3条多肽(P<0.05)。
N等[22]从高粱酒糟蛋白质水解物中分离得到的6条DPP-IV抑制肽中也有4条多肽具有该结构特征,且特征结构抑制肽与DPP-IV的结合能力更强,因而具有更好的DPP-IV抑制能力。此外,研究表明N末端前2位氨基酸对DPP-IV抑制特性起着决定性作用,而其他位置的氨基酸残基则起到次要作用,所以PALPSIPH和PAFPHPLP的DPP-IV抑制活性相近,且DPP-IV抑制作用也显著高于其他3条多肽(P<0.05)。
2.6 DPP-IV抑制肽对DPP-IV抑制作用类型研究
酶抑制剂通常与酶的特定部分在结构、电荷、疏水性等方面相匹配,酶抑制动力学是分析抑制剂与酶的作用机理的常用方法之一。抑制剂对酶的抑制作用包括竞争性抑制、非竞争性抑制和反竞争性抑制。本文选择DPP-IV抑制活性较高的PALPSIPH和PAFPHPLP对DPP-IV的作用类型进行探究,通过观察同一条DPP-IV抑制肽在不同浓度下线性回归曲线的交点位置来推测该抑制肽的作用类型。由图5-a可知,PALPSIPH在不同样品浓度下的线性回归曲线相交于纵坐标轴的正半轴,属于典型的竞争性抑制剂。在该抑制剂的作用下DPP-IV催化Gly-Pro-AMC的酶反应中米氏常数Km的值随着抑制肽浓度增大逐渐增加,而最大反应速率Vm不随抑制肽浓度的增加而改变。PAFPHPLP表现出竞争/非竞争性混合型抑制类型(图5-b),即不同抑制肽浓度的线性回归线交点位于坐标轴的第2象限内,说明加入抑制剂后反应中的Km增大,而Vm不变。这表明PAFPHPLP在发挥抑制作用时,不仅与DPP-IV酶活性中心部位结合,还与活性中心以外的其他位点结合,通过这2种结合方式共同作用来抑制DPP-IV。
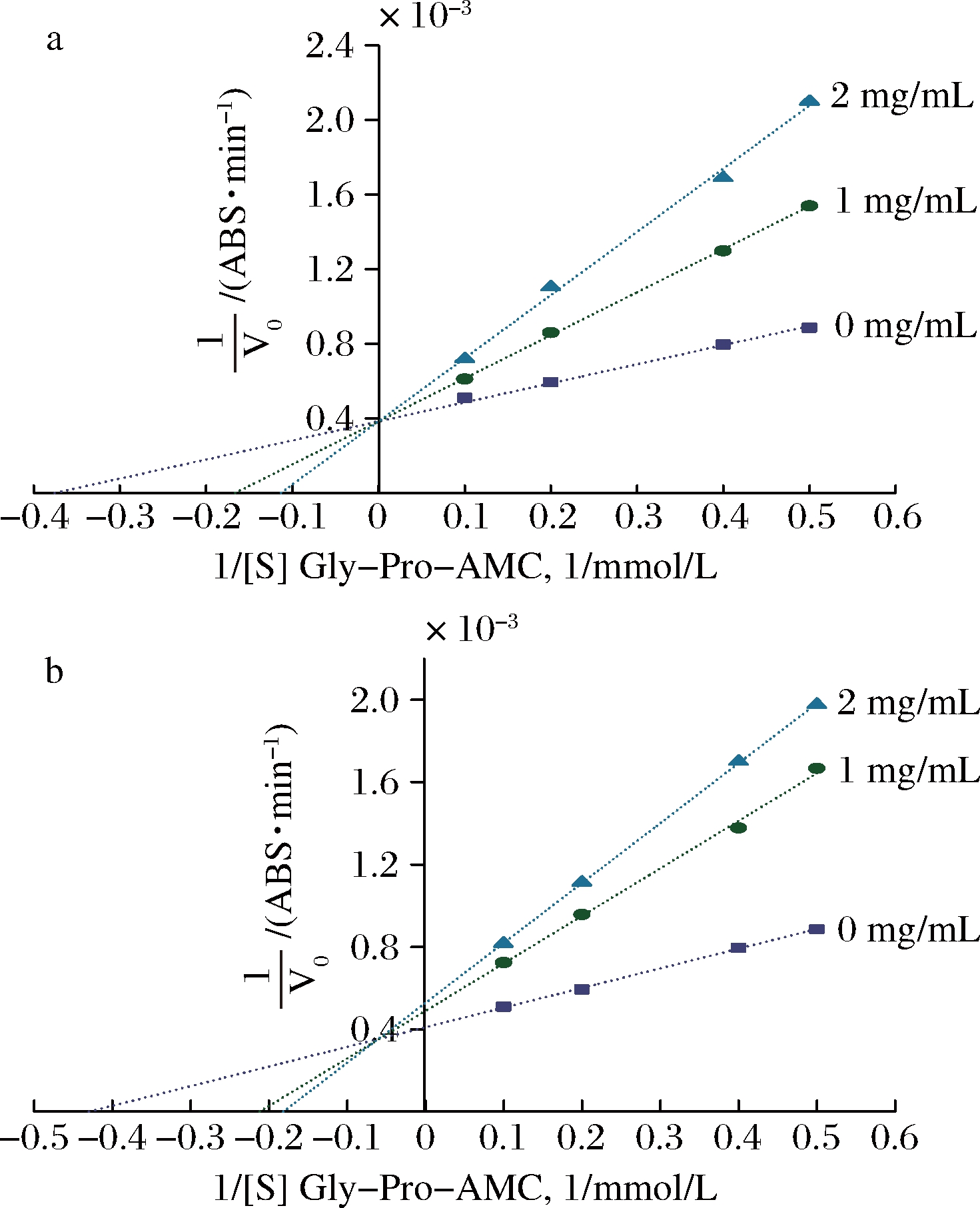
图5 DPP-IV抑制肽PALPSIPH(a)和PAFPHPLP(b)的Lineweaver-Buck双倒数图
Fig.5 Lineweaver-Buck double-reciprocal plot of peptides PSLPSIPH(a) and PAFPHPLP(b)
同时,PAFPHPLP比PALPSIPH表现出更高的DPP-IV抑制活性,这表明2种抑制方式的共同作用对DPP-IV的抑制效果可能更强。WANG等[9]通过研究羊皮基胶原蛋白肽发现,竞争/非竞争性混合型抑制肽GPAGPIGPV和GPAGPOFPG比其他合成肽的DPP-IV抑制活性更高;张颖[23]从牛乳蛋白中经分离纯化得到YPVEPF、APGPAGP和LPIIDI,这3条DPP-IV抑制肽表现出竞争/非竞争性混合型抑制剂的特点,它们对DPP-IV的抑制作用也较高,均与本实验结果一致。可能因为具有竞争/非竞争性混合型特征的抑制肽不被DPP-IV分解从而能够以原始的结构与DPP-IV活性位点结合,这种有效结合可能会对DPP-IV产生很大的抑制作用。
2.7 分子对接
为探究中国毛虾DPP-IV抑制肽的作用机理,使用分子对接分析多肽和DPP-IV受体间的相互作用位点和作用力类型。研究表明,DPP-IV是1种同源二聚体,每个亚基由2个催化结构域组成,即包含催化三联体(Ser630、Asp708和His740)的α/β水解酶结构和八叶β-螺旋桨折叠结构[24]。活性位点主要有疏水口袋S1和疏水口袋S2。疏水口袋S1包括疏水氨基酸残基(Try631、Val656、Trp659、Tyr662、Tyr666和Val711)和氧阴离子孔(Tyr547和Tyr631),S2口袋除了包括疏水性残基(Arg125、Phe357、Arg358、Tyr547、Pro550和Asn710)和氨基末端识别区(Glu205和Glu206)之外[25],还有1个位置在S2口袋之外的延伸口袋(Val207、Ser209、Phe357和Arg358)[26]。这些活性位点与多肽上的氨基酸残基结合后可以发挥DPP-IV抑制作用。PALPSIPH和PAFPHPLP与DPP-IV对接模型如图6所示。
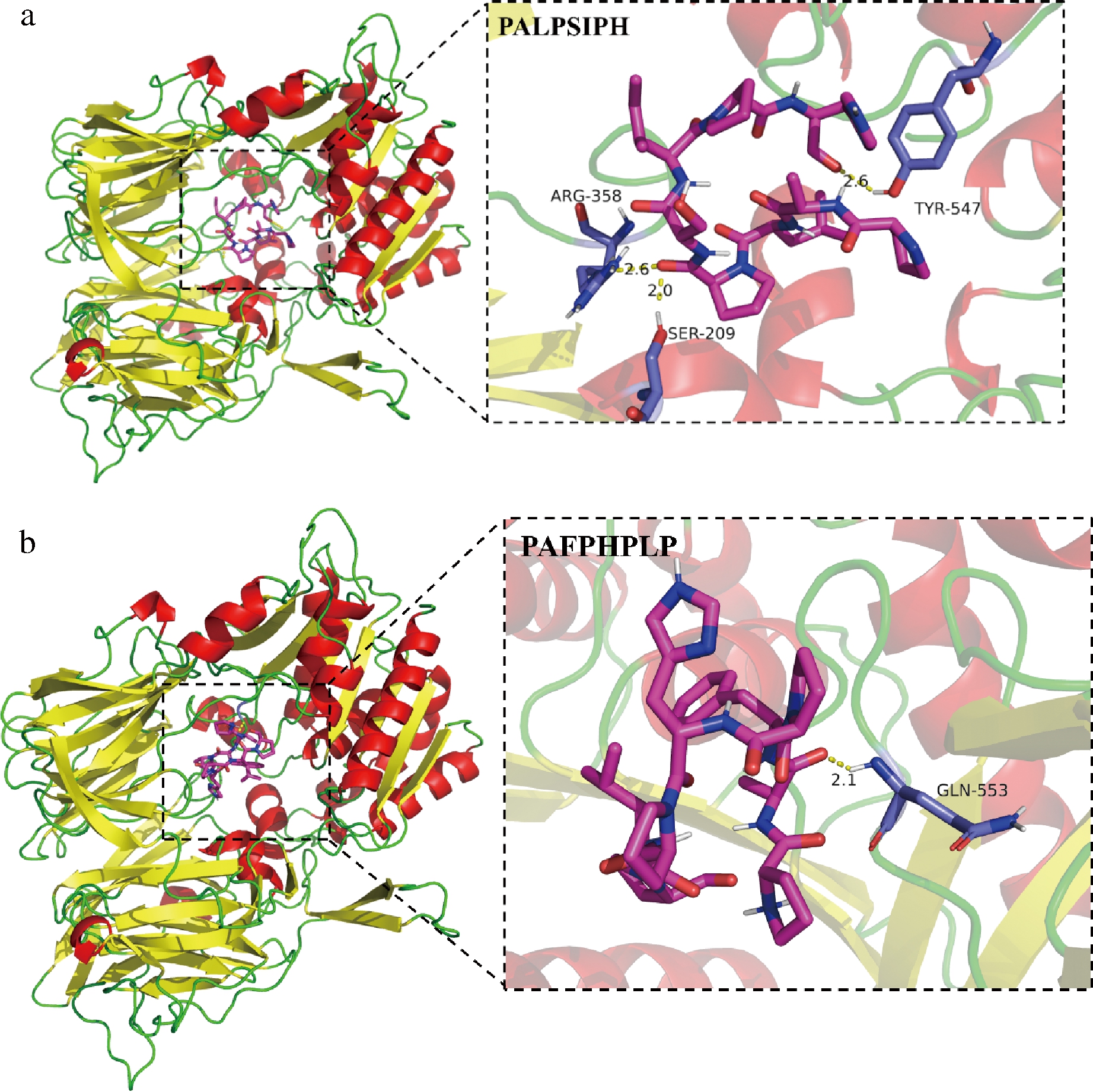
图6 PALPSIPH(a)和PAFPHPLP(b)与DPP-IV分子对接图
Fig.6 Molecular docking diagram of PSLPSIPH(a) and PAFPHPLP(b) with DPP-IV
注:紫红色短棒状模型表示DPP-IV抑制肽,蓝色/浅蓝色短棒状模型表示DPP-IV残基,黄色虚线表示氢键
可以看出2条DPP-IV抑制肽主要依靠氢键与DPP-IV残基连接来发挥潜在抑制作用的。PALPSIPH与DPP-IV之间的结合部位共有3处,且均为DPP的活性中心,即S2口袋中的Arg358和Try547、S2延伸口袋中的Ser209,这也证明了PALPSIPH与已知的DPP-IV活性位点之间形成氢键,表明该抑制肽对DPP-IV的作用类型属于竞争性抑制。PAFPHPLP与Gln533之间通过氢键作用力结合,而Gln33残基并不属于已报道的DPP-IV活性中心,也说明PAFPHPLP与DPP-IV之间存在非竞争性抑制。
PSLPSIPH和PAFPHPLP 2条DPP-IV抑制肽可以与DPP-IV结合从而起到抑制作用,表2展示了多肽经分子对接模拟得到的对接能量参数结果。其中结合能的绝对值越大,配体和受体结合释放的能力越多,说明对接效果越好[27]。PSLPSIPH和PAFPHPLP与DPP-IV酶之间的对接结合能分别为-8.45 kcal/mol和-8.55 kcal/mol,其中PAFPHPLP其他能量参数值均小于PSLPSIPH,这表明PAFPHPLP与DPP-IV结合形成的复合物更稳定,对DPP-IV抑制效果也更好。这一对接结果与体外DPP-IV抑制活性结果相印证,即表明PAFPHPLP对DPP-IV的抑制作用更强。
表2 多肽与DPP-IV分子对接模拟的能量参数
Table 2 Binding energy parameters of peptides and DPP-IV obtained by molecular docking simulation

DPP-IV抑制肽束缚自由能分子间能静电能结合能/(kcal·mol-1)PALPSIPH-4.01-10.27-0.58-8.45PAFPHPLP-5.9-11.26-1.58-8.55
3 结论
中国毛虾经动物蛋白酶水解得到的酶解液具有一定的DPP-IV抑制活性,其中对DPP-IV酶有抑制作用的组分主要富集在低分子质量多肽(分子质量<3 kDa)中。超滤组分ACH-3再经Sephadex G-15和RP-HPLC分离纯化和LC-MS/MS技术对抑制活性最高的组分进行结构鉴定,经数据库检索和结构特征对比,最后筛选出YGGQFPTRPD、PALPSIPH、IFTAPQVP、PAFPHPLP和LGDAPGEVP 5条DPP-IV抑制肽。通过固相合成和活性验证可知PALPSIPH和PAFPHPLP对DPP-IV的抑制效果较强,结果表明PALPSIPH,分子质量为830.5 Da,IC50值为(2.68±0.14) mmol/mL,与DPP-IV活性位点中的Arg358、Try547和Ser209通过氢键相结合,属于竞争性抑制;PAFPHPLP,分子质量为874.5 Da,IC50值为(1.61±0.06) mg/mL,通过氢键连接DPP-IV活性中心以外的Gln533残基,说明二者之间存在非竞争性抑制。本文以中国毛虾为原料制备得到了2条活性较好的DPP-IV抑制肽,不仅为中国毛虾的高值化利用和资源开发提供了新的方向,同时为天然来源的食源性DPP-IV抑制肽研究提供了基础理论依据,以期为中国毛虾作为潜在的功能性水产原料奠定基础。
[1] ROGLIC G.WHO Global report on diabetes:A summary[J].International Journal of Noncommunicable Diseases, 2016, 1(1):3.
[2] 林媛媛. 2型糖尿病临床诊断和治疗的研究进展[J].中国医学创新, 2021, 18(16):185-188.
LIN Y Y.Progress in the clinical diagnosis and treatment of type 2 diabetes[J].Medical Innovation of China, 2021, 18(16):185-188.
[3] GUPTA A, AL-AUBAIDY H A, MOHAMMED B I.Glucose dependent insulinotropic polypeptide and dipeptidyl peptidase inhibitors:Their roles in management of type 2 diabetes mellitus[J].Diabetes & Metabolic Syndrome:Clinical Research & Reviews, 2016, 10(2):S170-S175.
[4] 曹文红, 章超桦, 谌素华, 洪鹏志.中国毛虾营养成分分析与评价[J].福建水产, 2001, 23(1):8-14.
CAO W H, ZHANG C H, CHEN S H, et al.Analysis and evaluation of nutrients of Acetes chinensis[J].Journal of Fujian Fisheries, 2001, 23(1):8-14.
[5] 王海涛, 王伟, 陈铭, 等.中国毛虾流感病毒神经氨酸酶抑制活性肽的研究[J].高等学校化学学报, 2013, 34(11):2 540-2 545.
WANG H T, WANG W, CHEN M, et al.Active peptide from Acetes chinensis with inhibitory activity on neuraminidase of influenza virus[J].Chemical Journal of Chinese Universities, 2013, 34(11):2 540-2 545.
[6] 付雪艳, 薛长湖, 宁岩, 等.中国毛虾酶解多肽降压作用的初步探讨[J].海洋科学, 2005, 29(3):20-24.
FU X Y, XUE C H, NING Y, et al.Study of antihypertensive effect of polypeptides from Acetes chinensis on renovasular antihypertensive rats[J].Marine Sciences, 2005, 29(3):20-24.
[7] LANG M, SONG Y S, LI Y, et al.Purification, identification, and molecular mechanism of DPP-IV inhibitory peptides from defatted Antarctic krill powder[J].Journal of Food Biochemistry, 2021, 45(9):e13872.
[8] 陈宏. 牡蛎DPP-Ⅳ抑制肽的分离纯化及其作用机理研究[D].厦门:集美大学, 2020.
CHEN H.Purification and interaction mechanism of DPP-Ⅳ inhibitory peptides from Pacific oyster(Crassostrea gigas)[D].Xiamen:Jimei University, 2020.
[9] WANG B B, YU Z, YOKOYAMA W, et al.Collagen peptides with DPP-IV inhibitory activity from sheep skin and their stability to in vitro gastrointestinal digestion[J].Food Bioscience, 2021, 42:101161.
[10] 汪学荣, 周玲, 阚建全.牛血清蛋白的超滤提取工艺研究[J].食品工业科技, 2010, 31(4):289-292.
WANG X R, ZHOU L, KAN J Q.Study on extraction of bovine serum albumin by ultrafiltration technique[J].Science and Technology of Food Industry, 2010, 31(4):289-292.
[11] JIN R T, TENG X Y, SHANG J Q, et al.Identification of novel DPP-IV inhibitory peptides from Atlantic salmon (Salmo salar) skin[J].Food Research International, 2020, 133:109161.
[12] 尹剑, 武瑞赟, 胡锦蓉, 等.鲟鱼皮中二肽基肽酶-IV抑制肽的分离纯化与鉴定[J].食品科学, 2022, 43(6):195-203.
YIN J, WU R Y, HU J R, et al.Puriflcation and identiflcation of dipeptidyl peptidase IV inhibitory peptide from sturgeon skin collagen[J].Food Science, 2022, 43(6):195-203.
[13] CHI C F, WANG B, WANG Y M, et al.Isolation and characterization of three antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) heads[J].Journal of Functional Foods, 2015, 12:1-10.
[14] 陈宏, 章骞, 陈玉磊, 等.利用牡蛎制备DPP-Ⅳ抑制肽及其活性分析[J].食品科学, 2021, 42(10):120-126.
CHEN H, ZHANG Q, CHEN Y L, et al.Preparation and activity analysis of DPP-Ⅳ inhibitory peptides from Pacific oyster(Crassostrea gigas)[J].Food Science, 2021, 42(10):120-126.
[15] 李健民, 卓越, 张毅达, 等.尺寸排阻-反相液相色谱-质谱联用技术在大鼠肾脏翻译后修饰蛋白质鉴定中的应用[J].色谱, 2021, 39(1):87-95.
LI J M, ZHUO Y, ZHANG Y D, et al.Size exclusion-reverse liquid column chromatography-mass spectrometry and its application in the identification of post-translationally modified proteins in rat kidney[J].Chinese Journal of Chromatography, 2021, 39(1):87-95.
[16] GU H F, GAO J, SHEN Q, et al.Dipeptidyl peptidase-IV inhibitory activity of millet protein peptides and the related mechanisms revealed by molecular docking[J].LWT, 2021, 138:110587.
[17] AMINI SARTESHNIZI R, SAHARI M A, AHMADI GAVLIGHI H, et al.Influence of fish protein hydrolysate-pistachio green hull extract interactions on antioxidant activity and inhibition of α-glucosidase, α-amylase, and DPP-IV enzymes[J].LWT, 2021, 142:111019.
[18] LACROIX I M E, LI-CHAN E C Y.Food-derived dipeptidyl-peptidase IV inhibitors as a potential approach for glycemic regulation-Current knowledge and future research considerations[J].Trends in Food Science & Technology, 2016, 54:1-16.
[19] NONGONIERMA A B, PAOLELLA S, MUDGIL P, et al.Identification of novel dipeptidyl peptidase IV (DPP-IV) inhibitory peptides in camel milk protein hydrolysates[J].Food Chemistry, 2018, 244:340-348.
[20] SINGH A K, JATWA R, PUROHIT A, et al.Synthetic and phytocompounds based dipeptidyl peptidase-IV (DPP-IV) inhibitors for therapeutics of diabetes [J].Journal of Asian Natural Products Research, 2017,19(10):1 036-1 045.
[21] HARNEDY-ROTHWELL P A, MCLAUGHLIN C M, O’KEEFFE M B, et al.Identification and characterisation of peptides from a boarfish (Capros aper) protein hydrolysate displaying in vitro dipeptidyl peptidase-IV (DPP-IV) inhibitory and insulinotropic activity[J].Food Research International, 2020,131:108989.
[22] GARZ N A G, VERAS F F, BRANDELLI A, et al.Purification, identification and in silico studies of antioxidant, antidiabetogenic and antibacterial peptides obtained from sorghum spent grain hydrolysate[J].LWT, 2022, 153:112414.
N A G, VERAS F F, BRANDELLI A, et al.Purification, identification and in silico studies of antioxidant, antidiabetogenic and antibacterial peptides obtained from sorghum spent grain hydrolysate[J].LWT, 2022, 153:112414.
[23] 张颖. 牛、羊乳酪蛋白源DPP-Ⅳ抑制肽的制备、鉴定及抑制机理研究[D].北京:中国农业大学, 2016.
ZHANG Y.Enzymatic preparation, identification and inhibition mechanism of DPP-Ⅳ inhibitory peptides derived from bovine and caprine milk casein[D].Beijing:China Agricultural University, 2016.
[24] THOMA R, LÖFFLER B, STIHLE M, et al.Structural basis of proline-specific exopeptidase activity as observed in human dipeptidyl peptidase-IV[J].Structure, 2003, 11(8):947-959.
[25] 王贝贝. 羊皮胶原基DPP-Ⅳ抑制活性肽的制备及活性机制分析[D].无锡:江南大学, 2021.
WANG B B.Preparation and mechanism analysis of DPP-Ⅳ inhibitory peptides of sheepskin collagen[D].Wuxi:Jiangnan University, 2021.
[26] KUHN B, HENNIG M, MATTEI P.Molecular recognition of ligands in dipeptidyl peptidase IV[J].Current Topics in Medicinal Chemistry, 2007, 7(6):609-619.
[27] 刘吉元. 蛋白质与配体相互作用分子模拟研究[D].杨凌:西北农林科技大学, 2014.
LIU J Y.In silico study of protein-ligand interactions[D].Yangling:Northwest A &F University, 2014.