活性氧(reactive oxygen species,ROS)是细胞中广泛分布的具有生理活性的代谢产物。正常情况下,动物体内的ROS处于动态平衡状态,抗氧化防御系统调节体内ROS的产生和代谢[1]。动物屠宰后,由于机体内氧化还原稳态被破坏,ROS不断积累,产生氧化应激,导致蛋白质氧化、细胞凋亡等一系列反应,影响肉的嫩度。有研究发现,氧化应激造成的蛋白质氧化可以通过增加蛋白质分子的交联聚合,减弱钙蛋白酶(calpain)活性等途经,影响骨架蛋白的降解,从而降低肉的嫩度[2]。CHEN等[3]发现高氧气调包装会导致猪背最长肌中发生氧化应激,蛋白质氧化程度增加,抑制μ-calpain的活性从而影响肌原纤维蛋白的降解,导致猪肉的嫩度降低。但同时有研究发现,高强度宰前应激导致罗非鱼体内产生氧化应激,使鱼肉的嫩度提高[4]。李孟孟[5]也发现氧化应激处理后的羊肉中细胞凋亡酶(caspase)活性和肌原纤维小片化指数显著增加。CHEN等[6]通过体外实验证明,氧化应激处理后的肌间线蛋白(desmin)的构象改变,更易被caspases降解。
目前氧化应激对肉嫩度的影响暂不明确,且多从蛋白质氧化或细胞凋亡等途径单方面进行解释。因此本实验采用H2O2浸泡处理牛背最长肌,人为创造氧化应激条件,探究在牛肉宰后初期氧化应激途径中蛋白质氧化和细胞凋亡的变化,并阐述其调控牛肉嫩度的机制。
1 材料与方法
1.1 材料与仪器
本实验随机选取6头20月龄饲养方式、生长环境一致的西门塔尔杂交阉割公牛(山东菏泽曹县商都恒昌清真肉类有限公司,胴体质量约为360 kg,pH24为5.4~5.8)作为实验样本。
H2O2、三氯乙酸、2,4-二硝基苯肼(dinitrophenylhydrazine,DNPH),天津凯通化学试剂有限公司;N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC),上海麦克林生化科技有限公司;生理盐水,辰欣药业股份有限公司;BCA试剂盒,北京康为世纪生物科技有限公司;2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)、desmin一抗,Sigma-Aldrich;EDTA、SDS、盐酸胍、溴酚蓝(bromophenol blue,BPB),北京索莱宝科技有限公司;钙测试盒(C004-2-1),南京建成生物工程研究所有限公司;TUNEL检测试剂盒、蛋白免疫印迹二抗,武汉赛维尔生物科技有限公司。
HH-4型数显恒温水浴锅,常州国华电器有限公司;TA-XT2i型质构仪,英国Stable Micro System公司;JXFSTPRP-Ⅱ型冷冻研磨仪,中国净信实业发展有限公司;5804R型高速冷冻离心机,德国Eppendorf公司;SpectraMax M5型酶标仪,美国Molecular Devices公司。
1.2 实验方法
1.2.1 样品处理
肉牛经商业流程屠宰后,在放血30 min内取左半胴体背最长肌,立即使用液氮冷冻约30 g肉样作为0 h样本,并将剩余肉样迅速切分为2.5 cm厚的牛排(用于剪切力的测定)和1 cm×1 cm×0.5 cm大小均匀的肉块,随机分为3组。按照肉液比1∶1(g∶mL),将肉样分别浸泡在20 mmol/L H2O2(氧化应激组)、20 mmol/L NAC(ROS清除剂,抑制应激组)和0.9%的生理盐水(对照组)中,在16 ℃下孵育至6 h后(避免冷收缩),继续在4 ℃下孵育至12、24、72和168 h。在相应时间点测定剪切力,将部分肉样在质量分数4%多聚甲醛中固定,用于末端脱氧核苷酸转移酶介导的缺口末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)的测定,并留取约30 g肉样在液氮冷冻后于-80 ℃保存,用于后续肌原纤维蛋白降解、蛋白质氧化等指标的测定。
1.2.2 ROS相对含量的测定
参考张玉林[7]的方法并稍作修改。将0.5 g肉样加入5 mL Tris-HCl缓冲液(10 mmol/L Tris-HCl,0.1 mmol/L EDTA-2Na,0.008 g/mL NaCl,10 mmol/L 蔗糖,pH 7.4)中,使用冷冻研磨仪研磨3次(4 ℃,45 Hz,每次45 s),于4 ℃下4 000×g离心15 min收集上清液,并用BCA试剂盒测定蛋白浓度。将100 μL上清液与100 μL反应缓冲液(10 mmol/L Tris-HCl,0.1 mmol/L EDTA-2Na,0.008 g/mL NaCl,10 mmol/L 蔗糖,15 μmol/L DCFH-DA,pH 7.4)混合,迅速用酶标仪测定0 min的荧光值。在37 ℃下孵育30 min后再次测定荧光值。ROS的相对含量按照公式(1)计算:
ROS相对含量/[荧光强度·(mg protein)-1]=
(1)
1.2.3 剪切力的测定
参考HOU等[8]的方法,将宰后0、1、3、7 d的牛排置于真空包装袋中,牛排的中心部位插入温度计,于80 ℃水浴加热至中心温度70 ℃,牛排在室温下冷却后放置于4 ℃过夜。用直径为1.27 cm的空心取样器沿着肌纤维方向取出肉柱(避开脂肪和筋腱),使用质构仪测定肉柱的剪切力(测前速度2.0 mm/s;测中速度1.0 mm/s;测后速度5.0 mm/s;触发力0.098 N;下压距离23.0 mm;探头类型:HDP/BSW),牛排的剪切力值(N)为该牛排各个肉柱测定结果的平均值。
1.2.4 全蛋白质的提取
将0.5 g肉样加入5 mL 10 mmol/L磷酸盐缓冲液(含2% SDS,pH 7.0)中,使用冷冻研磨仪研磨3次(4 ℃,45 Hz,每次45 s),于4 ℃下12 000×g离心20 min,上清液即为全蛋白提取物。用BCA试剂盒测定蛋白浓度后,用上述磷酸盐缓冲液调整蛋白质浓度至10 mg/mL。将蛋白质溶液与等体积的上样缓冲液(100 mmol/L Tris-base,4% SDS,20% 甘油,5 mmol/L EDTA,体积分数0.8% β-巯基乙醇,质量分数0.005% BPB,pH 7.0)充分混合,95 ℃金属浴5 min,室温冷却后分装样品,-80 ℃储存用于蛋白质免疫印迹的测定。
1.2.5 蛋白质免疫印迹
采用5%的浓缩胶和10%的分离胶进行电泳。浓缩胶恒压90 V电泳30 min,分离胶恒压120 V电泳至BPB跑至分离胶底部。凝胶在恒压90 V冰浴转印90 min,将目的蛋白转印至聚偏氟乙烯(poly vinylidene fluoride,PVDF)膜上。转印后将PVDF膜在含有5%脱脂奶粉的洗膜缓冲液(tris buffered saline tween,TBST)(20 mmol/L Tris-base,137 mmol/L NaCl,5 mmol/L KCl和0.1% 吐温-20)中室温封闭1.5 h。desmin一抗按体积比1∶500用TBST稀释,将封闭后的膜置于一抗溶液中,在摇床上4 ℃孵育过夜。孵育结束后用TBST溶液洗膜3次,每次10 min。之后将膜放入用TBST稀释的二抗溶液(1∶5 000)中室温孵育1.5 h,再用TBST溶液洗膜3次,每次10 min。将ECL显影液避光与膜反应2 min,用凝胶成像仪拍照观察。
1.2.6 蛋白质羰基含量及表面疏水性的测定
将0.5 g肉样加入5 mL试剂Ⅰ(100 mmol/L Tris-base,10 mmol/L EDTA,pH 8.3)中,使用冷冻研磨仪研磨3次(4 ℃,45 Hz,每次45 s),于4 ℃下13 000×g离心40 min后倒掉上清液。向沉淀中加入5 mL试剂Ⅱ(20 mmol/L 磷酸盐缓冲液,0.6 mol/L NaCl,pH 6.5),研磨2次(4 ℃,35 Hz,每次30 s),于4 000×g下离心10 min,上清液即为肌原纤维蛋白提取物,并用BCA试剂盒测定蛋白浓度。
蛋白质羰基含量的测定参考SOYER等[9]的方法并稍作修改。取3份肌原纤维蛋白各30 μL,2份作为实验组各加入1 mL 10 mmol/L DNPH溶液(2 mol/L HCl溶液溶解),1份作为对照组加入1 mL 2 mol/L的HCl溶液。混匀后置于37 ℃避光反应1 h,反应期间每隔20 min取出样品振荡混匀。反应结束后,实验组和对照组各加入0.5 mL质量分数20%的三氯乙酸溶液,混匀后于4 ℃下10 000×g离心15 min。沉淀用1 mL无水乙醇和乙酸乙酯的混合液(1∶1,mL∶mL)于4 ℃下12 000×g离心洗涤10 min,重复洗涤步骤3次并吹干。将洗涤后的沉淀溶解在1.5 mL 6 mol/L的盐酸胍溶液(试剂Ⅱ溶解)中,于370 nm处测定吸光度。蛋白质羰基含量(nmol/mg protein)使用摩尔吸光系数22 000 M-1 cm-1计算。
蛋白质表面疏水性的测定参考CHELH等[10]的方法并稍作修改。用试剂Ⅱ调整肌原纤维蛋白的浓度至3 mg/mL,取2份1 mL肌原纤维蛋白溶液作为实验组,并以试剂Ⅱ作为对照组,各加入200 μL 1 mg/mL的BPB溶液,混匀后室温反应15 min。反应结束后,于4 ℃下5 000×g离心15 min。用试剂Ⅱ将上清液稀释10倍后于595 nm处测定吸光值,以结合态BPB作为蛋白质表面疏水性指数,结合态BPB按照公式(2)计算:
结合态![]()
(2)
1.2.7 肌浆内Ca2+浓度的测定
参考POMPONIO等[11]的方法并稍作修改。称取2 g肉样,切碎后在冰上孵育20 min,于4 ℃下13 000×g离心30 min收集肌浆上清液,并用双缩脲法测定蛋白浓度。用钙测试盒(C004-2-1)检测肌浆内Ca2+浓度。取10 μL肌浆上清液与250 μL检测工作液混匀,静置5 min后立即在610 nm处测定吸光值,同时以1 mmol/L的钙标准液作为标准(C标准),以去离子水作为空白。肌浆内Ca2+浓度按照公式(3)计算:
肌浆内Ca2+浓度/(mmol·g-1)=
(3)
1.2.8 细胞凋亡率的测定
根据TUNEL检测试剂盒方法进行测定。对4%多聚甲醛溶液中固定的肉样进行石蜡包埋、切片、脱蜡处理。将切片浸于1×PBS缓冲液(pH 7.4)中漂洗3次,每次5 min。向切片上滴加蛋白酶K工作液覆盖组织,37 ℃反应20 min;使用1×PBS浸洗。向每个切片上滴加破膜液(0.1% triton)覆盖组织,常温下孵育20 min;使用1×PBS浸洗。切片稍甩干后滴加缓冲液覆盖组织,常温下孵育10 min。根据组织切片大小滴加适量反应液至覆盖组织,切片于湿盒内37 ℃孵育2 h;孵育结束后再次浸洗。切片稍甩干后滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染液,避光室温孵育10 min;再次浸洗。用抗荧光淬灭封片剂封片,切片于荧光显微镜下观察并采集图像。
1.3 数据处理
使用Quantity One 4.6.2软件对蛋白质免疫印迹条带进行分析,使用Image-Pro Plus 6.0软件对TUNEL结果中的荧光细胞进行计数,使用SAS 9.0软件中的混合模型对数据进行方差分析,使用Origin 2018软件进行绘图。试验结果采用平均值±标准差表示。
2 结果与分析
2.1 氧化应激处理对牛肉宰后初期ROS相对含量的影响
ROS作为细胞内重要的信号因子,广泛参与细胞凋亡信号传递等生理生化过程。动物屠宰后,机体内抗氧化防御系统的能力逐渐降低,机体不能及时清除ROS而造成其不断积累,导致氧化应激水平增加。
如图1所示,在整个实验过程中,与对照组相比,氧化应激组的ROS相对含量显著升高(P<0.05),抑制应激组的ROS相对含量显著降低(P<0.05),说明H2O2处理显著提高了宰后牛肉细胞内的氧化应激水平,而ROS清除剂NAC处理显著抑制了细胞内的氧化应激水平。氧化应激组的ROS相对含量随着宰后时间的延长而不断增加,在宰后6~24 h增长趋势较为平缓;抑制应激组的ROS相对含量在宰后6 h显著下降(P<0.05),在宰后12~24 h内变化不显著(P>0.05);同样,对照组的ROS相对含量在宰后6~24 h内变化不显著(P>0.05)。与本研究结果相似,张玉林[7]也发现在鹅肉早期成熟过程中ROS相对含量变化不显著,NAC处理导致鹅肉早期成熟过程中ROS相对含量显著下降。这可能是由于宰后早期,肌肉细胞中的抗氧化物质仍在发挥作用,清除了部分ROS,在一定程度上减缓了氧化应激的进程,而随着宰后成熟时间的延长,机体抗氧化防御系统被耗尽,氧化应激程度显著增加。

图1 氧化应激处理对牛肉宰后初期ROS相对含量的影响
Fig.1 Effect of oxidative stress on ROS relative content of beef in early postmortem
注:a~e表示同一处理方式不同贮藏时间差异达到显著水平(P<0.05);x~z表示同一贮藏时间不同处理方式差异达到显著水平(P<0.05)
2.2 氧化应激处理对牛肉宰后初期剪切力的影响
由表1可以看出,贮藏时间与处理方式对剪切力无交互作用(P>0.05),但处理方式与贮藏时间的主效应分别影响显著(P<0.05)。牛肉剪切力值呈现先上升后下降的趋势,在宰后1 d达到最大值(107.31 N)。氧化应激组的剪切力值显著低于抑制应激组(P<0.05),在宰后成熟第3天和第7天,氧化应激组的剪切力值分别是抑制应激组的83.32%和87.97%,说明H2O2处理引起的氧化应激显著加快了牛肉宰后成熟过程中的嫩化速度。与本研究结果相似,WANG等[12]也发现H2O2处理后的牦牛肉剪切力值显著降低,并证明氧化应激可以通过激活细胞线粒体凋亡通路,增强caspase的活性,进而提高嫩度。
表1 氧化应激处理对牛肉宰后初期剪切力的影响
Table 1 Effect of oxidative stress on Warner-Bratzler shear force of beef in early postmortem
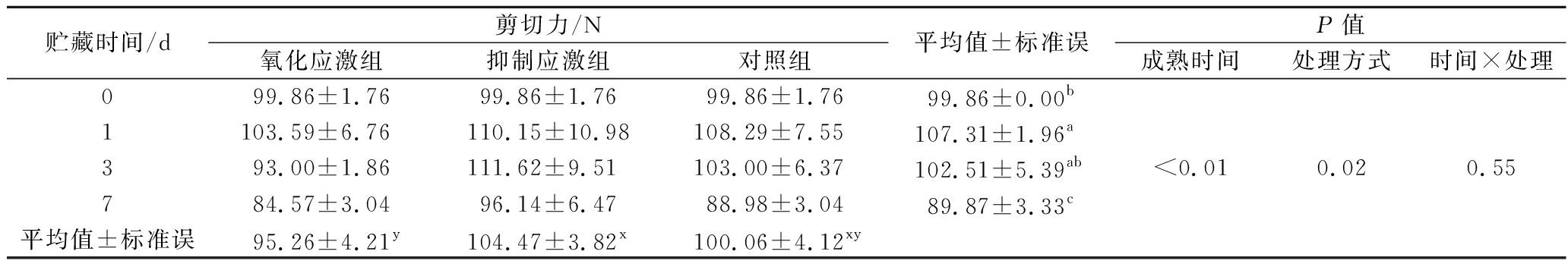
贮藏时间/d剪切力/N氧化应激组抑制应激组对照组平均值±标准误P值成熟时间处理方式时间×处理099.86±1.7699.86±1.7699.86±1.7699.86±0.00b1103.59±6.76110.15±10.98108.29±7.55107.31±1.96a393.00±1.86111.62±9.51103.00±6.37102.51±5.39ab<0.010.020.55784.57±3.0496.14±6.4788.98±3.0489.87±3.33c平均值±标准误95.26±4.21y104.47±3.82x100.06±4.12xy
注:a~c表示不同贮藏时间差异达到显著水平(P<0.05);x~y表示不同处理方式差异达到显著水平(P<0.05)(下同)
2.3 氧化应激处理对牛肉宰后初期desmin降解程度的影响
Desmin作为重要的肌原纤维蛋白,是嫩度的标志蛋白之一,其降解是肉宰后成熟过程中嫩化的必要条件[13]。SMUDER等[14]研究发现,肌原纤维蛋白暴露在不同程度的H2O2氧化条件下,都不会自发的降解,表明肌原纤维蛋白的降解程度并不依赖于H2O2处理的直接作用。从图2和表2中可以看出,desmin在宰后前6 h的降解程度变化不显著(P>0.05),而后降解程度随着成熟时间的延长而不断增加。
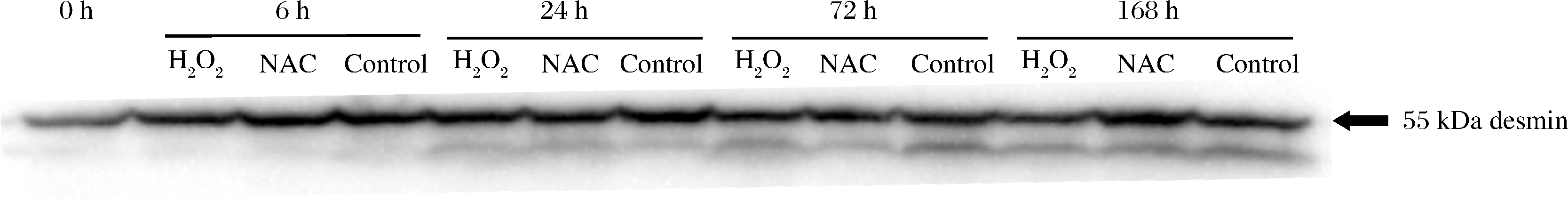
图2 氧化应激处理对牛肉宰后初期desmin降解程度的影响
Fig.2 Effect of oxidative stress on the degradation of desmin of beef in early postmortem
注:H2O2表示氧化应激组,NAC表示抑制应激组,Control表示对照组(下同)
表2 氧化应激处理对牛肉宰后初期desmin降解程度的影响
Table 2 Effect of oxidative stress on the degradation of desmin of beef in early postmortem

贮藏时间/h处理方式氧化应激组抑制应激组对照组平均值±标准误P值成熟时间处理方式时间×处理01.00±0.001.00±0.001.00±0.001.00±0.00a60.99±0.031.06±0.031.00±0.021.02±0.02a240.80±0.030.93±0.010.85±0.030.86±0.04b720.67±0.050.82±0.040.74±0.060.75±0.04c1680.51±0.080.59±0.090.52±0.080.54±0.03d平均值±标准误0.79±0.09y0.88±0.08x0.82±0.09y<0.01<0.010.85
与抑制应激组相比,氧化应激组desmin的降解程度显著增加(P<0.05),表明氧化应激处理导致肌原纤维蛋白降解程度增加,从而加速了牛肉的嫩化进程。与剪切力值结果相一致,这也表明氧化应激处理加速肌原纤维降解是牛肉嫩化加速的主要原因。
2.4 氧化应激处理对牛肉宰后初期蛋白质羰基含量及表面疏水性的影响
羰基含量的增加是蛋白质氧化最显著的变化之一,是检测蛋白质氧化最常用的指标。蛋白质表面疏水性在维持蛋白质三级结构方面起着重要作用,当蛋白质被氧化时,其构象发生改变,蛋白质分子内被包埋的疏水基团暴露,导致表面疏水性增加[15]。
如表3所示,3个处理组的蛋白质羰基含量和表面疏水性均随着成熟时间的延长而不断增加,但在宰后6~12 h变化不显著(P>0.05),与ROS相对含量相对应。氧化应激组与其他2组相比,蛋白质羰基含量和表面疏水性显著升高(P<0.05),表明氧化应激处理显著提高了牛肉宰后成熟过程中蛋白质氧化水平,导致蛋白质构象改变。与本研究结果相似,崔文斌等[16]发现随着H2O2处理浓度的增加,牦牛肉肌原纤维蛋白氧化应激水平增加,蛋白质羰基含量也随之增加。张玉林等[17]研究发现色氨酸残基具有很强的疏水性,H2O2处理会促使色氨酸残基从被包埋状态中暴露出来,从而增加蛋白质的表面疏水性。
表3 氧化应激处理对牛肉宰后初期蛋白质羰基含量及表面疏水性的影响
Table 3 Effect of oxidative stress on protein carbonyl content and surface hydrophobicity of beef in early postmortem
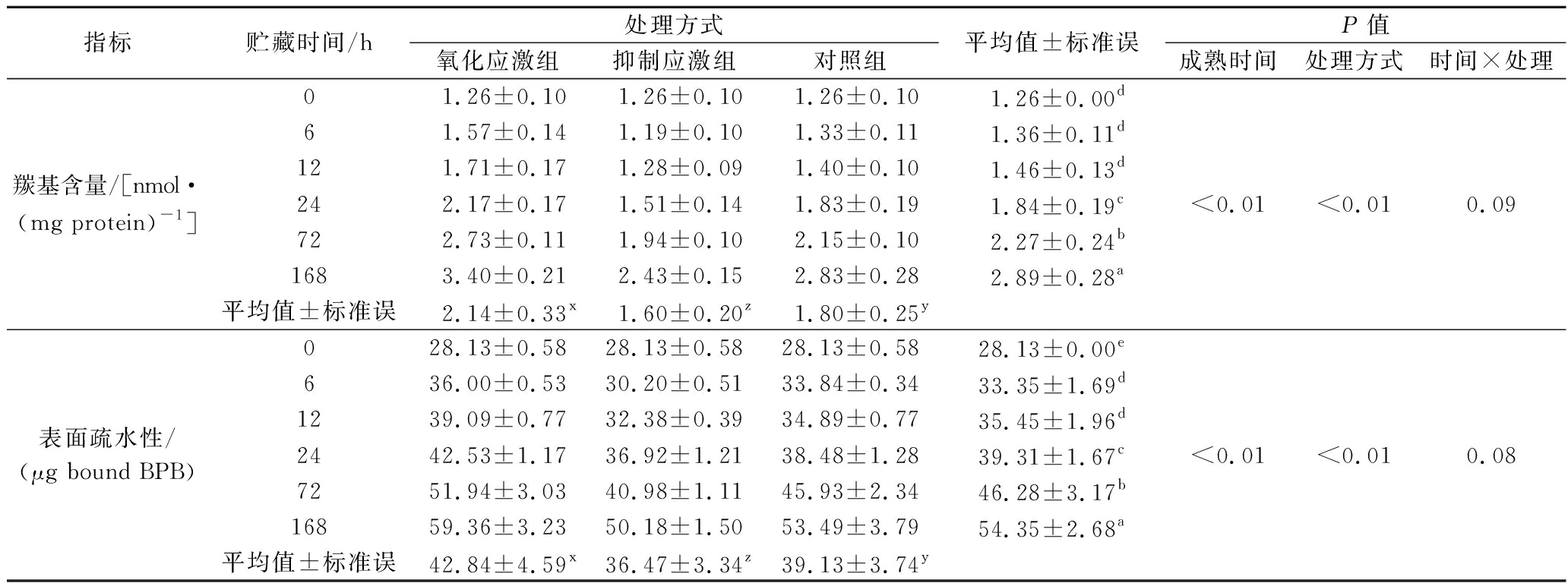
指标贮藏时间/h处理方式氧化应激组抑制应激组对照组平均值±标准误P值成熟时间处理方式时间×处理羰基含量/[nmol·(mg protein)-1]01.26±0.101.26±0.101.26±0.101.26±0.00d61.57±0.141.19±0.101.33±0.111.36±0.11d121.71±0.171.28±0.091.40±0.101.46±0.13d242.17±0.171.51±0.141.83±0.191.84±0.19c722.73±0.111.94±0.102.15±0.102.27±0.24b1683.40±0.212.43±0.152.83±0.282.89±0.28a平均值±标准误2.14±0.33x1.60±0.20z1.80±0.25y<0.01<0.010.09表面疏水性/(μg bound BPB)028.13±0.5828.13±0.5828.13±0.5828.13±0.00e636.00±0.5330.20±0.5133.84±0.3433.35±1.69d1239.09±0.7732.38±0.3934.89±0.7735.45±1.96d2442.53±1.1736.92±1.2138.48±1.2839.31±1.67c7251.94±3.0340.98±1.1145.93±2.3446.28±3.17b16859.36±3.2350.18±1.5053.49±3.7954.35±2.68a平均值±标准误42.84±4.59x36.47±3.34z39.13±3.74y<0.01<0.010.08
注:a~e表示不同贮藏时间差异达到显著水平(P<0.05);x~z表示不同处理方式差异达到显著水平(P<0.05)
MALHEIROS等[18]研究发现安格斯杂交牛的嫩度与氧化应激造成的蛋白质氧化程度呈正相关关系,推测ROS导致的氧化应激会在细胞凋亡过程中诱导产生caspase,caspase与calpain协同降解肌原纤维蛋白,且蛋白质氧化修饰会使肌原纤维蛋白更易被蛋白酶识别降解。FU等[19]也研究发现,体外氧化后的肌球蛋白氧化位点暴露,更容易被μ-calpain和caspase-3降解。因此,氧化应激引起的氧化修饰,以及构象改变导致蛋白质分子部分展开、酶解位点暴露,可能会使肌原纤维蛋白的酶水解敏感性更高,从而加速嫩化过程。
2.5 氧化应激处理对牛肉宰后初期肌浆内Ca2+浓度及细胞凋亡率的影响
Ca2+是细胞凋亡的始动信号分子,其浓度的变化与细胞凋亡密切相关。ROS造成的氧化应激能够破坏细胞膜、线粒体膜以及内质网等细胞器,使细胞外Ca2+内流,肌浆内Ca2+浓度增加,导致线粒体钙超载,线粒体膜通透性增加,进而释放细胞色素c和凋亡因子,诱导caspase级联反应,最终导致细胞凋亡[20]。
图3中,蓝色荧光和绿色荧光总数为总细胞数,绿色荧光为凋亡细胞数,细胞凋亡率即为凋亡细胞数/总细胞数。如表4所示,随着成熟时间的延长,肌浆内Ca2+浓度及细胞凋亡率显著增加(P<0.05),在宰后168 h,细胞凋亡率达到44.02%。与对照组相比,氧化应激组的肌浆内Ca2+浓度及细胞凋亡率显著增加(P<0.05),而抑制应激组的肌浆内Ca2+浓度及细胞凋亡率显著降低(P<0.05)。在宰后成熟过程中,氧化应激组的细胞凋亡率相比于抑制应激组增加了29.10%,相比于对照组增加了15.62%,表明氧化应激处理显著提高了牛肉宰后成熟过程中细胞凋亡程度。与本研究结果相似,赵培等[21]研究发现,H2O2处理会使小鼠胚胎细胞内Ca2+浓度显著增加,H2O2可通过Ca2+稳态失调诱导细胞凋亡。
表4 氧化应激处理对牛肉宰后初期肌浆内Ca2+浓度及细胞凋亡率的影响
Table 4 Effect of oxidative stress on Ca2+ concentration in sarcoplasm and apoptosis rate of beef in early postmortem

指标贮藏时间/h处理方式氧化应激组抑制应激组对照组平均值±标准误P值成熟时间处理方式时间×处理肌浆内Ca2+浓度/[mmol·(g protein)-1]012.82±0.6712.82±0.6712.82±0.6712.82±0.00f614.22±0.7012.89±0.6413.28±0.6013.46±0.39e1215.21±0.5713.57±0.7714.07±0.7014.28±0.48d2416.19±0.5614.48±0.6014.93±0.4415.20±0.51c7218.11±0.6316.23±0.6516.78±0.6517.04±0.56b16819.16±0.7117.44±1.0618.41±0.7618.34±0.35a平均值±标准误15.95±0.97x14.57±0.77z15.05±0.88y<0.01<0.010.16细胞凋亡率/%626.35±1.3719.43±1.2321.64±1.6622.47±2.04d2432.53±1.4121.99±1.7326.45±1.4026.99±3.05c7242.12±2.5429.35±1.8035.81±2.4835.76±3.69b16850.90±3.0236.90±2.5544.26±2.8744.02±4.04a平均值±标准误37.97±5.39x26.92±3.94z32.04±5.02y<0.01<0.010.20
注:a~f表示不同贮藏时间差异达到显著水平(P<0.05);x~z表示不同处理方式差异达到显著水平(P<0.05)

图3 氧化应激处理对牛肉宰后初期细胞凋亡率的影响
Fig.3 Effect of oxidative stress on cell apoptosis rate of beef in early postmortem
通常认为,细胞凋亡可从Ca2+信号传导、caspase激活等方面高度参与宰后初期肌肉的嫩化过程[22]。研究发现,牦牛的3个部位肉在宰后成熟过程中剪切力值与细胞凋亡率均呈极显著相关关系(P<0.001),随着细胞凋亡率的增加,剪切力值不断下降,牦牛肉的嫩度提高[23]。DANG等[24]抑制僵直前牛背最长肌中线粒体对钙的摄取,导致肌浆内Ca2+浓度升高,细胞凋亡增加,牛肉嫩度提高。周昌瑜等[25]向宰后鹅胸肉中注射CaCl2,发现处理组中的caspase-3以及calpain活性显著升高,同时肌原纤维蛋白降解程度显著增加,剪切力值显著降低,推测CaCl2注射增加了肌浆内Ca2+浓度,激活了内源酶活性,促进肌原纤维蛋白的降解,进而提高了嫩度。
3 结论
蛋白质氧化和细胞凋亡是牛肉宰后氧化应激过程中不可避免的变化,且都与嫩度相关。本研究结果表明,在宰后早期阶段,牛肉细胞内留存的抗氧化物质仍会发挥一定作用,清除了部分ROS,进而延缓了蛋白质羰基含量、表面疏水性和肌浆内Ca2+浓度的升高。与对照组和抑制氧化应激处理组相比,氧化应激处理使蛋白质羰基含量与表面疏水性显著增加,表明蛋白质氧化程度增加;肌浆内Ca2+浓度显著上升,造成钙稳态失衡,细胞凋亡率显著升高,表明细胞凋亡程度增加;同时desmin降解程度增大,剪切力值降低,牛肉的嫩度增加。因此,相比于蛋白质氧化对嫩度造成的不利影响,氧化应激对肌原纤维蛋白的氧化修饰和对蛋白质构象的改变可能会暴露更多的酶切位点,而氧化应激造成Ca2+稳态失衡导致细胞凋亡,可能会诱导caspase级联反应并通过与calpain协同作用等途径,促使肌原纤维蛋白降解,进而加速了牛肉宰后成熟过程中嫩化的进程。然而蛋白质氧化和细胞凋亡通路错综复杂,蛋白质氧化和细胞凋亡共同影响嫩度的具体通路还需要进一步研究。
[1] ZHANG L T, LI Q, JIA S L, et al.Effect of different stunning methods on antioxidant status, in vivo myofibrillar protein oxidation, and the susceptibility to oxidation of silver carp (Hypophthalmichthys molitrix) fillets during 72 h postmortem[J].Food Chemistry, 2018, 246:121-128.
[2] 黄琳琳, 张一敏, 朱立贤, 等.蛋白质氧化和翻译后修饰对肉品质的影响及机制研究进展[J].食品科学, 2021, 42(9):241-247.
HUANG L L, ZHANG Y M, ZHU L X, et al.Advances in research of the effects and mechanisms of protein oxidation and post-translational modification on meat quality[J].Food Science, 2021, 42(9):241-247.
[3] CHEN L, ZHOU G H, ZHANG W G.Effects of high oxygen packaging on tenderness and water holding capacity of pork through protein oxidation[J].Food and Bioprocess Technology, 2015, 8(11):2 287-2 297.
[4] GOES E, GOES M D, CASTRO P L, et al.Imbalance of the redox system and quality of tilapia fillets subjected to pre-slaughter stress[J].PLoS One, 2019, 14(1):e0210742.
[5] 李孟孟. 肉羊宰后ROS形成对caspase介导细胞骨架蛋白的影响[D].邯郸:河北工程大学, 2020.
LI M M.Effects of ROS formation on caspase-mediated cytoskeleton protein of mutton sheepafter slaughter[D].Handan:Hebei University of Engineering, 2020.
[6] CHEN Q Q, HUANG J C, HUANG F, et al.Influence of oxidation on the susceptibility of purified desmin to degradation by μ-calpain, caspase-3 and-6[J].Food Chemistry, 2014, 150:220-226.
[7] 张玉林. 宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D].宁波:宁波大学, 2014.
ZHANG Y L.The mechanism of the influence on meat quality of goose muscle caused by the generation of reactive oxygen species (ROS) after slaughter[D].Ningbo:Ningbo University, 2014.
[8] HOU X, LIANG R R, MAO Y W, et al.Effect of suspension method and aging time on meat quality of Chinese fattened cattle M.Longissimus dorsi[J].Meat Science, 2014, 96(1):640-645.
[9] SOYER A, ÖZALP B, DALM
 Ü, et al.Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J].Food Chemistry, 2010, 120(4):1 025-1 030.
Ü, et al.Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J].Food Chemistry, 2010, 120(4):1 025-1 030.
[10] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[11] POMPONIO L, ERTBJERG P.The effect of temperature on the activity of μ- and m-calpain and calpastatin during post-mortem storage of porcine longissimus muscle[J].Meat Science, 2012, 91(1):50-55.
[12] WANG L L, YU Q L, HAN L, et al.Study on the effect of reactive oxygen species-mediated oxidative stress on the activation of mitochondrial apoptosis and the tenderness of yak meat[J].Food Chemistry, 2018, 244:394-402.
[13] TAYLOR R G, GEESINK G H, THOMPSON V F, et al.Is Z-disk degradation responsible for postmortem tenderization? [J].Journal of Animal Science, 1995, 73(5):1 351-1 367.
[14] SMUDER A J, KAVAZIS A N, HUDSON M B, et al.Oxidation enhances myofibrillar protein degradation via calpain and caspase-3[J].Free Radical Biology and Medicine, 2010, 49(7):1 152-1 160.
[15] ZHANG T, XUE Y, LI Z J, et al.Effects of ozone-induced oxidation on the physicochemical properties of myofibrillar proteins recovered from bighead carp (Hypophthalmichthys nobilis)[J].Food and Bioprocess Technology, 2015, 8(1):181-190.
[16] 崔文斌, 王惠惠, 刘小波, 等.羟自由基氧化对牦牛肉肌原纤维蛋白生化特性的影响[J].核农学报, 2019, 33(6):1 165-1 172.
CUI W B, WANG H H, LIU X B, et al.Effect of hydroxyl radical oxidation on the biochemical characteristics of myofibrillar protein of yak meat[J].Journal of Nuclear Agricultural Sciences, 2019, 33(6):1 165-1 172.
[17] 张玉林, 曹锦轩, 潘道东, 等.成熟过程中活性氧簇(ROS)对肌原纤维蛋白结构的影响[J].现代食品科技, 2014, 30(9):26-32;108.
ZHANG Y L, CAO J X, PAN D D, et al.Effect of reactive oxygen species(ROS) on structural changes in meat myofibrillar protein during ageing[J].Modern Food Science and Technology, 2014, 30(9):26-32;108.
[18] MALHEIROS J M, BRAGA C P, GROVE R A, et al.Influence of oxidative damage to proteins on meat tenderness using a proteomics approach[J].Meat Science, 2019, 148:64-71.
[19] FU Q Q, LIU R, ZHANG W G, et al.In vitro susceptibility of oxidized myosin by μ-calpain or caspase-3 and the determination of the oxidation sites of myosin heavy chains[J].Journal of Agricultural and Food Chemistry, 2020, 68(32):8 629-8 636.
[20] SINGH S, MABALIRAJAN U.Mitochondrial calcium in command of juggling myriads of cellular functions[J].Mitochondrion, 2021, 57:108-118.
[21] 赵培, 闫晓风, 王晓玲.H2O2通过钙稳态失调诱导小鼠胚胎肝细胞凋亡[J].中国细胞生物学学报, 2015, 37(9):1 257-1 262.
ZHAO P, YAN X F, WANG X L.H2O2 induced hepatocyte apoptosis by intracellular calcium homeostasis[J].Chinese Journal of Cell Biology, 2015, 37(9):1 257-1 262.
[22] 黄峰, 魏起超, 李侠, 等.细胞凋亡对宰后肌肉嫩化作用机理的研究进展[J].中国农业科学, 2021, 54(10):2 192-2 202.
HUANG F, WEI Q C, LI X, et al.Research progress on mechanisms of apoptosis to postmortem tenderization in muscle[J].Scientia Agricultura Sinica, 2021, 54(10):2 192-2 202.
[23] 孙志昶. 宰后牦牛肉成熟过程中细胞凋亡的发生及其对肉品质与微观结构变化的影响[D].兰州:甘肃农业大学, 2015.
SUN Z C.The research in the mechanism of apoptosis occurrence on yak meat quality and microstructure changes during postmortem aging[D].Lanzhou:Gansu Agricultural University, 2015.
[24] DANG D S, BUHLER J F, DAVIS H T, et al.Inhibition of mitochondrial calcium uniporter enhances postmortem proteolysis and tenderness in beef cattle[J].Meat Science, 2020, 162:108039.
[25] 周昌瑜, 楼宵玮, 杜筱婧, 等.氯化钙注射对鹅肉成熟机制及品质影响的研究[J].现代食品科技, 2016, 32(10):151-159.
ZHOU C Y, LOU X W, DU X J, et al.Effects of calcium chloride injection on the aging mechanism and the quality of goose meat[J].Modern Food Science and Technology, 2016, 32(10):151-159.