獭兔是一种草食性皮肉兼用型经济动物,其肉质蛋白质和多不饱和脂肪酸含量高,脂肪含量低,其他微量元素也较丰富,可预防心脑血管疾病,是一种营养较全面的动物性食品,市场应用前景较好[1-2]。宰后成熟过程中肌肉内部所发生的各种复杂生理生化反应导致肌肉品质和理化性质等发生改变,使动物胴体逐渐由肌肉转变成可食用肉,是一种有效改善肉品质量的途径[3],獭兔肉与牛羊肉类似也可通过宰后成熟过程改善肌肉品质[4]。
宰后肌肉迅速进入缺血缺氧状态导致肌肉内部产生较多活性氧(reactive oxygen species,ROS)氧化物,且此过程不可避免地与有氧环境接触,这就使得整个成熟过程中蛋白质的氧化反应极易发生;又因动物胴体在宰后成熟过程中自身抗氧化系统的缺失,不能有效及时地清除外界氧化因子,从而导致肌肉氧化应激水平逐渐升高,并最终对肌肉品质造成影响[5]。ROS是细胞代谢过程中产生的氧自由基(·OH、![]() 等)和能转化为自由基的物质(H2O2、氢过氧化物等)[6-7],ROS会攻击多不饱和脂肪酸引起脂质的氧化酸败,还可通过攻击蛋白质肽键、改变蛋白质二级结构并氧化蛋白质结构上的氨基酸,导致蛋白质氧化发生,影响蛋白质的结构和功能特性,最终影响肌肉品质[8-9]。研究指出脂质氧化反应与肌肉褪色之间有着紧密的内在联系[10];脂质氧化生成的活性和非活性自由基可通过夺取蛋白质的氢原子,生成蛋白自由基,引发蛋白质氧化链式反应,促进蛋白质氧化的发生[11]。蛋白氧化过程中产生的席夫碱和二硫键等会对肌肉的质构特性造成影响,导致肉硬度的增加[12];蛋白氧化后生成的产物,相互交联结合,外露的基团结合水面积的减小引起保水性的进一步下降[13]。同时,蛋白质氧化还会破坏细胞骨架蛋白间的物理和化学作用力,改变肌肉蛋白的二级和三级结构的功能特性,进而改变肌肉凝胶特性及功能特性等性质[14]。目前,关于獭兔的研究主要集中在其皮毛特性以及屠宰、饲养、加工方法和储藏对肉品质影响方面,而有关獭兔肉在宰后成熟过程中由ROS水平改变导致的氧化应激对肌肉品质、脂质氧化和蛋白质氧化影响方面的研究还尚未有报道,有必要进行进一步研究。
等)和能转化为自由基的物质(H2O2、氢过氧化物等)[6-7],ROS会攻击多不饱和脂肪酸引起脂质的氧化酸败,还可通过攻击蛋白质肽键、改变蛋白质二级结构并氧化蛋白质结构上的氨基酸,导致蛋白质氧化发生,影响蛋白质的结构和功能特性,最终影响肌肉品质[8-9]。研究指出脂质氧化反应与肌肉褪色之间有着紧密的内在联系[10];脂质氧化生成的活性和非活性自由基可通过夺取蛋白质的氢原子,生成蛋白自由基,引发蛋白质氧化链式反应,促进蛋白质氧化的发生[11]。蛋白氧化过程中产生的席夫碱和二硫键等会对肌肉的质构特性造成影响,导致肉硬度的增加[12];蛋白氧化后生成的产物,相互交联结合,外露的基团结合水面积的减小引起保水性的进一步下降[13]。同时,蛋白质氧化还会破坏细胞骨架蛋白间的物理和化学作用力,改变肌肉蛋白的二级和三级结构的功能特性,进而改变肌肉凝胶特性及功能特性等性质[14]。目前,关于獭兔的研究主要集中在其皮毛特性以及屠宰、饲养、加工方法和储藏对肉品质影响方面,而有关獭兔肉在宰后成熟过程中由ROS水平改变导致的氧化应激对肌肉品质、脂质氧化和蛋白质氧化影响方面的研究还尚未有报道,有必要进行进一步研究。
本实验以四川草业科学研究所培育的川白獭兔肉为实验对象,用H2O2和N-乙酰半胱氨酸(N-acetylcysteine,NAC)对宰后獭兔肉进行处理,建立肌肉氧化和还原模型,研究处理组和空白组獭兔肉食用品质、脂质氧化和蛋白质氧化在成熟过程中的变化规律,并探究肌肉中ROS的积累、清除和对照组之间脂质氧化和蛋白氧化之间的差异,最终明确氧化应激影响獭兔肉肌肉品质形成的可能机制,为提高獭兔肉品质及精深加工提供理论依据。
1 材料与方法
1.1 材料与试剂
样品处理及采集:选取150日龄獭兔,由四川草业科学研究所自主培育。以宰后獭兔后腿肉为试验材料,剔除脂肪、筋和膜后,分割切块。将肉块随机分成3组,做3种处理(50 mmol/L H2O2,50 mmol/L NAC,0.9%的盐水),按肉液比(10∶1,g∶mL)均匀注射,在冷藏条件下分别成熟6、12、24、72、120、168 h后在相应时间点取样,测定相关指标。
试剂:硫代巴比妥酸、三氯乙酸、氯仿、丙酮、石油醚、硫酸亚铁、H2O2、N-乙酰半胱氨酸、亚硫酸钠、乙二胺四乙酸、磷酸氢二钠、磷酸二氢钠、浓盐酸、浓硫酸、溴酚蓝、乙酸乙酯、尿素、2,4-二硝基苯肼、5,5′-二硫代双(2-硝基苯甲酸),以上均为分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
pHS-3型pH计,上海日岛仪器厂;CR-400型色差仪,日本Konica Minolta公司;U2800紫外分光光度计,日本日立高技术公司;DS-1高速组织捣碎机,上海标本模型厂;22K高速真空离心机,长沙英泰仪器有限公司;UV-6100型紫外分光光度计,上海美谱达仪器有限公司。
1.3 指标及测定方法
1.3.1 氧化应激水平
ROS水平:参照张玉林[15]的方法测定肌肉ROS含量。
超氧化物歧化酶(superoxide dismutase,SOD)活性用SOD活性检测试剂盒测定[16]。用酶标仪在波长550 nm处测定吸光度值,以无添加肉样的溶液为对照组;测定样品的蛋白浓度,根据公式(1)计算酶活性。
SOD活性![]() 相同匀浆浓度下的蛋白含量/(mg prot·mL-1)
相同匀浆浓度下的蛋白含量/(mg prot·mL-1)
(1)
1.3.2 食用品质
pH值参照GB 5009.237—2016《食品pH值的测定》。
肉色参照文献[4]方法测定。选取肉样的3个不同位置作为测量点,测定每个肉样的红色度a*值。
蒸煮损失参照李婉竹[17]方法。割掉肉中的筋、膜与脂肪,切成3 cm厚,称重,质量记为m1,装入保鲜袋中,将电子温度计插入肉块中心后扎紧袋口,80 ℃水浴加热,温度计显示温度达到70 ℃时取出冷却至室温,肉样表面水分吸干,称重记为m2。计算如公式(2)所示:
蒸煮损失![]()
(2)
剪切力参照戴四发等[18]方法。将整块肉装袋,浸入温度为80 ℃的恒温水浴锅中,温度计插入肉块中心,到温度为70 ℃时取出,冷却至室温,吸干表面残余水分。将肉块用剪切力仪测定剪切力值。
1.3.3 肌肉新鲜度
过氧化值(peroxide value,POV)参照GB 5009.227—2016《食品中过氧化值的测定》。
硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量参照FAUSTMAN等[19]方法测定。
挥发性盐基氮(total volatile base nitrogen,TVB-N)参照GB 5009.228—2016《食品中挥发性盐基氮的测定》。
1.3.4 蛋白氧化程度
肌原纤维蛋白(myofibrillar protein,MP)提取参照XIONG等[20]的方法。
浊度参照韩敏义等[21]的方法。取MP沉淀溶入磷酸盐缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4,pH 6.25)中,制成蛋白质质量浓度为2.5 mg/mL的溶液,在室温下放置20 min后,以磷酸缓冲液为空白溶液,在340 nm处测定吸光值,该吸光度值即为肌原纤维蛋白的浊度。
溶解度参照AGYARE等[22]的方法。取肌原纤维蛋白溶液在4 ℃条件下放置60 min后取出,在4 ℃,8 000 r/min条件下离心15 min,留上清液,测定其蛋白浓度,未加入蛋白的磷酸盐缓冲溶液作空白组。溶解度计算如公式(3)所示:
溶解度![]()
(3)
羰基含量参照李学鹏等[23]方法测定;巯基含量按照THANNHAUSER等[24]方法测定。
表面疏水性参照CHELH等[25]方法。取1 mL 2.5 mg/mL蛋白质溶液和200 mL 1.0 mg/mL溴酚蓝,加入离心管中,同时设置对照(0.02 mol/L磷酸盐缓冲液1.0 mL,1.0 mg/mL溴酚蓝200 μL于离心管中),室温下振荡10 min,在8 000 r/min条件下离心10 min,取400 μL上清液稀释10倍,在波长595 nm处测定吸光度值,记作A样品,空白为0.02 mol/L、pH 7.0的磷酸盐缓冲液,吸光度记作A空白。表面疏水基含量计算如公式(4)所示:
表面疏水基含量![]()
(4)
二硫键含量参照THANNHAUSER等[24]方法作适当修改。取0.5 mL 4.0 mg/mL的混合蛋白溶液,加入3.0 mL新配NTSB(2-nitro-5-thiosulfobenzoate)检测溶液(pH 9.5),混匀后在暗处反应25 min,波长412 nm处测定吸光值。二硫键含量按公式(5)计算:
二硫键含量![]()
(5)
式中:B,稀释倍数,此处为1.46;ρ,混合蛋白溶液质量浓度,mg/mL。
1.4 统计分析
所有数据均为3次重复测定的平均值,结果用平均值±标准差表示。利用SPSS对数据进行统计分析获得平均值和标准差,采用Duncan多重比较进行显著性方差分析,显著性水平P<0.05。采用Excel软件作图。
2 结果与分析
2.1 H2O2、NAC处理对宰后獭兔肉成熟过程中氧化应激水平的影响
如图1-a所示,H2O2处理组ROS水平呈先显著上升后下降趋势(P<0.05);NAC处理组和空白组ROS水平呈先下降后上升趋势,并分别在120 h和72 h达到最大值随后显著下降(P<0.05)。6~168 h,H2O2处理组ROS水平均显著高于其他2组,空白组ROS水平也显著高于NAC处理组(P<0.05),此结果与张玉林[15]研究相一致,均说明H2O2处理可提高宰后肌肉ROS水平,而NAC作为一种ROS自由基清除剂使处理组ROS水平降低。
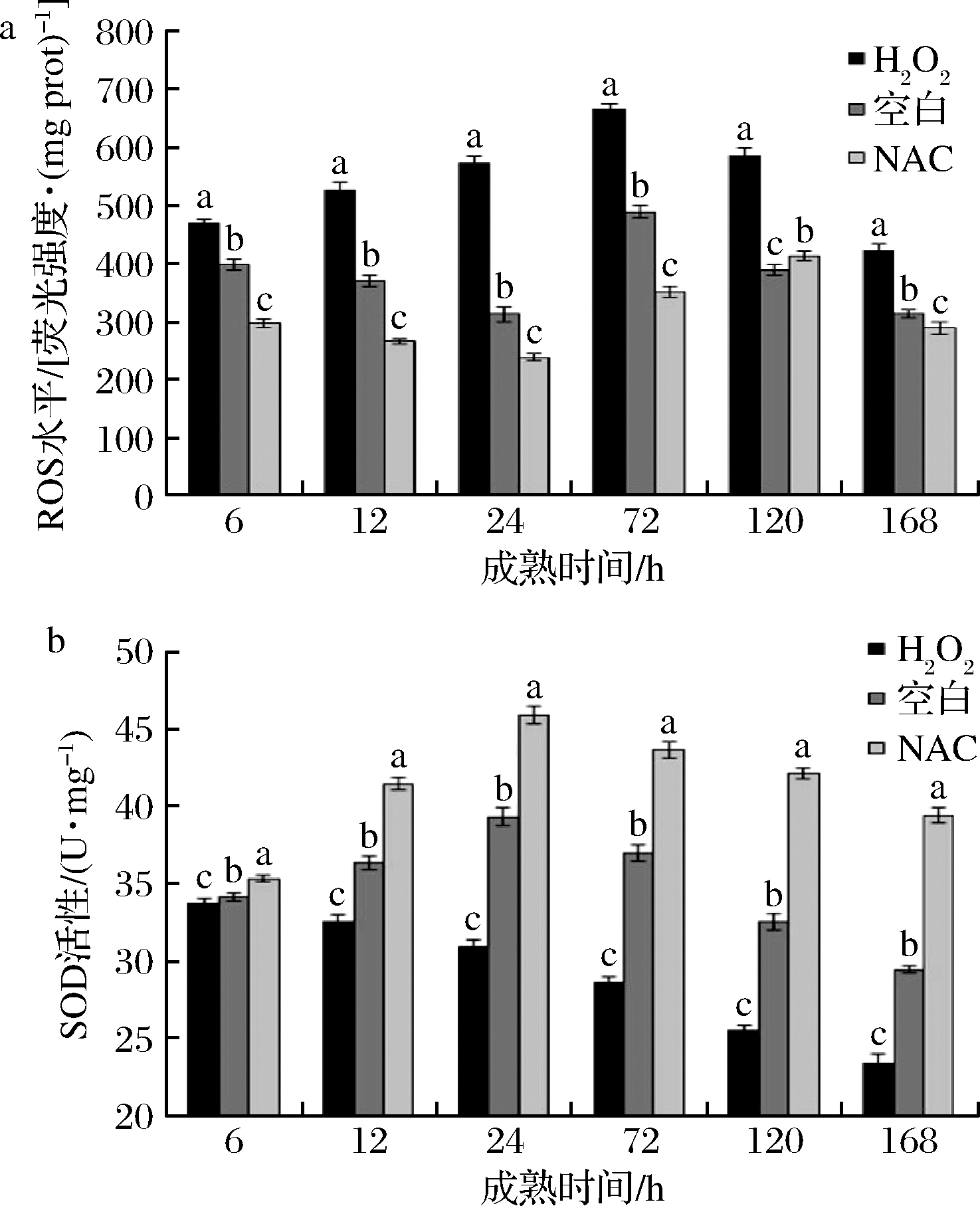
a-ROS水平;b-SOD活性
图1 H2O2、NAC处理对宰后獭兔肉成熟过程中氧化应激水平的影响
Fig.1 Effects of H2O2 and NAC treatment on oxidative stress levels of rex rabbit meat
注:不同小写字母代表差异显著,P<0.05(下同)
SOD的活性反应肌肉中的抗氧化能力,SOD通过将自由基转化为H2O2,再被过氧化氢酶和氧化酶转化为水,起到减少自由基保护细胞的作用[26]。由图1-b可知,H2O2处理组SOD活性呈显著下降趋势(P<0.05),原因可能是肌肉经处理后产生的过量ROS自由基,使其内部抗氧化系统遭到破坏并失去平衡,从而提高了肌肉的氧化应激水平;同时,整个成熟过程,H2O2处理组SOD活性均显著低于空白组和NAC处理组;空白组和NAC处理组SOD活性均在24 h达到最大值,并存在显著差异(P<0.05)。综上所述,H2O2处理显著提高了肌肉ROS水平,降低SOD活性,减弱了肌肉抗氧化能力,进而提高了肌肉的氧化应激水平,并可能进一步影响肌肉品质。
2.2 H2O2、NAC处理对宰后獭兔肉成熟过程中肌肉食用品质的影响
由图2-a可知,3个处理组pH均呈先显著下降后上升趋势,原因是糖原的无氧酵解产生了乳酸以及能量降解反应产生了一些酸性离子,最终导致肌肉pH下降。6~24 h,H2O2处理组pH显著下降,并显著低于空白组和NAC处理组(P<0.05),与文献[27]报道类似。6~24 h,NAC处理组pH均显著高于空白组(P<0.05),但在72~120 h无显著差异,说明NAC通过抑制肌肉的氧化,抑制了糖酵解反应减少乳酸产生从而提高了肌肉的pH。由图2-b可知,3个处理组a*值整体均呈显著下降趋势(P<0.05),原因是宰后肌肉中氧合肌红蛋白不稳定,慢慢氧化成高铁肌红蛋白而使a*下降。6~168 h,NAC处理组和空白组a*值均高于H2O2处理组,并在6~72 h差异显著(P<0.05),说明H2O2处理介导的氧化应激不利于肌肉色泽稳定;12~ 24 h,NAC处理组a*值显著高于空白组(P<0.05),但在成熟后期无显著差异,说明NAC的抗氧化作用在一定程度上对肉色起到保护作用。
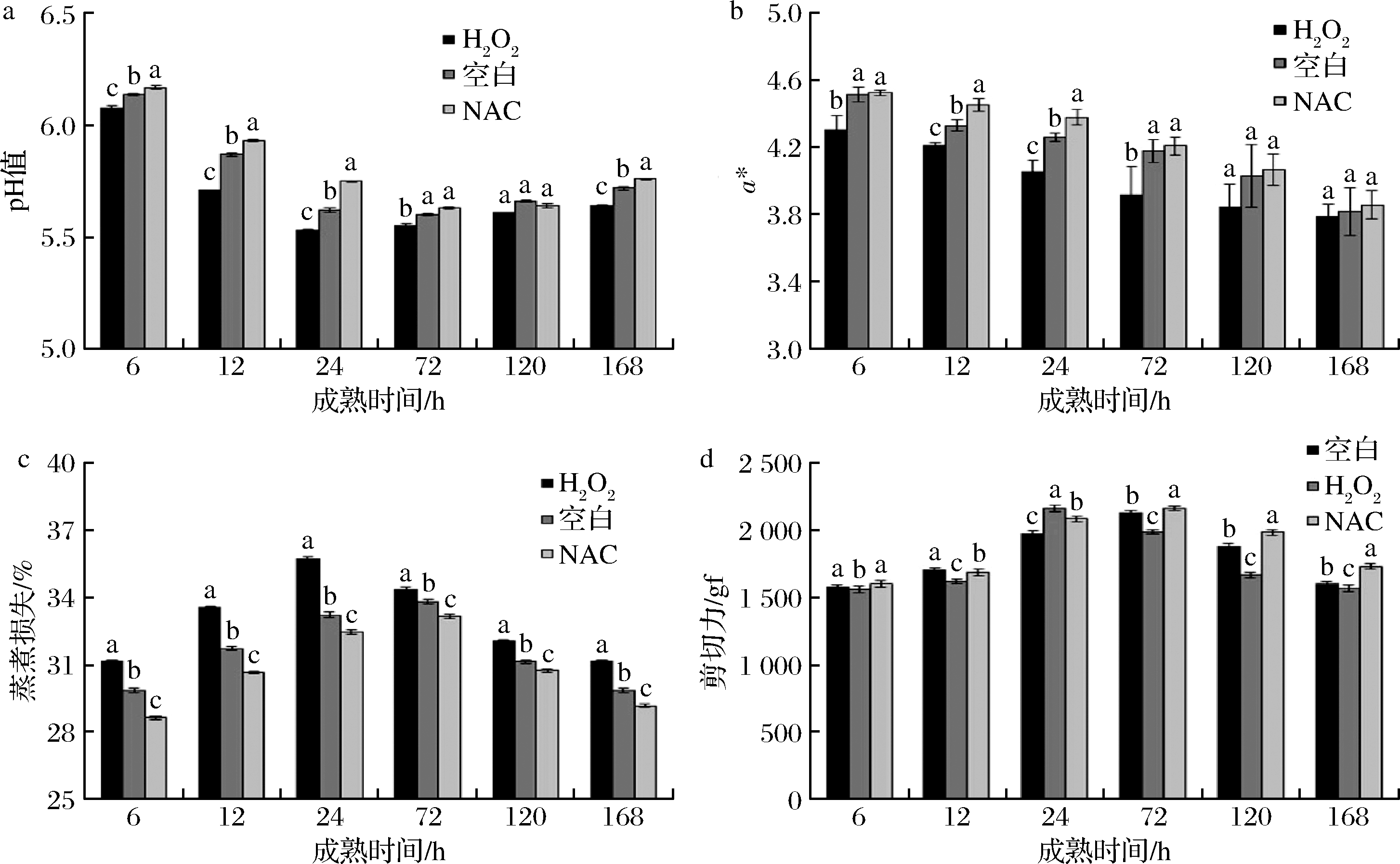
a-pH;b-a*值;c-蒸煮损失;d-剪切力
图2 H2O2、NAC处理对宰后獭兔肉成熟过程中食用品质的影响
Fig.2 Effects of H2O2 and NAC treatment on edible quality of rex rabbit meat
由图2-c可知,3个处理组蒸煮损失均呈先增大后减小趋势(P<0.05)。6~168 h,H2O2处理组蒸煮损失均显著高于空白组和NAC处理组(P<0.05);同时,空白组蒸煮损失也显著高于NAC处理组(P<0.05),与文献[28]报道相一致,均说明氧化会加重肌肉蒸煮损失。原因可能是H2O2通过加剧肌肉的氧化应激,提高糖酵解速度而降低pH值,加快蛋白质的变性进而减弱了其对水分的结合力,加之肌肉中的骨架蛋白被慢慢降解,肌原纤维间隙增加,细胞外水重新渗入细胞内,使肌肉的持水力提高[29]。如图2-d所示,3个处理组肌肉剪切力值均呈先增大后减小趋势。成熟24 h时,H2O2处理组剪切力达到最大2 164.52 gf,显著高于空白组和NAC处理组(P<0.05),说明H2O2处理组獭兔肉比NAC处理组和空白组提前进入僵直阶段;72~168 h,H2O2处理组剪切力值均显著小于NAC处理组,且72~168 h时,NAC处理组剪切力值均显著小于空白组(P<0.05),说明H2O2处理可在一定程度上促进肌肉成熟,而抗氧化剂NAC起相反作用。
2.3 H2O2、NAC处理对宰后獭兔肉成熟过程中肌肉新鲜度的影响
由图3-a可知,12~168 h,3个处理组POV总体均呈显著上升变化(P<0.05),且H2O2处理组POV的变化最为明显,说明宰后成熟过程中肌肉中脂质氧化逐渐加大。6~168 h,H2O2处理组POV均显著高于空白组和NAC处理组(P<0.05);12~168 h(24 h除外),NAC处理组POV均显著低于空白组(P<0.05),说明H2O2处理明显提高了肉中POV,促进肌肉脂质氧化程度,原因在于ROS的促氧化作用,而NAC的抗氧化作用则显著降低了肌肉的脂质氧化程度。
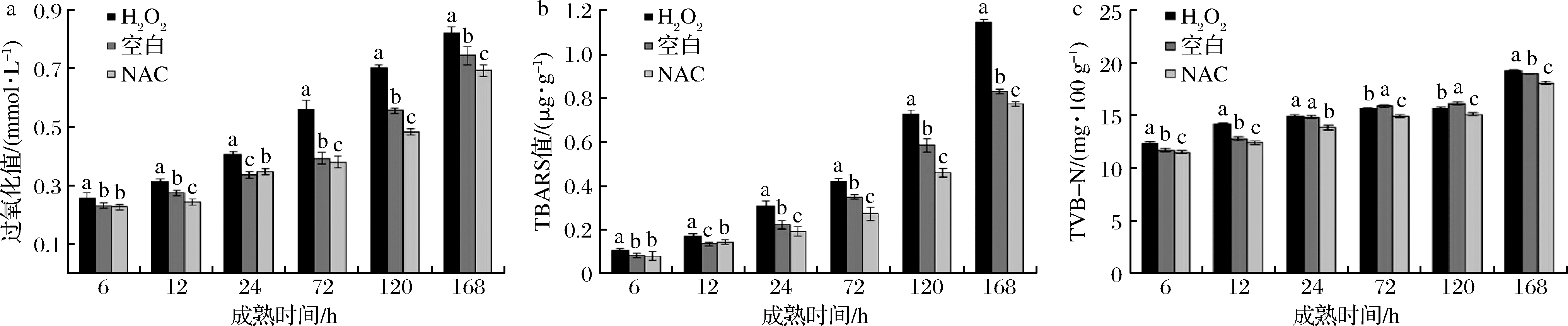
a-POV值;b-TBARS值;c-TVB-N值
图3 H2O2、NAC处理对宰后獭兔肉成熟过程中新鲜度的影响
Fig.3 Effects of H2O2 and NAC treatment on freshness of rex rabbit meat
如图3-b所示,6~24 h,3个处理组TBARS值均呈缓慢上升趋势,72 h后显著上升(P<0.05)。6~168 h,H2O2处理组TBARS值显著高于NAC处理组和空白组(P<0.05);同时,NAC处理组TBARS值显著低于空白组。新鲜肉和肉制品的脂肪酸败临界值是0.5 μg/g,6~72 h H2O2处理组TBARS值在临界值内;6~120 h NAC处理组TBARS值在临界值内,说明ROS促进了脂肪的氧化,加快了脂肪的酸败,而抗氧化剂NAC则与之相反,此结果与李兴艳[30]研究相一致。
如图3-c所示,24~120 h,H2O2处理组TVB-N值上升缓慢且与空白组接近;120 h后,3个处理组TVB-N值均明显上升并显著高于6~72 h的值(P<0.05);6~168 h,H2O2处理组和空白组TVB-N值均显著高于NAC处理组(P<0.05),由于H2O2为弱酸性,促进了肉中蛋白质及其他物质的降解以及含氮物质的产生,进而提高了TVB-N值;但24 h时H2O2处理组和空白组TVB-N值无显著差异,并在72~120 h,H2O2处理组TVB-N值显著低于空白组(P<0.05)。以上结果说明,H2O2不仅加剧了脂质氧化程度还在一定程度上促进蛋白质和氨及氨类物质的分解,造成肌肉新鲜度的下降。
2.4 H2O2、NAC处理对獭兔肉宰后成熟过程中蛋白氧化程度的影响
由图4-a可知,H2O2、NAC处理组和空白组MP浊度均呈先上升后缓慢下降变化并分别在24、72、72 h达到最大值,此时肉的pH接近MP的等电点,蛋白质容易发生变性聚集,致使溶液变浑浊,反之远离等电点的MP浊度变小。成熟过程中(除72 h),H2O2处理组蛋白质浊度整体显著高于空白组,并显著高于NAC处理组(P<0.05)。说明ROS介导的氧化应激促进了蛋白质的氧化降解,使其发生变性聚集,蛋白颗粒增大,溶液变浑浊,而NAC则抑制了蛋白质的聚集,减小了蛋白质浊度。如图4-b所示,6~24 h,3个处理组MP溶解度呈显著下降趋势(P<0.05),这与pH变化相似,均在24 h前呈显著下降变化,原因是此过程中蛋白质因缺乏静电相互作用而聚集和沉淀;成熟后期蛋白质溶解度缓慢下降的原因是pH回升导致静电相互作用增大,产生了亲水性和水合作用,蛋白质疏水基团发生聚集,减少了与水的接触,而使蛋白质溶解度变化不明显[5]。

a-浊度;b-溶解性;c-羰基含量;d-巯基含量;e-表面疏水性;f-二硫键含量
图4 H2O2、NAC处理对獭兔肉宰后成熟过程中蛋白氧化程度的影响
Fig.4 Effects of H2O2 and NAC treatment on protein oxidation levels of rex rabbit meat
由图4-c可知,3个处理组MP羰基含量呈显著上升趋势(P<0.05)。同时,6~168 h,H2O2处理组的MP羰基含量显著高于空白组和NAC处理组(P<0.05),且NAC处理组MP羰基含量显著低于空白组(P<0.05),说明H2O2处理会导致羰基含量的增加;而NAC则通过清除肌肉中的·OH,抑制肌肉蛋白质羰基的产生,从而减缓蛋白质氧化。此研究结果与崔文斌[5]研究相一致。如图4-d所示,3个处理组MP巯基含量显著下降(P<0.05),说明随着成熟进行肌肉内部MP发生降解,蛋白质的天然构象发生改变,活性巯基暴露而被氧化成二硫键,从而导致活性巯基数量减少。6~168 h,H2O2处理组MP巯基含量均显著低于空白组和NAC处理组(P<0.05),说明H2O2产生的自由基进攻含硫氨基酸的巯基,使其被氧化形成二硫键,导致巯基含量减少,而NAC通过清除一部分自由基,减缓了宰后肌肉中MP巯基的氧化。
由图4-e可知,3个处理组MP表面疏水性呈先上升后平稳变化的趋势,并分别在24、72、72 h时达到最大值(P<0.05),原因是当肌肉pH值下降接近蛋白质等电点时,蛋白质容易发生聚集变性,引起疏水基团的暴露;同时因宰后肌肉僵直收缩,蛋白质结构发生变化,溶解度下降,蛋白质内部疏水基团暴露,最终使疏水性增加。6~168 h,H2O2处理组MP疏水性整体显著高于空白组(P<0.05),NAC处理组MP疏水性显著低于空白组(P<0.05),说明H2O2处理后显著促进了MP的氧化,NAC则发挥相反作用。由图4-f可知,3个处理组MP二硫键含量均随着成熟时间的延长呈上升趋势(P<0.05)。且在整个成熟过程中,H2O2处理组MP二硫键含量显著高于NAC处理组和空白组(P<0.05),NAC处理组MP二硫键含量最低,说明氧化修饰可显著提高肌肉MP的氧化程度,并可能对肌肉品质造成影响。综上所述,H2O2处理导致ROS水平增加并进一步介导肌肉发生氧化应激,并对MP氧化起促进作用,并可能进一步影响肌肉品质。
3 结论
H2O2处理显著提高了肌肉ROS水平并降低SOD活性,从而降低了肌肉的抗氧化能力,并进一步提高了肌肉的氧化应激水平;成熟过程中,H2O2处理组pH值迅速下降,并显著低于空白组和NAC处理组;H2O2处理后导致的氧化应激对肌肉色泽、保水性均产生不利影响,但对肌肉嫩化有一定积极作用。同时,H2O2介导的氧化应激显著提高了肌肉的脂质过氧化,造成肌肉新鲜度下降,还对MP的氧化起促进作用。
综上所述,宰后缺血缺氧环境导致獭兔肉内氧化应激水平升高,可能通过促进肌肉的脂质氧化和蛋白氧化最终导致獭兔肉食用品质的下降。
[1] 张岩, 简文素, 汪平, 等.獭兔肉兔肉氨基酸脂肪酸组分比较分析[J].食品工业, 2015, 36(9):204-207.
ZHANG Y, JIAN W S, WANG P, et al.Meat rabbit and white rex rabbit amino acid and fatty acid composition analysis[J].The Food Industry, 2015, 36(9):204-207.
[2] 陈炼红, 王琳琳, 简文素, 等.川白獭兔兔肉肌原纤维蛋白热诱导凝胶制备工艺优化[J].食品工业科技, 2019, 40(24):136-143;151.
CHEN L H, WANG L L, JIAN W S, et al.Optimization of preparation process for myofibrillar proteins thermally-induced gel of Chuan-bai rex rabbit [J].Science and Technology of Food Industry, 2019, 40(24):136-143;151.
[3] KRISTENSEN L, PURSLOW P P.The effect of ageing on the water-holding capacity of pork:Role of cytoskeletal proteins[J].Meat Science, 2001, 58(1):17-23.
[4] 张岩, 简文素, 汪平, 等.獭兔肉成熟过程中肉用品质及结构变化特点[J].食品科技, 2015, 40(6):136-141.
ZHANG Y, JIAN W S, WANG P, et al.Variations in quality and structural characteristics of rex rabbit meat during postmortem aging[J].Food Science and Technology, 2015, 40(6):136-141.
[5] 崔文斌. 不同氧化体系对牦牛肉成熟过程中肌原纤维蛋白生化特性及质构的影响[D].兰州:甘肃农业大学, 2019.
CUI W B.Effects of different oxidation systems on biochemical characteristics and texture of myofibrillar protein during beef ripening[D].Lanzhou:Gansu Agricultural University, 2019.
[6] POILLET-PEREZ L, DESPOUY G, DELAGE-MOURROUX R, et al.Interplay between ROS and autophagy in cancer cells, from tumor initiation to cancer therapy[J].Redox Biology, 2015, 4:184-192.
[7] 崔艳军. 热应激和氧化应激对肥育猪骨骼肌代谢的影响及硫辛酸的调控作用[D].北京:中国农业科学院, 2016.
CUI Y J.Effects of heat stress and oxidative stress on metabolism of skeletal muscle and protection of lipoic acid in finishing pigs[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[8] 李儒仁, 韩玲, 余群力, 等.冻藏对牦牛肉蛋白质、脂质氧化和保水性的影响[J].农业机械学报, 2015, 46(6):218-225.
LI R R, HAN L, YU Q L, et al.Impact of frozen storage on protein, lipid oxidation and water holding capacity of yak meat[J].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(6):218-225.
[9] KRISTINSSON H G.Antioxidants and Functional Components in Aquatic Foods[M].Chichester, UK:John Wiley & Sons, Ltd, 2014.
[10] JH C.Lipid oxidation in meat[J].Journal of Nutrition and Food Sciences, 2016, 6(3).DOI:10.4172/2 155-9 600.1000494.
[11] STADTMAN E R, LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J].Amino Acids (Vienna), 2003, 25(3-4):207-218.
[12] SOLADOYE O P, JU REZ M L, AALHUS J L, et al.Protein oxidation in processed meat:Mechanisms and potential implications on human health[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2):106-122.
REZ M L, AALHUS J L, et al.Protein oxidation in processed meat:Mechanisms and potential implications on human health[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2):106-122.
[13] GROEGER G, QUINEY C, COTTER T G.Hydrogen peroxide as a cell-survival signaling molecule[J].Antioxidants & Redox Signaling, 2009, 11(11):2 655-2 671.
[14] ZHANG W G, XIAO S, AHN D U.Protein oxidation:Basic principles and implications for meat quality[J].Critical Reviews in Food Science and Nutrition, 2013, 53(11):1 191-1 201.
[15] 张玉林. 宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D].宁波:宁波大学, 2014.
ZHANG Y L.The mechanism of the influence on meat quality of goose muscle caused by the generation of reactive oxygen species (ROS) after slaughter [D].Ningbo:Ningbo University, 2014.
[16] WANG L L, YU Q L, HAN L, et al.Study on the effect of reactive oxygen species-mediated oxidative stress on the activation of mitochondrial apoptosis and the tenderness of yak meat[J].Food Chemistry, 2018, 244:394-402.
[17] 李婉竹. 多次冻融对牦牛肉品质及其蛋白质氧化的影响[D].兰州:甘肃农业大学, 2017.
LI W Z.Effects of multiple freezing and thawing on quality and protein oxidation of yak meat[D].Lanzhou:Gansu Agricultural University, 2017.
[18] 戴四发, 闻爱友, 王立克, 等.肉仔鸡肌肉色泽与品质相关性研究[J].中国农业大学学报, 2007, 12 (1):61-64.
DAI S F, WEN A Y, WANG L K, et al.Study on relationship between meat color and meat quality of Arber Acres broiler[J].Journal of China Agricultural University, 2007, 12 (1):61-64.
[19] FAUSTMAN C, SPECHT S M, MALKUS L A, et al.Pigment oxidation in ground veal:Influence of lipid oxidation, iron and zinc[J].Meat Science, 1992, 31(3):351-362.
[20] XIONG Y L, LOU X, WANG C, et al.Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions[J].Journal of Food Science, 2000, 65(1):96-100.
[21] 韩敏义, 徐幸莲, 林丽军, 等.兔骨骼肌肌球蛋白的纯化及溶液浊度和溶解度研究[J].食品科学, 2004, 25(12):50-54.
HAN M Y, XU X L, LIN L J, et al.Extraction and purification of myosin from rabbit skeletal muscles and its solution turbidity and solublility[J].Food Science, 2004, 25(12):50-54.
[22] AGYARE K K, XIONG Y L, ADDO K.Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J].Food Chemistry, 2008, 107(3):1 131-1 137.
[23] 李学鹏, 周凯, 王金厢, 等.羟自由基对六线鱼肌原纤维蛋白的氧化规律[J].中国食品学报, 2014, 14(6):19-27.
LI X P, ZHOU K, WANG J X, et al.Effects of hydroxyl radical oxidation system on myofibrillar protein structure and properties in Hexagrammos otakii[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(6):19-27.
[24] THANNHAUSER T W, KONISHI Y, SCHERAGA H A.Analysis for disulfide bonds in peptides and proteins[J].Methods in Enzymology, 1987, 143(1):115-119.
[25] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination [J].Meat Science, 2006, 74(4):681-683.
[26] 董亮, 何永志, 王远亮, 等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报, 2013, 15(5):53-58.
DONG L, HE Y Z, WANG Y L, et al.Research progress on application of superoxide dismutase (SOD)[J].Journal of Agricultural Science and Technology, 2013, 15(5):53-58.
[27] 藏磊, 马纪兵, 韩玲, 等.活性氧对宰后牦牛肉成熟过程中腺苷一磷酸活化蛋白激酶通路、糖酵解及肉品质的影响[J].食品与发酵工业, 2020, 46(12):44-50.
ZANG L, MA J B, HAN L, et al.Effect of reactive oxygen species on yak meat AMPK pathway, glycolysis and meat quality during postmortem aging[J].Food and Fermentation Industries, 2020, 46(12):44-50.
[28] 王策. 含氧气调包装对冷却肉持水性的影响机制[D].北京:中国农业科学院, 2018.
WANG C.The effect of different oxygen concentrations in modified atmosphere packaging on water holding capacity of chilled meat[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.
[29] 慕妮. 鸡肉钙激活酶的动力学性质及其在鸡肉成熟中的作用研究[D].南京:南京农业大学, 2013.
MU N.The kinetics of calpains from chicken breast meat and its role in postmortem aging[D].Nanjing:Nanjing Agricultural University, 2013.
[30] 李兴艳. 兔肉成熟过程中理化及蛋白质功能性质的变化[D].重庆:西南大学, 2014.
LI X Y.Changes of physicochemical and protein functional properties during rabbit ageing[D].Chongqing:Southwest University, 2014.