淀粉是一种环保、可降解的并且性价比高的资源,被广泛运用到造纸、医药和食品等行业中[1]。但天然淀粉存在着许多缺点,如冻融稳定性差、水溶性差且透光率低,限制了淀粉在工业上的运用[2]。不同的应用方式,对淀粉品质特性的要求有所不同,为了扩大淀粉的利用范围,将淀粉进行改性处理是常见方法[3-4],淀粉改性的方法包括化学改性、物理改性、生物改性和复合改性4种。化学改性方法运用最为广泛,主要包括酸改性、氧化改性、交联改性等[5],酸改性淀粉水解的效率高,糖苷键被破坏,淀粉水解成小分子[6],主要是应用盐酸、柠檬酸等化学试剂改性;氧化改性在氧化过程中发生羟基被氧化为羰基以及糖苷键断裂现象[7],由于其具有淀粉成膜性良好等特征常用于造纸等行业。交联淀粉能改善淀粉的透明度及黏度,常用三偏磷酸钠等交联剂进行改性[8]。物理改性常指通过微波处理、电离放射线处理、超声波处理、球磨处理、挤压处理等物理手段对淀粉进行改性[9],微波改性和超声波改性较为常见。淀粉的生物改性是主要利用各种淀粉酶和淀粉相互反应,改变天然的化学结构[10],主要由α-淀粉酶,β-淀粉酶等单一酶水解淀粉。
慈姑淀粉约占慈姑球茎干物质质量50%[11],目前,提取慈姑淀粉的工艺流程没有标准化,对慈姑淀粉的利用处于科学研究阶段。陈晓明等[12]对天然慈姑淀粉的理化性质进行分析,慈姑淀粉糊的热浆黏度和最终黏度高,糊稳定性好,但是冻融稳定性较差,易老化。对于慈姑变性淀粉的研究,国内外的报道相对较少。酸解-微波法制得的慈姑改性淀粉晶型转变为C型,具有连续的致密结构和更强的持水力,但溶解度和透明度均降低[13]。γ-辐射制得的慈姑改性淀粉的峰值黏度、热黏度、终值黏度和回生值均显著减小,膨润度和凝沉性降低[14]。超声波法制得慈姑改性淀粉降解度和淀粉糊热稳定性都增大,但冷冻融性变差且淀粉颗粒表面变得粗糙[11]。过氧化氢氧化后的慈姑淀粉,溶解度、膨润度升高,凝沉性更好,但冻融稳定性变差[15]。为扩大慈姑淀粉利用范围,为其应用提供理论支持,本文对慈姑变性淀粉的品种进行扩展,采用微波、苹果酸、盐酸、三偏磷酸钠、α-淀粉酶、乙酸酐等作用于慈姑淀粉,对变性慈姑淀粉的理化性质进行探讨。
1 材料与方法
1.1 材料与设备
慈姑淀粉,弥勒市竹园镇蔗林食品厂;苹果酸、盐酸、三偏磷酸钠、乙酸酐、NaCl、NaOH,成都市科龙化工试剂,均为分析纯。α-淀粉酶(≥3 700 U/g),北京奥博星生物科技有限公司。
DZKW-S-8恒温水浴锅,北京市永光明医疗仪器有限公司;STARTER 3100 pH计,奥豪斯仪器有限公司;DF-101S 集热式恒温加热磁力搅拌器,巩义市予-华仪器有限责任公司;UV8100紫外分光光度计,北京莱伯泰科仪器有限公司;SC-80C全自动色差计,北京晨光光学仪器有限公司;101 电热鼓风干燥器、分析天平,常州衡正电子仪器有限公司;HD场发射扫描电子显微镜,德国SIGMA;Nicolet is 50傅里叶变换红外光谱仪,美国赛默飞;Rigaku smartlab9 X-衍射仪,日本理学;Q200差示扫描量热仪,美国TA仪器。
1.2 变性慈姑淀粉的制备
称取40 g的慈姑原淀粉(I)配制质量分数40%的淀粉乳分别进行以下6种操作:将淀粉乳密封,室温下放置24 h,转至微波(6 W/g)加热30 s[16],然后抽滤,干燥粉碎后得微波慈姑淀粉(II);在淀粉乳中加入淀粉干基质量3%的苹果酸[17],40 ℃下水浴反应2 h,用1 mol/L的NaOH溶液调节pH至中性,然后抽滤,洗涤至滤液中性后,干燥粉碎后得苹果酸慈姑淀粉(III);在淀粉乳中滴入2 mL质量分数0.36%的盐酸[18],用玻璃棒不断搅拌,在65 ℃下水浴反应1 h,用质量分数3%的盐酸调节溶液至中性,洗涤抽滤,干燥粉碎后得盐酸慈姑淀粉(IV);在水浴锅中搅拌淀粉乳升温至40 ℃,用质量分数为2.5%的NaOH溶液调节pH为11.0,然后加入1.5 g的三偏磷酸钠[19],反应2 h后用稀盐酸调pH至中性,洗涤抽滤,干燥粉碎后得三偏磷酸钠慈姑淀粉(V);将淀粉乳用0.5 mol/L的盐酸调节pH至6,加入2 g的α-淀粉酶[20],70 ℃水浴反应2.5 h,洗涤抽滤,干燥粉碎后得α-淀粉酶慈姑淀粉(VI);用质量分数30%的NaOH和10%的盐酸调节淀粉乳液的pH为8.5,均匀缓慢滴入占淀粉干基质量8%的乙酸酐溶液[21],25 ℃水浴下反应2 h,用质量分数10%的盐酸调节溶液至中性,洗涤抽滤,干燥粉碎后得乙酸酐慈姑淀粉(VII)。干燥温度均为40 ℃。
1.3 淀粉得率的测定
称取40 g慈姑原淀粉进行处理,对不同变性方式后的淀粉烘干后进行称量计为m(g),变性淀粉得率为y(%),计算如公式(1)所示:
y/%=(m/40)×100
(1)
1.4 色差的测定
利用SC-80C全自动色差计对测试样品的L*,a*,b*进行测定。
1.5 直链淀粉与支链淀粉的测定
参考碘显色光度法,对样品中直链和支链淀粉的含量进行测定[22]。
1.6 淀粉性质的测定
无特别说明情况下以下测试中,淀粉乳浓度均为1%;干淀粉制备均为过300目筛后在40 ℃鼓风干燥箱中干燥24 h,在干燥环境下贮存待测。
1.6.1 透明度
沸水浴中将淀粉乳连续搅拌20 min,利用分光光度计测定淀粉乳在620 nm的透光率。
1.6.2 凝沉性
将配制好的淀粉乳在沸水浴中糊化,结束后倒入具塞量筒中,每间隔一段时间记录上层清液的体积。
1.6.3 溶解度与膨胀度
将淀粉乳在设定的温度梯度(55、65、75、85、95 ℃)下进行糊化、冷却、离心、称重。
1.6.4 冻融稳定性
参考谢显华等[18]方法,以冷冻-解冻3次后的析水率为指标,将解冻后淀粉乳在5 000 r/min离心20 min,研究样品的冻融稳定性。
1.6.5 X-射线衍射及扫描电镜
参考文献[16]进行测定。
1.6.6 红外光谱
采用KBr压片法进行测定。
1.6.7 差示扫描量热仪(differential scanning calorimeter,DSC)
在30~120 ℃,N2气氛下,升温速率为10 ℃/min,得到淀粉样品的糊化起始温度(T0)、峰值糊化温度(Tp)和焓值(ΔH)。
2 结果与分析
2.1 变性淀粉得率结果
按照1.2进行实验,得到6种不同条件处理后的慈姑改性淀粉,每种方法加工后淀粉的得率结果见图1。

图1 不同处理条件下慈姑变性淀粉得率
Fig.1 Yield of arrowhead modified starch under different treatment conditions
注:上标不同字母表示差异显著(P<0.05)(下同)
经过α-淀粉酶处理的淀粉损耗最多,能回收约57.27%的酶改性慈姑淀粉。其余方法处理后的变性淀粉得率均在85%以上。α-淀粉酶处理方式为酶解作用,α-淀粉酶是一种内切酶,以随机的方式从淀粉颗粒分子内部水解α-1,4糖苷键,淀粉水解产生糊精,淀粉的得率大大降低。
2.2 色差
对慈姑淀粉及其改性淀粉的色差测定结果见表1,其中淀粉的亮度情况与L*值相关,红绿色度与a*值相关,黄蓝色度与b*值相关。除苹果酸、α-淀粉酶处理的慈姑淀粉亮度明显降低外,其他4种方法加工后的慈姑淀粉亮度均增加。6种慈姑改性淀粉的a*值无明显变化。从黄色度来看,苹果酸和盐酸改性的慈姑淀粉无明显变化,其余4种方法均显著减小。整体而言,经三偏磷酸钠及乙酸酐改性的慈姑淀粉,亮度明显增加,黄色度明显降低,外观品质优于变性前淀粉。
表1 色差及直链-支链淀粉含量测定结果
Table 1 Determination results of color difference and amylose amylopectin content

处理方式色度值L*a*b*直链淀粉/%支链淀粉/%慈姑原淀粉70.97±0.01de2.84±0.07a10.31±0.07a55.81±0.011 5c44.11±0.018 7ab微波71.11±0.27d2.98±0.09a9.78±0.08b71.95±0.092 8bc27.82±0.013 7b苹果酸69.87±0.03f2.75±0.25a10.22±0.11a80.86±0.000 7ab19.10±0.019 5cd盐酸71.43±0.10c2.67±0.48a10.06±0.14a77.77±0.001 7b22.21±0.006 0c三偏磷酸钠71.97±0.03b2.75±0.04a9.17±0.11d76.33±0.001 1b23.62±0.012 2bcα-淀粉酶70.75±0.18e2.75±0.39a9.81±0.19b54.59±0.016 5cd45.35±0.016 4a乙酸酐72.81±0.02a2.75±0.05a9.53±0.03c81.20±0.003 1a18.77±0.006 9d
注:同列数值上标不同字母表示差异显著(P<0.05)(下同)
2.3 直链淀粉与支链淀粉含量
不同处理方法对慈姑淀粉的直链和支链淀粉含量影响结果见表1。常见淀粉中直链淀粉所占比例为15%~25%,如玉米淀粉中的直链淀粉含量为27%,小麦中的直链淀粉含量为25%[21],而本实验慈姑淀粉原料的直链淀粉的相对含量约为55%。不同条件处理后所得的慈姑变性淀粉的直链和支链淀粉的含量差异明显;α-淀粉酶改性慈姑淀粉的直链淀粉相对含量低于原淀粉,α-淀粉酶改性慈姑淀粉支链淀粉相对含量增多;其余变性淀粉的直链淀粉相对含量增加,支链淀粉的相对含量减少。直链淀粉和支链淀粉的相对含量大小,会影响淀粉的部分理化性质,与后文部分性质变化相对应。
2.4 透明度
经不同方法处理后所得慈姑淀粉透明度的分析结果见图2。与原慈姑淀粉相比,α-淀粉酶改性慈姑淀粉的透明度比原淀粉高41%,盐酸、乙酸酐处理方式下的淀粉透明度略微升高,微波、苹果酸、三偏磷酸钠等方式处理后的淀粉透明度略低于原淀粉。由此可知,酶解处理可以明显提高慈姑淀粉的透明度。糊化后的淀粉分子在α-淀粉酶的作用下,能够促进淀粉颗粒结构被破坏[20],使得经过α-淀粉酶改性的慈姑淀粉溶解度增大,淀粉与水分子之间的缔合作用增强,淀粉颗粒膨胀,所以α-淀粉酶改性的慈姑淀粉的透明度升高,与图3中α-淀粉酶作用后的慈姑淀粉的溶解度结果一致。

图2 不同处理条件下慈姑淀粉的透明度
Fig.2 Transparency of arrowhead starch under different treatment conditions
2.5 溶解度和膨胀度
淀粉的膨胀度和溶解度数值大小反映了淀粉颗粒分子相互结合的能力和持水能力。由图3、图4可知,随着温度的升高,6种变性慈姑淀粉的溶解度和膨润度呈现不同比例的增长,微波处理后的慈姑淀粉溶解度与膨润度降低,微波辐射处理会使淀粉颗粒内部大分子链分解产生小分子链并重新排列,无定形区的可及度降低,致使淀粉的溶解性及膨胀力降低[23]。经过苹果酸、盐酸和乙酸酐改性过的慈姑淀粉溶解度都有增加,而膨胀度降低,其原因可能是酸水解使淀粉颗粒的结构变得疏松,与表1中的支链淀粉含量降低一致。支链淀粉的百分含量相对减少,直链淀粉含量相对增多[17]。经过三偏磷酸钠改性过的慈姑淀粉溶解度和膨胀度都明显下降,过多的交联键能降低膨胀度,抑制了淀粉分子从淀粉颗粒中浸出,从而使溶解度下降[24]。经过α-淀粉酶改性的慈姑淀粉溶解度高于慈姑原淀粉,然而膨胀度却低于慈姑原淀粉,经过酶化处理后的慈姑淀粉生成了麦芽糖及葡萄糖等一些易溶于水的小分子物质,所以溶解度大幅度增加,但质点间结合力越强,膨胀度越小[20]。

图3 不同处理条件下慈姑淀粉的溶解度
Fig.3 Solubility of arrowhead starch under different treatment conditions
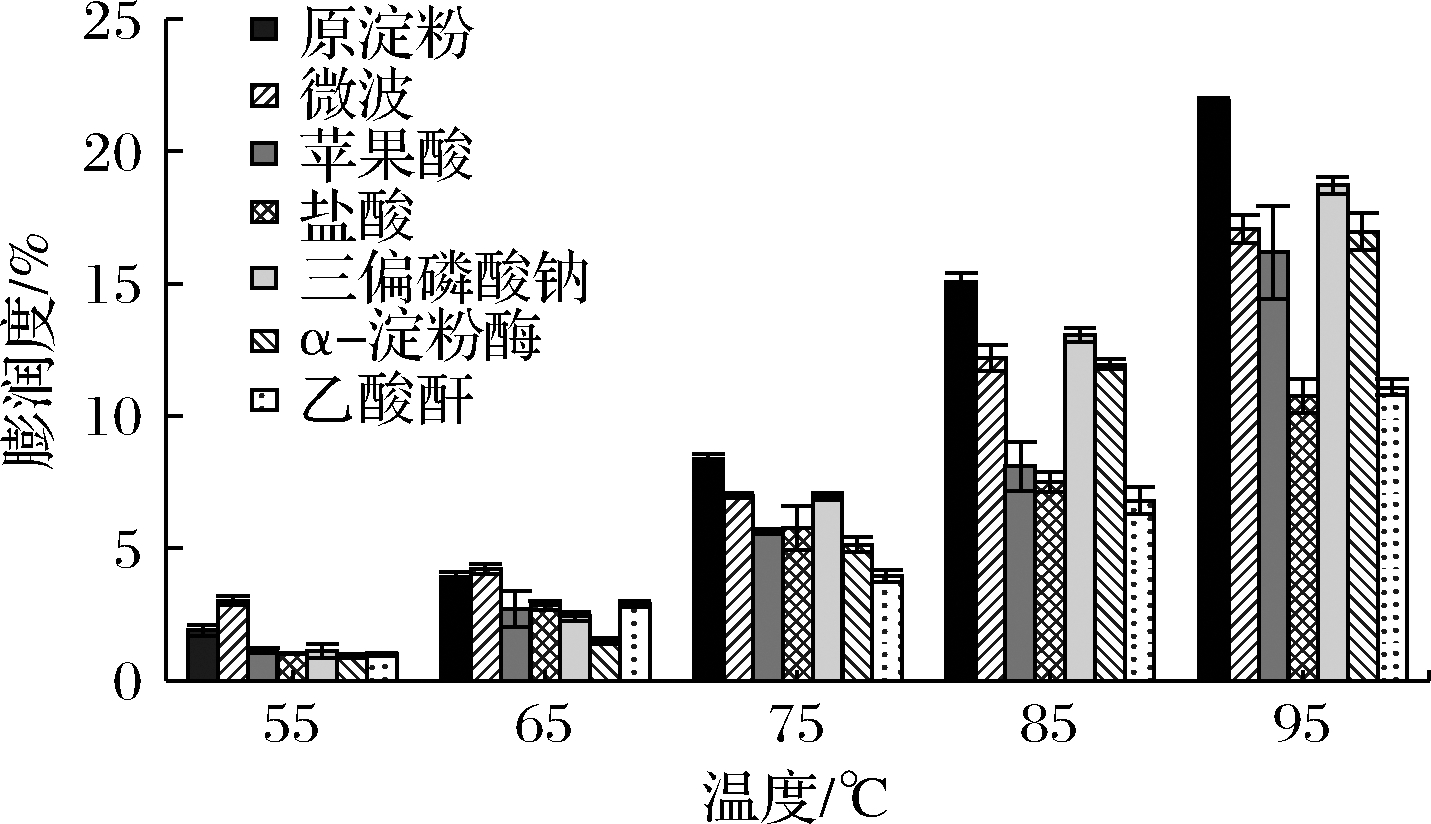
图4 不同处理条件下慈姑淀粉的膨胀度
Fig.4 Swelling degree of arrowhead starch under different treatment conditions
2.6 冻融稳定性
慈姑淀粉及其6种变性淀粉的冻融稳定性结果见图5,随着冷冻循环的次数增加,析水率在逐渐增大。经过苹果酸、盐酸、乙酸酐处理后的慈姑淀粉的稳定性相对较差,若考虑将慈姑变性淀粉用于冷冻产品,这3种改性方式要回避;此结果与表2中的直链和支链淀粉的结果基本一致,直链淀粉相对含量比例增加,导致析水率增高[25]。经过微波辐射过的慈姑淀粉,在3次循环过程中,析水率均低于原淀粉,稳定性有所提高,与慈姑淀粉相比,更适合做冷冻食品。经过三偏磷酸钠交联剂改性后的慈姑淀粉析水率与原淀粉相似,对慈姑淀粉的冻融稳定性基本没有影响。α-酶改性的慈姑淀粉在第1次冷冻循环中析水率低于原淀粉,经过3次循环达到稳定后,析水率明显高于原淀粉,冷冻融性明显低于慈姑原淀粉。

图5 不同处理条件下慈姑淀粉的析水率
Fig.5 Water evolution rate of arrowhead starch under different treatment conditions
2.7 凝沉性
淀粉的凝沉性与淀粉的老化相关,是淀粉糊的重要性质之一。由图6可知,不同处理方式对慈姑变性淀粉的凝沉性影响不同,在1 d内,α-淀粉酶、盐酸、三偏磷酸钠交联改性慈姑淀粉析出水的体积均比原淀粉高,微波和苹果酸处理后的淀粉析出水的体积低于原淀粉。放置4 d后,酶改性和盐酸改性淀粉的析出水的体积依旧高于原淀粉,表明其凝沉性较强。三偏磷酸钠改性和微波改性析出水的体积与原淀粉相似,苹果酸改性析出水的体积低于原淀粉,表明其凝沉性弱于其他改性淀粉。其原因可能是苹果酸处理的慈姑淀粉的支链淀粉长链主要转化为可溶性直链淀粉,直链淀粉的链长较长,其聚合度较高,空间阻力大,取向困难,回生慢,大大降低了其发生凝沉现象的趋势[17]。
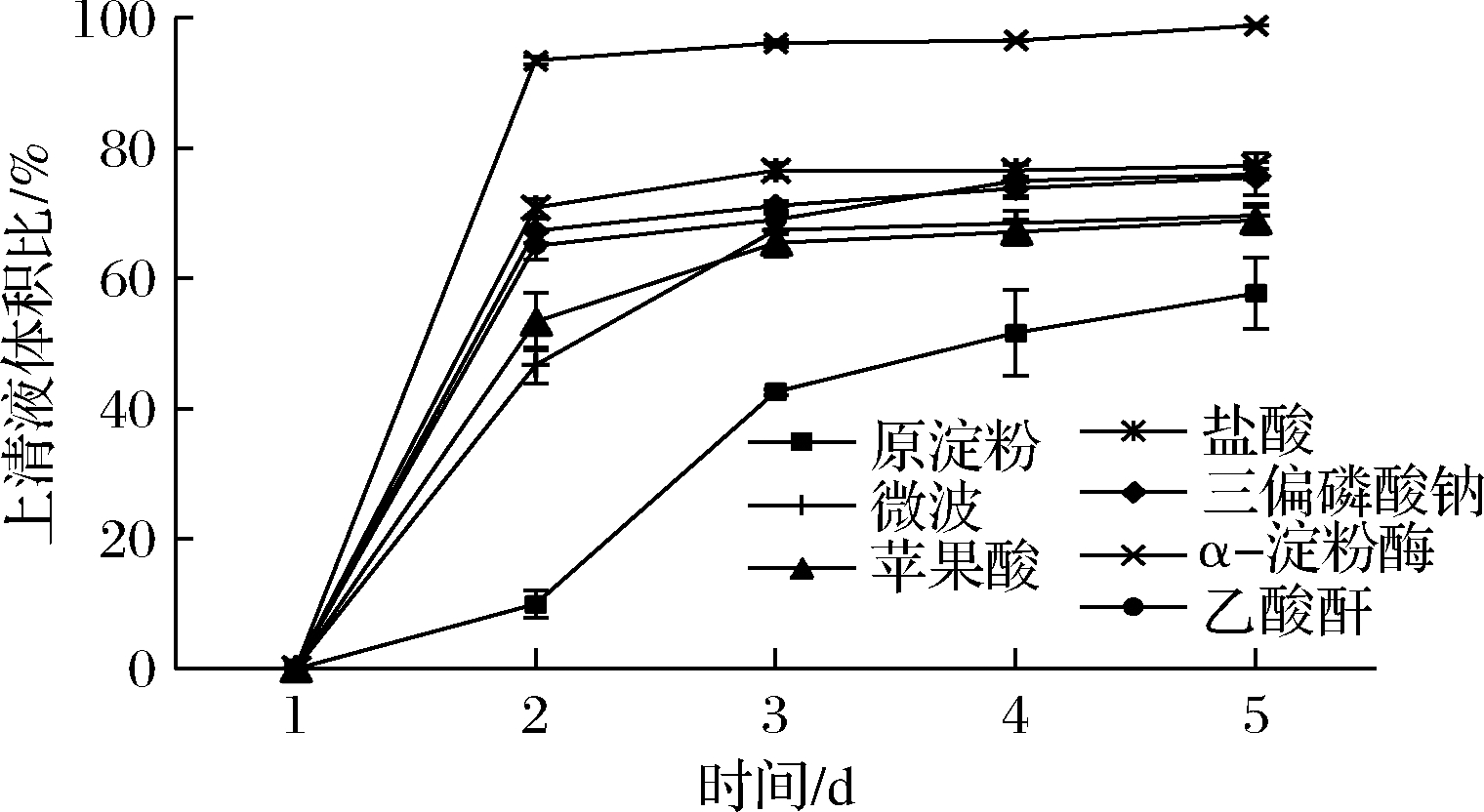
图6 不同处理条件下慈姑淀粉凝沉性的测定
Fig.6 Coagulability of arrowhead starch under different treatment conditions
2.8 扫描电镜
从图7-a可以看出,所选原慈姑淀粉呈椭圆形,淀粉表面有细微的粘连。微波改性的淀粉颗粒表面光滑,颗粒呈椭圆状或者球状,部分颗粒出现凹陷,并且颗粒表面出现粘连情况,小的颗粒抱团组成了较大的颗粒。苹果酸和乙酸酐处理后的淀粉颗粒基本相似,部分颗粒形成凹坑和空洞,可能与淀粉酸水解时,具有随机性和不定性有关[23]。盐酸改性慈姑淀粉的颗粒表面产生大量的碎片,吸附在完整颗粒的表面。三偏磷酸钠处理后改性的淀粉部分颗粒表面发生变化,部分淀粉颗粒表面出现裂纹。酶解后的淀粉与慈姑原淀粉的结构有明显的区别,酶解后的慈姑淀粉的颗粒表面失去了光滑性,出现了不规则的凹陷,且随机分布,说明水解情况比较良好。

a-原淀粉;b-微波改性;c-苹果酸改性;d-盐酸改性;e-三偏磷酸钠改性;f-α-淀粉酶改性;g-乙酸酐改性
图7 不同处理条件下慈姑淀粉扫描电镜图
Fig.7 Scanning electron microscope of arrowhead starch under different treatment conditions
2.9 DSC
DSC测定结果见图8及表2,微波处理后的淀粉糊化特性温度都明显增大,可能是因为微波辐射产生的作用力降低了原淀粉无定形区对结晶消失过程的干扰程度[25],此结果与扫描电镜结果一致。如表2所示,苹果酸和盐酸改性的慈姑淀粉的焓值分别为10.76、9.65 J/g,均明显升高,其原因可能是经过酸改性后的淀粉,氢键数目增多,同时有新基团形成,因此焓值升高,此结果与红外光谱分析的结果相呼应。经过三偏磷酸钠改性的慈姑淀粉糊化温度及焓值都升高,其原因可能是羟基发生缔合,进一步巩固了分子结构。乙酸酐改性的慈姑淀粉的糊化起始温度低于原淀粉,表明由于淀粉完整性被破坏,导致结晶度降低,糊化起始温度降低,此结果与乙酸酐处理后的慈姑淀粉的扫描电镜和X-衍射中结晶度减少结果相一致。经过α-淀粉酶改性的慈姑淀粉的Tc-To糊化范围减小,说明其在糊化过程中温度的变化较为稳定。
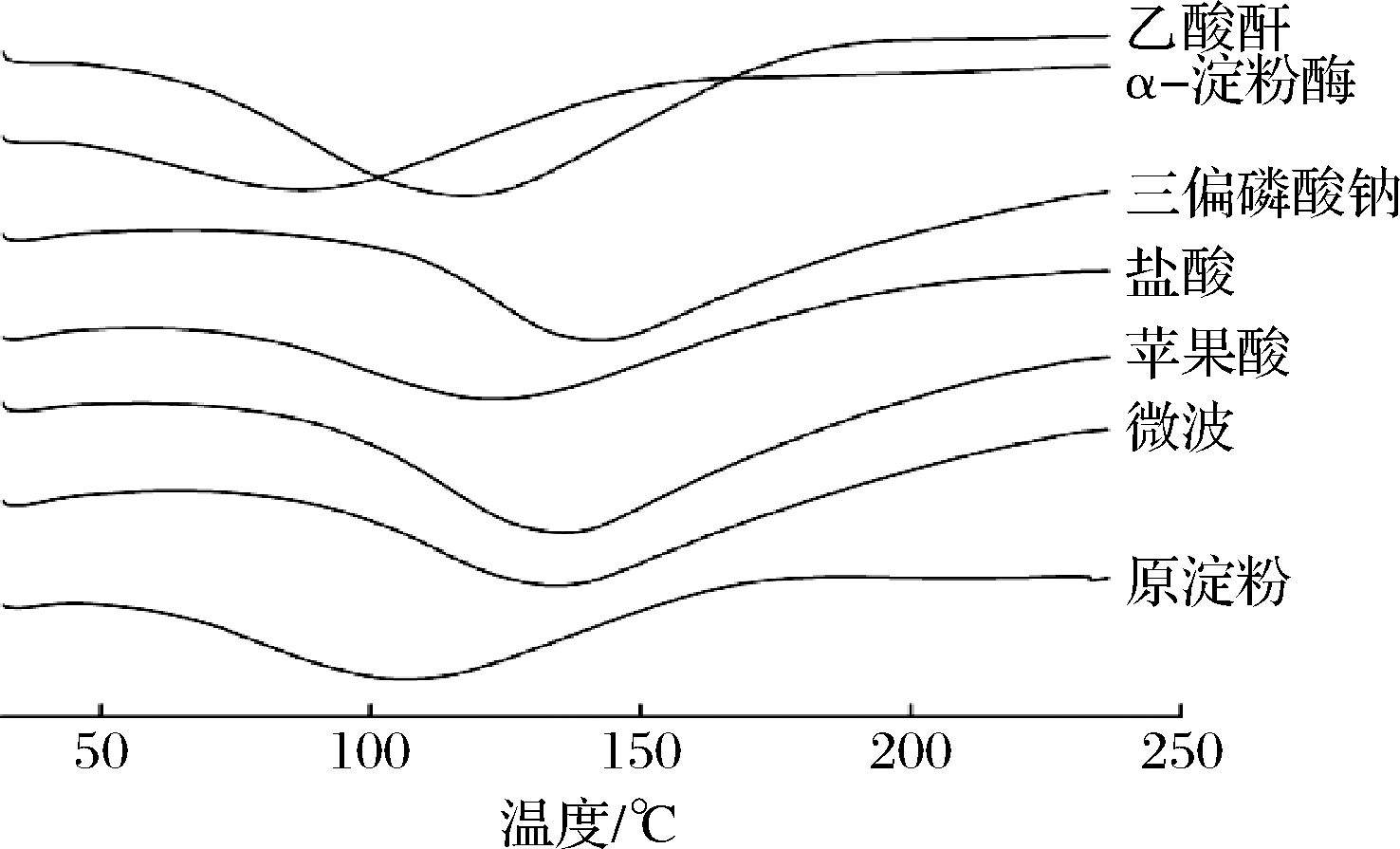
图8 六种改性慈姑淀粉DSC的分析
Fig.8 DSC analysis of different modified arrowhead starch
表2 DSC、XRD及红外部分结果分析
Table 2 Analysis of some DSC, XRD and IR results

处理方式DSCTo/℃Tp/℃Tc/℃ΔH/(J·g-1)结晶度/%红外1 047/1 022慈姑原淀粉45.51±0.32d106.84±1.02d186.74±0.59c7.95±0.15b44.800.861 7微波64.18±0.15b134.37±0.29b236.45±0.30a10.18±0.38a50.220.867 7苹果酸58.11±0.11c135.76±0.44b236.56±0.41a10.76±0.72a13.080.891 8盐酸58.33±0.25c122.70±0.42c236.58±0.43a9.65±0.05a43.800.918 6三偏磷酸钠66.57±0.48a142.58±1.32a236.50±0.35a10.70±0.05a47.900.891 7α-淀粉酶30.50±0.10e87.54±0.11e156.43±0.28d5.53±0.38c53.500.898 8乙酸酐30.37±0.41e117.54±1.36c216.34±0.19b7.85±0.05b42.460.847 9
2.10 X-衍射
淀粉的X-衍射结果如图9,慈姑原淀粉在15.16°、17.10°、17.92°和22.99°出现吸收峰,说明慈姑原淀粉属于A型结构,6种改性的慈姑淀粉峰形和位置大体相似,均属于A型结构。经过微波、盐酸和乙酸酐分别处理的慈姑淀粉的峰形高且窄,其结晶区域比较完整;苹果酸改性的慈姑淀粉的结晶峰面积小,结晶度降低[24]。经过α-淀粉酶改性的慈姑淀粉的峰形矮且宽,原因可能是直链淀粉含量降低,直链与支链结合渗透进入支链的微晶结构[26],此结果与直链和支链淀粉结果一致。经过三偏磷酸钠改性的慈姑淀粉峰形没有明显变化。由表2可知经过三偏磷酸钠、微波和α-淀粉酶改性的慈姑淀粉的结晶峰面积依次增大且大于慈姑原淀粉(44.8%),说明4种样品的结晶度依次增大。
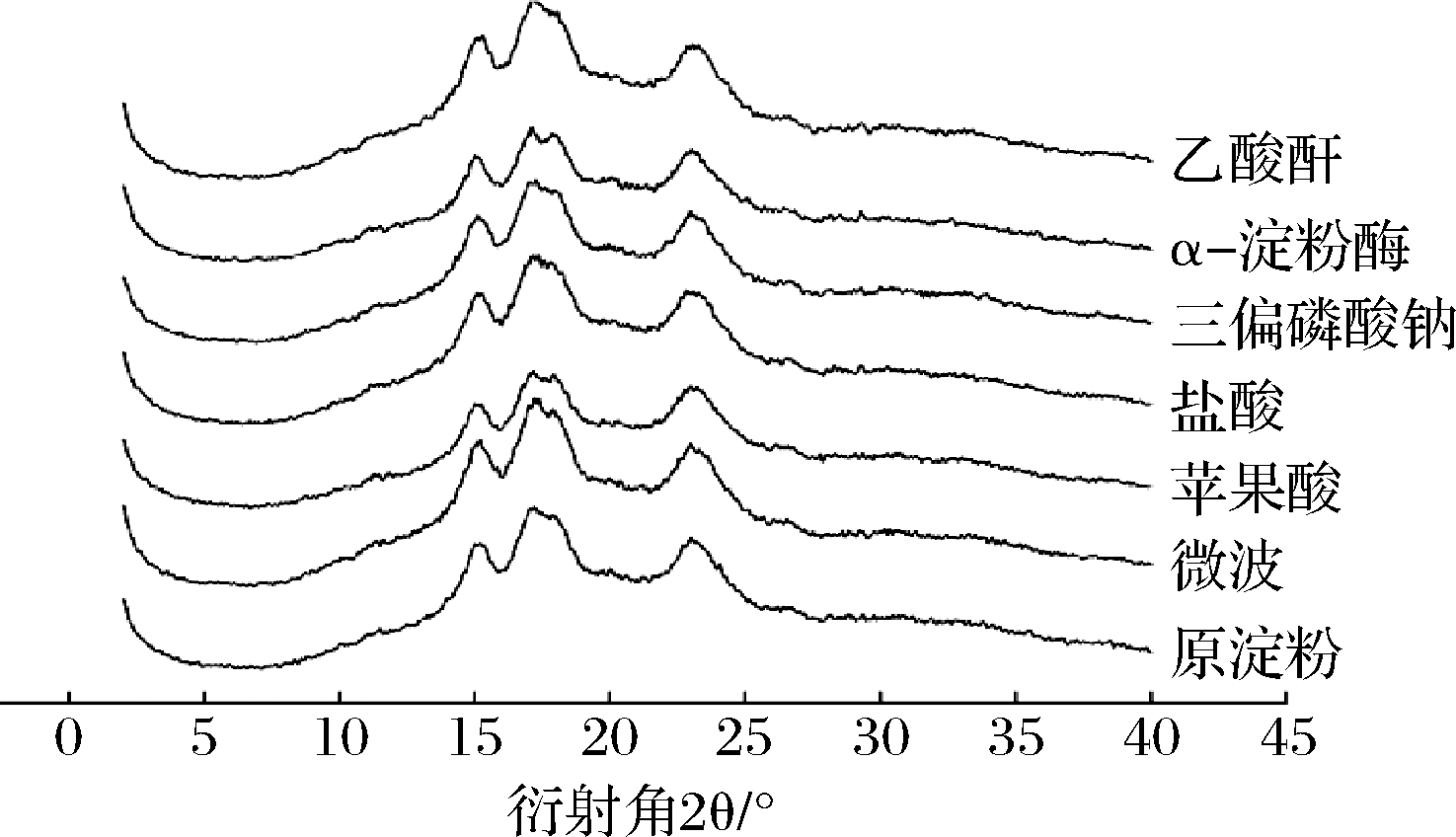
图9 不同处理条件下慈姑淀粉的X-衍射图
Fig.9 X-ray diffraction patterns of arrowhead starch under different treatment conditions
2.11 红外光谱
红外光谱常用于化学键和官能团的定性分析,对淀粉衍生物的结构分析有着重要意义。慈姑原淀粉与6种改性的淀粉红外测定结果如图10及表2所示,盐酸改性慈姑淀粉在1 100~1 030 cm-1有1个吸收峰,与慈姑原淀粉相比,频率向上移动,这是由于p-π共轭使C—Cl键具有双键性质,使其频率向高频位移,并且—Cl的吸电子效应对羰基的振动频率有影响,当氯原子与羰基直接相连时,羰基伸缩振动频率向高频位移[27]。乙酸酐改性慈姑淀粉在1 660~1 760 cm-1的频率范围内,C![]() O之间原来靠近氧原子的电子密度云向碳原子方向移动,导致羰基的电子云密度增大且伸缩振动力常数增加,伸缩振动频率向高频移动,并且经过乙酸酐处理后的慈姑淀粉的1 047/1 022的吸光度比值低于原淀粉,其有序度降低[28]。三偏磷酸钠改性慈姑淀粉在3 431 cm-1处有1个明显的吸收峰,其峰形比较宽,并且非常不对称,从峰的位置可以看出该吸收峰是羟基伸缩振动吸收峰,相比于慈姑原淀粉,该峰的形状变宽并且该峰的频率向低频方向移动[28],表明淀粉颗粒的羟基发生缔合。其余改性淀粉的红外光谱图与原淀粉相比其化学键和官能团没有明显差异。
O之间原来靠近氧原子的电子密度云向碳原子方向移动,导致羰基的电子云密度增大且伸缩振动力常数增加,伸缩振动频率向高频移动,并且经过乙酸酐处理后的慈姑淀粉的1 047/1 022的吸光度比值低于原淀粉,其有序度降低[28]。三偏磷酸钠改性慈姑淀粉在3 431 cm-1处有1个明显的吸收峰,其峰形比较宽,并且非常不对称,从峰的位置可以看出该吸收峰是羟基伸缩振动吸收峰,相比于慈姑原淀粉,该峰的形状变宽并且该峰的频率向低频方向移动[28],表明淀粉颗粒的羟基发生缔合。其余改性淀粉的红外光谱图与原淀粉相比其化学键和官能团没有明显差异。

图10 不同处理条件下慈姑淀粉的红外光谱图
Fig.10 Infrared spectra of arrowhead starch under different treatment conditions
3 结论
本文探究了6种改性方式对慈姑淀粉的理化特性影响,与慈姑原淀粉相比,溶解度、膨胀度、凝沉性和冷冻融性等性质都发生不同程度的变化。6种改性慈姑淀粉与原淀粉的峰形大体相似,都是属于A型,盐酸和乙酸酐改性的慈姑淀粉的峰形高且窄,结晶区域较完整。三偏磷酸钠改性的慈姑淀粉颗粒表面出现裂痕,淀粉颗粒的羟基发生缔合。直链淀粉的含量升高,且结晶度高于原慈姑淀粉。微波改性淀粉表面粘连,部分淀粉颗粒抱团,析水率降低,冷冻融稳定性好,其得率高达(96.64±0.16)%,利用其在低温状态下的稳定性来提高食品的抗冻融能力,用来制作雪糕等冷冻食品,其抗融化性和储藏的稳定性,还能够代替部分脂肪[29]。苹果酸改性的慈姑淀粉的凝沉性和透明度低于慈姑淀粉,且外观品质较低,红外结果显示其1 047/1 022吸光度比值升高,颗粒内的有序度降低。三偏磷酸钠和乙酸酐分别改性的慈姑亮度增加,黄色程度明显下降,外观明显优于慈姑淀粉,将改性后的淀粉加入到制作食品的面粉中,可以有效地改善面粉的色泽。盐酸改性的慈姑淀粉凝沉性好,凝沉性指标与食品老化程度有关,将其加入淀粉类的食物中,加速食物的老化,节约时间。α-淀粉酶改性的慈姑淀粉凝沉性比较高,透光率最好,高达(49.57±1.14)%,但是其得率最低,为(56.82±1.33)%,可将其加入到糖果类食品中,使糖果更加的光泽透亮,同时可利用变性淀粉的吸附性,将经过酶改性的淀粉加入到饮料类中,期望能遮盖涩味改善口味,使饮料浑浊程度降低。淀粉的改性方法不同,即使来源相同,改性淀粉的理化特性大部分显示较大差异,在具体应用过程中,可根据实际需要选择对应特性突出的改性慈姑淀粉。
[1] FAN Y F, PICCHIONI F.Modification of starch:A review on the application of “green” solvents and controlled functionalization[J].Carbohydrate Polymers, 2020, 241:116350.
[2] KAUR J, KAUR G, SHARMA S, et al.Cereal starch nanoparticles—A prospective food additive:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(7):1 097-1 107.
[3] GUO P, YU J L, COPELAND L, et al.Mechanisms of starch gelatinization during heating of wheat flour and its effect on in vitro starch digestibility[J].Food Hydrocolloids, 2018, 82:370-378.
[4] ESMAEILI M, PIRCHERAGHI G, BAGHERI R.Optimizing the mechanical and physical properties of thermoplastic starch via tuning the molecular microstructure through co-plasticization by sorbitol and glycerol[J].Polymer International,2017, 66(6):809-819.
[5] PAN Y, WU Z Z, ZHANG B, et al.Preparation and characterization of emulsion stabilized by octenyl succinic anhydride-modified dextrin for improving storage stability and curcumin encapsulation[J].Food Chemistry, 2019, 294:326-332.
[6] 张燕萍.变性淀粉制造与应用[M].北京:化学工业出版社,2007.
ZHANG Y P.Manufacturing and Application of Modified Starch [M].Beijing:Chemical Industry Press, 2007.
[7] MAULANI R R, FARDIAZ D, KUSNANDAR F, et al.Characterization of chemical and physical properties of hydroxypropylated and cross-linked arrowroot (Marantha arundinacea) starch[J].Journal of Engineering and Technological Sciences, 2013, 45(3):207-221.
[8] XIE Y, ZHANG B, LI M N, et al.Effects of cross-linking with sodium trimetaphosphate on structural and adsorptive properties of porous wheat starches[J].Food Chemistry, 2019, 289(5):187-194.
[9] 段善海,徐大庆,缪铭.物理法在淀粉改性中的研究进展[J].食品科学,2007, 28(3):361-366.
DUAN S H, XU D Q, MIAO M.Review on advance of modified starch based on physical methods[J].Food Science, 2007, 28(3):361-366.
[10] 孔勇,杨枝,王治法,等.淀粉改性研究及其在钻井液中的应用[J].应用化工,2016,45(11):2 153-2 157.
KONG Y, YANG Z, WANG Z F, et al.Research of modified starch and its application in drilling fluid[J].Applied Chemical Industry,2016,45(11):2 153-2 157.
[11] 何荣海,谢斌,仲晗实, 等.扫频脉冲超声辅助提取慈姑淀粉的试验研究[J].食品工业科技,2012,33(15):274-276;288.
HE R H, XIE B, ZHONG H S, et al.Extraction of starch from Arrowhead Corm by frequency sweeping pulsed ultrasound[J].Science and Technology of Food Industry,2012,33(15):274-276;288.
[12] 陈晓明,伏春燕,金征宇.慈菇淀粉的理化性质[J].中国粮油学报,2010,25(7):57-61.
CHEN X M, FU C Y, JIN Z Y.Properties of starch from Sagittaria latifoliais[J].Journal of the Chinese Cereals and Oils Association,2010,25(7):57-61.
[13] 游曼洁,刘欣,赵力超, 等.酸解-微波法制备慈姑抗性淀粉的研究[J].食品工业科技, 2009, 30(12):262-264.
YOU M J, LIU X, ZHAO L C, et al.Study on the preparation of arrowhead resistant starch by acid hydrolysis-microwave method[J].Science and Technology of Food Industry, 2009, 30(12):262-264.
[14] WANI A A, WANI I A, HUSSAIN P R, et al.Physicochemical properties of native and γ-irradiated wild arrowhead (Sagittaria sagittifolia L.) tuber starch[J].International Journal of Biological Macromolecules, 2015, 77:360-368.
[15] 戢得蓉, 雷敏, 谢建明, 等.过氧化氢/硫酸铜氧化慈姑淀粉的制备及性质研究[J].食品与发酵工业, 2020, 46(13):209-216.
JI D R, LEI M, XIE J M, et al.Preparation and properties analysis of arrowhead starch oxidized by H2O2/CuSO4[J].Food and Fermentation Industries, 2020, 46(13):209-216.
[16] 罗志刚, 徐小娟, 陈永志.微波对马铃薯淀粉螺旋结构及消化性的影响[J].华南理工大学学报(自然科学版), 2017, 45(12):1-7.
LUO Z G, XU X J, CHEN Y Z.Effect of microwave treatment on helical structure and digestibility of potato starch[J].Journal of South China University of Technology (Natural Science Edition), 2017, 45(12):1-7.
[17] 胡爱军,李杨,郑捷, 等.超声复合有机酸改性香芋淀粉的研究[J].中国食品学报,2018,18(3):150-156.
HU A J, LI Y, ZHENG J, et al.Studies on taro starch modification using the ultrasound and organic acid methods[J].Journal of Chinese Institute of Food Science and Technology,2018,18(3):150-156.
[18] 谢显华, 罗志刚, 杨连生.无水有机醇介质中盐酸对小麦淀粉性质的影响[J].食品与发酵工业, 2008, 34(7):86-89.
XIE X H, LUO Z G, YANG L S.Properties of wheat starch treated in different anhydrous alcohols with hydrochloric acid[J].Food and Fermentation Industries, 2008, 34(7):86-89.
[19] 程东,洪雁,庞艳生,等.交联和羟丙基改性对蜡质玉米淀粉糊化和流变性质的影响[J].食品与发酵工业,2016,42(3):18-23.
CHENG D, HONG Y, PANG Y S, et al.Effects of cross-linking and hydroxypropylation on pasting and rheological properties of waxy maize starch[J].Food and Fermentation Industries,2016,42(3):18-23.
[20] 周旭倩,王晓丹,陆国权,等.酶法改性芋艿淀粉工艺研究及其性质分析[J].食品科技,2015,40(1):277-282.
ZHOU X Q, WANG X D, LU G Q, et al.Preparation and characterization of enzymatic modified taro starch by α-amylase[J].Food Science and Technology,2015,40(1):277-282.
[21] 于泓鹏,朱婉怡,高群玉, 等.食用醋酸酯淀粉制备和性质的研究[J].食品科学,2003,24(7):70-74.
YU H P, ZHU W Y, GAO Q Y, et al.Study on preparation and properties of edible acetate starch[J].Food Science,2003,24(7):70-74.
[22] 范明顺,张崇玉,张琴, 等.双波长分光光度法测定高粱中的直链淀粉和支链淀粉[J].中国酿造,2008(11):85-87.
FAN M S, ZHANG C Y, ZHANG Q, et al.Determination of amylose and amylopectin content in sorghum by dual wavelength method [J].China Brewing,2008(11):85-87.
[23] 兰冬梅. 微波对锥栗全粉理化性质的影响及即食锥栗的研制[D].福州:福建农林大学, 2016.
LAN D M.Effect of microwave irradiation on the physicochemical properties of Castanea henryi powder and the development of instant Castanea henryi[D].Fuzhou:Fujian Agriculture and Forestry University, 2016.
[24] 史晓云. 酶解玉米淀粉的性质及对粉丝品质影响的研究[D].济南:齐鲁工业大学, 2015.
SHI X Y.The research on the properties of hydrolysis of corn starch and its effects of vermicelli quality[D].Jinan:Qilu University of Technology, 2015.
[25] 罗志刚,谢显华,徐中岳.有机醇介质中盐酸对马铃薯淀粉性质的影响[J].华南理工大学学报(自然科学版),2009,37(3):90-93;98.
LUO Z G, XIE X H, XU Z Y.Effect of hydrochloric acid in organic alcohol on properties of potato starch[J].Journal of South China University of Technology(Natural Science Edition),2009,37(3):90-93;98.
[26] CH VEZ-MURILLO C E, WANG Y J, BELLO-PÉREZ L A.Morphological, physicochemical and structural characteristics of oxidized barley and corn starches[J].Starch - Stärke, 2008, 60(11):634-645.
VEZ-MURILLO C E, WANG Y J, BELLO-PÉREZ L A.Morphological, physicochemical and structural characteristics of oxidized barley and corn starches[J].Starch - Stärke, 2008, 60(11):634-645.
[27] 翁诗甫,徐怡庄.傅里叶变换红外光谱分析[M].3版.北京:化学工业出版社,2016.
WENG S P, XU Y Z.Fourier Transform Infrared Spectroscopy [M].Third edition.Beijing:Chemical Industry Press,2016.
[28] SHINGEL K I.Determination of structural peculiarities of dexran, pullulan and γ-irradiated pullulan by Fourier-transform IR spectroscopy[J].Carbohydrate Research,2002,337(16):1 445-1 451.
[29] 米佳. 醋酸酯淀粉在速冻水饺皮中作用机理的研究[D].济南:齐鲁工业大学, 2014.
MI J.Study of the mechanism of acetylated starch in dumpling wrappers[D].Jinan:Qilu University of Technology, 2014.