石蜡切片技术是观察植物组织结构最重要的技术之一[1-2]。该技术可以很好地将石蜡与植物组织结合,经过固定、脱水、透明、染色等一系列特殊的方法制成透明的薄片,在显微镜或电子显微镜下观察,可如实地反映细胞组织的结构和形态变化,定量地测定物料中组织结构的大小、数量及所含物质的量的多少[3-4]。
石蜡切片结合图像处理技术可以定量地对细胞结构的变化指标进行测定。近年来,越来越多的人关注果蔬干燥过程中微观结构的变化。常剑等[5]运用石蜡切片技术获得了马铃薯、苹果、胡萝卜薄壁组织细胞结构图像,通过Motic Images Plus 2.0软件测量细胞的面积、周长,计算出细胞当量直径和圆度,分析热风干燥对果蔬薄壁组织结构的变化,建立了微观参数与宏观参数(水分比)的数学模型。郭徽[6]利用石蜡切片技术获得了不同干燥方法三七主根组织微观图像,运用图像处理技术计算出面积分形维数以及迂曲分形维数,建立了三七主根内部传质的数学模型。韦玉龙等[7-8]利用石蜡切片结合图像处理技术获得了热风干制过程中枣果细胞、空腔等结构随含水率变化的分布曲线,建立了非线性模型,预测了干制过程中细胞、空腔等结构的变化情况。杨佳琪[9]运用石蜡切片技术获得了热风干燥蜜桃和胡萝卜的组织微观结构图像,运用MATLAB和Photoshop等图像处理软件获得相关微观参数,以含水率为指标进行分析,进一步得到了干燥过程中物料的微观与宏观结构参数的关系。ONG等[10]利用扫描电镜获取了热烫预处理后不同干燥方法的水果果实微观结构,表明不同干燥温度对水果果实薄壁细胞形状和完整度有显著的影响。MOREIRA等[11]使用刀片徒手切片后甲苯胺酮溶液染色,获取了新鲜、渗透脱水、风干和复水后板栗的微观结构,通过UTHSCSA Image Tool v.2.0等软件计算出板栗细胞大小和形状参数,对比了新鲜板栗和不同脱水处理后板栗微观结构的变化。
与扫描电镜相比,石蜡切片技术具有廉价、实时监测、制作简单等优点。目前,传统石蜡切片技术多数针对新鲜果蔬物料,本文针对干制怀山药硬度较大、含水率较低的特点,在传统的石蜡切片技术基础上进行改良,探索出适合干制怀山药的石蜡切片技术。利用改良技术观察了热风干燥、真空干燥和微波真空冷冻干燥怀山药的微观结构,该技术为研究干燥物料微观结构提供良好的技术支撑。
1 材料与方法
1.1 材料
新鲜怀山药产自河南焦作温县,2021年4月在中国特产温县馆采购,所选怀山药外形完整、粗细均匀、表皮无酶、无病虫害、肉质洁白,置于4 ℃冰箱备用。
1.2 设备与试剂
HistoCore MULTICUT轮转式切片机,徕卡显微系统(上海)有限公司;ZXRD-B5110热风干燥箱,上海智城分析仪器制造有限公司;DZF-6050B真空干燥箱,上海一恒科学有限公司;DK-90-II电热恒温水浴锅,天津市泰斯特仪器有限公司;Nikon Eclipse Ti倒置荧光显微镜,尼康映像仪器销售(中国)有限公司;SQP-QUINTIX124-1CN电子天平,赛多利斯科学仪器(北京)有限公司;DHS16-A多功能红外水分测定仪,上海精密科学仪器有限公司;微波真空冷冻干燥机,自制(设备原理参考文献[12]);GR-B2471PKF冰箱,泰州乐金电子冷机有限公司。
二甲苯、冰乙酸、固绿,上海麦克林生化科技有限公司;甲醛、无水乙醇、95%乙醇,天津市北联精细化学品开发有限公司;盐酸,北京化工厂;石蜡48~50 ℃,北京索莱宝科技有限公司;中性树胶,美仑生物科技有限公司;番红,上海源叶生物科技有限公司。
1.3 实验方法
1.3.1 实验设计
本实验分别选用热风干燥(hot-air drying, HAD):温度45、50、55 ℃;真空干燥(vacuum drying, VD):温度50、55、60 ℃,压强0.9×105 Pa;微波真空冷冻干燥(microwave vacuum freeze drying, MFD):微波功率0.225、1、1.5 W/g,压强50、100、150、200 Pa。每个干燥条件下装载量为(50.000±0.050) g,含水率≤10%(湿基含水率)时干燥结束。每个干燥条件的物料被分为2组,第1组取4/5怀山药,用于测量怀山药干制过程中的含水率。第2组取1/5怀山药,用于制作石蜡切片观察,尺寸约为5 mm×5 mm×4 mm的薄块,放入甲醛-乙醇-冰乙酸固定液(formaldehyde-acetic acid-ethanol fixative, FAA)中保存。
1.3.2 初始含水率的测定
开启显示器预热30 min,同时进行功能自检,在预热期间将待测的怀山药切碎(2 mm),待预热结束,设定加热温度105 ℃、加热时间120 min,称量切碎的物料10 g,开始工作。待测定结束,点击功能键查看物料含水率。
1.3.3 湿基含水率的测定
干燥试验过程中物料湿基含水率[13]的计算如公式(1)所示:
(1)
式中:ωt,任意干燥t时刻物料湿基含水率,%;ω0,物料初始湿基含水率,%;mt,任意干燥t时刻的质量,g;m0,物料初始质量,g。
1.3.4 传统石蜡切片技术
传统的石蜡切片技术是选用新鲜的物料[14],进行FAA或多聚甲醛固定液固定,梯度乙醇脱水,V(乙醇)∶V(二甲苯)=1∶1、二甲苯、二甲苯按顺序透明,旧蜡液40 ℃恒温箱过夜、纯蜡换3次,切片,展片,二甲苯脱蜡,番红-固绿二重染色,封片,拍照观察。
1.3.5 改良石蜡切片技术
干制怀山药的特点是硬度较大、含水率较低[15-16],造成溶液不宜渗透,固定、脱水、透明、浸蜡等过程难度大,且切出的薄片容易断裂,染色效果较差。有研究表明,针对干、硬物料制作石蜡切片需因材制宜,因此本文参考文献[14,17]在传统石蜡切片基础上增加了软化预处理的过程、加长固定时间以达到良好的切片效果。
1.3.5.1 取材、软化、固定
物料尺寸5 mm×5 mm×4 mm,在体积分数20%的盐酸中浸泡12 h,将浸泡好的物料沥干投入FAA固定液中固定,放入摇床,温度设置为室温,待36 h后将固定好的物料流水冲洗过夜。
1.3.5.2 脱水、透明
梯度乙醇脱水:50%→70%→85%→95%→100%→100%→V(乙醇)∶V(二甲苯)=1∶1→二甲苯→二甲苯,各1.5 h
透明、脱水的过程在室温下进行。
1.3.5.3 浸蜡、包埋
V(二甲苯)∶V(蜡液)=2∶8→新蜡液→新蜡液→包埋
V(二甲苯)∶V(蜡液)=2∶8浸蜡过夜、新蜡液分别浸蜡2 h、包埋需在浸蜡结束后立即进行。浸蜡的过程在恒温箱中进行,恒温箱的温度不宜太高,应设置高于石蜡熔点2~3 ℃。
1.3.5.4 切片、展片、烤片
将包埋好的蜡块修成梯形→设置切片厚度(10~12 μm)→切片→展片(水浴锅温度40 ℃)→捞片→烤片(恒温干燥箱温度40 ℃)
1.3.5.5 脱蜡、染色
二甲苯20 min→二甲苯20 min→V(无水乙醇)∶V(二甲苯)=1∶1 10 min→100%乙醇20 min→95%乙醇10 min→浸入番红染液中1 h→85%乙醇1 min(去浮色)→固绿染色液5~10 s→95%乙醇1 min→100%乙醇1 min→二甲苯10 min→二甲苯10 min
1.3.5.6 封片、镜检
封片是将盖玻片一侧放置在滴有中性树胶的组织切片上,随后缓慢放下并将空气完全排除,避免水蒸气进入,封片后将样片转于37 ℃恒温箱中烘干,即可长久保存。镜检是使用倒置荧光显微镜与NIS-Elements成像系统观察与拍照。
2 结果与分析
2.1 改良技术对干制怀山药石蜡切片效果的影响
改良前后石蜡切片效果的对比如图1所示。
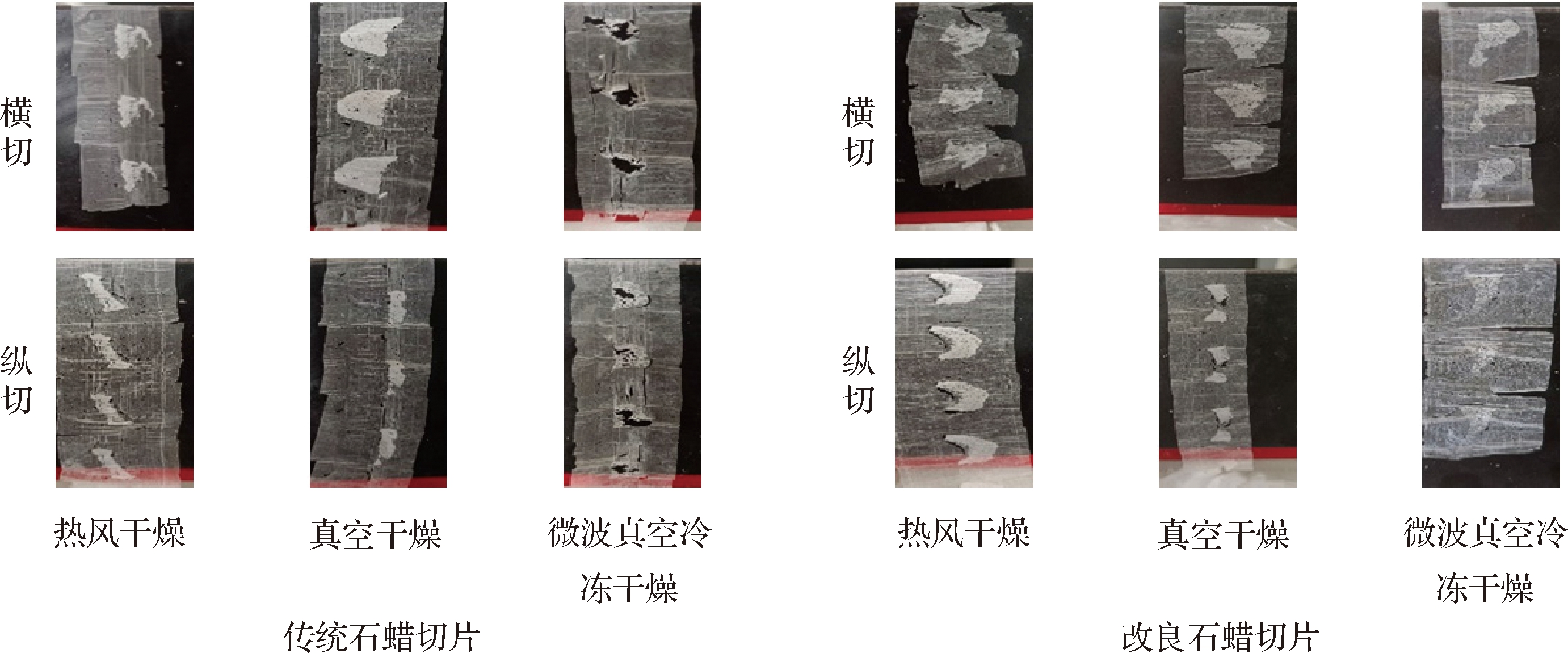
图1 改良前后石蜡切片效果的对比
Fig.1 Comparison of paraffin section before and after improvement
因为干制怀山药干、硬的特点,运用传统石蜡切片技术制作时物料不易渗透溶液,导致切片局部碎裂,无法进行展片、染色等步骤。传统石蜡切片制作的微波真空冷冻干燥怀山药的横纵切片均出现局部碎裂的情况,不利于后续石蜡切片制作。与传统石蜡切片比较,改良石蜡切片技术可以制出完整连续的薄片,组织容易渗透溶液,后续染色效果很好,适用于热风干燥、真空干燥、微波真空冷冻干燥的干制怀山药石蜡切片制作。
2.2 不同干燥方法对怀山药微观结构的影响
石蜡切片技术与扫描电镜均可以观察果蔬组织微观结构。本文运用改良石蜡切片技术对新鲜怀山药和干制怀山药进行横切和纵切,横、纵截面怀山药的微观结构图像如图2所示。

图2 不同干燥方法下怀山药改良石蜡切片截面图(×400)
Fig.2 Cross-section of paraffin sections of Diosocorea opposita with different drying methods (×400)
热风干燥的怀山药微观结构细胞壁破坏严重,组织结构致密,真空干燥的怀山药微观结构存在一定的水分蒸发通道,热风干燥与真空干燥微观结构变化较为相似,都是使物料的细胞壁失去了饱满而立体的状态,皱缩严重,与淀粉颗粒包裹在一起,但细胞结构框架依稀可辨,该现象与文献[18]观察到的一致,表明温度是导致细胞壁皱缩的首要因素;微波真空冷冻干燥的怀山药微观结构轮廓较清晰,细胞具有明显的蜂窝状结构,该现象与文献[19]观察到的一致,表明微波真空冷冻干燥在冷冻阶段已经形成了多孔的细胞结构,这个孔道在后续的微波真空干燥过程中得到了保持。与鲜样相比干制怀山药的细胞组织结构变化很大,鲜样的组织细胞结构松散,具有均匀的多孔结构,经过干燥处理之后,细胞壁皱缩、组织结构变得致密,由于干燥方法不同,去除水分的原理不同,造成怀山药细胞中水分迁出分布不同,淀粉与水之间的结合力改变,导致怀山药细胞结构发生变化。
2.3 热风干燥温度对怀山药微观结构的影响
热风干燥的怀山药微观结构横、纵截面如图3所示。温度45 ℃时横截面木质纤维破坏严重、纵截面孔道结构致密且淀粉粒分布收缩;温度50 ℃时横截面木质纤维破坏严重但是淀粉粒具有蜂窝状结构、纵截面孔道结构致密且淀粉粒分布收缩;温度55 ℃时横截面木质纤维破坏严重且具有空洞,纵截面孔道结构致密且淀粉粒分布收缩。说明干燥温度越高对物料的细胞壁破坏程度、皱缩程度影响越大。

图3 不同温度下热风干燥的改良石蜡切片截面图(×400)
Fig.3 Cross-section of paraffin sections blast drying at different temperatures (×400)
2.4 真空干燥温度对怀山药微观结构的影响
真空干燥怀山药的微观结构横、纵截面见图4。

图4 不同温度下真空干燥的改良石蜡切片截面图(×400)
Fig.4 Cross-section of paraffin sections vacuum drying at different temperatures (×400)
温度50 ℃,压强0.9×105 Pa时横截面木质纤维被破坏、出现较大空洞,纵截面孔道结构松散、淀粉粒具有蜂窝状结构;温度55 ℃,压强0.9×105 Pa时横纵截面木质纤维均破坏严重,出现较大空洞,淀粉粒收缩,纵截面孔道结构致密;温度60 ℃,压强0.9×105 Pa时横截面木质纤维均破坏严重,出现空洞,纵截面出现大面积空洞。说明真空干燥与热风干燥对怀山药组织的微观结构破坏程度相似,但是在压强的作用和温度越高时更容易出现大面积的空洞。
2.5 微波真空冷冻干燥的功率、压强对怀山药微观结构的影响
微波真空冷冻干燥的怀山药微观结构横、纵截面如图5所示。

图5 不同微波功率、压强下微波真空冷冻干燥的石蜡切片截面图(×400)
Fig.5 Cross-section of paraffin section microwave vacuum freeze-drying at different microwave power and vacuum degree (×400)
压强200 Pa,微波功率0.225 W/g时横截面空腔结构致密、纵截面木质纤维破坏较小;压强150 Pa,微波功率0.225 W/g时横截面木质纤维破坏较小、纵截面淀粉粒具有蜂窝状结构;压强100 Pa,微波功率0.225 W/g时横纵截面木质纤维破坏、空腔结构致密;压强50 Pa,微波功率0.225 W/g时横截面空腔结构、木质纤维保持最完整;压强100 Pa,微波功率1 W/g时横截面具有蜂窝状结构、纵截面木质纤维保持较好且淀粉粒分布具有蜂窝状结构;压强200 Pa,微波功率1.5 W/g时横截面结构致密但是出现水分通道、纵截面出现空洞。说明微波真空冷冻干燥可以很好地保持多孔介质的组织结构,相对压强越高时越容易出现结构致密和水分通道的现象,压强一定时微波功率的影响很小。
3 结论
改良石蜡切片技术溶液渗透效果较好,原有细胞形态保持良好,脱水透明时组织不易发脆,浸蜡时不会引起材料变脆、变硬而收缩,切片时可以形成完整的蜡带,不易碎裂,染色效果好、不易发生掉片现象。
运用改良石蜡切片技术观察怀山药的微观结构,其中热风干燥的怀山药温度越高,木质纤维破坏越严重;真空干燥的怀山药压强与温度越高越容易出现大面积空洞;微波真空冷冻干燥的怀山药压强越高越容易出现结构致密的现象和空洞,压强一定时微波功率的影响较小。
综合来看,改良石蜡切片技术结合显微成像技术可以得到组织完整的石蜡切片图像,能够清楚地分析干燥后物料组织的细胞及细胞与细胞之间的孔道网络,为干燥物料观察微观结构提供了一套具体的操作步骤。
[1] YE Q, WU Y, GAO Y, et al.A histological study of mouse tissues and water loss following lyophilization[J].Biotechnic & Histochemistry, 2020, 95(5):325-332.
[2] 高东菊, 鲍文敏, 陈岳, 等.黄瓜果瘤石蜡切片制片技术[J].分子植物育种, 2020, 18(21):7 143-7 148.
GAO D J, BAO W M, CHEN Y, et al.Paraffin section technology of fruit tumor tissues in cucumber(Cucumis sativus L.)[J].Molecular Plant Breeding, 2020, 18(21):7 143-7 148.
[3] NAMEI E G, SUN W, PAN D, et al.The advanced paraffin-section preparation technique based on multiple cumulus-oocyte complexes rather than ovaries in ovine[J].Reproductive Biology, 2021, 21(1):100473.
[4] LEE T H, KIM Y J, ROU W S, et al.Fabrication of formalin-fixed, paraffin-embedded (FFPE) circulating tumor cell (CTC) block using a hydrogel core-mediated method[J].Micromachines, 2021, 12(9):1128.
[5] 常剑, 杨德勇, 路倩倩, 等.热风干燥对果蔬薄壁组织细胞结构的影响[J].农业工程学报, 2012, 28(14):262-268.
CHANG J, YANG D Y, LU Q Q, et al.Effect of hot-air drying on cell structure of fruit and vegetable parenchyma[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(14):262-268.
[6] 郭徽. 云南三七干燥特性及其传质模型研究[D].昆明:昆明理工大学, 2015.
GUO H.Research on drying characteristics and mass transfer model of Yunnan Panax notoginseng[D].Kunming:Kunming University of Science and Technology, 2015.
[7] 韦玉龙. 热风干制对哈密大枣组织结构的影响[D].乌鲁木齐:新疆农业大学, 2015.
WEI Y L.The effects of hot-air drying on the structure of Hami jujube[D].Urumqi:XinJiang Agricultural University, 2015.
[8] 韦玉龙, 于宁, 许铭强, 等.热风干制温度对枣果微观组织结构的影响[J].农业工程学报, 2016, 32(7):244-251.
WEI Y L, YU N, XU M Q, et al.Effect of hot air drying temperature on microstructure of Chinese jujube[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(7):244-251.
[9] 杨佳琪. 果蔬干燥过程微观组织结构变化的实验研究[D].西安:陕西科技大学, 2020.
YANG J Q.Experimental study on microstructure changes of fruits and vegetables during drying[D].Xi’an:Shaanxi University of Science & Technology, 2020.
[10] ONG S P, LAW C L.Microstructure and optical properties of salak fruit under different drying and pretreatment conditions[J].Drying Technology, 2011, 29(16):1 954-1 962.
[11] MOREIRA R, CHENLO F, CHAGURI L, et al.Analysis of chestnut cellular tissue during osmotic dehydration, air drying, and rehydration processes[J].Drying Technology, 2010, 29(1):10-18.
[12] DUAN X, REN G Y, ZHU W X.Microwave freeze drying of apple slices based on the dielectric properties[J].Drying Technology, 2012, 30(5):535-541.
[13] 段续, 刘文超, 任广跃, 等.双孢菇微波冷冻干燥特性及干燥品质[J].农业工程学报, 2016, 32(12):295-302.
DUAN X, LIU W C, REN G Y, et al.Drying characteristics and quality of button mushrooms during microwave freeze drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(12):295-302.
[14] 王艳芳, 叶淄, 刘昊, 等.不同发育时期苹果果实组织石蜡切片制作探究[J].果树学报, 2014, 31(5):973-976;1.
WANG Y F, YE Z, LIU H, et al.Studies of paraffin section manufaction for apple fruits in different development stages[J].Journal of Fruit Science, 2014, 31(5):973-976;1.
[15] 段柳柳. 怀山药微波冷冻干燥(MFD)过程的孔道演变特性及调控[D].洛阳:河南科技大学, 2019.
DUAN L L.Characteristics and regulation of porous morphological of Chinese yam during microwave freeze-drying(MFD)[D].Luoyang:Henan University of Science and Technology, 2019.
[16] 肖敏. 不同糖渗透处理和干燥方式对苹果脆片质构品质形成影响的研究[D].北京:中国农业科学院, 2017.
XIAO M.Study on effects of osmotic dehydration with different saccharides and drying methods on texure of dried apple chips[D].Beijing:Chinese Academy of Agricultural Sciences, 2017.
[17] 王志敏, 张玉平, 曹均, 等.‘蓝塔’圆柏茎段组织石蜡切片技术研究[J].中国农学通报, 2019, 35(28):75-79.
WANG Z M, ZHANG Y P, CAO J, et al.Stem segment tissue of Sabina chinesis ‘lanta’:Paraffin section technology[J].Chinese Agricultural Science Bulletin, 2019, 35(28):75-79.
[18] 丁媛媛, 毕金峰, 木泰华, 等.不同干燥方式对甘薯产品品质的影响[J].食品科学, 2011, 32(16):108-112.
DING Y Y, BI J F, MU T H, et al.Effect of different drying methods on quality of sweet potato products[J].Food Science, 2011, 32(16):108-112.
[19] 黄略略, 乔方, 叶晓梦, 等.不同干燥方式对铁棍山药品质的影响[J].食品与生物技术学报, 2014, 33(11):1 210-1 215.
HUANG L L, QIAO F, YE X M, et al.Effect of different drying method on quality of iron yam[J].Journal of Food Science and Biotechnology, 2014, 33(11):1 210-1 215.