樱桃番茄(Solanum lycopersicum var.cerasiforme)又称小西红柿、圣女果,不仅香甜多汁,酸甜适宜,还富含多种番茄红素、β-胡萝卜素、多酚等抗氧化物质,具有很高的营养价值,此外,樱桃番茄还具有促进生长发育、增强免疫力和延缓衰老等功效[1],深受消费者喜爱。但从各大生鲜电商平台的客户评价中发现,樱桃番茄容易出现软化现象,继而发生腐烂变质,消费者体验不好,是生鲜果蔬中差评率较高的品种之一,这种情况在夏季高温物流时尤为明显。因此,解决樱桃番茄高温物流软化问题对我国生鲜果蔬流通有较大的实际意义。
质地特性是评价果蔬贮藏品质的重要指标。在果蔬采后流通过程中果实硬度的改变与果蔬细胞壁物质降解紧密相关。成熟的高等植物细胞的细胞壁在形态学上被分为初生壁、胞间层和次生壁3个组成成分。植物细胞壁主要由纤维素、半纤维素和果胶组成,多糖占其组成高达90%以上,细胞壁多糖物质的降解则与相关细胞壁代谢酶活性,如果胶甲酯酶(pectinmethylesterase,PME)、多聚半乳糖醛酸酶(polygalacturonase,PG)、纤维素酶(cellulase,Cx)、半乳糖苷酶(β-glucosidase,β-Glu)等密切相关[2-3]。气调保鲜技术通过包装调节袋内气体环境和组分,进而抑制细胞壁代谢酶活性,调节细胞壁多糖的代谢降解,保持果实良好质地,有效延缓果实的软化进程。研究发现3% O2、7% CO2气调贮藏可以较好地保持黄瓜细胞壁结构的完整性,延缓黄瓜细胞壁原果胶的降解,抑制纤维素酶活性,并控制β-Glu活性的增强和可溶性果胶的产生,可降低细胞壁胞间层结构的改变对黄瓜硬度造成的影响[4]。
普通包装薄膜的透过率无法满足采后果蔬较高呼吸速率,容易造成膜内O2浓度低于1%进而导致果蔬的无氧呼吸。因此,开发高透过率的薄膜是解决果蔬采后呼吸问题的方法之一,而微孔膜是其中较为简单的方法。微孔膜气调包装基于气调包装的原理,通过调节微孔的大小和数量改变包装袋薄膜O2、CO2和水蒸气的渗透率,使之与包装内的果蔬呼吸速率相匹配,从而在包装内建立新的平衡气氛。微孔膜的成本与市场上的普通膜相差不大,来源广泛,具有广阔的应用前景。目前,微孔包装已在枇杷[5]、甜玉米[6]、苹果[7]等果蔬保鲜上取得良好效果。但关于微孔包装调控樱桃番茄采后高温物流过程中软化机理的研究较少,本试验以新鲜樱桃番茄为原料,分析不同孔径大小的微孔包装对樱桃番茄硬度、细胞壁代谢相关物质及酶活性的影响,探索微孔包装控制高温物流软化的机制,为樱桃番茄采后保鲜的流通环节提供一定的理论依据和实践指导。
1 材料与方法
1.1 材料
实验所用樱桃番茄品种为红圣女果,购于重庆市北碚区天生农贸市场,挑选批次相同、大小均匀、无机械损伤与病虫害的樱桃番茄。
本实验所用试剂均为分析纯。
1.2 仪器与设备
CheckMate3.0顶空分析仪,美国膜康公司;人工气候箱,宁波东南仪器有限公司;紫外可见分光光度计,上海仪电分析仪器有限公司;物性测定仪,英国Stable Micro System公司。
1.3 实验方法
1.3.1 样品准备
挑选大小均匀、无开裂的樱桃番茄,清水洗净,去蒂,晾干后随机分成4组,每组350 g左右装于PET保鲜盒中,用厚度30 μm的PP膜覆盖在PET盒表面然后密封。实验共设置4个不同分组:(1)8 mm组:在PP膜上打有间隔均匀,两排共8个孔径,且大小为8 mm的孔;(2)1 mm组:在PP膜上打有间隔均匀,两排共8个孔径,且大小为1 mm的孔;(3)0.3 mm组:在PP膜上打有间隔均匀,两排共8个孔径,且大小为0.3 mm的孔;(4)无孔组:不打孔作为对照。每组3个平行,将所有分组全部放入35 ℃、相对湿度70%的人工气候箱中贮藏6 d,每天取样检测指标。
1.3.2 顶空气体含量及相对湿度
利用顶空气体分析仪测定樱桃番茄包装盒内O2及CO2含量。
利用温湿度记录仪测定樱桃番茄包装盒内的相对湿度。在保证不触碰到实验样品的情况下,将探头插入PET盒的中间位置,使探头在每组盒中处于相同的位置,每6 h记录1次读数,将测量结果作为盒内湿度记录。
1.3.3 呼吸强度
参考程曦[8]的方法,稍加改动,随机挑选(400±50)g樱桃番茄,放入呼吸器室中,静置30 min,测量呼吸器室中初始CO2体积分数、最终CO2体积分数。通过排水法测定放置樱桃番茄的呼吸器室中剩余空间体积。根据公式计算樱桃番茄呼吸强度,结果以mg/(kg·h)表示。
1.3.4 PME活性
参考HAGERMAN等[9]的方法,稍加改动,称取5 g果肉,加入20 mL质量分数8.8%的NaCl溶液和0.5 g聚乙烯吡咯烷酮研磨。将匀浆在10 000×g下离心30 min,收集上清液,调节pH至7.5,测定活性。加入酶提取物后,用分光光度法测量620 nm处吸光度。结果以U/mL表示。
1.3.5 PG活性
参考曹建康等[10]的比色法,稍加改动,称取1.0 g样品,加入2 mL经预冷的体积分数(下同)95%乙醇研磨,低温放置10 min,4 ℃ 12 000×g离心20 min,将上清液倒出。加入1 mL经预冷的80%乙醇,振荡,低温静置,离心后倾去上清液。向沉淀物中加入5 mL已预冷的提取缓冲液,低温静置20 min,离心,得到的上清液即为酶提取液。在540 nm处测吸光度,结果以μg/(h·g)表示。
1.3.6 果胶含量
参考曹建康等[10]的咔唑比色法,称取约0.5 g果实样品并研磨成匀浆,在沸水浴中用95%乙醇提取15 min,期间及时补充乙醇,重复提取4~5次后,弃掉上清液。剩余沉淀物加入蒸馏水,于50 ℃水浴锅保温30 min,12 000 r/min离心10 min,取上清液,定容到100 mL,得到可溶性果胶。剩余沉淀加0.5 mol/L H2SO4溶液于沸水浴加热1 h,取上清液同样定容至100 mL,即为原果胶。取1 mL提取液,测定2种果胶含量,重复3次。果胶含量为可溶性果胶和原果胶含量之和,以%表示。
1.3.7 Cx活性
参考曹建康等[10]的比色法,其中酶提取液制备方法同PG,在540 nm处测吸光度。结果以μg/(h·g)表示。
1.3.8 β-Glu活性
参考曹建康等[10]的方法,稍加改动,称取1.0 g果蔬样品,置于经预冷的研钵中,加入2 mL预冷的95%乙醇,在冰浴条件下研磨匀浆,低温放置10 min,于4 ℃、12 000×g离心20 min。倾去上清液,向沉淀物中再加人1 mL经预冷的80%乙醇,振荡,低温放置10 min,然后在相同条件下离心。倾去上清液,向沉淀物中再加入5 mL经预冷的提取缓冲液,于4 ℃放置提取20 min,再经过离心后收集上清液即为酶提取液。在540 nm处测吸光度,结果以μg/(h·g)表示。
1.3.9 纤维素含量
参考BU等[11]的方法,取1.5 g樱桃番茄,加入3.0 mL乙酸/硝酸盐试剂研磨,在100 ℃的沸水浴中加热30 min,4 508×g下离心20 min,冷却后弃去上清液。用蒸馏水洗涤2次后将残渣溶解在10 mL 67%硫酸中,充分混合并用蒸馏水稀释至100 mL。将1 mL溶液移入玻璃试管中,加入4 mL去离子水和10 mL冷蒽酮试剂,于沸水浴中加热10 min。然后冰浴5 min,在620 nm处测吸光度,结果以%表示。
1.3.10 硬度
使用物性测定仪进行测定,每组选取10个果,在赤道处进行测定并取平均。为模拟人手拿捏樱桃番茄时的触感,选用P/36R探头,结果以g表示,设置参数如下:TPA模式、测前速度3 mm/s、测中及测后速度1 mm/s、受压深度3 mm、触发力20 g
1.3.11 感官评价
参考叶小平[12]的方法,略有改动。感官评定标准见表1。分别对每项指标进行打分,并利用加权法得出总分。外观、色泽、气味和口感加权系数分别为0.3、0.2、0.2、0.3,根据总分评定樱桃番茄的品质。感官评价小组由10名食品学院同学组成,结果取平均,本实验中以7分及以上为具有商品性。
表1 樱桃番茄感官评价表
Table 1 Cherry tomato sensory evaluation form

评分感官指标外观色泽气味口感9果实饱满硬度好鲜艳有光泽香气明显酸甜适宜,味道可口7果实较饱满,硬度较好颜色较鲜艳稍有果香甜味稍淡,口感略酸5外观完好但稍有软化无光泽无果香口感偏酸3果实出现皱缩,质地较软颜色较暗淡有轻微异味酸甜皆较淡1果实软烂颜色很暗淡异味明显没有味道或有异味
1.4 数据处理与统计分析
使用Microsoft Excel 2010对各指标进行数据计算;用IBM SPSS Statistics 22对指标进行显著性分析,P<0.05表示有显著差异,P<0.01表示有极显著差异,P>0.05表示差异不显著;最后用Origin 2018制图。
2 结果与分析
2.1 微孔包装对樱桃番茄顶空气体含量、相对湿度及呼吸强度的影响
2.1.1 微孔包装对樱桃番茄顶空气体含量及相对湿度的影响
由图1可知,8 mm组包装内CO2和O2浓度在贮藏过程中变化不大,几乎与大气浓度一致,这是8 mm孔径较大导致。1 mm与0.3 mm组在贮藏过程中O2和CO2含量变化趋势较为相近,在经历第1天O2浓度下降,CO2浓度上升后,1 mm与0.3 mm组气体组成保持相对稳定直到贮藏后期。而无孔组在第1天O2浓度大幅下降直至第6天降低为0,其CO2浓度在贮藏过程中不断上升,后期尤甚,贮藏第6天达到21.7%。开孔可以起到维持盒内气体含量恒定的作用,这是包装内外气体透过率与果实呼吸达到动态平衡所致,且孔径越小O2含量越低,CO2含量越高,说明气体浓度与孔径大小密切相关。在整个贮藏期,各组O2含量由高到低均依次为8 mm组、1 mm组、0.3 mm组和无孔组,在第6天无孔组O2含量已降为0%,同时CO2含量由高到低则依次为无孔组、0.3 mm组、1 mm组和8 mm组,与O2含量相反,这是因为无孔组透气性差,盒内消耗的O2得不到补充,而CO2又过多的积累,无孔组CO2含量与其它各组均呈极显著性差异(P<0.01)。微孔包装能加强盒内外气体交换,维持恒定的气体含量,且可通过调节孔径大小来达到所需的O2及CO2含量。一般认为,微孔包装对于控制包装内外的气体交换符合Fick扩散定律[13],但由于受包装材质及果实呼吸的影响,其渗透过程通常较难预测。对顶空气体含量的分析可以发现目前市面上采用的8 mm大孔包装是起不到调节气氛作用的。如图2所示,各组相对湿度从第1天即基本保持恒定,8 mm组、1 mm组、0.3 mm组和无孔组分别为92%、97%、98%、100%,孔径越小相对湿度越大。

a-O2;b-CO2
图1 不同孔径对顶空气体含量的影响
Fig.1 Effect of different pore sizes on headspace gas content
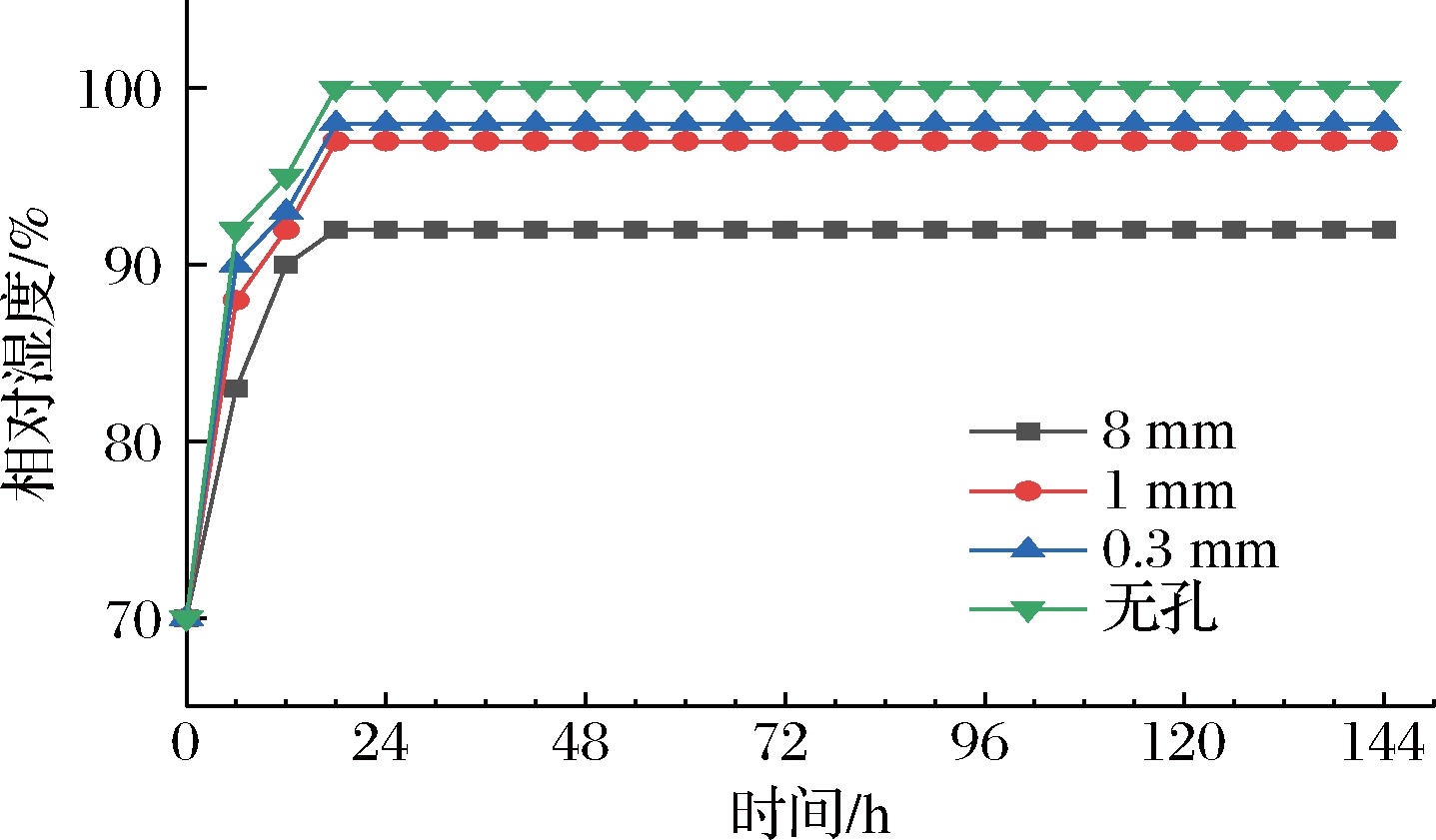
图2 不同孔径对相对湿度的影响
Fig.2 Effect of different pore sizes on relative humidity
2.1.2 微孔包装对樱桃番茄呼吸强度的影响
果实采后依然进行着呼吸作用,樱桃番茄采后会出现呼吸高峰,是典型的呼吸跃变型果实,高峰过后品质会快速下降,所以对樱桃番茄的保鲜处理要能起到抑制呼吸高峰来临及降低高峰值的效果。图3展示了不同孔径微孔包装对呼吸强度的影响,各组呼吸强度均随时间延长呈先上升后下降的趋势,其中无孔组和8 mm组在第2天出现了呼吸高峰,其高峰值分别为4 889和4 161.7 mg/(kg·h),而1 mm组和0.3 mm组则在第3天才出现呼吸高峰,且其高峰值更低,分别为1 616.7和2 838.3 mg/(kg·h)。至贮藏第6天,呼吸强度由高到低依次为无孔组、8 mm组、1 mm组和0.3 mm组,且各组间均彼此呈极显著性差异(P<0.01)。
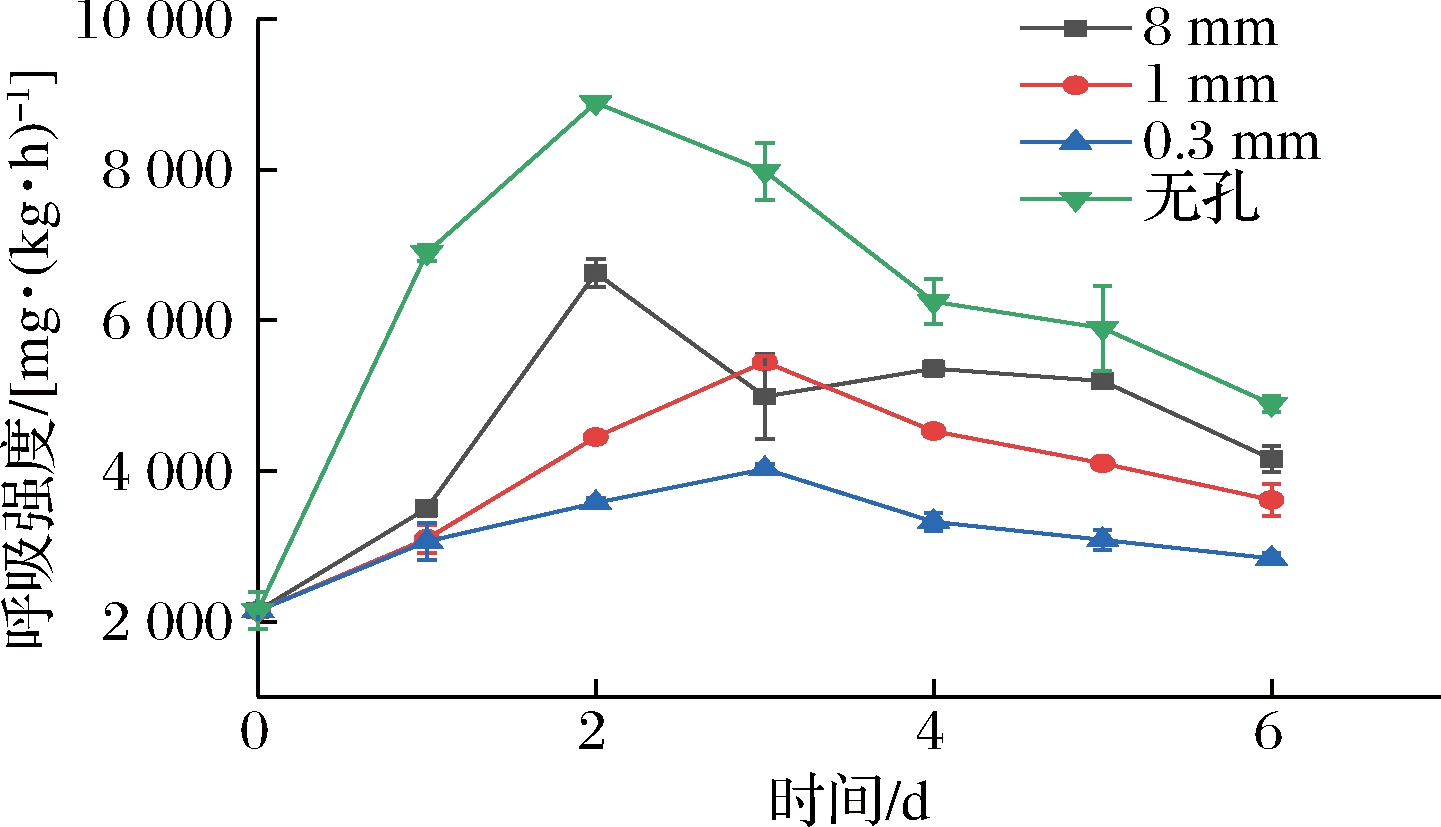
图3 不同孔径对呼吸强度的影响
Fig.3 Effect of different pore sizes on respiration intensity
上述结果表明,微孔包装能加强盒内外气体交换,维持恒定的气体含量,且可通过调节孔径大小来达到所需的O2及CO2含量。而果实呼吸需要一定的气体条件,适当降低O2、提高CO2含量有助于减弱果实采后的生理代谢活动,延缓衰老,但过低的O2又会使其产生无氧呼吸,易造成果实内乙醇等物质的积累,产生毒害,造成腐烂,因此最理想的情况是使果实进行较微弱的有氧呼吸而又不产生无氧呼吸。微孔包装能通过控制盒内O2与CO2浓度达到一定平衡来延缓樱桃番茄呼吸高峰的出现,并降低高峰值,其中0.3 mm组效果更好。
2.2 微孔包装对樱桃番茄PME、PG及果胶含量的影响
2.2.1 微孔包装对樱桃番茄PME活性的影响
果胶是D-半乳糖醛酸以α-1,4-糖苷键连接而成的长链物质,其中部分半乳糖醛酸的羧基发生甲酯化,PME可催化胞间层果胶物质的去甲酯化,与果实软化相关[14]。如图4所示,总体来看,各组PME活性均随时间延长呈先上升后下降的趋势。第1天,各组间PME活性彼此差异不显著(P>0.05),且均在第3天出现活性高峰,其中无孔组和8 mm组活性高峰值无显著性差异(P>0.05),1 mm组和0.3 mm组之间差异也不显著(P>0.05),但两微孔组与无孔、8 mm组间活性高峰值呈显著性差异(P<0.05),说明微孔包装对降低PME活性高峰值有显著的效果。在第4天,各组PME活性均快速下降,并在贮藏第6天各组间彼此差异均不明显(P>0.05)。从整个贮藏期来说,无孔组PME活性较高,8 mm组在贮藏前期PME活性也较高,但在贮藏末期各组活性均较低,说明微孔能起到降低PME活性高峰值的作用,但随着贮藏时间延长,微孔包装对PME活性的抑制作用也逐渐减弱。
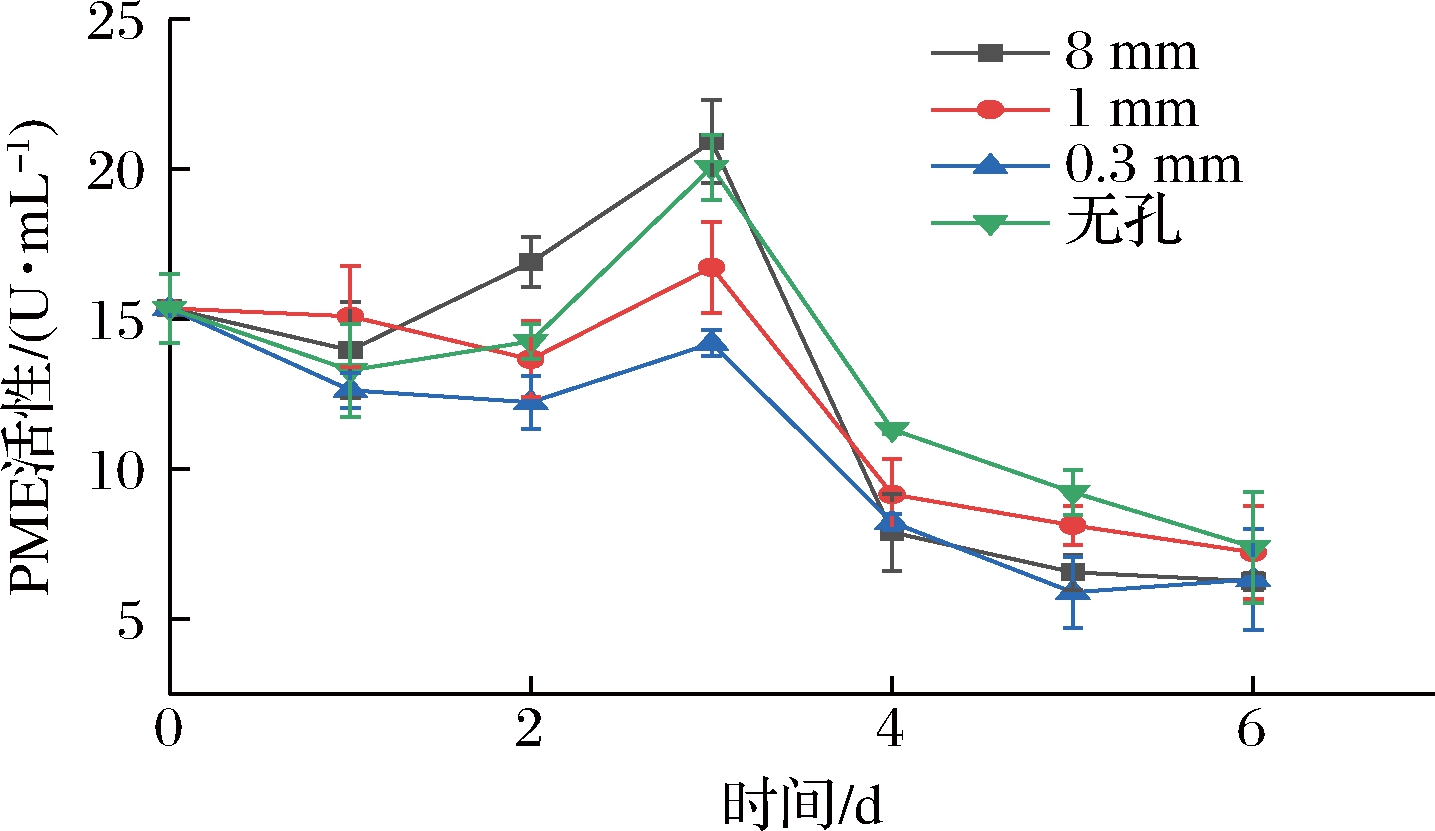
图4 不同孔径对PME活性的影响
Fig.4 Effect of different pore sizes on PME activity
2.2.2 微孔包装对樱桃番茄PG活性的影响
PG是参与果胶水解的一种重要水解和疏松酶,它可以催化果胶分子中α-1,4-聚半乳糖醛酸的裂解,导致果胶水解、细胞壁结构被破坏进而使得果实硬度下降。研究认为PG参与的前提条件是PME先发挥作用,将果胶物质去甲酯化后再由PG参与水解[15]。由图5所示,各组PG活性均随贮藏时间的延长呈上升趋势,在整个贮藏期,0.3 mm组PG活性上升速度最慢,始终与无孔、8 mm组呈极显著性差异(P<0.01)。0.3 mm组PG活性在贮藏前期与1 mm组呈显著性差异(P<0.05)。在贮藏第2~3天,8 mm组与1 mm组间活性差异不明显(P>0.05),但从第4天开始,8 mm组PG活性快速上升,并逐渐与1 mm组呈极显著性差异(P<0.01)。在贮藏第6天,1 mm、0.3 mm组PG活性较8 mm组分别低32.3%、48.1%。果实的软化与PG酶活性呈显著的相关性,PG活性增大导致果实软化。采用小孔径的微孔包装代替目前的大孔包装能起到降低PG活性、延缓软化的作用,其中0.3 mm组效果最佳。
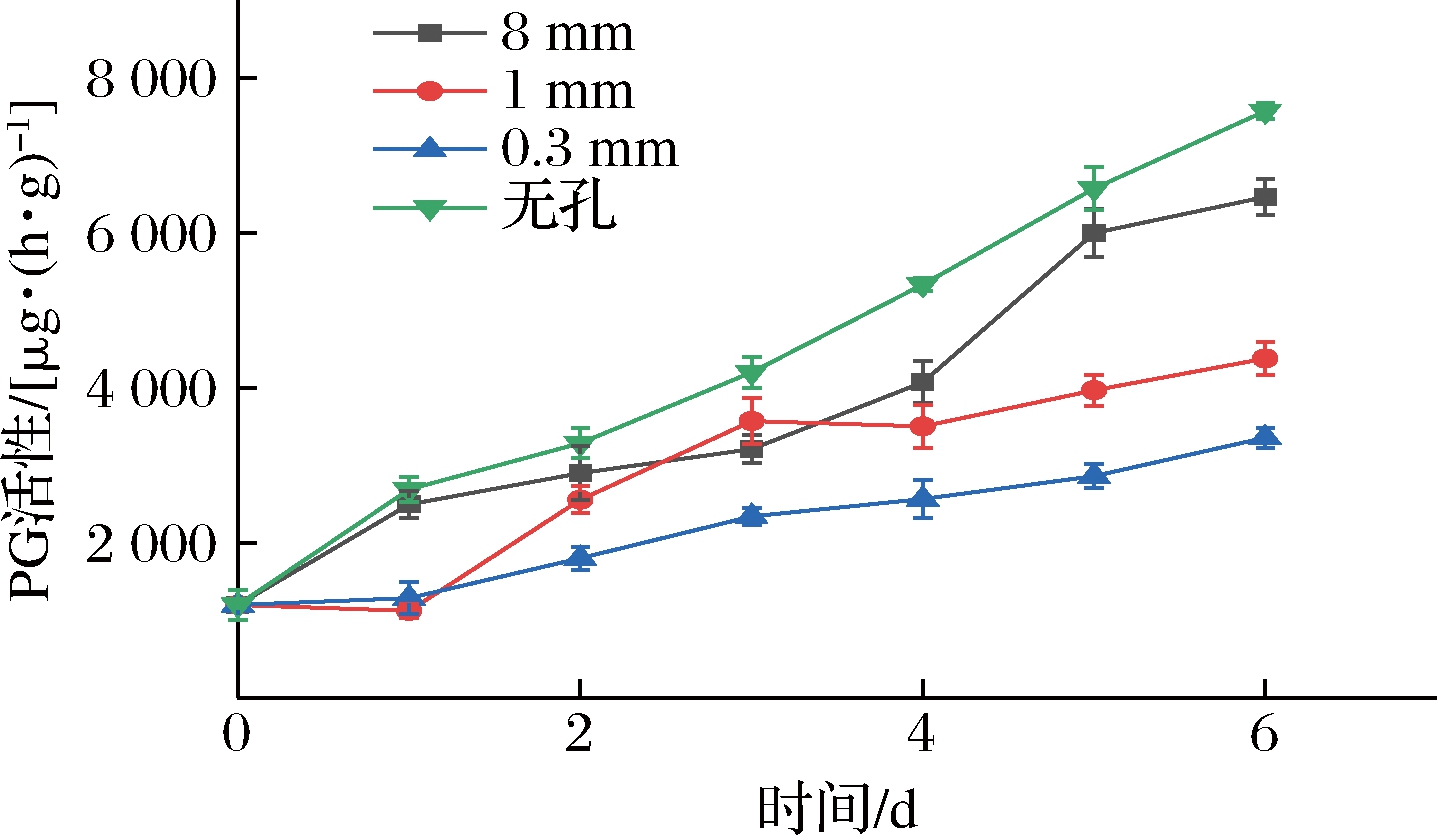
图5 不同孔径对PG活性的影响
Fig.5 Effect of different pore sizes on PG activity
2.2.3 微孔包装对樱桃番茄原果胶含量的影响
果胶是植物细胞胞间层与初生壁的主要组成成分,果实软化过程中一个最主要的变化即为果胶的溶解。伴随着果胶溶解,胞间层逐渐消失,细胞壁变薄,导致细胞壁结构被破坏,造成软化。未成熟的果实中果胶质多以原果胶状态存在。如图6所示,各组原果胶含量均随贮藏时间延长呈下降趋势,因为在贮藏过程中,樱桃番茄继续成熟,其原果胶在果胶酶的作用下被水解为可溶性果胶,细胞壁支撑作用逐渐丧失,果实出现软化的现象。整体来看,无孔组原果胶含量下降最快,且在贮藏中后期与其他3组呈极显著性差异(P<0.01),8 mm组在贮藏前4天与1 mm、0.3 mm两组差异不明显(P>0.05),第4天后8 mm组原果胶含量下降速度加快,并与1 mm、0.3 mm 两组呈显著性差异(P<0.05),微孔包装能显著维持原果胶含量,且孔径越小效果越好。但1 mm组和0.3 mm组之间直至第6天才显示出差异(P<0.05)。综上所述,相比于目前常采用的8 mm大孔包装,1 mm孔径和0.3 mm孔径的微孔包装均能在贮藏中后期起到抑制樱桃番茄原果胶含量下降的效果,而不开孔则会明显加快原果胶的分解速度。
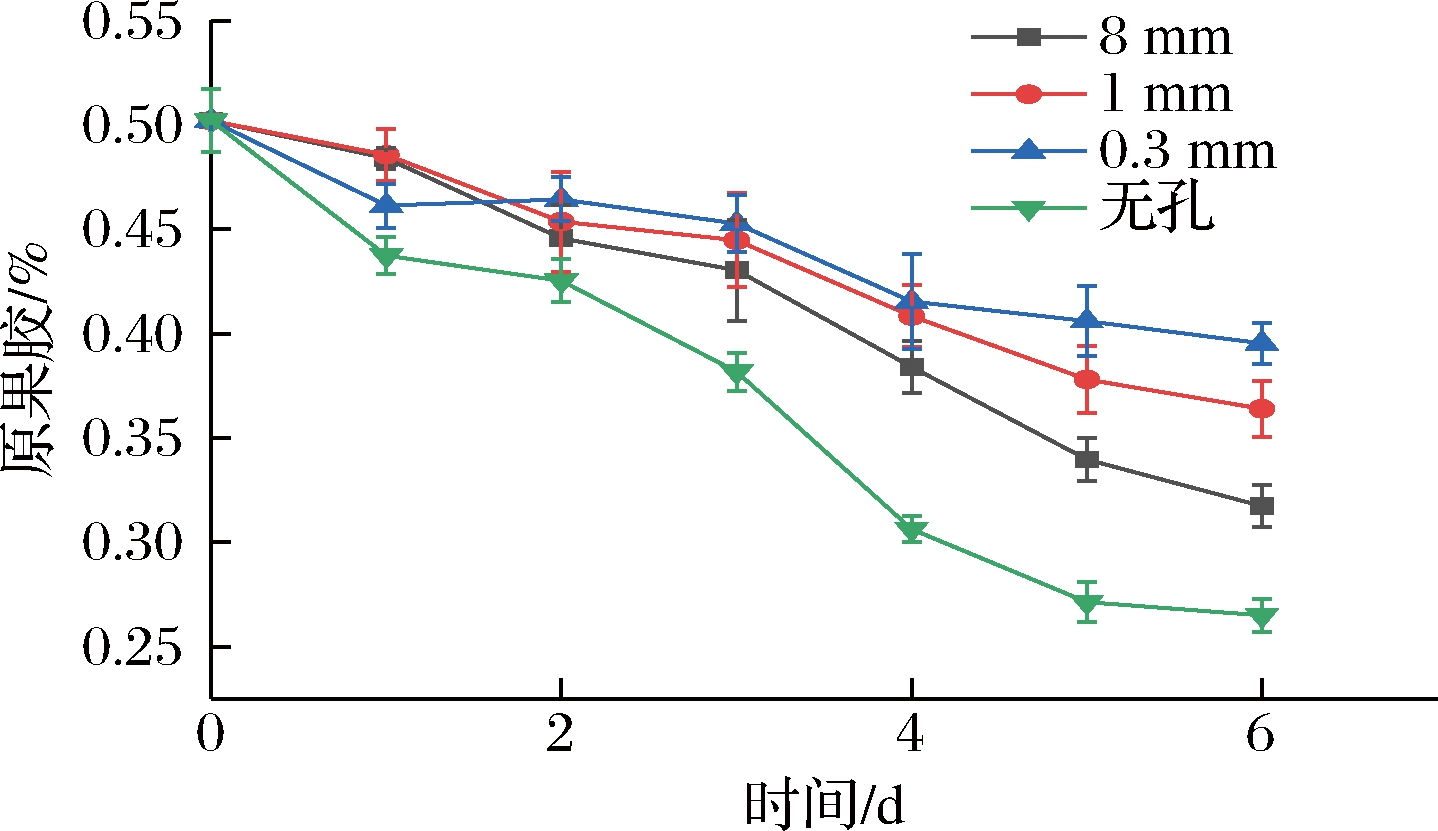
图6 不同孔径对原果胶含量的影响
Fig.6 Effect of different pore sizes on raw pectin content
2.2.4 微孔包装对樱桃番茄可溶性果胶含量的影响
随着果实的成熟,果胶物质逐渐与纤维素分离,并形成易溶于水的果胶,此时果实组织也逐渐变得松弛软化,导致果实硬度下降。如图7所示,各组可溶性果胶含量在整个贮藏期均随时间延长呈上升趋势。在前2天,各组间可溶性果胶含量彼此差异不大(P>0.05)。第3天后,无孔组、8 mm组和1 mm组可溶性果胶含量上升速度加快,且无孔、8 mm组始终与0.3 mm组保持极显著性差异(P<0.01)。从第3~6天,可溶性果胶含量从多到少依次为无孔组,8 mm组,1 mm组和0.3 mm组,且两微孔组均与8 mm、无孔两组呈极显著性差异(P<0.01)。可见微孔包装能抑制可溶性果胶含量的上升,且孔径越小效果越好。可溶性果胶含量与果实硬度呈显著负相关,KRAMER等[16]的研究结果表明,随着番茄的不断成熟,可溶性果胶含量也不断上升,而不软化的番茄突变体其果胶含量则始终不发生变化。由于微孔包装有效地减缓了樱桃番茄可溶性果胶含量的上升,因此其对维持硬度、抑制软化有明显的效果。
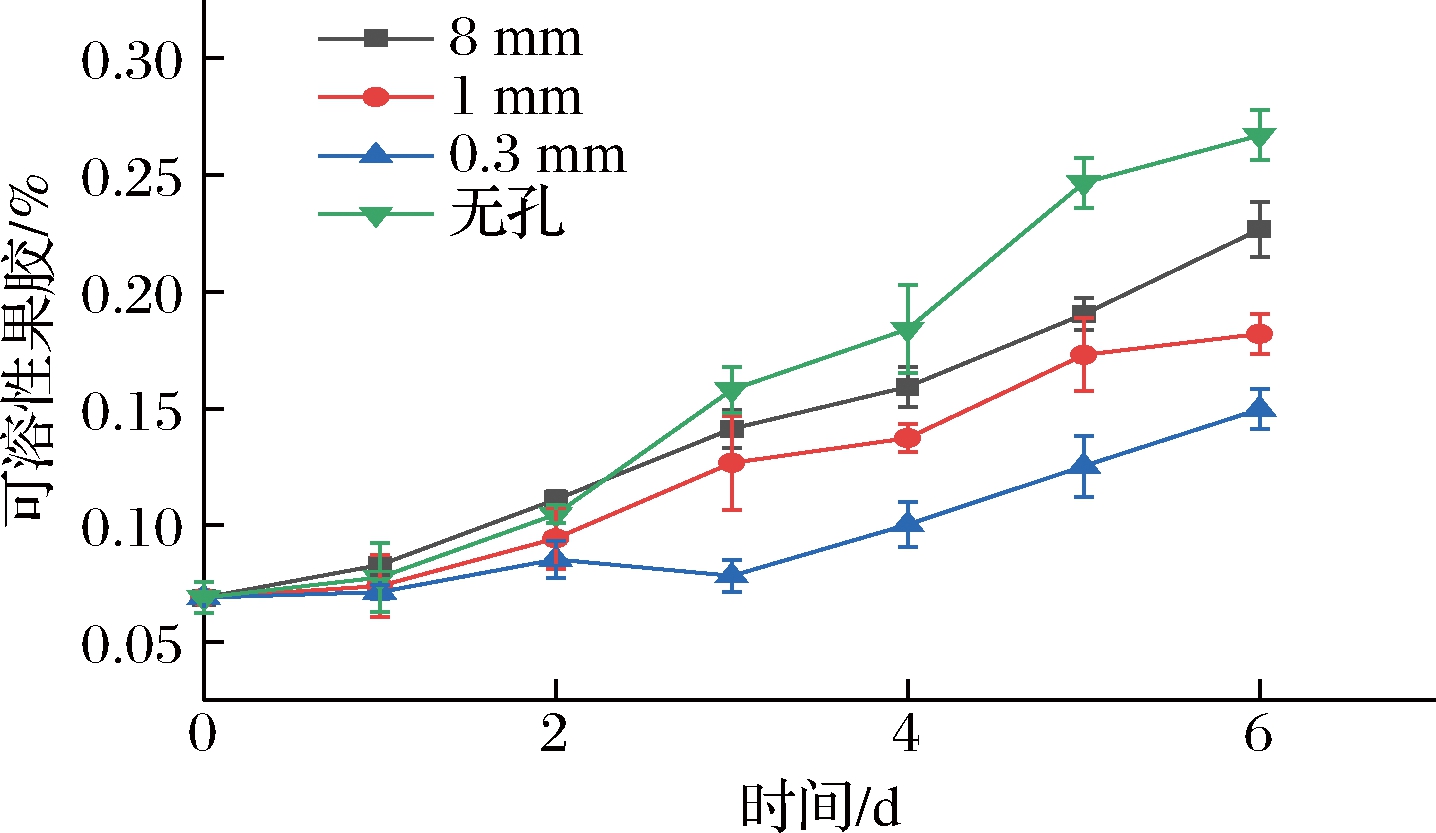
图7 不同孔径对可溶性果胶含量的影响
Fig.7 Effect of different pore sizes on soluble pectin content
PME和PG是分解果胶物质的关键酶,PME使果胶去甲酯化,PG则进一步将果胶分解为小分子物质。随着樱桃番茄贮藏时间的延长,原果胶在PME和PG的作用下逐渐转化为可溶性果胶,原果胶含量逐渐下降,可溶性果胶含量增加,造成细胞间结构松弛,引起果实软化。本研究表明,微孔包装可以有效抑制樱桃番茄采后PME、PG活性的上升,进而减缓樱桃番茄原果胶的降解,延缓可溶性果胶含量增加,有效维持樱桃番茄采后正常果胶质分布状态。
2.3 微孔包装对樱桃番茄Cx、β-Glu及纤维素含量的影响
2.3.1 微孔包装对樱桃番茄Cx活性的影响
Cx能使细胞壁结构中微纤丝、半纤维素和果胶之间的连接松散,进而造成果实软化。如图8所示,各组Cx活性均随时间延长呈上升趋势。在第1~2天,1 mm组与8 mm组Cx活性差异不显著(P>0.05),从第3天开始,8 mm组Cx活性快速上升,并与1 mm、0.3 mm两组形成极显著性差异(P<0.01),与无孔组呈显著性差异(P<0.05)。至第4天,8 mm组与无孔组形成极显著性差异(P<0.01)。在贮藏第6天,各组Cx活性由高到低依次为无孔组、8 mm组、1 mm组和0.3 mm组,且各组间彼此呈极显著性差异(P<0.01)。在整个贮藏期,0.3 mm组Cx活性数值上升速度最慢,并在贮藏第6天分别比无孔组、8 mm组和1 mm组低63.3%、54.8%、33%。8 mm组大孔包装在贮藏前期对Cx活性影响的效果与微孔包装组差异不大,但在贮藏后期抑制Cx活性效果不明显。总体而言,微孔包装能起到抑制Cx活性的作用,且孔径越小其抑制效果越明显。
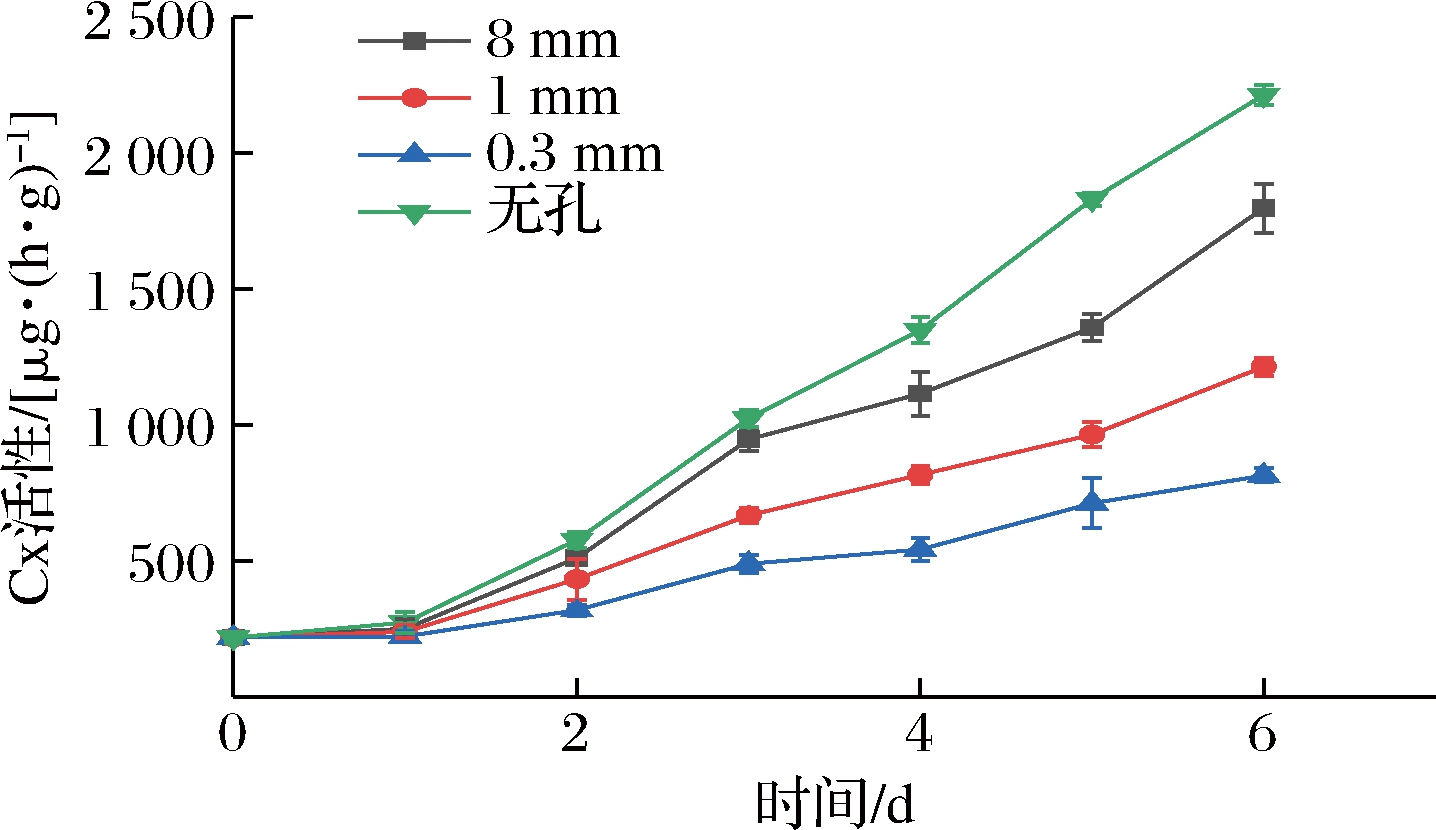
图8 不同孔径对Cx活性的影响
Fig.8 Effect of different pore sizes on Cx activity
2.3.2 微孔包装对樱桃番茄β-Glu活性的影响
β-Glu是纤维素酶的重要组分,与细胞壁松弛有关[17]。如图9所示,在整个贮藏期内各组β-Glu活性逐渐上升。在贮藏前2天,各组间β-Glu活性彼此差异不显著(P>0.05),从第3天开始,无孔组β-Glu活性上升速度逐渐加快,与其余3组形成显著性差异(P<0.05),在贮藏第6天与其余3组呈极显著性差异(P<0.01)。8 mm组β-Glu活性在贮藏前5天始终与2个微孔组差异不显著(P>0.05),但在第6天,8 mm组与1 mm、0.3 mm两组形成极显著性差异(P<0.01)。1 mm组与0.3 mm组在贮藏第1~5天差异不显著(P>0.05),在第6天呈显著性差异(P<0.05)。说明微孔可以起到抑制β-Glu活性的效果,相比于8 mm大孔包装,在贮藏前中期微孔包装的效果不是很明显,但在贮藏末期效果较为显著。
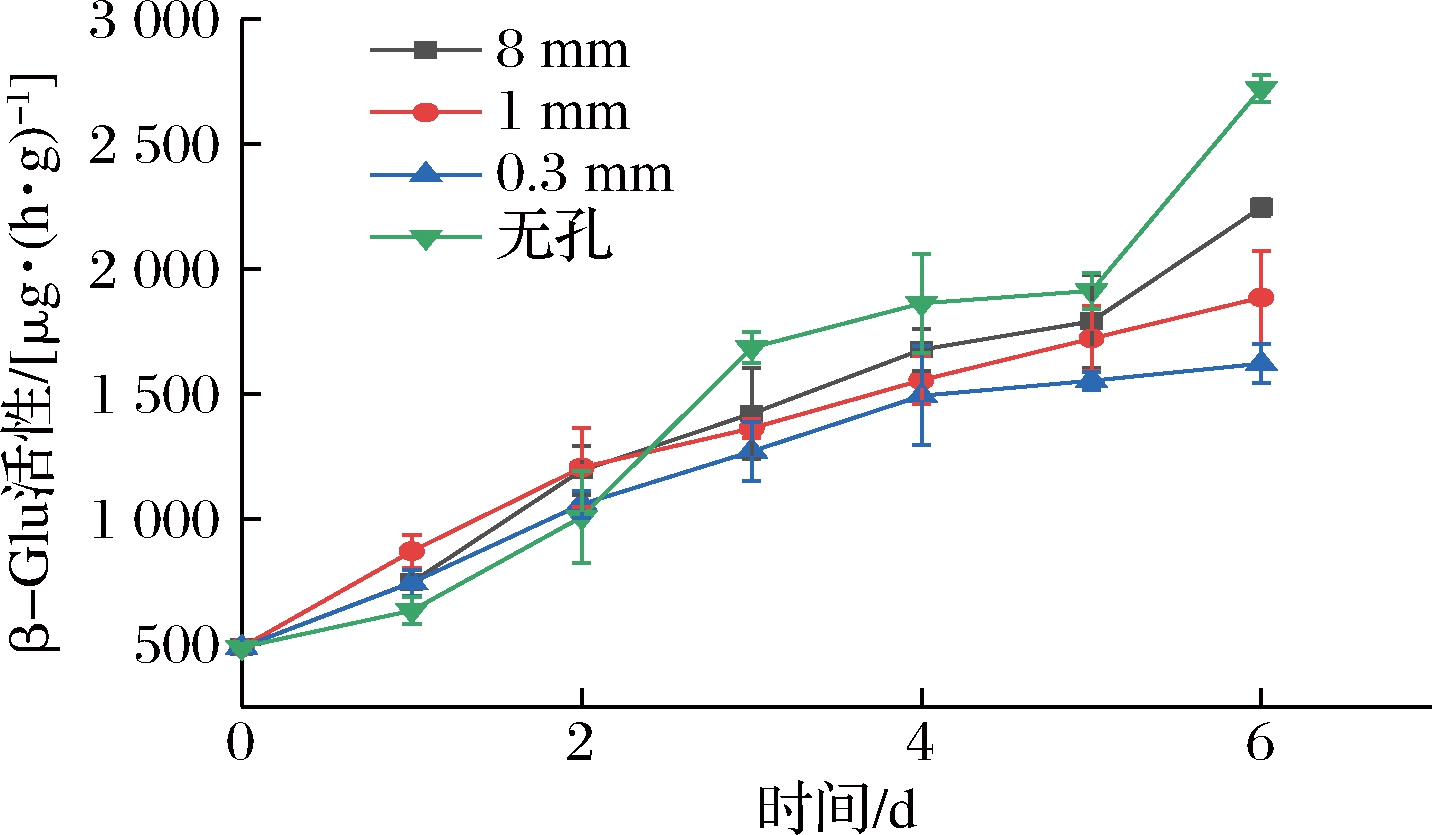
图9 不同孔径对β-Glu活性的影响
Fig.9 Effect of different pore sizes on β-Glu activity
2.3.3 微孔包装对樱桃番茄纤维素含量的影响
作为初生壁和次生壁的主要成分之一,纤维素是以β-1,4-糖苷键连接而成的D-葡萄糖长链,以微纤丝的形式存在,形成稳定的细胞壁骨架网络结构,起到维持果实硬度的作用[18]。如图10所示,在整个贮藏期内,4组处理组纤维素含量不断下降,无孔组纤维素含量降低最快,但整体来看基本与8 mm组差异不大(P>0.05)。但1 mm组和0.3 mm组纤维素含量下降相对而言更慢,这2组在贮藏中后期与无孔、8 mm两组均呈显著性差异(P<0.05),但两微孔组间差异始终不大(P>0.05)。在贮藏第6天,无孔组、8 mm组、1 mm组和0.3 mm组相较于第0天时的纤维素含量分别下降了55.5%、48.6%、36.1%、32.6%,两微孔组均与无孔、8 mm两组形成了极显著性差异(P<0.01),说明相比于无孔和大孔,微孔包装能显著维持纤维素含量。
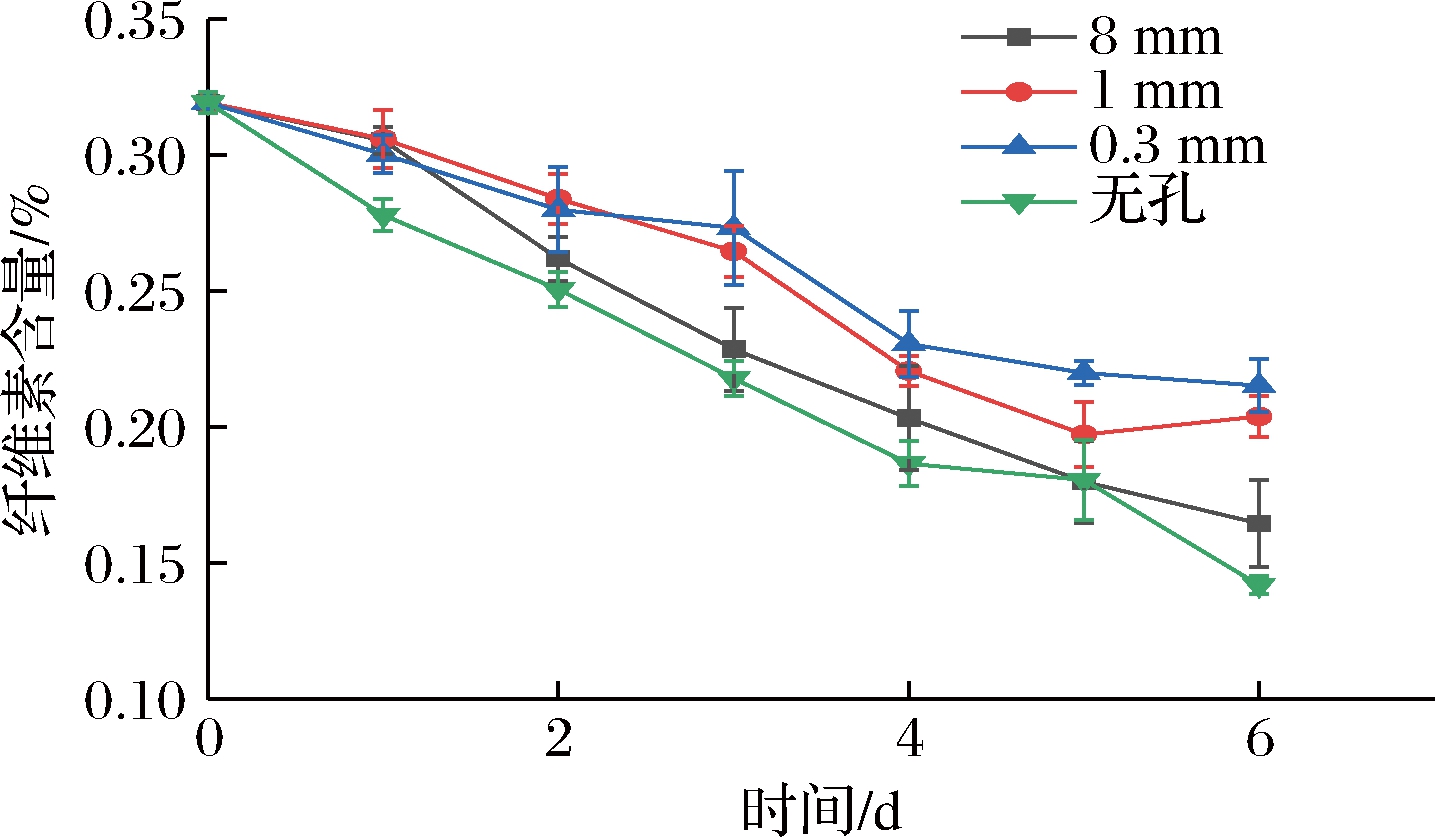
图10 不同孔径对纤维素含量的影响
Fig.10 Effect of different pore sizes on cellulose content
纤维素在Cx和β-Glu的作用下最终水解为单糖,破坏了细胞壁的组成成分和结构,造成果实软化。樱桃番茄采后Cx和β-Glu活性均随时间延长逐渐上升,与此同时纤维素含量下降,而微孔包装处理可以有效抑制Cx和β-Glu活性上升,延缓樱桃番茄纤维素含量下降,减缓细胞壁完整结构受损。
2.4 微孔包装对樱桃番茄硬度和感官评价的影响
2.4.1 微孔包装对樱桃番茄硬度的影响
如图11所示,各组樱桃番茄在贮藏期间其硬度均随时间延长呈下降趋势。在贮藏前2天,8 mm组、1 mm组和0.3 mm组硬度彼此差异不大(P>0.05),但这3组均与无孔组呈显著性差异(P<0.05)。从第3天开始,1 mm、0.3 mm组与其余2组的差距逐渐拉大,但此2组间差异依然不大(P>0.05)。直至第5天,1 mm组和0.3 mm组间呈极显著性差异(P<0.01)。在贮藏第6天,无孔组、8 mm组、1 mm组和0.3 mm组的硬度相比于第0天时分别下降了74.7%、58.5%、40.6%、26.9%,微孔组显著维持了硬度,且孔径越小效果越好。这与以下几方面原因有关:(1)软化是后熟的表现之一,微孔维持了盒内较低的O2含量,减弱了呼吸,进而抑制了后熟,硬度下降较慢;(2)8 mm组由于孔径较大,盒内水分散失较多、相对湿度较低,易造成果实失水、细胞膨压下降,导致软化;(3)无孔组由于包装本身气密性较高,盒内O2含量低,使樱桃番茄进入了无氧呼吸,产生过多的乙醇、乙酸等有害物质,腐烂现象严重,果实内部出现软烂的现象,硬度降低[19];(4)适宜的气体环境改变了细胞壁水解酶的活性,阻碍了细胞壁水解,是1 mm组和0.3 mm组硬度维持较好的重要因素。
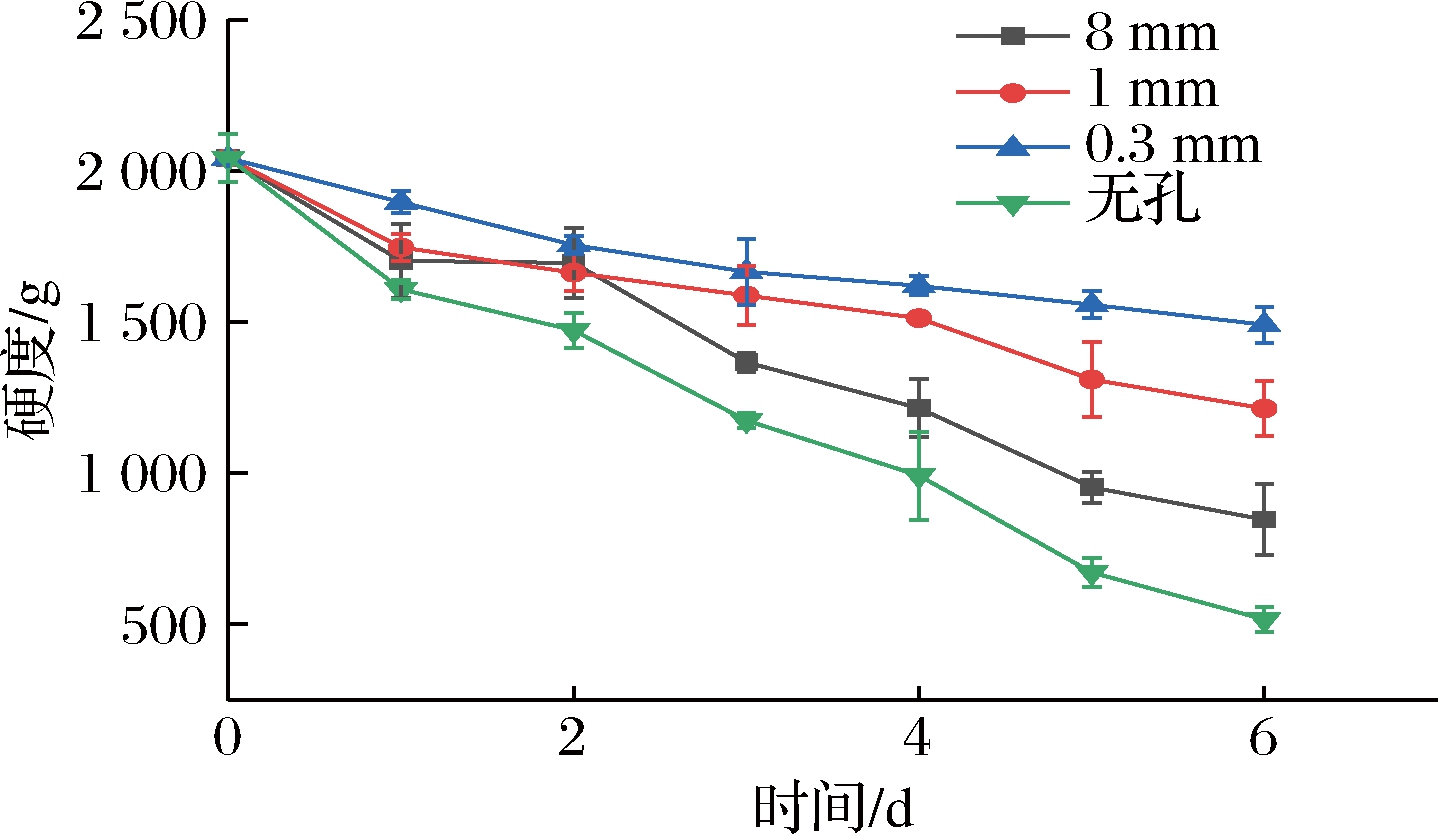
图11 不同孔径对硬度的影响
Fig.11 Effect of different pore sizes on firmness
2.4.2 微孔包装对樱桃番茄感官评价的影响
通过对樱桃番茄的外观、色泽、气味和口感对其感官进行评定。如图12所示,随着贮藏时间的延长,各组感官评价分数逐渐降低,其中无孔组评分下降最快,在贮藏第3天时已下降至6分,商品性较差。1 mm组和0.3 mm组感官评价始终较高,在贮藏前4天,2组间差异不大(P>0.05),但从第5天开始,0.3 mm组感官评价下降速度变快,并在第6天显著低于1 mm组(P<0.05),这可能是因为0.3 mm微孔组盒内CO2相对于1 mm微孔组含量较高,CO2对细胞壁多糖降解与相关酶的活性有一定影响[20],从而维持了0.3 mm组樱桃番茄较好的硬度,但在贮藏后期CO2含量相对偏高导致樱桃番茄口感风味发生变化,品质劣变感官评分下降较快,与张丙云等[21]的研究结果相近,而1 mm组则维持了较好的风味口感,故而感官评价高于0.3 mm组。在贮藏第6天,无孔组、8 mm组、1 mm组和0.3 mm组感官评分依次为1分、3.8分、7.2分和6.2分,因此综合樱桃番茄的风味感官来看,1 mm组在延缓果实软化基础上,感官效果最好,目前所采用的8 mm大孔包装则无法满足夏季高温物流6 d的要求。
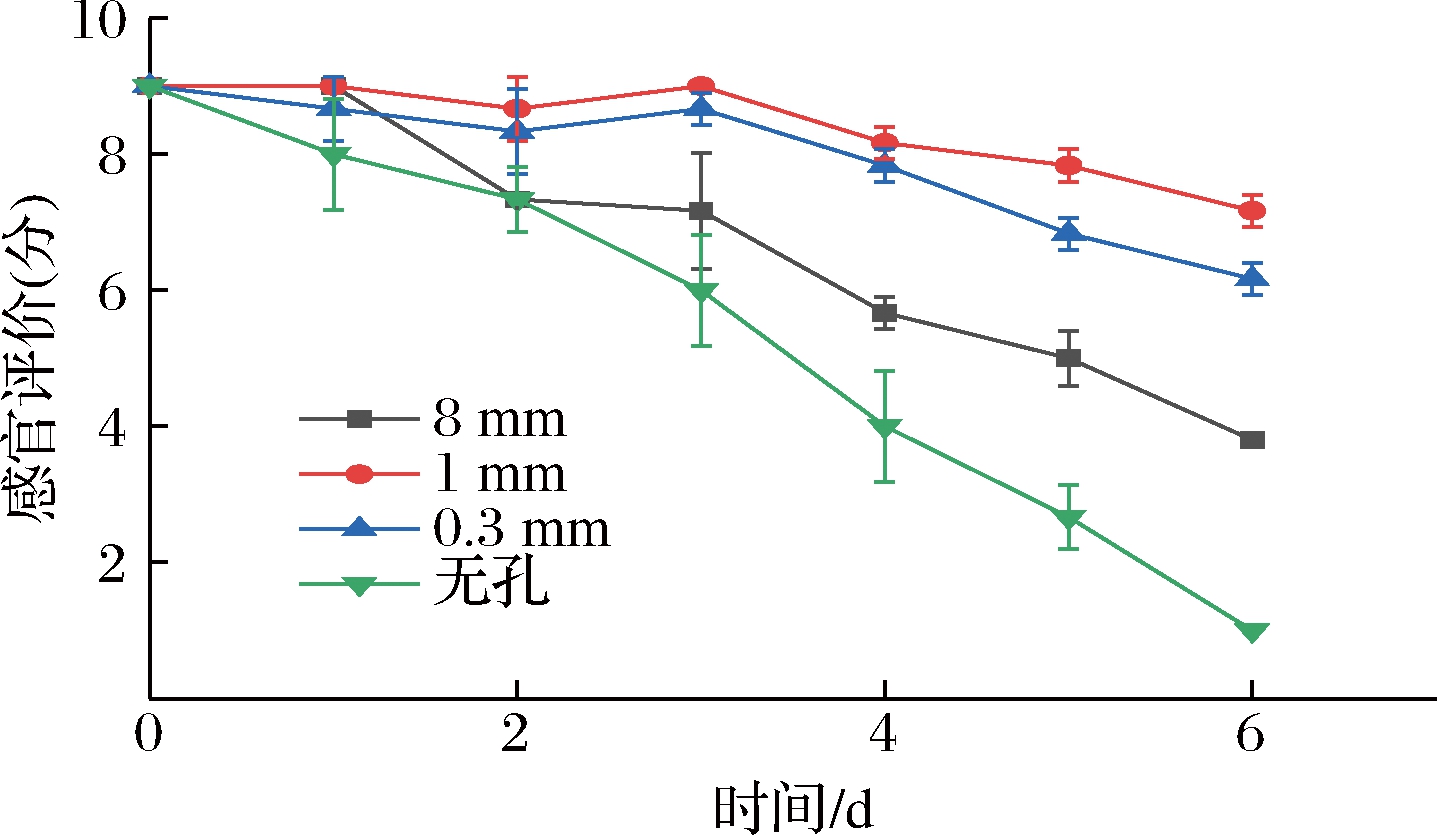
图12 不同孔径对感官评价的影响
Fig.12 Effect of different pore sizes on sensory properties
本研究显示微孔包装能有效抑制樱桃番茄采后硬度的下降,维持其感官品质。微孔处理能使樱桃番茄包装环境气体比例达到动态平衡,适宜的O2和CO2含量抑制了樱桃番茄采后呼吸强度,延缓呼吸高峰的出现,有效地降低樱桃番茄的生理代谢活动,进而抑制了PME、PG、Cx和β-Glu活性,减缓果胶和纤维素等细胞壁多糖的降解进程,较好的维持了细胞壁结构,抑制樱桃番茄软化。
3 结论
微孔包装是一种安全卫生、成本低廉的气调保鲜方法,它通过薄膜上开设的微孔自发调节包装袋内O2和CO2比例,抑制果蔬呼吸代谢,减少营养物质的消耗,推迟果蔬呼吸高峰的出现,进而抑制果蔬硬度的下降达到延缓软化的效果。对猕猴桃[22]、百合[23]和无花果[24]的研究表明,微孔包装能有效抑制果蔬硬度的下降。本研究显示微孔处理能使包装内气体达到一个动态平衡,更适合樱桃番茄在高温条件下的呼吸速率,适宜的气体比例能有效抑制樱桃番茄细胞壁水解酶活性,减缓细胞壁多糖的降解进程,从而避免细胞壁完整结构遭到严重破坏,一定程度上延缓果实硬度的下降。其中,以0.3 mm组延缓软化的效果最好,它能有效维持樱桃番茄果实硬度,在贮藏后期依然维持樱桃番茄较低的细胞壁降解酶活性,并与非微孔处理组呈显著性差异(P<0.05)。
研究表明,果实软化的主要原因是细胞壁相关降解酶催化果胶和纤维素等细胞壁组分降解,破坏细胞壁成分间的相互连接,细胞间产生空隙,最终导致细胞壁解体,果实软化[2]。本研究结果显示,樱桃番茄贮运初期果实硬度较高,细胞壁中果胶物质主要是不溶性的原果胶形态,但在贮藏中后期,果实中原果胶和纤维素含量不断下降,可溶性果胶逐渐上升,果实硬度随之降低。本研究表明微孔包装处理可以延缓樱桃番茄在高温物流条件下细胞壁原果胶、纤维素的降解,维持正常的果胶质分布状态,从而抑制果实硬度的下降。
PME、PG、Cx和β-Glu等细胞壁水解酶活性极大地影响了果实细胞壁多糖的降解。这些水解酶受到基因表达的影响,在它们的协同作用下调控果实细胞壁多糖成分的降解,对细胞壁完整结构造成损伤,在果实采后后熟的不同阶段发挥作用影响果实软化。实验结果表明,贮藏期间樱桃番茄PME活性先上升后下降,果实原果胶含量随之快速下降,PG、Cx和β-Glu活性随时间延长逐渐上升,与此同时纤维素含量下降,可溶性果胶不断增加,说明相关细胞壁水解酶活性的改变对樱桃番茄原果胶、纤维素物质的降解起到促进作用,加速了果实硬度的下降。研究结果表明,相较于8 mm的大孔处理组和无孔组,1 mm和0.3 mm微孔处理组樱桃番茄果实在实验过程中PME、PG、Cx和β-Glu活性始终处于低水平,其中0.3 mm组相关酶活性最低,这可能是因为微孔处理使包装内自发形成一个适合樱桃番茄贮藏的气体环境,达到动态平衡,有效抑制了果实PME、PG、Cx和β-Glu的活性,减缓细胞壁原果胶、纤维素的降解,避免了果实细胞壁受到严重破坏,从而延缓果实软化,维持果实硬度。因此,微孔包装可有效抑制樱桃番茄高温物流条件下的果实软化,延长其采后贮运保鲜期。
本研究结果显示微孔包装通过调节包装内气体达到平衡抑制樱桃番茄的呼吸强度和细胞壁降解酶活性,维持其硬度延长保质期,其中0.3 mm微孔组抑制软化最好,但0.3 mm组的感官评价略低于1 mm微孔组,所以后续研究还需要解决如何在保证硬度的同时,将风味口感维持的更好,将综合保鲜效果达到最佳。
[1] RAFFO A, LEONARDI C, FOGLIANO V, et al.Nutritional value of cherry tomatoes (Lycopersicon esculentum Cv.Naomi F1) harvested at different ripening stages[J].Journal of Agricultural and Food Chemistry, 2002, 50(22):6 550-6 556.
[2] WANG D, YEATS T H, ULUISIK S, et al.Fruit softening:Revisiting the role of pectin[J].Trends in Plant Science, 2018, 23(4):302-310.
[3] BARKA E A, KALANTARI S, MAKHLOUF J, et al.Impact of UV-C irradiation on the cell wall-degrading enzymes during ripening of tomato (Lycopersicon esculentum L.) fruit[J].Journal of Agricultural and Food Chemistry, 2000, 48(3):667-671.
[4] 魏亚博, 郑鄢燕, 赵晓燕, 等.气调箱贮藏对鲜切黄瓜品质的影响及对假单胞菌的抑制作用[J].食品与发酵工业, 2020, 46(4):180-186.
WEI Y B, ZHENG Y Y, ZHAO X Y, et al.Effect of controlled atmosphere storage on the quality of fresh-cut cucumber and inhibition on Pseudomonas plecoglossicida[J].Food and Fermentation Industries, 2020, 46(4):180-186.
[5] 马佳佳, 隋思瑶, 孙灵湘, 等.微孔自发气调包装对冠玉枇杷的保鲜效果[J].现代食品科技, 2020, 36(11):137-146;187.
MA J J, SUI S Y, SUN L X, et al.The preservation effects of microporous spontaneous controlled atmosphere packaging on Guanyu loquat[J].Modern Food Science and Technology, 2020, 36(11):137-146;187.
[6] 李家政, 李晓旭, 王晓芸.甜玉米微孔自发气调包装应用研究[J].包装工程, 2015, 36(3):31-35;64.
LI J Z, LI X X, WANG X Y.Application of micro-perforated modified atmosphere packaging of sweet corn[J].Packaging Engineering, 2015, 36(3):31-35;64.
[7] 张四普, 牛佳佳, 韩立新, 等.1-MCP结合微孔、打孔保鲜袋对‘富士’苹果贮藏品质的影响[J].食品工业科技, 2020, 41(9):278-284;290.
ZHANG S P, NIU J J, HAN L X, et al.Effect of 1-MCP combined with different fresh-keeping bags on quality of ‘Fuji’Apple during storage[J].Science and Technology of Food Industry, 2020, 41(9):278-284;290.
[8] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学, 2017.
CHENG X.Study on the preservation mechanism and optimization of insulating package in course of normal temperature-logistics of lettuce tip[D].Chongqing:Southwest University, 2017.
[9] HAGERMAN A E, AUSTIN P J.Continuous spectrophotometric assay for plant pectin methyl esterase[J].Journal of Agricultural and Food Chemistry, 1986, 34(3):440-444.
[10] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[Z].果蔬采后生理生化实验指导, 2007.
CAO J K, JIANG W B, ZHAO Y M.Experimental guidance for postharvest physiology and Biochemistry of fruits and vegetables [Z].Experimental Guidance for Postharvest Physiology and Biochemistry of Fruits and Vegetables, 2007.
[11] BU J W, YU Y C, AISIKAER G, et al.Postharvest UV-C irradiation inhibits the production of ethylene and the activity of cell wall-degrading enzymes during softening of tomato (Lycopersicon esculentum L.) fruit[J].Postharvest Biology and Technology, 2013, 86:337-345.
[12] 叶小平. 包装材料及方式对采后樱桃番茄品质的影响[D].扬州:扬州大学, 2017.
YE X P.Effects of packaging materials and methods on postharvest cherry tomato quality[D].Yangzhou:Yangzhou University, 2017.
[13] CASTELLANOS D A, CERISUELO J P, HERNANDEZ-MU OZ P, et al.Modelling the evolution of O2 and CO2 concentrations in MAP of a fresh product:Application to tomato[J].Journal of Food Engineering, 2016, 168:84-95.
OZ P, et al.Modelling the evolution of O2 and CO2 concentrations in MAP of a fresh product:Application to tomato[J].Journal of Food Engineering, 2016, 168:84-95.
[14] REN Y Y, SUN P P, WANG X X, et al.Degradation of cell wall polysaccharides and change of related enzyme activities with fruit softening in Annona squamosa during storage[J].Postharvest Biology and Technology, 2020, 166:111203.
[15] CHEA S, YU D J, PARK J, et al.Fruit softening correlates with enzymatic and compositional changes in fruit cell wall during ripening in‘Bluecrop’highbush blueberries[J].Scientia Horticulturae, 2019, 245:163-170.
[16] KRAMER M, SHEEHY R E, HIATT W R.Progress towards the genetic engineering of tomato fruit softening[J].Trends in Biotechnology, 1989, 7(7):191-194.
[17] LIN Y F, LIN Y Z, LIN Y X, et al.A novel chitosan alleviates pulp breakdown of harvested longan fruit by suppressing disassembly of cell wall polysaccharides[J].Carbohydrate Polymers, 2019, 217:126-134.
[18] 韩郸. 茉莉酸甲酯对采后蓝莓果实软化的调控作用[D].沈阳:沈阳农业大学, 2020.
HAN D.Effect of methyl jasmonate on softening of blueberry fruits after harvest[D].Shenyang:Shenyang Agricultural University, 2020.
[19] 王羽, 梁敏, 齐小晶, 等.包装材料对樱桃番茄气调保鲜效果的影响[J].包装工程, 2016, 37(19):91-96.
WANG Y, LIANG M, QI X J, et al.Effects of packaging materials on modified atmosphere preservation of cherry tomato[J].Packaging Engineering, 2016, 37(19):91-96.
[20] 钱敏, 白卫东, 于新, 等.CO2对果蔬采后生理的作用[J].食品工业科技, 2009, 30(10):350-355.
QIAN M, BAI W D, YU X, et al.Effects of CO2 on post-harvest physiology in fruits and vegetables[J].Science and Technology of Food Industry, 2009, 30(10):350-355.
[21] 张丙云, 秦跃龙, 田世龙, 等.不同浓度CO2对贮藏期间马铃薯生理品质的影响[J].食品工业科技, 2014, 35(17):325-328.
ZHANG B Y, QIN Y L, TIAN S L, et al.Effects of different CO2 concentrations on physiological quality changes of potato during storage[J].Science and Technology of Food Industry, 2014, 35(17):325-328.
[22] 俞静芬, 尚海涛, 凌建刚, 等.1-MCP结合微孔保鲜膜对猕猴桃出库货架期品质影响研究[J].农产品加工, 2018(4):4-5;8.
YU J F, SHANG H T, LING J G, et al.1-MCP combined with microporous preservative film influence on kiwifruit storage shelf quality[J].Farm Products Processing, 2018(4):4-5;8.
[23] 康丹丹.微环境气调结合相温对兰州百合采后品质的调控效应[D].沈阳:沈阳农业大学, 2020.
KANG D D.Effects of micro-environmental modified atmosphere combined with phase temperature on postharvest quality of Lanzhou lily[D].Shenyang:Shenyang Agricultural University, 2020.
[24] VILLALOBOS M, SERRADILLA M J, MART N A, et al.Preservation of different fig cultivars (Ficus carica L.) under modified atmosphere packaging during cold storage[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2 103-2 115.
N A, et al.Preservation of different fig cultivars (Ficus carica L.) under modified atmosphere packaging during cold storage[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2 103-2 115.