志贺氏菌(Shigella)又称痢疾杆菌,可以侵袭结肠上皮细胞,并可能通过穿透和破坏结肠上皮而导致严重的炎症反应,从而引发细菌性痢疾[1-2]。志贺氏菌根据其抗原结构和生化反应的不同可划分为痢疾志贺菌(Shigella dysenteriae)、福氏志贺菌(Shigella flexneri)、鲍氏志贺菌(Shigella boydii)和宋内氏志贺菌(Shigella sonnei),福氏志贺菌表现出较强的耐酸、耐盐能力,并且可以在水和许多种类的食物中生存和生长。由志贺氏菌引起的食源性疾病暴发通常是由于摄入了受污染的水和即食食物而导致的[3-4],其临床症状包括腹痛腹泻、寒战高热以及反复惊厥等,严重时可危及生命[5]。在过去的几十年里,志贺氏菌病的发生在不发达国家和发达国家都很流行[6]。
目前最常用于检测志贺氏菌的方法是传统培养法,利用传统方法往往具有培养时间较长、费时费力、需要5~7 d才能出结果等缺点,因此迫切需要一种简单、低成本、高选择性、灵敏且准确的福氏志贺菌检测方法。除此之外,目前也有研究者建立了PCR法[7]﹑滚环扩增法[8]﹑环介导等温扩增技术[9]﹑核酸等温扩增方法[10]﹑免疫法和生物传感器法[11-12]。尽管以上方法都能够对目标菌进行精准检测,然而,有些方法却仍需要较长时间(超过10 h)来进行细菌培养和DNA提取。此外,在检测的过程中还会受到食品基质的影响,从而降低检测效果。化学发光(chemiluminescence, CL)以其灵敏度高、线性范围宽、分析速度快、操作简单、对环境无污染而广泛应用于食品安全[13]、药理学[14]和病毒[15]等领域。磁分离技术主要用到的材料是磁性纳米粒子(magnetic nanoparticles, MNPs),该粒子是含有磁性金属或具有独特超顺磁特性的金属氧化物的纳米粒子[16],可与酶、抗体、DNA等多种功能分子结合。利用磁性纳米粒子的超顺磁性可以实现目标物质的快速分离、富集和纯化,从而有效地缩短富集时间,消除样品基质对检测灵敏度的影响,大大提高检测效率。磁分离技术因其特异性好和效率高等特点而被应用于生命科学、食品安全、化工及环境卫生等[17~22]领域。
本研究以福氏志贺菌为靶标,将福氏志贺菌适配体和磁性纳米材料连接起来构建捕获探针,同时设计福氏志贺菌适配体互补序列,并将其与发光试剂鲁米诺连接起来构建信号探针,当福氏志贺菌和信号探针同时存在时,它们会与体系中的捕获探针进行竞争性结合,在磁场作用下,上清液中的信号探针越少,发光强度越低。上清液中的稳态化学发光信号的发光强度与福氏志贺菌浓度存在正相关。因此通过检测上清液中的化学发光信号就可以实现对福氏志贺菌的定量检测。该方法可以从复杂的食品基质中快速捕获靶标,无需对其进行前富集处理,可以快速高效地对牛奶和猪肉中的福氏志贺菌进行检测。
1 材料与方法
1.1 材料与试剂
AuCl4,国药集团化学试剂有限公司;壳聚糖,美国SIGMA公司;乙酸钴、硅酸四乙酯,上海麦克林生化有限公司;三羟甲基氨基甲烷、亲和素,北京索莱宝科技有限公司;三(2-羧乙基)膦盐酸盐(tris(2-carboxyethyl)phosphine hydrochloride,TCEP)、鲁米诺,梯希爱(上海)化成工业发展有限公司;戊二醛,山西益鑫泰生物科技有限公司。
福氏志贺菌适配体序列(FSZ-1):5′-Biotin-CCTCATGTCGAACAGCAACACTGCAACACTGTATAGTCC-TGTGTGCCTTGAGCGTTTCTGAGCT-3′[23],福氏志贺菌适配体互补序列(FSZ-2HH):5′-HS-(CH2)6-AAACGCTCAAGGCACAC-3′。
1.2 仪器与设备
MP-EII电致化学发光检测仪,西安瑞迈分析仪器有限公司;DF-101集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;XFH-75CA电热式压力蒸汽灭菌器,浙江新丰医疗器械有限公司;HR/T16MM微量高速冷冻离心机,湖南赫西仪器装备有限公司;BluStarB紫外可见分光光度计,北京莱伯泰科仪器股份有限公司;SPC150TEM透射电镜,深圳市速普仪器有限公司。
1.3 鲁米诺功能化花状纳米金的制备
鲁米诺功能化花状纳米金(Luminol-AuNFs)是通过鲁米诺和壳聚糖共同还原氯金酸制得。具体操作步骤如下:先称取0.2 g壳聚糖溶于50 mL体积分数为2%的冰乙酸溶液中,然后取1 mL 0.1 mol/L鲁米诺储备液到上述溶液中,加水至95 mL,加热至沸腾,同时剧烈搅拌,快速加入5 mL质量浓度2 g/L的氯金酸储备液,在沸腾状态下保持30 min。最后将制得的产物冷却至室温,避光保存于4 ℃条件下,备用。
1.4 氨基化磁性纳米Fe3O4的制备
按文献[24]的方法合成氨基化磁性纳米Fe3O4,具体操作步骤如下:首先称取100 mg的纳米Fe3O4,将其溶解于一定溶液[V(无水乙醇)∶V(水)=3∶1]中,加入6 mL氨水,于室温下超声5 min;然后加入2 mL正硅酸乙酯,置于摇床中孵育(200 r/min,6 h);最后结合磁分离,同时用无水乙醇洗涤2次,即可得到硅烷化磁性纳米Fe3O4;配制体积分数95%~97%的乙醇溶液,取160 mL,然后用冰乙酸调节pH至4.5~5.5;向上述溶液中添加8 mL硅烷偶联剂,振荡5 min后加入制备的硅烷化磁性纳米Fe3O4进行反应(200 r/min,2 h);最后结合磁分离,同时用无水乙醇洗涤2次,将其置于烘箱中(110 ℃,30 min),取出后放入干燥皿中备用。
1.5 信号探针的构建
信号探针是通过Luminol-AuNFs连接FSZ-2HH后得到的复合物。根据LI等[25]的方法,首先取5 mL Luminol-AuNFs离心,将沉淀的纳米粒子分散于0.5 mL Tris-HCL缓冲液(30 mmol/L,pH 7.4)中得到Luminol-AuNFs胶体溶液。其次,将福氏志贺菌适配体的互补序列(150 μL,2.5 μmol/L)和TCEP(75 μL,2.5 μmol/L)在摇床中孵育30 min,然后加入到Luminol-AuNFs胶体溶液中,并置于摇床中振荡孵育6 h,用0.01 mol/L PBS缓冲液清洗多次,离心收集所得纳米材料,最后将制得的信号探针分散于PBS缓冲液中。
1.6 捕获探针的构建
称取10 mg氨基化磁性纳米Fe3O4,用移液枪取5 mL PBS(pH 7.4),超声5 min,加入1.25 μL质量浓度250 g/L戊二醛溶液,避光,孵育2 h(37 ℃,130 r/min)。磁分离,加入5 mL PBS,超声5 min,弃上清液,如此重复操作2次,加入2.25 mL PBS,超声5 min,加入750 μL 0.5 mg/mL亲和素,超声,避光孵育12 h(37 ℃,130 r/min),磁分离(取上清液测紫外),加5 mL PBS,清洗磁珠2次,加10 mL PBS,超声5 min,制成亲和素标记的Fe3O4。弃上清液100 μL,加入100 μL 10 μmol/L适配体,然后孵育6 h(37 ℃,130 r/min),磁分离(取上清液测紫外),清洗3次,制得经适配体修饰的磁性纳米材料,即捕获探针。
1.7 发光体系的构建
将0.2 mL Luminol-AuNFs与0.5 mL发光缓冲溶液B混合,然后通过静脉注射测定化学发光。向缓冲溶液A中加入0.1 mol/L的NaOH溶液、30 mmoL/L的Co2+和0.2 mol/L的H2O2溶液制得发光缓冲溶液B,缓冲溶液A是0.1 mol/L,pH 9.0的碳酸盐缓冲液。
1.8 福氏志贺菌的检测
首先,取0.2 mL捕获探针和0.2 mL信号探针在37 ℃条件下孵育1 h,利用磁分离技术去除上清液,然后取一系列不同浓度福氏志贺菌0.2 mL于上述沉淀中继续在37 ℃条件下孵育1 h。磁分离后取0.2 mL上清液于检测池中,通过静脉注射加入0.5 mL发光缓冲溶液B,记录发光信号值。
1.9 选择性实验
通过干扰实验对本研究方法的选择性进行测定,干扰细菌包括大肠杆菌、沙门氏菌、金黄色葡萄球菌、单核增生李斯特菌、枯草芽孢杆菌。依照上述对福氏志贺菌的检测方法对选取的其他致病菌进行等浓度检测,浓度均为500 CFU/mL,同时记录体系化学发光强度的变化(ΔCL=CL-CL0,其中,CL表示体系化学发光强度的变化,CL表示当体系中存在福氏志贺菌以及其他致病菌时的化学发光强度,CL0表示当体系中不存在任何致病菌时的化学发光强度)。
1.10 实际样品检测
为了验证该方法在食品中应用的可行性,本实验选取牛奶和生鲜猪肉进行加标实验。牛奶和生鲜猪肉样本购自当地超市,配制一定浓度的福氏志贺菌菌液(5.7×102CFU/mL),分别吸取1~25 mL无菌奶样品和25 g猪肉样品,混合均匀后,利用以上建立的方法进行检测,同时利用传统培养方法对以上结果进行验证,计算回收率。
2 结果与分析
2.1 鲁米诺功能化花状纳米金的表征
利用透射电镜表征合成的鲁米诺纳米金复合材料,从图1-a可以看出,合成材料均匀分布,粒径大小均一,从图1-b可以看出单一纳米材料呈现花状结构,平均粒径约为50 nm。花状结构可以有效地增大纳米材料表面积,其形成机制如下:鲁米诺和壳聚糖作为氯金酸的共还原剂,与单一还原剂相比,具有更强的还原性,在制备初期,氯金酸被还原成大量的纳米点,进而形成花状的金纳米颗粒。壳聚糖的用量决定了Luminol-AuNFs颗粒的粒径,壳聚糖用量越少,合成的物质粒径越大,反之同理。

a-×5 000;b-×100 000
图1 鲁米诺功能化花状纳米金在不同放大倍数下的透射电镜图
Fig.1 Transmission electron microscopy of Luminol functionalized flower-like gold nanoparticles at different magnification
2.2 磁性纳米Fe3O4及氨基化磁性纳米Fe3O4的表征
图2是磁性纳米粒子的X-射线衍射(X-ray diffraction, XRD)表征图。在20°~70°呈现不同强度的晶体衍射峰,结果表明,产物具有良好的结晶度,即产物的结构为尖晶石结构。图2-a特征峰与Fe3O4标准卡(JCPDS 65-3107)表示的衍射峰完全一致,6个特征峰分别为2θ=30.1°、35.5°、43.1°、53.4°、57.0°、62.6°,晶面指数分别为220、311、400、422、511、440。从图中可以看出,b特征峰与a特征峰大致相同,只有衍射峰的宽度不太相同,这可能与粒径不同相关。因此,纳米粒子在小范围内具有细观有序结构,在氨基化之后也不能改变Fe3O4的晶型。
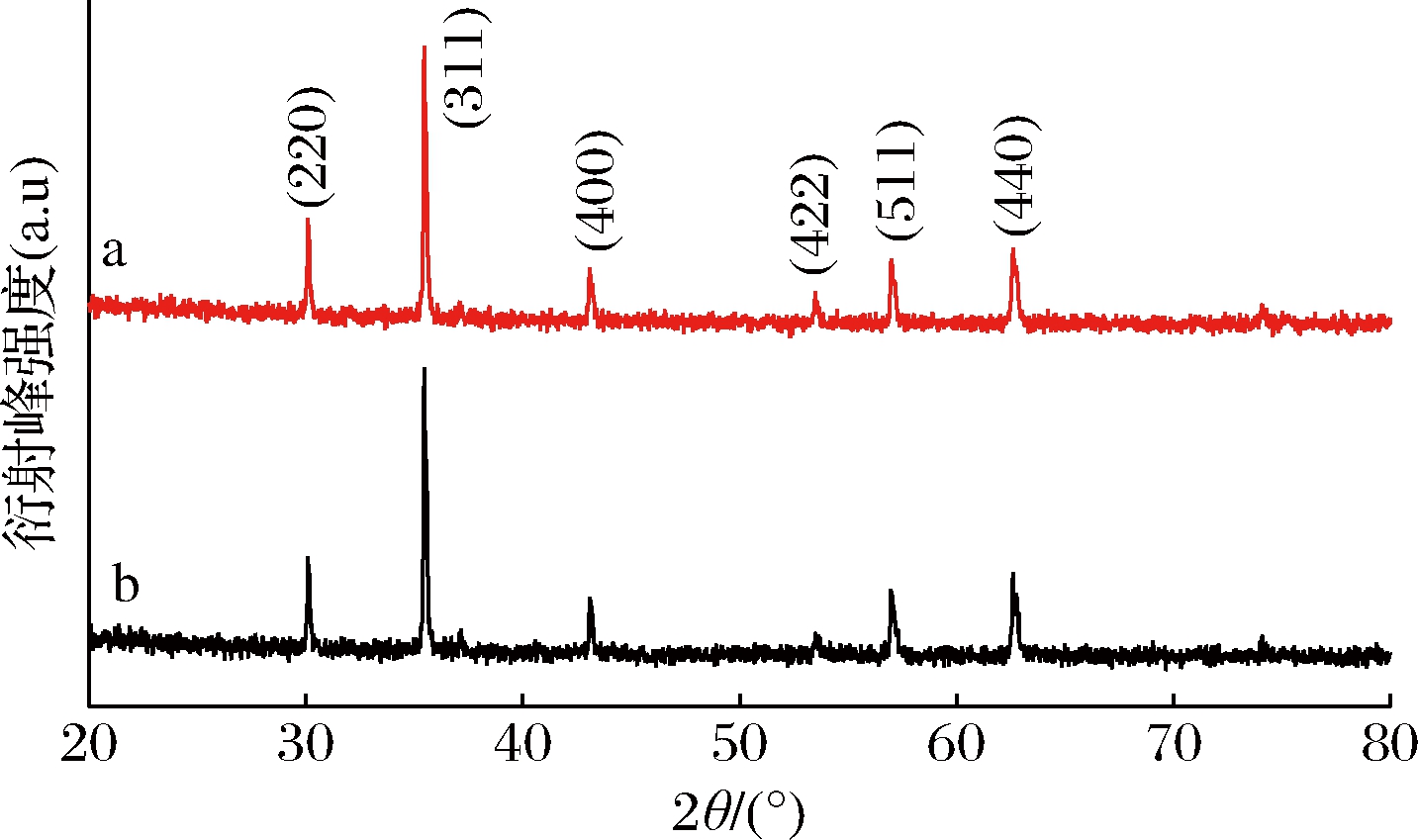
a-纳米Fe3O4;b-氨基化纳米Fe3O4
图2 磁性纳米Fe3O4的X-射线衍射图
Fig.2 X-ray diffraction of magnetic nanometer ferric oxide
2.3 捕获探针和信号探针的表征
图3-a为亲和素修饰前后的氨基化磁性纳米Fe3O4的紫外光谱图。图3-a表示未经修饰的氨基化磁性纳米Fe3O4的吸光度,而图3-b表示修饰后的氨基化磁性纳米Fe3O4,在280 nm处吸光度值有明显下降,表明亲和素与氨基化磁性纳米Fe3O4成功连接。如图3-b所示,经对适配体原液与亲和素化的氨基化磁性纳米Fe3O4孵育前后的上清液进行吸光度值测定后,发现在260 nm处孵育后的吸光度(b)较孵育前的吸光度(a)明显下降,说明适配体序列已连接在亲和素修饰后的氨基化磁性纳米Fe3O4的表面,即成功制备了捕获探针。

图3 亲和素原液(a)和氨基化磁性纳米Fe3O4与亲和素反应后上清液(b)的紫外光谱图(A);福氏志贺菌适配体原液(a)和亲和素化磁性纳米Fe3O4与福氏志贺菌适配体反应后上清液(b)的紫外光谱图(B)
Fig.3 UV spectrogram of the supernatant (b) after the reaction of avidin stock solution (a) and amininated magnetic nano-Fe3O4 with avidin (A);Ultraviolet spectrogram of S. flexneri aptamer raw solution (a) and avidinized magnetic nano-Fe3O4supernatant (b) after reaction with S. flexneri aptamer (B)
信号探针是由巯基化的福氏志贺菌适配体互补序列与鲁米诺功能化花状纳米金连接而成的。巯基化的核酸适配体互补序列可以通过Au—S键与纳米金进行连接,为了提高连接效率而加入TCEP,TCEP的功能是损坏位于巯基化核酸适配体互补序列内部和2条核苷酸序列之间的S—S共价键,以便巯基化的核酸适配体互补序列与纳米金形成Au—S键。
图4是巯基化的核酸适配体互补序列修饰前后的鲁米诺功能化花状纳米金的紫外光谱图,与未经修饰的鲁米诺功能化花状纳米金对比,经适配体互补序列修饰的鲁米诺功能化花状纳米金的上清液在260 nm处的吸光度值明显下降,表明适配体的互补序列已经连接在鲁米诺功能化花状纳米金的表面,进而证明信号探针制备成功。

图4 福氏志贺菌适配体互补序列原液(a)和鲁米诺功能化花状纳米金与互补序列反应后上清液(b)的紫外光谱图
Fig.4 UV spectrogram of the original solution (a) of the S. flexneri aptamer complementary sequence and the supernatant solution (b) of the Luminol functionalized flower-like gold nanoparticles after the reaction with the complementary sequence
2.4 实验条件的优化
通过单变量实验对影响化学发光强度的适配体的互补序列与鲁米诺功能化花状纳米金的孵育时间、H2O2浓度、缓冲溶液的pH、Co2+的浓度进行优化,优化结果如图5所示。

a-孵育时间;b-缓冲液中H2O2浓度;c-缓冲液pH;d-Co2+浓度
图5 福氏志贺菌适配体互补序列与鲁米诺功能化花状纳米金的孵育时间、缓冲液中H2O2浓度、缓冲液pH以及Co2+浓度对化学发光强度的影响
Fig.5 Effect of inincubation time of S. flexneri aptamer complementary sequence and luminol functionalized flower-like gold nanoparticles, H2O2 concentration, buffer pH and CO2 + concentration on chemiluminescence intensity
福氏志贺菌适配体的互补序列和福氏志贺菌会竞争性结合福氏志贺菌的核酸适配体,所以信号探针上的适配体互补序列与Luminol-AuNFs粒子之间的孵育时间在检测过程中是非常重要的。如图5-a所示,在待测时间范围内,紫外吸光度值的差值随着时间的增加而减小,待出现最大值后再次减小。因此,本实验中互补序列和Luminol-AuNFs的最佳孵育时间为6 h。除此之外,对H2O2浓度、缓冲液的pH和Co2+浓度进行了一系列优化,由图5-b~图5-d可知当H2O2的浓度为0.2 mol/L、发光缓冲液的pH为9.0时,Co2+浓度为30 mmol/L时,体系的化学发光强度分别达到最大值。因此选择优化后的孵育时间、Co2+浓度、过氧化氢浓度和pH作为该实验方法的最佳反应条件。
2.5 检测性能分析
当体系中不存在福氏志贺菌时,捕获探针只能和信号探针结合,此时体系的化学发光信号强度达到最小值;当体系中存在福氏志贺菌时,福氏志贺菌和信号探针会竞争性结合捕获探针,此时化学发光强度升高。选取最佳的实验条件,配制一系列不同浓度的福氏志贺菌菌液,在本实验构建的体系下测定化学发光,从而得到不同浓度福氏志贺菌的化学发光光谱图和线性曲线图(图6)。
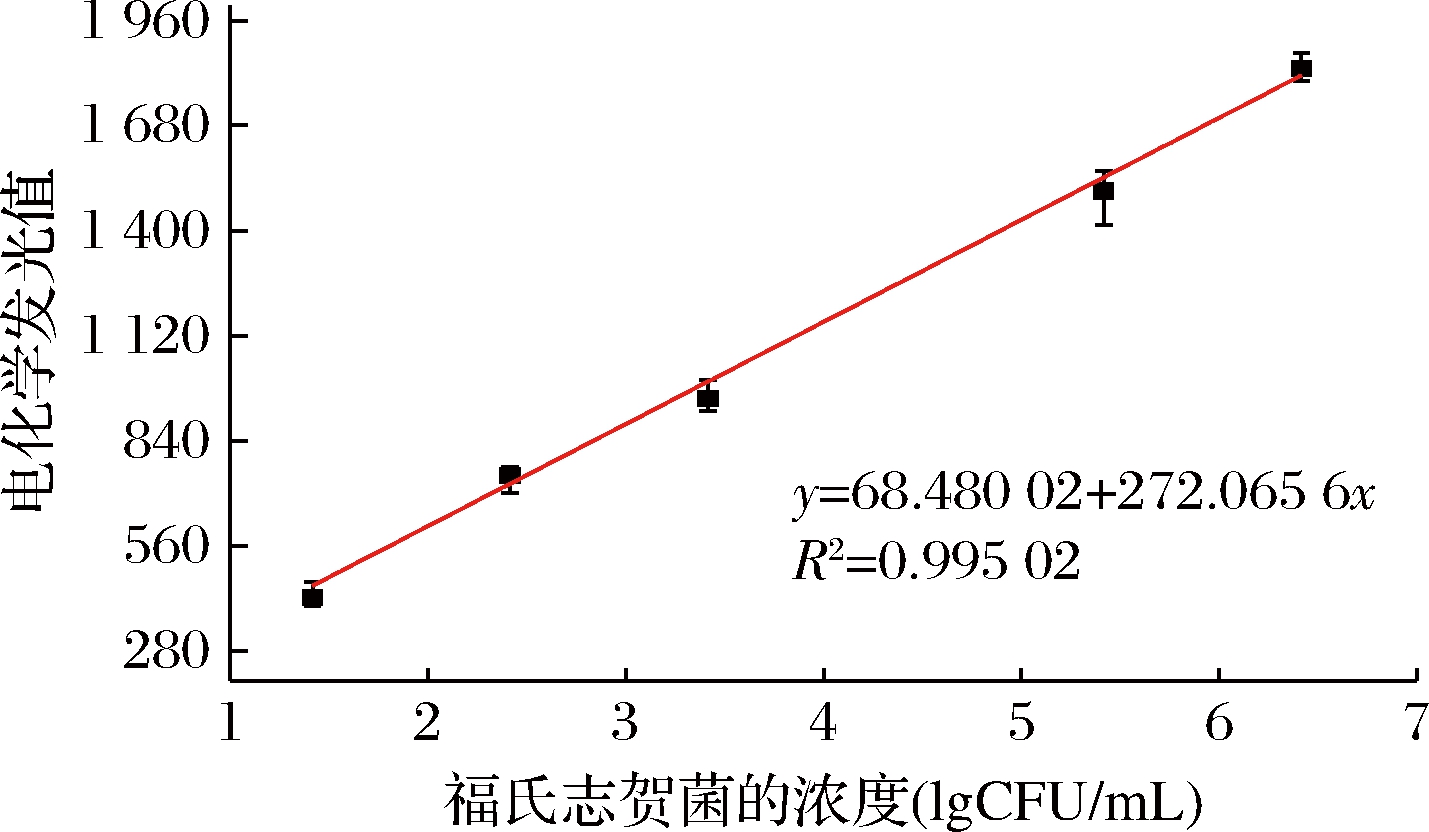
图6 福氏志贺菌浓度和电化学发光强度的关系
Fig.6 Correlation between the concentration of S. flexneri and chemiluminescence intensity
该实验所构建的体系化学发光强度与福氏志贺菌的浓度呈正相关,同时在福氏志贺菌浓度为2.6×10~2.6×105 CFU/mL具有良好的线性关系。其线性方程为Y=68.480 02+272.065 6X,R2=0.995 02,检测限为12 CFU/mL。LUO等[26]开发了一种用于检测粪便和血液中志贺菌的免疫传感器,检出限可以达到21和18 CFU/mL。FENG等[27]开发一种适用于福氏志贺菌的纳米金比色法,检出限达到80 CFU/mL。与以上2种方法相比,本研究建立的方法具有更低的检出限值。
2.6 选择性实验结果
如图7所示,当福氏志贺菌存在时,体系的化学发光强度变化较大,说明捕获探针上连接的适配体可以与福氏志贺菌发生特异性结合,从而使得本实验所构建的适配体传感器对福氏志贺菌呈现良好的特异性;而当其他致病菌存在时,体系的化学发光强度变化不明显,即表明捕获探针上连接的适配体不能与它们发生特异性结合。该结果说明本文构建的检测方法受到其他致病菌的干扰较小,对福氏志贺菌呈现较高的特异性。

图7 不同类型细菌对发光强度值的影响
Fig.7 Effect of different types of bacteria on luminescence intensity
2.7 实际样品检测
为了验证该方法的可行性,利用该方法对市售牛奶和猪肉进行加标检测。如表1所示,福氏志贺菌的加标回收率在95.4%~114.4%,相对偏差(n=3)在1.4%~3.9%,说明本方法具有良好的准确性。
表1 本方法对牛奶和猪肉中福氏志贺菌加标回收检测结果(n=3)
Table 1 Recovery of S. flexneri in milk and pork (n=3) using this method

样品添加浓度该方法检测结果回收率/%RSD/%牛奶/(CFU·mL-1)5.7×1026.5×102114.43.55.7×1026.2×102108.81.45.7×1025.4×10295.43.9猪肉/[CFU·(25 g)-1]5.7×1026.5×102114.43.75.7×1025.5×10296.53.35.7×1025.6×10298.23.7
3 结论
本研究以纳米Fe3O4为原料制得氨基化磁性纳米Fe3O4,以鲁米诺和壳聚糖作为共还原剂对氯金酸进行还原合成鲁米诺功能化花状纳米金。在此基础上成功构建用于检测福氏志贺菌的核酸适配体传感器,呈现良好的特异性。利用本实验构建的检测方法对市售牛奶和猪肉样品进行加标回收实验,其加标回收率在95.4%~114.4%,相对偏差(n=3)在1.4%~3.9%,本方法的建立为今后食源性致病菌的快速检测提供了新的思路。
[1] FRITAH S, LHOCINE N, GOLEBIOWSKI F, et al.Sumoylation controls host anti-bacterial response to the gut invasive pathogen Shigella flexneri[J].EMBO Reports, 2014, 15(9):965-972.
[2] ASHIDA H, SUZUKI T, SASAKAWA C.Shigella infection and host cell death:A double-edged sword for the host and pathogen survival[J].Current Opinion in Microbiology, 2021, 59:1-7.
[3] RANALLO R T, KAMINSKI R, BAQAR S, et al.Oral administration of live Shigella vaccine candidates in rhesus monkeys show no evidence of competition for colonization and immunogenicity between different serotypes[J].Vaccine, 2014, 32(15):1 754-1 760.
[4] YANG C J, LI P, ZHANG X J, et al.Molecular characterization and analysis of high-level multidrug-resistance of Shigella flexneri serotype 4 s strains from China[J].Scientific Reports, 2016, 6:29124.
[5] LAVU P S, MONDAL B, RAMLAL S.Selection and characterization of cell surface specific aptamer and development of fluorescence assay for detection of Shigella flexneri from water samples[J].Journal of Fluorescence, 2021, 31(3):685-693.
[6] SHAHIN K, ZHANG L L, DELFAN A S, et al.Effective control of Shigella contamination in different foods using a novel six-phage cocktail[J].LWT, 2021, 144:111137.
[7] SUN X H, XU Q, PAN Y J, et al.A loop-mediated isothermal amplification method for rapid detection of Vibrio parahaemolyticus in seafood[J].Annals of Microbiology, 2012, 62(1):263-271.
[8] ZHU D, YAN Y R, LEI P H, et al.A novel electrochemical sensing strategy for rapid and ultrasensitive detection of Salmonella by rolling circle amplification and DNA-AuNPs probe[J].Analytica Chimica Acta, 2014, 846:44-50.
[9] SHAO Y C, ZHU S M, JIN C C, et al.Development of multiplex loop-mediated isothermal amplification-RFLP (mLAMP-RFLP) to detect Salmonella spp.and Shigella spp.in milk[J].International Journal of Food Microbiology, 2011, 148(2):75-79.
[10] WANG Z Y, YANG Q, ZHANG Y Z, et al.Saltatory rolling circle amplification (SRCA):A novel nucleic acid isothermal amplification technique applied for rapid detection of Shigella spp.in vegetable salad[J].Food Analytical Methods, 2018, 11(2):504-513.
[11] NGUYEN N T, PARK R M, KIM Y H, et al.Detection and discrimination of Shigella sonnei and Shigella flexneri based on vacuolar responses in Saccharomyces cerevisiae[J].Journal of Biotechnology, 2018, 287:1-7.
[12] ZHAO G Y, ZHAN X J, DOU W C.A disposable immunosensor for Shigella flexneri based on multiwalled carbon nanotube/sodium alginate composite electrode[J].Analytical Biochemistry, 2011, 408(1):53-58.
[13] 蒋艳, 余姓鸿, 谢礼, 等.化学发光免疫方法在食品安全检测中的应用及展望[J].食品安全质量检测学报, 2020, 11(20):7 603-7 609.
JIANG Y, YU X H, XIE L, et al.Application and prospect of chemiluminescence immunoassay in food safety detection[J].Journal of Food Safety & Quality, 2020, 11(20):7 603-7 609.
[14] 何华红, 张陆勇, 何玲, 等.化学发光分析及其在药理学上的应用[J].药学进展, 2004, 28(6):257-262.
HE H H, ZHANG L Y, HE L, et al.Chemiluminescence analysis and its application in pharmacology[J].Progress in Pharmaceutical Sciences, 2004, 28(6):257-262.
[15] 马超. 基于纳米磁分离和化学发光的肝炎分子检测新技术研究[D].南京:东南大学, 2018.
MA C.Novel methods for molecule detection of hepatitis viruses based on magnetic separation and chemiluminescence[D].Nanjing:Southeast University, 2018.
[16] 李蕴. 纳米磁分离技术在食品微生物快速检测领域的应用[J].黑龙江科技信息, 2016(31):107.
LI Y.Application of nanomagnetic separation technology in the rapid detection of food microbes[J].Heilongjiang Science and Technology Information, 2016(31):107.
[17] CHU S, LIM B, CHOI C.Application status and prospect of magnetic separation technology for wastewater treatment[J].Journal of Korean Society on Water Environment, 2020, 36(2):153-163.
[18] BINANDEH M, KARIMI F, ROSTAMNIA S.Application of magnetic nanoparticles by comparing the absorbance and stabilization of biomolecules DNA-C, L by the electrophoretic detection[J].International Journal of Health Sciences, 2021, 15(2):3-8.
[19] KARGINA Y V, ZINOVYEV S V, PEREPUKHOV A M, et al.Silicon nanoparticles with iron impurities for multifunctional applications[J].Functional Materials Letters, 2020, 13(4):2040007.
[20] SAVVIDOU M G, FERRARO A, HRISTOFOROU E, et al.Incorporation of magnetic nanoparticles into protoplasts of microalgae Haematococcus pluvialis:A tool for biotechnological applications[J].Molecules (Basel, Switzerland), 2020, 25(21):5068.
[21] 刘莹, 程立, 张博.基于新型磁分离技术的高分辨率DNA片段筛选技术[J].生物技术通报, 2021, 37(10):257-265.
LIU Y, CHENG L, ZHANG B.High-resolution DNA screening based on novel magnetic separation technology[J].Biotechnology Bulletin, 2021, 37(10):257-265.
[22] 于颖, 杨秀娜, 杨振宇, 等.磁分离技术在石油及化工领域的应用[J].石油炼制与化工, 2021, 52(1):20-26.
YU Y, YANG X N, YANG Z Y, et al.Application of magnetic separation technology in petroleum and chemical industry[J].Petroleum Processing and Petrochemicals, 2021, 52(1):20-26.
[23] ZHU W H, LI Z J, LIU X X, et al.Determination of Shigella flexneri by a novel fluorescent aptasensor[J].Analytical Letters, 2015, 48(18):2 870-2 881.
[24] KHOSROSHAHI M E, GHAZANFARI L.Synthesis and functionalization of SiO2 coated Fe3O4 nanoparticles with amine groups based on self-assembly[J].Materials Science and Engineering:C, 2012, 32(5):1 043-1 049.
[25] LI F, CUI H.A label-free electrochemiluminescence aptasensor for thrombin based on novel assembly strategy of oligonucleotide and luminol functionalized gold nanoparticles[J].Biosensors and Bioelectronics, 2013, 39(1):261-267.
[26] LUO J L, WANG J P, MATHEW A S, et al.Ultrasensitive detection of Shigella species in blood and stool[J].Analytical Chemistry, 2016, 88(4):2 010-2 014.
[27] FENG J L, SHEN Q, WU J J, et al.Naked-eyes detection of Shigella flexneri in food samples based on a novel gold nanoparticle-based colorimetric aptasensor[J].Food Control, 2019, 98:333-341.