随着全民生活水平的提高和食品加工技术的发展,消费者的饮食结构也在发生变化,越来越多可以引发人们过敏的食物被发现。其中能够引发过敏的蛋白或其他活性物质被称为食物过敏原。世界卫生组织(World Health Organization,WHO)和联合国粮农组织(Food and Agriculture Organization, FAO)发布可引发人类过敏的170多种食物,其中90%的食物过敏由牛奶、鸡蛋、鱼、甲壳类、大豆、小麦、花生、坚果引起,被命名为“The Big-8”[1-2]。流行病学调查显示,近年来食物过敏的发病率在世界范围内不断上升,全球已有3%人口受到过敏带来的影响,已经成为继哮喘病后的全球第二波流行病,严重影响人们的生活质量,已经成为世界公认的食品安全问题之一[3]。
甲壳类动物是FAO和WHO认定为八大类食物过敏原之一,虾及其制品是海鲜过敏的主要原因,主要集中在中国、日本和北美等地区[4]。虾及其制品引发的过敏是由IgE介导的超敏反应,能够引起消费者哮喘、腹泻、皮炎等症状,严重时可引发休克甚至死亡等疾病,严重威胁消费者的健康[5]。
1 原肌球蛋白
虾中含有大量过敏蛋白,目前已经证实的过敏蛋白有:原肌球蛋白(tropomyosin, TM)、精氨酸激酶(arginine kinase, AK)、肌质钙结合蛋白(sarcoplasmic calcium-binding protein, SCP)、肌球蛋白轻链(myosin light chain, MLC)、血蓝蛋白亚基(hemocyanin, HC)和肌钙蛋白C(troponin C, TnC)。其中,原肌球蛋白引起的过敏高达80%,是虾中最主要的过敏原[6-7]。
原肌球蛋白是分子质量为32~39 kDa的盐溶性蛋白,理论等电点4.5,含有丰富的谷氨酸、酪氨酸、苯丙氨酸、精氨酸和丝氨酸,结构以α-螺旋为主,具有热稳定性,在机体中与肌动蛋白和肌球蛋白一起调节肌肉收缩,由HOFFMAN在1981年首次从虾中分离出来,是甲壳类动物主要过敏原[7-9]。不同物种中TM蛋白表现出了高度同源性,结构具有相似性,如:克氏原鳌虾、中国明对虾和凡纳滨对虾等9种虾TM蛋白序列同源性高达90%以上[10]。
近年来,随着检测技术的不断发展,越来越多的过敏原被人们发现,YU等[11]在海螺中分离出99 kDa的新型过敏原,通过质谱法确定为副原肌球蛋白(paramyosin,PM),并通过生物信息学工具预测出PM蛋白含有7个抗原表位。SUZUKI等[12]在盘鲍中检测到PM蛋白,并且发现PM蛋白与TM蛋白间存在交叉反应。LEE等[13]通过免疫印迹发现煮熟虾的提取物与过敏患者血清在63 kDa处发生结合,通过SDS-PAGE结合质谱技术确定此蛋白为丙酮酸激酶(pyruvate kinase,PK)。
2 TM蛋白消减技术
目前,对于食物过敏没有良好的治愈办法,但可以通过有效预防和加工处理降低食物致敏率,一般有2种途径:一是对食品过敏反应进行早期识别和管理、准确标识、提醒和警示过敏人群,如:美国、欧盟、日本等国对含有甲壳类动物的食品标签进行强制标识[14];二是对含有过敏原的食物进行加工生产低敏甚至脱敏食物[15]。本文针对虾主要过敏原TM蛋白,总结常见的消敏技术。
一些加工技术可以改变虾肉的品质,引起蛋白发生变性、降解、聚合或糖基化等,可能改变了TM蛋白的结构,导致抗原表位的破坏、丢失或者暴露,从而消减TM蛋白致敏性。因此选择合适的加工技术可以有效降低虾的致敏性。TM蛋白是耐热蛋白,传统的热加工很难降低其致敏性,往往需要借助其他手段进行处理以降低其致敏性。目前主要的加工方法有:物理加工法、化学处理法、生物法以及联合处理法。常见的非热加工对TM蛋白致敏性的影响见表1。
表1 常见非热加工方法对TM蛋白致敏性的影响
Table 1 Effect of common non-thermal processing technologies on the sensitization of tropomyosin

加工方法最优加工条件对致敏性的影响参考文献物理法超高压等离子体超声波300 MPa,20 ℃处理40 min致敏性降低约45.32%;TM蛋白二级结构未发生明显改变;表面疏水性与致敏性变化趋势相同;TM蛋白致敏性和三级结构有关,与二级结构无关[16]300 MPa,65 ℃处理10 min超高压处理使TM致敏性发生波动式变化,未破坏TM蛋白一级结构;使α-螺旋和β-转角之间相互转换;三级结构改变,表面疏水性降低[10]500 MPa,55 ℃处理10 min超高压可能导致蛋白化学交联,蛋白结构改变,破坏了TM蛋白抗原表位;减轻了BALB/c小鼠模型过敏症状;降低了血清中特异性IgE、组胺IL-4、IFN-γ 和 IL-10含量[17]600 MPa,120 ℃处理10 minHHP处理后,TM蛋白致敏性降低65%;提高了TM蛋白消化率[18]7 kGy,上升速率为1 kGy/s免疫印迹和ELISA显示TM蛋白致敏性分别降低92%和59%;α-螺旋和 β-折叠向β-转角转变[2]10 kGy和15kGy,上升速率为0.5 kGy/h10和15 kGy时TM蛋白的IgG明显减少;水分、蛋白质和碳水化合物的含量存在显著差异[19]0、3、5、7 或 10 kGy的剂量3 kGy 辐照的虾提取物结合能力增加了大约 10%;10 kGy 时TM蛋白的IgE结合能力降低了大约20%[20]氩气低温等离子体处理15 minIgE和IgG结合能力分别降低17.6%和26.87%;巯基含量显著减少;表面疏水性显著增加;半胱氨酸和蛋氨酸含量显著减少;α-螺旋向β-折叠、β-转角和无规则卷曲转变[21]频率20 kHz;功率100~800 W;时间15 min;随着超声功率变大,致敏性降低,800 W时致敏性下降约70%;高强度超声处理使TM蛋白降解,产生肽段,诱导半胱氨酸(Cys)、蛋氨酸(Met)和赖氨酸(Lys)氧化修饰形成二硫键并提高了TM蛋白消化率[22]频率20 kHz;功率400 W;时间20 min总蛋白质含量降低了 28.26%;消化率提高7.53%;TM蛋白致敏性下降76%[1]化学法糖基化TM和葡萄糖胺为按质量比1∶1,TG酶量10 U/g,37 ℃温度高时,消减效果更好。在37 ℃ TG酶添加量为10 U/g条件下进行TM蛋白糖基化反应,其IgG/IgE结合能力分别降低36.9%和54.27%;表面疏水性升高,游离氨基减少[23]酶处理2 000 nkat/g酪氨酸酶+0.1 mol/L咖啡酸,37 ℃下孵育2 hTM蛋白分子质量变大;TM蛋白IgG和IgE活性分别降低37.19%和49.41%;表面疏水性降低 66.50%;α-螺旋含量降低[24]生物法发酵处理口服Lactobacillus casei Zhang的 BALB/c 小鼠模型增加了小鼠对TM蛋白的耐受性,减轻了小鼠过敏症状[25]联合处理美拉德联合热处理D-半乳糖(半乳糖与水的质量比1∶3)在 0.08 MPa、115 ℃下联合处理 6 min高温和美拉德联合处理下TM蛋白IgG/IgE结合活性更低;对虾肌肉消化率更高[26]
2.1 物理法
2.1.1 热加工
热加工是传统的食品加工技术,包括蒸、煮、煎、炒、炸等,是以减少食物中微生物、延长保质期和提高品质为目的的一种加工技术。如图1所示,蛋白易受热变性,引起空间结构发生变化,蛋白分子发生伸展,分子间作用力改变,破坏了蛋白的构象表位,降低过敏原免疫结合能力,但热加工不会改变虾TM蛋白线性表位,高温还会引起TM蛋白与还原糖的美拉德反应,可能会增加致敏性[6-7]。热处理不能改变凡纳滨对虾TM蛋白致敏性,煮制后SCP、磷酸丙糖异构酶(triosephosphate isomerase,TIM)、AK、MLC和TM 5种过敏原IgG结合活性并没有发生改变,高温一定压力处理后MLC活性降低,TIM、AK没有阳性反应,TM蛋白仍然存在较高的IgG结合活性[27]。热处理TM蛋白在经胃蛋白酶和胰蛋白酶消化后仍有较高的致敏性[28]。煮制后的虾与生虾相比,TM蛋白IgE结合活性明显升高[29]。LALY等[30]发现花尾虾在沸水中保持5~25 min后,IgE活性升高18%~27%。但是MEJRHIT等[31]研究摩洛哥人对虾TM蛋白敏感性,发现热处理后,ELISA和Dot Blot显示热处理降低了TM蛋白阳性反应,可能引起摩洛哥人对TM蛋白过敏的抗原表位是构象表位。不同的抗体与TM蛋白之间结合位点不同,高温状态下以α-螺旋为主的TM蛋白空间构象发生改变,但温度恢复到室温后TM蛋白α-螺旋又回复到原始状态[32],TM蛋白中含有大量的赖氨酸,热加工会促使其与还原糖反应速度加快,形成新的抗原表位,提高了TM蛋白的IgE结合活性。
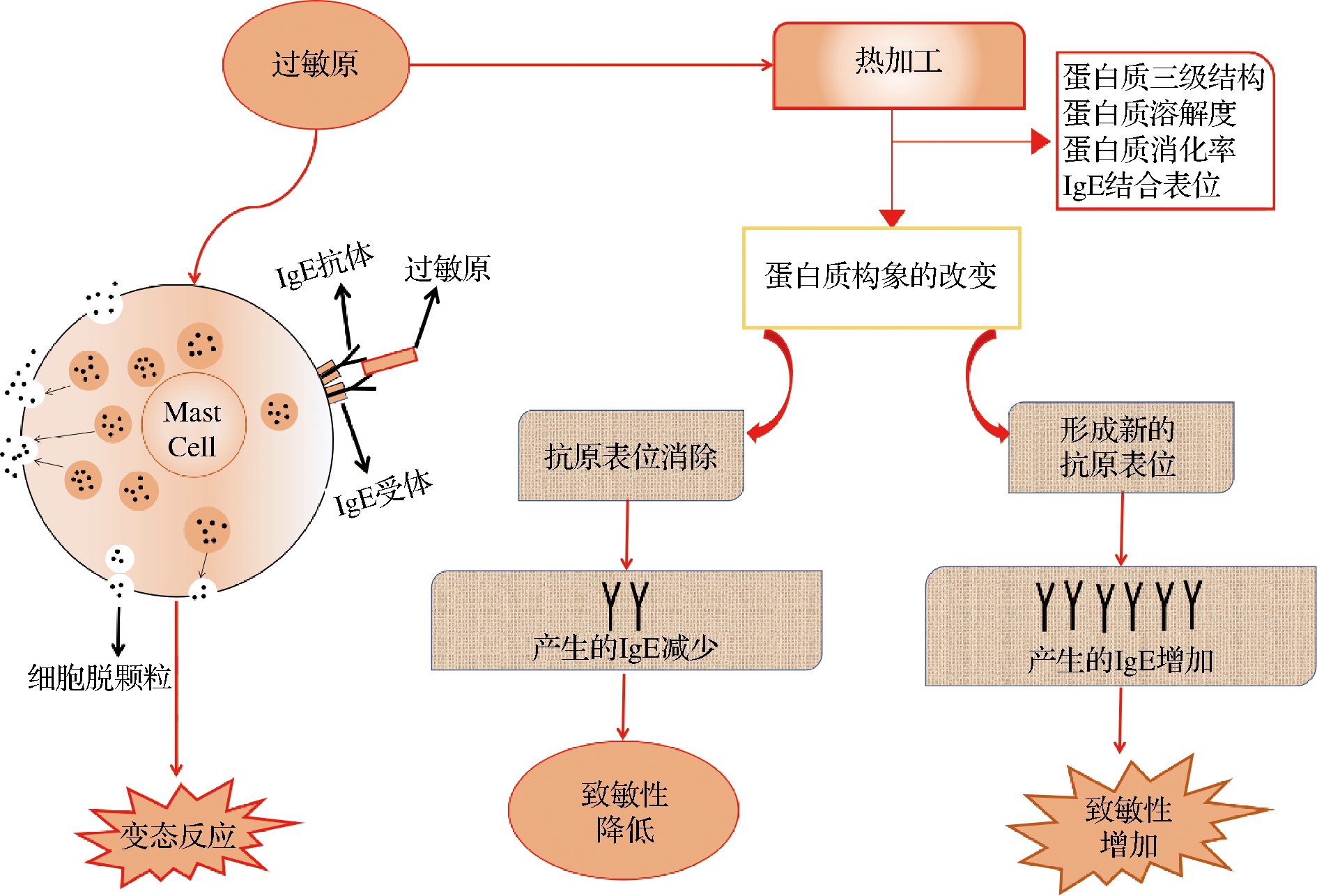
图1 热加工对过敏原致敏性的影响[7]
Fig.1 Effect of allergen reduction by thermal treatment
2.1.2 超高压技术
超高压(high hydrostatic pressure,HHP)技术又叫超高压杀菌技术、高静压技术,是一种非热加工技术,它是在25~60 ℃,通过介质在压强0~1 000 MPa下处理食品[3,7]。HHP主要影响蛋白质之间的氢键、离子键和疏水键等非共价键,破坏蛋白二、三级结构,使蛋白质结构发生不可逆的改变,从而降低了食物致敏性。与热加工相比,HHP处理可保留食品原有的色泽,较大程度保留食物的营养成分,近年来在消减过敏原研究中受到国内外学者广泛关注[3,17]。HHP可以显著降低TM蛋白致敏性,胡志和等[16]发现,虾TM蛋白在300 MPa、20 ℃保压40 min时,致敏性最低[OD492(0.210±0.005)];而当压强增加至700 MPa时,致敏性最高[OD492(0.328±0.004)]。韩建勋[10]发现HHP未改变TM蛋白一级结构,对二级结构影响较小, 当处理条件为65 ℃、压强为300 MPa保压15 min时致敏性最低,且HHP可破坏TM蛋白表位(MDAIKKKKMQAMKLEKDNAMDRADTLEQQNKEAN-NRA、VAALNRRIQLLEEDLERSEER和QKLQKEVDR-LEDELVNEKEKYKSITDELDQTFSELSGY)。LONG等[17] 发现TM蛋白经500 MPa、55 ℃处理10 min后几乎完全失活,而当压强高于500 MPa时,TM蛋白致敏性增大,可能是高压使TM蛋白内部的抗原表位暴露导致的。FAISAL等[18]发现600 MPa、120 ℃处理TM蛋白10 min,其致敏性降低65%,且胃蛋白酶消化后原肌球蛋白抗原性显著降低。
2.1.3 辐照技术
食品辐照作为一种典型的非热食品加工技术,是采用高能、高穿透性射线对食品或原料进行辐照,使食品成分或生物活性物质发生物理变化或化学反应,辐照源包括能量≤10 MeV的电子束、≤ 5 MeV的X射线和Co60和Cs137放射出的γ射线,主要应用于食品杀菌和延长货架期等[33]。辐照可以破坏过敏蛋白的空间构象和表位结构,达到降低或者消除致敏性的作用。采用γ辐射处理虾肉粗提物,TM蛋白含量降低,免疫印迹和ELISA结果显示 TM蛋白IgE活性随着辐照剂量的增加而降低[34]。采用0、1、3、5、7、9 kGy剂量的辐照处理中华管鞭虾TM蛋白,其致敏性降低,在7 kGy时效果最显著,IgG结合能力下降了59%;3、7和9 kGy剂量的电子束辐射导致 α-螺旋和 β-折叠结构含量减少,β-转角结构含量增加,无规则卷曲含量无显著变化[2]。采用γ-辐射处理罗氏沼虾TM蛋白,在10和15 kGy剂量下IgG结合能力明显减少[19]。采用电子束辐照处理冷冻虾TM蛋白,结果显示蛋白发生降解,10 kGy辐照后致敏性降低了20%,而在低剂量3 kGy辐照后致敏性增加了10%,这可能是由于轻微的辐照会产生低浓度的活性氧,改变蛋白的空间结构,反而提高了TM蛋白致敏性[20]。
2.1.4 等离子体技术
等离子体是近年来兴起的一种非热加工技术,又称非热等离子体或低温等离子体,与传统的加工技术相比,有能耗低、处理温度低和耗时短等优点[35]。它是由气体激发和电离后产生物质的一个集合体,包括电子、离子、自由基、负离子等,又被称为“物质第四态”[36]。当过敏蛋白暴露于含有自由基的冷等离子体时,这些活性基团与蛋白质发生相互作用,破坏蛋白质结构,引起α-螺旋和β-折叠含量的变化、酰胺键和侧链的分解,这些变化可能掩盖或破坏构象表位和线性表位,降低过敏性[17,37]。SHRIVER等[38]发现白滨对虾TM蛋白经30 kV、60 Hz处理5 min后致敏性降低了67%。EKEZIE等[21]采用氩气低温等离子体(98%氩气和2%氧气)处理凡纳滨对虾TM蛋白 3、6、9、12、15 min,随着处理时间的延长,间接ELISA显示IgG/IgE分别降低了17.6%和26.87%,巯基含量显著降低,表面疏水性增加,促进了α-螺旋向β-折叠和β-转角的转变。目前,已经发现等离子体可以消减虾、花生、小麦的致敏性,但是有研究证明,等离子体可能会促进油脂的氧化,破坏食品中一些营养成分,降低食品的品质。因此,等离子体在实际加工生产过程中的应用仍有待于进一步确认。
2.1.5 超声技术
超声加工技术有耗能低、无污染和对食品品质影响小等优势,受到人们广泛关注。高强度超声(100~800 W,15 min)处理可减少TM蛋白α-螺旋和β-折叠含量、增加β-转角和无规则卷曲含量,诱导TM蛋白产生多肽片段,ELISA结果显示超声处理后TM蛋白致敏性降低70%,消化率提高[22]。TM蛋白在0、50 ℃下经30 kHz、800 W超声处理1.5 h,0 ℃处理并未明显降低TM蛋白致敏性,50 ℃超声处理后致敏性显著下降,表明超声消减TM蛋白致敏性需要温度共同作用[39]。煮熟的南美白对虾经800 W,30 kHz,0 ℃超声处理30 min后,过敏患者血清与IgE结合能力下降了50%[40]。LI等[41]用30 Hz、800 W超声处理TM蛋白,间接ELISA结果表明,TM蛋白IgE结合活性下降75%,消减率和处理时间成线性关系。室温下20 kHz,400 W超声处理虾制品,0~20 min致敏性随处理时间延长而降低,20 min时TM蛋白含量减少76%,体外消化率提高7.53%[1]。超声处理并不能降低对虾中所有过敏原,CHEN等[42]采用30 ℃,200 W超声处理小龙虾AK蛋白,其致敏性并没有发生明显改变。超声处理是一种非常有潜力的过敏原消减技术,目前关于超声消减TM蛋白致敏性研究相对较少,消减机制还需要进一步研究。
2.1.6 其他物理方法
微波和脉冲强光等物理处理也可以改变TM蛋白致敏性。1 000 W、75~125 ℃微波处理南美白对虾5~15 min,TM蛋白条带强度随着处理温度和时间的增加而降低,125 ℃微波处理15 min后TM蛋白含量减少75%[9]。采用脉冲强光(3 脉冲/s,距光源 10 cm)处理TM蛋白,SDS-PAGE显示4 min后TM蛋白灰度降低,处理1~3 min时,Western bolt显示与未处理TM蛋白相比,IgE结合能力并未发生明显改变,处理4~6 min时,IgE活性显著降低,采用煮沸结合脉冲强光联合处理,TM蛋白致敏性下降程度最大[43]。
2.2 化学法
2.2.1 糖基化
糖基化是还原糖和游离氨基之间发生的非酶促反应,主要发生在经过热处理和长期储存后的食品中。TM蛋白含有丰富的谷氨酸、酪氨酸、苯丙氨酸、精氨酸和丝氨酸,糖基化可能破坏TM蛋白表位,导致致敏性降低[8,44]。还原糖数量和种类、温度和时间等因素会影响糖基化处理对TM蛋白致敏性的消减效果。美拉德反应(核糖、阿拉伯糖、半乳糖、葡萄糖和麦芽糖)可影响青蟹TM蛋白和AK致敏性,半乳糖、葡萄糖和阿拉伯糖降低了TM蛋白的致敏性,只有阿拉伯糖降低了AK致敏性[45]。YUAN等[23]发现经谷氨酰转氨酶催化糖基化后,TM蛋白α-螺旋含量增加、紫外吸收峰发生蓝移、表面疏水性增加、游离氨基含量减少,IgG/IgE结合能力降低。LYU等[44]研究了核糖处理对TM蛋白构象及致敏性影响,发现TM蛋白空间结构发生明显改变,核糖修饰了苯丙氨酸、异亮氨酸和蛋氨酸残基,改变了TM蛋白抗原表位,4 000 mmol/L核糖可显著降低TM蛋白IgE结合能力,并抑制RBL-2H3细胞释放细胞因子。TM蛋白经低聚乳糖(TM-GOS)、甘露聚糖(TM-MOS)、麦芽五糖(TM-MPS)糖化处理后致敏性降低,而TM-FOS糖化增加了TM蛋白的致敏性和小鼠嗜碱性粒细胞过敏反应,α-螺旋从78.7%分别减少到60.7%(TM-GOS)、66.7%(TM-FOS)、71.3%(TM-MOS)和68.9%(TM-MPS)[46]。
2.2.2 酶处理
酶处理包括:(1)酶解,在胰蛋白酶和木瓜蛋白酶等水解酶作用下,蛋白被水解成多肽、氨基酸以及其他小分子,导致线性表位丢失而降低致敏性;(2)酶交联,常用酶有酪氨酸酶、漆酶、转谷氨酰胺酶和多酚氧化酶,主要是通过分子间交联导致蛋白聚集,引起蛋白空间构象变化而降低致敏性。酶解过程温和,可以有效地破坏蛋白质的功能特性,降低动物过敏原IgE结合能力[7,24,47,48]
AHMED等[24]研究了酪氨酸酶交联对刀额对虾TM蛋白致敏性的影响,发现酪氨酸酶和咖啡酸交联后的TM蛋白分子质量明显变大,灰度值下降,酪氨酸酶处理导致 IgE 结合带在36 kDa处减少;2 000 nkat/g的酪氨酸酶处理导致TM蛋白IgG/IgE结合能力分别下降了33.83%和43.9%。体外和体内实验显示酶交联后提高了TM蛋白消化率,IgG/IgE的识别率显著降低,有效地抑制了细胞脱颗粒[47]。采用漆酶、漆酶/咖啡酸交联TM蛋白,ELISA和WB实验显示IgG/IgE结合活性降低,TM蛋白空间结构发生改变,紫外吸收峰蓝移、荧光最大吸收峰降低且最大吸收波长红移、表面疏水性降低,胃肠消化率提高[8]。通过转谷酰胺酶和酪氨酸酶处理TM蛋白,其蛋白结构发生改变,α-螺旋在转谷酰胺酶和酪氨酸酶处理后分别降低20.1%和15.2%,β-转角分别增加5.8%和6.2%;酪氨酸酶交联后,TM蛋白IgE结合活性下降34.95%[48],可能是由于TM蛋白表位中含有大量谷氨酸、酪氨酸和赖氨酸,酶处理后导致蛋白表位破坏降低了致敏性。酪氨酸酶和辣根过氧化物酶交联螃蟹TM蛋白,其IgE结合能力分别下降了34.5%和63.5%,IgG结合能力分别降低了16.9%和70.8%,消化稳定性下降,RBL-2H3细胞脱颗粒受到抑制,增加了小鼠口服耐受性[49]。LIU等[50]用胃蛋白酶、胰蛋白酶和糜蛋白酶处理太平洋白对虾和草虾,发现TM蛋白耐酶解。TM蛋白显示出对胃蛋白酶消化具有一定的抵抗力,而肌球蛋白重链和肌动蛋白都在短时间内迅速降解。酶催化蛋白交联和蛋白水解2种方法可对过敏性蛋白进行修饰,为减轻甲壳动物过敏原的致敏性提供了温和而又安全的方法。
2.2.3 其他化学处理
除了常用的糖基化和酶法可消减TM蛋白的致敏性,还有使用其他化学处理方法,如采用丙烯酰胺、2,2′-偶氮二异丁基脒二盐酸盐、丙二醛、多酚和pH等。25 ℃下将刀额对虾TM蛋白在1 mmol/L丙烯酰胺中孵育24 h,BALB/c 小鼠模型显示TM 蛋白特异性IgE和IgG1血清水平、组胺含量显著降低;RBL-2H3细胞模型显示β-氨基己糖苷酶、组胺、半胱氨酰白三烯和前列腺素D2含量与未处理的TM蛋白相比显著降低(P<0.01),表明丙烯酰胺可修饰TM蛋白并降低其致敏性,随着处理浓度的增加,TM蛋白IgE结合能力降低[51]。使用2,2′-偶氮二异丁基脒二盐酸盐修饰TM蛋白,羰基和游离氨基含量显著降低,赖氨酸和表面疏水性含量显著增加(P<0.05);荧光最大发射波长蓝移,荧光强度降低;小鼠模型中TM蛋白特异性IgE/IgG1、组胺和mMCP-1水平显著降低;RBL-2H3细胞中介质释放能力降低;IgG/IgE结合能力显著降低,5和25 mmol/L 2,2′-偶氮二异丁基脒二盐酸盐处理TM蛋白时出现新条带,发生了交联[5]。丙二醛可诱导TM蛋白发生交联,降低α-螺旋含量,增加了β-折叠、β-转角和无规则卷曲含量;表面疏水性和羰基含量显著增加,游离氨基和可用赖氨酸含量显著减少(P<0.05);低浓度丙二醛交联后的TM蛋白仍有IgG结合活性,而高浓度处理后IgG活性降低,且TM蛋白诱导RBL-2H3释放介质和细胞因子下降[52-53]。虾TM蛋白经不同浓度的丙二醛处理后发生轻微降解,提高了胃蛋白酶消化稳定性,但是TM蛋白IgE结合能力在胃消化后略有下降,肠消化后下降显著[54]。多酚可诱导TM蛋白分子质量发生改变,同时降低TM蛋白的IgG/IgE结合能力,降低RBL-2H3细胞介质释放能力和小鼠模型中TM蛋白的致敏性[4]。pH会影响TM蛋白特异性结合能力,当pH<4.0时,IgG结合能力降低了42.2%[55],在pH 1.0~3.5下腌制虾肉,TM蛋白IgE结合能力显著降低[56]。
2.3 生物法
发酵是一种传统的加工与保藏技术,发酵法主要利用发酵过程中微生物对一些过敏原蛋白进行分解,引起变性,改变过敏原空间构象,破坏抗原表位,从而达到降低或消除致敏性的目的。发酵法与热处理以及其他物理法相比,不会破坏其他营养物质,还可以分解基质中蛋白质生成肽或氨基酸,促进机体的吸收,一定程度上增加食品风味。目前发酵法在消减水产品致敏性方面的研究较少,现阶段主要应用于豆制品、奶制品以及花生制品的加工中[37,57]。PARK等[58]研究发现发酵过程可以降低虾中TM蛋白与过敏人群血清的结合能力,当发酵温度为25 ℃时,发酵12 d TM蛋白致敏性开始下降,降低发酵温度会延长TM蛋白致敏降低现象的出现时间。FU等[25]发现口服干酪乳杆菌可减轻BALB/c小鼠对虾TM蛋白的过敏症状和肠上皮损伤。虾酱在37 ℃自然发酵过程中, TM蛋白含量和免疫活性随发酵时间的增加而逐渐下降,18 d后致敏性下降69%[59]。
2.4 联合消减
LIU等[26]采用美拉德反应结合热处理TM蛋白,与单独热处理和美拉德反应相比,其消化率有所提高且IgG/IgE结合活性降低更多。采用10 kGy剂量辐照和100 ℃热加工处理TM蛋白,与单独处理相比,消减效果显著提高,但TM蛋白致敏性随着处理时间的延长未发生明显改变[60]。木瓜蛋白酶结合超高压处理虾仁,在酶与底物质量比为1∶130、450 MPa、40 ℃条件下处理55 min,过敏人血清反应OD492(0.053)接近正常人血清OD492(0.05),单独超高压处理时与过敏人血清结合OD492为0.585,在降低致敏性方面表现出明显的优势[61]。
3 结论
TM蛋白耐酸碱、耐高温、耐消化,传统加工方式不能有效地对其致敏性进行消减。长时间加压高温可以有效地对TM蛋白致敏性进行消减,但会对虾肉品质造成影响。目前,一些非热加工(如:超高压、超声、等离子体、辐照等)在消减对虾TM蛋白致敏性上有了初步研究,但是消减效果不一,也会对虾肉品质带来影响。因此,部分学者采用联合方法进行消减致敏性。虽然两种或多种技术的组合不仅可以提高消减效果,而且可以大大缩短加工时间,保证食品的理化特性,但是与单一技术相比,组合方式需要控制更多的参数,组合技术在连续处理同一对象时,会产生明显的相互作用,可能是协同也可能是拮抗作用,还可能产生不可预见的问题。因此,两种或多种高效联合消减技术的研究仍具有一定的挑战性,有必要寻找更多的可能性,进行更多样化的研究。此外,目前研究对虾过敏原消减技术主要集中在纯化后过敏原的消减,而对于整只虾、虾仁或者虾肉糜的研究较少,是否会有同样的消减作用,仍需进一步的确认和关注。
[1] DONG X, WANG J, RAGHAVAN V.Effects of high-intensity ultrasound processing on the physiochemical and allergenic properties of shrimp[J].Innovative Food Science & Emerging Technologies, 2020, 65:102441.
[2] GUAN A Y, MEI K L, LYU M C, et al.The effect of electron beam irradiation on IgG binding capacity and conformation of tropomyosin in shrimp[J].Food Chemistry, 2018, 264:250-254.
[3] ZHANG Y F, REN Y Y, BI Y G, et al.Review:Seafood allergy and potential application of high hydrostatic pressure to reduce seafood allergenicity[J].International Journal of Food Engineering, 2019, 15(8):20180392.
[4] LYU L T, QU X, YANG N, et al.Changes in structure and allergenicity of shrimp tropomyosin by dietary polyphenols treatment[J].Food Research International, 2021, 140:109997.
[5] LYU L T, LIN H, LI Z X, et al.Structural changes of 2, 2′-azobis(2-amidinopropane) dihydrochloride (AAPH) treated shrimp tropomyosin decrease allergenicity[J].Food Chemistry, 2019, 274:547-557.
[6] CHENG J H, WANG H F, SUN D W.An overview of tropomyosin as an important seafood allergen:Structure, cross-reactivity, epitopes, allergenicity, and processing modifications[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(1):127-147.
[7] KHAN M U, AHMED I, LIN H, et al.Potential efficacy of processing technologies for mitigating crustacean allergenicity[J].Critical Reviews in Food Science and Nutrition, 2019, 59(17):2 807-2 830.
[8] AHMED I, LIN H, XU L L, et al.Immunomodulatory effect of laccase/caffeic acid and transglutaminase in alleviating shrimp tropomyosin (met e 1) allergenicity[J].Journal of Agricultural and Food Chemistry, 2020, 68(29):7 765-7 778.
[9] DONG X, WANG J, RAGHAVAN V.Impact of microwave processing on the secondary structure, in vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei) proteins[J].Food Chemistry, 2021, 337:127811.
[10] 韩建勋. 高静压处理对虾原肌球蛋白致敏性及结构变化规律研究[D].北京:中国农业大学, 2016.
HAN J X.Effect of high hydrostatic pressure on the allergenicity and structure of tropomyosin from shrimp[D].Beijing:China Agricultural University,2016.
[11] YU C, GAO X, LIN H, et al.Identification and amino acid analysis of allergenic epitopes of a novel allergen paramyosin (rap v 2) from Rapana venosa[J].Journal of Agricultural and Food Chemistry, 2021, 69(18):5 381-5 391.
[12] SUZUKI M, KOBAYASHI Y, HIRAKI Y, et al.Paramyosin of the disc abalone Haliotis discus Discus:Identification as a new allergen and cross-reactivity with tropomyosin[J].Food Chemistry, 2011, 124(3):921-926.
[13] LEE C H, WU C C, TYAN Y C, et al.Identification of pyruvate kinase as a novel allergen in whiteleg shrimp (Litopenaeus vannamei) by specific-IgE present in patients with shrimp allergy[J].Food Chemistry, 2018, 258:359-365.
[14] ZHOU J R, WANG Y B, QIAN Y F, et al.Quantification of shellfish major allergen tropomyosin by SPR biosensor with gold patterned Biochips[J].Food Control, 2020, 107:106547.
[15] ZHANG Z Y, LI Z X, LIN H.Reducing the allergenicity of shrimp tropomyosin and allergy desensitization based on glycation modification[J].Journal of Agricultural and Food Chemistry, 2021, 69(49):14 742-14 750.
[16] 胡志和, 王星璇, 张晴青, 等.高压处理诱发虾原肌球蛋白结构变化与致敏性的关系[J].食品科学, 2017, 38(11):33-39.
HU Z H, WANG X X, ZHANG Q Q, et al.Relationship between conformational changes caused by ultra-high pressure and allergenicity of shrimp tropomyosin[J].Food Science, 2017, 38(11):33-39.
[17] LONG F Y, YANG X, WANG R R, et al.Effects of combined high pressure and thermal treatments on the allergenic potential of shrimp (Litopenaeus vannamei) tropomyosin in a mouse model of allergy[J].Innovative Food Science & Emerging Technologies, 2015, 29:119-124.
[18] FAISAL M, BUCKOW R, VASILJEVIC T, et al.Effect of simulated digestion on antigenicity of banana prawn (Fenneropenaeus merguiensis) after high pressure processing at different temperatures[J].Food Control, 2019, 104:187-192.
[19] MUANGHORN W, KONSUE N, SHAM H, et al.Effects of gamma irradiation on tropomyosin allergen, proximate composition and mineral elements in giant freshwater prawn (Macrobrachium rosenbergii)[J].Journal of Food Science and Technology, 2018, 55(5):1 960-1 965.
[20] LIU Y X, LI Z J, PAVASE T, et al.Evaluation of electron beam irradiation to reduce the IgE binding capacity of frozen shrimp tropomyosin[J].Food and Agricultural Immunology, 2017, 28(2):189-201.
[21] EKEZIE F G C, SUN D W, CHENG J H.Altering the IgE binding capacity of king prawn (Litopenaeus vannamei) tropomyosin through conformational changes induced by cold Argon-plasma jet[J].Food Chemistry, 2019, 300:125143.
[22] ZHANG Z Y, ZHANG X F, CHEN W, et al.Conformation stability, in vitro digestibility and allergenicity of tropomyosin from shrimp (Exopalaemon modestus) as affected by high intensity ultrasound[J].Food Chemistry, 2018, 245:997-1 009.
[23] YUAN F Z, LYU L T, LI Z X, et al.Effect of transglutaminase-catalyzed glycosylation on the allergenicity and conformational structure of shrimp (Metapenaeus ensis) tropomyosin[J].Food Chemistry, 2017, 219:215-222.
[24] AHMED I, LYU L T, LIN H, et al.Effect of tyrosinase-aided crosslinking on the IgE binding potential and conformational structure of shrimp (Metapenaeus ensis) tropomyosin[J].Food Chemistry, 2018, 248:287-295.
[25] FU L L, XIE M H, WANG C, et al.Lactobacillus casei Zhang alleviates shrimp tropomyosin-induced food allergy by switching antibody isotypes through the NF-κB-dependent immune tolerance[J].Molecular Nutrition & Food Research, 2020, 64(10):e1900496.
[26] LIU M, HUAN F, HAN T J, et al.Combination processing method reduced IgE-binding activity of Litopenaeus vannamei by modifying lysine, arginine, and cysteine on multiple allergen epitopes[J].Journal of Agricultural and Food Chemistry, 2021, 69(16):4 865-4 873.
[27] 刘思寒. 热加工对凡纳滨对虾过敏原免疫结合活性的影响研究[D].厦门:集美大学, 2020.
LIU S H.Research on the effect of thermal processing on immune binding activity of allergens from Litopenaeus vannamei[D].Xiamen:Jimei University, 2020.
[28] YU H L, CAO M J, CAI Q F, et al.Effects of different processing methods on digestibility of Scylla paramamosain allergen (tropomyosin)[J].Food and Chemical Toxicology, 2011, 49(4):791-798.
[29] LIU G M, CHENG H, NESBIT J B, et al.Effects of boiling on the IgE-binding properties of tropomyosin of shrimp (Litopenaeus vannamei)[J].Journal of Food Science, 2010, 75(1):T1-T5.
[30] LALY S J, SANKAR T V, PANDA S K.Effect of extended period of boiling on allergic protein of flower tail shrimp Metapenaeus dobsoni[J].Indian Journal of Fisheries, 2019, 66(3):110-115.
[31] MEJRHIT N, AZDAD O, CHDA A, et al.Evaluation of the sensitivity of Moroccans to shrimp tropomyosin and effect of heating and enzymatic treatments[J].Food and Agricultural Immunology, 2017, 28(6):969-980.
[32] USUI M, HARADA A, ISHIMARU T, et al.Contribution of structural reversibility to the heat stability of the tropomyosin shrimp allergen[J].Bioscience, Biotechnology, and Biochemistry, 2013, 77(5):948-953.
[33] ZEHI Z B, AFSHARI A, NOORI S M A, et al.The effects of X-ray irradiation on safety and nutritional value of food:A systematic review article[J].Current Pharmaceutical Biotechnology, 2020, 21(10):919-926.
[34] LI Z X, LIN H, CAO L M, et al.The influence of gamma irradiation on the allergenicity of shrimp (Penaeus vannamei)[J].Journal of Food Engineering, 2007, 79(3):945-949.
[35] WEI S, CHELLIAH R, OH D H, et al.Applications of Cold Plasma on Aquatic Products Applications of Cold Plasma in Food Safety[M].Singapore: Springer, 2022:243-267.
[36] CHAROUX C M G, PATANGE A, LAMBA S, et al.Applications of nonthermal plasma technology on safety and quality of dried food ingredients[J].Journal of Applied Microbiology, 2021, 130(2):325-340.
[37] SARANGAPANI C, PATANGE A, BOURKE P, et al.Recent advances in the application of cold plasma technology in foods[J].Annual Review of Food Science and Technology, 2018, 9:609-629.
[38] SHRIVER S K.Effect of selected nonthermal processing methods on the allergen reactivity of Atlantic white shrimp (Litopenaeus setiferus)[D].Florida:University of Florida, 2011.
[39] LI Z X, CAOLIMIN L, JAMIL K.Reduction of allergenic properties of shrimp (Penaeus vannamei) allergens by high intensity ultrasound[J].European Food Research and Technology, 2006, 223(5):639-644.
[40] LI X, LI Z, LIN H, et al.Effect of power ultrasound on the immunoactivity and texture changes of shrimp (Penaeus vannamei)[J].Czech Journal of Food Sciences, 2011, 29(5):508-514.
[41] LI Z X, LIN H, CAO L M, et al.Effect of high intensity ultrasound on the allergenicity of shrimp[J].Journal of Zhejiang University.Science.B, 2006, 7(4):251-256.
[42] CHEN H L, MAO H Y, CAO M J, et al.Purification, physicochemical and immunological characterization of arginine kinase, an allergen of crayfish (Procambarus clarkii)[J].Food and Chemical Toxicology, 2013, 62:475-484.
[43] SHRIVER S, YANG W D, CHUNG S Y, et al.Pulsed ultraviolet light reduces immunoglobulin E binding to Atlantic white shrimp (Litopenaeus setiferus) extract[J].International Journal of Environmental Research and Public Health, 2011, 8(7):2 569-2 583.
[44] LYU L T, AHMED I, QU X, et al.Effect of the structure and potential allergenicity of glycated tropomyosin, the shrimp allergen[J].International Journal of Food Science & Technology, 2022, 57(3):1 782-1 790.
[45] HAN X Y, YANG H, RAO S T, et al.The Maillard reaction reduced the sensitization of tropomyosin and arginine kinase from Scylla paramamosain, simultaneously[J].Journal of Agricultural and Food Chemistry, 2018, 66(11):2 934-2 943.
[46] ZHANG Z Y, LI X M, XIAO H, et al.Insight into the allergenicity of shrimp tropomyosin glycated by functional oligosaccharides containing advanced glycation end products[J].Food Chemistry, 2020, 302:125348.
[47] AHMED I, LIN H, LI Z X, et al.Tyrosinase/caffeic acid cross-linking alleviated shrimp (Metapenaeus ensis) tropomyosin-induced allergic responses by modulating the Th1/Th2 immunobalance[J].Food Chemistry, 2021, 340:127948.
[48] WANG Y B, NI S Q, WANG C, et al.Cross-linking of shrimp tropomyosin catalyzed by transglutaminase and tyrosinase produces hypoallergens for potential immunotherapy[J].Food & Function, 2019, 10(3):1 609-1 618.
[49] LIU G Y, HU M J, SUN L C, et al.Allergenicity and oral tolerance of enzymatic cross-linked tropomyosin evaluated using cell and mouse models[J].Journal of Agricultural and Food Chemistry, 2017, 65(10):2 205-2 213.
[50] LIU G M, HUANG Y Y, CAI Q F, et al.Comparative study of in vitro digestibility of major allergen, tropomyosin and other proteins between Grass prawn (Penaeus monodon) and Pacific white shrimp (Litopenaeus vannamei)[J].Journal of the Science of Food and Agriculture, 2011, 91(1):163-170.
[51] LYU L T, LIN H, LI Z X, et al.Allergenicity of acrolein-treated shrimp tropomyosin evaluated using RBL-2H3 cell and mouse model[J].Journal of the Science of Food and Agriculture, 2018, 98(11):4 374-4 378.
[52] SONG Y N, LI Z X, GAO Q, et al.Effect of malonaldehyde cross-linking on the ability of shrimp tropomyosin to elicit the release of inflammatory mediators and cytokines from activated RBL-2H3 cells[J].Journal of the Science of Food and Agriculture, 2016, 96(12):4 263-4 267.
[53] SONG Y N, LI Z X, LIN H, et al.Effect of malondialdehyde treatment on the IgE binding capacity and conformational structure of shrimp tropomyosin[J].Food Chemistry, 2015, 175:374-380.
[54] LYU L T, LIN H, LI Z X, et al.Determining the effect of malondialdehyde on the IgE-binding capacity of shrimp tropomyosin upon in vitro digestion[J].Journal of the Science of Food and Agriculture, 2017, 97(13):4 588-4 594.
[55] LIN H X, LI Z X, LIN H, et al.Effect of pH shifts on IgE-binding capacity and conformational structure of tropomyosin from short-neck clam (Ruditapes philippinarum)[J].Food Chemistry, 2015, 188:248-255.
[56] LASEKAN A, CAO H J, MALEKI S, et al.Shrimp tropomyosin retains antibody reactivity after exposure to acidic condition[J].Journal of the Science of Food and Agriculture, 2017, 97(11):3 623-3 630.
[57] PI X W, FU G M, DONG B, et al.Effects of fermentation with Bacillus natto on the allergenicity of peanut[J].LWT, 2021, 141:110862.
[58] PARK J G, SAEKI H, NAKAMURA A, et al.Allergenicity changes in raw shrimp (Acetes japonicus) and Saeujeot (salted and fermented shrimp) in cabbage Kimchi due to fermentation conditions[J].Food Sci.Biotechnol, 2007, 16(6):1 011-1 017.
[59] 王梦梦. 抑菌保鲜和加工方式对虾类主要过敏原原肌球蛋白免疫活性的影响[D].上海:上海海洋大学, 2019.
WANG M M.Effects of bacteriostasis preservation and processing methods on the immunological activity of major allergen tropomyosin in shrimp[D].Shanghai:Shanghai Ocean University, 2019.
[60] 李振兴. 虾(Penaeus vannamei)过敏原免疫活性的研究[D].青岛:中国海洋大学, 2006.
LI Z X.Study on the immunoreactivity of shrimp allergen[D].Qingdao:Ocean University of China, 2006.
[61] 胡志和, 谢丹丹.一种高压结合酶法制备低过敏原海虾仁的方法:CN102356891B[P].2013-01-02.
HU Z H, XIE D D. Method for preparing low allergen shrimp base material by enzyme method: CN102356891B[P]. 2013-01-02.