骨关节炎是全球范围内致残及致畸率较高的一种慢性、进行性疾病,以关节基质崩解、软骨细胞的减少为主要特征。公众对骨关节炎的关注度因人口老龄化的加快和预期寿命的延长而提高[1]。相关研究证实,骨关节炎对年轻人群体的影响日益显著,并对其生活质量产生负面影响。目前,治疗骨关节炎药物的主要作用途径是减轻疼痛,而未对内在软骨细胞及基质大分子的合成起到任何作用。尽管目前在改善骨关节炎方面应用了不同的替代疗法,如补充硫酸软骨素、葡萄糖胺等[2],但仍存在不足,葡萄糖胺干扰了葡萄糖运输和胰岛素分泌,导致高血糖和胰岛素抵抗。近年来,胶原蛋白的安全性已得到认证,且其对骨关节炎的改善带来了新的启发,从而弥补了上述疗法的不足[3]。然而,目前关于胶原蛋白治疗骨关节炎的研究还相对较少,本文系统综述了胶原蛋白在改善骨关节炎方面的研究进展,为胶原蛋白作为新的营养补充剂提供理论参考。
1 关节软骨与骨关节炎
软骨是一种特殊的、坚韧的、有弹性的组织,它覆盖在关节的长骨末端[4],具有低摩擦系数和光滑的关节表面。软骨由 90%的细胞外基质(extracellular matrix, ECM)和10%的软骨细胞组成。ECM包含大量的水[5],其余为有机物质。在软骨的有机物质中,主要的蛋白质是Ⅱ型胶原蛋白,其占软骨胶原蛋白的 90%~95%。因此,Ⅱ型胶原蛋白被认为是软骨的特征性胶原蛋白,具有促进软骨细胞分化的功能。软骨细胞是软骨中唯一的细胞结构,其过度凋亡会打破ECM合成和降解的平衡,可加快骨关节炎的发病进程[6]。作为最常见的关节疾病,骨关节炎主要是在机械和生物因素共同作用下,引起软骨细胞、ECM和软骨下骨的分解代谢和合成的失衡[7-8]。软骨细胞在调节合成代谢和分解代谢过程中起着中心作用,二者之间的平衡维持着软骨基质合成代谢和分解代谢的平衡,二者之间的失衡是ECM的降解和破坏的根本原因。
据统计,我国65岁以上膝骨关节炎患病率高达85%,且女性高于男性,致残率高达53%[9];到2050年,全球预计至少有 1.3亿人患骨关节炎[10-11]。骨关节炎主要影响负重关节,造成慢性疼痛和功能障碍[12],极大地降低了人们的生活质量[13-14],从而加快了衰老的步伐,最终可能导致患者过早死亡[15],但至今确切病因尚不清楚。
2 骨关节炎发病机制
骨关节炎潜在的病理特征比简单的软骨“磨损”更为复杂。它不是一种单一组织疾病,而是涉及整个关节的疾病[16]。随着骨关节炎的发展,软骨机制的平衡被打破,导致软骨结构破坏和软骨损伤。
2.1 结构成分的损失或破坏
骨关节炎的发病机制涉及多种途径之间的相互作用,其中,肥胖、衰老、创伤、重复性剧烈关节活动和遗传均是发病的危险因素。其中Ⅱ型胶原蛋白质的降低和量的减少是关节软骨丧失其正常生物力学特性的直接原因。如果软骨中的Ⅱ型胶原蛋白被破坏,则易使软骨细胞暴露,引起细胞机械性损伤,造成软骨结构的缺损和破坏,最终引发骨关节炎。
2.2 炎症因子
骨关节炎的临床症状与滑膜炎及软骨的损伤有关。在骨关节炎的发展过程中,关节软骨也会产生几种与转化生长因子-β(transforming growth factor-β,TGF-β)作用相反的促炎因子,如白细胞介素-1b(interleukin-1b,IL-1b)[17]、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和前列腺素E2。
这些促炎因子通过上调基质金属蛋白酶(matrix metalloproteases, MMPs)与蛋白聚糖酶等[18-19]多种分解代谢介质,来抑制ECM合成和降解酶的表达,从而影响关节软骨分解代谢[17],导致ECM降解,最终引起关节软骨损伤[20]。IL-1b 和 TNF-α上调软骨细胞中与软骨基质破坏相关的因子,如MMPs、诱导酶与自由基等,同时通过抑制软骨特异性基因的表达抑制软骨基质的合成[21]。

图1 促炎因子诱导关节损伤机制[21]
Fig.1 Mechanism of joint injury induced by pro-inflammatory factors[21]
2.3 软骨细胞衰老
年龄是骨关节炎的危险因素之一[22],骨关节炎与年龄增加引起的软骨细胞衰老及软骨损伤修复异常密切相关[23-24]。除此之外,衰老细胞能够加速软骨退变进程[24-25],这些相关的老化改变了基质的组成,使得软骨失去弹性,更易受外界损伤。GAO等[23]发现在膝骨关节炎受损软骨组织周围与衰老相关的 β-半乳糖苷酶染色阳性的软骨细胞增多,且阳性细胞数量与骨关节炎严重程度密切相关。XU等[26]将体外构建的带荧光标记的衰老软骨细胞移植入野生型小鼠膝关节中,通过 18-脱氧葡萄糖正电子发射断层扫描示踪衰老软骨细胞,移植衰老软骨细胞的小鼠表现出典型骨关节炎病理变化。由此可见,软骨细胞衰老在骨关节炎病理生理过程中发挥了重要作用,但调控软骨细胞衰老的具体机制暂不明确。JEON等[24]从接受全膝关节置换术的骨关节炎患者的软骨细胞中选择性去除衰老细胞,发现了衰老和炎症标志物的表达降低,同时软骨组织ECM蛋白的表达有所增加。
3 骨关节炎的营养补充剂——胶原蛋白及其水解物
3.1 营养补充剂
骨关节炎的治疗旨在控制疾病的发展进程,缓解疼痛,最终改善或维持软骨关节的正常功能。虽然传统的治疗药物(如阿司匹林和双氯芬酸[27-28])有一定的治疗效果,但长时间使用会产生一定的不良反应,例如皮疹、过敏、肾功能损害、心血管疾病风险增加以及胃肠道出血,限制了其作为临床一线药物的长期使用[29-30]。而营养补充剂则通过直接供应天然化合物,从而抑制或增强生物介质在维持身体结构和功能完整方面的作用。因此,在改善骨关节炎方面开始倾向于补充营养剂,包括补充硫酸软骨素、葡萄糖胺和透明质酸以及胶原衍生物,补充营养剂既可以缓解症状,又可以对软骨及软骨细胞起到调节作用[2]。目前,葡萄糖胺[31-32]和硫酸软骨素的联合应用来缓解疼痛和促进软骨再生最为常见[33-34]。然而,也有研究表明,葡萄糖胺会干扰葡萄糖运输和胰岛素分泌,进而导致高血糖和胰岛素抵抗[35],因此,其疗效有待进一步探究。
尽管目前在缓解骨关节炎相关疼痛和抑制炎症方面取得了重大进展,但依旧有很大的发展空间。现如今,人们更加关注健康饮食对疾病的预防作用,这不仅可以缓解病痛,还可以延缓疾病发展,且无毒副作用。由于口服使用的胶原蛋白可在肠道中被消化并可参与目标组织中的代谢过程,且胶原蛋白衍生产品(如明胶或水解胶原蛋白)的安全性已得到医疗界的认可[36]。近些年的研究也发现天然或水解胶原蛋白在治疗骨关节炎方面有积极作用[37]。胶原蛋白在症状治疗方面与非甾体类抗炎药相似,因此,胶原衍生物在改善骨关节炎方面值得深入探索。
3.2 胶原蛋白及其水解物
临床上用于骨关节炎治疗的三大胶原衍生物主要是基于胶原蛋白的不同水解程度来划分的,分别为明胶、水解胶原和天然未变性胶原。胶原蛋白是一种天然蛋白质,是ECM的主要蛋白质成分,其含有特定的氨基酸,即羟脯氨酸(hydroxyproline,Hyp)。虽然未变性Ⅱ型胶原已被证明可以保护关节[38-39],减少关节损伤的发生[40],但由于其高分子质量和三螺旋结构,口服摄入的天然胶原蛋白吸收效果不佳,而胶原蛋白水解物可以提高其吸收效果。
胶原蛋白水解物也被称为水解胶原蛋白(hydrolyzed collagen,CH),是天然胶原蛋白经过变性和水解,生成分子质量非常低(3~6 kDa)[41]的胶原肽,CH具有更高的生物利用度和溶解度,在传统医学中被用于改善血液循环和缓解骨关节炎相关的疼痛等。不同处理方法产生的CH具有不同的胶原肽序列和分子质量,这些差异可能影响其调节关节炎症和软骨下骨作用。它们以不同的组合和排列方式通过肽键共价连接,主要为含Gly-X-Y的重复结构。研究表明当胶原蛋白以三肽形式摄入时,水解产物能被人体有效吸收。CH独特的氨基酸组成和结构使其具有良好的稳定性和不同的蛋白酶裂解位点;且高含量脯氨酸的CH通常会因为裂解位点附近的脯氨酸残基,阻止蛋白酶进一步裂解肽键,从而提高了它们对消化酶和肠道肽酶的稳定性,因而更容易被小肠吸收。BELLO等[42]研究发现,C14标记的胶原水解物在血浆中的放射性达到最大浓度600 dpm/100 μL,这说明胶原蛋白在口服后可被肠道吸收[43]。WANG等[44]采用药代动力学方法测定Hyp在大鼠口服后的生物利用度,进一步证实了CH可以被小肠吸收。对健康志愿者给予不同剂量的CH,血液Hyp水平以剂量依赖的方式增加[45],Hyp在血液中不仅以游离氨基酸的形式存在,还以小肽的形式存在[46]。并且有研究表明,可以通过口服Ⅱ型胶原蛋白诱导自身免疫耐受,抑制关节炎[47]。这些研究结果更好地说明了胶原蛋白水解物在体内的吸收为其在骨关节炎治疗方面提供了可能性。
4 CH的作用
胶原蛋白无论其来源如何,包含19种氨基酸,包括Hyp,而Hyp不存在于其他蛋白质中[48]。氨基酸可在体内转化为其他生物活性化合物,如蛋氨酸转化为S-腺苷蛋氨酸,这已被证明可改善关节健康[49]。与生物活性肽一样,摄入CH后,餐后血浆氨基酸增加。值得注意的是,在摄入CH后,观察到血浆甘氨酸、脯氨酸、Hyp、赖氨酸和丙氨酸的增加[46],这些氨基酸在关节健康方面发挥了重要作用。

图2 胶原蛋白氨基酸序列
Fig.2 Amino acid sequence of collagen
4.1 体外刺激软骨细胞合成ECM大分子
ECM组成的变化会影响软骨细胞合成活性和降解活性的平衡。软骨细胞具有生成和维持胶原蛋白和蛋白聚糖等软骨基质的功能,负责ECM的合成、组织和维持。口服CH后,由于其分子质量较低,具有更高的生物利用度和溶解度,因此与未变性胶原蛋白相比,其更易被小肠吸收[41,46]。OESSER等[43]发现胶原蛋白肽以完整的肽形式(不再经酶裂解为氨基酸)直接通过小肠黏膜吸收,积聚在关节软骨,刺激产生Ⅱ型胶原蛋白(关节软骨的主要蛋白质)和蛋白多糖(软骨ECM)。
OESSER等[50]证实了降解的胶原对软骨细胞Ⅱ型胶原合成的刺激作用,并提出了软骨组织中胶原转换调节的可能反馈机制。他们在研究降解胶原对成熟牛软骨细胞形成Ⅱ型胶原的影响时发现,负责合成和维持软骨基质的软骨细胞在体外受到来自水解Ⅰ型胶原或水解Ⅱ型胶原的刺激时,产生Ⅱ型胶原,证实了降解胶原对软骨细胞Ⅱ型胶原生物合成的刺激作用。SCHUNCK等[51]在软骨细胞培养模型中,研究了CH对ECM大分子生物合成的效果,并比较了氨基葡萄糖硫酸盐(glucosamine sulfate,GS)和氨基葡萄糖盐酸盐(glucosamine hydrochloride,GH)的作用效果。在培养基中添加CH可使蛋白多糖合成量显著增加(P<0.05)。与对照细胞相比,CH处理后细胞相关蛋白多糖的数量几乎增加了1倍。服用CH也增加了聚集蛋白聚糖表达和Ⅱ型胶原生物合成,合成量显著增加了1.5倍(P<0.05)。相反,给予GS或GH对软骨细胞的Ⅱ型胶原生物合成没有刺激作用。上述结果表明CH对蛋白多糖和Ⅱ型胶原的合成有促进作用。同时也说明,GS和GH不能刺激软骨细胞合成ECM大分子。CH可能通过刺激软骨组织中的合成代谢过程来帮助减少ECM的退行性改变。
动物模型对于理解疾病进展和测试治疗的安全性和有效性至关重要。DAR等[52]研究了动物口服Ⅰ型胶原制剂的影响,在补充Ⅰ型胶原后发现Ⅰ型CH可刺激蛋白多糖和胶原蛋白的合成,证明了Ⅰ型胶原水解物在骨关节炎治疗中通过体外刺激软骨细胞增加蛋白多糖和胶原蛋白的合成来表现出对软骨的保护作用。
4.2 免疫调节
胶原蛋白肽可以通过T调节细胞(tregulatory cell, Treg)诱导和迁移到炎症和损伤区域来调节炎症因子的表达,Treg 的作用也与骨关节炎症状的缓和有关,BROERE等[53-54]研究发现 Treg 产生的抗炎细胞因子可刺激软骨细胞合成软骨基质成分,此外还在免疫调节中作为信号分子[41]。
在免疫调节方面, Treg 细胞通过 IL-10 的产生抑制炎症,IL-10 能通过下调单核细胞表面主要组织相容性抗原II的表达,降低其抗原呈递作用,下调T淋巴细胞活性抑制炎性细胞的激活、迁移和黏附;同时,IL-10 也能抑制炎症因子的合成与释放,从而在治疗中发挥作用。
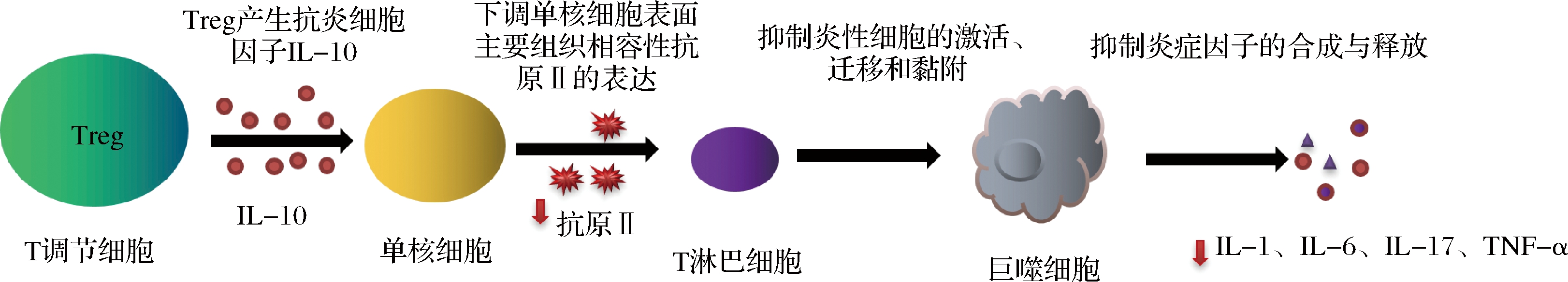
图3 胶原蛋白通过T调节细胞作用的抗炎机制[53, 55]
Fig.3 Anti-inflammatory mechanism of collagen regulating cell action through Treg[53, 55]
在动物模型中,张慧琴等[56]发现羊骨胶原蛋白肽作用于正常状态的巨噬细胞,可以提高其代谢活性、吞噬活性以及TNF-α、IL-6的分泌量,上调Toll样受体(Toll like receptor,TLR)通路相关基因表达量,通过TLRs信号通路对炎症免疫反应发挥双向调节作用。证明胶原蛋白肽可以通过对免疫细胞的调节在骨关节炎治疗中起到作用。
4.3 作为细胞外信号分子抑制软骨细胞肥大
最初,Ⅱ型胶原被认为只是软骨基质的一种结构成分,但最近LIAN等[55]研究发现Ⅱ型胶原也可以作为细胞外信号分子抑制软骨细胞肥大。软骨细胞的表型变化,如异常分化、肥大等,能够导致骨关节炎软骨基质降解[57-58],由于BMP-SMAD1信号的持续激活诱导周围部分软骨细胞发生肥大分化,下调COL2A1的表达,上调可分解现有COL2A1的MMPs。COL2A1的减少可阻止其对BMP-SMAD1通路的抑制,进一步加速软骨细胞肥大。软骨细胞肥大和软骨基质破坏可以从局灶性损伤传播到邻近的软骨,最终引起关节炎的发生。因而可以通过补充COL2A1,抑制BMP-SMAD1信号的激活,抑制软骨细胞肥大减缓骨关节炎的发生。

图4 Ⅱ型胶原(COL2A1)在BMP-SMAD1信号通路的作用机制[55]
Fig.4 Mechanism of action of type II collagen (COL2A1) in BMP-SMAD1 signaling pathway[55]
目前已有体外实验、动物实验以及人体实验研究证明了在骨关节炎病变中,CH有助于疼痛的缓解、软骨细胞的改善以及相关炎症因子的调节等,例如软骨面积、软骨细胞数量、Ⅱ型胶原蛋白水平的增加以及 MMP-13 和 CTX-II水平的降低[52,59],CTX-Ⅱ是软骨降解的生物标志物,表明结构性关节损伤的减少依赖于胶原蛋白。在对来自于猪的天然Ⅱ型胶原蛋白作为止痛剂和软骨保护剂有效性的研究中,经过治疗的动物尿和血浆中 CTX-Ⅱ水平降低[39],这一证据为进一步研究低剂量胶原蛋白的机制及其在骨关节炎治疗中的相关性提供了重要依据。Ⅱ型胶原蛋白可增加关节软骨的机械强度,有效减轻骨关节炎软骨损伤[60]。MA等[61]发现鸡胸骨软骨水解液能抑制软骨下骨异常表达,并以剂量依赖的方式防止骨赘形成,有效预防骨关节炎。通过抑制软骨细胞变化和胶原结构的破坏,来抑制胶原的降解,从而减轻软骨损伤。虽然胶原蛋白在治疗骨关节炎效应的潜在机制尚不明确,但这些研究数据为胶原蛋白在骨关节炎治疗方面提供了切实有效的证据,包括可以通过体外刺激软骨细胞合成ECM、调节免疫的表达和抑制软骨细胞肥大等。
5 结语
骨关节炎的病理发展受软骨基质中Ⅱ型胶原蛋白的降解的影响,Ⅱ型胶原蛋白的降解可破坏软骨基质网络结构,进而破坏ECM各成分的平衡。在胶原衍生物中,CH具有良好的生物利用度,其中高含量的脯氨酸和甘氨酸等氨基酸会影响软骨中胶原蛋白结构的稳定性,通过免疫调节抑制炎症因子的表达和抑制软骨细胞肥大。
近年来,国内外许多研究与临床试验结果都表明,CH可以通过肠道直接被吸收,适量补充CH可以促进体内胶原蛋白的合成,帮助维持胶原蛋白的稳态水平,在骨关节健康方面发挥积极的作用。因此,胶原蛋白可作为功能活性成分应用作营养膳食补充剂,用于改善因胶原蛋白缺失所引起的各种亚健康状态。相关研究还发现胶原蛋白和其他营养素在改善骨关节健康中存在协同作用。但目前针对不同人群的研究有限,此外,不同分子质量的胶原蛋白肽功效等问题也需要进行深入研究。且这些生物活性肽的分子靶标尚未完全阐明,其作用机制需要从分子生物学角度进一步验证。未来关于胶原蛋白肽与免疫、炎症的关系研究应更贴近基础生物医学,运用基因解析、组学、生物信息学等现代科技手段,对胶原蛋白肽如何提高免疫力、缓解炎症的分子机制进行探究。此外,临床观察实验也应重视,使用更为严谨的药代动力学评估胶原蛋白肽的适宜摄入量及潜在毒性。未来还需要更多的研究来阐明胶原蛋白的具体作用机制,以期为骨关节炎的治疗提供新的见解。
[1] SCHRIEBER R, GAREIS H.Gelatine handbook:Theory and industrial practice[M].Hoboken:Wiley, 2007.
[2] RAGLE R L, SAWITZKE A D.Nutraceuticals in the management of osteoarthritis:A critical review[J].Drugs & Aging, 2012, 29(9):717-731.
[3] 景淑萍. 胶原蛋白的安全性及其保健功能[J].甘肃高师学报, 2009, 14(5):82-83;89.
JING S P.On the safety of collagen and its application functions in healthcare industry[J].Journal of Gansu Normal Colleges, 2009, 14(5):82-83;89.
[4] 钱善华. 天然关节软骨的摩擦行为研究[D].徐州:中国矿业大学, 2009.
QIAN S H.Study on friction behavior about natural articular cartialge[D].Xuzhou:China University of Mining and Technology, 2009.
[5] JAABAR I, MICHE A, WANHERDRICK K, et al.Composition and structure of human cartilage extracellular matrix:Unravelling changes during osteoarthrosis at the nanoscale[J].Osteoarthritis and Cartilage, 2021, 29:S198.
[6] AIGNER T, SÖDER S, GEBHARD P M, et al.Mechanisms of Disease:Role of chondrocytes in the pathogenesis of osteoarthritis:Structure, chaos and senescence[J].Nature Clinical Practice Rheumatology, 2007, 3(7):391-399.
[7] MURPHY C A, GARG A K, SILVA-CORREIA J, et al.The Meniscus in normal and osteoarthritic tissues:Facing the structure property challenges and current treatment trends[J].Annual Review of Biomedical Engineering, 2019, 21:495-521.
[8] KIM H A, LEE Y J, SEONG S C, et al.Apoptotic chondrocyte death in human osteoarthritis[J].The Journal of Rheumatology, 2000, 27(2):455-462.
[9] 王斌, 邢丹, 董圣杰, 等.中国膝骨关节炎流行病学和疾病负担的系统评价[J].中国循证医学杂志, 2018, 18(2):134-142.
WANG B, XING D, DONG S J, et al.Prevalence and disease burden of knee osteoarthritis in China:A systematic review[J].Chinese Journal of Evidence-Based Medicine, 2018, 18(2):134-142.
[10] MAIESE K.Picking a bone with WISP1 (CCN4):New strategies against degenerative joint disease[J].Journal of Translational Science, 2016, 1(3):83-85.
[11] LEONG D J, CHOUDHURY M, HIRSH D M, et al.Nutraceuticals:potential for chondroprotection and molecular targeting of osteoarthritis[J].International Journal of Molecular Sciences, 2013, 14(11):23 063-23 085.
[12] NEOGI T.The epidemiology and impact of pain in osteoarthritis[J].Osteoarthritis and Cartilage, 2013, 21(9):1 145-1 153.
[13] LITWIC A, EDWARDS M H, DENNISON E M, et al.Epidemiology and burden of osteoarthritis[J].British Medical Bulletin, 2013, 105:185-199.
[14] BERTHELOT G, JOHNSON S, NOIREZ P, et al.The age-performance relationship in the general population and strategies to delay age related decline in performance[J].Archives of Public Health, 2019, 77:51.
[15] SALMON J H, RAT A C, SELLAM J, et al.Economic impact of lower-limb osteoarthritis worldwide:A systematic review of cost-of-illness studies[J].Osteoarthritis and Cartilage, 2016, 24(9):1 500-1 508.
[16] MOBASHERI A.The future of osteoarthritis therapeutics:Emerging biological therapy[J].Current Rheumatology Reports, 2013, 15(12):1-9.
[17] 高宗强, 郭雄, 陈君长, 等.大骨节病、骨关节炎软骨细胞分泌IL-1β、TNF-α及透明质酸对其影响实验研究[J].陕西医学杂志, 2015, 44(7):774-778.
GAO Z Q, GUO X, CHEN J C, et al.The effect of hyluronic acid on the expression of IL-1β, TNF-α in chondrocytes of Kashin-beck disease and osteoarthritis cultured in vitro[J].Shaanxi Medical Journal, 2015, 44(7):774-778.
[18] MALEMUD C J.Anticytokine therapy for osteoarthritis:Evidence to date[J].Drugs & Aging, 2010, 27(2):95-115.
[19] GOLDRING M B.Anticytokine therapy for osteoarthritis[J].Expert Opinion on Biological Therapy, 2001, 1(5):817-829.
[20] ZHOU X R, YANG H J, GUAN F, et al.T-2 toxin alters the levels of collagen II and its regulatory enzymes MMPs/TIMP-1 in a low-selenium rat model of kashin-beck disease[J].Biological Trace Element Research, 2016, 169(2):237-246.
[21] TONG T, ZHAO W, WU Y Q, et al.Chicken type II collagen induced immune balance of main subtype of helper T cells in mesenteric lymph node lymphocytes in rats with collagen-induced arthritis[J].Inflammation Research, 2010, 59(5):369-377.
[22] PRIETO-ALHAMBRA D, JUDGE A, JAVAID M K, et al.Incidence and risk factors for clinically diagnosed knee, hip and hand osteoarthritis:Influences of age, gender and osteoarthritis affecting other joints[J].Annals of the Rheumatic Diseases, 2014, 73(9):1 659-1 664.
[23] GAO S G, ZENG C, LI L J, et al.Correlation between senescence-associated beta-galactosidase expression in articular cartilage and disease severity of patients with knee osteoarthritis[J].International Journal of Rheumatic Diseases, 2016, 19(3):226-232.
[24] JEON O H, KIM C, LABERGE R M,et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment[J]. Nature Medicine, 2017,23(6): 775-781.
[25] CHILDS B G, GLUSCEVIC M, BAKER D J, et al.Senescent cells:An emerging target for diseases of ageing[J].Nature Reviews Drug Discovery, 2017, 16(10):718-735.
[26] XU M, BRADLEY E W, WEIVODA M M, et al.Transplanted senescent cells induce an osteoarthritis-like condition in mice[J].The Journals of Gerontology:Series A, 2016, 72(6):780-785.
[27] SHEN X H, CUI Y.Progress in traditional Chinese and Western medicine treatments and nursing care of knee osteoarthritis[J].Chinese Nursing Research, 2015, 2(2-3):71-74.
[28] DEHGHAN M, SAFFARI M, RAFIEIAN-KOPAEI M, et al.Comparison of the effect of topical Hedera helix L.extract gel to diclofenac gel in the treatment of knee osteoarthritis[J].Journal of Herbal Medicine, 2020, 22:100350.
[29] UNGPRASERT P, CHEUNGPASITPORN W, CROWSON C S, et al.Individual non-steroidal anti-inflammatory drugs and risk of acute kidney injury:A systematic review and meta-analysis of observational studies[J].European Journal of Internal Medicine, 2015, 26(4):285-291.
[30] CATELLA-LAWSON F, REILLY M P, KAPOOR S C, et al.Cyclooxygenase inhibitors and the antiplatelet effects of aspirin[J].The New England Journal of Medicine, 2001, 345(25):1 809-1 817.
[31] UEBELHART D.Clinical review of chondroitin sulfate in osteoarthritis[J].Osteoarthritis and Cartilage, 2008, 16:S19-S21.
[32] LIU Q, WANG J F, SUN Y J, et al.Chondroitin sulfate from sturgeon bone protects chondrocytes via inhibiting apoptosis in osteoarthritis[J].International Journal of Biological Macromolecules, 2019, 134:1 113-1 119.
[33] DEAL C L, MOSKOWITZ R W.Nutraceuticals as therapeutic agents in osteoarthritis.The role of glucosamine, chondroitin sulfate, and collagen hydrolysate[J].Rheum Dis Clin North Am, 1999, 25(2):379-395.
[34] HOUPT J B, MCMILLAN R, WEIN C, et al.Effect of glucosamine hydrochloride in the treatment of pain of osteoarthritis of the knee[J].The Journal of Rheumatology, 1999, 26(11):2 423-2 430.
[35] WANDEL S, JÜNI P, TENDAL B, et al.Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee:Network meta-analysis[J].BMJ (Clinical Research Ed.), 2010, 341:c4675.
[36] GARZON C, MIHAILOVIC A, JIAN-YU E, et al.Evaluation of away-from-home excursion patterns after falling among individuals with glaucoma:A longitudinal study[J].BMC Geriatrics, 2022, 22(1):101.
[37] ADAM M.Therapie der osteoarthrose-welche wirkung haben gelantinepraparate? [J].Therapiewoche, 1991, 41.
[38] NAGLER-ANDERSON C, BOBER L A, ROBINSON M E, et al.Suppression of type II collagen-induced arthritis by intragastric administration of soluble type II collagen[J].Evidence-Based Complementary and Alternative Medicine, 1986, 83(19):7 443-7 446.
[39] DI CESARE MANNELLI L, MICHELI L, ZANARDELLI M, et al.Low dose native type II collagen prevents pain in a rat osteoarthritis model[J].BMC Musculoskeletal Disorders, 2013, 14:228.
[40] ASNAGLI H, MARTIRE D, BELMONTE N, et al.Type 1 regulatory T cells specific for collagen type II as an efficient cell-based therapy in arthritis[J].Arthritis Research & Therapy, 2014, 16(3):R115.
[41] LE N-L
N-L PEZ A, MORALES-PE
PEZ A, MORALES-PE ALOZA A, MART
ALOZA A, MART NEZ-JU
NEZ-JU REZ V M, et al.Hydrolyzed collagen-sources and applications[J].Molecules (Basel, Switzerland), 2019, 24(22):E4031.
REZ V M, et al.Hydrolyzed collagen-sources and applications[J].Molecules (Basel, Switzerland), 2019, 24(22):E4031.
[42] BELLO A E, OESSER S.Collagen hydrolysate for the treatment of osteoarthritis and other joint disorders:A review of the literature[J].Current Medical Research and Opinion, 2006, 22(11):2 221-2 232.
[43] OESSER S, ADAM M, BABEL W, et al.Oral administration of 14C labeled gelatin hydrolysate leads to an accumulation of radioactivity in cartilage of mice (C57/BL)[J].The Journal of Nutrition, 1999, 129(10):1 891-1 895.
[44] WANG L, WANG Q, QIAN J, et al.Bioavailability and bioavailable forms of collagen after oral administration to rats[J].J Agric Food Chem, 2015, 63(14):3 752-3 756.
[45] SHIGEMURA Y, KUBOMURA D, SATO Y, et al.Dose-dependent changes in the levels of free and peptide forms of hydroxyproline in human plasma after collagen hydrolysate ingestion[J].Food Chemistry, 2014, 159:328-332.
[46] ICHIKAWA S, MORIFUJI M, OHARA H, et al.Hydroxyproline-containing dipeptides and tripeptides quantified at high concentration in human blood after oral administration of gelatin hydrolysate[J].International Journal of Food Sciences and Nutrition, 2010, 61(1):52-60.
[47] SKOV K, OXFELDT M, THØGERSEN R, et al.Enzymatic hydrolysis of a collagen hydrolysate enhances postprandial absorption rate:A randomized controlled trial[J].Nutrients, 2019, 11(5):E1064.
[48] GAUZA-W ODARCZYK M, KUBISZ L, W
ODARCZYK M, KUBISZ L, W ODARCZYK D.Amino acid composition in determination of collagen origin and assessment of physical factors effects[J].International Journal of Biological Macromolecules, 2017, 104:987-991.
ODARCZYK D.Amino acid composition in determination of collagen origin and assessment of physical factors effects[J].International Journal of Biological Macromolecules, 2017, 104:987-991.
[49] LI Y S, XIAO W F, LUO W, et al.Alterations of amino acid metabolism in osteoarthritis:Its implications for nutrition and health[J].Amino Acids, 2016, 48(4):907-914.
[50] OESSER S, SEIFERT J.Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen[J].Cell and Tissue Research, 2003, 311(3):393-399.
[51] SCHUNCK M, SCHULZE C H, OESSER S.p199 disparate efficacy of collagen hydrolysate and glucosamine on the extracellular matrix metabolism of articular chondrocytes[J].Osteoarthritis and Cartilage, 2006, 14:S114.
[52] DAR Q A, SCHOTT E M, CATHELINE S E, et al.Daily oral consumption of hydrolyzed type 1 collagen is chondroprotective and anti-inflammatory in murine posttraumatic osteoarthritis[J].PLoS One, 2017, 12(4):e0174705.
[53] BROERE F, WIETEN L, KLEIN KOERKAMP E I, et al.Oral or nasal antigen induces regulatory T cells that suppress arthritis and proliferation of arthritogenic T cells in joint draining lymph nodes[J].Journal of Immunology, 2008, 181(2):899-906.
[54] PAUL C, LESER S, OESSER S.Significant amounts of functional collagen peptides can be incorporated in the diet while maintaining indispensable amino acid balance[J].Nutrients, 2019, 11(5):E1079.
[55] LIAN C, WANG X, QIU X, et al.Collagen type II suppresses articular chondrocyte hypertrophy and osteoarthritis progression by promoting integrin β1-SMAD1 interaction[J].Bone Research, 2019, 7:8.
[56] 张慧琴, 霍乃蕊, 冀霞, 等.羊骨胶原肽对大鼠腹腔巨噬细胞免疫能力的影响[J].中国实验动物学报, 2021, 29(2):176-182.
ZHANG H Q, HUO N R, JI X, et al.Effect of sheep bone collagen peptide on immune function in rat peritoneal macrophages[J].Acta Laboratorium Animalis Scientia Sinica, 2021, 29(2):176-182.
[57] VAN DER KRAAN P M, VAN DEN BERG W B.Chondrocyte hypertrophy and osteoarthritis:Role in initiation and progression of cartilage degeneration? [J].Osteoarthritis and Cartilage, 2012, 20(3):223-232.
[58] CUI Z, CRANE J, XIE H, et al.Halofuginone attenuates osteoarthritis by inhibition of TGF-β activity and H-type vessel formation in subchondral bone[J].Ann ls of the Rhenmatic Diseases, 2016, 75(9):1 714-1 721.
ls of the Rhenmatic Diseases, 2016, 75(9):1 714-1 721.
[59] VAN DE WATER E, OOSTERLINCK M, DUMOULIN M, et al.The preventive effects of two nutraceuticals on experimentally induced acute synovitis[J].Equine Veterinary Journal, 2017, 49(4):532-538.
[60] ISAKA S, SOMEYA A, NAKAMURA S, et al.Evaluation of the effect of oral administration of collagen peptides on an experimental rat osteoarthritis model[J].Pharmaceutics, 2017, 13(6):2 699-2 706.
[61] MA C C, YU M X, HUANG Z J, et al.Oral administration of hydrolysates of cartilage extract in the prevention of osteoarthritis[J].Journal of Functional Foods, 2021, 78:104376.