缬氨酸属于支链氨基酸,具有促进哺乳动物乳腺细胞的发育、改善动物的免疫状态及加快肌肉组织修复的作用,广泛应用于医药、食品和饲料等行业[1-4]。目前工业上主要通过微生物发酵法生产缬氨酸,随着缬氨酸市场需求的不断增加,持续优化生产菌株的发酵性能、开发更为经济高效的发酵工艺以提高缬氨酸的生产效率也日益引起研究者的关注。
近年来,通过诱变筛选和系统代谢工程的方法已经获得了几种高产缬氨酸的谷氨酸棒杆菌和大肠杆菌菌株,这些菌株的主要构建策略包括解除反馈调控,增强关键酶表达,减弱竞争途径,改善氧化还原平衡,促进产物外排等[5-8]。同大部分的氨基酸发酵过程相同,缬氨酸最初主要是通过好氧发酵获得,但是好氧发酵过程中,相当多的物质和能量会进入三羧酸(tricarboxylic acid,TCA)循环用于细胞的生长,从而降低了底物的利用效率和产品的转化率。厌氧条件下,TCA循环被阻断,物质和能量的消耗大幅降低,从而会提高底物的利用率与产品转化率,但是容易造成还原力循环不畅而使细胞代谢失衡[9-10]。为此研究者通过改变缬氨酸合成途径辅因子的偏好性,促进还原力的平衡,使细胞能够在厌氧条件下高效产酸[7]。然而,厌氧条件下由于糖酵解(Embden-Meyerhof-Parnas,EMP)途径溢流以及还原TCA途经的加强,会导致丙氨酸、乳酸、乙酸、琥珀酸等副产物的积累,并且由于ATP供应不足等原因会导致菌体生长活力差[11-13]。为了解决这些问题,一方面可通过代谢工程的方法对其副产物合成途径进行阻断。如HASEGAWA等[14]通过敲除产缬氨酸谷氨酸棒杆菌中的ldhA、ppc基因有效地降低了乳酸和琥珀酸的积累;HAO等[8]通过敲除产缬氨酸大肠杆菌中的adhE、ldhA、pflB基因有效地阻断了乙醇、乳酸和甲酸的合成。另一方面也可通过发酵过程控制,特别是溶氧条件的优化降低副产物。STEINSIEK等[15]证实了胞内副产物有机酸生成速率随氧气的增加而降低。ZOU等[16]在利用大肠杆菌产泛酸的过程中发现相比于厌氧发酵,微溶氧条件下有机酸的积累显著降低。
课题组在前期的研究中,通过增强缬氨酸合成途径和输出系统,提高前体物供应,同时将合成途径的辅因子需求从NADPH改变为NADH,构建了1株高产缬氨酸的大肠杆菌菌株VHY18,并开发了一种新型好氧-限氧双阶段发酵工艺,5 L罐上可生产84 g/L缬氨酸,转化率达到了0.41 g/g葡萄糖,生产强度为2.33 g/(L·h)[8]。但该菌株在发酵过程中乙酸和琥珀酸大量积累,菌体生长活力明显衰退,限制了发酵性能的进一步提升。针对这些问题,本研究首先通过基因敲除的方法阻断了乙酸和琥珀酸的主要合成途径,显著减弱了乙酸和琥珀酸合成。接着,通过发酵工艺的优化进一步降低了琥珀酸和乙酸的积累量,并提升了菌株生长稳定性及缬氨酸产率。最终所得菌株在优化后的发酵工艺控制下,副产物琥珀酸和乙酸的积累量降低至1.2和2.7 g/L,缬氨酸产量和转化率分别提升至90.4 g/L和0.53 g/g葡萄糖,具有很好的工业化应用前景。
1 材料与方法
1.1 菌株、质粒及主要试剂
本研究所涉及的菌株及质粒如表1所示。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study

菌株/质粒基因型来源E.coli DH5αCloning host本实验室VHY18E.coli W3110, △lacI, ycdN::Ptrc-alsS, ydeU::Ptrc-alsS, yjiV::Ptrc-il-vED, yjiT::Ptrc-brnFE,yeeP::Ptrc-spoT[R290E, K292D], ycjV::pntAB, △ldhA, △adhE, △pflB, Ptrc- ilvE::Ptrc-bcdBsu, ilvE::Ptrc-bcdBsu, ycgh::Ptrc-ilvCM, ilvC::Ptrc-ilvCM本实验室VHY18-1VHY18, △poxB本研究VHY18-2VHY18, △ackA本研究VHY19VHY18-1, △ackA本研究VHY20VHY19, △mdh本研究pREDCas9Sper, Cas9 and λ-Red recombinase expres-sion vector[17]pGRBAmpr, gRNA expression vector[17]
引物均由苏州金唯智科技有限公司合成;Primer STAR HS DNA聚合酶,大连宝生物科技有限公司;2×Rapid Taq Mix、ClonExpress® II One Step Cloning Kit,南京诺唯赞生物科技有限公司;质粒快速提取试剂盒、DNA凝胶纯化回收试剂盒,美国Omega公司;其余生化试剂为进口或国产分析纯试剂。
1.2 培养基
斜面培养基(g/L):葡萄糖1,蛋白胨10,牛肉膏10,酵母粉5,NaCl 2.5,琼脂25。
发酵培养基(g/L):葡萄糖10,酵母粉2,蛋白胨2,K2HPO4 7,(NH4)2SO4 3,柠檬酸1,MgSO4·7H2O 2,FeSO4·7H2O 0.03,MnSO4 0.01,维生素B1、维生素B3、维生素B5、维生素B12、维生素H各0.001。
1.3 基因敲除
利用CRISPR/Cas9基因编辑技术[17]对菌株mdh、poxB和ackA基因实施敲除,所涉及的引物如表2所示。具体步骤以mdh基因的敲除为例:通过primer 5设计mdh基因位点的上游同源臂引物(UP-mdh-S、UP-mdh-A)和下游同源臂引物(DN-mdh-S、DN-mdh-A)。以E.coli W3110基因组为模板通过PCR扩增获得上下游同源臂片段,上述片段通过重叠PCR的方法融合,获得用于mdh基因敲除的重组片段;构建含有靶位点的pGRB-mdh质粒:使用引物gRNA-mdh-S和gRNA-mdh-A退火制得包含PAM基因靶位点的片段,将其与线性化pGRB连接后化转至E.coli DH5α化转感受态,挑取阳性菌落得到pGRB-mdh质粒;制备E.coli VHY19的感受态细胞,先将pREDCas9质粒化转至E.coli VHY19中后,再制备感受态同时将mdh重组片段和pGRB-mdh质粒同时电转至感受态细胞中,于32 ℃培养,待长出单菌落,经菌落PCR鉴定筛选出阳性转化子,再消除pGRB-mdh和pREDCas9质粒,获得菌株E.coli VHY20。
表2 本研究所用引物
Table 2 Primers used in this study

引物序列(5'- 3')UP-mdh-S TGTTGTTTTGGCTGAACGGTAGUP-mdh-A ATCTTTCTTCAGCGTATCCAGCACGGAGTCGCATCTTCACCAGDN-mdh-S CTGGTGAAGATGCGACTCCGTGCTGGATACGCTGAAGAAAGATDN-mdh-A CTTTGCGATTCCTTTCCAGTTAGUP-poxB-S TGGATTGGGTAGAGCAGGAAGTUP-poxB-A AACTCTTCTTTGGCGACCACCGACCGCCAGTTCTCCGCTADN-poxB-S TAGCGGAGAACTGGCGGTCGGTGGTCGCCAAAGAAGAGTTDN-poxB-A TTCATCGCCACTTTATCCAGCUP-ackA-S ACAACTCAGCGGGACAACGTUP-ackA-A CCGCTTCCTGGGTTACATAGAAGCCGCTTCCTGTTTATTGCDN-ackA-S GCAATAAACAGGAAGCGGCTTCTATGTAACCCAGGAAGCGGDN-ackA-A GCGGCTGAGCGATAGGTTTgRNA-mdh-S AGTCCTAGGTATAATACTAGTGATGTCGT-TCTTATCTCTGCGTTTTAGAGCTAGAAgRNA-mdh-A TTCTAGCTCTAAAACGCAGAGATA-AGAACGACATCACTAGTATTATACCTAGGACTgRNA-poxB-S AGTCCTAGGTATAATACTAGTGGCAACCT-GCACTTAATCAAGTTTTAGAGCTAGAAgRNA-poxB-A TTCTAGCTCTAAAACTTGATTAAGTGCAG-GTTGCCACTAGTATTATACCTAGGACTgRNA-ackA-S AGTCCTAGGTATAATACTAGTTCTGCG-CAGCTGACTGCTATGTTTTAGAGCTAGAAgRNA-ackA-A TTCTAGCTCTAAAACATAGCAGTCAGCT-GCGCAGAACTAGTATTATACCTAGGACT
1.4 双阶段发酵工艺
菌株经两代斜面培养活化后,用100 mL无菌水将菌体转接至装有2.4 L发酵培养基的5 L发酵罐中进行发酵,发酵过程中控制pH值7.0,温度35 ℃,发酵前期通过转速和风量的调整控制相对溶氧值为25%~35%,待发酵至16 h将转速调整为200 r/min并阻断通风[8](工艺优化过程详见结果与分析)。当罐中的葡萄糖耗尽时,开始以一定的速率流加800 g/L的葡萄糖溶液,维持罐中葡萄糖质量浓度在0.1~2 g/L。
1.5 检测方法
利用分光光度计测定波长600 nm下发酵液的吸光度来检测过程生物量;采用SBA-40E生物传感器检测发酵液中的葡萄糖浓度;采用高效液相色谱法检测发酵液中缬氨酸含量:色谱柱为Agilent ZORBAX Eclipse AAA(4.6 mm×150 mm,5-Micron),样品利用2,4-二硝基氟苯衍生,以体积分数50%的乙腈溶液和50 mmol/L的乙酸钠水溶液进行梯度洗脱[18],流速1 mL/min,检测波长360 nm,柱温33 ℃;采用高效液相色谱法检测发酵液中有机酸含量:色谱柱为Bio-Rad Aminex HPX-87H(300 mm×7.8 mm),检测器为RID-20A示差检测器,流动相为5 mmol/L H2SO4,流速0.5 mL/min,柱温37 ℃。
1.6 数据分析方法
发酵数据代表3组平行发酵数据的平均值和标准差。利用T检验双尾分布对2组发酵参数进行单向方差分析。*表示P<0.05,表示差异显著;**表示P<0.01,表示差异极其显著。
2 结果与分析
工程菌株VHY18是课题组前期构建的可以在限氧条件下高产缬氨酸的工程菌株,但该菌株在发酵过程中会大量积累副产物乙酸(~12 g/L)和琥珀酸(~26 g/L),并且在限氧发酵阶段生长活力会显著降低,从而限制了菌株的缬氨酸发酵性能。为解决该问题,本研究对VHY18进行代谢工程改造并对发酵工艺进行了优化。
2.1 阻断乙酸和琥珀酸合成途径
2.1.1 ackA和poxB基因敲除对缬氨酸发酵的影响
大肠杆菌合成乙酸的主要途径有2条,一条是由丙酮酸氧化酶(poxB基因编码)催化丙酮酸生成乙酸,另一条途径是由磷酸转乙酰酶(pta基因编码)和乙酸激酶(ackA基因编码)催化乙酰辅酶A生成乙酸,其中磷酸转乙酰酶(pta基因编码)的阻断会限制乙酰磷酸的生成,对细胞生长有较大的的影响[19-20]。为此本研究对VHY18中的poxB和ackA基因进行了单敲除和组合敲除,分别得到工程菌VHY18-1、VHY18-2和VHY19,并通过发酵罐发酵的方式考察了poxB和ackA基因单独敲除与组合敲除对缬氨酸发酵的影响。VHY18、VHY18-1、VHY18-2和VHY19在5 L发酵罐上进行好氧-限氧双阶段发酵,菌体生长、缬氨酸产量及副产物积累情况见图1。
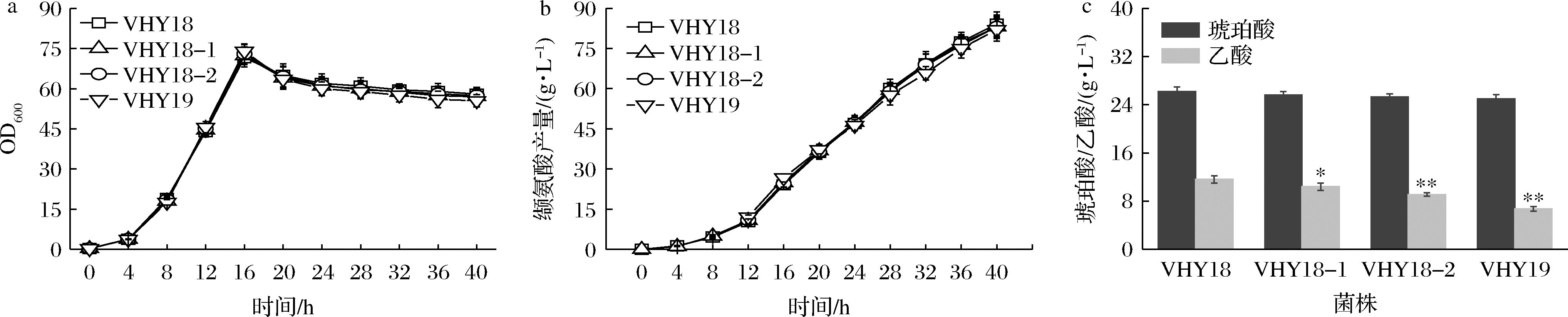
a-菌体生长曲线;b-缬氨酸产量曲线;c-副产物浓度
图1 VHY18、VHY18-1、VHY18-2和VHY19在5 L发酵罐上的发酵结果
Fig.1 Fermentation results of the strain VHY18, VHY18-1, VHY18-2 and VHY19 in a 5 L bioreactor
发酵结果显示,VHY18-1、VHY18-2和VHY19三株菌的菌体生长(图1-a)和缬氨酸产量(图1-b)与对照菌VHY18相比并无显著差别,最终琥珀酸的积累量也相当(图1-c)。至发酵结束时,VHY18-1、VHY18-2和VHY19发酵液中乙酸质量浓度分别为10.4、9.1和6.7 g/L,较VHY18(11.9 g/L)分别降低了12.6%、23.5%和43.7%(图1-c),该结果显示poxB和ackA基因的敲除均可降低乙酸浓度,特别是2个基因的组合敲除效果更佳,这与PARIMI等[21]在研究poxB、ackA基因敲除对影响副产物乙酸浓度的结果一致,说明poxB和ackA基因的敲除有效降低了乙酸的合成通量,从而使乙酸的积累量显著降低。
2.1.2 mdh基因敲除对缬氨酸发酵的影响
大肠杆菌在限氧过程中由前体物草酰乙酸经3步反应合成琥珀酸,其中苹果酸脱氢酶(mdh基因编码)是第一步关键酶[22-23]。为降低琥珀酸的合成,本研究敲除了VHY19中的mdh基因,得到工程菌VHY20,并通过发酵罐发酵的方式考察了mdh基因敲除对缬氨酸发酵的影响。VHY19和VHY20在5 L发酵罐上进行好氧-限氧双阶段发酵,菌体生长、缬氨酸产量及副产物积累情况见图2。

a-菌体生长曲线;b-缬氨酸产量曲线;c-副产物浓度
图2 VHY20与VHY19在5 L发酵罐上的发酵结果
Fig.2 Fermentation results of the strain VHY20 and VHY19 in a 5 L bioreactor
从2株菌的生长曲线对比来看(图2-a),VHY20生长速率较VHY19明显降低,培养至16 h时VHY20的OD600为42.3,较VHY19(72)降低了41.2%,可能是mdh基因的敲除干扰了TCA循环,造成细胞生长代谢受阻。发酵结束时,2株菌发酵液中乙酸浓度没有明显差别,但VHY20的琥珀酸质量浓度为12.1 g/L,较VHY19(24.4 g/L)降低了50.8%,该结果与KIM等[22]在研究不同苹果酸脱氢酶活性对影响琥珀酸生成的结果一致,说明mdh基因的敲除有效降低了还原TCA循环的通量,从而使琥珀酸的积累量显著降低。另外,由于mdh基因的敲除影响了菌体的生长,VHY20在好氧发酵阶段(0~16 h)缬氨酸的产量(13.2 g/L)较VHY19(25.5 g/L)降低了48.2%(图2-b),但是因为竞争途径减弱,更多的丙酮酸可以流向缬氨酸的合成,因此VHY20在限氧发酵阶段(16~40 h)产酸能力加强,在该阶段VHY20缬氨酸总的积累量为68.3 g/L,与对照菌(59.4 g/L)相比提高了14.9%,最终2株菌的缬氨酸产量相当。由于副产物琥珀酸积累量的大幅下降,VHY20的缬氨酸糖酸转化率(0.41 g/g葡萄糖)较VHY19(0.39 g/g葡萄糖)也稍有提升。总之,通过敲除mdh基因虽使好氧发酵阶段菌体的生长受阻,但大幅降低了限氧发酵阶段琥珀酸的积累,提高了菌体缬氨酸生产性能。
前述通过3个基因的敲除部分阻断了乙酸和琥珀酸的合成途径,有效降低了2种副产物的积累。但发酵液中仍有较多乙酸和琥珀酸,然而完全阻断乙酸和琥珀酸合成途径可能会严重阻碍菌体生长[24-25]。有机酸的大量积累是菌体在限氧条件下的应激反应,许多研究证实改善溶氧条件可以有效降低限氧发酵过程中有机酸等副产物的积累[15],并协调菌体生长与产物生产之间的代谢平衡[26],为此,本研究继续对VHY20在限氧条件下的发酵条件进行了优化,以进一步降低副产物积累,促进缬氨酸生产。
2.2 发酵过程工艺的优化
溶氧是协调限氧条件下菌体生长,产物合成和副产物积累的关键因素。而发酵液中的溶氧量和供氧条件(搅拌转速、通风量等)、菌体浓度及活力以及底物葡萄糖的供应息息相关。为此,本研究从限氧发酵过程中的供氧条件,溶氧条件转换时机(决定最终菌体浓度)和葡萄糖流加速率3个方面对VHY20的发酵工艺进行了系统优化。
2.2.1 限氧发酵阶段供氧条件的优化
最初的双阶段发酵工艺在菌体好氧培养到16 h后停止通入无菌空气,并将转速降至200 r/min,开始进行限氧发酵,过程中有机酸副产物积累,菌体活力衰退。本研究考虑适当提高第2阶段发酵过程中的供氧量,以降低副产物的积累,并提升菌体生长活力。共设置了4种供氧条件:A1(转速200 r/min、不通风)、A2(转速400 r/min、通风量1 L/min)、A3(转速400 r/min、通风量2 L/min)和A4(转速500 r/min、通风量2 L/min),其中条件A1为初始工艺,作为对照。4种控制工艺下,菌体生长、缬氨酸产量及副产物积累情况见图3。
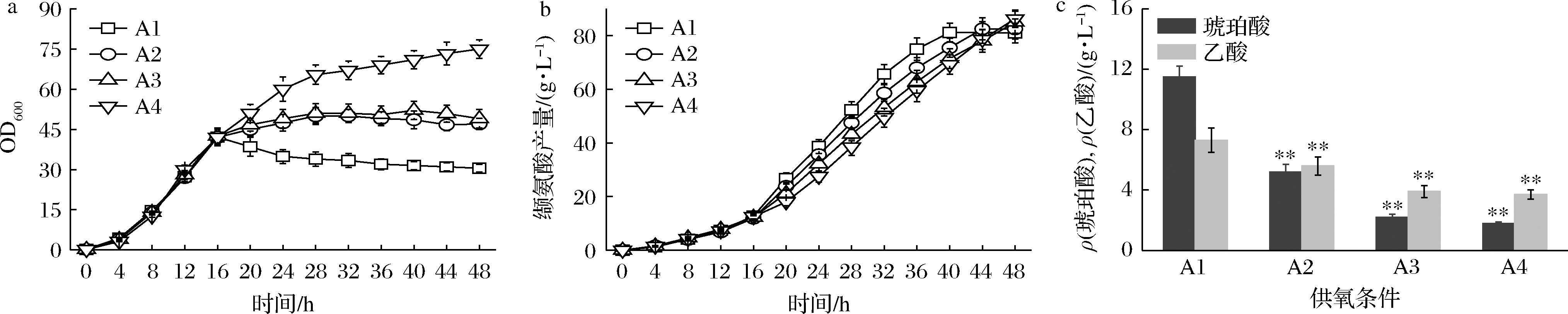
a-菌体生长曲线;b-缬氨酸产量曲线;c-副产物浓度
图3 四种供氧控制工艺下VHY20在5 L发酵罐上的发酵结果
Fig.3 Fermentation results of VHY20 in a 5 L bioreactor under the four processes
从图3-a可知,初始工艺下,限氧发酵阶段OD600值会持续下降,而提高该阶段的供氧条件后(A2和A3),后期OD600会逐渐趋于稳定,进一步提高供氧条件为A4时,菌体表现出持续生长的趋势,最终的OD600值(75.6)较初始工艺(31.5)提高了140%。从图3-c可知,随着限氧发酵阶段供氧条件的提升,琥珀酸及乙酸浓度呈逐渐降低的趋势,供氧条件设置为A4时,发酵液中最终的琥珀酸及乙酸质量浓度分别为1.8和3.7 g/L,较初始工艺(A1,琥珀酸和乙酸浓度为11.5和7.3 g/L)分别降低了84.3%、49.3%。另外,相比于初始工艺,提高限氧发酵阶段的供氧条件,缬氨酸产量也略有提升(图3-b),A2、A3和A4条件下,最终的缬氨酸的产量分别为82.5、85.1和86.3 g/L较初始工艺(A1,81.2 g/L)分别提高了1.6%、4.8%和6.3%。由于条件改变对菌体生长和副产物积累的显著影响,最终的糖酸转化率也发生了明显变化。在A2、A3发酵条件下,最终的转化率分别为0.44和0.46 g/g葡萄糖,相较初始工艺(A1,0.41 g/g葡萄糖)分别提高了7.3%和12.2%,但是在A4条件下,由于菌体会持续生长,消耗了更多的碳源,最终的转化率只有0.39 g/g葡萄糖,相较于初始工艺降低了4.8%。总体来说,限氧发酵阶段较佳的供氧条件为A3,该条件下琥珀酸及乙酸的浓度显著降低,同时对菌株活力、缬氨酸的产量和产率均有较大的促进作用,更有利于缬氨酸的高效生产。
2.2.2 供氧条件转变时机的选择
在相同的供氧条件下,菌体量的不同会造成发酵液中的溶氧环境的差异,进而影响菌体代谢。从前述研究结果可以看出,供氧条件转换是影响最终菌体量的关键因素。因此本研究接着探究了双阶段发酵过程中,不同供氧条件转换时机对VHY20发酵生产缬氨酸的影响。在好氧发酵分别进行至12 h(B1)、14 h(B2)、16 h(B3,初始工艺)和18 h(B4)时转变为限氧发酵,供氧条件设置为A3(转速400 r/min,通风量2 L/min),至发酵结束。在B1~B4四种控制工艺下,菌体生长、缬氨酸产量及副产物积累情况见图4。
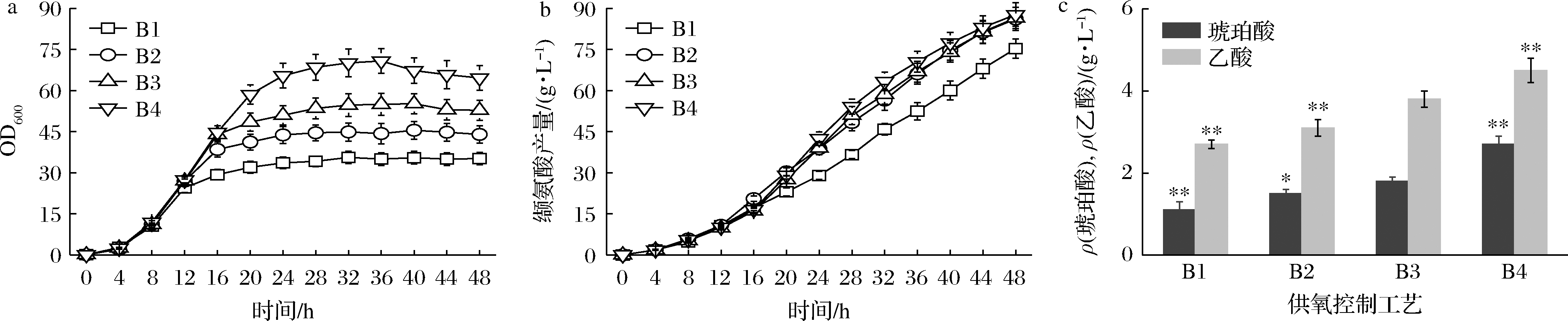
a-菌体生长曲线;b-缬氨酸产量曲线;c-副产物浓度
图4 四种供氧控制工艺下VHY20在5 L发酵罐上的发酵结果
Fig.4 Fermentation results of VHY20 in a 5 L bioreactor under the four processes
从图4-a可知,在好氧发酵转为限氧发酵后,菌体生长即趋于稳定,并且随着供氧条件转换时间的后延,最终的菌体量也逐渐提升。提前进行条件转换,会降低副产物,如在B1工艺下,最终乙酸和琥珀酸的质量浓度分别降低至1.1和2.5 g/L(图4-c),可能原因在于提前转变供氧条件使得最终菌体量大幅降低,限氧发酵阶段的相对溶氧提高。在B2、B3和B4工艺控制下,缬氨酸的最终产量分别为86.1、86.5和87.7 g/L,相差不大,但在B1工艺由于菌体量的大幅降低,缬氨酸的生产效率也显著下降,最终的缬氨酸产量只有73.3 g/L(图4-b)。由于最终菌体量差异明显,不同工艺的葡萄糖消耗量变化较大,最终导致糖酸转化率的不同。B1~B4四种工艺最终的糖酸转化率为0.50、0.48、0.46和0.42 g/g葡萄糖。综合看来,在B2工艺下可取得最佳缬氨酸发酵指标,该工艺下缬氨酸的产量为86.5 g/L,糖酸转化率为0.48 g/g葡萄糖,琥珀酸和乙酸的积累量分别为1.5和3.1 g/L。
2.2.3 补糖速率的优化
常规的大肠杆菌发酵过程通常会通过葡萄糖流加速率的控制使发酵液处于“零残糖”状态,葡萄糖的供给量会直接影响菌体的代谢通量分布[27]。为了确定合适的葡萄糖供给量,本研究探究了限氧发酵阶段中葡萄糖流加速率对缬氨酸发酵的影响。在前面优化的发酵工艺基础上,将限氧发酵阶段的葡萄糖流加速率分别控制在20、25和30 g/h(对应工艺分别记为C1、C2和C3),3种控制工艺下,菌体生长、缬氨酸产量及副产物积累情况见图5。

a-菌体生长曲线;b-缬氨酸产量曲线;c-副产物浓度
图5 三种葡萄糖流加控制工艺下VHY20在5 L发酵罐上的发酵结果
Fig.5 Fermentation results of VHY20 in a 5 L bioreactor under the three processes
从图5-a可知,在实验范围内,尽管补糖速率差异较大,但是对菌体的生长基本无影响。然而不同的补糖速率对缬氨酸的产量产生了显著影响(图5-b),C1、C2和C3工艺下,最终缬氨酸的产量分别为75.1、90.4和94.5 g/L,说明随着补糖量的提高,缬氨酸的产量也逐渐提升。副产物乙酸和琥珀酸质量浓度也会随着补糖量的增加而增加(图5-c),这是因为较高的葡萄糖供应加强了糖酵解途径,并且较高的葡萄糖供应导致相对溶氧的降低,进而造成代谢溢流从而促进了副产物的合成。另外,由于缬氨酸产量、副产物浓度的显著变化,导致3种工艺的糖酸转化率的差异,C1、C2和C3三种工艺最终的糖酸转化率分别为0.54、0.53和0.48 g/g葡萄糖。综合指标来看,较佳的补糖速率应控制在25 g/h,缬氨酸的产量为90.4 g/L,糖酸转化率为0.53 g/g葡萄糖,副产物琥珀酸和乙酸的积累量分别为1.2和2.7 g/L。
3 结论
为了解决工程菌株VHY18在限氧发酵过程中大量积累乙酸和琥珀酸以及菌株生长活力明显衰退等问题,本研究对VHY18菌株进行了代谢工程改造并对配套的发酵工艺进行了优化。为了降低乙酸的合成,敲除了乙酸合成关键酶丙酮酸氧化酶和乙酸激酶的编码基因poxB和ackA;为了降低琥珀酸的合成,敲除了苹果酸脱氢酶的编码基因mdh。最终获得VHY20菌株,乙酸和琥珀酸的积累量分别降低了43.7%和50.8%。为进一步降低副产物积累、提高缬氨酸发酵水平,本研究从限氧发酵阶段的供氧条件、双阶段发酵的转变时机以及葡萄糖流加速率3个方面对发酵工艺进行了系统的优化。最终,确立的工艺为:发酵开始时先进行好氧发酵,14 h后将好氧发酵转换至限氧发酵,并将供氧条件设置为搅拌转速400 r/min、风量2 L/min,补糖速率控制在25 g/h。工程菌VHY20在该发酵工艺下发酵48 h,可生产90.5 g/L缬氨酸,转化率为0.53 g/g葡萄糖,副产物琥珀酸和乙酸分别为1.2 和2.7 g/L。与原有菌株及发酵工艺相比,工程菌VHY19产酸提高了7.8%,转化率提高了30.5%,副产物琥珀酸和乙酸分别降低了95.4%、76.9%,效果显著。本研究提供的限氧发酵生产缬氨酸工艺具有较好的产业化应用前景。纯厌氧发酵生产缬氨酸目前已经引起了研究者的浓厚兴趣,下一步研究可通过适应性实验室进化的方法提高菌株对厌氧环境的适应性,以进一步提高菌株缬氨酸的生产性能,并实现纯厌氧发酵高效生产缬氨酸,从而降低生产成本,推动缬氨酸的高效绿色生产进程。
[1] KARAU A, GRAYSON I.Amino acids in human and animal nutrition[J].Advances in Biochemical Engineering/Biotechnology, 2014, 143:189-228.
[2] DUNSHEA F R, BAUMAN D E, NUGENT E A, et al.Hyperinsulinaemia, supplemental protein and branched-chain amino acids when combined can increase milk protein yield in lactating sows[J].The British Journal of Nutrition, 2005, 93(3):325-332.
[3] TAKPHO N, WATANABE D, TAKAGI H.High-level production of valine by expression of the feedback inhibition-insensitive acetohydroxyacid synthase in Saccharomyces cerevisiae[J].Metabolic Engineering, 2018, 46:60-67.
[4] PARK J H, LEE S Y.Fermentative production of branched chain amino acids:A focus on metabolic engineering[J].Applied Microbiology and Biotechnology, 2010, 85(3):491-506.
[5] 张学礼, 郭恒华, 刘萍萍, 等.生产L-缬氨酸的重组大肠杆菌、其构建方法及其应用:中国, CN113278641A[P].2021-08-20.
ZHANG X L, GUO H H, LIU P P, et al.Producing L-valine in recombinant Escherichia coli and the application with the method of its construction:China, CN113278641A[P].2021-08-20.
[6] PARK J H, KIM T Y, LEE K H, et al.Fed-batch culture of Escherichia coli for L-valine production based on in silico flux response analysis[J].Biotechnology and Bioengineering, 2011, 108(4):934-946.
[7] HASEGAWA S, UEMATSU K, NATSUMA Y, et al.Improvement of the redox balance increases L-valine production by Corynebacterium glutamicum under oxygen deprivation conditions[J].Applied and Environmental Microbiology, 2012, 78(3):865-875.
[8] HAO Y N, MA Q, LIU X Q, et al.High-yield production of L-valine in engineered Escherichia coli by a novel two-stage fermentation[J].Metabolic Engineering, 2020, 62:198-206.
[9] 周景文, 高松, 刘延峰, 等.新一代发酵工程技术:任务与挑战[J].食品与生物技术学报, 2021, 40(1):1-11.
ZHOU J W, GAO S, LIU Y F, et al.Next generation fermentation engineering:Missions and challenges[J].Journal of Food Science and Biotechnology, 2021, 40(1):1-11.
[10] YU Y, ZHU X N, XU H T, et al.Construction of an energy-conserving glycerol utilization pathways for improving anaerobic succinate production in Escherichia coli[J].Metabolic Engineering, 2019, 56:181-189.
[11] 刘剑, 赵策, 储炬, 等.溶氧对谷氨酸棒杆菌发酵产谷氨酸代谢的影响[J].华东理工大学学报(自然科学版), 2012, 38(4):459-464.
LIU J, ZHAO C, CHU J, et al.Influence of dissolved oxygen on metabolism of glutamic acid biosynthesis by Corynebacterium glutamicum[J].Journal of East China University of Science and Technology (Natural Science Edition), 2012, 38(4):459-464.
[12] 焦策. 溶氧对Candida glycerinogenes产甘油发酵的调控机理研究[D].无锡:江南大学, 2012.
JIAO C.Regulate mechanism of dissolved oxygen on the glycerol fermentation by Candida glycerinogenes[D].Wuxi:Jiangnan University, 2012.
[13] BOECKER S, SLAVIERO G, SCHRAMM T, et al.Deciphering the physiological response of Escherichia coli under high ATP demand[J].Molecular Systems Biology, 2021, 17(12):e10504.
[14] HASEGAWA S, SUDA M, UEMATSU K, et al.Engineering of Corynebacterium glutamicum for high-yield L-valine production under oxygen deprivation conditions[J].Applied Environmental Microbiology, 2013, 79(4):1 250-1 257.
[15] STEINSIEK S, FRIXEL S, STAGGE S, et al.Characterization of E.coli MG1655 and frdA and sdhC mutants at various aerobiosis levels[J].Journal of Biotechnology, 2011, 154(1):35-45.
[16] ZOU S P, ZHAO K, TANG H, et al.Improved production of D-pantothenic acid in Escherichia coli by integrated strain engineering and fermentation strategies[J].Journal of Biotechnology, 2021, 339:65-72.
[17] LI Y F, LIN Z Q, HUANG C, et al.Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J].Metabolic Engineering, 2015, 31:13-21.
[18] 杜丽红, 熊海波, 徐达, 等.利用谷氨酸棒杆菌CRISPRi系统构建L-缬氨酸高产菌株[J].食品与发酵工业, 2020, 46(17):1-8.
DU L H, XIONG H B, XU D, et al.Construction of L-valine production strain by CRISPRi system of Corynebacterium glutamicum[J].Food and Fermentation Industries, 2020, 46(17):1-8.
[19] SCHÜTZE A, BENNDORF D, PÜTTKER S, et al.The impact of ackA, pta, and ackA-pta mutations on growth, gene expression and protein acetylation in Escherichia coli K-12[J].Frontiers in Microbiology, 2020, 11:233.
[20] WANG J, SHANG Q, ZHAO C, et al.Improvement of Streptococcus suis glutamate dehydrogenase expression in Escherichia coli through genetic modification of acetate synthesis pathway[J].Letters in Applied Microbiology, 2020, 70(2):64-70.
[21] PARIMI N S, DURIE I A, WU X H, et al.Eliminating acetate formation improves citramalate production by metabolically engineered Escherichia coli[J].Microbial Cell Factories, 2017, 16(1):114.
[22] KIM W J, AHN J H, KIM H U, et al.Metabolic engineering of Mannheimia succiniciproducens for succinic acid production based on elementary mode analysis with clustering[J].Biotechnology Journal, 2017, 12(2):1600701.
[23] 刘嵘明, 梁丽亚, 吴明科, 等.微生物发酵生产丁二酸研究进展[J].生物工程学报, 2013, 29(10):1 386-1 397.
LIU R M, LIANG L Y, WU M K, et al.Progress in microbial production of succinic acid[J].Chinese Journal of Biotechnology, 2013, 29(10):1 386-1 397.
[24] MA J F, JIANG M, CHEN K Q, et al.Strategies for efficient repetitive production of succinate using metabolically engineered Escherichia coli[J].Bioprocess and Biosystems Engineering, 2011, 34(4):411-418.
[25] 王莉. 乙醛酸循环途径对谷氨酸棒杆菌两阶段发酵生产丁二酸的影响[D].杭州:浙江大学, 2013.
WANG L.Effects of glyoxylate cycle on succinic acid dual-phase production in Corynebacterium glutamicum ATCC 13032[D].Hangzhou:Zhejiang University, 2013.
[26] BETTENBROCK K, BAI H, EDERER M, et al.Towards a systems level understanding of the oxygen response of Escherichia coli[J].Advances in Microbial Physiology, 2014, 64:65-114.
[27] PATIL V, SANTOS C N S, AJIKUMAR P K, et al.Balancing glucose and oxygen uptake rates to enable high amorpha-4, 11-diene production in Escherichia coli via the methylerythritol phosphate pathway[J].Biotechnology and Bioengineering, 2021, 118(3):1 317-1 329.