食品安全传统检测大多以色谱法、光谱法、质谱法、聚合酶链式反应法等仪器分析方法为主,它们虽然具有灵敏度高、特异性好,结果稳定等优点,但也同时存在样品处理繁琐、检测成本高、检测时间长等问题,难以满足“快、准、灵、廉、简”的现场检测和市场监督需求[1-4]。此外,由于当今食品组分复杂、干扰杂质繁多,故对食品中特定污染物的现场快速检测成为分析领域的主要难点之一。
免疫层析检测技术是一种基于免疫检测与层析分离相结合的检测技术,具有检测快速(10~20 min)、操作简易、成本低廉、携带便捷等特点,在基层大样本筛查中可实现现场实时检测[5-6]。然而,传统免疫层析检测技术仅能对单一待检物进行检测,无法实现多种待检物的同时检测,故只能提供有限的样本信息。随着对快速检测灵敏度和检测效率日益增长的现实需求,多重免疫层析检测法逐渐成为研究热点[7-9]。相较于多次单一待检物的检测,单次多重检测既能提高检测效率,降低成本,又能节约被测样品,对某些需要进行多个指标联合检测的微量样品具有很大的应用价值,尤其适合在基层实验室推广与应用。此外,采用上述方法可以获得被测样品更丰富的信息,有助于提高检测结果的准确性。
近年来,食品安全领域对于多种物质同时检测的需求越来越大,推进了多重免疫层析检测法的发展。本文首先对多重免疫层析检测法中不同信号输出探针的研究进展进行综述,阐述了各类探针的增敏作用及其优缺点。然后,系统综述了多重免疫层析检测技术在食品安全快速检测中的应用,最后对该技术在食品安全快速分析检测中所面临的挑战和发展前景进行研讨,以期为食品安全多重快速检测方法的建立提供理论支撑。
1 多重免疫层析检测技术
多重免疫层析检测技术因具有低成本、高效率、操作简单、读取方便等优点,被广泛应用于医疗诊断、环境检测、食品安全检测等多个领域中,原理如图1所示。多重免疫层析检测平台由样品垫、结合垫、硝酸纤维素膜(nitrocellulose membrane,NC 膜)和吸水垫在有一定硬度的底板上拼接组合而成,并且在 NC 膜上固化有控制线(control line,C 线)和多条检测线(test line, T 线),其中 C 线显色表示检测有效,而 T 线显色则指示阴性或阳性,其检测结果可通过视觉直接识别或阅读器进行定性或半定量分析。

图1 多重免疫层析平台原理图
Fig.1 Schematic of the multiplex immunochromatography platform
2 不同标记材料在多重免疫层析检测技术中的应用
多重免疫层析检测技术其核心是免疫探针,不同标记材料所制备探针的信号表现方式及效果不同,而免疫探针信号的强度及其稳定性是影响检测灵敏度的最重要因素[6]。随着材料科学的发展,纳米材料因其独特的尺寸效应、高比表面积、量子效应、宏观量子隧道效应等特性成为了研究热点,且纳米材料具有较高的光、电、磁敏感性以及较好的表面稳定性,进而相继涌现出各式各样的新型纳米材料应用于免疫层析检测中。纳米材料的引入为免疫层析检测技术实现高灵敏度、高特异性、高效率、高速度奠定了较好的基础。不同的标记材料用于多重免疫层析检测技术中时,其信号检测模式不同。目前,研究者们所聚焦的新型纳米材料主要包括如以比色信号为读取信号的金纳米粒子、碳基纳米材料等标记材料,以荧光信号为读取信号的量子点、上转换荧光纳米材料等标记材料以及以拉曼信号,化学发光信号等为检测信号的复合材料等。
2.1 比色型纳米材料在多重免疫层析检测中的应用研究进展
比色信号检测作为免疫层析检测技术中最为广泛应用的信号读取模式,在多重免疫层析检测领域中也受到了大量关注,其检测原理是通过特异性的免疫结合使各种颜色的纳米探针在检测线上产生可供读取分析的颜色条带,然后通过肉眼或者借助读取仪即可对待测物进行定性及半定量分析。目前常用的比色型纳米标记材料主要包括纳米金、乳胶微球、碳纳米材料等。
2.1.1 纳米金
纳米金(gold nanoparticle,AuNPs,又称为胶体金,colloidal gold)是由氯金酸通过还原法制备而成的缔合胶体,由基础金核和两层双离子层构成,外层离子层在静电作用下形成悬浮稳定的胶体分散状态[10]。纳米金因具有独特的尺寸效应、高比表面积、高生物相容性、高稳定性且易于制备、易于功能化修饰、易于裸眼判读等特点,成为目前免疫层析法中应用最为广泛的标记材料,具有不可替代的商业地位。WANG等[11]以传统的球型纳米金分别偶联5种单克隆抗体作为探针,对牛奶中5种金黄色葡萄球菌肠毒素(staphylococcal enterotoxin A、B、C、D、E)进行检测,其检测限分别为2.5、2.5、2.5、1和5 ng/mL。XU等[12]基于传统纳米金建立了可同时检测牛奶中己烯雌酚和雌二醇的免疫层析检测法,其检出限分别为25 和65 ng/g。传统的小粒径球型纳米金发光强度较低,需要大量聚集其信号才能被检测识别,往往导致检测灵敏度较低,无法满足对样品中目标物的痕量检测。
近年来,研究者们开始关注异型且粒径相对较大的纳米金颗粒,常见的有棒状纳米金、花状纳米金、锥形纳米金等。相较于球形纳米金,异型纳米金常常具有更大的比表面积使其可承载更多的抗体分子等生物分子,同时由于具有更高的光学亮度和更好的胶体稳定性,以其制备的标记探针往往具有较高的检测灵敏度。如JI等[13-14]使用花状纳米金作为标记材料制备了超灵敏定量检测黄曲霉毒素 B1 的免疫层析试纸条,花状纳米金的采用使得该方法的抑制浓度比传统基于球型纳米金的免疫层析试纸条检测法低10倍。HUANG等[15]采用多分支的花状纳米金作为探针构建了能够同时检测伏马菌素 B1(fumonisin B1,FB1)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)2种真菌毒素的免疫层析检测法,其检出限为5 ng/mL,较球型纳米金提高了4倍。WU等[16]采用4种不同颜色的异形纳米金作为标记材料用于同时检测玉米样品中 FB1、玉米赤霉烯酮(zearalenone,ZEN)、赭曲霉毒素A(ochratoxin A,OTA) 和黄曲霉毒素B1(aflatoxin B1,AFB1)4种真菌毒素,其原理如图2所示,其检出限分别为3.27、0.70、0.10和0.06 ng/mL。

图2 基于不同颜色纳米金构建同时检测4种真菌毒素的免疫层析检测法原理图(a);定性检测结果图(b、c)[16]
Fig.2 Schematic diagram of an immunochromatography assay for simultaneous detection of four mycotoxins based on gold nanoparticles of different colors(a); Qualitative test results(b,c)[16]
2.1.2 乳胶微球
乳胶微球(latex microsphere,LMs)是通过高聚合材料合成的纳米标记材料,与胶体金相比,乳胶微球颜色丰富,能够满足多种检测的要求。此外,乳胶微球大小均匀,比表面积大,为偶联抗体提供了丰富的位点,具有良好的稳定性与较高的灵敏度。CHEN等[17]以红色、绿色和蓝色表面为羧基的聚苯乙烯乳胶微球作为探针,构建了一种与智能手机设备相结合的彩虹“红绿灯”型免疫层析检测法,可同时检测 AFB1、T-2 毒素和 ZEN 三种真菌毒素,原理如图3所示,其在谷物中检出限分别为0.04、0.40和1.21 μg/kg。
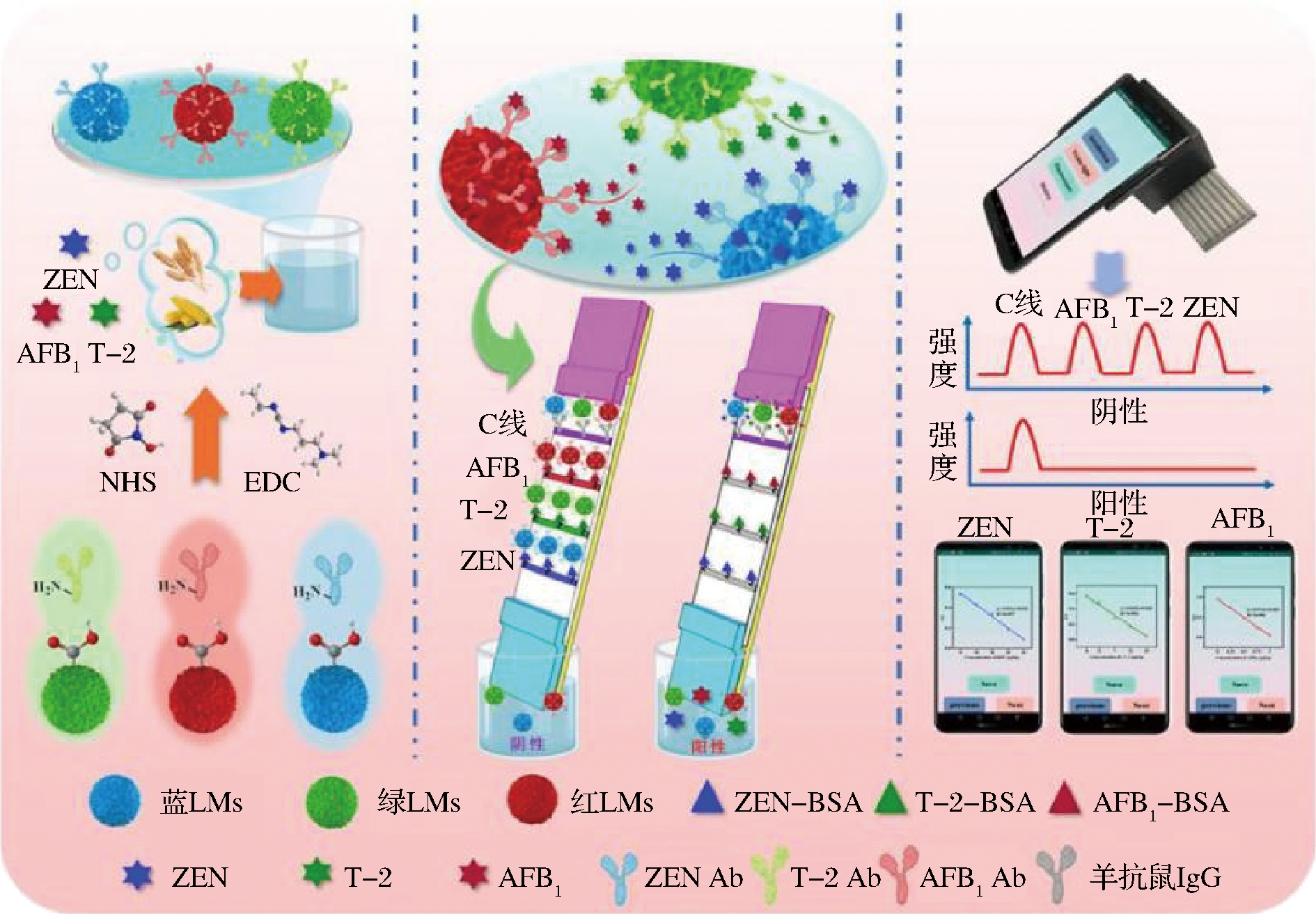
图3 基于乳胶微球的多重免疫层析检测法检测3种真菌毒素原理图[17]
Fig.3 Schematic diagram of multiplex immunochromatography based on latex microspheres for the detection of three mycotoxins[17]
2.1.3 碳纳米材料
碳纳米颗粒(carbon nanoparticles,CNPs)具有制备简单、无毒性、不需要活化以及原材料成本低廉等显著优势,已经成为继胶体金后最重要的标记材料之一,且与传统金纳米颗粒相比,碳纳米颗粒还具有优异的导电性和环保性,在许多领域都显示出了巨大的应用潜力[18]。在检测灵敏度方面,由于其黑色信号可与白色背景的层析膜形成强烈的对比,从而具有较高的视觉灵敏度,其裸眼可判读最低检测灵敏度远高于胶体金。ZHANG等[19]以无定形碳纳米颗粒(amorphous carbon nanoparticles,ACNs)作为探针,建立了可同时检测 DON,T-2毒素和 ZEN 的免疫层析检测方法,原理图如图4所示,其检测限分别为20、13和1 μg/kg,与以胶体金和量子点作为探针的免疫层析检测方法相比,其灵敏度提高了8倍和2倍。为了能够对牛奶样品中22种β-内酰胺类抗生素进行同时检测,ZHANG等[20]采用无定形碳纳米颗粒作为探针构建了多重免疫层析检测法,其对此类抗生素检测的相应阻断值均低于欧盟设定的最大残留量水平。
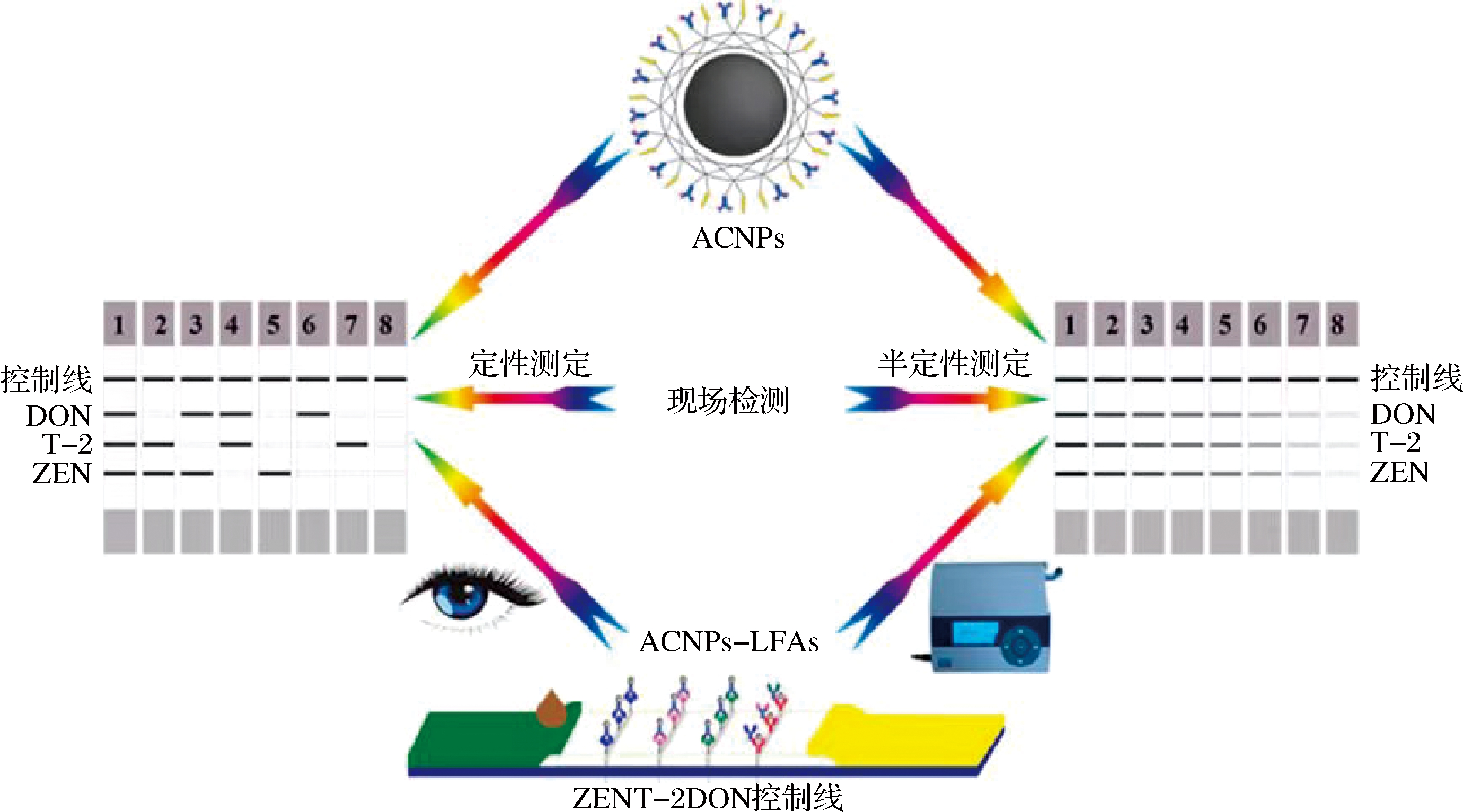
图4 基于碳基纳米材料的多重免疫层析检测法检测3种真菌毒素原理图[19]
Fig.4 Schematic diagram of multiplex immunochromatography assay based on carbon nanoparticles for the detection of three mycotoxins[19]
2.2 荧光型纳米材料在多重免疫层析检测中的应用研究进展
比色信号在检测过程中易受待测样品环境本底颜色的干扰,从而导致检测灵敏度降低、检测结果不准确等问题,难以用于有色食品中有害物质的检测。为解决此类问题,荧光信号逐渐成为研究热点。基于荧光信号的多重免疫层析检测技术因其具有可视化、稳定性好、抗干扰能力强、灵敏度高等优点,已成为食品安全快速检测的重要技术。近年来,用于开发多重免疫层析试纸条的荧光型标记材料主要包括量子点、量子点微球、时间分辨荧光微球、上转换荧光纳米材料等。
2.2.1 量子点及量子点微球
量子点(quantum dots,QDs)是一类由 Ⅱ~Ⅵ 族或 Ⅲ~Ⅴ 族元素组成的半导体荧光无机晶体,直径通常在1~10 nm。由于其具有荧光量子产率高、抗光漂白能力强、荧光寿命长、激发光谱宽、发射光谱窄、颜色可调等优良光学特性,在免疫层析检测法中获得了广泛关注[21]。量子点的多色性常用于同一体系中多种食品污染物的同时检测[22]。TARANOVA等[23]利用红色、黄色和绿色3种不同颜色的 QDs 分别标记3种单克隆抗体建立了基于3条检测线的“交通信号灯”模式的免疫层析方法,用于检测牛奶样品中氧氟沙星、氯霉素和链霉素3种常见抗生素的残留,最低检测限分别为0.3、0.12和0.2 ng/mL,比采用相同抗体的酶联免疫吸附剂检测法灵敏度高80~200倍。ZHAO等[24]合成了具有超高荧光亮度的聚合物碳量子点作为信号探针,在最佳条件下,氯氰菊酯、3-苯氧苯甲酸的检测限分别为0.35和0.04 ng/mL。量子点在多重免疫层析方法中展现了其优越的性能,但 QDs 标记抗体会诱导产生氧自由基,对抗体活性有一定毒性;且 QDs 与抗体等蛋白结合后会导致其荧光减弱或淬灭,使信号减弱或消失;由于量子点粒径较小,与蛋白偶联后分离步骤复杂,回收不便,这一系列缺陷限制了其广泛应用。
量子点微球是通过物理或化学方法将量子点与二氧化硅球、高聚合物球等微纳米球体结合起来构建的量子点荧光微球。相比于量子点,量子点微球具有如下优势:(1)单个量子点微球可包裹数百甚至上万的量子点,具有更高的荧光强度;(2)通过高聚物材料对量子点的包裹,减少外界对量子点的影响,提高了荧光的稳定性;(3)量子点微球粒径较大,进行生物偶联后,低转速就能实现微球探针的分离纯化。REN等[25]采用聚甲基丙烯酸甲酯包裹 QDs 制备量子点荧光微球,其荧光强度比 QDs 提高了约2 863倍,且荧光稳定性也得到了显著提升,以其作为探针建立 AFB1的免疫层析检测方法,其半抑制率比以 QDs 作为探针的低39倍,比传统的胶体金免疫层析试纸条低约100倍。DUAN等[26]以此方法通过调节2种量子点的比例合成黄色、橙色和红色3种不同颜色的量子点微球,将其作为探针,构建了多色荧光免疫层析试纸条同时检测玉米中的 ZEN、OTA 和 FB1,其原理如图5所示,其可视检测灵敏度为 10、5和 20 ng/mL。

图5 三色量子点微球合成示意图(a);免疫层析检测法原理图(b);有关检测结果示意图(c)[26]
Fig.5 Schematic diagram of the three-color quantum dot microsphere synthesis(a); Schematic diagram of the three-color quantum dot microsphere spherical immunochromatography detection method(b); Schematic diagram of the relevant test results(c)[26]
为了改善量子点的功能特性以及克服其缺陷,科学家们开始将量子点与其他材料复合使用。如XIONG等[27]利用SiO2和量子点制备成新型纳米复合材料(SiO2@QDs)作为先进的信号探针,提出了一种多重荧光横向流动免疫分析法,可同时检测猪尿液和猪肉样品中的雷克托巴胺和沙丁胺醇,其检测限分别为0.007 和0.032 ng/mL,该新型复合材料的灵敏度优于金纳米颗粒和荧光微球,同时克服了量子点容易聚集和离心后收集困难的缺点。ZHENG等[28]将具有捕获/检测双功能的磁性量子点纳米珠复合材料作为探针,建立了可同时检测食品中AFB1、OTA和FB1的多重免疫层析检测法,由于探针具有富集能力可捕获靶分子从而消除杂质的干扰,且双层量子点外壳可使信号得到进一步放大,磁珠外的多层羧基化 QDs 不仅大大增加了 QDs 进入纳米结构的数量,而且提高了探针在复杂环境中的分散性以及稳定性,原理如图6所示,其检测限分别为0.42、11.48和4.21 pg/mL[28]。

图6 双功能磁性量子点的制备(a);不同免疫探针的制备(b);免疫磁富集靶真菌毒素(c);基于磁性量子点复合纳米材料的多重免疫层析检测法检测三种真菌毒素原理图(d)[28]
Fig. 6 Preparation of bifunctional magnetic quantum dots(a); Preparation of different immune probes(b); Immunogagnetic enrichment of target mycotoxins(c); Schematic diagram of three mycotoxins detected by multiplex immunochromatography assay based on magnetic quantum dot composite nanomaterials(d)[28]
2.2.2 时间分辨荧光微球
时间分辨荧光微球(time-resolved fluorescent microspheres,TRFMs)采用高分子聚合物如聚苯乙烯材料或螯合二氧化硅纳米粒子包裹镧系稀土离子(如铕Eu3+、铽Tb3+、镝Dy3+和钐Sm3+)而构成。镧系元素跟普通荧光物质相比,具有 Stocks 位移大,荧光寿命长,宽激发窄发射等特点,因此可较好地避免激发光的干扰,同时解决生物材料自发荧光及荧光染料易淬灭等问题,并进一步提高了检测的特异性和灵敏度。
TANG等[29]以Eu/Tb 时间分辨荧光微球标记纳米抗体作为探针,建立可同时检测玉米样品中 AFB1和 ZEN 两种真菌毒素的免疫层析检测法,其检出限分别为0.05和0.07 ng/mL。在相同浓度下,Eu/Tb 荧光微球比不含 Tb 的荧光微球的荧光强度更高,说明以此制备的信号探针能有效提高检测灵敏度。卢迪莎等[30]采用铕系时间分辨荧光微球分别标记AFB1和OTA的单克隆抗体作为探针,建立了一种可同时检测AFB1和OTA的免疫层析试纸条。在最佳条件下,其检测限分别为 3.70 和5.55 μg/kg。JIANG等[31]基于时间荧光分辨微球建立动物性食品中链霉素(streptomycin,STR)和双氢链霉素(dihydrostreptomycin,DHSTR)免疫层析检测法,在牛奶中的检测限分别为3.62和2.48 μg/kg。
2.2.3 上转换荧光纳米材料
上转换荧光纳米材料(upconversion nanoparticles,UCNPs)是由稀土金属元素(Er、Yb、Sm 等稀土离子)掺杂在某些惰性材料中构成可上转换发光的荧光纳米材料。由于其长波激发和短波发射的特性,具有良好的组织穿透性,可避免生物样本中的背景荧光对检测结果的影响,从而显著提高检测信号的信噪比,故适合复杂样品基质中痕量分析物的检测。与传统的有机荧光染料和量子点相比,UCNPs 独特的反斯托克斯位移发光信号可用于区分食物、环境、生物组织等复杂基质的自发荧光,从而降低背景干扰和提高检测灵敏度[32]。此外,UCNPs 显示出更窄的发射光谱,因此可根据吸收和发射光谱进行自由组合,实现多重检测[33]。XU等[34]开发了一种基于铕纳米颗粒(europium nanoparticles,EuNPs)的双荧光免疫层析法,用于同时检测玉米样品中的橘霉素和ZEN,其检测限分别为0.06和0.11 ng/mL。虽然通过掺杂各种稀土元素或过渡金属离子,可以制备具有不同颜色的 UCNPs,从而设计具有多检测线的多重免疫层析检测方法。然而,掺入稀土元素的 UCNPs 发光光谱宽度最多只能控制在30 nm以内,因此只能合成4、5种颜色的 UCNPs[35]。另外,由于 UCNPs 发光效率偏低、制备复杂且需对表面进行亲水性修饰等劣势限制了该材料的应用。
2.2.4 有机染料荧光微球
有机染料荧光微球指采用聚苯乙烯等将具有荧光特性的有机染料包裹在内而形成的荧光微球。ZHANG等[36]选择商品化的红、绿双色荧光微球与单克隆抗体偶联作为荧光探针,对鱼肉样品中的微囊藻毒素(microcystin-LR,MC-LR)和冈田酸(okadaic acid,OA)进行同时检测,原理如图7所示,其检出限分别为0.074和2.42 μg/kg。LI等[37]使用荧光微球取代传统纳米金,对牛奶样品中多肽抗生素黏菌素(colistin,COL)和杆菌肽(bacitracin,Baci)进行同时检测,其检测限分别为1.89和7.85 ng/mL。

图7 荧光探针合成示意图(a);免疫层析试纸条示意图(b);基于有机染料荧光微球构建可同时检测食品中微囊藻毒素和冈田酸的免疫层析检测法原理图(c)[36]
Fig.7 Schematic diagram of fluorescent probe synthesis(a); Schematic diagram of the immunochromatography test strip(b); Schematic diagram of an immunochromatographic assay for simultaneous detection of microcystin and okadic acid in food based on organic dye fluorescent microspheres(c)[36]
2.3 其他信号纳米材料在多重免疫层析检测中的应用研究进展
除了常见的比色信号、荧光信号外,表面增强拉曼散射信号(surface enhanced Raman scattering,SERS)因其极高的灵敏度在多重免疫层析检测中掀起了研究浪潮。基于SERS的检测方法不但可以达到单分子水平适合用于食品中对痕量物质的检测还非常适用于多重检测。ZHANG等[38]设计合成了带双拉曼标签的Au@Ag芯壳纳米颗粒用于制备探针,建立了基于多重表面增强拉曼散射的横向流动免疫传感器,同时检测玉米中的6种主要霉菌毒素,该方法可在20 min内完成,且该免疫传感器的LOD值低于仪器分析和大多数其他生物传感器。为了实现高灵敏度的多重免疫层析检测,研究者们也开始考虑在简单纳米材料的基础上进行修饰和组合,以期使标记材料同时具有多重功能或多重信号的优点,进一步提高检测的灵敏度,稳定性,同时还能在一定程度上简化检测操作。这些复合纳米材料一般集合了2种或2种以上材料的优势功能,且具备2种及2种以上类型的信号,使得检测效果得以提升或检测步骤得以优化。CHAI等[39]设计出一种基于金纳米颗粒和辣根过氧化物酶相结合的复合纳米材料作为探针标记物,开发了能够识别双重信号的侧流免疫检测平台,可实现样本中多种抗生素和霉菌毒素的同时定量检测。基于该方法的硫霉素和 FB1的检出限分别比以前所报道过的方法低8和40倍。LIU 等建立了一种磁性普鲁斯蓝纳米酶介导的双信号读出多重侧流免疫分析法,该方法采用纳米酶作为信号标签,将其原始颜色产生的视觉比色信号与纳米酶优异的过氧化物酶模拟催化活性产生的催化信号相结合,实现双读出策略,得到了更高的精度和更宽的检测范围。该检测方法具有2种定量分析模式,可满足不同的检测要求,在实际样品中具有良好的重现性、准确性和实用性[40]。该团队还制备了一种可再生生物资源衍生的高亲和力铁基纳米酶,并将其作为多重横向流动免疫分析中的多功能高亲和信号标签,对模拟样本(猪、猪肝)进行检测,结果表明,样品中的盐酸莱克多巴胺和克仑特罗(兽药残留)的检测线性范围分别为0~12和0~20 μg/kg,与其他方法相比扩大了检测范围,有利于满足现场双半定量判断[41]。
3 多重免疫层析检测技术在食品安全快速检测中的应用
3.1 在真菌毒素检测方面的应用
真菌毒素(mycotoxins)是丝状真菌在适宜条件下产生的一类具有较强毒性的小分子次级代谢产物,其污染范围较大,且种类繁多。其中最为常见的真菌毒素有黄曲霉毒素(aflatoxins,AFs)、赭曲霉毒素(ochratoxins,OTs)、ZEN、FB1、DON 和T-2、桔霉素(citrinin,CIT)等。在当今实际生产中,由于加工途径繁多,同一农产品往往同时被多种真菌毒素污染,不但威胁到人类健康,且还会使产品失去经济价值,造成经济损失。因此,建立快速高效的真菌毒素多重检测技术迫在眉睫。近年来,有关真菌毒素多重免疫层析法检测的研究进展如表1所示。
表1 基于免疫层析技术同时检测多种真菌毒素研究进展
Table 1 Research progress on simultaneous detection of multiple fungal toxins based on immunochromatographyassay
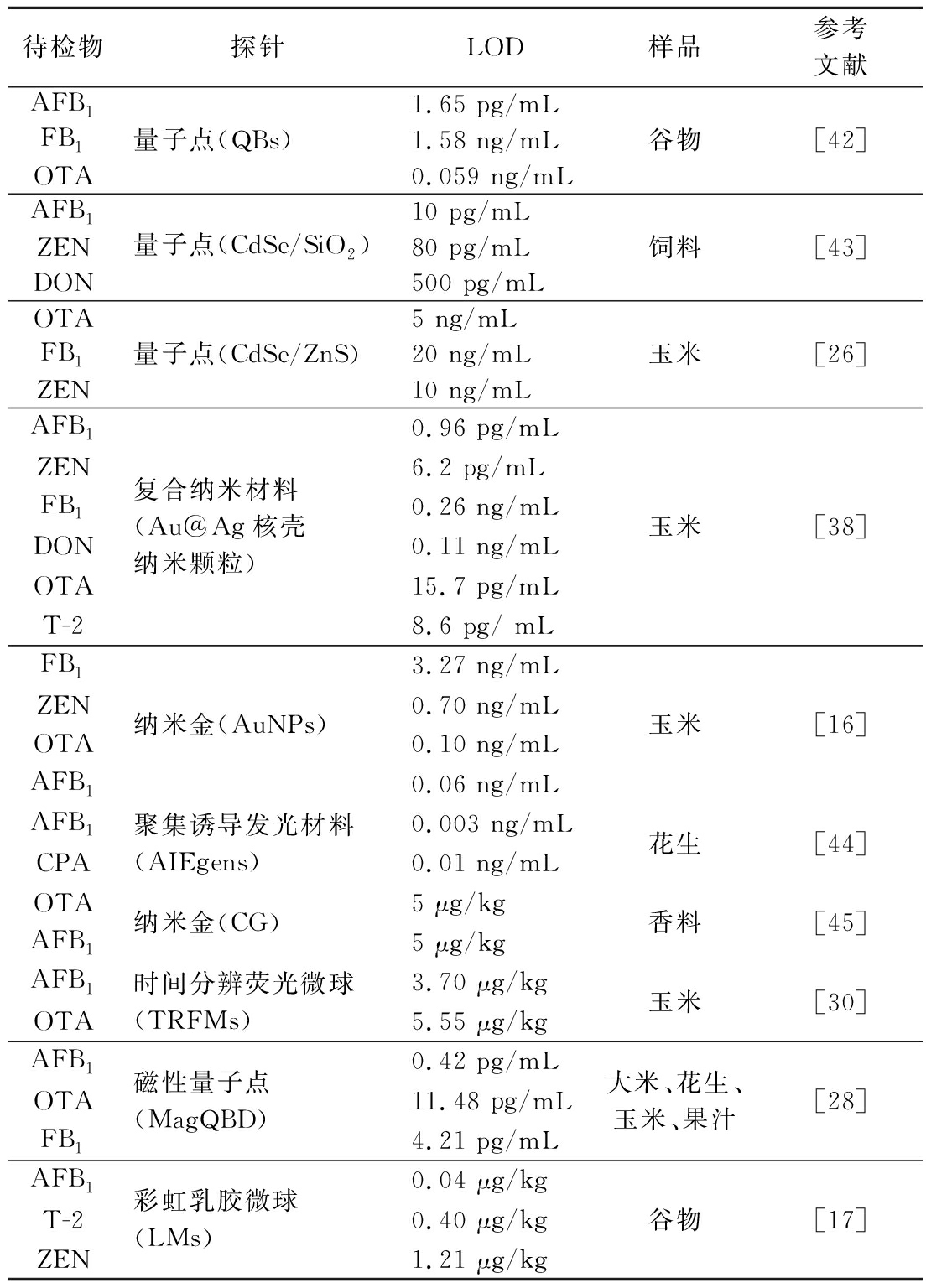
待检物探针LOD样品参考文献AFB1FB1OTA 量子点(QBs)1.65 pg/mL1.58 ng/mL0.059 ng/mL谷物[42]AFB1ZENDON量子点(CdSe/SiO2)10 pg/mL80 pg/mL500 pg/mL饲料[43]OTA FB1ZEN量子点(CdSe/ZnS)5 ng/mL20 ng/mL10 ng/mL玉米[26]AFB1 ZENFB1DONOTAT-2复合纳米材料(Au@Ag核壳纳米颗粒)0.96 pg/mL6.2 pg/mL0.26 ng/mL0.11 ng/mL15.7 pg/mL8.6 pg/ mL玉米[38]FB1ZENOTAAFB1纳米金(AuNPs)3.27 ng/mL0.70 ng/mL0.10 ng/mL0.06 ng/mL玉米[16]AFB1CPA聚集诱导发光材料(AIEgens)0.003 ng/mL0.01 ng/mL花生[44]OTAAFB1 纳米金(CG)5 μg/kg5 μg/kg香料[45]AFB1OTA时间分辨荧光微球(TRFMs)3.70 μg/kg5.55 μg/kg玉米[30]AFB1OTA FB1磁性量子点(MagQBD)0.42 pg/mL11.48 pg/mL4.21 pg/mL大米、花生、玉米、果汁[28]AFB1T-2ZEN彩虹乳胶微球(LMs)0.04 μg/kg0.40 μg/kg1.21 μg/kg谷物[17]
3.2 在食源性致病菌快速检测中的应用
食源性致病菌是引发食源性疾病的重要因素,常见于各种食品环境与饮用水源中,此类污染已成为食品安全领域的重要问题之一。常见的引起人和动物发病的食源性致病菌有大肠杆菌O157∶H7(Escherichia coli O157:H7)、金黄色葡萄球菌(Staphylococcus aureus)、副溶血性弧菌(Vibrio parahaemolyticus)、单核增生李斯特菌(Listeria monocytogenes)、肠炎沙门氏菌(Salmonella enteritidi)、鼠伤寒沙门氏菌(Salmonella typhimurium)等细菌。在实际生活中,一种食物存在同时被多种食源性致病菌污染的可能,所以同时快速准确地检测食品是否被多种致病菌污染对保障消费者权益是十分重要的。关于食品中的食源性致病菌的多重免疫层析检测部分研究进展如表2所示。
表2 同时检测多种食源性致病菌研究进展
Table 2 Research progress in simultaneous detection of multiple foodorne pathogens

待检物探针LOD/(CFU·mL-1)样品参考文献S.EnteritidisE.coli O157:H7纳米酶(Pt-Pd)20 34 牛奶、冰淇淋[46]S.enterica Sero-type EnteritidisL.monocytogenes复合纳米材料(AuMBA@Ag)27 19牛奶、鸡胸肉和牛肉[47]L.monocytogenes S.typhi 纳米金(4-MBA@AuNPs)7575牛奶[48]E.coli O157:H7S.typhi 量子点(Si@DQD)5050牛奶、蔬菜、肉[49]S.typhi S.aureus复合纳米材料(Fe3O4@Au)129牛奶[50]S.aureusE.coli O157:H7S.typhi 纳米片(GO@Au)81010脱脂牛奶、胡萝卜汁和葡萄汁[51]
3.3 在农兽药残留检测方面的应用
面对食物中多种农兽药残留带来的检测挑战,开发出灵敏、便捷和廉价的多重检测方法是辅助监管农兽药使用及保障人民食品安全的关键。近年来关于农兽药残留的多重免疫层析检测法的研究进展如表3所示。
表3 基于免疫层析技术同时检测多种农兽药残留研究进展
Table 3 Research progress on simultaneous detection of various agricultural and veterinary drug residues based on immunochromatography
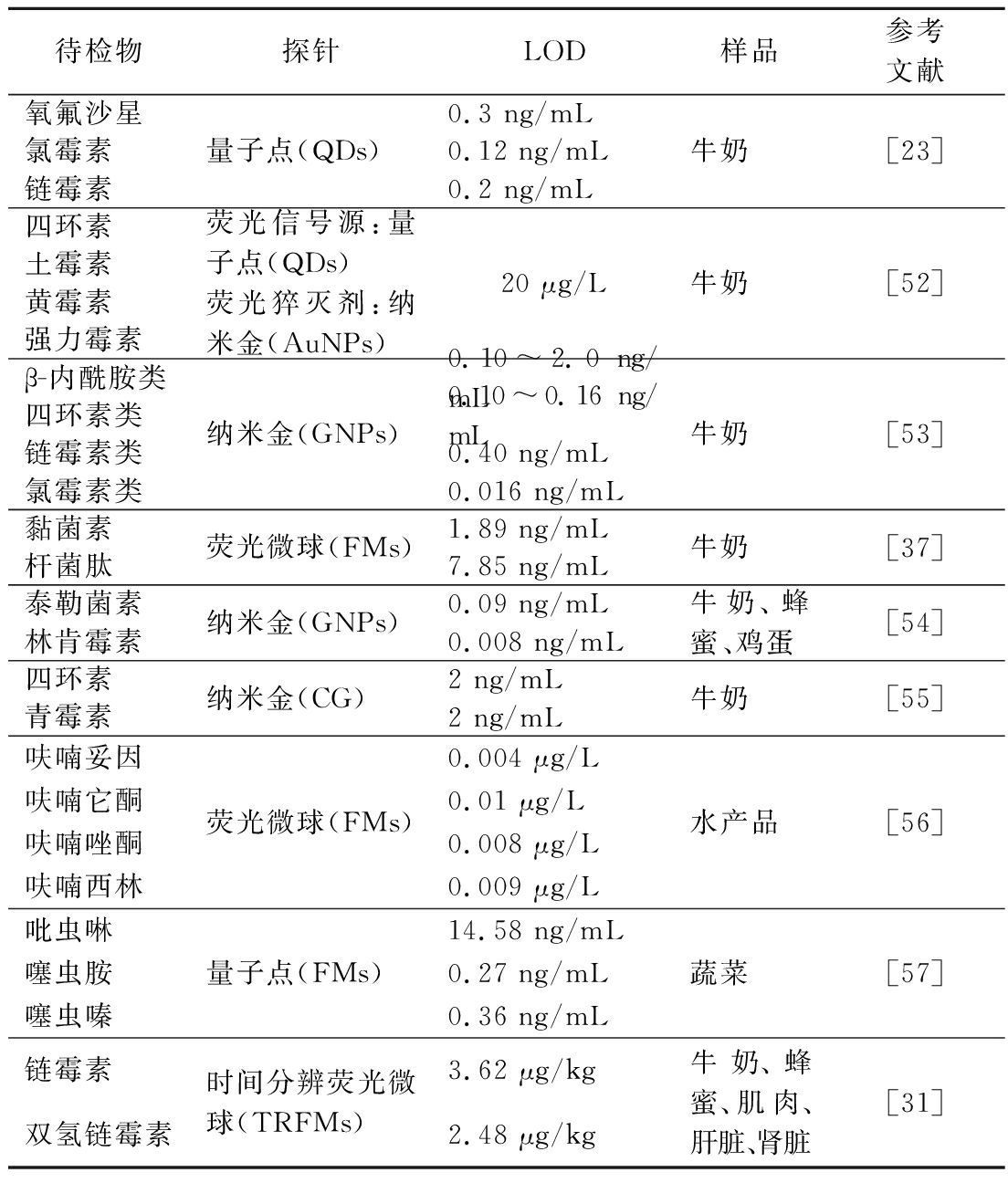
待检物探针LOD样品参考文献氧氟沙星氯霉素链霉素量子点(QDs)0.3 ng/mL0.12 ng/mL0.2 ng/mL牛奶[23]四环素土霉素黄霉素强力霉素荧光信号源:量子点(QDs)荧光猝灭剂:纳米金(AuNPs)20 μg/L牛奶[52]β-内酰胺类四环素类链霉素类氯霉素类纳米金(GNPs)0.10~2.0 ng/mL0.10~0.16 ng/mL0.40 ng/mL0.016 ng/mL牛奶[53]黏菌素杆菌肽荧光微球(FMs)1.89 ng/mL7.85 ng/mL牛奶[37]泰勒菌素林肯霉素纳米金(GNPs)0.09 ng/mL0.008 ng/mL牛奶、蜂蜜、鸡蛋[54]四环素青霉素纳米金(CG)2 ng/mL2 ng/mL牛奶[55]呋喃妥因呋喃它酮呋喃唑酮呋喃西林荧光微球(FMs)0.004 μg/L0.01 μg/L0.008 μg/L0.009 μg/L水产品[56]吡虫啉 噻虫胺噻虫嗪量子点(FMs)14.58 ng/mL0.27 ng/mL0.36 ng/mL蔬菜[57]链霉素双氢链霉素时间分辨荧光微球(TRFMs)3.62 μg/kg2.48 μg/kg牛奶、蜂蜜、肌肉、肝脏、肾脏[31]
4 结论与展望
本文综述了多重免疫层析检测技术不同标记探针的特性以及多重免疫层析检测技术在快速检测食品样品多重污染中的应用,与传统食品安全检测技术相比,多重免疫层析检测技术具有“更快、更准、更灵、更廉、更简”的优势,且多重免疫层析检测技术能够实现多种目标分析物的同时检测,获取的样本信息更为全面。尽管该多重检测技术的实验室研究取得了较快的进展,但在实际食品安全快速分析检测应用中仍存在挑战:复杂的食品基质造成的干扰问题、检测探针合成的复杂性及探针稳定性问题、多种目标物间存在的交叉反应导致的准确性问题等。对于探针标记物而言,复合纳米材料因其具有多结构,多功能,多信号的优势必将会成为未来的研究热点,是提高检测灵敏度及检测性能的关键,但如何简化复合纳米材料的制备方法及如何解决材料批次间合成质量差异大的问题也是非常重要的。其次,检测中部分类别信号需要采用专业仪器进行读取处理,且由于读取仪器价格昂贵使检测成本大大增加,而基于智能手机的便捷检测读取平台由于其携带方便、成本低廉、可联网进行数据处理及数据上传,提高了检测的效率及实效性,是未来多重快速检测设备发展的趋势,同时可开发智能化的检测软件配合使用,以简化操作,做到人人可检测,人人会检测,从而提升检测速度和降低检测成本。总而言之,未来的研究将朝着更快速、更准确、更灵敏、更廉价、更高效、更智能、更自动化、操作更简单的多重免疫层析检测法发展,只有这样才能解决食品安全的部分问题,从而保证食品行业健康发展。
[1] IAMMARINO M, MENTANA A, CENTONZE D, et al.Simultaneous determination of twelve dyes in meat products:Development and validation of an analytical method based on HPLC-UV-diode array detection[J].Food Chemistry, 2019, 285:1-9.
[2] BISWAS S, MONDAL R, MUKHERJEE A, et al.Simultaneous determination and risk assessment of fipronil and its metabolites in sugarcane, using GC-ECD and confirmation by GC-MS/MS[J].Food Chemistry, 2019, 272:559-567.
[3] STELLA R, SETTE G, MORESSA A, et al.LC-HRMS/MS for the simultaneous determination of four allergens in fish and swine food products[J].Food Chemistry, 2020, 331:127276.
[4] AFIFA KHATUN M, HOSSAIN A, HOSSAIN M S, et al.Detection of species adulteration in meat products and Mozzarella-type cheeses using duplex PCR of mitochondrial cyt b gene:A food safety concern in Bangladesh[J].Food Chemistry:Molecular Sciences, 2021, 2:100017.
[5] WU Y H, SUN J Y, HUANG X L, et al.Ensuring food safety using fluorescent nanoparticles-based immunochromatographic test strips[J].Trends in Food Science & Technology, 2021, 118:658-678.
[6] 黄小林, 李倩影, 吴雨豪, 等.多重免疫层析试纸辅助食品安全快速检测的研究进展[J].食品与生物技术学报, 2021, 40(11):12-21.
HUANG X L, LI Q Y, WU Y H, et al.Research progress of multiplex immunochromatographic test strips for rapid food safety detection[J].Journal of Food Science and Biotechnology, 2021, 40(11):12-21.
[7] ANFOSSI L, DI NARDO F, CAVALERA S, et al.Multiplex lateral flow immunoassay:An overview of strategies towards high-throughput point-of-need testing[J].Biosensors, 2018, 9(1):2.
[8] ADUNPHATCHARAPHON S, ELLIOTT C T, SOOKSIMUANG T, et al.The evolution of multiplex detection of mycotoxins using immunoassay platform technologies[J].Journal of Hazardous Materials, 2022, 432:128706.
[9] GUAN T, XU Z L, WANG J, et al.Multiplex optical bioassays for food safety analysis:Toward on-site detection[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):1 627-1 656.
[10] SAHA K, AGASTI S S, KIM C, et al.Gold nanoparticles in chemical and biological sensing[J].Chemical Reviews, 2012, 112(5):2 739-2 779.
[11] WANG W B, LIU L Q, XU L G, et al.Gold-nanoparticle-based multiplexed immunochromatographic strip for simultaneous detection of staphylococcal enterotoxin A, B, C, D, and E[J].Particle & Particle Systems Characterization, 2016, 33(7):388-395.
[12] XU Z H, SUN T Q, HE H W, et al.Simultaneous detection of diethylstilbestrol and estradiol residues with a single immunochromatographic assay strip[J].Food Science & Nutrition, 2021, 9(3):1 824-1 830.
[13] JI Y W, REN M L, LI Y P, et al.Detection of aflatoxin B1 with immunochromatographic test strips:Enhanced signal sensitivity using gold nanoflowers[J].Talanta, 2015, 142:206-212.
[14] DI NARDO F, BAGGIANI C, GIOVANNOLI C, et al.Multicolor immunochromatographic strip test based on gold nanoparticles for the determination of aflatoxin B1 and fumonisins[J].Microchimica Acta, 2017, 184(5):1 295-1 304.
[15] HUANG X Y, HUANG T, LI X J, et al.Flower-like gold nanoparticles-based immunochromatographic test strip for rapid simultaneous detection of fumonisin B1 and deoxynivalenol in Chinese traditional medicine[J].Journal of Pharmaceutical and Biomedical Analysis, 2020, 177:112895.
[16] WU Y H, ZHOU Y F, HUANG H, et al.Engineered gold nanoparticles as multicolor labels for simultaneous multi-mycotoxin detection on the immunochromatographic test strip nanosensor[J].Sensors and Actuators B:Chemical, 2020, 316:128107.
[17] CHEN J Y, LUO P J, LIU Z W, et al.Rainbow latex microspheres lateral flow immunoassay with smartphone-based device for simultaneous detection of three mycotoxins in cereals[J].Analytica Chimica Acta, 2022, 1 221:340138.
[18] ASADIAN E, GHALKHANI M, SHAHROKHIAN S.Electrochemical sensing based on carbon nanoparticles:A review[J].Sensors and Actuators B:Chemical, 2019, 293:183-209.
[19] ZHANG X Y, YU X Z, WEN K, et al.Multiplex lateral flow immunoassays based on amorphous carbon nanoparticles for detecting three Fusarium mycotoxins in maize[J].Journal of Agricultural and Food Chemistry, 2017, 65(36):8 063-8 071.
[20] ZHANG X Y, ZHAO F F, SUN Y W, et al.Development of a highly sensitive lateral flow immunoassay based on receptor-antibody-amorphous carbon nanoparticles to detect 22 β-lactams in milk[J].Sensors and Actuators B:Chemical, 2020, 321:128458.
[21] JAMIESON T, BAKHSHI R, PETROVA D, et al.Biological applications of quantum dots[J].Biomaterials, 2007, 28(31):4 717-4 732.
[22] GARC A DE ARQUER F P, TALAPIN D V, KLIMOV V I, et al.Semiconductor quantum dots:Technological progress and future challenges[J].Science, 2021, 373(6 555):eaaz8541.
A DE ARQUER F P, TALAPIN D V, KLIMOV V I, et al.Semiconductor quantum dots:Technological progress and future challenges[J].Science, 2021, 373(6 555):eaaz8541.
[23] TARANOVA N A, BERLINA A N, ZHERDEV A V, et al.‘Traffic light’ immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk[J].Biosensors and Bioelectronics, 2015, 63:255-261.
[24] ZHAO Y T, RUAN X F, SONG Y, et al.Smartphone-based dual-channel immunochromatographic test strip with polymer quantum dot labels for simultaneous detection of cypermethrin and 3-phenoxybenzoic acid[J].Analytical Chemistry, 2021, 93(40):13 658-13 666.
[25] REN M, XU H, HUANG X, et al.Immunochromatographic assay for ultrasensitive detection of aflatoxin B1 in maize by highly luminescent quantum dot beads[J].ACS Appl Mater Interfaces, 2014, 6(16):14 215-14 222.
[26] DUAN H, LI Y, SHAO Y N, et al.Multicolor quantum dot nanobeads for simultaneous multiplex immunochromatographic detection of mycotoxins in maize[J].Sensors and Actuators B:Chemical, 2019, 291:411-417.
[27] XIONG J C, QIN L Q, ZHANG H X, et al.Sensitive and simultaneous detection of ractopamine and salbutamol using multiplex lateral flow immunoassay based on polyethyleneimine-mediated SiO2@QDs nanocomposites:Comparison and application[J].Microchemical Journal, 2022, 181:107730.
[28] ZHENG S, WU T, LI J X, et al.Difunctional immunochromatographic assay based on magnetic quantum dot for ultrasensitive and simultaneous detection of multiple mycotoxins in foods[J].Sensors and Actuators B:Chemical, 2022, 359:131528.
[29] TANG X Q, LI P W, ZHANG Q, et al.Time-resolved fluorescence immunochromatographic assay developed using two idiotypic nanobodies for rapid, quantitative, and simultaneous detection of aflatoxin and Zearalenone in maize and its products[J].Analytical Chemistry, 2017, 89(21):11 520-11 528.
[30] 卢迪莎, 王序, 杨金易, 等.同时检测玉米中黄曲霉毒素B1和赭曲霉毒素A的时间分辨荧光免疫层析试纸条的研制[J].食品科学, 2022, 43(2):2 346-2 354.
LU D S, WANG X, YANG J Y, et al.Development of a time-resolved fluorescence immunochromatographic strip for the simultaneous detection of aflatoxin B1 and ochratoxin A in corn samples[J].Food Science, 2022, 43(2):2 346-2 354.
[31] JIANG J L, LUO P J, LIANG J X, et al.A highly sensitive and quantitative time resolved fluorescent microspheres lateral flow immunoassay for streptomycin and dihydrostreptomycin in milk, honey, muscle, liver, and kidney[J].Analytica Chimica Acta, 2022, 1192:339360.
[32] JI G N, WANG Y, QIN Y K, et al.Latest developments in the upconversion nanotechnology for the rapid detection of food safety:A review[J].Nanotechnology Reviews, 2022, 11(1):2 110-2 122.
[33] HU Q S, WU Q X, HUANG F C, et al.Multicolor coding up-conversion nanoplatform for rapid screening of multiple foodborne pathogens[J].ACS Applied Materials & Interfaces, 2021, 13(23):26 782-26 789.
[34] XU Y, MA B, CHEN E J, et al.Dual fluorescent immunochromatographic assay for simultaneous quantitative detection of citrinin and Zearalenone in corn samples[J].Food Chemistry, 2021, 336:127713.
[35] SU Z X, DOU W C, LIU X J, et al.Nano-labeled materials as detection tags for signal amplification in immunochromatographic assay[J].TrAC Trends in Analytical Chemistry, 2022, 154:116673.
[36] ZHANG H Y, LUO J X, BELOGLAZOVA N, et al.Portable multiplex immunochromatographic assay for quantitation of two typical algae toxins based on dual-color fluorescence microspheres[J].Journal of Agricultural and Food Chemistry, 2019, 67(21):6 041-6 047.
[37] LI Y, JIN G H, LIU L Q, et al.A portable fluorescent microsphere-based lateral flow immunosensor for the simultaneous detection of colistin and bacitracin in milk[J].The Analyst, 2021, 145(24):7 884-7 892.
[38] ZHANG W J, TANG S S, JIN Y P, et al.Multiplex SERS-based lateral flow immunosensor for the detection of major mycotoxins in maize utilizing dual Raman labels and triple test lines[J].Journal of Hazardous Materials, 2020, 393:122348.
[39] CHAI F L, WANG D, ZHU L N, et al.Dual gold nanoparticle/chemiluminescent immunoassay for sensitive detection of multiple analytes[J].Analytical Chemistry, 2022, 94(17):6 628-6 634.
[40] LIU S J, DOU L N, YAO X L, et al.Nanozyme amplification mediated on-demand multiplex lateral flow immunoassay with dual-readout and broadened detection range[J].Biosensors and Bioelectronics, 2020, 169:112610.
[41] LIU S J, SHU R, MA J Q, et al.Mussel-inspired Fe-based Tannic acid Nanozyme:A renewable bioresource-derived high-affinity signal tag for dual-readout multiplex lateral flow immunoassay[J].Chemical Engineering Journal, 2022, 446:137382.
[42] SHAO Y N, DUAN H, ZHOU S, et al.Biotin-streptavidin system-mediated ratiometric multiplex immunochromatographic assay for simultaneous and accurate quantification of three mycotoxins[J].Journal of Agricultural and Food Chemistry, 2019, 67(32):9 022-9 031.
[43] LI R X, MENG C Z, WEN Y, et al.Fluorometric lateral flow immunoassay for simultaneous determination of three mycotoxins (aflatoxin B1, Zearalenone and deoxynivalenol) using quantum dot microbeads[J].Mikrochimica Acta, 2019, 186(12):748.
[44] HU X F, ZHANG P F, WANG D, et al.AIEgens enabled ultrasensitive point-of-care test for multiple targets of food safety:Aflatoxin B1 and cyclopiazonic acid as an example[J].Biosensors and Bioelectronics, 2021, 182:113188.
[45] ZHAO X, JIN X D, LIN Z, et al.Simultaneous rapid detection of aflatoxin B1 and ochratoxin A in spices using lateral flow immuno-chromatographic assay[J].Foods (Basel, Switzerland), 2021, 10(11):2738.
[46] CHENG N, SONG Y, ZEINHOM M M A, et al.Nanozyme-mediated dual immunoassay integrated with smartphone for use in simultaneous detection of pathogens[J].ACS Applied Materials & Interfaces, 2017, 9(46):40 671-40 680.
[47] LIU H B, DU X J, ZANG Y X, et al.SERS-based lateral flow strip biosensor for simultaneous detection of Listeria monocytogenes and Salmonella enterica serotype enteritidis[J].Journal of Agricultural and Food Chemistry, 2017, 65(47):10 290-10 299.
[48] WU Z Z.Simultaneous detection of Listeria monocytogenes and Salmonella typhimurium by a SERS-based lateral flow immunochromatographic assay[J].Food Analytical Methods, 2019, 12(5):1 086-1 091.
[49] ZHENG S, YANG X S, ZHANG B, et al.Sensitive detection of Escherichia coli O157:H7 and Salmonella typhimurium in food samples using two-channel fluorescence lateral flow assay with liquid Si@quantum dot[J].Food Chemistry, 2021, 363:130400.
[50] LI J X, WU T, WANG C G, et al.Nanogapped Fe3O4@Au surface-enhanced Raman scattering tags for the multiplex detection of bacteria on an immunochromatographic strip[J].ACS Applied Nano Materials, 2022, 5(9):12 679-12 689.
[51] SHEN W Z, WANG C G, ZHENG S, et al.Ultrasensitive multichannel immunochromatographic assay for rapid detection of foodborne bacteria based on two-dimensional film-like SERS labels[J].Journal of Hazardous Materials, 2022, 437:129347.
[52] SHENG W, CHANG Q, SHI Y J, et al.Visual and fluorometric lateral flow immunoassay combined with a dual-functional test mode for rapid determination of tetracycline antibiotics[J].Mikrochimica Acta, 2018, 185(9):404.
[53] ZHOU J Y, NIE W, CHEN Y Q, et al.Quadruplex gold immunochromatogaraphic assay for four families of antibiotic residues in milk[J].Food Chemistry, 2018, 256:304-310.
[54] HENDRICKSON O D, ZVEREVA E A, ZHERDEV A V, et al.Development of a double immunochromatographic test system for simultaneous determination of lincomycin and tylosin antibiotics in foodstuffs[J].Food Chemistry, 2020, 318:126510.
[55] 吴玉晗, 陈伟.侧向免疫层析快速检测牛乳中四环素和青霉素[J].食品科学, 2020, 41(24):281-286.
WU Y H, CHEN W.Rapid detection of tetracycline and penicillin in milk by lateral immunochromatography[J].Food Science, 2020, 41(24):281-286.
[56] 吴烁, 张彪, 张万利, 等.荧光微球免疫层析方法定量检测水产品中4种硝基呋喃代谢物[J].食品科学, 2021, 42(20):299-304.
WU S, ZHANG B, ZHANG W L, et al.Microsphere-based fluorescence immunochromatographic assay for quantitative detection of four nitrofuran metabolites in aquatic products[J].Food Science, 2021, 42(20):299-304.
[57] CAO H, CAO S J, HAN Y Y, et al.Synthesis of quantum dot encoded multicolour nanobeads for the ultrasensitive and multiplex immunochromatographic detection of neonicotinoid insecticides[J].Sensors and Actuators B:Chemical, 2022, 361:131671.