幽门螺杆菌(Helicobacter pylori)是人体常见的致病菌,在全球范围内,H.pylori有着极高的感染率与传染率,特别是在发展中国家,H.pylori的感染率甚至能够达到70%~90%[1]。有研究表明,这种现象可能与H.pylori毒力特性、食物保存方法、饮食习惯和遗传学相关。H.pylori感染与浅表性胃炎、消化性溃疡、非溃疡性消化不良、慢性胃炎甚至是胃癌等多种消化道疾病息息相关[2-5]。目前,国内外公认的根除H.pylori的临床治疗方法是抑酸药物与抗生素的组合[6],但抗生素的使用会增强H.pylori耐药性,同时也会产生包括腹泻、胃胀等在内的副作用[7]。因此,更新治疗H.pylori的方法势在必得。有研究表明,益生菌作为根除H.pylori药物治疗的辅助治疗手段,可以显著提高H.pylori的根除率,降低药物治疗产生的副作用[8]。因此,益生菌或将成为H.pylori治疗的“参与者”,因而被广泛研究[9-11]。
嗜酸乳杆菌、发酵乳杆菌、罗伊氏乳杆菌、鼠李糖乳杆菌、干酪乳杆菌等多种乳杆菌均被研究证明具有抑制H.pylori的作用[10,12-14]。SALAS-JARA等[10]以发酵乳杆菌UCO-979C为研究对象,证明了其在体外能够抑制感染的人胃腺癌(AGS)细胞中H.pylori脲酶的产生,表明其具有抑制H.pylori的能力。SGOURAS等[15]利用H.pylori感染小鼠,证明了干酪乳杆菌Shirota能够显著降低感染小鼠体内H.pylori定殖量,缓解因H.pylori感染引发的胃部炎症。同时,临床试验表明,嗜酸乳杆菌、鼠李糖乳杆菌、罗伊氏乳杆菌能够显著降低患者体内H.pylori载量[16-18]。CHEN等[18]开展了一项包含40名受试者的随机对照临床试验,结果表明在接受4周含有嗜酸乳杆菌和鼠李糖乳杆菌的益生菌制剂治疗之后,受试者14C呼气值得到了显著降低。以上研究均表明,乳杆菌具有缓解H.pylori感染的作用,而共聚集是乳杆菌缓解H.pylori感染的机制之一。德国研究人员利用共聚集作用筛选出1株在体外与H.pylori具有强共聚集作用的罗伊氏乳杆菌DSMZ17648,经过临床实验证明该菌可以降低H.pylori定殖量,改善受试者胃肠道症状,证明基于共聚集作用筛选出的乳杆菌存在临床上治疗幽门螺杆感染的潜能[16-17]。目前,基于乳杆菌通过共聚集作用来缓解H.pylori感染的研究主要集中在罗伊氏乳杆菌DSMZ17648上,中国尚无能够通过共聚集作用来缓解H.pylori感染的乳杆菌菌株。本实验室前期从各种生境中筛选得到多株乳杆菌,从中选取25株可食用且具有较好生理特性的潜力菌株用来筛选与H.pylori具有较强共聚集作用的菌株。
本研究拟筛选出与H.pylori具有较强共聚集作用的菌株,探究其在临床上缓解H.pylori感染的效果,以期开发与H.pylori具有强共聚集作用,用以干预治疗H.pylori感染的食用益生菌。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株与细胞
乳杆菌及H.pylori SS1菌株,江南大学食品学院食品生物技术中心菌种保藏库(所有使用的乳杆菌菌株分离自发酵食品、乳制品及健康人群粪便,H.pylori SS1菌株受赠于南方医科大学陈烨教授);人胃腺癌细胞(AGS),中国科学院(上海)细胞库。
1.1.2 主要试剂
哥伦比亚琼脂培养基、酵母粉,英国OXOID公司;脑心浸液培养基(brain heart infusion, BHI),青岛海博生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),上海赛默飞科技公司;胃蛋白酶,上海生工生物工程有限公司;脱纤维绵羊血(无菌),杭州新锐公司;F-12液体培养基、胎牛血清、胰酶,美国Gibco公司;青霉素、链霉素,上海博光生物公司;粪便基因组提取试剂盒,美国MP公司;超薄琼脂糖凝胶纯化回收试剂盒,北京天根生化科技有限公司。
1.1.3 主要设备
PB3002-N电子天平、EL204分析电子天平、FE20型 pH计,上海梅特勒-托利多公司;TOMY SX-700全自动高压灭菌锅,上海鼎谦生物公司;GRP-9080恒温恒湿培养箱、DGG-9123A电热恒温鼓风干燥箱,上海森信实验公司;SW-CJ-1FD超净工作台,苏州安泰公司;i160三气培养箱、MULTISCAN GO全波长多功能自动酶标仪,美国Thermo Fisher公司;SU8100冷场发射扫描电子显微镜,日本Hitachi公司;
1.2 体外实验方法
1.2.1 乳杆菌与H.pylori共聚集能力的测定
参考HOLZ等[16]的方法。取活化3代的菌液,8 000×g离心10 min,用pH=4的人工胃液(质量分数0.9% NaCl、0.3%胃蛋白酶原)重悬,调整浓度为1×109 CFU/mL。将用人工胃液重悬的H.pylori菌悬液1 mL与乳杆菌菌悬液1 mL混合后,37 ℃培养2 h后,吸取上清液用酶标仪在600 nm处进行测定。每个样本进行3次平行实验。共聚集能力按公式(1)计算:
共聚集能力![]()
(1)
式中:OD乳杆菌、OD致病菌和OD混合分别代表乳杆菌、致病菌和两者混合液在37 ℃静置2 h后在600 nm处测定的吸光值。
1.2.2 乳杆菌与H.pylori共聚集扫描电子显微镜分析
用上述方法获得乳杆菌和H.pylori SS1的共聚集体,加入体积分数4%的戊二醛固定液重悬,放置于4 ℃冰箱中固定过夜。取出固定好的共聚体,使用70%、80%、90%、95%、100%、100%(体积分数)的乙醇溶液进行梯度脱水,每次脱水10 min。于室温下放置5~10 min后,进行真空冷冻干燥处理。用钯溅射干燥好的样品,采用冷场发射扫描电子显微镜对样品扫描观察,放大倍数12 000。
1.2.3 乳杆菌抑制H.pylori黏附能力的测定
参考张美怡[19]的方法,将培养好的AGS细胞消化后接种于细胞用96孔板中(2×104个/孔)置于37 ℃细胞培养箱中培养,待细胞贴壁后,用PBS洗涤3次去除死细胞,加入用不含血清及双抗的F-12培养基重悬的H.pylori菌悬液(2×106 CFU/mL)培养2 h,洗涤3次去除未黏附的H.pylori,之后加入同等浓度的用不含血清及双抗的F-12培养基重悬的乳杆菌菌悬液,培养2 h后洗涤3次,加入200 μL尿素酶指示剂(14 μg/mL苯酚红,20 mmol/L尿素,0.9% NaCl,pH=6.8)培养3 h后,测定550 nm吸光值。每个样本实验重复6次。
1.3 临床试验设计
本研究已经通过江苏省盐城市亭湖区人民医院伦理管理委员会审核(编号:ET2021085),并在中国临床注册中心进行注册(注册号:ChiCTR2100053710)。本研究招募了54名符合条件的受试者,随机分为2组,其中,一组给予安慰剂,另外一组给予发酵乳杆菌FBJSYZ21-1菌粉,两者包装与外观均相同。受试者早晚2次服用菌粉(5×109 CFU/包,2 g/包)或安慰剂产品,服用4周。
1.3.1 临床试验受试者纳入及排除标准
招募人群为通过14C呼气试验诊断为H.pylori感染、无胃肠道病史且未进行根除H.pylori治疗的人群。实验开始前1个月内服用了抗生素或益生菌产品的人群,将被排除在外。
1.3.2 临床试验指标测定
1.3.2.1 14C呼气值
受试者在研究开始前及结束后通过14C呼气试验来测定呼气值。
1.3.2.2 胃肠道症状
胃肠道症状量表(gastrointestinal symptom rating scale, GSRS)参考TIAN等[20]设计。受试者分别在研究开始前及结束后填写量表。
1.3.2.3 血常规及血生化指标测定
受试者在研究开始前及结束后抽取空腹肘静脉血,进行血常规检测及血液生化分析。
1.4 数据分析
数据差异性用 SPSS 25.0和 GraphPad Prism 8进行分析,计量数据表示为“平均值±标准误差”,差异性比较采用单因素方差分析(One-way ANOVA)或者t检验,图形的绘制通过GraphPad Prism 8完成。
2 结果与分析
2.1 乳杆菌与H.pylori共聚集能力的测定
至少2种不同细胞类型彼此黏结并形成共聚集体的过程称为共聚集,合适的乳杆菌与H.pylori细胞相接触形成共聚体,有利于防止H.pylori在体内定殖,降低H.pylori患者体内H.pylori定殖量,缓解因H.pylori定殖所引发的胃肠道疾病。因此,体外共聚集实验是筛选具有H.pylori共聚集能力乳杆菌的重要指标。选取25株可食用且具有较好生理特性的乳杆菌菌株与H.pylori进行体外共聚集实验,如图1所示。对共聚集能力>60%的乳杆菌菌株进行分析,结果表明,发酵乳杆菌FBJSYZ21-1的共聚集能力为(77.45±0.87)%,显著高于其他乳杆菌。
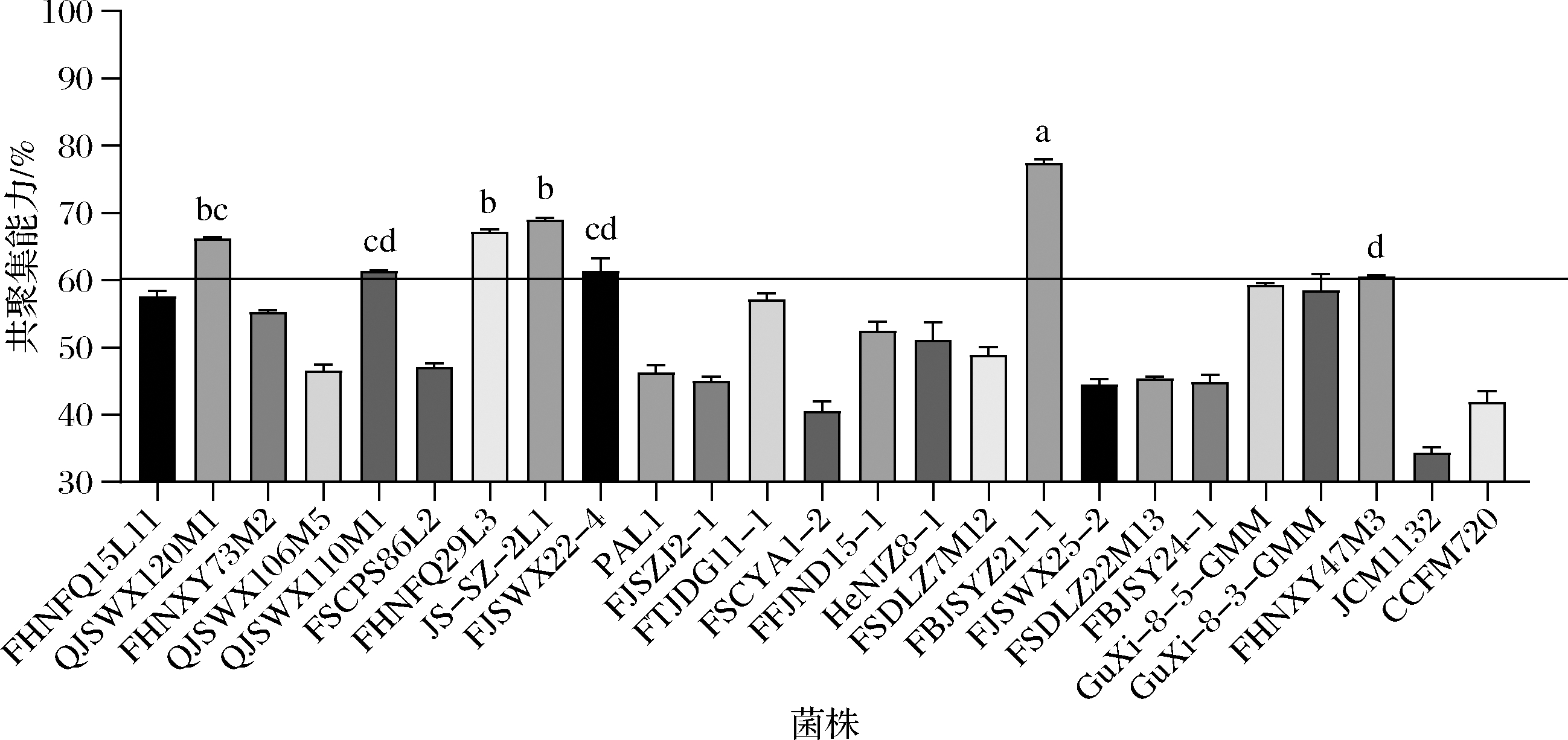
图1 二十五株乳杆菌与H.pylori共聚集能力测定
Fig.1 Determination of the co-aggregation ability of 25 strains of Lactobacillus and Helicobacter pylori
注:不同字母小写字母表示组间存在显著性差异(P<0.05),横线以上为共聚集能力>60%
图2展示了发酵乳杆菌FBJSYZ21-1与H. pylori共聚集SEM图,直观地表现出发酵乳杆菌FBJSYZ21-1与H. pylori共聚集体形态。

a-发酵乳杆菌FBJSYZ21-1;b-发酵乳杆菌与H.pylori共聚集2 h
图2 发酵乳杆菌FBJSYZ21-1单菌和与H.pylori共聚集2 h后SEM图
Fig.2 The SEM photograph of single Limosilactobacillus fermentum and after 2 h co-aggregated with H.pylori
宋雨心等[21]发现10株乳杆菌(包括唾液乳杆菌、食淀粉乳杆菌、口乳杆菌、嗜酸乳杆菌等)与致病性大肠埃希氏菌、鸡白痢沙门氏菌与金黄色葡萄球菌的共聚集能力均达到了80%以上,证明乳杆菌具有良好的抗菌特性。任大勇[22]也证明了共聚集作用强的乳杆菌菌株能够更好地抑制致病菌的侵袭。因此,在所选用的25株乳杆菌中,发酵乳杆菌FBJSYZ21-1与H.pylori表现出较强的共聚集能力,或能在体内发挥缓解H.pylori感染的作用。
2.2 乳杆菌抑制H.pylori黏附能力的测定
H.pylori通过黏附在胃黏膜细胞发挥致病作用,因此,乳杆菌干预能否降低H.pylori的黏附可以反映其是否具有缓解H.pylori感染的作用。将发酵乳杆菌FBJSYZ21-1对H.pylori感染的AGS细胞模型进行干预治疗,得出乳杆菌干预对H.pylori黏附AGS细胞的相对黏附率。相对黏附率与抑制效果成反比,即抑制作用越强,相对黏附率越低。
如图3所示,AGS细胞黏附实验表明,发酵乳杆菌FBJSYZ21-1能够显著降低H.pylori与AGS细胞的黏附[(85.55±3.99)%],显示出极强的降低H.pylori与 AGS细胞黏附的作用。这种抑制黏附的作用可能与菌株的表面物质相关。HU等[23]证明乳杆菌PW-7的胞外多糖具有潜在的抗H.pylori活性和抗氧化性。SALAS-JARA等[10]探究了发酵乳杆菌UCO-979C体外拮抗H.pylori的作用,结果表明UCO-979C菌株可以通过阻碍H.pylori生物膜的形成,来抑制H.pylori感染AGS细胞的脲酶活性(80.4%)。因此,发酵乳杆菌FBJSYZ21-1可能是与H.pylori发生共聚集作用后,破坏H.pylori生物膜的形成,从而抑制了H.pylori与AGS细胞的黏附。
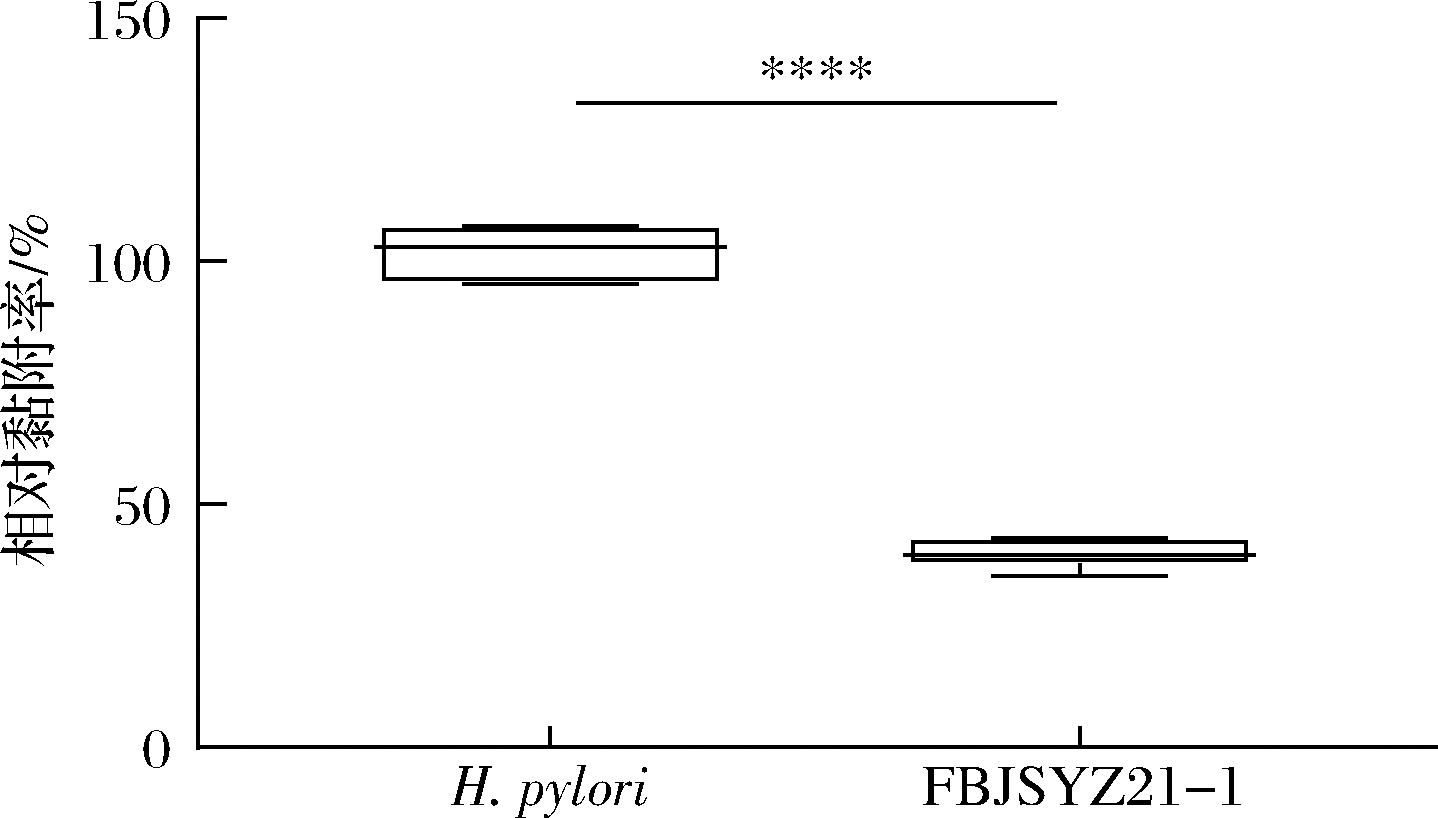
图3 乳杆菌干预对H.pylori与AGS细胞黏附的影响
Fig.3 Effects of Lactobacillus intervention on the adhesion of H.pylori to AGS cells
注: *表示2组间存在显著性差异,P<0.05;**,P<0.01;***,P<0.001;****,P<0.0001(下同)
2.3 临床试验受试者基本信息
如图4所示,本临床试验共招募符合要求的H.pylori阳性患者54名,其中,安慰剂组23名,发酵乳杆菌FBJSYZ21-1干预组31名,中途有17名受试者(空白组8名,益生菌干预组9名)因服用抗生素或失访被排除,2组基本信息如表1所示,2组受试者基本信息比较差异无统计学意义,具有可比性。

图4 临床试验完成情况
Fig.4 Completion of clinical trials
表1 入组受试者基线信息
Table 1 Basic information of the enrolled population
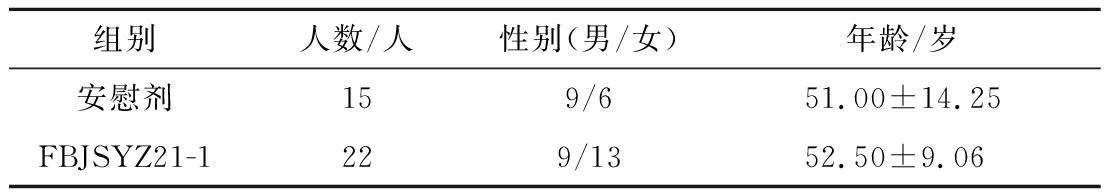
组别人数/人性别(男/女)年龄/岁安慰剂159/651.00±14.25FBJSYZ21-1229/1352.50±9.06
2.4 发酵乳杆菌FBJSYZ21-1干预对受试者H.pylori定殖量的影响
14C呼气值是临床上常用来确定患者是否具有H.pylori感染的方法,这项检测是基于H.pylori的脲酶活性。患者摄入14C同位素标记的尿素,在H.pylori存在的情况下,14C尿素被水解成为铵和带有14C标记的CO2。临床上将14C呼气值>100确诊为H.pylori感染。由于脲酶的活性能够反映H.pylori在体内的定殖状态,因此呼气值的降低也被认为能够间接反映H.pylori在体内的减少或根除。本研究收集益生菌干预前后所有入组受试者的呼气值,2组受试者呼气值变化情况如图5所示。安慰剂组14C呼气值在摄入前后表现出轻微的上升,说明在不进行治疗的情况下,H.pylori感染会逐渐加重。一项针对有胃癌家族史的H.pylori患者临床试验证明,比起持续感染,根除H.pylori显著降低了胃癌的发生[2]。发酵乳杆菌FBJSYZ21-1干预下,受试者的14C呼气值表现出显著的降低。CHEN等[18]的临床研究发现,在经过鼠李糖乳杆菌及嗜酸乳杆菌混合菌制剂干预4周后,与安慰剂组(26.0)相比,益生菌干预组受试者的13C呼气值(18.5)表现出了显著降低13C呼气值>10被诊断为H.pylori感染)。

图5 发酵乳杆菌FBJSYZ21-1干预对H.pylori感染患者14C呼气降低值的影响
Fig.5 Reduction in value of UBT with the supplementation of L.fermentum FBJSYZ21-1
如表2所示,经过4周干预后,与安慰剂组(26.67%)相比,发酵乳杆菌FBJSYZ21-1在根除率方面表现更好(68.18%)。除此之外,张美怡等[24]研究发现鼠李糖乳杆菌JS-SZ-2-1也表现相似的效果。
表2 发酵乳杆菌FBJSYZ21-1干预对H.pylori感染根除率的影响
Table 1 Effect of L.fermentum FBJSYZ21-1 intervention on eradication rate of H.pylori infection

组别人数/人阳性人数/人阴性人数/人转阴率/%安慰剂1511426.67FBJSYZ21-12271568.18
2.5 发酵乳杆菌FBJSYZ21-1干预对受试者胃肠道症状的影响
GSRS是评价患者胃肠症状严重程度和频率的评定量表,受试者根据自身实际情况进行填写,按照症状的4种程度进行评分,评分分数与症状严重程度成正比。如图6所示,在干预前后,安慰剂组的GSRS无显著差异,而经过发酵乳杆菌FBJSYZ21-1干预后,受试者GSRS评分显著降低,表明在乳杆菌干预后受试者胃肠道症状得到了显著改善。这可能与摄入乳杆菌菌株FBJSYZ21-1后,患者体内H.pylori定殖量降低有关。罗伊氏乳杆菌DSM17938、ATCC PTA 6475也表现出类似效果[25]。
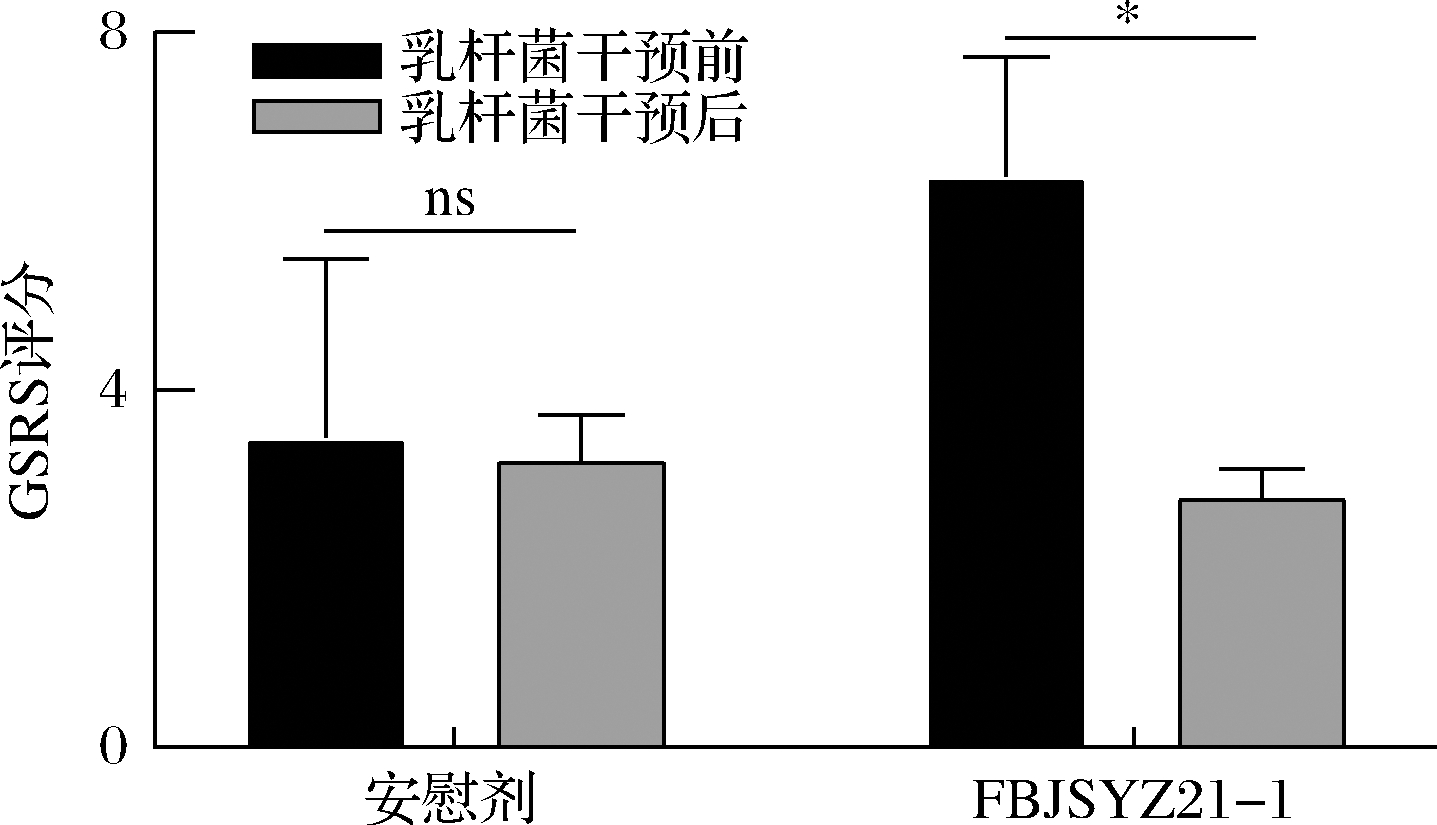
图6 发酵乳杆菌FBJSYZ21-1干预对受试者GSRS评分的影响
Fig.6 Effects of L.fermentum FBJSYZ21-1 on the value of GSRS in subjects
2.6 发酵乳杆菌FBJSYZ21-1干预对受试者血清生化指标的影响
血液常规与血液生化是反映机体状态的一项基础指标。在研究开始前一天和结束后一天分别收集受试者血清进行血液生化指标的检测,以评估乳杆菌干预是否会对受试者产生其他影响。如图7所示,益生菌干预前后,红、白细胞数量、血红蛋白浓度、谷丙转氨酶等指标均未有显著性变化,表示乳杆菌干预对受试者肝脏、肾脏等没有产生其他影响。HOLZ等[16]对罗伊氏乳杆菌DSMZ17648的临床试验也表明,乳杆菌干预不会影响受试者以肝肾功能标记物为安全参数的血常规及血生化指标,与本实验结果一致。

a-白细胞数量;b-红细胞数量;c-血红蛋白;d-血小板数量;e-碱性磷酸脂酶活性;f-谷丙转氨酶活性;g-谷草转氨酶活性;h-尿素
图7 发酵乳杆菌FBJSYZ21-1干预前后受试者的血常规及血清生化指标
Fig.7 Serum indexes of subjects of L.fermentum FBJSYZ21-1 intervention
3 结论
在体外共聚集实验中,发酵乳杆菌FBJSYZ21-1表现出较强的共聚集能力。除此之外,发酵乳杆菌FBJSYZ21-1也表现出了显著抑制H.pylori黏附AGS细胞的能力。进一步对发酵乳杆菌FBJSYZ21-1进行临床实验,以评估发酵乳杆菌FBJSYZ21-1的临床应用效果。临床试验表明,与安慰剂相比,发酵乳杆菌FBJSYZ21-1显著降低了受试者14C呼气值,改善了受试者的胃肠道状况。除此之外,受试者在益生菌干预前后血清生化指标显示,益生菌及安慰剂干预未发现会对受试者体内红细胞、白细胞、谷丙转氨酶等基本生理指标产生影响。
[1] BURKITT M D, DUCKWORTH C A, WILLIAMS J M, et al.Helicobacter pylori-induced gastric pathology:Insights from in vivo and ex vivo models[J].Disease Models & Mechanisms, 2017, 10(2):89-104.
[2] CHOI I J, KIM C G, LEE J Y, et al.Family history of gastric cancer and Helicobacter pylori treatment[J].The New England Journal of Medicine, 2020, 382(5):427-436.
[3] LANAS A, CHAN F K L.Peptic ulcer disease[J].The Lancet, 2017, 390(10094):613-624.
[4] CROWE S E.Helicobacter pylori infection[J].The New England Journal of Medicine, 2019, 380(12):1 158-1 165.
[5] CHOI I J, KOOK M C, KIM Y I, et al. Helicobacter pylori therapy for the prevention of metachronous gastric cancer[J].The New England Journal of Medicine, 2018, 378(12):1 085-1 095.
[6] SUGANO K, TACK J, KUIPERS E J, et al.Kyoto global consensus report on Helicobacter pylori gastritis[J].Gut, 2015, 64(9):1 353-1 367.
[7] YANG C H, LIANG L P, LV P J, et al.Effects of non-viable Lactobacillus reuteri combining with 14-day standard triple therapy on Helicobacter pylori eradication:A randomized double-blind placebo-controlled trial[J].Helicobacter, 2021, 26(6):e12856.
[8] HAGHDOOST M, TAGHIZADEH S, MONTAZER M, et al.Double strain probiotic effect on Helicobacter pylori infection treatment:A double-blinded randomized controlled trial[J].Caspian Journal of Internal Medicine, 2017, 8(3):165-171.
[9] RYAN K A, O’HARA A M, VAN PIJKEREN J P, et al.Lactobacillus salivarius modulates cytokine induction and virulence factor gene expression in Helicobacter pylori[J].Journal of Medical Microbiology, 2009, 58(Pt 8):996-1 005.
[10] SALAS-JARA M J, SANHUEZA E A, RETAMAL-D AZ A, et al.Probiotic Lactobacillus fermentum UCO-979C biofilm formation on AGS and Caco-2 cells and Helicobacter pylori inhibition[J].Biofouling, 2016, 32(10):1 245-1 257.
AZ A, et al.Probiotic Lactobacillus fermentum UCO-979C biofilm formation on AGS and Caco-2 cells and Helicobacter pylori inhibition[J].Biofouling, 2016, 32(10):1 245-1 257.
[11] ZHAO K, XIE Q, XU D, et al.Antagonistics of Lactobacillus plantarum ZDY2013 against Helicobacter pylori SS1 and its infection in vitro in human gastric epithelial AGS cells[J].Journal of Bioscience and Bioengineering, 2018, 126(4):458-463.
[12] ASGARI B, KERMANIAN F, HEDAYAT YAGHOOBI M, et al.The anti- Helicobacter pylori effects of Lactobacillus acidophilus, L.plantarum, and L.rhamnosus in stomach tissue of C57BL/6 mice[J].Visceral Medicine, 2020, 36(2):137-143.
[13] SAKAMOTO I, IGARASHI M, KIMURA K, et al.Suppressive effect of Lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans[J].The Journal of Antimicrobial Chemotherapy, 2001, 47(5):709-710.
[14] SUNANLIGANON C, THONG-NGAM D, TUMWASORN S, et al.Lactobacillus plantarum B7 inhibits Helicobacter pylori growth and attenuates gastric inflammation[J].World Journal of Gastroenterology, 2012, 18(20):2 472-2 480.
[15] SGOURAS D, MARAGKOUDAKIS P, PETRAKI K, et al.In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota[J].Applied and Environmental Microbiology, 2004, 70(1):518-526.
[16] HOLZ C, BUSJAHN A, MEHLING H, et al.Significant reduction in Helicobacter pylori load in humans with non-viable Lactobacillus reuteri DSM17648:A pilot study[J].Probiotics and Antimicrobial Proteins, 2015, 7(2):91-100.
[17] MEHLING H, BUSJAHN A.Non-viable Lactobacillus reuteri DSMZ 17648 (PylopassTM) as a new approach to Helicobacter pylori control in humans[J].Nutrients, 2013, 5(8):3 062-3 073.
[18] CHEN M J, CHEN C C, HUANG Y C, et al.The efficacy of Lactobacillus acidophilus and rhamnosus in the reduction of bacterial load of Helicobacter pylori and modification of gut microbiota:A double-blind, placebo-controlled, randomized trial[J].Helicobacter, 2021, 26(6):e12857.
[19] 张美怡. 具有抗幽门螺杆菌感染作用乳杆菌的筛选及其临床效果评价[D].无锡:江南大学, 2020.
ZHANG M Y.Screening and clinical functional evaluation of Lactobacillus strains for their anti-Helicobacter pylori effects[D].Wuxi:Jiangnan University, 2020.
[20] TIAN P J, CHEN Y, ZHU H Y, et al.Bifidobacterium breve CCFM1025 attenuates major depression disorder via regulating gut microbiome and tryptophan metabolism:A randomized clinical trial[J].Brain, Behavior, and Immunity, 2022, 100:233-241.
[21] 宋雨心, 王文骞, 张园, 等.黏附与聚集、抗肿瘤及抗菌特性乳杆菌的筛选[J].中国预防兽医学报, 2018, 40(11):986-991.
SONG Y X, WANG W Q, ZHANG Y, et al.Screening of the probiotics with adhesion and aggregation, anti-tumor and anti-pathogenic bacteria properties[J].Chinese Journal of Preventive Veterinary Medicine, 2018, 40(11):986-991.
[22] 任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D].长春:吉林大学, 2013.
REN D Y.Research on adhesion and immunoregulation of probiotic Lactobacillus strains[D].Changchun:Jilin University, 2013.
[23] HU J, TIAN X, WEI T, et al.Anti-Helicobacter pylori activity of a Lactobacillus sp.PW-7 exopolysaccharide[J].Foods (Basel, Switzerland), 2021, 10(10):2453.
[24] 张美怡, 翟齐啸, 赵建新, 等.鼠李糖乳杆菌JS-SZ-2-1抗幽门螺杆菌感染的临床效果评价[J].食品与发酵工业, 2020, 46(23):29-34.
ZHANG M Y, ZHAI Q X, ZHAO J X, et al.Clinical efficacy evaluation of Lactobacillus rhamnosus JS-SZ-2-1 against Helicobacter pylori infection[J].Food and Fermentation Industries, 2020, 46(23):29-34.
[25] DORE M P, BIBB S, PES G M, et al.Role of probiotics in Helicobacter pylori eradication:Lessons from a study of Lactobacillus reuteri strains DSM 17938 and ATCC PTA 6475 (Gastrus®) and a proton-pump inhibitor[J].Canadian Journal of Infectious Diseases and Medical Microbiology, 2019:3409820.
S, PES G M, et al.Role of probiotics in Helicobacter pylori eradication:Lessons from a study of Lactobacillus reuteri strains DSM 17938 and ATCC PTA 6475 (Gastrus®) and a proton-pump inhibitor[J].Canadian Journal of Infectious Diseases and Medical Microbiology, 2019:3409820.