白酒是以粮食谷物为原料,以酒曲为糖化剂和发酵剂,经过糖化、发酵、蒸馏和勾兑而成的蒸馏酒[1]。高粱是制作白酒的主要原料,且不同产地高粱产出白酒酒体的风格不同[2]。白酒中含有丰富的风味物质,高级醇就是其中重要的一类,高级醇具有高沸点、强挥发性,其主要包括正丙醇、异丁醇、异戊醇、活性戊醇等,是2个碳以上的一元醇类物质的总称,又被称作杂醇油[3-4]。研究表明,高级醇的代谢包括埃里希(Ehrlich)途径[5]和合成代谢(Harris)[6]途径,Ehrlich代谢机制是在酵母细胞间氨基酸转氨,再脱羧(去CO2),最后生成比原氨基酸少1个碳原子的高级醇;Harris途径是酵母利用糖以α-酮酸及醛为重要中间产物合成高级醇。
高级醇作为风味物质对酒体的贡献很大[7],高级醇的种类和含量决定了白酒的香气特征[8]和口感[9],适量的高级醇可以使得酒体更加协调、丰满,高级醇含量过少则会使酒体过于单薄、不够饱满,然而过量的高级醇会破坏酒体质量,饮后会产生苦、涩等不愉快的感受,还会因不容易代谢而对神经造成难以修复的损伤,使人产生头痛、恶心等上头现象,对人们身体健康造成威胁[10]。因此,调控高级醇的含量对白酒的生产极其重要。
在白酒发酵过程中,白酒的发酵条件影响着杂醇油的含量,如氮源种类[11]、曲粮比例[12]、加糠量以及投粮量[13]等。白酒是通过多种微生物混合发酵、共同作用的产物,杂醇油是酵母发酵的副产物,其产量的多少与酵母代谢途径息息相关[14],通过调控微生物来控制高级醇含量也是一个潜在的突破点。因此,可通过工艺条件和微生物的优化来调控高级醇的含量。
本文通过模拟白酒工艺进行固态发酵,对比大曲和小曲对酒体高级醇的影响,进行液态发酵对比酒曲微生物利用葡萄糖发酵的能力,研究不同产地粳高粱、不同加曲量以及曲与酿酒酵母(Saccharomyces cerevisiae)、异常威克汉姆酵母(Wickerhamomyces anomalus)、米曲霉(Aspergillus oryzae)3种菌协同合作对白酒高级醇含量的影响,以期为白酒酿造过程中高级醇产生量的调控提供理论依据。
1 材料和方法
1.1 材料
1.1.1 微生物菌株
酿酒酵母(Saccharomyces cerevisiae)N-1、异常威克汉姆酵母(Wickerhamomyces anomalus)J-1、米曲霉(Aspergillus oryzae)Q-1均为工业生产用优良菌株,中国食品发酵工业研究院实验室保存。
1.1.2 原料
山西粳高粱、东北粳高粱、小曲、大曲,市售;α-淀粉酶(≥3 700活力单位/g)、糖化酶(≥10万单位/g),北京奥博星生物技术有限责任公司。
1.1.3 仪器
固相微萃取进样器、固相微萃取柱(50/30 μm,DVB/CAR/PDMS),美国Supelco公司;Clarus 600型GC-MS联用仪、AutoSystem XL气相色谱仪、CP-Wax 57CB毛细管色谱柱(50 m×0.25 mm×0.2 μm),美国PerkinElmer公司。
1.2 测定方法
1.2.1 气相色谱分析方法[15]
柱温程序:起始温度40℃,恒温2 min,以10 ℃/min程序升温至60 ℃,以20 ℃ /min程序升温至120 ℃,以40 ℃/min程序升温至220 ℃;载气(高纯N2):流速8 mL/min,分流比1∶1;H2流速45 mL/min;空气流速450 mL/min;检测器温度250 ℃;进样器温度240 ℃。
1.2.2 GC-MS对微量风味成分的定量分析[16]
将分析酒样用超纯水降度至10%,移取一定量稀释后的酒样于20 mL的顶空瓶中,加入NaCl至饱和后再加入内标储备液,放入磁力搅拌转,密封。插入萃取头,纤维头置于距离酒样表面约20 mm的上部空间,搅拌约15 min,在50 ℃水浴温度下萃取,先预热15 min,萃取30 min后,取出手柄,直接进样分析。
GC-MS条件:DB-WAX ETR型色谱柱(30 m×0.25 mm×0.25 μm);柱温箱升温程序:初始温度35 ℃,恒温2 min,以4 ℃/min升至230 ℃,保持7 min。进样口温度250 ℃,载气He,流速1.0 mL/min,不分流。电子轰击(electron impact,EI)离子源,电子能量70 eV,传输线温度240 ℃,离子源温度240 ℃,质量扫描m/z 55~500。
1.3 菌液及培养基的制备
1.3.1 酵母种子液制备[17]
一级种子液:从试管斜面接种一环酵母菌于5 mL YPD培养基的20 mL试管中,30 ℃、180 r/min培养12 h。
二级种子液:将1 mL一级种子液转接入装有100 mL YPD培养基的250 mL三角瓶中,30 ℃、180 r/min培养12 h,至菌液浓度为107CFU/mL左右。
1.3.2 米曲霉孢子悬浮液制备[18]
霉菌孢子悬浮液的制备:于活化的菌株斜面倒入10 mL无菌水,用接种环刮下斜面上孢子,将孢子打散混匀,用血球计数板计数,进行稀释,至孢子浓度为108 CFU/mL左右[15]。
1.3.3 高粱汁发酵培养基
高梁汁发酵培养基:称取100 g粉碎高粱(粒度0.45 mm)加入800 mL自来水,蒸煮2 h,冷却后加入1.35 g α-淀粉酶、0.05 g糖化酶进行糖化、液化处理,搅拌均匀放置于60 ℃水浴锅中保温2~3 h,期间使用稀碘液试纸不变蓝,继续加热煮沸5 min,冷却后过滤,调整糖度为7°Bx。115 ℃灭菌20 min备用。
1.4 发酵工艺
实验室模拟白酒固态发酵采取陶罐发酵,工艺如下所示:
原料→粉碎→润粮→蒸粮→摊晾加水→加曲→入缸发酵→出缸拌糠→装甑蒸馏→风味检测
工艺要点如下:将高粱粉碎,粉碎粒度至1.5 mm,称取粉碎好的1 000 g高粱加入600 mL的85 ℃热水润粮24 h,第2天将高粱蒸煮80 min后,加入300 mL冷水,冷却待温度降到25~30 ℃时,添加160 g的大曲粉或者小曲粉,将曲和料拌匀后,装入罐内发酵,将陶罐完全密封,发酵30 d后拌糠蒸馏[19]。
实验室模拟液态白酒发酵采取三角瓶发酵,根据实验设计将菌液或曲粉接种于含100 mL高粱汁发酵培养基的三角瓶中,30 ℃静置培养数天,发酵结束后样液用1.2.1方法测定高级醇含量,每个实验重复3次。
1.4.1 小曲、大曲对固态发酵酒的影响
利用小曲、大曲2种酒曲分别按照实验室模拟固态白酒发酵方法进行,用1.2.2方法检测酒样风味成分。
1.4.2 粳高粱产地对液态发酵小曲酒的影响
按照1.3.1方法分别制备山西粳高粱、东北粳高粱发酵培养基。加入清香小曲2 g,按照实验室模拟液态白酒发酵方法发酵1~7 d后取样分析。
1.4.3 加曲量对液态发酵小曲酒的影响
加曲量按曲粮比为(2%、4%、6%、8%、10%,质量分数,下同)分别按照1.4中实验室模拟液态白酒发酵方法进行,发酵5 d后取样分析。
1.4.4 曲与微生物对液态发酵大曲酒的影响
按照实验室模拟液态白酒发酵方法进行,在高粱汁中接种大曲、异常威克汉姆酵母、酿酒酵母的二级种子液和米曲霉的孢子悬浮液按照表1添加量进行发酵。
表1 微生物接种量与大曲加样量
Table 1 Microbial inoculation and Daqu dosing

实验组大曲J-1N-1Q-1110%000201%003001%040001%510%1%00610%01%0710%001%801%1%0910%1%1%01001%1%1%1110%1%1%1%
1.5 数据处理
实验数据采用Origin、Excel 2019和SPSS 26.0进行数据处理和分析。
2 结果与分析
2.1 小曲、大曲对固态发酵酒的影响
小曲、大曲对固态发酵白酒的总高级醇、总醛、总酯含量如图1所示,总酯是乙酸乙酯、丁酸乙酯、乙酸异戊酯、油酸乙酯、亚油酸乙酯、乳酸乙酯、辛酸乙酯、己酸乙酯、棕榈酸乙酯含量的总和;总高级醇为仲丁醇、正丁醇、异戊醇、异丁醇、正丙醇、活性戊醇、苯乙醇、正己醇8种高级醇的总和;总醛含量是乙醛、丙醛、异丁醛、乙缩醛、异戊醛、苯甲醛含量的总和。大曲酒总高级醇、总酯、总醛的含量均高于小曲酒,所以大曲酒相比较于小曲酒醇香馥郁、回味甘甜。由于二者中所富含的微生物种类、数量、性能不同,利用小曲、大曲酿出的酒的高级醇含量也有很大差异的,酒曲的种类不同会影响到白酒中高级醇的含量。
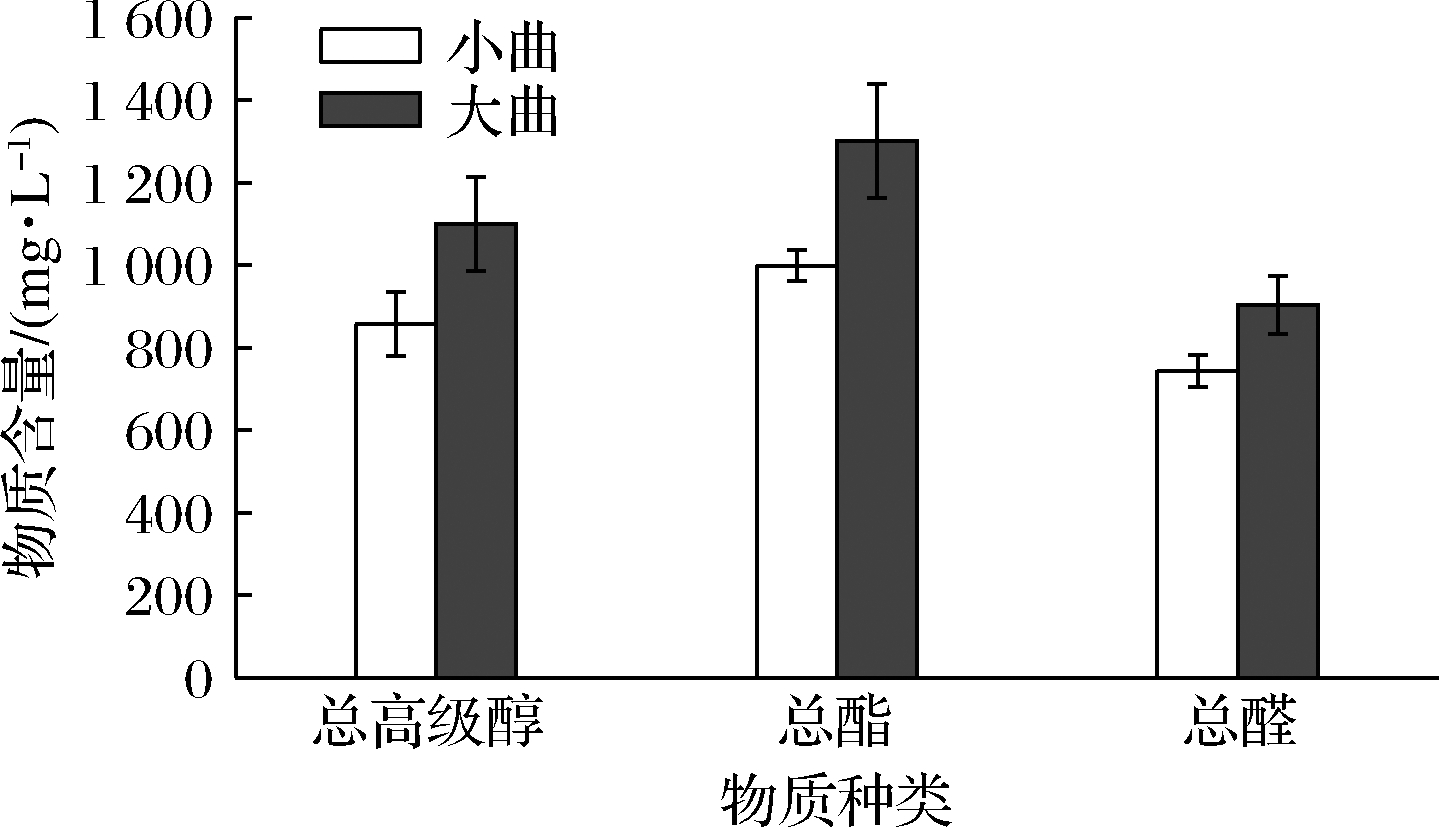
图1 小曲、大曲酒的高级醇总和、总酯、总醛对比
Fig.1 Comparison of the total higher alcohols, total ester and total aldehyde of Xiaoqu and Daqu Baijiu
小曲、大曲对固态发酵白酒的高级醇含量影响如表2所示,总高级醇含量是仲丁醇、正丙醇、异丁醇、正丁醇、活性戊醇、异戊醇、苯乙醇、正己醇的含量的总和。大曲酒的总高级醇含量为(1 099.47±113.71) mg/L,小曲酒总高级醇含量为(857.50±78.13) mg/L,高出了28.2%。大曲酒中正丙醇、异丁醇、异戊醇的含量高于小曲酒,而正丁醇、苯乙醇和活性戊醇的含量低于小曲酒。
表2 小曲、大曲对固态发酵白酒醇类物质的影响 单位:mg/L
Table 2 Effects of Daqu and Xiaoqu on alcohols of solid fermented Baijiu

不同酒曲仲丁醇正丙醇异丁醇正丁醇活性戊醇异戊醇苯乙醇正己醇高级醇总和小曲酒N56.03±11.51180.91±16.19512.76±7.29137.58±12.87400.28±68.6268.62±7.111.19±0.26857.50±78.13大曲酒0.77±0.66114.13±19.08307.50±49.4510.42±3.85100.04±30.66553.98±48.5611.62±7.431.01±1.021 099.47±113.71
注:N表示未检出
2.2 不同产地粳高粱对液态发酵小曲酒的影响
如图2所示,同样是粳高粱,小曲在不同产地的粳高粱汁中发酵时产高级醇的含量不同。随着发酵时间的变化,小曲在山西粳高粱汁中发酵了2 d达到峰值后总高级醇含量呈递减趋势,到第5天时总高级醇含量升高后继续下降,而在东北粳高粱汁中发酵时总高级醇含量呈递减趋势,东北粳高粱发酵1天所产高级醇含量比山西粳高粱高3.5倍,总高级醇含量相差最大。
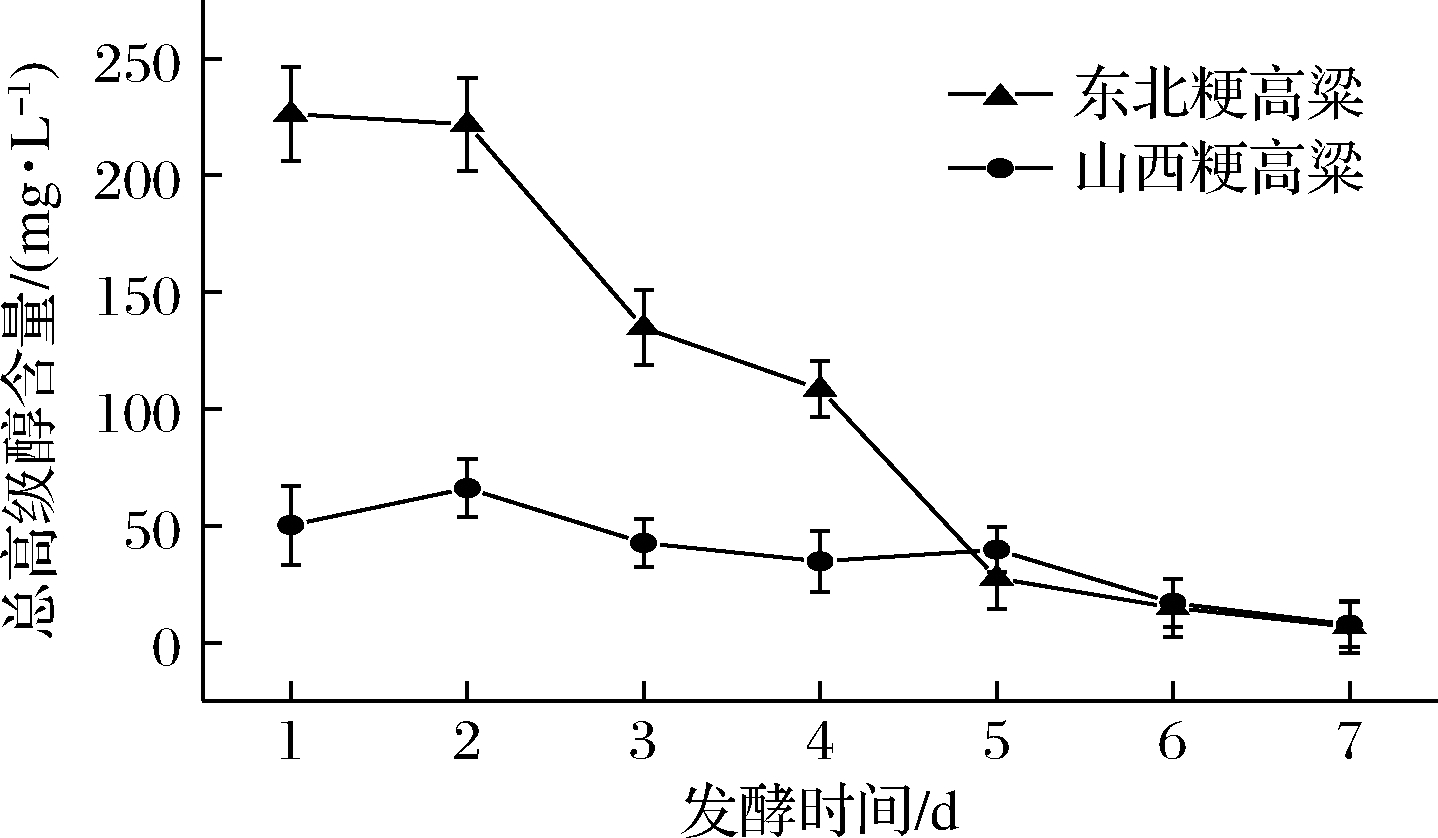
图2 液态发酵中不同产地粳高粱产总高级醇含量
Fig.2 Content of total higher alcohol produced by japonica sorghum of different origins during liquid fermentation
注:总高级醇为异戊醇、异丁醇、正丙醇3种主要高级醇的总和
造成此现象原因可能是不同高粱的淀粉结构和含量间的差异,东北粳高粱所含的淀粉更容易被微生物分解利用,同时产生酒精和副产物高级醇[20]。发酵前期可能由于淀粉含量较高,利用较充分,发酵到5 d时山西粳高粱中淀粉含量略高于东北粳高粱,也可能是由于不同高粱中的单宁含量不同从而对微生物种群产生了一定的影响[21]。
2.3 不同加曲量对液态发酵小曲酒的影响
以山西高粱为原料用小曲进行液态发酵,通过添加不同曲料比探究对高级醇含量的影响(图3)。曲料比在4%时3种高级醇的含量最高,而曲料比在2%时产高级醇含量最少,曲料比在6%、8%、10%时3种高级醇的总含量相差不大。曲料比在2%时所产的3种高级醇含量的总和比曲料比在4%时低98.4%。造成该现象的原因可能是在曲料比为2%时,由于加曲量太少,富集的微生物含量过少从而产高级醇较少。在曲料比为6%、8%、10%时,由于加曲量过多从而富集微生物过多,导致微生物之间相互竞争进而生长受到抑制,最终导致产高级醇的微生物存活量较少,进一步减少了微生物分解氨基酸或利用葡萄糖过程中高级醇的生成。曲料比为4%时,各微生物之间可能达到平衡或互利模式,使得微生物的生长到达最适状态,从而产高级醇较高。因此在工艺优化中可以通过调节曲料比来控制高级醇含量。

图3 不同加曲量对产高级醇的影响
Fig.3 Effect of Daqu content on the production of higher alcohols
2.4 曲与微生物对液态发酵大曲酒的影响
不同曲与菌种液态发酵的高级醇含量如图4-a~图4-c所示,在大曲、各菌种单独发酵时,异常威克汉姆酵母J-1产异戊醇和异丁醇的能力低于酿酒酵母N-1,产正丙醇的能力高于酿酒酵母N-1。米曲霉Q-1高级醇产量最低,酿酒酵母N-1发酵产3种高级醇总含量最高(图4-d),说明酿酒酵母N-1充分利用高粱汁的碳源生成高级醇的能力最强。

a-异戊醇;b-异丁醇;c-正丙醇;d-3种高级醇总含量
图4 大曲和菌种液态发酵对高级醇的影响
Fig.4 Effect of liquid fermentation of Daqu and strains on higher alcohols
注:G-大曲;J-异常威克汉姆酵母J-1;N-酿酒酵母N-1;Q-米曲霉Q-1;不同字母表示差异显著(P<0.05)
如图4-d所示,大曲和米曲霉Q-1共同发酵时相对于大曲单独发酵,高级醇含量有所提高,可能因为米曲霉Q-1与大曲中微生物协同产生了代谢产物高级醇[22];大曲和酿酒酵母N-1共同发酵时,高级醇含量相比大曲单独发酵时有显著的上升,但比酿酒酵母N-1菌种单独发酵时的产量低,可能由于其过度增殖,而大曲中的微生物与其有竞争关系,导致酿酒酵母N-1细胞量减少,从而降低了高级醇含量;大曲和异常威克汉姆酵母J-1共同发酵时产高级醇量相比大曲单独发酵时低,是因为微生物间相互抑制,导致产高级醇的微生物存活率较低,降低了高级醇的含量。
酵母与大曲中产高级醇的微生物共同发酵时有抑制作用,大曲与酿酒酵母N-1、异常威克汉姆酵母J-1混合发酵时高级醇含量显著低于大曲单独发酵时。酿酒酵母N-1和异常威克汉姆酵母J-1共同发酵产高级醇的含量明显要低于酿酒酵母N-1单独发酵时,说明2种酵母共同发酵时存在竞争关系。
大曲与米曲霉Q-1、酿酒酵母N-1和异常威克汉姆酵母J-1共同发酵时比3种菌株混合发酵时产异戊醇、异丁醇和正丙醇的含量分别降低了53.88%、47.77%、88.57%,但比大曲和酿酒酵母N-1、异常威克汉姆酵母J-1混合发酵时的异戊醇和异丁醇含量分别增加了73.79%和60.30%,说明米曲霉Q-1产生的蛋白酶对大曲和酿酒酵母N-1、异常威克汉姆酵母J-1共同发酵时利用氨基酸产异戊醇和异丁醇起到了促进作用。米曲霉Q-1、酿酒酵母N-1和异常威克汉姆酵母J-1共同发酵时与酿酒酵母N-1和异常威克汉姆酵母J-1混合发酵时相比,所产异戊醇、异丁醇分别降低了5.17%和4.20%,正丙醇增加了1.96%,说明米曲霉Q-1对2种酵母混合发酵产高级醇没有显著影响。
3 结语
通过改变酒曲种类、产地酿酒原料、加曲量以及微生物等多个因素模拟白酒发酵实验结果发现:利用小曲酿酒和大曲酿酒酯类和醇类物质产量差别较大,小曲发酵产高级醇含量较少,可能是因为小曲富含的微生物种类、数量、性能与大曲的不同,因此后期可通过筛选小曲中优良菌种再添加到大曲中进行发酵酿酒进而调控酒中高级醇含量。
随着发酵时间的变化,小曲在山西粳高粱汁中发酵2 d时达到峰值后总高级醇含量呈持续递减趋势,到发酵5 d时总高级醇含量升高后继续下降,而在东北粳高粱汁中发酵时总高级醇含量呈递减趋势,东北粳高粱发酵1 d所产高级醇含量比山西粳高粱高3.5倍,总高级醇含量相差最大。
曲料比的不同对高级醇含量有一定的影响,实验发现曲料比为4%时3种高级醇的含量最高,曲料比在2%时产高级醇含量最少,曲料比在6%、8%、10%时3种高级醇的总含量相差不大,而曲料比在2%时所产的3种高级醇含量的总和比曲料比在4%时低98.4%。
与大曲单独发酵时相比,大曲和米曲霉Q-1共同发酵、大曲和酿酒酵母N-1共同发酵时,产高级醇的量有所增加;大曲和异常威克汉姆酵母J-1共同发酵,大曲与酿酒酵母N-1、异常威克汉姆酵母J-1共同发酵的高级醇产量降低。米曲霉Q-1、酿酒酵母N-1和异常威克汉姆酵母J-1共同发酵时与酿酒酵母N-1和异常威克汉姆酵母J-1混合发酵时相比高级醇产量没有显著变化,说明米曲霉Q-1对2种酵母混合发酵产高级醇没有显著影响。米曲霉Q-1产生的蛋白酶对大曲和酿酒酵母N-1和异常威克汉姆酵母J-1发酵利用氨基酸产异戊醇和异丁醇起到了促进作用。
[1] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5 425-5 432.
[2] HAN X L, WANG D L, ZHANG W J, et al.The production of the Chinese Baijiu from sorghum and other cereals[J].Journal of the Institute of Brewing, 2017, 123(4):600-604.
[3] LACHENMEIER D W, HAUPT S, SCHULZ K.Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products[J].Regulatory Toxicology and Pharmacology, 2008, 50(3):313-321.
[4] EL-DALATONY M M, SAHA S, GOVINDWAR S P, et al.Biological conversion of amino acids to higher alcohols[J].Trends in Biotechnology, 2019, 37(8):855-869.
[5] MANGAS J J, CABRANES C, MORENO J, et al.Influence of cider-making technology on cider taste[J].LWT - Food Science and Technology, 1994, 27(6):583-586.
[6] 甘水洋. 啤酒中高级醇的产生及控制办法[J].福建轻纺, 1998(1):1-4.
GAN S Y.Producing and controlling of senior alcohol in beer production[J].The Light & Textile Industries of Fujian, 1998(1):1-4.
[7] CORDENTE A G, ESPINASE NANDORFY D, SOLOMON M, et al.Aromatic higher alcohols in wine:Implication on aroma and palate attributes during chardonnay aging[J].Molecules (Basel, Switzerland), 2021, 26(16):4979.
[8] DE-LA-FUENTE-BLANCO A, S ENZ-NAVAJAS M P, FERREIRA V.On the effects of higher alcohols on red wine aroma[J].Food Chemistry, 2016, 210:107-114.
ENZ-NAVAJAS M P, FERREIRA V.On the effects of higher alcohols on red wine aroma[J].Food Chemistry, 2016, 210:107-114.
[9] 苟静瑜, 贾智勇, 闫宗科, 等.降低白酒中高级醇含量的研究进展[J].酿酒, 2016, 43(4):25-29.
GOU J Y, JIA Z Y, YAN Z K, et al.Research progress in decreasing the contents of higher alcohols in Baijiu(liquor)[J].Liquor Making, 2016, 43(4):25-29.
[10] 程军, 秦伟帅, 赵新节.葡萄酒酿造中高级醇的形成机制与调节[J].中国酿造, 2011, 30(12):9-11.
CHENG J, QIN W S, ZHAO X J.Formation and regulation of higher alcohols in wine fermentation[J].China Brewing, 2011, 30(12):9-11.
[11] YIN Y J, HAN X L, LU Y F, et al.Control of N-propanol production in simulated liquid state fermentation of Chinese Baijiu by response surface methodology[J].Fermentation, 2021, 7(2):85.
[12] 孙金旭, 朱会霞, 杨晓红, 等.酵母添加量对酱香型白酒中杂油醇影响[J].食品研究与开发, 2010, 31(12):67-70.
SUN J X, ZHU H X, YANG X H, et al.The increase the volume of different yeast inoculum concentration influence study on the Maotai-alcohol[J].Food Research and Development, 2010, 31(12):67-70.
[13] 罗惠波, 苟云淩, 叶光斌, 等.影响白酒中高级醇生成的工艺条件研究[J].中国酿造, 2011, 30(8):87-90.
LUO H B, GOU Y L, YE G B, et al.Process conditions influencing the formation of higher alcohols in liquor spirit[J].China Brewing, 2011, 30(8):87-90.
[14] 张敏倩, 刘功良, 费永涛, 等.白酒酿造中杂醇油调控技术的研究进展[J].中国酿造, 2020, 39(5):8-12.
ZHANG M Q, LIU G L, FEI Y T, et al.Research progress on control technology of fusel oil during Baijiu fermentation[J].China Brewing, 2020, 39(5):8-12.
[15] 王鹏, 蒋超, 崔磊, 等.安徽地产白酒风味构成的分析研究[J].中国酿造, 2018, 37(5):37-41.
WANG P, JIANG C, CUI L, et al.Analysis and research on the flavor composition of Baijiu produced in Anhui[J].China Brewing, 2018, 37(5):37-41.
[16] 郭世鑫, 张小娜, 姚孟琦, 等.不同工艺酱香型白酒成分分析[J].食品与发酵工业, 2022, 48(1):241-246.
GUO S X, ZHANG X N, YAO M Q, et al.Composition analysis of Maotai-flavor Baijiu with different processing technologies[J].Food and Fermentation Industries, 2022, 48(1):241-246.
[17] 王亚平, 邢爽, 孙中贯, 等.液态法大曲酒发酵过程中高级醇影响因素的研究[J].天津科技大学学报, 2019, 34(5):39-44.
WANG Y P, XING S, SUN Z G, et al.Factors influencing higher alcohol in the liquid fermentation of Daqu Baijiu[J].Journal of Tianjin University of Science & Technology, 2019, 34(5):39-44.
[18] 叶磊. 小曲中优良根霉的分离筛选及产酶条件研究[D].重庆:西南大学, 2009.
YE L.Screening and optimization of producing enzyme condition of excellent Rhizopus in Chinese koji[D].Chongqing:Southwest University, 2009.
[19] 陈彬, 何宏魁, 刘国英, 等.大小曲及发酵方式对清香型白酒风味的影响[J].食品与发酵工业, 2018, 44(8):166-171.
CHEN B, HE H K, LIU G Y, et al.The influence of the Daqu, Xiaoqu and the fermentation way on the flavor of Fen-flavor Baijiu(Chinese liquor)[J].Food and Fermentation Industries, 2018, 44(8):166-171.
[20] 孙细珍, 熊亚青, 杜佳炜, 等.不同品种高粱小曲白酒感官表征及重要风味物质对比分析[J].食品与发酵工业, 2022, 48(9):34-40.
SUN X Z, XIONG Y Q, DU J W, et al.Comparative analysis of aroma compounds in Xiaoqu Baijiu fermented by different varieties of sorghum[J].Food and Fermentation Industries, 2022, 48(9):34-40.
[21] 杨玲, 王琪, 郭旭凯, 等.高粱单宁含量对清香型大曲白酒酒醅中细菌种群的影响[J].中国酿造, 2020, 39(7):83-88.
YANG L, WANG Q, GUO X K, et al.Effect of tannin content of sorghum on bacterial community in fermented grains of Fen-flavor Daqu Baiju[J].China Brewing, 2020, 39(7):83-88.
[22] WU Q, CHEN B, XU Y.Regulating yeast flavor metabolism by controlling saccharification reaction rate in simultaneous saccharification and fermentation of Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology, 2015, 200:39-46.