胆固醇是细胞的功能和完整性的必需物质,但长期血清胆固醇水平升高可能导致动脉粥样硬化,因此被认为是心血管疾病的主要危险因素。根据世界卫生组织的数据,心血管疾病仍将是导致死亡的主要原因,到2030年将影响全球约2 360万人,而且高胆固醇血症者发生心脏病的概率是血脂正常者的3倍[1-3]。有关降脂的大规模随机试验发现,血清总胆固醇水平降低1%,即可使冠心病的发生几率降低2%~3%[4]。肝脏中高胆固醇血症导致甘油三酯的过度积累也被认为是非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的重要原因[5]。目前使用他汀类药物是治疗高胆固醇血症最广泛的方法,然而,这类药物中有些价格昂贵,还有些有副作用[2],包括导致肌肉疼痛、肝损伤、神经系统紊乱、血糖升高和流产等[6]。因此,有必要开发更安全、成本更低、效果更好的治疗高胆固醇血症的方法。
20世纪70年代,MANN首次报道了含有乳酸菌的发酵乳有降胆固醇作用后,研究人员探讨了乳酸菌的降胆固醇作用,尤其是乳杆菌和双歧杆菌,也证实了食用益生菌,可显著降低低密度脂蛋白和总胆固醇水平[1,7-8]。ZAFAR等[3]的研究表明,鼠李糖乳杆菌FM9和发酵乳杆菌Y57在改善高胆固醇、高脂饮食模型的雄性大鼠血脂方面与他汀类药物一样有效。CardiovivaTM是目前市售的降胆固醇益生菌产品之一,该产品已被加拿大卫生部批准为心血管健康的膳食补充剂,在美国和欧洲也有报道显示每日摄入该产品可使高胆固醇血症成人低密度脂蛋白胆固醇水平降低11.6%[1]。因此,益生菌以其安全性高、价格低廉、容易获取等优点,作为药物辅助治疗剂,颇具市场开发潜力。
从安全角度考虑,具有悠久食用历史的传统发酵食品是获得益生菌资源的良好来源,它们受制作工艺和环境条件的影响含有不同的微生物群落。拜城县隶属于我国新疆阿克苏地区,当地医疗水平落后,地理环境恶劣,人们生活水平也较低,但却被国际自然医学会(International Society of Natural Medicine,INMS)在1984年认定为世界级“长寿乡”[9]。拜城县的人们习惯食用家庭自制的赛里木酸奶,其品质优越、极具民族特色和地域特点,是新疆维吾尔族的非物质文化遗产,甚至被誉为“长寿秘诀”[10]。苑贝贝[10]发现赛里木酸奶中的功能因子除了来源于奶源之外,最大可能的来源就是其中的微生物。但是目前尚无针对赛里木酸奶源降解胆固醇微生物的研究。
本课题组前期对赛里木酸奶中的微生物进行了分离和纯化,并运用分子生物学方法对分离纯化的菌株进行了初步鉴定,根据基础特性(对人工胃液、人工肠液的耐受性,对常见病原菌的抑菌性,对Caco-2细胞的黏附性)对初步鉴定的菌株进行了筛选,结果发现从赛里木酸奶中筛选出的大部分疑似植物乳杆菌具有较优的基础特性,是潜在的益生菌株。因此,本研究对从赛里木酸奶中筛选出的疑似植物乳杆菌进行降解胆固醇能力的研究,并对高降解胆固醇菌株通过生理生化试验进一步进行鉴定,最后对其安全性进行初步研究,以期得到高降解胆固醇能力和具有一定安全性的潜在赛里木酸奶源益生菌菌株,为下一步对菌株进行体内降胆固醇功能研究和应用提供数据支撑。
1 材料与方法
1.1 实验材料
1.1.1 菌株来源
鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG, LGG),购自中国微生物菌种保藏管理委员会普通微生物中心,编号为ATCC 53103,作为对照菌株。
大肠杆菌(Escherichia coli)ATCC 25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923,保存自河北农业大学生物工程系实验室,作为抗生素敏感性试验和溶血试验的质控菌株。
疑似植物乳杆菌R2-5、R2-7、R2-8、R4-2、R5-1、R6-1、R6-2、R6-3,分离自新疆传统赛里木酸奶,为本研究的试验菌株。
1.1.2 主要培养基的配制
胆固醇 MRS 培养基:2 g/L胆盐,2 g/L巯基乙酸钠和100 μg/mL胆固醇的MRS 培养基。
1.1.3 主要仪器与设备
SHP-250生化培养箱,上海精宏实验设备有限公司;LG GR-206SVQ冰箱,泰州乐金电子冷机有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司;DL-CJ-1N超净工作台,哈尔滨东联电子技术开发有限公司;5417R高速冷冻离心机,德国Eppendorf;酶标仪,美国Thermo公司等。
1.2 试验方法
1.2.1 菌株降胆固醇能力测定
采用李尧[11]报道的硫酸铁铵法稍作修改,测定菌株降解胆固醇的能力,具体操作如下:分别取0、0.1、0.2、0.3、0.4、0.5 mL质量浓度为1 mg/mL的胆固醇溶液加入到10 mL试管中,然后依次加入1、0.9、0.8、0.7、0.6、0.5 mL无水乙醇,再依次缓慢加入2 mL硫酸铁铵试剂,混匀,待冷却至室温后,在560 nm波长下测吸光度。以胆固醇浓度为横坐标,以吸光值为纵坐标,制作标准曲线。将活化至对数末期的菌株按体积比为1%的比例接种到胆固醇MRS 培养基中,37 ℃恒温培养至稳定期,将培养液5 000 r/min离心10 min,取2 mL上清液于干净试管中,加8 mL无水乙醇,摇匀,4 500 r/min离心10 min,取1 mL上清液于新的干净试管中,加入2 mL 硫酸铁铵显色液,摇匀,冷却后于 560 nm 处测定吸光度值,即为A样品,未接种菌株的胆固醇 MRS培养基作对照,即为A对照。胆固醇降低率按公式(1)计算。
胆固醇降低率![]()
(1)
1.2.2 高降解胆固醇菌株的鉴定
1.2.2.1 生理生化鉴定
按照乳酸菌成套生化鉴定管(SHBG13)使用说明书进行操作,对高降解胆固醇菌株进一步进行生理生化鉴定,结果判断标准如表1所示。
表1 乳酸菌生化试验判断标准
Table 1 The judgment standard for biochemical test of lactic acid bacteria

产品名称结果判断阳性阴性培养时间/h备注七叶苷黄色或黑色紫色或紫灰色24~48无菌液体石蜡覆盖麦芽糖黄色紫色或紫灰色24~48/纤维二塘黄色紫色或紫灰色24~48/水杨苷黄色紫色或紫灰色24~48/甘露醇黄色紫色或紫灰色24~48/山梨醇黄色紫色或紫灰色24~48/棉子糖黄色紫色或紫灰色24~48/蔗糖黄色紫色或紫灰色24~48/乳糖黄色紫色或紫灰色24~48/菊糖黄色紫色或紫灰色24~48/1%马尿酸钠深紫色淡紫色或无色培养结束后,加入0.2 mL茚三酮溶液,置于37 ℃培养箱,10 min后判读结果
1.2.2.2 构建系统发育树
下载与高降解胆固醇菌株的16S rDNA序列同源性最高菌株的序列,使用MEGA软件,利用Neighbor-joining统计方法,采用Bootstrap method法建树,反复次数为1 000,运用p-distance方法计算进化距离,构建系统发育树。
1.2.3 高降解胆固醇菌株的安全性评价
1.2.3.1 抗生素敏感性检测
以LGG为对照菌株,金黄色葡萄球菌ATCC 25923和大肠杆菌ATCC 25922为质控菌株,采用药敏纸片琼脂扩散法[12]检测菌株对抗生素的敏感性。将活化好的LGG、R2-5、R2-7、R4-2、ATCC 25923和ATCC 25922用生理盐水洗涤、重悬,调整浓度为(1~2)×108CFU/mL,取100 μL菌悬液,LGG、R2-5、R2-7和R4-2均匀涂布于倒入25 mL无菌MRS固体培养基已凝固的平板上,ATCC 25923和ATCC 25922均匀涂布于倒入25 mL无菌LB固体培养基已凝固的平板上,3~10 min后,用无菌镊子夹药敏片轻放于固体培养基上,扩散5 min后,倒置于37 ℃恒温培养箱中24 h,然后测量抑菌圈直径。参照美国临床和实验室标准协会(Clinical & Laboratory Standards Institute,CLSI)标准来判断菌株的药敏性。
1.2.3.2 质粒检测
质粒的提取以含有质粒的植物乳杆菌为阳性对照菌株,与不含质粒的LGG为阴性对照菌株,参照文献[13]的方法进行操作。
1.2.3.3 氨基酸脱羧酶活性的测定
参照文献[14]的方法略有修改。将待测菌株在MRS液体培养基中活化好之后,接种于含质量分数为0.1%的前体氨基酸(组氨酸、酪氨酸、色氨酸、赖氨酸、鸟氨酸、苯丙氨酸)和含质量分数为0.005%吡哆醛-5-磷酸的MRS液体培养基中,37 ℃培养24 h,传代5次,以此诱导脱羧酶。然后将菌株接入含前氨基酸的脱羧酶培养基,不含前氨基酸的液体培养基作为对照,放置于37 ℃恒温培养箱中培养4 d,观察培养基颜色变化。若颜色变成紫色,则为阳性结果,表示菌株形成氨基酸对应的生物胺。
1.2.3.4 溶血活性检测
以金黄色葡萄球菌ATCC 25923为质控菌株,将LGG、R2-5、R2-7、R4-2和ATCC 25923分别在哥伦比亚血琼脂平板上划线,37 ℃培养48 h,观察溶血反应特征。根据《乳酸细菌分类鉴定及实验方法》[15]进行溶血判断。
1.3 数据统计分析
试验数据统计分析和图片绘制采用SPSS 17.0和 GraphPad Prism 8.0.1软件完成。用ANOVA分析各处理组间差异显著性,显著性标准设为P<0.05,极显著标准设为P<0.01。
2 结果与分析
2.1 菌株降解胆固醇能力的测定
以LGG为对照菌株,测定了8株疑似植物乳杆菌的降胆固醇的能力,胆固醇标准曲线如图1所示,菌株降胆固醇能力结果如图2所示。

图1 胆固醇标准曲线
Fig.1 Standard curve of cholesterol
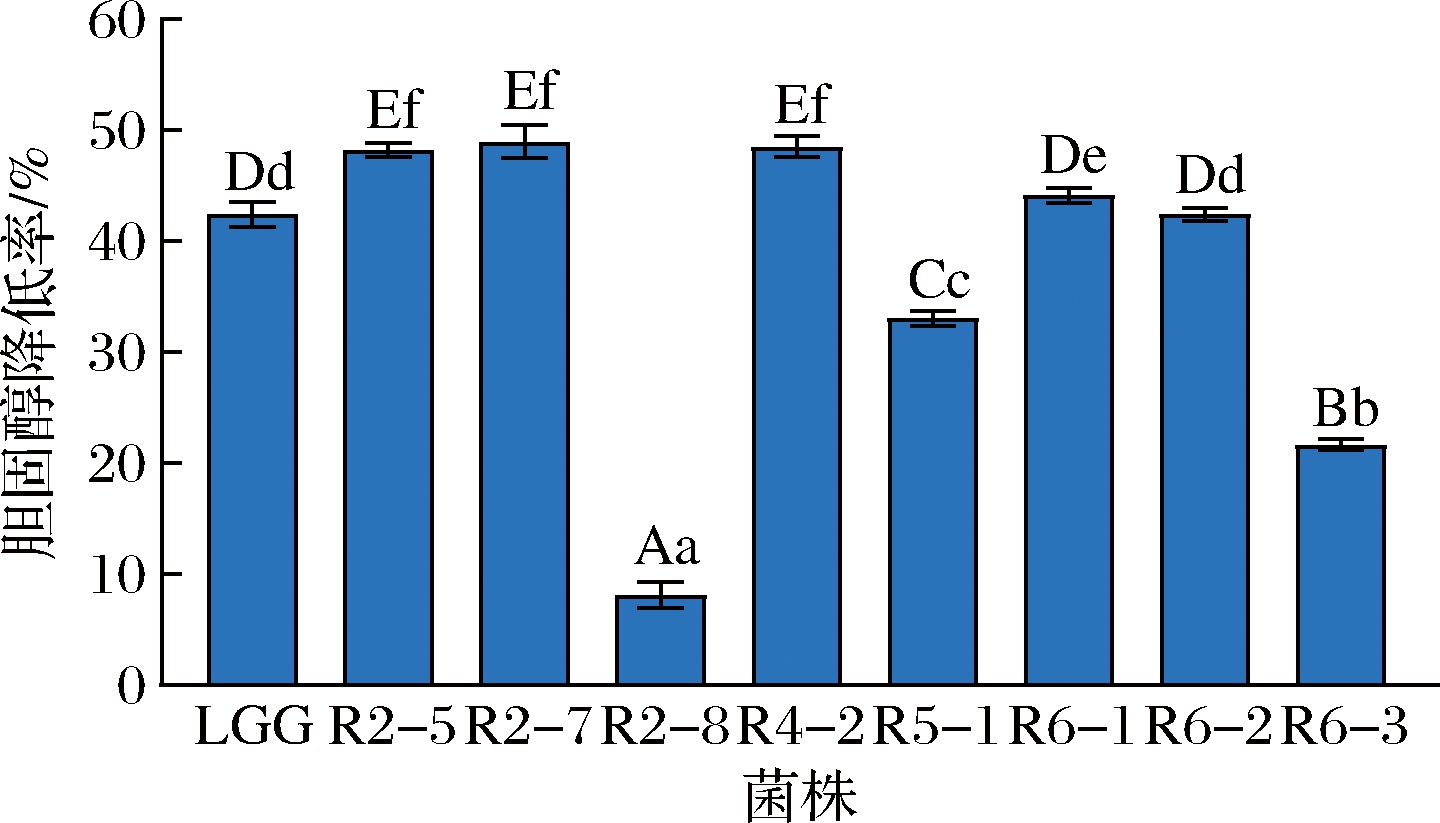
图2 菌株对胆固醇的降解力
Fig.2 Degradation of cholesterol by strains
注:不同菌株相比,n=3,上标小写字母代表P<0.05水平的显著性差异,上标大写字母代表P<0.01水平的显著性差异
图1可看出,在胆固醇质量浓度为0~0.5 mg/mL时,胆固醇质量浓度与OD值呈现良好线性关系,线性方程为y=1.865x+0.019 38,相关系数R2=0.990 3。如图2所示,R2-5、R2-7和R4-2降解胆固醇的能力极显著高于对照菌株LGG(P<0.01),R6-1降解胆固醇的能力显著高于对照菌株LGG(P<0.05),R6-2降解胆固醇的能力与LGG无显著差异(P>0.05), R2-8、R5-1和R6-3降解胆固醇的能力极显著低于对照菌株LGG(P<0.01)。
2.2 高降解胆固醇菌株的鉴定
2.2.1 生理生化鉴定
对筛选出的高降解胆固醇能力的疑似植物乳杆菌通过生理生化试验对菌株进一步鉴定,结果见表2。R2-5、R2-7和R4-2均能利用七叶苷、麦芽糖、纤维二糖、水杨苷、甘露醇、山梨醇、棉子糖、蔗糖、乳糖、菊糖和1%马尿酸钠,对照《乳酸细菌分类鉴定及实验方法》,进一步鉴定菌株R2-5、R2-7和R4-2为植物乳杆菌。
表2 乳酸菌生化鉴定管结果
Table 2 The identification results of biochemical identification tube of lactic acid bacteria

菌株七叶苷麦芽糖纤维二糖水杨苷甘露醇山梨醇棉子糖蔗糖乳糖菊糖1%马尿酸钠R2-5+++++++++++R2-7+++++++++++R4-2+++++++++++
注:“+”表示阳性反应
2.2.2 系统发育树的构建
利用MEGA软件,对筛选出来的高降解胆固醇菌株和相关菌株的16S rDNA序列进行了比对和系统发育分析,并构建系统发育树,如图3所示。菌株R2-5、R2-7和R4-2均与Lactobacillus plantarum聚集成一枝,结合2.2.1的生理生化鉴定结果,确定菌株R2-5、R2-7和R4-2均为植物乳杆菌。

图3 基于16S rDNA序列的系统发育树
Fig.3 Phylogenetic tree based on 16S rDNA sequences
2.3 植物乳杆菌R2-5、R2-7和R4-2的安全性评价
2.3.1 抗生素敏感性
以LGG为对照菌株,对植物乳杆菌R2-5、R2-7和R4-2进行了常用10类12种抗生素的敏感性测定,结果如表3所示。植物乳杆菌R2-5、R2-7和R4-2均对氯霉素、氨苄西林、红霉素、四环素敏感,对克林霉素中度敏感,对万古霉素、卡那霉素、链霉素、环丙沙星具有抗性;植物乳杆菌R2-5和R2-7对庆大霉素具有抗性,对利福平中度敏感,而R4-2对庆大霉素和利福平均敏感;植物乳杆菌R2-5和R4-2均对青霉素G具有抗性,而植物乳杆菌R2-7对青霉素G敏感。与LGG相比,植物乳杆菌对链霉素、利福平和克林霉素表现出更大的抗性。
表3 菌株对常见抗生素的敏感性
Table 3 Sensitivity of strains to common antibiotics
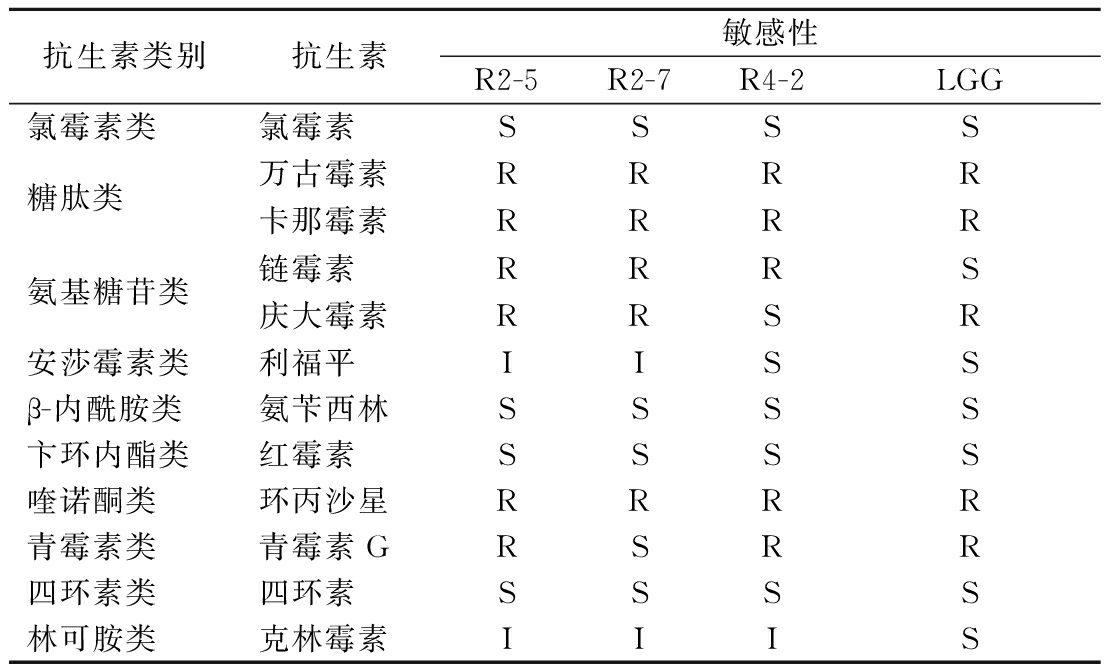
抗生素类别抗生素敏感性R2-5R2-7R4-2LGG氯霉素类氯霉素SSSS糖肽类万古霉素RRRR卡那霉素RRRR氨基糖苷类链霉素RRRS庆大霉素RRSR安莎霉素类利福平IISSβ-内酰胺类氨苄西林SSSS卞环内酯类红霉素SSSS喹诺酮类环丙沙星RRRR青霉素类青霉素GRSRR四环素类四环素SSSS林可胺类克林霉素IIIS
注:S-敏感;I-中度敏感;R-具有抗性
2.3.2 质粒检测
以含有质粒的植物乳杆菌和LGG为对照菌株,对植物乳杆菌R2-5、R2-7和R4-2进行质粒提取,结果如图4所示。植物乳杆菌R2-5、R2-7和R4-2均不含有质粒,意味着植物乳杆菌虽然对些抗生素具有抗性,但不含有质粒,因此在这方面是安全的。
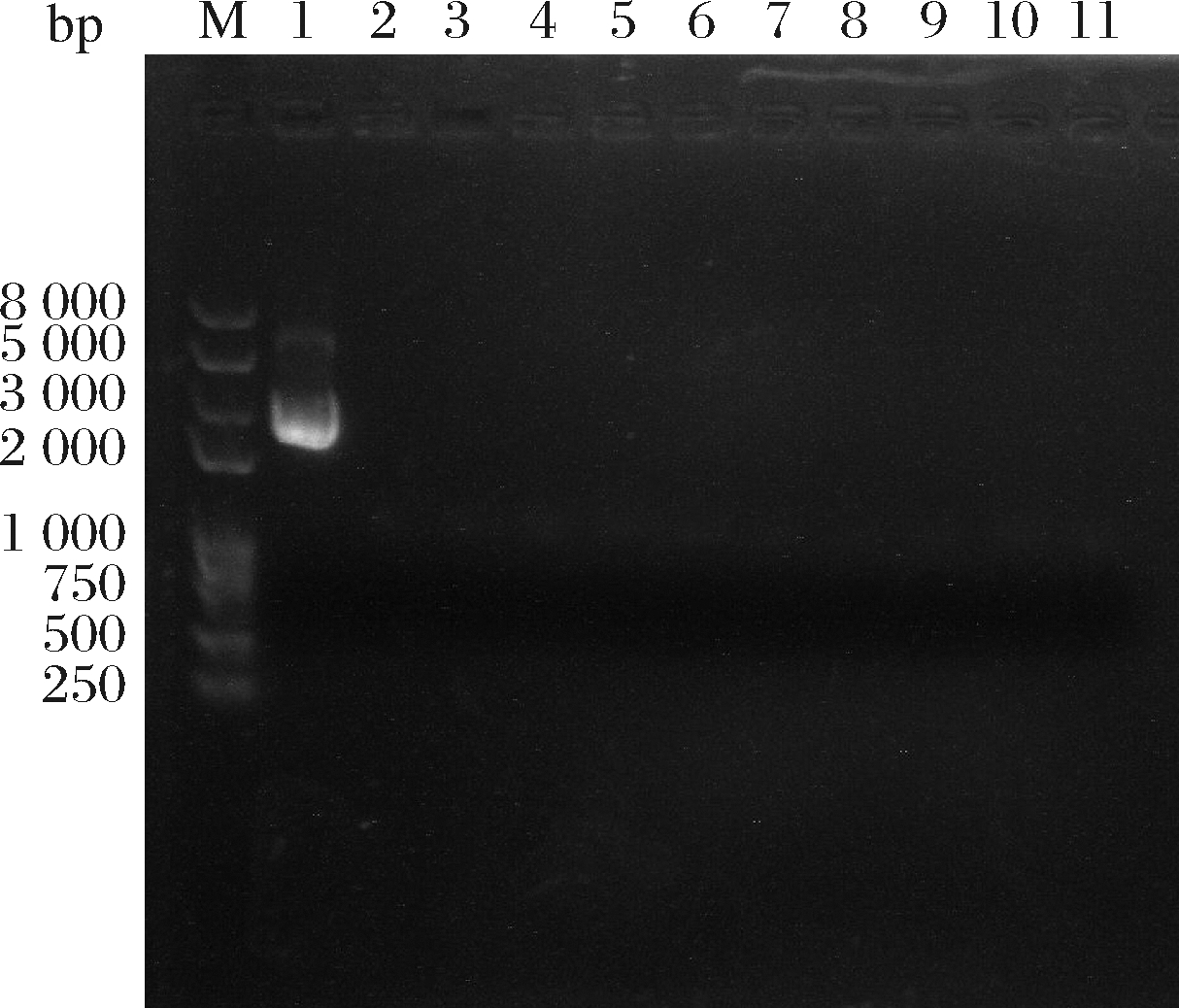
M-super DNA marker;1-含有质粒的植物乳杆菌菌株;3-LGG;4-R2-5;5-R2-7;7-R4-2
图4 菌株质粒提取电泳图
Fig.4 Electrophoresis graph of plasmid extraction from strains
2.3.3 氨基酸脱羧酶活性
以LGG为对照菌株,对植物乳杆菌R2-5、R2-7和R4-2进行了氨基酸脱羧酶活性的测定,结果如表4所示。植物乳杆菌R2-5、R2-7、R4-2和LGG均不产生组胺、酪胺、色胺、尸胺、腐胺和苯乙胺,说明植物乳杆菌R2-5、R2-7和R4-2不具备氨基酸脱羧酶活性,即不产生生物胺类有害代谢产物。
表4 菌株产生物胺能力检测
Table 4 Amine production capacity of strains

菌株编号生物胺组胺酪胺色胺尸胺腐胺苯乙胺R2-5------R2-7------R4-2------LGG------
注:“+”代表阳性反应,“-”代表阴性反应
2.3.4 溶血试验
以金黄色葡萄球菌ATCC 25923为质控菌株, LGG为对照菌株,采用哥伦比亚血琼脂平板法对植物乳杆菌R2-5、R2-7和R4-2进行了溶血活性检测,结果如图5所示。金黄色葡萄球菌ATCC 25923菌落周围红细胞完全破裂,形成透明溶血环,即呈现β-型溶血,具有溶血活性。在划线植物乳杆菌R2-5、R2-7、R4-2和LGG的血平板上,红细胞完好无损,菌落周围未形成透明溶血环,即为Y-型溶血,不具备溶血活性。
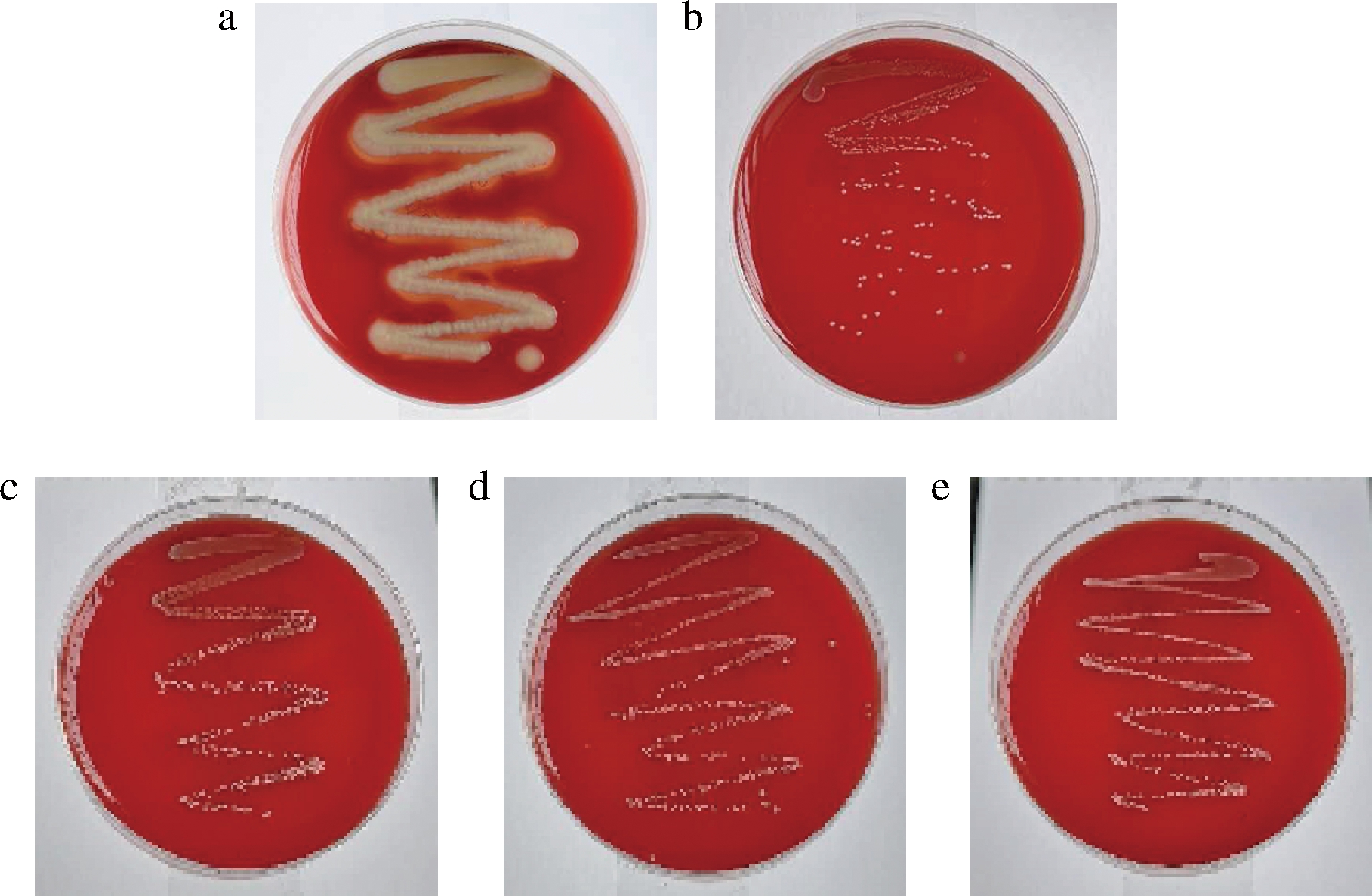
a-ATCC 25923;b-LGG;c-R2-5;d-R2-7;e-R4-2
图5 菌株溶血活性检测
Fig.5 Hemolytic activity of strains
3 结论与讨论
血清胆固醇水平升高是被认为是心血管疾病的主要危险因素。然而目前使用药物是治疗高胆固醇血症最广泛的方法,但是这些药物中有些价格昂贵,有些有副作用。目前,益生菌已被提议作为降低血清胆固醇水平的替代方法[7]。然而,任何被认定是益生菌的菌株都应具备一定的基础特性,如对宿主消化系统恶劣环境条件的耐受性,竞争性排除肠道病原菌或抑菌潜力,黏附于肠道内壁并且在肠道定殖,进而发挥有益作用[16]。因此,本研究以目前最被认可的益生菌LGG为阳性对照菌株,研究了从新疆传统赛里木酸奶中分离筛选出来的具有较优基础特性菌株的降解胆固醇能力,结果显示R2-5、R2-7和R4-2对胆固醇的降解力分别为48.19%、48.92%和48.50%,均极显著高于对照菌株LGG对胆固醇的降解率42.40%(P<0.01)。韦云路等[17]发现动物双歧杆菌LPL-RH、长双歧杆菌TTF及植物乳杆菌LPL-1的体外胆固醇脱除率分别为23.8%、24.5%、20.9%;陈珂可等[18]从20株分离自健康人体肠道的Bifidobacterium lactis中筛选出1株各方面均具有良好抗逆性的Bifidobacterium lactis BLa80,其胆固醇降解能力为34.56%;李尧[11]从传统自然发酵食品中分离的 30 株乳酸菌筛选出4株具有较强降胆固醇能力的乳酸菌,融合魏斯氏菌WS1、植物乳杆菌LP2、LP3和 LP6,它们分别降胆固醇效率分别为34.06%,34.85%,30.61%和 37.15%;杨晓艳[19]从传统发酵制品酸芋荷、酸豆角中筛选出具有降解胆固醇作用的优良菌株植物乳杆菌A03 d1,胆固醇降解为35.8%;张晓磊[20]从泡菜中分离出的10株菌中筛选到1株高效降胆固醇能力的植物乳杆菌,其降胆固醇能力达到 46.27%。比较而言,植物乳杆菌R2-5、R2-7和R4-2具有较高的降解胆固醇能力。
植物乳杆菌是具有欧洲食品安全局(EFSA)的安全资格认定(QPS)菌株,且为美国食品药品监督管理局(FDA)的公认安全(GRAS)菌株,此外它是具有文献记载的食品使用史的微生物,迄今为止,大多数研究支持植物乳杆菌的安全性[21]。赛里木酸奶是新疆阿克苏地区人们长期食用的食物,因此从中筛选出来的微生物也具有一定的安全性,然而,研究人员发现一些乳酸菌菌株是可能感染人类的机会致病菌,所以在将这些菌株用作益生菌之前,确定其安全性至关重要[22]。因此,本研究对植物乳杆菌R2-5、R2-7和R4-2的安全性进行了初步评价。结果显示:植物乳杆菌R6-3对部分抗生素具有抗性,但是通过质粒检测,植物乳杆菌R2-5、R2-7和R4-2中均不存在质粒,即该菌不存在耐药因子转移的风险。通过对植物乳杆菌R2-5、R2-7和R4-2氨基脱羧酶活性的检测,得出该菌不产生有害代谢产物生物胺,并且无溶血活性。因此。可初步判定植物乳杆菌R2-5、R2-7和R4-2属于安全性菌株。
总之,本研究对从赛里木酸奶中分离出来的具有潜在益生特性的疑似植物乳杆菌进行了降解胆固醇能力的研究,得到3株高降解胆固醇能力的菌株,通过生理生化试验进一步鉴定,确定3株菌均为植物乳杆菌。通过安全性研究(抗生素敏感性、质粒提取、氨基酸脱羧酶活性、溶血活性),得出这3株植物乳杆菌具备一定安全性。体外试验只能对菌株进行初步评价,是否真的具有降解胆固醇功能和具有安全性,须通过体内试验进行验证。因此,本研究为下一步对菌株进行体内降解胆固醇功能的研究和应用提供了数据支撑,对赛里木酸奶的推广具有重大意义,为赛里木酸奶的工业化生产提供了菌种资源,为我国开发具有自主知识产权的原创性益生菌提供了新资源。
[1] THUSHARA R M, GANGADARAN S, SOLATI Z, et al.Cardiovascular benefits of probiotics:A review of experimental and clinical studies[J].Food & Function, 2016, 7(2):632-642.
[2] WANG G Q, HUANG W L, XIA Y J, et al.Cholesterol-lowering potentials of Lactobacillus strain overexpression of bile salt hydrolase on high cholesterol diet-induced hypercholesterolemic mice[J].Food & Function, 2019, 10(3):1 684-1 695.
[3] ZAFAR H, AIN N U, ALSHAMMARI A, et al.Lacticaseibacillus rhamnosus FM9 and Limosilactobacillus fermentum Y57 are as effective as statins at improving blood lipid profile in high cholesterol, high-fat diet model in male wistar rats[J].Nutrients, 2022, 14(8):1654.
[4] MANSON J E, TOSTESON H, RIDKER P M, et al.The primary prevention of myocardial infarction[J].The New England Journal of Medicine, 1992, 326(21):1 406-1 416.
[5] BROWNING J D, HORTON J D.Molecular mediators of hepatic steatosis and liver injury[J].The Journal of Clinical Investigation, 2004, 114(2):147-152.
[6] KOSLIK H J, MESKIMEN A H, GOLOMB B A.Physicians’ experiences as patients with statin side effects:A case series[J].Drug Safety - Case Reports, 2017, 4(1):3.
[7] CHOI E A, CHANG H C.Cholesterol-lowering effects of a putative probiotic strain Lactobacillus plantarum EM isolated from kimchi[J].LWT - Food Science and Technology, 2015, 62(1):210-217.
[8] OOI L G, LIONG M T.Cholesterol-lowering effects of probiotics and prebiotics:A review of in vivo and in vitro findings[J].International Journal of Molecular Sciences, 2010, 11(6):2 499-2 522.
[9] LIU Y L, LUO K L, LIN X X, et al.Regional distribution of longevity population and chemical characteristics of natural water in Xinjiang, China[J].Science of the Total Environment, 2014, 473-474:54-62.
[10] 苑贝贝. 拜城赛里木酸奶营养组分及功能因子的分析[D].阿拉尔:塔里木大学, 2017.
YUAN B B.Analysis on nutritional ingredients and functional of sayram ketteki from Baicheng County[D].Ala’er:Tarim University, 2017.
[11] 李尧, 张羽竹, 张利, 等.分离自传统自然发酵食品中降胆固醇乳酸菌的筛选与评价[J].中国食品学报, 2019, 19(6):212-222.
LI Y, ZHANG Y Z, ZHANG L, et al.The screening and evaluation of cholesterol-lowering lactic acid bacteria isolated from traditional naturally fermented food[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):212-222.
[12] 张娜. 母乳婴儿源益生菌筛选及其干预炎症性肠病的免疫效应和相关机制研究[D].保定:河北农业大学, 2020.
ZHANG N.Screening of probiotics from breast-fed infants faeces and the research of immune effects and related mechanism on inflammatory bowel disease[D].Baoding:Hebei Agricultural University, 2020.
[13] 张波, 李晨, 董慧, 等.1种快速高效提取乳酸菌质粒的方法[J].中国食品学报, 2014, 14(9):7-13.
ZHANG B, LI C, DONG H, et al.A rapid method for extracting plasmids from lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(9):7-13.
[14] PRADHAN D, SINGH R, TYAGI A, et al.Assessing safety of Lactobacillus plantarum MTCC 5690 and Lactobacillus fermentum MTCC 5689 using in vitro approaches and an in vivo murine model[J].Regulatory Toxicology and Pharmacology, 2019, 101:1-11.
[15] 凌代文, 东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社, 1999.
LING D W, DONG X Z.Classification, Identification and Experimental Methods of Lactic Acid Bacteria[M].Beijing:China Light Industry Press, 1999.
[16] BINDU A, LAKSHMIDEVI N.Identification and in vitro evaluation of probiotic attributes of lactic acid bacteria isolated from fermented food sources[J].Archives of Microbiology, 2021, 203(2):579-595.
[17] 韦云路, 刘义, 王瑶, 等.3 株益生菌体外降胆固醇能力及体内降血脂效果评价[J].食品科学, 2017, 38(23):129-134.
WEI Y L, LIU Y, WANG Y, et al.Cholesterol-lowering ability in vitro and hypolipidemic effect in vivo of three probiotic strains[J].Food Science, 2017, 38(23):129-134.
[18] 陈珂可, 朱建国, 姜甜, 等.具有降解胆固醇能力的益生菌菌株筛选[J].食品科技, 2018, 43(11):7-11.
CHEN K K, ZHU J G, JIANG T, et al.Screening for highly adherent probiotic bacteria with the ability to degrade cholesterol [J].Food Science and Technology, 2018, 43(11):7-11.
[19] 杨晓艳. 降胆固醇乳酸菌的筛选及其在低脂沙拉酱中的应用[D].邯郸:河北工程大学, 2019.
YANG X Y.Screening of cholesterol-lowering lactic acid bacteria and its application in low-fat salad dressing[D].Handan:Hebei University of Engineering, 2019.
[20] 张晓磊. 益生菌发酵豆乳对高脂饮食小鼠降血脂及缓解肝损伤作用[D].长春:吉林农业大学, 2016.
ZHANG X L.The effect of probiotic-fermented soymilk hypolipidemic and ameliotating liver injury in mice fed a high-fat diet [D].Changchun:Jilin Agricultural University, 2016.
[21] SEDDIK H A, BENDALI F, GANCEL F, et al.Lactobacillus plantarum and its probiotic and food potentialities[J].Probiotics and Antimicrobial Proteins, 2017, 9(2):111-122.
[22] SURESH K, KRISHNOPPA S, BHARDWAJ P.Safety concerns of probiotic use:A review[J].IOSR Journal of Dental and Medical Sciences, 2013, 12(1):56-60.