在心血管疾病中,高血压已经成为致病的主要危险因素,致死率高[1]。随着中国人口老龄化问题加重以及代谢危险因素的流行,高血压已经成为中国面临的重要公共卫生问题。血管紧张素转化酶(angiotensin I-converting enzyme,ACE)是一种锌依赖的羧肽酶,可以通过肾素-血管紧张素系统(rein-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)中的关键限速酶,在血压调控中发挥重要作用,近年来也被视为治疗高血压的重要靶点[2]。许多合成的ACE抑制剂如卡托普利、依那普利,已经被广泛用作治疗高血压的药物。然而,长期使用这些合成的ACE抑制类药物会产生许多副作用,如干咳、头痛、皮疹甚至高钾血症[3]。因此,寻找天然安全的新型ACE抑制剂成为了研究热点。
目前,食源性蛋白水解获得的生物活性肽因其生物利用度高、毒性低、副作用少等优势引起广泛关注。例如,SONKLIN等[4]通过绿豆蛋白水解获得5种ACE抑制肽(LPRL、YADLVE、LRLESF、HLNVVHEN、PGSGCAGTDL)。常畅等[5]从棉籽蛋白水解物中分离鉴定得到3种新型ACE抑制肽(VFNNNPQE、LLSQTPRY、VFPGCPET)。螺旋藻作为最早被食用的藻类,其蛋白质含量在藻类食物中最高(60%~70%),且氨基酸种类丰富[6],是绝佳的生物活性肽来源。但目前,国内外对于螺旋藻来源的ACE抑制肽的报道较少。另外,传统的从食源蛋白中分离ACE抑制肽需要使用超滤、反相高效液相色谱、凝胶渗透色谱等分离方法,这些方法费时费钱,活性肽的产率低,不利于后续研究与开发[7]。
本研究以螺旋藻为原料,采用不同蛋白酶水解螺旋藻蛋白制备活性肽,通过水解度、DPPH自由基清除活性和ACE抑制活性筛选出最佳水解酶。进一步通过肽组学与计算机模拟方法,筛选具有ACE抑制活性的新型活性肽,并探究其抑制机理以及稳定性,并对细胞毒性进行评估,为食源蛋白在功能性降压食品上的应用与开发提供参考。
1 材料与方法
1.1 试剂与材料
螺旋藻粉,上海光语生物科技有限公司;中性蛋白酶(50 U/mg)、胰蛋白酶(≥10 000 U/mg,以N-苯甲酸-L-精氨酸乙酯计)、胃蛋白酶(≥2 500 U/mg,来源猪胃黏膜)、碱性蛋白酶(2.4 U/g)、血管紧张素转化酶(≥10 U/mg,来源猪肾脏)、卡托普利,美国Sigma-Aldrich公司;N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰甘氨酰甘氨酸{N-[3-(2-furyl)acryloyl]-L-phenylalanyl-glycyl-glycine,FAPGG},4-羟乙基哌嗪乙磺酸{2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES},生工生物(上海)股份有限公司。
1.2 仪器与设备
AX224ZH/E型电子天平,常州奥豪斯仪器公司;FE20型pH计,上海梅特勒-托利多仪器有限公司;Synergy H4型多功能酶标仪,美国伯腾仪器有限公司;TU-1901型双光束紫外分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 螺旋藻蛋白酶解液的制备
配制100 g/L的螺旋藻粉悬浮液,9×107 Pa下高压均质5个循环后收集破壁液。4 ℃,10 000 r/min离心30 min后收集上清液即为螺旋藻蛋白提取液,冷冻干燥后为蓝色粉末,保存于4 ℃。
根据蛋白酶活力测定法(GB/T 23527—2009)统一定义碱性蛋白酶、中性蛋白、胰蛋白酶、胃蛋白酶4种不同来源的酶的活性。分别添加胰蛋白酶(40 ℃,pH=2)、胃蛋白酶(40 ℃,pH=2)、中性蛋白酶(50 ℃,pH=7)、碱性蛋白酶(50 ℃,pH=8)水解螺旋藻蛋白,加酶量为5 000 U/g。水解结束后在95 ℃加热10 min对蛋白酶进行灭活,冷却后8 000 r/min离心5 min收集上清夜即酶解液。以蛋白水解度、DPPH清除率、ACE抑制率为指标,筛选出最佳的水解蛋白酶。
1.3.2 水解度的测定
水解度的测定采用邻苯二甲醛(O-phthalaldehyde,OPA)法[8],并稍作修改。配制6 mol/L的HCl对螺旋藻蛋白进行完全水解,水解条件为115 ℃下反应24 h。取100 μL水解液或完全水解液与OPA试剂一起孵育2 min后在340 nm下测量其吸光度。使用丝氨酸标准曲线测定游离氨基酸的量,其中(NH2)t是水解t h后释放的游离氨基酸的量,(NH2)t0是水解前的游离氨基酸的量,(NH2)T是完全水解后游离氨基酸的量。水解度计算如公式(1)所示:
水解度![]()
(1)
1.3.3 DPPH自由基清除能力
配制0.3 mmol/L的DPPH溶液并移取稀释5倍的水解液100 μL于96孔板中,于517 nm处测得吸光度Ab,然后加入100 μL DPPH溶液,混合均匀并于黑暗中反应30 min,测得As。水代替样品作为对照组,其空白吸光度和反应后的吸光度分别为Acb和Ac。DPPH自由基的清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.3.4 ACE抑制活性检测
测定活性肽的抑制潜力参考LIU等[9]的方法,并稍作修改。每100 μL的活性肽样品(100 μmol/L)与5 mU ACE于37 ℃混合后保温5 min,加入100 μL的0.5 mmol/L FAPGG于37 ℃反应30 min后加入200 μL甲醇对ACE灭活。空白组仅加入FAPGG,对照组仅加入ACE和FAPGG,其余用HEPES缓冲液补齐并在相同条件下反应30 min。吸取上述反应液各10 μL,分别点在硅胶薄层板上,以正丁醇-乙酸-水(体积比4∶1∶1)为展开剂分离反应底物FAPGG以及水解产物苯丙胺酰基(furylacryloyl-Phe,FAP),并置于紫外灯下(254 nm)下检视。
参考骆琳等[10]的方法绘制ACE抑制肽的抑制曲线,并通过Graphpad Prism进行曲线拟合计算IC50。用HEPES缓冲液(pH 8.3、含200 mmol/L NaCl)配制1 mmol/L FAPGG和0.1 U/mL的ACE溶液中,在96孔板中加入40 μL样品、10 μL酶溶液以及50 μL FAPGG后37 ℃反应0.5 h。FAPGG作为ACE作用的底物,能被水解成FAP和双甘氨肽(Gly-Gly,GG),这些肽类的释放会减少FAPGG在340 nm的吸光度,而酶活性被定义为340 nm处吸光度减少的速率ΔA340/min。分别测定添加样品后的ACE酶活性A和空白组的ACE酶活性B。抑制率计算如公式(3)所示:
ACE抑制率![]()
(3)
1.3.5 基于液质联用的肽段序列分析
将处理好的样品委托北京百泰派克生物科技有限公司通过液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。使用自填脱盐柱对水解样品脱盐,于45 ℃真空离心浓缩仪中挥干溶剂。色谱条件:流动相A为0.1%甲酸;流动相B为0.1%甲酸和80%乙腈(acetonitrile,ACN);色谱柱为Acclaim PepMap C18反相色谱柱(150 μm×150 mm,1.9 μm)。肽段经由液相分离后进Orbitrap质谱进行分析,离子源电压设置为2.2 kV。得到的质谱原始结果的原始文件,经过软件Byonic分析,得到鉴定结果。
1.3.6 药效团的构建
从AHTPDB(database of antihypertensive peptides)收集了24条具有ACE抑制活性的肽段作为药效团的训练集(表1)。所选肽段的IC50在0.21~9 900 μmol/L,跨越5个数量级。通过CHARMM立场对各组活性肽进行能量最小化及结构优化。之后利用Common Feature Pharmacophore Protocol 程序生成药效团,其中单分子产生最大构象数为255,构象变化算法为best,能量约束为83.68 kJ/mol,并引入氢键受体、氢键给体、阳离子中心、正电荷中心、阴离子中心、负电荷中心、疏水中心7项药效特征,将会产生10个药效团模型。选取最佳药效团模型对1.3.5中鉴定的肽段进行分析预测,并得到fit值。
表1 训练集肽
Table 1 The training set of peptides

序列IC50/(μmol·L-1)序列IC50/(μmol·L-1)IKW0.21WM96.60LKP0.32SF130.20IRY0.59IA153.00LSP1.70GVW240.00GPL2.60AV300.00LLF3.50EAP360.00IEF3.80GTW464.40VPP9.00YP720.00IAK15.70AG2500.00RAP16.00LG8800.00VR52.80GD9200.00GY72.10TG9900.00
1.3.7 分子对接
分子对接技术由软件AutoDock 4.2和Vina完成。受体分子的准备:
从PDB蛋白质数据库(http://www.rcsb.org/pdb/home/home.do)下载ACE晶体复合物(PDB code:1O86)的X衍射蛋白三维结构,并用Mgltools 1.5.6处理蛋白结构,去水,删除配体后,加氢、计算电荷、合并非极性氢,并进一步优化蛋白质的三维结构。
小分子配体的准备:利用ChemBioDraw 14.0绘制小分子肽的结构,并在ChemBio3D Ultra 14.0中优化肽的结构和能量,做好对接受体的准备。
分子对接:将配体分子放置在ACE蛋白的活性位点附近,X、Y、Z轴的格点数设为60×60×60,其中格点距离为0.375 Å。
1.3.8 ACE抑制肽的抑制类型分析
根据1.3.4操作中测定的合成抑制肽在不同底物浓度下ACE抑制率。根据IC50选择寡肽HIIARPH(0、300、600 μmol/L)和LRLKE(0、100、300 μmol/L)的浓度,底物浓度为0.25、0.5、1.0、2.0 mmol/L。应用双倒数式,以反应速度倒数对基质浓度的倒数作图,得到Lineweaver-Burk图。
1.3.9 ACE抑制肽的稳定性
稳定性测定方法参考蔡金秀等[11],并稍作修改。配制100 μmol/L的ACE抑制肽样品,分别在0、25、50、75、100 ℃下保温2 h后,根据1.3.4测定其ACE抑制率。
用pH值为2、4、6、8、10的缓冲液配制100 μmol/L 的ACE抑制肽样品,室温下保温2 h,并测定其ACE抑制率。
1.3.10 HUVEC细胞毒性
HUVEC细胞接种与96孔板中,接种密度为1×106个/mL,接种量为100 μL。培养24 h后采用不同浓度的HIIARPH和LRLKE(10、100、1000 μmol/L)处理HUVEC细胞24 h,采用MTT法检测ACE抑制肽对HUVEC细胞的毒性影响,通过酶标仪测定490 nm下的吸光度并计算细胞活力。
1.3.11 数据分析
所有试验均重复测定3次,采用Graphpad prism 9进行作图分析。显著性差异通过Excel计算得到。
2 结果与分析
2.1 水解蛋白酶的筛选
根据国标蛋白酶活性统一测定碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶4种蛋白水解酶的酶活性,分别为5.17×105U/mL、3.3×105、1.0×106、2.2×105 U/g。在相同酶活力下分别用这4种蛋白酶水解螺旋藻蛋白,并测定其水解度、DPPH自由基清除率和ACE抑制率,结果如图1所示。
由图1可知,4种蛋白酶均可水解螺旋藻蛋白并获得具有DPPH自由基清除率、ACE抑制活性的活性肽,但在相同的酶活力下,不同蛋白酶水解螺旋藻蛋白的能力具有差异。其中碱性蛋白酶水解螺旋藻蛋白的水解度、DPPH清除率以及ACE抑制率最高。据报道,碱性蛋白酶能够水解得到具有更高ACE抑制活性的肽。BAO等[12]比较了碱性蛋白酶、风味蛋白酶、中性蛋白酶和蛋白酶K水解脱脂山羊奶,发现碱性蛋白酶水解物具有更高的水解度以及ACE抑制活性。AMBIGAIPALAN等[13]使用碱性蛋白酶、风味蛋白酶、嗜热菌蛋白酶水解枣籽粉,发现碱性蛋白酶水解物ACE抑制活性更高。本研究同样发现碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶水解螺旋藻蛋白,碱性蛋白酶水解物具有更高的ACE抑制活性。据报道,通过碱性蛋白酶水解可以得到富含疏水氨基酸的肽,如C端残基为Ala、Val、Leu、Phe、Pro、Ile、Met[12-14]。研究表明ACE抑制肽与ACE的结合受底物C端肽序列的强烈影响,C端含有疏水性氨基酸的肽具有显著的抑制活性[15],这可能是碱性蛋白酶水解物具有更高ACE抑制活性的主要原因。随着水解度的提升,碱性蛋白酶水解产物的DPPH自由基清除率以及ACE抑制率呈现先增后降的趋势,在水解时间为1 h时,即可获得DPPH自由基清除率和ACE抑制率较高的水解产物。此外考虑到碱性蛋白酶价格较为低廉,在工业生产上应用更为广泛,因此本实验选择碱性蛋白酶为水解蛋白酶,且水解时间为1 h制备ACE抑制肽。

a-水解度;b-DPPH自由基清除率;C-ACE抑制活性
图1 不同蛋白酶水解螺旋藻蛋白的水解度、DPPH自由基清除率以及ACE抑制活性
Fig.1 Hydrolysis degree, DPPH scavenging, and ACE inhibition rate of hydrolyzed spirulina protein with different proteases
2.2 螺旋藻蛋白水解物中的肽段鉴定结果
通过LC-MS/MS对水解液进行肽序分析并通过质谱与软件Byonic数据库检索共鉴定得到782条肽序列,理论分子质量在301.14~2 796.58 Da,相对丰度排名前20的肽段如表2所示。水解液中肽多为氨基数目在3~10的寡肽。根据打分选取排名前10的寡肽进行计算模拟,筛选具有ACE抑制潜力的寡肽。
表2 螺旋藻蛋白水解液中肽的分析
Table 2 The analysis of peptides from Spirulina protein hydrolysate

序号肽序分子质量/Da打分相对丰度序号肽序分子质量/Da打分相对丰度1LTGYVIGEQVY1 241.64233.724 980 000 00011LALR472.32469.1444 520 0002IER417.246149.72 324 300 00012TYL396.214175.2421 320 0003LHI382.244119.82 114 900 00013HIIARPH422.251382.1418 000 0004KPY407.22781.81 406 800 00014LRLKE329.715317.0335 350 0005LSLPK557.367176.01 072 100 00015VAF336.192211.0313 520 0006SSLAS464.24570.2919 790 00016SFR409.219108.0276 680 0007REVDKPF445.741179.1912 740 00017STHIIARPH344.529457.0266 560 0008SFL366.21438.3696 760 00018LYR451.268148.1233 210 0009ELY424.208119.6524 940 00019ELAI445.26673.2231 870 00010KKTV475.3224.6471 460 00020FLVG435.27271.2231 330 000
2.3 以药效团和结合能为指标的分子对接筛选ACE抑制肽以及活性验证
本研究共产生了10个药效团模型如表3所示。其中rank值是由HipHop算法对所生成的药效团的打分,代表了药效团与训练集中分子的匹配度,rank值越高代表匹配的小分子数目越多。本研究中生成的Hypothese 1药效团的rank值最高为209.152。Hypothese 1中药效团包含了一个氢键受体(A)、一个负电离子中心(Z)和正电离子中心(Y)。fit值代表寡肽与药效团模型的匹配度,Fit值越高,则匹配度越高,具有ACE抑制活性的潜力越大。寡肽与药效团匹配结果如表4所示,其中REVDKPF的匹配度最高,fit值为2.880。HIIARPH、LSLPK、LRLKE匹配度次之,fit值分别为2.866、2.851、2.836。
之后通过AutoDock、Vina软件分别对ACE(1O86)与筛选出的10种寡肽对接,分析肽与ACE的相互作用模式,对接结果如表4所示。结合自由能越低,表示其结合越紧密。结果表明,10种肽都能与ACE结合,其中REVDKPF、HIIARPH、LRLKE、SFR与ACE的结合较优,结合能分别为-35.11、-38.87、-37.20、-35.53 kJ/mol。综合考虑药效团与分子对接的结果,共合成IER(对照)、REVDKPF、HIIARPH、LRLKE、SFR 5条肽段进行体外验证其ACE抑制活性,合成肽的纯度均在98%以上。
为进一步证实所选肽的ACE抑制活性,对其体外ACE抑制活性进行测试。在100 μmol/L浓度下,以FAPGG为底物,测定5种肽对ACE的抑制潜力。FAPGG作为ACE作用的底物,能被水解为FAP和GG[10],薄层层析(thin layer chromatography,TLC)可以分离水解生成的FAP和未被水解的FAPGG。FAPGG对应条带越深表明ACE的活性越低,抑制效果越好。如图2所示,HIIARPH(P2)、LRLKE(P3)对应的FAPGG条带较其余更深,表明他们具有更好的ACE抑制活性。因此进一步测定不同浓度下寡肽HIIARPH和LRLKE对ACE的抑制活性,结果如图3所示。通过Graphpad Prism进行曲线拟合计算HIIARPH和LRLKE的IC50分别为461.5、155.8 μmol/L,有良好的ACE抑制活性。
最后通过分子对接进一步探讨ACE抑制肽与ACE互相作用的分子机制。ACE主要的活性中心由S1(Gln 281、His 353、Lys 511、His 513)、S2(Glu 382、Ala 354、Tyr 523)以及S3(Glu 162)3个口袋组成。同时Zn2+作为ACE的辅酶因子在其活性位点能够与His 383、His 387以及Glu 411结合,形成一个四面体结构,对于整个复合物的稳定起关键作用[16]。通过分析寡肽HIIARPH和LRLKE与ACE的氨基酸残基结合情况(图4),七肽HIIARPH能与Asn 70、Arg 124、Tyr 360、Ala 354、Ala 356、Asn 522、Tyr 523等氨基酸残疾形成氢键,五肽LRLKE能与Asn 277、Gln 281、His 353、Ala 354、Cys 370、Thr 372、Glu 384、His 513、Tyr 520等氨基酸残基形成氢键。据报道,抑制剂酶的相互作用中,氢键的长短与数量影响了抑制剂与酶的结合力[17]。李娇等[18]研究发现六肽WHAFLW因能与活性口袋里的氨基酸残基形成氢键而活性高于七肽WFHAVFW,认为氢键是维持ACE和抑制肽结合的主要作用力。本研究所筛选出的七肽HIIARPH与五肽LRLKE都能与S1、S2中的氨基酸残基形成氢键,同时两个抑制肽都能与His 383发生相互作用,WU等[17]在研究中发现当配体与残基His 383、His 387、Glu 411之间的相互作用能够导致四面体配体的Zn2+的扭曲。此外五肽LRLKE能进一步的与S3口袋形成盐桥,同时LRLKE能与Zn2+存在相互作用,这可能是LRLKE抑制活性优于HIIARPH的原因。
表3 训练集生成的10个药效团模型参数
Table 3 The generated ten pharmacophore model parameters from training set

模型特征rank值max fit模型特征rank值max fitHypothese 1YZA209.1523Hypothese 6YZA194.1693Hypothese 2YZA205.8063Hypothese 7PZA190.7523Hypothese 3YZA199.4663Hypothese 8YZA190.3543Hypothese 4YZA198.8653Hypothese 9YZA188.9923Hypothese 5YZA195.9243Hypothese 10PZA187.4063
注:Y为正电离子化中心;Z为负电离子化中心;A为氢键受体;P为正电排斥
表4 寡肽药效团匹配打分和ACE的分子对接结果
Table 4 Pharmacophore fite values and molecular docking results of oligopeptides with ACE

序号肽序fit值结合自由能/(kJ·mol-1)序号肽序fit值结合自由能/(kJ·mol-1)1IER2.758-31.356TYL2.200-33.442LHI2.559-32.607HIIARPH2.866-38.873LSLPK2.851-30.938LRLKE2.836-37.204REVDKPF2.880-35.119VAF2.550-34.695ELY2.814-30.5110SFR2.474-35.53
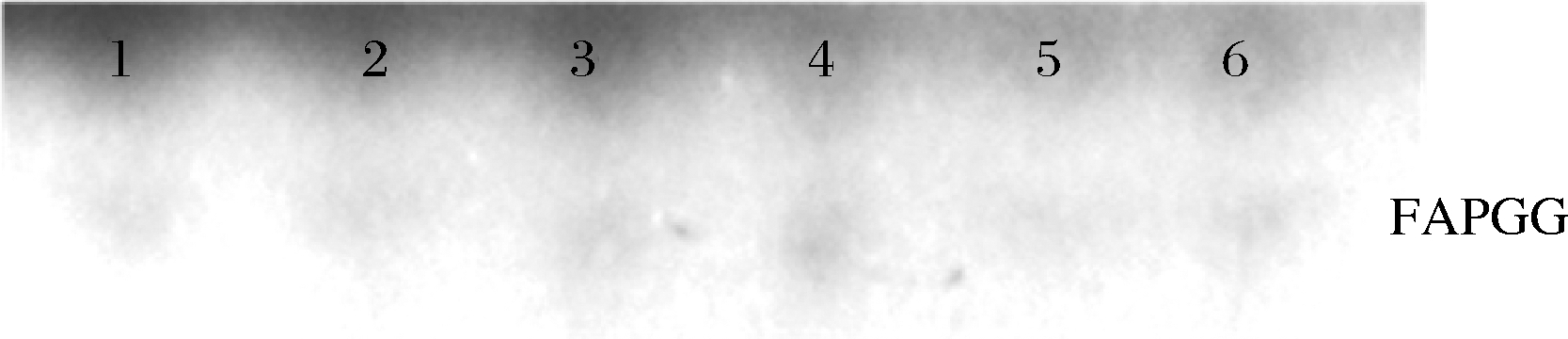
1-空白;2-REVDKPF;3-HIIARPH;4-LRLKE; 5-SFR;6-IER(对照)
图2 TLC法检测寡肽对ACE抑制活性
Fig.2 ACE inhibitory activity of oligopeptides by TLC chromatograms
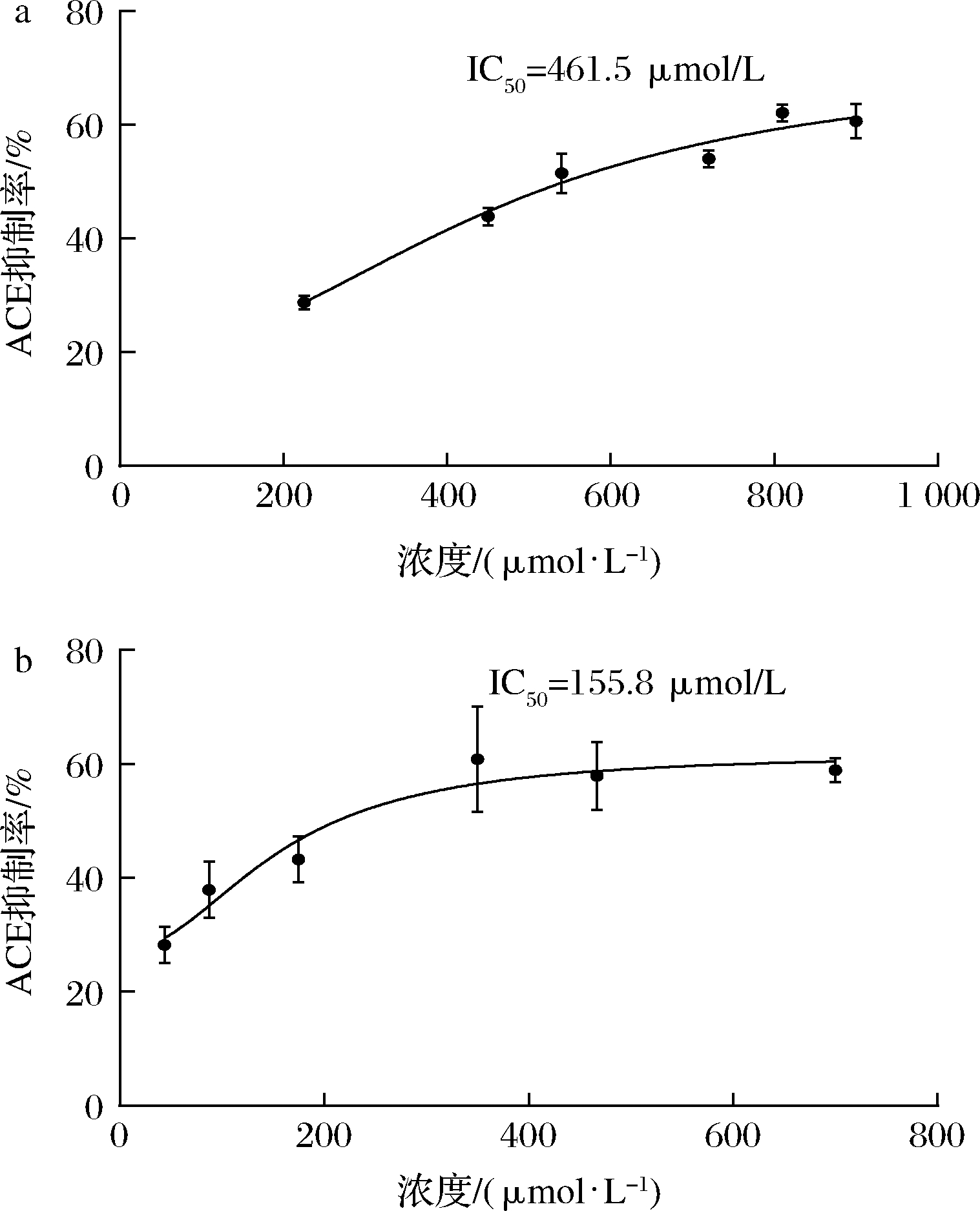
a-HIIARPH;b-LRLKE
图3 HIIARPH和LRLKE的ACE抑制活性
Fig.3 The ACE inhibitory activity of HIIARPH and LRLKE
2.4 活性肽对ACE的抑制模式分析
Lineweaver-Burk双倒数作图法常被用于确定ACE抑制肽的抑制类型。对研究中鉴定的两种ACE抑制肽HIIARPH和LRLKE分别进行ACE抑制模式的分析,并绘制Lineweaver-Burk双倒数图,结果如图5所示。两种活性肽的各系列抑制曲线都相交于横坐标轴,表明两种寡肽的抑制模式为非竞争性抑制,即随着抑制剂浓度增加,酶促反应的米氏常数Km不变,但最大反应速度vmax变小[19]、寡肽HIIARPH和LRLKE能够和酶的非活性区结合,形成抑制肽-ACE-FAPGG复合物从而降低ACE的催化活性。这与报道的来自于螺旋藻的ACE抑制肽IQP和VEP[19],来自白酒糟中的ACE抑制肽AVQ等具有相同的抑制模式[20]。相比较于竞争性抑制剂的强烈作用,HIIARPH和LRLKE这类非竞争性抑制剂的抑制效果持续时间更长,有利于长时间保持其生理作用。

图4 HIIARPH和LRLKE的分子对接结果
Fig.4 Docking results of HIIARPH and LRLKE
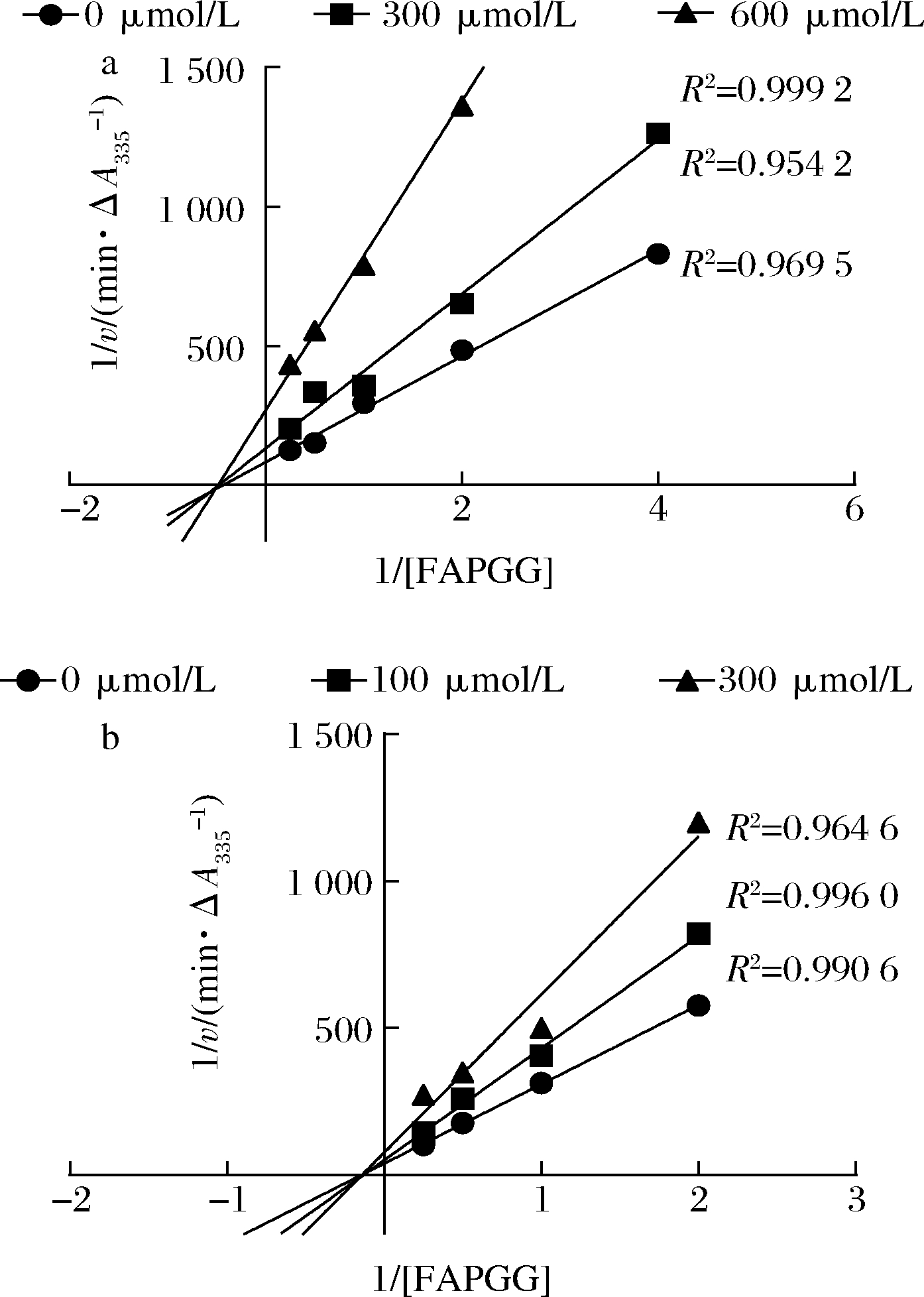
a-HIIARPH;b-LRLKE
图5 HIIARPH和LRLKE对ACE的抑制Lineweaver-Burk图
Fig.5 The Lineweaver-Burk plots for the ACE inhibition pattern of HIIARPH and LRLKE
2.5 ACE抑制肽的稳定性分析
目前,对ACE抑制肽的研究多数在制备、分离纯化、抑制活性和作用机制上,忽略了在后期加工生产与应用时,温度、pH等因素对ACE抑制肽活性的影响。因此,本研究进一步探究了寡肽HIARPH和LRLKE的稳定性。
2.5.1 温度对ACE抑制肽的稳定性影响
对寡肽HIIARPH和LRLKE在25~100 ℃时的稳定性进行测定。由图6-a可知,不同的温度处理下寡肽LRLKE的ACE抑制活性均保持在40%以上(P>0.05)。但不同的温度处理后寡肽HIIARPH的ACE抑制活性有一定程度的影响。在75~100 ℃,HIIARH的稳定性差,ACE抑制活性显著降低(P<0.05)。在75 ℃时其抑制活性减少一半,100 ℃时已无抑制活性。这可能是高温破坏了肽链从而使其结果变化,抑制其活性[17]。相对而言,LRLKE的热稳定性较高,能够在热处理中保持较高的抑制活性,是一种良好的ACE抑制肽。
2.5.2 pH对ACE抑制肽的稳定性影响
不同肽具有不同的最适pH范围,并在这个范围内能表现出最好的稳定性与活性。如图6-b所示,pH值的变化对寡肽HIIARPH和LRLKE在一定范围内有影响。在酸性(pH<6)和碱性(pH>8)条件下,寡肽HIIARPH的活性都有所下降,稳定性较差。在酸性条件下,LRLKE还保持着较高的ACE抑制活性(>40%)。pH=2时,LRLKE的抑制活性提高了约14%,可以推测在体内胃酸环境中可能有利于保持LRLKE活性。在碱性条件下,LRLKE的活性较酸性条件有所下降(<40%),与pH=6的时候相比下降了约15%。WU等[21]报道了牛酪蛋白衍生的ACE抑制肽可以抵抗食品加工过程中的酸性或弱碱性条件而强碱加热下被降解或水解成无活性片段。周剑敏等[22]研究pH对高粱蛋白肽ACE抑制活性的影响时发现强碱性条件下ACE抑制肽的抑制活性有所降低,认为肽在强碱性环境下会发生消旋作用,改变肽结构从而导致活性降低。ACE抑制肽HIIARPH和LRLKE在强碱性条件下活性显著降低,推测是强碱性条件破坏其肽链结构,导致部分活性的丧失。而在肠胃道环境中pH<9.0,因此可以推测抑制肽在体内环境中能保持一定的活性和稳定。

a-不同温度;b-不同pH值
图6 不同温度和pH对ACE抑制活性的影响
Fig.6 The influence of different temperature, and pH for ACE inhibitory activity
注:图中不同小写字母表示差异显著(P<0.05)
2.6 ACE抑制肽的细胞毒性分析
由图7可知,在测试浓度为10、100、1 000 μmol/L的寡肽处理下,HUVEC细胞的存活率没有明显降低,存活率都>80%,可以认为1 000 μmol/L浓度下的寡肽HIIARH和LRLKE对HUVEC细胞无明显毒性(P>0.05)。这表明它们能进一步研究或开发应用于食品或者医药。
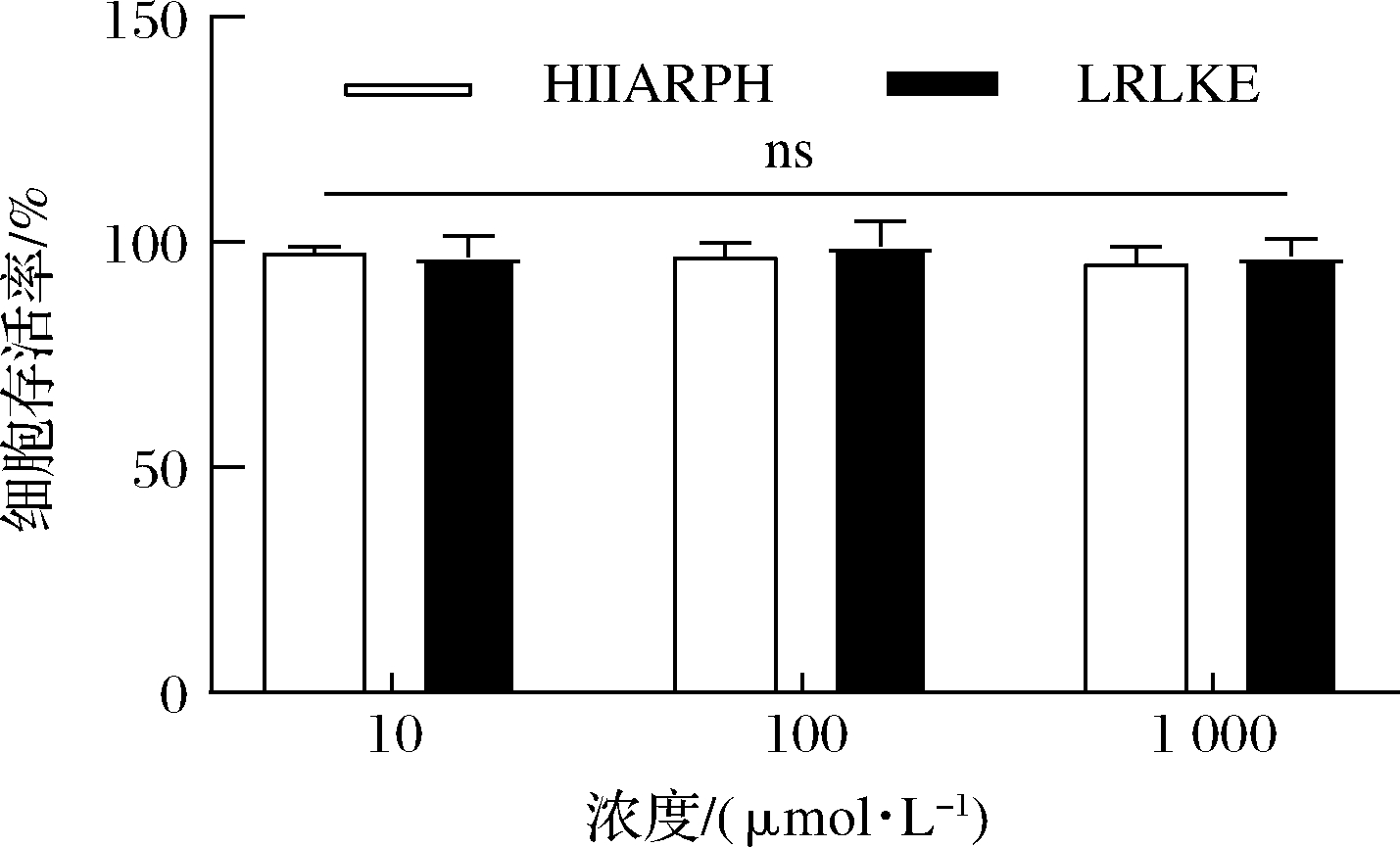
图7 两种新ACE抑制肽对HUVEC细胞活力的影响
Fig.7 The influence of cell viability for two new ACE inhibitory peptides on HUVEC cells
注:ns表示无显著差异(P>0.05)
3 结论与讨论
本研究分别用碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶水解螺旋藻源蛋白,其中碱性蛋白酶水解物的水解度、DPPH自由基清除活性以及ACE抑制活性最优。通过肽组学手段与药效团和分子对接的方法联用,筛选出两种未被报道过的ACE抑制肽HIIARPH(461.5 μmol/L)和LRLKR(155.8 μmol/L)。本研究提供的方法较传统酶解分离方法极大节约时间和成本,显著提高筛选与鉴定ACE抑制肽的效率。此外,研究发现HIIARPH和LRLKR的酶抑制动力学为非竞争抑制模式。进一步,分子对接结果表明HIIARPH和LRLKR与ACE的氨基酸残基活性口袋S1、S2形成氢键作用力,从而具有显著的体外ACE抑制活性。LRLKE能与S3口袋和Zn2+结合,表明其具有更佳的抑制活性。稳定性研究表明LRLKE在酸性和弱碱性条件下能够保持较好的ACE抑制活性,但是HIIARH对热和pH的较敏感,之后可以对HIIARPH进行修饰或包载以提高它在应用时的稳定性。这些结果表明,通过计算模拟可以快速筛选出具有ACE抑制活性的肽段,同时HIIARPH和LRLKE具有替代药物治疗高血压的潜在可能性。之后的工作将进一步研究这两种新的ACE抑制肽是否具有体内降压作用以及其作用机制。
[1] SINGH S, SHANKAR R, SINGH G P.Prevalence and associated risk factors of hypertension:A cross-sectional study in urban Varanasi[J].International Journal of Hypertension, 2017:5491838.
[2] LIN K, ZHANG L W, HAN X, et al.Novel angiotensin I-converting enzyme inhibitory peptides from protease hydrolysates of Qula casein:Quantitative structure-activity relationship modeling and molecular docking study[J].Journal of Functional Foods, 2017, 32:266-277.
[3] SICA D A.Angiotensin converting enzyme inhibitors side effects-physiologic and non-physiologic considerations[J].The Journal of Clinical Hypertension, 2004, 6(7):410-416.
[4] SONKLIN C, ALASHI M A, LAOHAKUNJIT N, et al.Identification of antihypertensive peptides from mung bean protein hydrolysate and their effects in spontaneously hypertensive rats[J].Journal of Functional Foods, 2020, 64(c):103635.
[5] 常畅, 刘治平, 陈哲漪, 等. 棉籽蛋白ACE抑制肽的酶法制备及其体外稳定性研究[J]. 食品科学技术学报, 2023, 41(1):106-114.
CHANG C, LIU Z P, CHEN Z Y, et al. Enzymatic preparation of cottonseed protein ACE inhibitory peptide and its stability in vitro[J]. Journal of Food Science and Technology, 2023, 41(1):106-114.
[6] 张学成, 信式祥, 李清华, 等.螺旋藻最完美的功能食品[M].青岛:海洋大学出版社, 1999:54-83.
ZHANG X C, XIN S X, LI Q H, et al.Spirulina the Most Perfect Functional Food[M].Qing Dao:Ocean University Press, 1999:54-83.
[7] 于志鹏, 樊玥, 赵文竹, 等.鸡蛋蛋白ACE抑制肽的筛选、鉴定及其作用机制[J].食品科学, 2020, 41(12):129-135.
YU Z P, FAN Y, ZHAO W Z, et al.Identification and mechanism of action of angiotensin I converting enzyme inhibitory peptides from egg proteins[J].Food Science, 2020, 41(12):129-135.
[8] TONG X Y, GOVINDARAJAN P, ZHANG N, et al.Spectroscopic and molecular docking studies on the interaction of phycocyanobilin with peptide moieties of C-phycocyanin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 236:1 386-1 425.
[9] LIU D Z, LIN Y S, HOU W C.Monohydroxamates of aspartic acid and glutamic acid exhibit antioxidant and angiotensin converting enzyme inhibitory activities[J].Journal of Agricultural and Food Chemistry, 2004, 52(8):2 386-2 390.
[10] 骆琳, 丁青芝, 马海乐.96孔板法用于高通量血管紧张素转化酶抑制剂体外检测[J].分析化学, 2012, 40(1):129-134.
LUO L, DING Q Z, MA H L.Establishment of in vitro high-throughput activity detection method for angiotensin converting enzyme inhibitors based on 96 well plates[J].Chinese Journal of Analytical Chemistry, 2012, 40(1):129-134.
[11] 蔡金秀, 夏姗姗, 马佳雯, 等.马面鱼皮ACE抑制肽的制备、分离纯化及稳定性[J].中国食品学报, 2022, 22(3):225-234.
CAI J X, XIA S S, MA J W, et al.Preparation, isolation and stability of collagen ACE inhibitory peptides from the skin of navodon septentrionalis[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(3):225-234.
[12] BAO C J, CHEN H, CHEN L, et al.Comparison of ACE inhibitory activity in skimmed goat and cow milk hydrolyzed by alcalase, flavourzyme, neutral protease and proteinase K[J].Acta Universitatis Cibiniensis Series E:Food Technology, 2016, 20(1):77-84.
[13] AMBIGAIPALAN P, AL-KHALIFA A S, SHAHIDI F.Antioxidant and angiotensin I converting enzyme inhibitory activities of date seed protein hydrolysates prepared using Alcalase, Flavourzyme and Thermolysin[J].Journal of Functional Foods, 2015, 18:1 125-1 137.
[14] LOURENÇO DA COSTA E, ANTONIO DA ROCHA GONTIJO J, NETTO F M.Effect of heat and enzymatic treatment on the antihypertensive activity of whey protein hydrolysates[J].International Dairy Journal, 2007, 17(6):632-640.
[15] WIJESEKARA I, KIM S K.Angiotensin-I-converting enzyme (ACE) inhibitors from marine resources:Prospects in the pharmaceutical industry[J].Marine Drugs, 2010, 8(4):1 080-1 093.
[16] RAWENDRA R D S, AISHA, CHANG C I, et al.A novel angiotensin converting enzyme inhibitory peptide derived from proteolytic digest of Chinese soft-shelled turtle egg white proteins[J].Journal of Proteomics, 2013, 94:359-369.
[17] WU Q Y, JIA J Q, YAN H, et al.A novel angiotensin-I converting enzyme(ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa (Bombyx mori) protein:Biochemical characterization and molecular docking study[J].Peptides, 2015, 68:17-24.
[18] 李娇, 苏继磊, 陈敏, 等. 马氏珍珠贝肉蛋白水解特征及其ACE抑制肽的筛选[J]. 食品科学, 2022, 43(4): 119-126.
LI J, SU J L, CHEN M, et al. Hydrolysis characteristics of Pinctada fucata meat protein and screening angiotensin-converting enzyme inhibitory peptides[J]. Food Science, 2022, 43(4): 119-126.
[19] 鲁军, 任迪峰, 王建中, 等.螺旋藻源血管紧张素转化酶抑制肽的纯化和鉴定[J].生物化学与生物物理进展, 2010, 37(5):568-574.
LU J, REN D F, WANG J Z, et al.Purification and characterization of an angiotensin I-converting enzyme inhibitory peptide derived from Spirulina platensis[J].Progress in Biochemistry and Biophysics, 2010, 37(5):568-574.
[20] WEI D, FAN W L, XU Y.In vitro production and identification of angiotensin converting enzyme inhibitory peptides derived from distilled spent grain prolamin isolate[J].Foods, 2019, 8:390.
[21] WU W, YU P P, ZHANG F Y, et al.Stability and cytotoxicity of angiotensin-I-converting enzyme inhibitory peptides derived from bovine casein[J].Journal of Zhejiang University Science B, 2014, 15(2):143-152.
[22] 周剑敏, 尹方平, 于晨, 等.高粱碱溶蛋白ACE抑制肽的制备及其稳定性研究[J].中国粮油学报, 2019, 34(8):66-72.
ZHOU J M, YIN F P, YU C, et al.Preparation and stability of ACE inhibitory peptides derived from Sorghum protein[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):66-72.