维生素D3是一类常见维生素,在维持血液钙和磷的稳定、抗佝偻、协助骨骼正常生长和肌肉收缩病防治以及神经传导等方面发挥着重要作用[1-4]。随着人们对维生素的不断认识和探索,维生素D3在心血管病、糖尿病等方面的作用也在不断开拓[5-7]。但维生素D3作为一类脂溶性维生素相较于维生素C等水溶性维生素很难直接均匀添加入食品、化妆品中,光照、脂肪酸败也将影响维生素D3的稳定性,这些特性都限制了其应用操作的范围[8]。微胶囊包埋技术作为近年来新兴的研究领域[9],可以用于对维生素D3等敏感活性物质进行保护,可提高活性物质对光照、温度、氧气等加工条件的稳定性,延长它的货架期。
玉米低聚肽(下简称玉米肽)和小麦低聚肽(下简称小麦肽)分别是以玉米黄粉和谷朊粉两类淀粉副产物为原料,经酶解精制得到的活性短肽。在已有研究中这两类短肽展现了抗肿瘤、抗氧化、降血压等多样的生物活性,在作为功能性食品基础原料等研究中有巨大的应用价值[10-13]。但目前以该类蛋白酶解物作为微胶囊壁材的研究还较为少见。玉米肽和小麦肽具有良好的水溶性,二者作为壁材不仅可以保护维生素D3的活性,还可作为营养物质被人体吸收。
本文选择玉米肽和小麦肽作为壁材,维生素D3油作为芯材采用喷雾干燥法制得新型的玉米肽-维生素D3微胶囊和小麦肽-维生素D3微胶囊,对2种微胶囊的制备过程进行了正交实验优化,并对其稳定性进行了初步研究,为相关微胶囊产品在食品应用方向研究的进一步发展提供帮助。
1 材料与方法
1.1 材料与试剂
玉米低聚肽、小麦低聚肽,浙江海氏生物科技有限公司;维生素D3油(100万IU/g食品级),郑州利升生物科技有限公司;吐温-20(分析纯),天津市光复精细化工研究所;石油醚(分析纯),天津市大茂化学试剂厂;25%氨水(分析纯),北京益利精细化学品有限公司;95%乙醇(分析纯),北京化工厂有限责任公司;乙醚(分析纯),北京市通广精细化工公司。
1.2 仪器与设备
KQ-250E超声波振荡器,昆山市超声仪器有限公司;AB104-N电子天平,Mettler Toledo公司;1204007恒温水浴锅,苏州珀西瓦尔实验设备有限公司;DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司;T25 digital高速分散机,上海珂淮仪器有限公司;UV1780紫外光谱仪,日本岛津公司;YC-1000喷雾制粒包衣机,上海雅程仪器设备有限公司;JB-1A磁力搅拌器,上海精科仪器有限公司;LG10-2.4A离心机,北京时代北利离心机有限公司;傅里叶变换红外光谱仪,美国帕金埃尔默公司。
1.3 实验方法
1.3.1 低聚肽-维生素D3微胶囊的制备
根据所需芯壁比(维生素D3油质量m1:肽粉质量m2)和固形物质量浓度(溶液中肽粉和维生素D3油总质量浓度),称取一定质量玉米肽粉或小麦肽粉,将玉米肽粉或小麦肽粉溶于蒸馏水中,加入对应质量维生素D3油和体积0.5%的吐温-20,在50 ℃条件下用恒温水浴锅搅拌20 min(500 r/min),用高速剪切分散机以6 000 r/min的速度剪切乳化,形成稳定乳状液。将装有乳化液的烧杯置于磁力搅拌机上匀速搅拌,同时以6 mL/min速度进料在一定温度下喷雾干燥,制得低聚肽-维生素D3微胶囊,质量为m3。上述操作均在避光条件下进行。产率X1计算如公式(1)所示:
(1)
1.3.2 维生素D3微胶囊包埋率的测定
采用石油醚萃取法获取表面油:准确称取2.000 g(精确至0.001 g)样品放入离心管中,加入15 mL石油醚,振荡混匀3 min,离心5 min(6 000 r/min)后取上清液,重复3次合并上清液,将上清液倒入已称重的干燥表面皿中,使石油醚自然挥发,利用减重法计算产品表面油质量m4。
采用碱性乙醚法获取总油:准确称取2.000 g(精确至0.001 g)样品放入离心管中,加入10 mL水在60 ℃下溶解,加入1 mL 25%氨水,摇匀;加入10 mL乙醇,摇匀。冷却至室温后,转入分液漏斗中,加入25 mL乙醚,摇匀,放气。加入25 mL石油醚,摇匀,分液取上层石油醚相,倒入已称重的干燥表面皿中,使石油醚自然挥发,用减重法得出产品总油质量m5。微胶囊包埋率X2计算如公式(2)所示:
(2)
1.3.3 维生素D3标准曲线
以正己烷为溶剂,维生素D3油为溶质,配制维生素D3油质量浓度为0.40 g/L的标准溶液。对0.40 g/L维生素D3油标准溶液以正己烷为溶剂稀释,最终得到质量浓度分别为0.04、0.08、0.12、0.16、0.20 g/L的维生素D3油标准溶液。在其最大吸收波长下测定各组标准溶液的吸光度,以维生素D3油标准溶液浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.4 维生素D3微胶囊芯材的红外光谱
选择从微胶囊中提取的维生素D3油和原料维生素D3油进行红外光谱扫描。
1.3.5 维生素D3微胶囊的稳定性评价
选择水溶性、热稳定性和胃环境稳定性作为评价微胶囊稳定性的指标。
水溶性:参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》和GB 5413.29—2010《食品安全国家标准 婴幼儿食品和乳品中溶解性的测定》分别测定样品水分含量和溶解度。
热稳定性:取适量包埋产品放入80 ℃烘箱中,2 h后取出测定芯材包埋率[14]。
胃环境稳定性:将包埋产品分别置于模拟胃液中,探究芯材在胃液中的累计释放率和时间的关系,评价样品的胃液稳定性和释放性能。模拟胃液配制和具体操作参考中国药典[15]。取包埋产品5 g,置于50 mL的模拟胃液中,并在37 ℃下模拟胃蠕动适度搅拌,分别在0、30、60、90、120、150、180、240 min取样3 mL,离心后取上清液用正己烷萃取,用紫外分光光度计在最大吸收波长下测定吸光度,由维生素D3油标准曲线计算释出油质量m6,绘制芯材的累积释放曲线。
2 结果与分析
2.1 低聚肽-维生素D3微胶囊制备单因素实验
包埋率是考量微胶囊质量的一个重要的物理量,但考量到微胶囊的产率在工业生产中的重要性,因此规定在产率低于60%时,其数据不被用于后续正交试验条件选取。
2.1.1 芯材壁材比对包埋率和产率的影响
在喷雾干燥温度150 ℃,固形物质量浓度0.15 g/mL,剪切乳化速度6 000 r/min,0.5%吐温-20的条件下,选择芯材壁材配比1∶5、1∶10、1∶15、1∶20、1∶25(质量比)进行单因素试验(图1)。在包埋率方面,玉米肽为壁材时,壁材比例越高,微胶囊包埋率整体呈上升趋势,但变化趋势也随之放缓;当芯材壁材比为1∶20时,包埋率可达75.5%,1∶25和1∶20相比包埋率出现了少量降低,为75.7%。小麦肽为壁材时,随芯材壁材比减小包埋率先上升后小幅下降趋平,芯材壁材比为1∶15时达到最大值72.2%,1∶25和1∶20时包埋率也高于1∶5、1∶10时的包埋率,整体为上升趋势。在产率方面,玉米肽为壁材时,产率呈先增大后减小的趋势,芯材壁材比为1∶15时达到最大值69.6%,推测其原因是壁材比例小时油状芯材导致粘壁损失,故随着壁材比例增大产率也增大,但壁材比例过大时乳状液流动性降低也发生粘壁,进而产率降低。而小麦肽为壁材时,产率整体呈上升趋势,但当壁材比例过大时产率也不再显著增高(P>0.05),芯材壁材比为1∶25时达到最大值75.4%。从产率和包埋率综合考虑,玉米肽选择1∶10、1∶15、1∶20三个水平,小麦肽选择1∶15、1∶20、1∶25三个水平进行正交试验。小麦肽微胶囊与玉米肽微胶囊在芯壁比由1∶5增加至1∶25时,包埋率增长趋势近似,包埋率的不同可能是由于二者的氨基酸组成存在差异,小麦肽富含极性氨基酸谷氨酰胺[16-17],而玉米肽富含非极性的支链氨基酸[18-19],侧链存在的差异影响了包埋率。在其他条件不变的情况下,优化芯材与壁材比条件后的玉米肽微胶囊包埋率高于小麦肽微胶囊
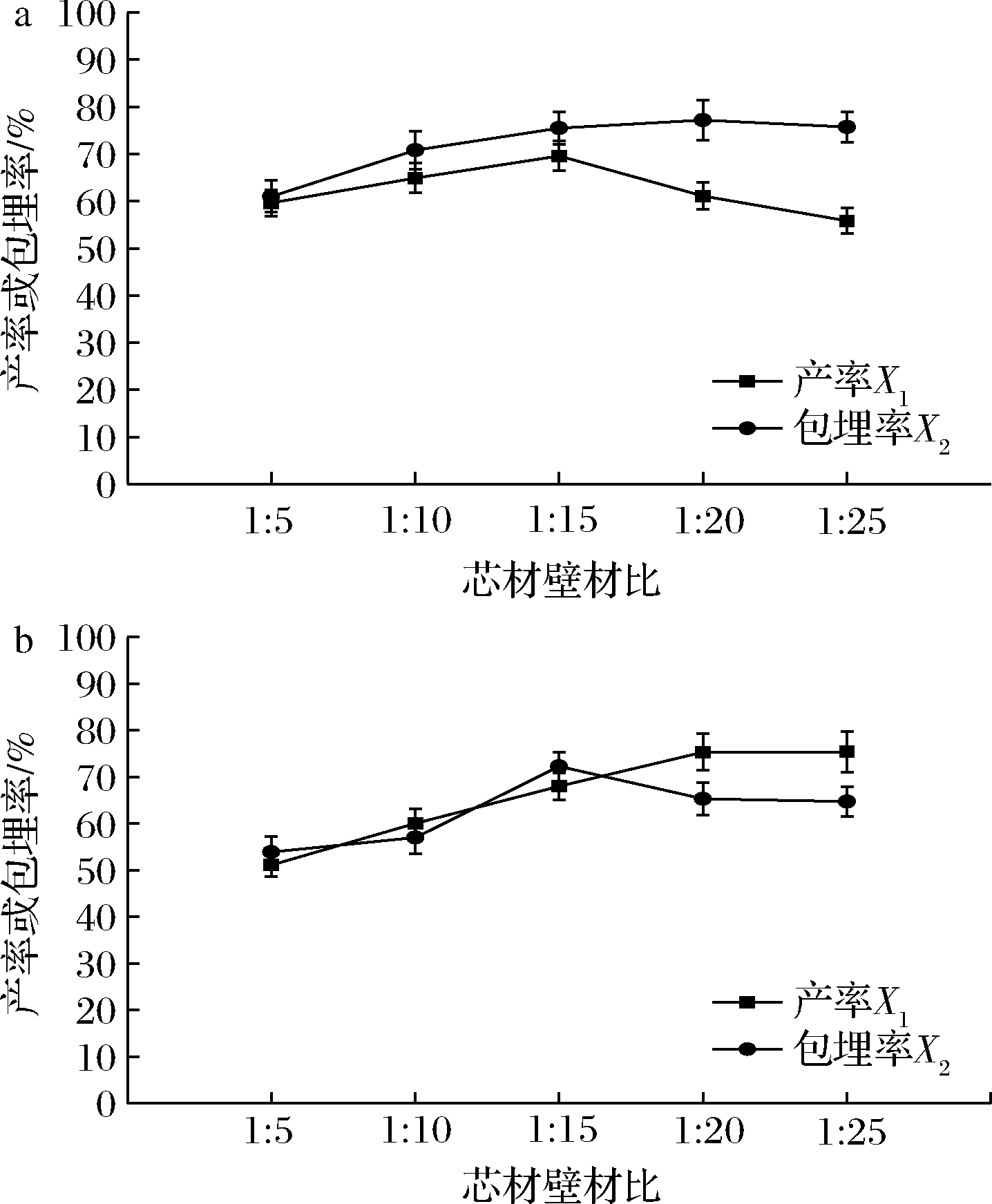
a-玉米肽;b-小麦肽
图1 芯材壁材比对玉米肽与小麦肽包埋率和产率的影响
Fig.1 Effects of core material and wall material ratio on embedding rate and yield of corn peptide and wheat peptide
2.1.2 固形物质量浓度对包埋率和产率的影响
在喷雾干燥温度150 ℃,芯材壁材比1∶15,剪切乳化速度6 000 r/min,0.5%吐温-20的条件下,固形物质量浓度选择0.05、0.10、0.15、0.20、0.25 g/mL,进行单因素试验(图2)。在包埋率方面,玉米肽微胶囊在固形物质量浓度0.05~0.20 g/mL的包埋率变化并不显著(P>0.05),在0.20 g/mL时包埋率最大值为75.8%;而质量浓度增大至0.25 g/mL时包埋率出现了显著降低(P<0.05),推测其原因是浓度过高使乳液黏度增大导致的喷雾干燥喷针堵塞雾化困难[20]。小麦肽微胶囊的包埋率随浓度增大出现了先增大后减小的趋势,在0.15 g/mL时包埋率最大值为72.2%。在产率方面,玉米肽微胶囊产率变化趋势与包埋率相近,均是在浓度过大时出现了显著下降(P<0.05),0.20 g/mL时产率最高为75.8%。小麦肽微胶囊产率在0.15 g/mL时出现下降,此后基本持平,0.10 g/mL时产率最高为71.6%。从产率和包埋率综合考虑,玉米肽选择0.10、0.15、0.20 g/mL 3个水平,小麦肽选择0.10、0.15、0.25 g/mL 3个水平进行正交试验。在固形物浓度实验中,包埋率随浓度变化趋势上,小麦肽微胶囊和玉米肽微胶囊均是在较高浓度时出现了下降,推测其原因均是浓度过高导致喷针堵塞。小麦肽微胶囊包埋率仅有2组高于70%,推测其原因在于2种肽氨基酸组成的差别,由此看出在该条件变化中玉米肽微胶囊包埋率也略高于小麦肽微胶囊。

a-玉米肽;b-小麦肽
图2 固形物质量浓度对玉米肽与小麦肽包埋率和产率的影响
Fig.2 Effects of concentration on embedding rate and yield of corn peptide and wheat peptide
2.1.3 喷雾干燥温度对包埋率和产率的影响
在固形物质量浓度0.15 g/mL,芯材壁材比1∶15,剪切乳化速度6 000 r/min,0.5%吐温-20的条件下,喷雾干燥温度选择130、140、150、160、170 ℃,进行单因素试验(图3)。在包埋率方面,高温使水分散失进而使溶液可快速形成微胶囊,玉米肽微胶囊随喷雾干燥温度升高包埋率呈先增大后减小的趋势,在150 ℃时包埋率最大值为75.5%,温度大于150 ℃后 包埋率出现显著降低(P<0.05),推测其原因为温度过高使水分散失过快,产品表面发生凹陷挤压了芯材[21]。小麦肽微胶囊的包埋率变化趋势与玉米肽近似,在150 ℃时包埋率最大为72.2%。在产率方面,玉米肽微胶囊产率在130~160 ℃逐步上升,130 ℃产率最低为54.7%,推测其原因是温度过低水分散失慢导致了严重粘壁现象。产率160 ℃产率最高为71.8%,温度过高时出现了轻微下降(P>0.05),推测原因也是由于芯材被挤压。小麦肽微胶囊产率随温度变化呈现显著升高(P<0.05)后基本不变化(P>0.05)的现象,130 ℃产率最低为46.4%,140 ℃产率最高为70.6%,推测其原因也是因温度过低水分散失慢导致了严重粘壁现象降低产率。从产率和包埋率综合考虑,玉米肽和小麦肽均选择140、150、160 ℃ 3个水平进行正交试验。温度调控实验中,两类微胶囊包埋率均在65%~73%浮动,表明温度对包埋率的影响可能强于2种肽本身化学组成的差异。

a-玉米肽;b-小麦肽
图3 喷雾干燥温度对玉米肽与小麦肽包埋率和 产率的影响
Fig.3 Effects of spray drying temperature on embedding rate and yield of corn peptide and wheat peptide
2.2 低聚肽-维生素D3微胶囊制备正交实验优化
如表2所示,选择喷雾干燥温度、芯材壁材比、固形物质量浓度为因素,每个因素选择3个水平,以包埋率为评价指标进行正交试验优化。
由表3可知各因素对玉米肽微胶囊包埋率影响大小关系为:温度>芯壁比>固形物质量浓度,包埋率最佳水平为喷雾干燥温度为150 ℃、芯材壁材比为1∶20、固形物浓度为0.15 g/mL,包埋率为75.8%。
由表4可知,各因素对小麦肽微胶囊包埋率影响大小关系为:固形物质量浓度>温度>芯壁比,最佳水平为喷雾干燥温度为150 ℃、芯材壁材比为1∶20、固形物质量浓度为0.15 g/mL,包埋率为73.8%。
表2 正交试验因素水平表
Table 2 Design of orthogonal test

壁材水平因素喷雾干燥温度A/℃芯材壁材比B固形物质量浓度C/(g·mL-1)11401∶100.10玉米肽21501∶150.1531601∶200.2011401∶150.10小麦肽21501∶200.1531601∶250.25
表3 玉米肽正交试验结果
Table 3 Results of corn peptide orthogonal test
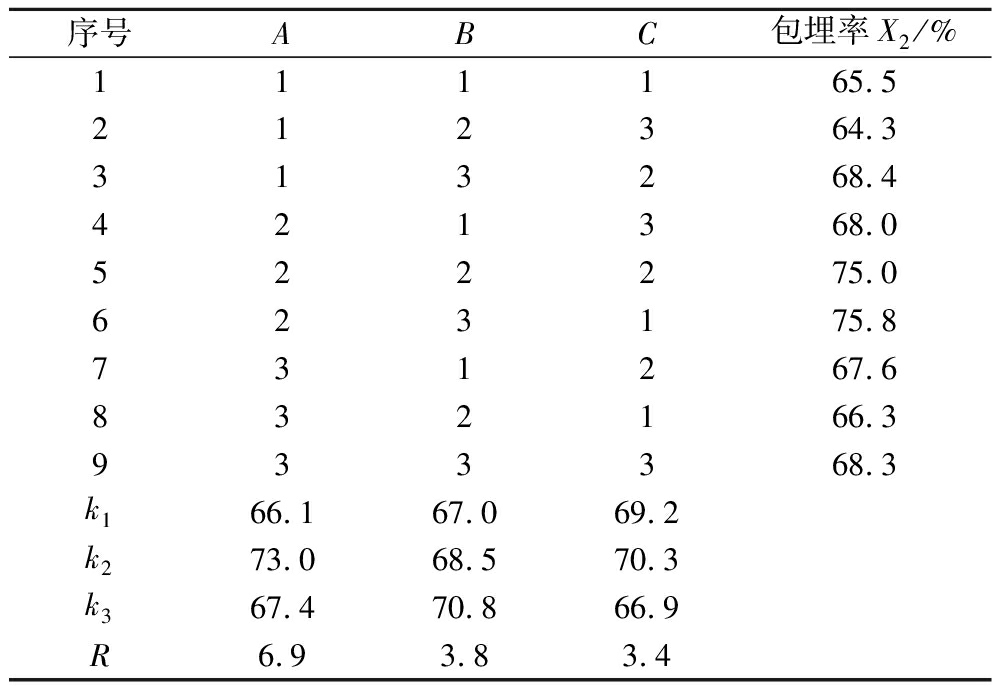
序号ABC包埋率X2/%111165.5212364.3313268.4421368.0522275.0623175.8731267.6832166.3933368.3k166.167.069.2k273.068.570.3k367.470.866.9R6.93.83.4
表4 小麦肽正交试验结果
Table 4 Results of wheat peptide orthogonal test

序号ABC包埋率X2/%111163.6212357.4313264.0421361.0522273.8623167.8731266.8832166.2933360.9k162.264.466.3k267.565.668.2k364.564.259.8R5.31.48.4
由玉米肽微胶囊和小麦肽微胶囊在最佳工艺条件下的包埋率以及正交实验数据可以看出,玉米肽微胶囊比小麦肽微胶囊的包埋率较优。
2.3 维生素D3微胶囊芯材的红外光谱
为确认微胶囊制备过程中芯材是否出现明显变质,影响营养成分,选择未包埋的原料维生素D3油和提取自微胶囊的总油进行红外光谱检测。如图4所示,包埋前后,维生素D3的特征羟基伸缩振动(3 393 cm-1,3 367 cm-1)、sp3碳氢键伸缩振动(2 925 cm-1,2 924 cm-1)、sp2碳碳键伸缩振动(1 760 cm-1,1 760 cm-1)、sp3碳氢键面内摇摆振动(1 461 cm-1,1 461 cm-1)、sp3碳氢键剪式振动(1 367 cm-1,1 378 cm-1)、原料溶剂玉米油(1 209 cm-1,1 207 cm-1)、环二级醇碳氧键伸缩振动(1 079 cm-1,1 049 cm-1)仍存在,证明芯材维生素D3油结构未出现变质。各个特征峰出现了小于30 cm-1的位移,原因可能在于微胶囊中维生素D3油提取过程中存在部分乙醇、乙醚、石油醚等溶剂少量残留。这些溶剂的分子结构同样存在羟基、碳氧键、sp3碳氢键,产生的红外吸收谱带与维生素D3油的原有谱带发生了重叠导致峰位移,同时这些溶剂分子与维生素D3的氢键等相互作用也可能使特征峰发生位移。

a-原料;b-微胶囊提取
图4 原料与微胶囊提取维生素D3油红外光谱
Fig.4 Infrared spectra of vitamin D3 from original oil and from microcapsules
2.4 维生素D3微胶囊的稳定性评价
2.4.1 水分含量、溶解度和热稳定性
如表5所示,玉米肽微胶囊和小麦肽微胶囊的溶解度分别为95.7%和96.0%,二者含水量分别仅有5.30%和5.80%,表明两类微胶囊均使非水溶性维生素D3油实现了水溶。微胶囊粉末经80 ℃烘箱加热2 h后,选用的玉米肽微胶囊包埋率下降7.50%,小麦肽微胶囊包埋率下降7.40%,下降幅度接近且均小于10%,表明肽-维生素D油类的包埋物均有较好的热稳定性。
表5 微胶囊的水分含量、溶解度和热稳定性
Table 5 Moisture content, solubility, and thermal stability of microcapsules
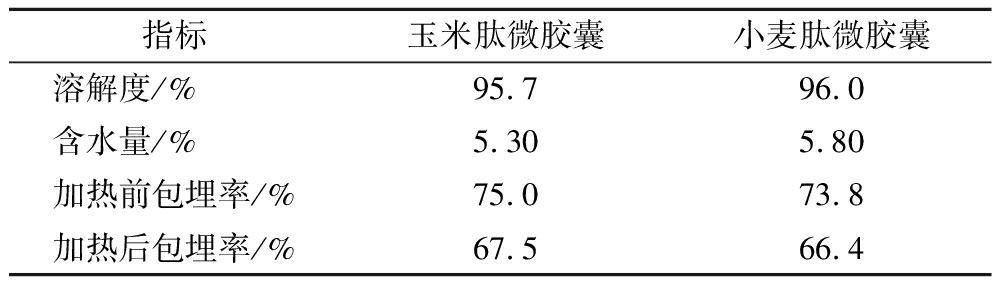
指标玉米肽微胶囊小麦肽微胶囊溶解度/% 95.796.0含水量/% 5.305.80加热前包埋率/%75.073.8加热后包埋率/%67.566.4
2.4.2 胃环境稳定性
标准曲线拟合方程为y=4.927x-0.032,R2=0.996,由此计算释放维生素D3含量和释放率。由图5可知,在模拟胃液中,4 h期间释放率随时间延长而增大。4 h时玉米肽微胶囊释放率为10.0%,小麦肽微胶囊释放率为5.75%,可见包埋产品释放十分缓慢,微胶囊具有较好的胃环境稳定性和缓释作用。小麦肽微胶囊稳定性略优于玉米肽微胶囊,推测其原因在于二者与维生素D3油间的相互作用的不同,玉米肽富含支链氨基酸与脂溶性的维生素D3可能存在广泛的疏水相互作用,而富含谷氨酰胺的小麦肽更可能与维生素D3中的羟基存在氢键。在酸性条件和胃蛋白酶影响下,氢键较疏水相互作用更加稳定,进而导致小麦肽具有更好的胃环境稳定性。
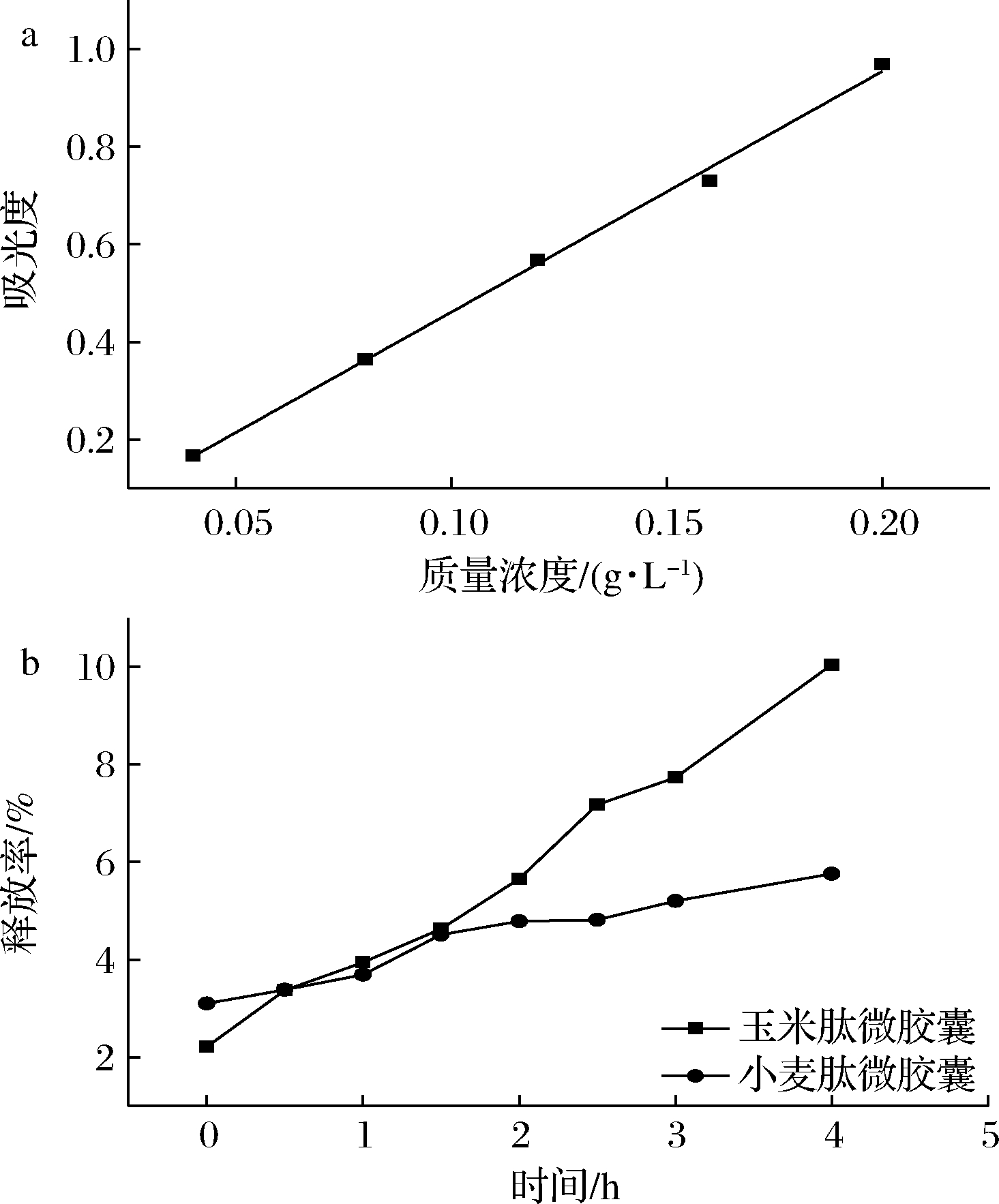
a-维生素D3油标准曲线;b-微胶囊在模拟胃液中的释放曲线
图5 维生素D3油标准曲线和微胶囊在模拟胃液中的 释放曲线
Fig.5 The standard curve of vitamin D3 oil and the release curve of microcapsules in simulated gastric fluid
3 结论
本文选择玉米低聚肽或小麦低聚肽为壁材,维生素D3油为芯材,吐温-20为乳化剂,利用喷雾干燥法成功制备了2种低聚肽包埋维生素D3微胶囊,并通过红外光谱确认了芯材在制备过程中稳定不变质。利用单因素试验和正交试验方法确定了玉米肽微胶囊和小麦肽微胶囊的最佳制备条件均为喷雾干燥温度150 ℃、芯材壁材比1∶20、固形物质量浓度0.15 g/mL,包埋率相近分别为75.8%和73.8%。两者制备过程的对比研究中发现,玉米肽微胶囊的包埋率一般高于小麦肽,推测原因在于二者的氨基酸组成的差异,小麦肽富含极性氨基酸谷氨酰胺,而玉米肽富含非极性的支链氨基酸,侧链存在的差异影响了包埋率。
2种微胶囊均有较好的热稳定性和胃环境稳定性,在胃液中均有明显的缓释效果,小麦肽微胶囊优于玉米肽微胶囊,推测其原因是也是两类肽侧链与维生素D3的相互作用不同导致的。两类微胶囊的制备对比在实用方面揭示了壁材短肽的结构极可能决定制备微胶囊性质,为后续制备肽壁材微胶囊在理论上筛选优化方法提供了实例思路,同时两类肽-维生素D3微胶囊均有良好的溶解性,可以有效解决脂溶性维生素D3的水溶性问题,将促进维生素D3水溶性制剂的发展。
[1] GUELI N, VERRUSIO W, LINGUANTI A, et al.Vitamin D:Drug of the future.A new therapeutic approach[J].Archives of Gerontology and Geriatrics, 2012, 54(1):222-227.
[2] RAMAGOPALAN S V, HEGER A, BERLANGA A J, et al.A ChIP-seq defined genome-wide map of vitamin D receptor binding:Associations with disease and evolution[J].Genome Research, 2010, 20(10):1 352-1 360.
[3] BISCHOFF-FERRARI H A, DAWSON-HUGHES B, WILLETT W C, et al.Effect of vitamin D on falls:A meta-analysis[J].JAMA, 2004, 291(16):1 999-2 006.
[4] TIAN J, LIU Y H, WILLIAMS L A, et al.Potential role of active vitamin D in retarding the progression of chronic kidney disease[J].Nephrology Dialysis Transplantation, 2007, 22(2):321-328.
[5] ZITTERMANN A, TRUMMER C, THEILER-SCHWETZ V, et al.Vitamin D and cardiovascular disease:An updated narrative review[J].International Journal of Molecular Sciences, 2021, 22(6):2 896.
[6] PITTAS A G, LAU J, HU F B, et al.The role of vitamin D and calcium in type 2 diabetes.A systematic review and meta-analysis[J].The Journal of Clinical Endocrinology &Metabolism, 2007, 92(6):2 017-2 029.
[7] 秦晓伟,韩璐,徐新娟.维生素D3对自发性高血压大鼠肾素-血管紧张素-醛固酮系统的影响[J].中华实用诊断与治疗杂志,2013,27(3):228-230.
QIN X W, HAN L, XU X J.Influence of vitamin D3 on renin-angiotensin-aldosterone system in the spontaneous hypertensive rats[J].Journal of Chinese Practical Diagnosis and Therapy, 2013, 27(3):228-230.
[8] 党子雪. 负载维生素D3改性壳聚糖纳米粒的制备与性质研究[D].杭州:浙江工商大学, 2020.
DANG Z X.Preparation and properties of modified chitosan nanoparticles loaded with vitamin D3[D].Hangzhou:Zhejiang Gongshang University, 2020.
[9] TSUJI K.Microencapsulation of pesticides and their improved handling safety[J].Journal of Microencapsulation, 2001, 18(2):137-147.
[10] 李勇, 蔡木易.肽营养学[M].北京:北京大学医学出版社, 2007.
LI Y, CAI M Y.Peptide Nutrition[M].Beijing:Peking University Medical Press, 2007.
[11] ORTIZ-MARTINEZ M, GONZALEZ DE MEJIA E, GARC A-LARA S, et al.Antiproliferative effect of peptide fractions isolated from a quality protein maize, a white hybrid maize, and their derived peptides on hepatocarcinoma human HepG2 cells[J].Journal of Functional Foods, 2017, 34:36-48.
A-LARA S, et al.Antiproliferative effect of peptide fractions isolated from a quality protein maize, a white hybrid maize, and their derived peptides on hepatocarcinoma human HepG2 cells[J].Journal of Functional Foods, 2017, 34:36-48.
[12] WANG L Y, DING L, YU Z P, et al.Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal -derived antioxidant peptides in HepG2 cells[J].Food Research International, 2016, 90:33-41.
[13] HUANG W H, SUN J, HE H, et al.Antihypertensive effect of corn peptides, produced by a continuous production in enzymatic membrane reactor, in spontaneously hypertensive rats[J].Food Chemistry, 2011, 128(4):968-973.
[14] 徐姗姗, 刘文颖, 陆路, 等. 猕猴桃籽油微胶囊的制备及稳定性研究[J]. 食品与发酵工业, 2018, 44(9):136-141.
XU S S, LIU W Y, LU L, et al. Preparation and stability of kiwi seed oil microcapsules[J]. Food and Fermentation Industries, 2018, 44(9):136-141.
[15] 国家药典委员会. 中华人民共和国药典-二部: 2010年版[M]. 北京: 中国医药科技出版社, 2010.
[16] 中华人民共和国工业和信息化部. 小麦低聚肽粉: QB/T 5298—2018[S]. 北京: 中国轻工业出版社,2018.
[17] 刘文颖, 冯晓文, 程青丽, 等. 小麦低聚肽的结构特征及其体外抗氧化活性[J]. 现代食品科技, 2021, 37(12):72-79.
LIU W Y, FENG X W, CHENG Q L, et al. Structural characteristics and in vitro antioxidative activity of wheat oligopeptides[J]. Modern Food Science and Technology, 2021, 37(12):72-79.
[18] 陈亮, 王雨晴, 冀峰, 等. 玉米低聚肽中焦谷氨酰亮氨酸(pEL)二肽的研究[J]. 食品与发酵工业, 2021, 47(3):49-52.
CHEN L, WANG Y Q, JI F, et al. Study on p EL dipeptide in corn oligopeptides[J]. Food and Fermentation Industries, 2021, 47(3):49-52.
[19] 中华人民共和国工业和信息化部. 玉米低聚肽粉: QB/T 4707—2014[S]. 北京: 中国轻工业出版社, 2014.
[20] 亢思莹,顾宙辉,黄鑫.喷雾干燥技术在固体分散体制备中的应用[J].药学与临床研究,2022,30(2):159-161.
KANG S Y, GU Z H, HUANG X.Application of spray dry technology in preparation of solid dispersion[J].Pharmaceutical and Clinical Research, 2022,30(2):159-161.
[21] 徐振波,梁军,陈丽丽,等.微胶囊化粉末油脂的研究与应用进展[J].食品工业科技,2014,35(5):392-395.
XU Z B, LIANG J, CHEN L L, et al.Research progress in production and application of microcapsulated oil and fat powder[J].Science and Technology of Food Industry, 2014,35(5):392-395.