在哺乳动物体内,5-羟基色氨酸(5-hydroxytr-yptophan, 5-HTP)是神经递质5-羟基色胺(5-hydroxytryptamine, 5-HT)的重要前体[1],5-HT是一种神经作用子,负责细胞间信号的传递,人脑中5-HT的含量水平与人类健康有密切关系[2-4]。摄入适量的5-HTP可以帮助人体提高5-HT水平,起到抗抑郁、改善纤维肌瘤的衰弱症状、促进减肥、降低血压、预防头疼和缓解失眠等功效[5]。
5-HTP主要由植物种子加纳子中提取,其成本易受原料市场价格波动而变化,且提取过程中易对环境造成不利影响[6-8]。而化学合成法合成路线长,反应条件苛刻,能耗大,生产成本较高,对环境污染较大。生物合成法则有周期短,成本低,对环境影响较小等优势[9]。对5-HTP菌种改造的研究已经有各种报道,LIN等[10]在大肠杆菌中建立了苯丙氨酸羟化酶途径,通过筛选对L-色氨酸底物亲和性好的羟化酶XcP4H并进一步进行蛋白质结构改造,引入了外源四氢单蝶呤(tetrahydromonapterin, MH4)循环机制,使得大肠杆菌摇瓶发酵产5-HTP为1.1~1.2 g/L。王海蛟[11]对人L-色氨酸羟化酶2(L-tryptophan hydroxylase 2,TPH2)基因短截突变体进行了功能表达,同时重组了人四氢蝶呤(tetrahydrobiopterin, BH4)的生物合成和再生途径,解决了BH4的内源供应问题。
本研究菌株HTP10-1是菌株HTP10[12]进一步改造得到的,其合成5-HTP途径共3个模块,分别为L-色氨酸生物合成模块,羟基化模块,BH4模块,与原菌HTP10区别为,羟基化模块构建在含有T7启动子的过表达质粒pSTV28上,其具有拷贝数适中,表达强度大的优势,使得L-色氨酸生物合成模块的L-色氨酸向5-HTP转化效率较高,然而,发酵过程中由于菌株生长迅速,细胞在快速分裂过程中质粒稳定性不佳,虽然有氯霉素压力筛选,但由于氯霉素抑菌原理为可逆结合核糖体70 S,发酵过程中会有损耗,因此,质粒丢失率较高。本研究通过优化磷盐添加策略以及发酵pH,使菌株在发酵过程中达到最佳比生长速率,极大地减少了质粒丢失,增加了5-HTP产量的同时减少了副产物L-色氨酸的积累。
1 材料与方法
1.1 菌株和质粒
本研究所用菌株和质粒及其来源见表1。
表1 菌株和质粒
Table 1 Strains and plasmids

菌株及质粒相关特点来源E.coli DH5αHost for cloning代谢工程实验室保藏HTP10E.coli W3110, ΔtnaA, lacI::PxylF-T7RNAP, mlc::mlc∗, trpLE::Ptrc-trpEfbr, yjiV::Ptrc-aroGfbr-serAfbr, ΔtyrR, ΔtrpR, mbhA::PT7-TPH150, yghX::Ptrc-mtrA-PTPS-SPR-Ptrc- PCD-DHPR代谢工程实验室保藏,专利来源:CN202110714155.1HTP10-1HTP10, pSTV28-TPH150代谢工程实验室保藏pSTV28P15A ori, CmR, E.coli expression vector代谢工程实验室保藏pSTV28-TPH150pSTV28, PT7-TPH150本研究构建
1.2 引物
本研究所用引物如表2所示。
表2 本研究所用的引物
Table 2 Primers used in this study

引物序列(5′-3′)pstv28-line-t-SACGGAGCATTGAAAATGTTTGAGGCACTGGCCGTCGTTTTpstv28-line-t-ACATCTTCCAGCTCTTCCTCCATGTAAT-CATGGTCATAGCTGTTTCCTGKZ-TPH150-SCAGGAAACAGCTATGACCATGATTACATG-GAGGAAGAGCTGGAAGATGKZ-TPH150-AAAAACGACGGCCAGTGCCTCAAACATTTTCAATGCTCCGT
注:pstv28-line-t-S、pstv28-line-t-A为扩增pstv28质粒线性载体引物;KZ-TPH150-S、KZ-TPH150-A为扩增目的基因TPH150引物
1.3 培养基配方
活化斜面培养基(g/L):葡萄糖2,蛋白胨10,牛肉膏10,酵母粉5,KH2PO4·3H2O 1,MgSO4·7H2O 0.2,琼脂粉25。
种子培养基(g/L):葡萄糖30,酵母粉6,蛋白胨2,硫酸铵2,磷酸二氢钾3,硫酸镁2,维生素H 0.002。
发酵培养基(g/L):葡萄糖10,酵母粉8,硫酸铵6,磷酸二氢钾4,硫酸镁3,硫酸亚铁0.08,硫酸锰0.050,维生素H 0.001。(除对磷酸二氢钾添加方式进行探究外,其他成分均相同)。
1.4 仪器与设备
LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;Agilent1200高效液相色谱仪,Agilent Technologies;752分光光度计,上海分析仪器厂。
1.5 培养方法
1.5.1 菌种活化
使用接种环从保藏在-80 ℃的甘油管中蘸取若干环菌液,然后均匀接种于2支一代斜面上,37 ℃培养箱,持续培养12 h,之后再从培养好的一代斜面中取一环菌体接种于二代斜面上,37 ℃培养箱,持续培养12 h。
1.5.2 种子培养
将200 mL左右无菌水于超净台火焰附近倒入上述茄形瓶中,使用灼烧冷却后的接种环将二代斜面上生长的菌落刮至无菌水中并打散制备菌悬液,在发酵罐火圈旁将菌悬液接种入发酵种子培养罐中,进行菌种扩大培养。培养过程pH值维持在6.7~7.0左右,温度维持在35 ℃左右,溶氧维持在30%~50%,培养至OD600为15时转接发酵罐中进行发酵培养。
1.5.3 发酵培养
当种子OD600达到15左右时,按20%的接种量接入含有发酵培养基的5 L发酵罐中,定容至3 L。发酵过程中通过流加调节液(用于调节pH),将pH值控制在7.0附近,通过控制转速和通风量将溶氧稳定在30%~50%,发酵温度为35 ℃。
1.6 实验方法
1.6.1 重组质粒的构建
利用软件CE Design V1.03设计引物A、B、C和D,各引物带有相应的同源序列。之后用引物对A/B和C/D分别扩增了TPH150羟化酶基因和线性载体,TPH150基因是人源2型色氨酸羟基化酶短截突变体,线性载体扩增模板为pSTV28空质粒。最后使用ClonExpress II一步克隆试剂盒(Vazyme Biotech, Nanjing, China),通过同源重组将线性载体与目的基因片段连接。同源重组结束后将新的载体化转至E.coli DH5α中,复苏1 h后,将其涂布于含有30 μg/mL的氯霉素LB平板中,37 ℃培养16 h后挑选阳性转化子,接种于含有30 μg/mL的氯霉素LB摇管中,37 ℃摇床培养14 h,提取质粒并委托安升达生物科技有限公司测序验证。
1.6.2 菌株的构建
将1.6.1构建的质粒pSTV28-TPH150电转化于HTP10电转感受态中,复苏2 h后,将其涂布于含有30 μg/mL的氯霉素LB平板中,37 ℃培养16 h后挑选阳性转化子,接种于含有30 μg/mL的氯霉素LB摇管中,37 ℃摇床培养14 h,得到菌株HTP10-1并保菌。
1.6.3 磷酸盐添加控制发酵试验
设计4种添加策略,总的磷盐添加量均为4 g/L。
A添加策略为发酵培养基中直接添加磷酸二氢钾,添加量与材料方法中相同;
B添加策略为发酵培养基中添加1 g/L的磷酸二氢钾,在葡萄糖流加瓶中添加3 g/L的磷酸二氢钾,随糖液流加进入发酵罐中;
C添加策略为发酵培养基中添加2 g/L的磷酸二氢钾,在葡萄糖流加瓶中添加2 g/L的磷酸二氢钾,随糖液流加进入发酵罐中;
D添加策略为发酵培养基中添加3 g/L的磷酸二氢钾,在葡萄糖流加瓶中添加1 g/L的磷酸二氢钾,随糖液流加进入发酵罐中。
1.7 分析测定方法
1.7.1 pH的测定
采用发酵罐自带的梅特勒pH电极进行测定,pH 6.4~8.0精密pH试纸辅助测定。
1.7.2 残糖含量检测
每隔2 h进行取样,离心,取上清液,将上清稀释100倍,用SBA-40E生物传感分析仪检测残糖含量。
1.7.3 菌体量检测
每隔2 h取样,分别稀释10、20、50、100倍,用紫外可见分光光度计测量OD600。菌体生物量的计算如公式(1)所示:
菌体生物量=OD600×稀释倍数
(1)
式中:吸光值在0.2~0.8,超过量程后需换下一个稀释倍数。
1.7.4 5-HTP和L-色氨酸的检测
发酵液12 000×g离心1 min,上清液用去离子水稀释适当倍数,经0.22 μm有机滤膜过滤后,用Thermo U-3000高效液相色谱(检测L-色氨酸与5-HTP含量。色谱柱:安捷伦反向TC-C18(2),25 ℃;流动相为V(甲醇)∶V[10 mmol/L磷酸钾缓冲液(pH 6.5)]=12∶88;流速1 mL/min,上样量20 μL;检测波长276 nm。
1.7.5 动力学参数的计算
使用Origin 2021软件选取Logistic方程非线性拟合得到生长曲线,再进一步处理数据得到比生长速率[13],计算如公式(2)所示:
(2)
式中:μ表示比生长速率,h-1;x表示菌体量,g/L;t表示时间,h。
1.7.6 质粒丢失率的计算
稀释涂布法稀释倍数的选取:6、12 h发酵液稀释106倍;18、24、30 h发酵液稀释108倍。
质粒丢失率的计算如公式(3)所示:
(3)
式中:R表示质粒丢失率,%;NB表示相同时间,相同稀释倍数无抗生素平板菌落数;NA表示相同时间,相同稀释倍数抗生素(氯霉素)平板菌落数。
2 结果与分析
2.1 菌株HTP10-1发酵过程验证
由于出发菌株5-HTP产量较低,本研究采用过表达TPH150的质粒pSTV28来强化羟化酶的表达。在PT7启动子的条件下,基于pSTV28质粒,插入TPH150基因得到新的质粒pSTV28-TPH150并电转化至HTP10感受态中,验证阳性转化子后得到菌株HTP10-1。
在5 L发酵罐中考察菌株HTP10-1及出发菌株HTP10发酵过程中5-HTP与副产物L-色氨酸产量情况,如图1所示。
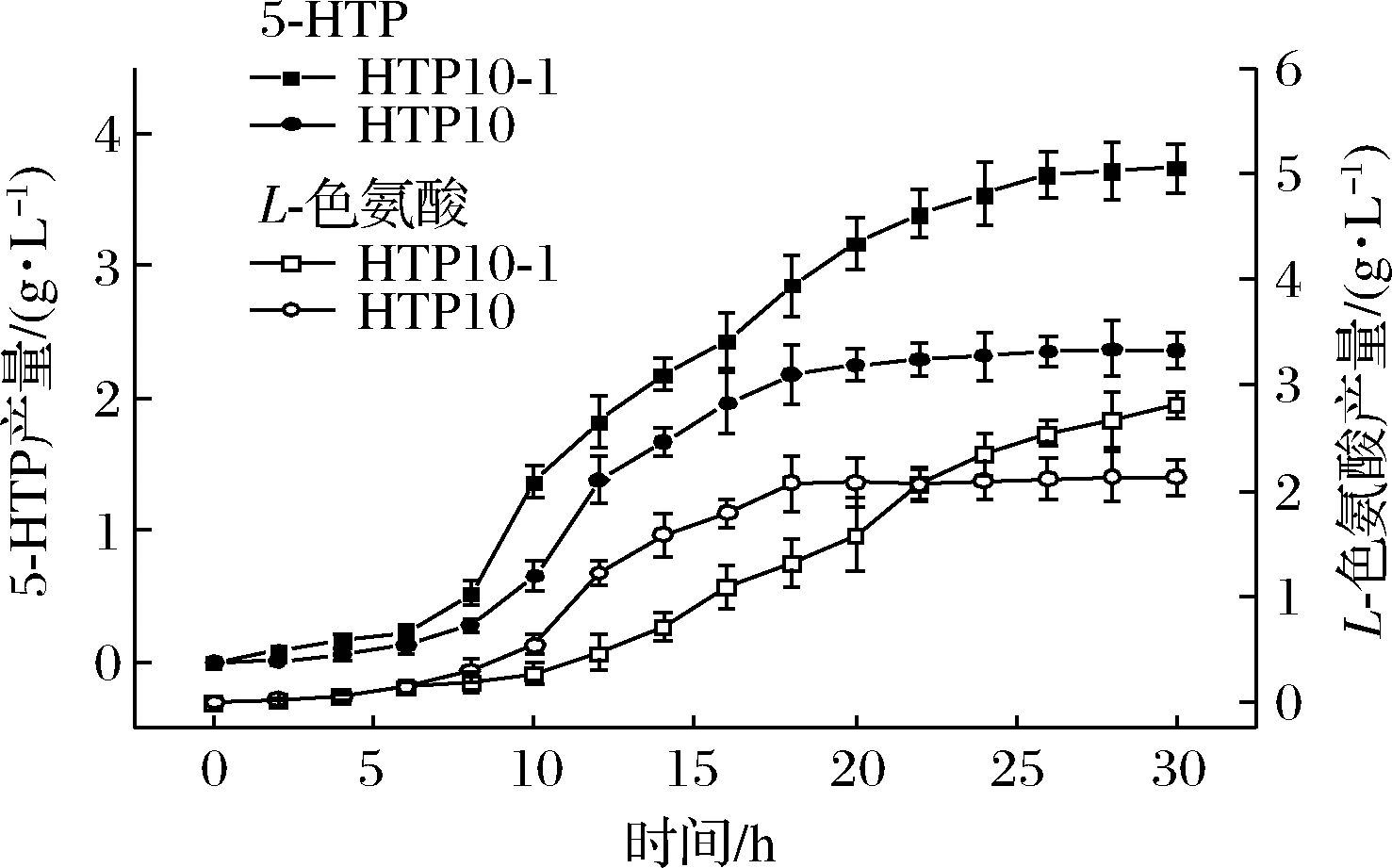
图1 菌株HTP10-1、HTP10发酵过程产酸对比
Fig.1 Comparison of acid production during fermentation of strains HTP10-1 and HTP10
由图1可知,菌株HTP10-1发酵5-HTP最终产量为3.74 g/L,比菌株HTP10产量(2.36 g/L)提高了58.4%;副产物L-色氨酸积累量为2.81 g/L,较HTP10L-色氨酸积累量(2.13 g/L)多27.2%。发酵结果显示,菌株HTP10-1极大地提高了5-HTP产量,说明了过表达质粒pSTV28-TPH150对羟化酶的表达量有大幅度提升,但L-色氨酸积累量仍然过多,后期L-色氨酸积累量提升,而5-HTP产量增长缓慢,推测原因是菌株质粒在发酵过程中丢失,导致L-色氨酸向5-HTP的羟化途径减弱。
2.2 pH对菌株HTP10-1发酵的影响
大肠杆菌的生长需要一定酸碱度,pH通过影响细胞膜电荷、酶活、营养物质的传质从而影响大肠杆菌的生长和代谢[14],为探究不同pH对菌株HTP10-1发酵的影响,通过生物反应器分别设定发酵pH值为7.0、6.7、6.4、6.1、以pH=7为对照组。
2.2.1 pH对大肠杆菌生长以及产物浓度的影响
在5 L发酵罐中考察不同pH对菌体比生长速率以及产量的影响,结果如图2所示。

a-OD值、5-HTP产量;b-生长速率
图2 pH值对菌体OD、产量、比生长速率的影响
Fig.2 Comparison of strain HTP10-1 and HTP10 shake flask fermentation
如图2-a可知,发酵pH对菌体生长影响显著,最终菌体量随着pH的升高而增加,pH为7.0时,最终OD600值为56.1,pH值为6.1时,最终OD600值为25.8,较对照组pH=7降低了约54.0%。pH值为6.7时,5-HTP产量最高,为4.11 g/L,较对照组3.8 g/L提高了约8.1%,而pH值为6.4时5-HTP产量为3.16 g/L,接近对照组产物浓度。虽然对照组最终菌体量高,但产物5-HTP浓度却低于实验组(pH=6.7),仅高于实验组(pH=6.4)3.4%。
对不同pH值比生长速率进行对比,结果如图2-b所示,pH为7时,最大比生长速率在5~6 h,μmax约为0.53 h-1,pH值为6.7时,最大比生长速率在6~8 h,μmax约为0.36 h-1,pH值为6.4和6.1时,μmax分别为0.2、0.08 h-1,表明随着pH的降低,最大比生长速率相应降低,菌体快速生长期推迟。实验组pH=6.1,产量远低于对照组,推测原因为发酵pH过低,影响菌体正常生长,影响细菌代谢途径,进而影响了L-色氨酸羟化系统的表达。
综合图2-a、图2-b,菌株HTP10-1在pH为中性时,比生长速率最高,但相应的会增大葡萄糖底物消耗速率,使得碳源更多地流向了菌体分裂生长[15],在对数生长期,菌体分裂生长过快,容易造成质粒丢失,最终导致L-色氨酸羟化系统中的羟化酶无法表达,L-色氨酸难以转化成5-HTP。
2.2.2 不同pH对大肠杆菌质粒稳定性的影响
针对菌HTP10-1发酵过程中可能存在的质粒丢失情况进行稀释涂布法验证,结果如图3所示。

图3 不同pH在各时间段质粒丢失率
Fig.3 Plasmid loss rate at different pH at each time period
由图3可知,pH值为7时,从第12 h开始,质粒丢失率均大于其他实验组,第30 h质粒丢失率高达33.4%,较pH值为6.7、6.4、6.1时,质粒丢失率分别增加了28.0%,36.3%,38.6%。因此,pH值为7.0时易对该菌株造成质粒丢失。
2.2.3 不同pH条件下对发酵副产物的影响
大肠杆菌发酵产5-HTP过程中主要副产物为L-色氨酸,由于L-色氨酸羟化系统表达不够充分、质粒胞内复制不稳定等问题,导致L-色氨酸会有一定积累。在探究不同pH对发酵产5-HTP过程中,发现部分实验组存在谷氨酸积累问题,结果如图4所示。
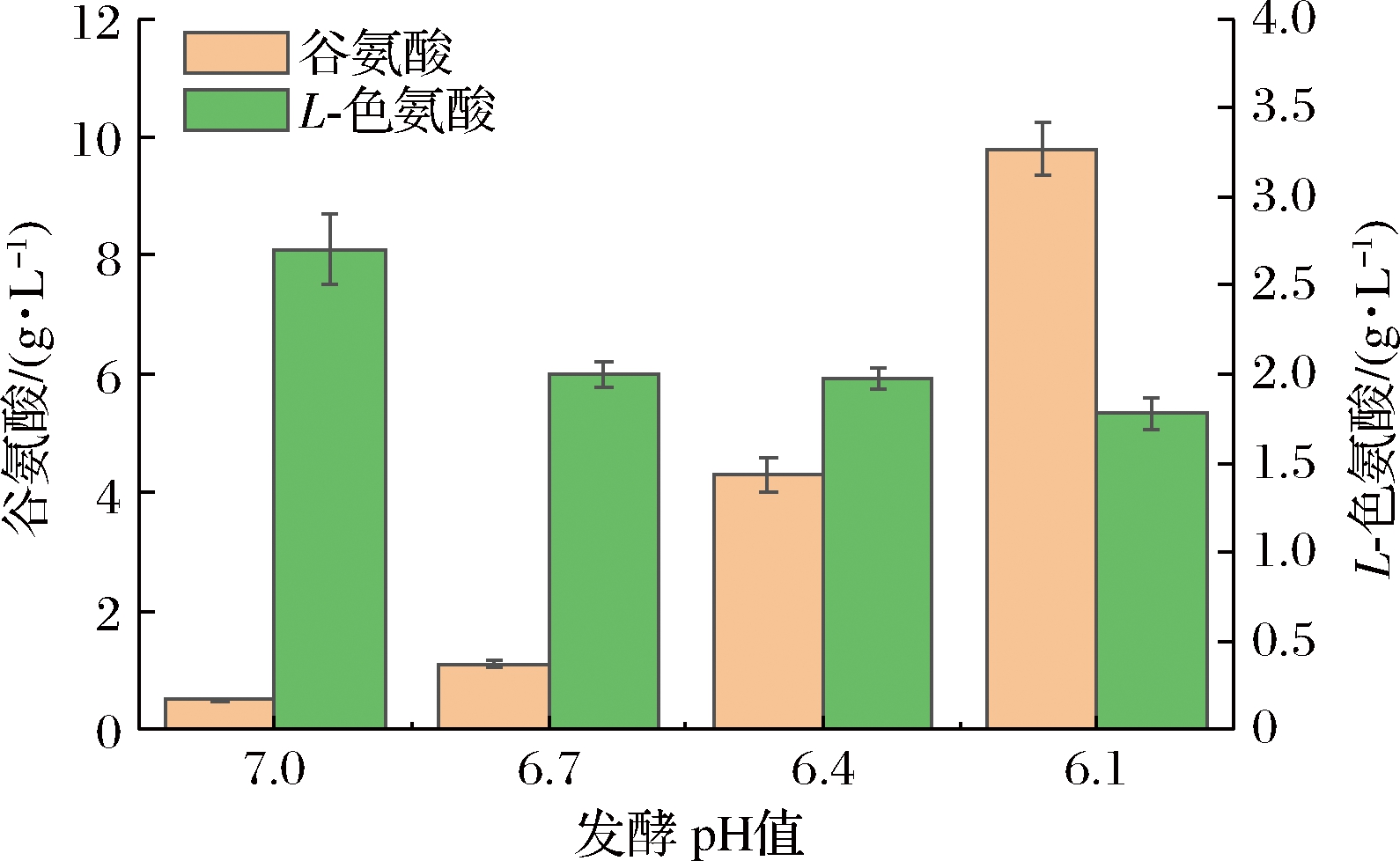
图4 不同发酵pH对发酵副产物谷氨酸、L-色氨酸的影响
Fig.4 Effect of different fermentation pH on fermentation by-products glutamic acid and tryptophan
如图4可知,在pH值为7时,L-色氨酸积累最高,达到2.7 g/L,谷氨酸积累较少;pH值为6.1时,谷氨酸积累最高,达到9.1 g/L;在pH值为6.7时,对比pH值为6.4实验组,L-色氨酸积累量持平,约为1.9 g/L,谷氨酸约为1.2 g/L,较pH值为6.4实验组低68.4%。分析可知,随着pH的逐渐升高,谷氨酸积累量逐渐增多,而实验组L-色氨酸积累量均较对照组降低。
谷氨酸是参与机体氮代谢的基本氨基酸之一[16-17],在生命代谢活动中发挥着重要作用[18],大肠杆菌在生长过程中受到pH等条件抑制时,葡萄糖碳源更多的流向三羧酸循环,用于合成ATP以及还原态氢用于呼吸作用,三羧酸循环中间产物α-酮戊二酸是谷氨酸合成前体,三羧酸循环增强导致谷氨酸积累增加。
综合以上分析,为避免谷氨酸过度积累,过低pH不适宜5-HTP的发酵生产,pH值为6.7时,5-HTP产量最高,达到4.11 g/L,副产物L-色氨酸,谷氨酸浓度最低,分别为1.9、1.2 g/L。因此在发酵pH值为6.7为最优值。
2.3 不同磷酸盐流加策略对5-HTP发酵的影响
2.3.1 磷酸盐添加方式对大肠杆菌比生长速率的调控及对5-HTP产量、合成速率的影响
根据2.2.2结果可知,在发酵pH值为6.7时,发酵中期仍有25%左右质粒丢失率,考虑到磷酸二氢钾是大肠杆菌生长代谢中的关键因子[19-20],为细胞膜磷脂的合成提供原料,且影响细胞HMP和EMP途径,是控制大肠杆菌生长速率的关键因素[21],故可以通过优化磷酸二氢钾添加工艺来调控比生长速率。
按照1.1.5中磷酸二氢钾添加策略A、B、C、D,以策略A为对照组,进行发酵对比实验,结果如图5所示。

a-OD及5-HTP产量;b-比生长速率;c-5-HTP合成速率
图5 不同磷酸盐流加方式对菌体OD值及5-HTP产量、比生长速率、5-HTP合成速率的影响
Fig.5 Effect of different phosphate flow addition methods on bacterial OD and 5-HTP production, specific growth rate, and 5-HTP synthesis rate
由图5-a可知,4种磷酸盐添加策略中菌体最终生物量差距较小,策略D中生物量最高,OD600约为55.4,策略B中生物量最低,OD600约为51.3。而策略A生长曲线在菌体对数生长期菌体量均高于B、C、D。且通过对比不难发现,随着发酵培养基底物中磷酸二氢钾浓度的降低,菌体对数生长期逐渐延后。由图5-a可知,策略B最终产量最高,达到5.46 g/L,策略A、C、D最终产量分别为4.10、4.66、4.32 g/L。根据图5-b对发酵过程中大肠杆菌比生长速率进行分析,在B策略下比生长速率曲线较其他实验组延后,且最大比生长速率μmax=0.21 h-1,低于其他添加策略,A、C、D的最大比生长速率分别为0.36、0.32、0.3 h-1。根据图5-c,对5-HTP合成速率进行分析,策略B的5-HTP合成速率趋势线最优,在12~14 h达到最大合成速率,相比于其他策略,最大合成速率最高,并且,磷酸盐在发酵培养基的添加量越低,5-HTP最大合成速率越高。
2.3.2 不同磷酸盐添加方式对发酵过程中质粒稳定性的影响
由2.2.2可知,pH值为6.7时在发酵中后期质粒丢失情况依然存在,故对对照组A及实验组B、C、D发酵过程中质粒丢失情况进行稀释涂布法验证,结果如图6所示。
由图6可知,B、C、D较对照组A在发酵前期差距不大,仅B实验组在12 h时,质粒丢失率为4.8%,比对照组低38.4%,而发酵中后期B、C、D质粒丢失情况较对照组均有一定改善,在18、24、30 h时,质粒丢失率对比如表3所示。

图6 磷酸盐流加方式对质粒稳定性的影响
Fig.6 Effect of phosphate flow addition method on plasmid stability
表3 各磷盐流加策略在18、24、30 h质粒丢失率对比
Table 3 Comparison of plasmid loss rates at 18, 24, and 30 h for each phosphate salt flow addition strategy
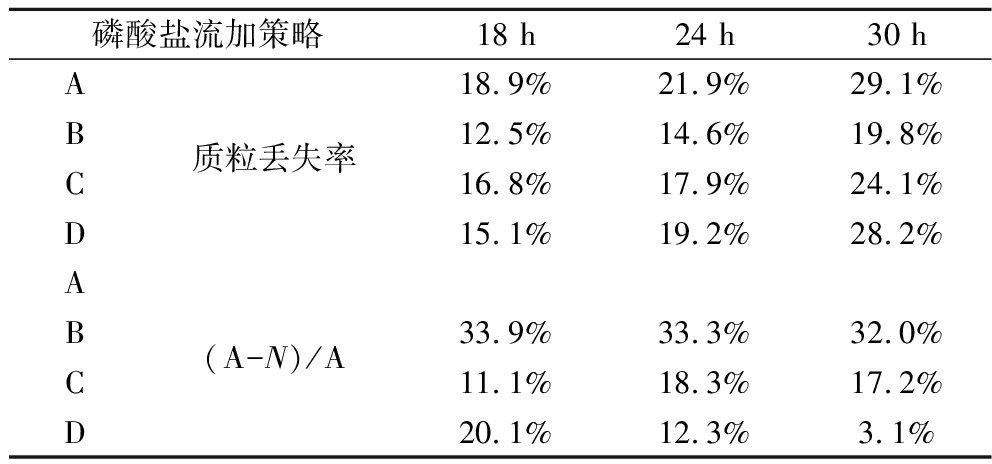
磷酸盐流加策略18 h24 h30 hA18.9%21.9%29.1%B质粒丢失率12.5%14.6%19.8%C16.8%17.9%24.1%D15.1%19.2%28.2%AB(A-N)/A33.9%33.3%32.0%C11.1%18.3%17.2%D20.1%12.3%3.1%
注:公式(A-N)/A中A为A流加策略质粒丢失率,N分别为B、C、D质粒丢失率
由表3可知,B流加策略质粒丢失率在各时间段明显下降,在18、24、30 h较对照组分别降低33.9%,33.3%,32.0%,而C、D流加策略质粒丢失率在各时间点均有一定下降,D流加策略在30 h处质粒丢失率仅下降3.1%。通过对比分析可知,磷酸二氢钾在发酵培养基中添加比例越高,质粒丢失率越高,结合图5-b,比生长速率随着磷酸二氢钾在发酵培养基中的添加比例的升高而增大,因此,磷酸盐可通过D流加策略实现对菌体生长的最佳控制,从而减少发酵过程中质粒的丢失,达到增加产量的目的。
2.3.3 不同磷酸盐添加方式对发酵过程中副产物L-色氨酸积累的影响
由2.2.3分析结果可知,在pH值为6.7条件下,菌体活力良好,谷氨酸积累量较少,故只对A、B、C、D 4种磷酸二氢钾添加策略进行副产物L-色氨酸的检测,结果如图7所示。
由图7可知,随着底物添加的磷酸二氢钾浓度下降,发酵结束时副产物L-色氨酸浓度也随之降低,B、C、D实验组最终L-色氨酸积累量分别为1.37、1.86、1.97 g/L,较对照组分别降低了31.8%、14.4%、7.4%。因此,B磷酸盐流加策略对减少副产物L-色氨酸的积累有较大作用。在6~10 h,L-色氨酸积累量提升较快,这一时期也处于菌体快速生长期,由于菌体量总量相对较小,载有羟化酶表达质粒的表达量不足,且大肠杆菌为生长协同性产酸,导致L-色氨酸积累较快,在中后期,菌体量较大,质粒中羟化酶部分表达量充足,L-色氨酸流向L-色氨酸羟化系统,故在这一阶段L-色氨酸积累相比快速生长期较慢。
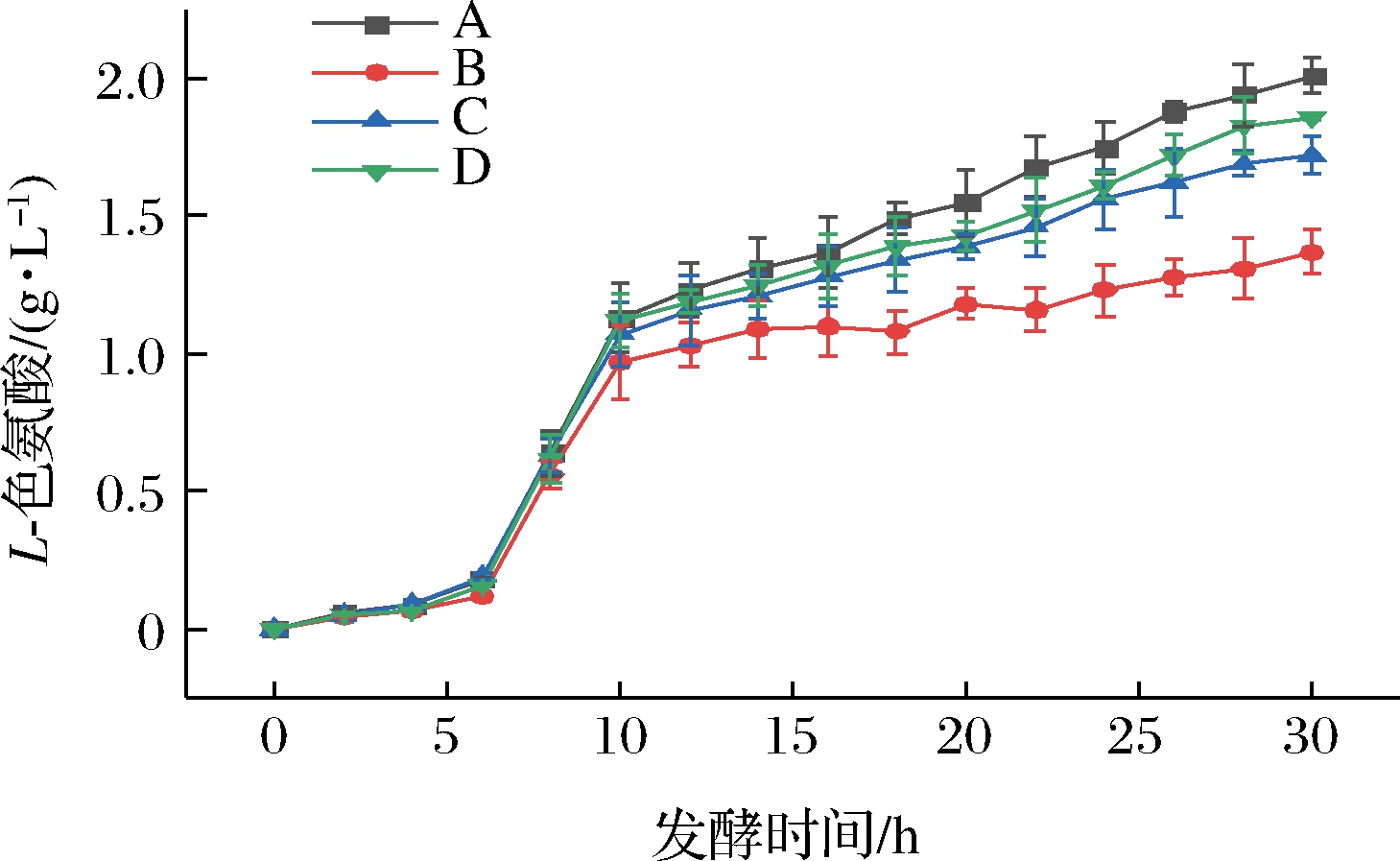
图7 不同磷酸盐添加策略对发酵过程中L-色氨酸的影响
Fig.7 Effect of different phosphate addition strategies on tryptophan during fermentation
在第12 h开始,B流加策略实验组L-色氨酸积累浓度趋势线显著低于对照组A,这一趋势与2.3.1实验结果相印证,B实验组在12~14 h时5-HTP合成速率达到最大,使L-色氨酸向羟化系统代谢流增加,而积累速率减缓。在12 h至发酵结束时,对照组A以及实验组C、D的L-色氨酸积累量上升趋势明显,分析并推断原因是在发酵中后期,质粒丢失率升高,虽然菌体量较大但总的L-色氨酸羟化酶表达量不足,导致L-色氨酸向羟化系统的代谢流减少,L-色氨酸积累量上升。
3 结论
在大肠杆菌发酵法产5-HTP的研究中,其产量与副产物L-色氨酸的积累量是发酵控制的基本指标,本研究中的菌株HTP10-1因其携带质粒的特性,故质粒的稳定性是发酵过程的关键控制点。本实验通过控制pH和优化磷盐添加策略来调控菌体比生长速率,避免了因菌体生长过快,质粒在细菌分裂过程中大量丢失的情况。实验通过梯度对比实验确定了最适pH值为6.7,比生长速率为0.35 h-1,在此条件下,探究了最佳磷酸二氢钾添加策略,即在发酵培养基中添加1 g/L的磷酸二氢钾,在糖瓶中添加3 g/L的磷酸二氢钾,随糖液流加进入发酵罐中。该策略在保证了细菌在生长过程中的磷元素需求的同时,又避免了因发酵培养基中过量的磷酸盐导致大肠杆菌在生长前期分裂过快,质粒在这一过程中大量丢失的情况。在pH值为6.7与该最佳磷酸二氢钾流加策略协同调控下,菌体比生长速率为0.21 h-1,最终5-HTP产量为5.46 g/L,副产物L-色氨酸产量为1.37 g/L,5-HTP产量较对照组提高了33.1%,L-色氨酸较对照组降低了31.8%,在发酵中后期,18、24、30 h的质粒丢失率分别比对照组降低了33.9%、33.3%、32.0%。大肠杆菌在发酵过程中的生长情况易受不同环境,营养条件控制,因此,通过调控pH,菌体生长所必须的磷元素等条件来使菌体达到适宜生长速率,进而达到较合理的原料利用率,促进工程菌产酸能力,尤其对携带质粒的工程菌发酵过程控制有重要的参考意义。
[1] 李俊德, 刘少华, 唐蜜.5-羟基色氨酸研究进展[J].精细与专用化学品, 2014, 22(11):36-39.
LI J D, LIU S H, TANG M.Recent progress on study of 5-hydroxytryptophan[J].Fine and Specialty Chemicals, 2014, 22(11):36-39.
[2] HINZ M, STEIN A, UNCINI T.5-HTP efficacy and contraindications[J].Neuropsychiatric Disease and Treatment, 2012, 8:323-328.
[3] MAFFEI M E.5-Hydroxytryptophan (5-HTP):Natural occurrence, analysis, biosynthesis, biotechnology, physiology and toxicology[J].International Journal of Molecular Sciences, 2020, 22(1):181.
[4] AALDIJK E, VERMEIREN Y.The role of serotonin within the microbiota-gut-brain axis in the development of Alzheimer′s disease:A narrative review[J].Ageing Research Reviews, 2022, 75, 101556.
[5] 包楠迪, 韩悦, 白皓, 等.五羟基色氨酸对抑郁症的影响及其机制[J].中国新药杂志, 2012, 21(18):2 141-2 144.
BAO N D, HAN Y, BAI H, et al.Effect of 5-hydroxytryptophan on depression in mice[J].Chinese Journal of New Drugs, 2012, 21(18):2 141-2 144.
[6] 谌迪, 林德钦, 郑志忠, 等.非洲加纳籽生物学特性及其化学成分(综述)[J].亚热带植物科学, 2013, 42(1):86-90.
CHEN D, LIN D Q, ZHENG Z Z, et al.Biological characteristics of Griffonia simplicifolia and its chemical composition[J].Subtropical Plant Science, 2013, 42(1):86-90.
[7] 刘岱琳, 董晋泉, 孙华庚, 等.加纳籽中5-羟基色氨酸的树脂纯化研究[J].中草药, 2010, 41(1):60-63.
LIU D L, DONG J Q, SUN H G, et al.Study on the resin purification of 5-hydroxytryptophan from Ghana seeds[J].Chinese Traditional and Herbal Drugs, 2010, 41(1):60-63.
[8] 张勤, 胡雪松, 秦岭, 等.超滤膜分离纯化加纳籽中5-羟基色氨酸的研究[J].天然产物研究与开发, 2014, 26(12):2 033-2 036.
ZHANG Q, HU X S, QIN L, et al.Isolation and purification of 5-hydroxytryptophan from Griffonia simplicifolia by ultrafiltration technique[J].Natural Product Research and Development, 2014, 26(12):2 033-2 036.
[9] 薛晓舟. 生物法制取5-羟基色氨酸[D].北京:北京化工大学, 2013.
XUE X Z.Biological production of 5-hydroxytryptophan[D].Beijing:Beijing University of Chemical Technology, 2013.
[10] LIN Y H, SUN X X, YUAN Q Q, et al.Engineering bacterial phenylalanine 4-hydroxylase for microbial synthesis of human neurotransmitter precursor 5-hydroxytryptophan[J].ACS Synthetic Biology, 2014, 3(7):497-505.
[11] 王海蛟. 代谢工程改造大肠杆菌合成5-羟基色氨酸的研究[D].杭州:浙江大学, 2019.
WANG H J.Metabolic engineering of Escherichia coli for the production of 5-hydroxytryptophan[D].Hangzhou:Zhejiang University, 2019.
[12] 徐庆阳, 金敏, 张震, 等.用于产生5-羟基色氨酸的基因工程菌及其构建方法与应用:CN113549588B[P].2021-10-26.
XU Q Y, J M, ZHANG Z, et al.Genetically engineered bacteria for 5-hydroxytryptophan production and its construction method and application:CN113549588B[P]. 2021-10-26.
[13] 王泽建, 张琴, 王萍, 等.恒化培养条件下粪产碱杆菌凝胶多糖的发酵动力学研究[J].食品工业科技, 2019, 40(11):139-146.
WANG Z J, ZHANG Q, WANG P, et al.Study on curdlan fermentation kinetics of Alcaligenes faecalis under chemostat cultivation[J].Science and Technology of Food Industry, 2019, 40(11):139-146.
[14] 姚汝华, 周世水.微生物工程工艺原理[M].广州:华南理工大学出版社, 2013.
YAO R H, ZHOU S S.Principles of Microbial Engineering Processes[M].Guangzhou:South China University of Technology Press, 2013.
[15] 王开方, 潘龙, 刁文娇, 等.pH值和比生长速率协同调控Streptomyces albulus合成ε-聚赖氨酸[J].食品与发酵工业, 2019, 45(23):8-14.
WANG K F, PAN L, DIAO W J, et al.Effects of pH and specific growth rates on ε-poly-L-lysine biosynthesis in Streptomyces albulus[J].Food and Fermentation Industries, 2019, 45(23):8-14.
[16] FAHIMITABAR A, RAZAVIAN S M H, REZAEI S A.Application of RSM for optimization of glutamic acid production by Corynebacterium glutamicum in bath culture[J].Heliyon, 2021, 7(6):e07359.
[17] 户红通, 徐达, 徐庆阳, 等.谷氨酸清洁发酵工艺研究[J].中国酿造, 2018, 37(10):51-56.
HU H T, XU D, XU Q Y, et al.Study on clean fermentation process of glutamic acid[J] China Brewing, 2018, 37(10):51-56.
[18] LIN Y D, YANG Z, LI J J, et al.Effects of glutamate and aspartate on prostate cancer and breast cancer:A Mendelian randomization study[J].BMC Genomics, 2022, 23(1):213.
[19] 张震, 熊海波, 徐庆阳.大肠杆菌高密度培养发酵L-色氨酸[J].食品与发酵工业, 2019, 45(23):15-20.
ZHANG Z, XIONG H B, XU Q Y.L-tryptophan fermentation by high cell density culture of Escherichia coli[J].Food and Fermentation Industries, 2019, 45(23):15-20.
[20] ANANDAN P, PARTHIPAN G, PAZHANIVEL K, et al.Growth and characterization of potassium halides mixed L-arginine phosphate monohydrate semi organic nonlinear optical single crystals[J].Optik-International Journal for Light and Electron Optics, 2014, 125(1):8-10.
[21] LAI S J, ZHANG Y, LIU S W, et al.Metabolic engineering and flux analysis of Corynebacterium glutamicum for L-serine production[J].Science China Life Sciences, 2012, 55(4):283-290.