腐乳是一种历史悠久的中国传统发酵豆制品,其风味独特、质地细腻、营养丰富,常作为佐餐食品呈现于人们餐桌[1]。腐乳发酵一般经豆腐制作、前发酵、码盐和加辅料后发酵制作而成,整个过程经多菌群协同长期发酵,游离氨基酸、脂肪酸、有机酸等营养物质含量高且易吸收,功能性成分如大豆异黄酮、小分子肽、维生素B族等均显著高于豆腐。然而长期发酵也会导致生物胺类对人体有害物质的积累[2-3]。
生物胺主要是由游离氨基酸经脱羧酶的酶促作用和醛酮还原胺化形成的一类含氮低分子有机物,主要有组胺、苯乙胺、尸胺、色胺、腐胺、精胺、酪胺、精胺等[4],少量存在时具有一定的生物活性。而人体过量摄入生物胺会出现头痛、呕吐、过敏、心悸、血压异常等中毒症状,严重者可致死亡[5]。由于生物胺的形成需具备游离氨基酸、具有产氨基酸脱羧酶能力的微生物和满足该类微生物生长的环境条件3个条件,其普遍存在于发酵豆制品、酒类、泡菜等各类发酵食品中。研究者认为发酵食品中组胺、酪胺和苯乙胺的允许质量浓度应不超过100、100、30 mg/kg[6-7])。李大伟等[8]在多种市售腐乳中检测出了组胺、尸胺、酪胺、亚精胺、苯乙胺等。QIU等[9]发现其检测的腐乳中的组胺、酪胺、苯乙胺超推荐限值5倍以上。GUAN等[10]报道的腐乳中总生物胺含量高达570 mg/kg,且部分样品组胺含量超安全推荐值。目前关于腐乳生物胺相关研究多侧重于不同腐乳成品中生物胺含量变化、生物胺与微生物菌群相关性分析[11-14],而对腐乳工业发酵中各阶段生物胺与影响其形成的3个前提条件之间关系的研究较少。
腐乳的发酵过程是动态变化的,前发酵和盐坯阶段处于开放性环境,后发酵处于相对密闭条件,不同地区的环境条件、自然菌群差异较大,从而造成各地区腐乳产品品质差异较大。八公山为中国豆腐发源地,八公山特有的富含多种矿物微量元素的自然山泉水为豆腐加工用水,经长期驯化具优良发酵特性的毛霉为前发酵菌种,后发酵在八公山自然环境特性条件下形成的腐乳制品(白方、红方和青方腐乳)具明显地方特色。本研究对八公山白方腐乳在发酵过程中的生物胺、游离氨基酸、主要理化因素和菌群变化进行动态检测,并分别进行生物胺与其他各指标间的相关性,综合分析影响生物胺变化的原因,为优化腐乳生物胺控制方案提供一定借鉴。
1 材料与方法
1.1 材料与试剂
腐乳取自安徽寿县八公山豆制品厂,黄豆制成鲜豆腐小块,于28 ℃环境中均匀喷洒毛霉孢子悬液,待其布满白毛,制成毛坯,搓毛后码盐腌制[分层撒盐,最上层薄层覆盖,盐坯含盐量控制在11%(质量分数)左右]约48 h制成盐坯,将盐坯整齐码放于玻璃瓶内,灌装汤料[包括由辣椒粉、花椒、陈皮、桂皮、甘草、芝麻混合磨制而成粉料和6%~8%(质量分数)白糖、8%~10%(体积分数)酒精等],密封,置于后发酵库房,后发酵约3个月成品(2021年9~12月)。随机选择3个批次,每批次产品在发酵过程中分时间段取样,分别取鲜坯(新接种豆腐)、毛坯、盐坯、后发酵前期(32 d)、后发酵中期(64 d)和后发酵末期(89 d),分别标记为FP、MP、SP、RB、RC和RD。样品装于无菌取样袋,置于-70 ℃冰箱保存。
亚精胺、尸胺、精胺、组胺、腐胺、色胺、苯乙胺、酪胺,纯度均大于99.5%,上海源叶生物有限公司;高氯酸、甲醇,均为色谱纯,默克公司;氨基酸混标,和光纯药工业株式会社;盐酸、柠檬酸钠、氢氧化钠、甲醛,均为分析纯,国药集团。
1.2 仪器与设备
U3000高效液相色谱仪、BR4I离心机,美国赛默飞;FA-1004电子天平,上海舜宇恒平;LA8080氨基酸自动分析仪,日本株式会社日立高新技术科学;PHS-3C pH计,上海越平;DYCP-32C电泳仪,北京市六一仪器厂;Qubit 2.0荧光定量仪,美国Life Qubit;2100生物分析仪,美国安捷伦;T100PCR,美国伯乐;Novaseq 6000测序仪,美国Illumina。
1.3 实验方法
1.3.1 生物胺测定
取均匀样品于离心管中,加入5 mL 5%(体积分数)高氯酸溶液超声提取30 min,6 000 r/min离心5 min,取上清液,重提1次,合并2次上清液定容至10 mL;用1 mL正己烷净化2次,取提取液3 mL,加入0.2 mL 2 mol/L的NaOH和100 μL苯甲酰氯溶液,涡旋20 s后40 ℃下保温30 min,然后向混合液里加入甲醇定容至6 mL并终止反应,过0.22 μm滤膜后进行HPLC测定。测定条件:syncronis C18色谱柱(250 mm×4.6 mm×5 μm),柱温35 ℃;进样量20 μL,流速1.0 mL/min, 流动相A:90%乙腈/10%0.01 mol/L乙酸铵溶液(含0.1%乙酸);流动相B:10%乙腈/90%0.01 mol/L乙酸铵溶液(含0.1%乙酸),洗脱程序:0~23 min:流动相A 70%+流动相B 30%,24~37 min:流动相A 10%+流动相B 90%,38~42 min:流动相A 70%+流动相B 30%,紫外检测器,检测波长254 nm。
1.3.2 理化指标检测
总酸、氨基酸态氮的测定:依据GB 5009.235—2016;水分测定:依据GB 5009.3—2016;食盐测定:依据GB 5009.42—2016;pH值测定:pH计法。
1.3.3 微生物菌群检测
细菌总数测定:参照GB 4789.2—2016并稍作修改,平板计数培养基中添加0.003%(质量分数)纳他霉素。霉菌/酵母菌总数测定:参照GB 4789.15—2016。
微生物群落结构分析采用宏基因组学技术。首先采用CTAB法提取环境微生物DNA的方法提取腐乳中全部微生物的DNA,利用1%琼脂糖凝胶电泳、Nanodrop和 Qubit 2.0分别对提取的微生物基因组DNA进行完整性、纯度和浓度检测。在构建文库和库检合格后,按照有效浓度及目标下机数据量的需求将不同文库pooling至flowcell,cBOT成簇后使用Illumina PE150(2×150)高通量测序平台进行测序。
参考文献[15-16]对测序获得的原始数据进行质控和去宿主序列预处理,包括去除接头序列 (参数ILLUMINACLIP:adapters_path:2:30:10);扫描序列(4 bp滑窗大小),如果平均质量分低于20(99%正确率),切除后续序列(参数SLIDINGWINDOW:4:20);去除最终长度<50 bp的序列(参数MINLEN:50),获取用于后续分析的有效序列。
采用Kraken2对所有样品的全部有效序列进行注释分类,用Bracken对Kraken2得到的分类结果进行分类后贝叶斯重新估算丰度来估算宏基因组样本的物种水平或属级丰度。
1.3.4 游离氨基酸检测
称取均匀的样品于水解管中,加入10~15 mL 6 mol/L盐酸溶液,将水解管放入冷冻剂中,冷冻3~5 min,充氮保护,拧紧瓶盖,将水解管放在(110±1) ℃的电热鼓风恒温箱中水解22 h后,取出,冷却至室温。打开水解管,将水解液过滤至50 mL容量瓶中,用少量水多次冲洗水解管,水洗液移入同一50 mL容量瓶内,最后用水定容至刻度,摇匀。准确吸取1.0 mL滤液移入至15 mL试管内,40 ℃减压至干,用1.0 mL pH 2.2的柠檬酸钠缓冲溶液复溶,振荡混匀后,过0.22 μm滤膜后,上氨基酸自动分析仪测定。
1.4 数据处理
利用Excel 2016进行数据统计,SPSS 17.0进行显著性(P<0.05 为差异显著)和Pearson相关性分析,Origin 8.6进行绘图,每个实验重复3次,实验数据以平均值±标准差的形式表示。
2 结果与分析
2.1 生物胺含量变化
由表1可知,不同发酵阶段腐乳中共检测到尸胺、腐胺、亚精胺、组胺和酪胺5种生物胺,总胺含量为54.05~641.03 mg/kg,其中组胺含最为(51.43±3.67)~(619.39±36.01)mg/kg,其次为腐胺(1.63±0.23)~(30.28±3.28) mg/kg、亚精胺(0.98±0.11)~(4.48±0.64) mg/kg,尸胺和酪胺只在后发酵的中期和末期可检测到。虽然腐胺和尸胺含量较低,但二者会通过抑制组胺氧化酶的活性增加组胺的毒性[7]。本研究腐乳中生物胺检测结果与QIU等[9]研究结果相似,均以组胺为主要生物胺。与YANG等[17]、TORO-FUNES等[18]所报道的结果差异较大。不同腐乳样品中生物胺种类和含量差异与原材料、前发酵菌种、腐乳种类和发酵环境差异密切相关,如YANG等[19]分别利用雅致放射毛霉、总状毛霉和五通桥毛霉发酵腐乳,发现前发酵菌种不同其各种生物胺有明显变化,其中总状毛霉发酵腐乳中生物胺含量最低,五通桥毛霉腐乳最高,雅致放射毛霉在发酵前期生物胺含量高于前二者,但随着发酵的进行生物胺积累较慢,后发酵结束时总生物胺含量接近于总状毛霉腐乳,八公山腐乳采用雅致放射毛霉前发酵,生物胺在后发酵前期与中期显著增加,末期出现明显降低,与菌株驯化特性及发酵环境变化有关。
随着腐乳发酵过程的进行,总生物胺和组胺含量到后发酵中期均显著升高,最高为发酵起始时的11倍;腐胺在后发酵前期积累到最高值(30.28±3.28)mg/kg,而在1个月后的中期显著降低,到末期时又出现了显著增加;亚精胺在盐坯阶段含量最高,尸胺和酪胺均在后发酵中期被检测到,至末期又显著降低。生物胺在前发酵阶段呈增加趋势,可能与该阶段蛋白酶、水解酶活性较高,游离氨基酸含量增加有关;后发酵阶段出现增加及降低的现象,其一可能与腐乳中单胺氧化酶活性变化有关,生物胺可被该酶氧化成氨、乙醛等而降低[20];其二与生物胺之间的相关转化有关,如腐胺、精胺和亚精胺三者之间可相互转换[7]。
表1 各发酵阶段腐乳中生物胺含量变化 单位:mg/kg
Table 1 Changes of biogenic amines in sufu at different fermentation stages

样品编号尸胺腐胺亚精胺组胺酪胺总生物胺FP- 1.63±0.23a0.98±0.11a 51.43±3.67a -54.05 MP-2.95±0.71b 2.87±0.86b 145.57±9.85b-151.38 SP-3.14±0.58b4.48±0.64c 202.78±15.61c-210.39 RB-30.28±3.28c 1.92±0.19b339.34±24.75d-371.54 RC6.07±0.65a 4.26±0.72b 4.18±0.82c 619.39±36.01e 7.12±0.88a 641.03 RD0.77±0.05b19.80±1.45d 2.59±0.34b456.16±21.9d1.35±0.15b 480.68
注:“-”表示未检出;同指标肩标字母不同表示差异显著(P<0.05)(下同)
2.2 影响因素与生物胺变化的相关性分析
2.2.1 主要理化指标
图1为腐乳不同发酵阶段主要理化指标氨基酸态氮、总酸、食盐、pH和含水量的变化情况。氨基态氮含量代表腐乳的后发酵程度,常作为发酵结束的重要指标。腐乳在整个工业发酵过程中,氨基态氮和总酸变化趋势相同,从发酵起始至后发酵中期显著增加(P<0.05),后发酵中期到末期出现轻微降低(P>0.05),最高分别为0.84、0.86 g/100 g,食盐在盐坯阶段最高,后发酵前期出现显著降低,中期后变化不显著;pH值从发酵起始至盐坯阶段呈显著下降趋势,后发酵阶段在中期出现明显降低,末期时又有回升,与总酸度变化规律相反,这与HUANG等[21]研究中腐乳发酵过程中总酸和pH变化规律相似,说明发酵过程无异常;含水量除在盐坯阶段出现显著降低外,其余各阶段水分含量均无明显变化,这由于前发酵至盐坯阶段,腐乳块为间隔摆放,会出现一定程度脱水,后发酵阶段注入汤汁因此含水量又回升接近初始阶段,保持在69%左右。
腐乳在发酵过程中其主要理化指标与生物胺之间的Pearson相关性结果见表2(水分含量与各指标之间均无显著相关性,未列出)。本研究中组胺占90%以上,总生物胺的变化趋势与组胺呈极显著正相关(P<0.01)。组胺与酪胺呈显著正相关,前人在发酵鱼露、豆酱、干酪等[22-24]研究中也发现相同规律,说明组胺与酪胺的形成可能受同类内源性脱羧酶的调控,具有一定的同步性。总生物胺与pH呈显著负相关(P<0.05),与总酸呈极显著正相关(P<0.01),这与已有研究表明的酸性条件利于具氨基酸脱羧酶活性的微生物进行脱羧形成生物胺相符[12]。总生物胺与氨基态氮呈极显著正相关,与豆瓣酱中生物胺与氨基态氮变化规律相同[25]。尸胺和腐胺会抑制组胺和酪胺的氧化酶活性,本研究中尸胺与酪胺和组胺均呈显著正相关,与其相符,而腐胺与酪胺和组胺无明显相关性,可能由发酵菌群和环境的复杂性所致。

A-总酸、氨基态氮和食盐;B-pH值和水分含量
图1 腐乳发酵过程中主要理化指标变化
Fig.1 Changes of main physical and chemical indexes during sufu fermenation
注:不同小写字母表示差异显著(P<0.05)
表2 腐乳发酵过程中主要理化指标与生物胺之间的 相关性
Table 2 Correlation between main physicochemical indexes and biogenic amines during sufu fermenation
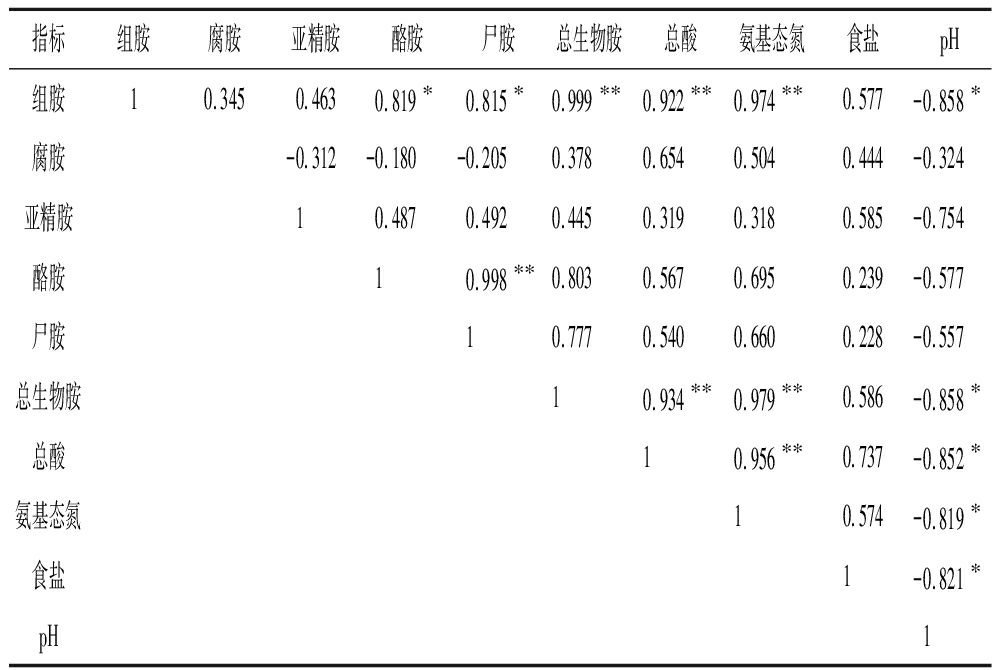
指标组胺腐胺亚精胺酪胺尸胺总生物胺总酸氨基态氮食盐pH组胺10.3450.4630.819∗0.815∗0.999∗∗0.922∗∗0.974∗∗0.577-0.858∗腐胺-0.312-0.180-0.2050.3780.6540.5040.444-0.324亚精胺10.4870.4920.4450.3190.3180.585-0.754酪胺10.998∗∗0.8030.5670.6950.239-0.577尸胺10.7770.5400.6600.228-0.557总生物胺10.934∗∗0.979∗∗0.586-0.858∗总酸10.956∗∗0.737-0.852∗氨基态氮10.574-0.819∗食盐1-0.821∗pH1
注:*表示在0.05水平(双侧)显著相关;**表示在0.01水平(双侧)显著相关(下同)
2.2.2 游离氨基酸含量
氨基酸是生物胺形成的前体物质,为探索腐乳中游离氨基酸与生物胺的关系,对工业发酵过程中腐乳17种游离氨基酸进行了检测,结果如图2所示,检测出17种游离氨基酸[因胱氨酸和蛋氨酸在整个发酵过程中含量较低(胱氨酸<0.2 g/100 g,蛋氨酸<0.1 g/100 g),结果未列出],腐乳中含量较高(>1.0 g/100 g)的依次为谷氨酸、天冬氨酸、亮氨酸、精氨酸、赖氨酸和苯丙氨酸,这与王巧云[26]研究结果相似。在整个工业发酵过程中,总游离氨基酸呈升降交替变化趋势,FP-MP-SP阶段中,毛坯中游离氨基酸含量最高,达14.5 g/100 g,该阶段霉菌繁殖最旺盛,产生大量蛋白酶,促使蛋白质分解为小分子肽和氨基酸。在后发酵阶段(RB-RC-RD),随着后发酵的进行总游离氨基酸含量呈升高趋势,后发酵中期达到整个发酵阶段的最高值18.11 g/100 g,随后又出现降低现象,这可能与发酵期间不同微生物类群的代谢转化作用和小分子物质的逸出有关。
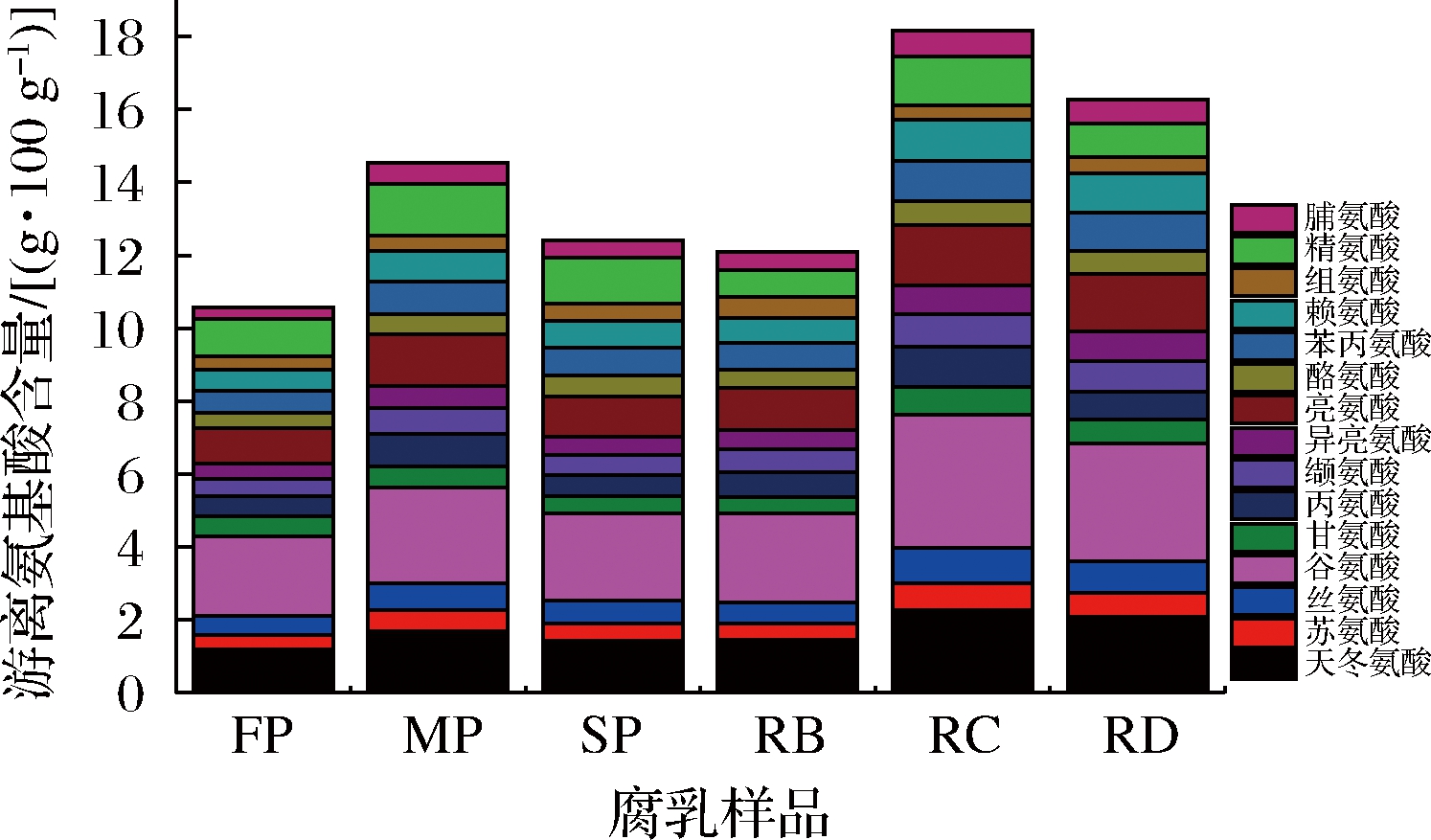
图2 腐乳发酵过程中游离氨基酸含量变化
Fig.2 Changes of free amino acid content during sufu fermentation
为进一步探索腐乳中生物胺与相关游离氨基酸的相关性,对腐乳中生物胺与其相应前体氨基酸(组胺与组氨酸、赖氨酸与尸胺、酪氨酸与酪胺、精氨酸与腐胺和亚精胺、谷氨酸与腐胺和亚精胺)的Pearson相关性进行了分析,结果见表3。精氨酸与腐胺呈显著负相关(P<0.05),组胺与组氨酸呈负相关,但不显著(P>0.05),其他前体物质与相应生物胺均无显著相关性,WANG等[22]对发酵鱼露中游离氨基酸与生物胺进行相关性分析中也发现其生物胺与相应前体氨基酸无显著相关。腐乳中总生物胺与总游离氨基酸呈显著正相关,说明腐乳发酵过程中游离氨基酸含量较低时生物胺的形成明显受影响,在腐乳工业生产中适当控制部分生物胺前体游离氨基酸含量,可减少生物胺的产生。
表3 腐乳发酵过程中相关氨基酸与生物胺的相关性
Table 3 Correlation between related amino acids and biogenic amines during sufu fermentation
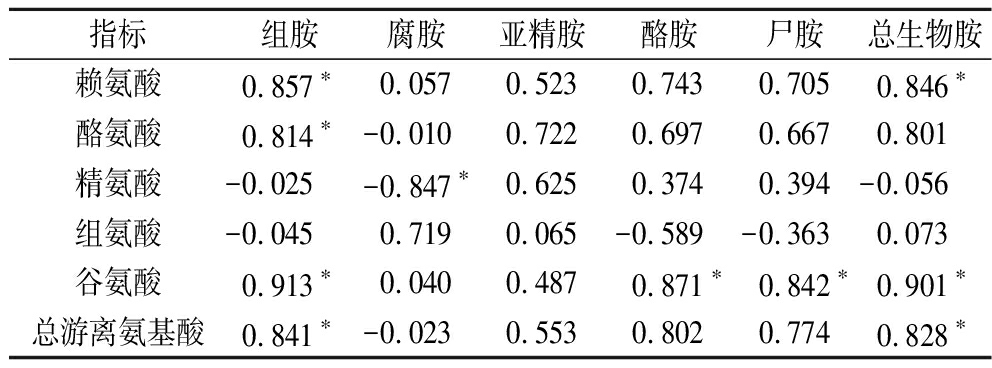
指标组胺腐胺亚精胺酪胺尸胺总生物胺赖氨酸0.857∗0.0570.5230.7430.7050.846∗酪氨酸0.814∗-0.0100.7220.6970.6670.801精氨酸-0.025-0.847∗0.6250.3740.394-0.056组氨酸-0.0450.7190.065-0.589-0.3630.073谷氨酸0.913∗0.0400.4870.871∗0.842∗0.901∗总游离氨基酸0.841∗-0.0230.5530.8020.7740.828∗
2.3 微生物群落变化及其与生物胺相关性分析
2.3.1 腐乳发酵过程中微生物群落数量及结构变化
表4为腐乳发酵过程中细菌总数和霉菌/酵母菌总数变化。腐乳整个发酵阶段细菌总数为(3.26±0.1) lgCFU/g~(6.9±0.21) lgCFU/g,霉菌/酵母菌总数为(1.97±0.03) lgCFU/g~(7.44±0.32) lgCFU/g,其中,细菌总数在毛坯及盐坯阶段出现显著降低(P<0.05);霉菌/酵母菌总数在毛坯阶段达(7.44±0.32) lgCFU/g,盐坯阶段急剧降低。微生物菌落总数受前发酵及盐坯阶段影响最为显著,可能由于毛坯阶段接种毛霉大量繁殖,一定程度抑制了细菌生长;盐坯阶段食盐的添加对细菌及真菌均显著抑制。后发酵前中期细菌总数数量显著增加,而真菌无明显变化,可能由于部分细菌代谢产物的积累抑制了真菌生长所致[27]。
表4 各发酵阶段腐乳中微生物菌落数变化
Table 4 Changes of microbial colony number in sufu at different fermentation stages

指标FPMPSPRBRCRD细菌总数(lgCFU/g)6.3±0.11a3.41±0.1b3.26±0.04b 5.83±0.22a 6.61±0.04c6.9±0.21c霉菌/酵母菌总数(lgCFU/g)2.73±0.1a7.44±0.32b 2.02±0.03a3.55±0.05c4.78±0.11d4.65±0.04d
由图3-A可知,各腐乳样品共检测到21个细菌门,其中相对丰度>1%的优势细菌门有厚壁菌门(Firmicutes)(21.6%~68.8%)、变形菌门(Proteobacteria)(30.7%~59.2%)、栖热异常菌门(Deinococcus_Thermus)(0%~9.1%)和拟杆菌门(Bacteroidetes)(1.39%~2.71%)4个,占比>97%。其中厚壁菌门和变形菌门在各发酵阶段腐乳中均为优势细菌门,仅鲜坯检测出优势栖热异常菌门(9.05%),并有18.38%的未分类细菌门,拟杆菌门只在后发酵中期和后期检测到。
由图3-B可知,从细菌属水平上来看,共检测到21个细菌属,不动杆菌属(Acinetobacter)(18.56%~36.37%)和乳球菌属(Lactococcus)(10.86%~46.82%)在各发酵阶段腐乳中均为优势菌属,而各样品中其他优势细菌属(相对丰度>5%)则有较大差异,如,鲜坯阶段优势细菌属还包括未分类细菌属(unclassified)(18.46%)、莫拉式菌属(Moraxella)(7.03%)、栖热菌属(Thermus)(7.76%)等;毛坯样品中还检测到17.41%的莫拉式细菌属和6.68%的巨球菌属(Macrococcus);盐坯样品中还包括明串珠菌属(Leuconostoc)(16.17%)和假单胞菌属(Pseudomonas)(9.99%)。四链球菌属(Tetragenococcus)是一种嗜盐菌,有报道其为腐乳优势菌[28],而本研究中,虽能被检测到,但包括盐坯阶段均未成为优势菌属,而具耐盐特性的假单胞菌则在盐坯阶段呈优势菌属,这与HUANG等[21]所报道相似。说明多阶段、长时间且开放的发酵方式使得样品原料和发酵环境对腐乳样品中菌群影响十分显著。
由图4-A可知,各腐乳样品中共检测到的真菌门有毛霉菌门(Mucoromycota)(17.02%~97.22%)、壶菌门(Chytridiomycota)(0.74%~76.34%)、子囊菌门(Ascomycota)(0.83%~13.67%)、担子菌门(Basidiomycota)(0.02%~1.08%)和未分类(unclassified)(0%~5.8%)。依据相对丰度>1%的优势真菌门来看,毛霉菌门为所有腐乳样品中的优势真菌,除鲜坯外,相对丰度占比均>78%;壶菌门在除后发酵中期外的各阶段均为优势菌门;子囊菌门在前发酵的盐坯和整个后发酵阶段均为优势菌门。
由图4-B可知,各腐乳样品中共检测到20个真菌属,其中优势真菌属(相对丰度>5%)有总状横梗霉属(Lichtheimia)、放射毛霉属(Actinomucor)、根霉属(Rhizopus)、壶菌属(Synchytrium)、毛霉属(Mucor)和假丝酵母属(Candida),其中放射毛霉属在腐乳各阶段样品中均为优势菌属;总状横梗霉属、根霉属和毛霉属除鲜坯样品外,其他各发酵阶段均为优势菌属,而鲜坯阶段中壶菌属为其优势均属(76.34%)。各发酵阶段毛霉菌属的变化与前发酵接种霉菌菌种和开放式发酵环境密切相关,LIANG等[12]和XU等[29]发现在腐乳发酵中除放射毛霉属外,随着发酵的进行曲霉属逐渐发展为优势菌属,而本研究中整个发酵阶段曲霉属均未呈优势。壶菌属多在淡水中寄生或腐生,也可寄生于陆生植物,本研究特殊的在鲜坯样品中检测到高相对丰度的壶菌属可能与豆腐加工用水或大豆原料有关。

A-门水平;B-属水平
图3 腐乳发酵过程中细菌群在门和属水平构成图
Fig.3 Composition of bacterial communities at phylum and genus levels during sufu fermentation

A-门水平;B-属水平
图4 腐乳发酵过程中真菌群在门和属水平构成图
Fig.4 Composition of fungal communities at phylum and genus levels during sufu fermentation
2.3.2 腐乳发酵过程中优势细菌属和真菌属与生物胺相关性分析
采用冗余分析(redundancy analysis,RDA)对微生物群落(属)与生物胺各成分之间进行相关性分析,如图5所示。箭头长度越长代表该生物胺与微生物群落相关性越大,原点越大代表微生物属丰度越大,原点与箭头的距离越近相关性越大。相较于亚精胺和腐胺,组胺、尸胺和酪胺受细菌属影响较大,其中腐乳优势细菌属中明串珠菌属、乳球菌属与尸胺、酪胺和组胺呈正相关,巨球菌属和假单胞菌属与腐胺呈正相关,不动杆菌属、莫拉式菌属和栖热菌属均与生物胺呈负相关,这与前人研究表明的乳酸菌与生物胺的形成密切相关的结果相符[24-26,28-29]。从真菌属与生物胺RDA来看,除腐胺、组胺与真菌属相关性较大外,其他生物胺均受真菌属影响较小。腐乳优势真菌属中总状横梗霉、根霉属与组胺和腐胺呈显著正相关,这两个真菌属在腐乳中除鲜坯外的各发酵阶段丰度均为高占比,相应的腐乳中组胺和腐胺含量均较高,可能总状横梗霉、根霉属会促使生物胺的形成。
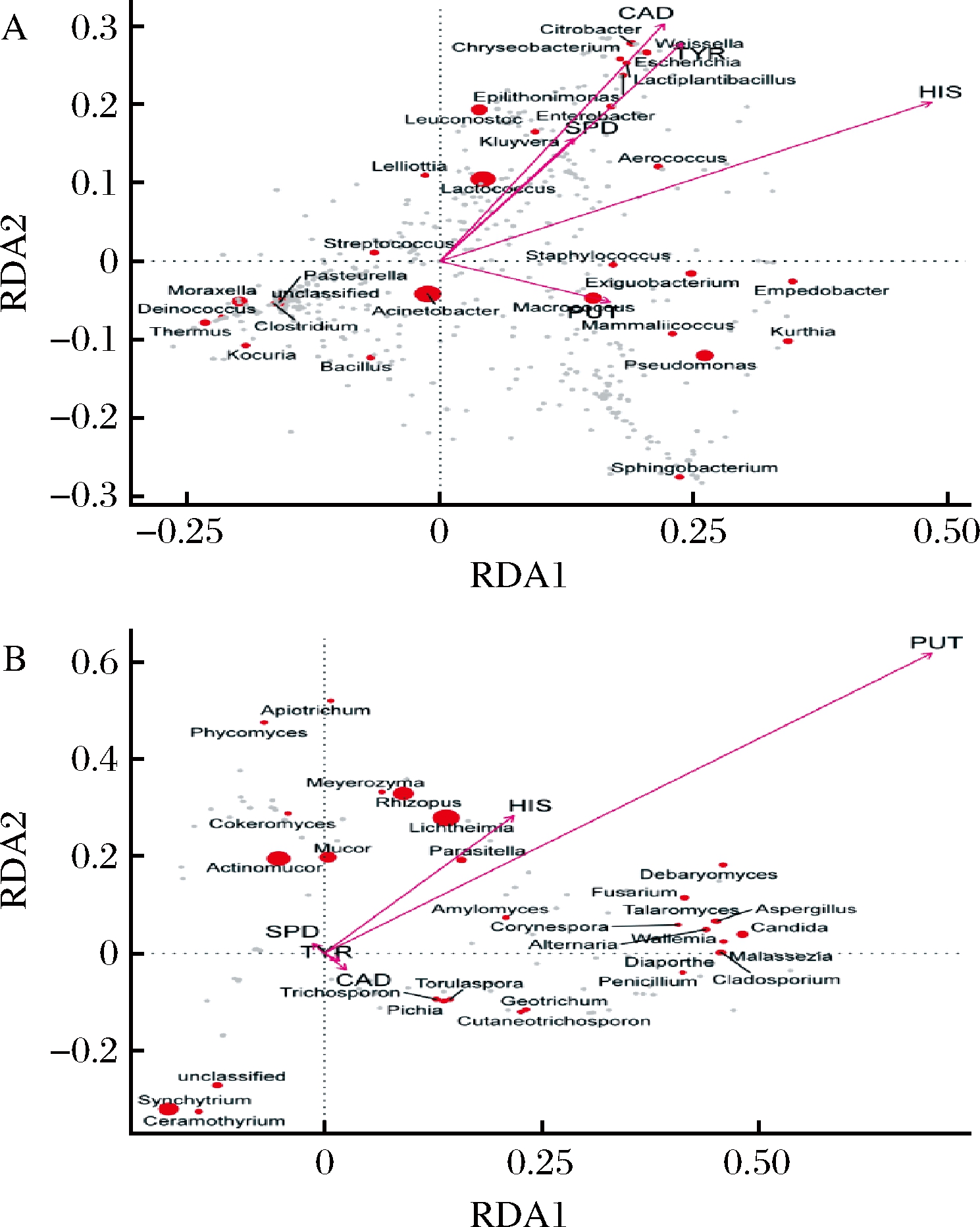
SPD-亚精胺(spermidine);PUT-腐胺(putrescine);HIS-组胺(histamine); CAD-尸胺(cadaverine);TYR-酪胺(tyramine) A-优势细菌属;B-优势真菌属
图5 腐乳发酵过程中优势细菌属和 优势真菌属与其生物胺的相关性
Fig.5 Correlation between dominant bacterial genera and dominant fungal genera and biogenic amines during sufu fermentation
3 结论
本研究腐乳中生物胺以组胺为主(占总生物胺90%以上),其次为腐胺、亚精胺、尸胺和酪胺,总生物胺含量在后发酵中期最高为641.03 mg/kg,低于安全推荐量1 000 mg/kg,而组胺则高于推荐的100 mg/kg。在腐乳发酵过程中,各生物胺之间具有一定相关性,其中,组胺与酪胺、尸胺与酪胺、组胺与尸胺均呈显著正相关(P<0.05),总生物胺与氨基态氮和总酸呈极显著正相关,与pH呈极显著负相关(P<0.01),与食盐和水分含量无明显相关性。整个发酵过程中,腐乳中游离氨基酸呈波动变化,在前发酵和后发酵阶段均呈先升再降趋势,最高含量为18.11 g/100 g,总游离氨基酸与总生物胺呈显著正相关,从各生物胺与其前体氨基酸相关性分析来看,除精氨酸与腐胺呈显著正相关外,其余均无显著相关性。宏基因组技术分析腐乳中微生物多样性结果显示,前发酵及盐坯阶段中,盐坯阶段的细菌和真菌丰度均较高,而细菌多样性较低,随着后发酵的进行,细菌的丰度和多样性均升高,真菌多样性降低。共检测到细菌门21个,优势菌门(相对丰度>1%)为厚壁菌门、变形菌门、栖热异常菌门和拟杆菌门,占比>97%,细菌属21个,不动杆菌属、乳球菌属、莫拉式菌属、栖热菌属、巴氏杆菌属和未分类菌属为优势细菌属;真菌门5个,毛霉菌门、壶菌门和子囊菌门为优势真菌门,真菌属有20个,放射毛霉属为各阶段共有优势真菌属,各发酵阶段优势真菌属还包括总状横梗霉属、根霉属、壶菌属和毛霉属。明串珠菌属、乳球菌属与尸胺、酪胺和组胺呈正相关,总状横梗霉与根霉属与组胺和腐胺呈显著正相关,腐乳中优势细菌属与生物胺相关性高于真菌属。本研究八公山腐乳样品中的组胺含量较高,其与理化因素中总酸、氨基态氮和微生物菌群乳酸菌数、根霉属均具有正相关性,后期还应结合代谢组学、基因组学等手段解析八公山腐乳中生物胺,尤其是组胺的代谢机制,为腐乳中生物胺的安全控制提供理论支持。
[1] 陶康, 吴凌伟, 金晓芳, 等.基于高通量基因测序分析腐乳微生物多样性[J].食品科学, 2021,42(8):143-149.
TAO K, WU L W, JIN X F, et al.Analysis of microbial diversity in sufu using high-throughput sequencing[J].Food Science, 2021,42(8):143-149.
[2] ZHAO C J, SCHIEBER A, G NZLE M G.Formation of taste active amino acids, amino acid derivatives and peptides in food fermentations:a review[J].Food Research International, 2016, 89:39-47.
NZLE M G.Formation of taste active amino acids, amino acid derivatives and peptides in food fermentations:a review[J].Food Research International, 2016, 89:39-47.
[3] SHI C S, LIU M M, ZHAO H F, et al.Formation and control of biogenic amines in sufu-a traditional Chinese fermented soybean product:A critical review[J].Food Reviews International,2021:1-22.DOI:10.1080/87559129.2021.1936002.
[4] 王新南. 发酵豆制品中生物胺含量研究进展[J].中国调味品, 2019, 44(9):188-190.
WANG X N.Research progress of biogenic amines in fermented soybean products[J].China Condiment, 2019, 44(9):188-190.
[5] Efsa Panel on Biological Hazards (BIOHAZ).Scientific Opinion on risk based control of biogenic amine formation in fermented foods[J].EFSA Journal, 2011, 9(10):2393.
[6] NOUT, M.J.R.Fermented foods and food safety[J].Food Research International, 1994, 27(3):291-298.
[7] 王光强, 俞剑燊, 胡健, 等.食品中生物胺的研究进展[J].食品科学, 2016, 37(1):269-278.
WANG G Q, YU J S, HU J, et al.Progress in research on biogenic amines in foods[J].Food Science, 2016, 37(1):269-278.
[8] 李大伟, 李丹丹, 梁静静, 等.高效液相色谱法测定市售腐乳中生物胺的含量[J].食品研究与开发, 2018,39(16):120-124.
LI D W, LI D D, LIANG J J,et al.Determination of biogenic amines in commercially sufu by high performance liquid chromatography[J].Food Research and Development, 2018,39(16):120-124.
[9] QIU S, WANG Y, CHENG Y Q, et al.Reduction of biogenic amines in sufu by ethanol addition during ripening stage[J].Food Chemistry, 2018, 239:1 244-1 252.
[10] GUAN R F, LIU Z F, ZHANG J J, et al.Investigation of biogenic amines in sufu (furu):A Chinese traditional fermented soybean food product[J].Food Control, 2013, 31(2):345-352.
[11] 王维亚, 刘玉婷, 万汉坤, 等. 腐乳中细菌群落结构与生物胺的相关性分析[J]. 食品工业科技, 2022, 43(22):181-188.
WANG W Y, LIU Y T, WAN H K, et al. Correlation analysis between bacterial community structure and biogenic amines in sufu[J]. Science and Technology of Food Industry, 2022, 43(22):181-188.
[12] LIANG J J, LI D W, SHI R Q, et al.Effects of microbial community succession on volatile profiles and biogenic amine during sufu fermentation[J].LWT-Food Science and Technology, 2019, 114:108379.
[13] TSAI Y H, KUNG H F, CHANG S C, et al.Histamine formation by histamine-forming bacteria in Douchi, a Chinese traditional fermented soybean product[J].Food Chemistry, 2007, 103(4):1 305-1 311.
[14] 舒蕊华, 卢士玲, 徐幸莲.粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium)产生物胺交互作用研究[J].食品与发酵工业, 2011, 37(6):16-20;24.
SHU R H, LU S L, XU X L.Investigation on interaction between Enterococcus faecalis and Enterococcus faecium on biogenic amine production[J].Food and Fermentation Industries, 2011, 37(6):16-20;24.
[15] BOLGER A M, LOHSE M, USADEL B. Trimmomatic: A flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15):2 114-2 120.
[16] LANGMEAD B, SALZBERG S L.Fast gapped-read alignment with bowtie 2[J].Nature Methods, 2012, 9(4):357-359.
[17] YANG J, DING X W, QIN Y R, et al.Safety assessment of the biogenic amines in fermented soya beans and fermented bean curd[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7 947-7 954.
[18] TORO-FUNES N, BOSCH-FUSTE J, LATORRE-MORATALLA M L, et al. Biologically active amines in fermented and non-fermented commercial soybean products from the Spanish market[J]. Food Chemistry, 2015, 173:1 119-1 124.
[19] YANG B, TAN Y, KAN J Q.Regulation of quality and biogenic amine production during sufu fermentation by pure mucor strains[J].Lebensmittel-Wissenschaft Und-Technologie, 2019, 117(4):108637.
[20] 赵丹,罗俏俏,王欣,等.汤汁辅料对腐乳发酵过程中单胺氧化酶活性及生物胺积累的影响[J].食品科学技术学报,2022, 40(2):91-97.
ZHAO D, LUO Q Q, WANG X, et al.Influence of soup accessories on activity of monoamine oxidase and accumulation of biogenic amines during sufu fermentation[J].Journal of Food Science and Technology, 2022, 40(2):91-97.
[21] HUANG X N, YU S Z, HAN B Z, et al.Bacterial community succession and metabolite changes during sufu fermentation[J].LWT-Food Science and Technology, 2018, 97:537-545.
[22] WANG Y Q, LI C S, LI L H, et al.Effect of bacterial community and free amino acids on the content of biogenic amines during fermentation of Yu-lu, a Chinese fermented fish sauce[J].Journal of Aquatic Food Product Technology, 2018, 27(4):496-507.
[23] BAI X Z, BYUN B Y, MAH J H.Formation and destruction of biogenic amines in Chunjang (a black soybean paste) and Jajang (a black soybean sauce)[J].Food Chemistry, 2013, 141(2):1 026-1 031.
[24] 宋雪梅, 宋国顺, 梁琪, 等.牦牛乳硬质干酪成熟过程中生物胺与细菌群落结构分析[J].食品科学, 2021, 42(23):27-33.
SONG X M, SONG G S, LIANG Q, et al.Analysis of biogenic amines and bacterial community composition during the ripening of hard cheese made from yak′s milk[J].Food Science, 2021, 42(23):27-33.
[25] 李东蕊, 刘红霞, 吴剑荣, 等.豆瓣酱工业发酵过程中生物胺的生成规律[J].食品与发酵工业, 2020, 46(9):78-82.
LI D R, LIU H X, WU J R, et al.The regular pattern of biogenic amine formation during the industrial fermentation of broad bean paste[J].Food and Fermentation Industries, 2020, 46(9):78-82.
[26] 王巧云. 双霉菌发酵的八公山腐乳品质研究[D].合肥:合肥工业大学, 2019.
WANG Q Y. Study on the quality of Bagongshan sufu fermented by double fungi[D]. Hefei: Hefei University of Technology, 2019.
[27] 李雄波, 邓维琴, 李恒, 等.分段发酵模式对郫县豆瓣甜瓣子发酵过程中微生物及产品品质的影响[J].食品科学, 2021,42(10):65-72.
LI X B, DENG W Q, LI H, et al.Effect of stepwise fermentation modes on microbial population and quality of Pixian broad bean paste mash during fermentation[J]. Food Science, 2021,42(10):65-72.
[28] 徐琼, 刘洋, 曲勤凤, 等.高通量测序分析不同地区红腐乳细菌多样性[J].食品科学, 2020, 41(10):110-116.
XU Q, LIU Y, QU Q F, et al.High-throughput sequencing analysis of bacterial diversity in red sufu from different regions[J].Food Science, 2020, 41(10):110-116.
[29] XU D D, WANG P, ZHANG X, et al.High-throughput sequencing approach to characterize dynamic changes of the fungal and bacterial communities during the production of sufu, a traditional Chinese fermented soybean food[J].Food Microbiology, 2020, 86:103340.