人体的正常代谢会产生活性氧(reactive oxygen species,ROS),低水平的ROS在体内会参与蛋白质磷酸化、细胞凋亡、免疫和分化等过程,当人体随着年龄增长,ROS在体内更易过量产生,细胞中的DNA、蛋白质和脂质等遭受破坏,导致细胞功能受损,从而造成氧化应激,许多慢性疾病如高血压、糖尿病、阿尔茨海默病等,甚至癌症都与氧化应激有关[1]。研究表明,人体通过摄入抗氧化剂可以减少氧化应激的发生[2],由于化学合成的抗氧化剂对人体有潜在的危害,因此开发天然、有效、安全的抗氧化剂很有必要。乳酸菌是一类具有天然活性的微生物,具有抗氧化[3]、降胆固醇[4]、调节肠道菌群平衡[5]、增强免疫[6]的益生功能,其广泛存在于肉类,乳类及各种果蔬食品中,尤其在一些自然发酵的传统食品中最为丰富,获取方便且成本较低,是一种很有潜力的天然抗氧化剂资源。浆水是我国西北地区的一种传统发酵食品,一般以芹菜、胡萝卜等蔬菜为原料,加入面汤和老浆水(俗称“引子”)发酵而成,其中富含大量菌种资源,以乳酸菌和酵母菌为优势菌群,具有促消化、解暑和抗衰老功效[7],目前对其研究主要集中在理化性质分析、工艺优化和微生物分离鉴定[8-9],而对从浆水中筛选抗氧化乳酸菌的研究涉及很少,因此从中筛选出具有高抗氧化活性的乳酸菌,对丰富本土化功能性乳酸菌资源库,开发新型天然抗氧化剂具有重要的研究价值。
乳酸菌要在人体内发挥其益生功能,必须要耐胃酸、耐胆盐,并具有较好的肠道黏附能力[10],使其顺利通过人体的消化系统,在肠道中定植并建立优势菌群。因此本文从传统发酵浆水中分离纯化乳酸菌,以DPPH自由基、羟自由基、超氧阴离子自由基为指标,筛选出具有高抗氧化活性的乳酸菌,并对其耐酸,耐胆盐能力及黏附特性进行评价,为开发功能性乳酸菌食品提供基础。
1 材料与方法
1.1 材料与仪器
传统发酵浆水,采集自陕西西安不同居民家中,保存于实验室4 ℃冰箱中;MRS培养基,北京奥博星生物技术有限责任公司;碳酸钙、氯化钠、硫酸亚铁,天津市天力化学试剂有限公司;DPPH、三羟甲基氨基甲烷盐酸盐(Tris-HCl),美国Sigma公司;邻菲罗啉,天津市天新精细化工开发中心;1492R、27F引物,上海派森诺生物科技有限公司;dNTP、Taq聚合酶,日本TaKaRa公司;琼脂糖,生工生物工程(上海)股份有限公司。其余试剂均为分析纯。
SW-CJ-2F型超净工作台,苏州净化设备有限公司;CX23型光学显微镜,日本OLYMPUS公司;Z206A型台式离心机,德国HERMLE公司;GHP-9270型隔水式恒温培养箱,上海一恒科学仪器有限公司;ABI 2070型PCR仪,美国Applied Biosystems公司;QL-861型旋涡振荡器,海门市麒麟医用仪器厂;MINI-300型电泳仪,美国Major science公司。
1.2 实验方法
1.2.1 乳酸菌的分离纯化
将采集的20份不同发酵时间的传统发酵浆水用筛网过滤,在无菌操作条件下吸取1 mL浆水汁,加入9 mL生理盐水,混合均匀,梯度稀释并选择合适的稀释度备用。将稀释液涂布于含1% CaCO3的MRS琼脂平板中,37 ℃培养48 h,挑取溶钙圈明显、白色或乳白色的单菌落进行分离纯化[11],重复上述步骤3次。对分离纯化后菌株进行革兰氏染色和过氧化氢酶实验。革兰氏阳性、过氧化氢酶阴性的无芽孢的杆状菌株初步可判定为乳酸菌,对纯化菌株编号,在-40 ℃用50%(体积分数)的甘油冷冻保藏。
1.2.2 乳酸菌抗氧化能力的测定
1.2.2.1 菌悬液制备
将菌株连续活化2代,按体积分数2%的接种量接种于MRS液体培养基中,置37 ℃培养18 h,将菌液在3 000×g离心10 min,收集菌泥,用PBS缓冲液洗涤菌体并再次离心,重复洗涤两次,调整菌悬液浓度为1×109 CFU/mL[12]。
1.2.2.2 DPPH自由基清除能力的测定
DPPH自由基清除能力测定参考刘珊春[13]的方法。取2 mL菌悬液,加入2 mL 0.2 mmol/L的DPPH无水乙醇溶液,充分混匀,室温下避光反应30 min。3 000×g离心10 min后,取上清液在517 nm处测定吸光度As,以3 μg/mL的维生素C溶液作阳性对照,计算DPPH自由基清除率,每组重复3次。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:As为2 mL的DPPH无水乙醇溶液+2 mL菌悬液的吸光度;A0为2 mL的无水乙醇+2 mL菌悬液的吸光度;Ai为2 mL的DPPH无水乙醇溶液+2 mL蒸馏水的吸光度。
1.2.2.3 羟自由基清除能力的测定
羟自由基清除能力测定参考张书文[14]的方法。取1 mL 2.5 mmol/L 的邻菲罗琳,依次加入1 mL PBS缓冲液,1 mL蒸馏水,充分混匀,再加入1 mL 2.5 mmol/L FeSO4和1 mL 20 mmol/L H2O2,在37 ℃反应90 min,取上清液在536 nm处测定吸光度A2。用1 mL蒸馏水代替1 mL H2O2为空白组,测定吸光度A0。用1 mL菌悬液代替1 mL的蒸馏水为样品组,测定吸光度A1。计算羟自由基清除率,每组重复3次。羟自由基清除率的计算如公式(2)所示:
羟自由基清除率![]()
(2)
1.2.2.4 超氧阴离子自由基清除能力的测定
超氧阴离子自由基清除能力测定参考YU等[15]的方法。将0.5 mL菌悬液与1.5 mL Tris-HCl溶液(pH 8.0)混合,在25 ℃反应20 min后,加入200 μL 25 mmol/L邻苯三酚反应5 min,然后加入250 μL HCl终止反应,在3 000×g离心10 min,取上清液在325 nm处测定吸光度A样品。用0.5 mL蒸馏水代替0.5 mL菌悬液作为对照组,测定吸光度A对照。计算超氧阴离子自由基清除率,每组重复3次。清除率计算如公式(3)所示:
超氧阴离子自由基清除率![]()
(3)
1.2.3 菌株16S rDNA 鉴定
用细菌基因组DNA提取试剂盒对菌株进行DNA提取。使用引物16S:27F(5-AGAGTTTGATCCTGGCTCAG-3)和16S:1492R (5-CTACGGCTACCTTGTTACGA-3)。PCR扩增体系:基因组DNA 1.0 μL、10×Buffer 5.0 μL、Taq聚合酶 1.0 μL、dNTP 1.0 μL、引物(R+F) 1.5 μL、双蒸水(ddH2O) 40.5 μL。扩增条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,72 ℃最终延伸7 min。取3 μL PCR产物进行1%琼脂糖凝胶电泳。取各个菌种纯化后的PCR产物,进行DNA测序。将拼接后的序列文件与GenBank基因库中的数据进行比对分析[16]。
1.2.4 乳酸菌耐酸能力的测定
乳酸菌耐酸能力测定参考刘璐等[17]的方法。将菌悬液按5%的接种量分别接种至pH 2.0、2.5、3.0的MRS液体培养基中,摇匀,37 ℃培养3 h,分别在0 h和3 h取样梯度稀释后涂布于MRS琼脂平板上,用平板计数法测定活菌数N对照和N实验,计算菌株存活率,每组重复3次。存活率计算如公式(4)所示:
存活率![]()
(4)
1.2.5 乳酸菌耐胆盐能力的测定
乳酸菌耐胆盐能力测定参考杨泽敏等[18]的方法。取1 mL菌悬液接种至9 mL含0.1%、0.2%、0.3%、0.5%(质量分数)胆盐的MRS液体培养基中,37 ℃培养3 h,分别在0 h和3 h取样梯度稀释后涂布于MRS琼脂平板上,用平板计数法测定活菌数,计算其存活率,每组重复3次。存活率计算如公式(5)所示:
存活率![]()
(5)
1.2.6 乳酸菌黏附能力的测定
乳酸菌黏附能力测定参考杨振泉等[19]的方法,乳酸菌黏附能力用菌株自凝聚率表示。取5 mL菌悬液置于试管中,室温静置分层,分别在静置0 h和3 h时缓慢吸取1 mL上层溶液,在600 nm处测定吸光度A0 h和A3 h,计算自凝聚率,每组重复3次。自凝聚率计算如公式(6)所示:
自凝聚率![]()
(6)
1.3 数据统计与分析
数据分析使用SPSS 26和Excel软件进行,采用方差分析进行显著性统计学分析,使用Origin 2021进行作图。
2 结果与分析
2.1 乳酸菌的分离纯化
应用选择性培养基从传统发酵浆水中分离纯化出120株具有明显溶钙圈的菌株,不同菌株表现出相似的菌落型态和菌体型态,如图1所示,菌落呈圆形或椭圆形,微白色,有光泽,符合乳酸菌的外观特征[20],菌体在显微镜下均呈短杆状且不连续,编号Z1~Z120,对这些分离的菌株进行革兰氏染色和过氧化氢酶实验,结果为革兰氏阳性、过氧化氢酶阴性,初步鉴定属于乳酸菌。

A-菌落型态;B-菌体型态
图1 分离乳酸菌的菌落型态和菌体型态(100×)
Fig.1 Colony morphology and cell morphology of isolated lactic acid bacteria
2.2 抗氧化乳酸菌的筛选
2.2.1 抗氧化乳酸菌的初选
DPPH自由基清除能力是评价乳酸菌抗氧化能力最常用的指标[21],可用于快速筛选菌株。120株菌株对DPPH自由基清除能力见图2,菌株间的DPPH自由基清除率差异较大,为5.32%~41.45%,其中Z12菌株的清除率最高,达到41.45%,而Z120菌株的清除率最低,仅为5.32%。DPPH自由基清除率>30%通常被认为是具有高抗氧化活性的乳酸菌[22]。由图2可知,Z12、Z13、Z45、Z33、Z41、Z3、Z6、Z19、Z26、Z5,10株菌株的DPPH自由基清除率均超过了30%,显著高于其他菌株和维生素C对照(P<0.05),可认为具有较高的抗氧化活性。乳酸菌的DPPH自由基清除能力与其来源有关,刘珊春等[23]从传统发酵酸乳中分离纯化的18株乳酸菌DPPH自由基清除率为4.71%~18.91%,甘奕[24]从自然发酵韩国泡菜中分离纯化的2株植物乳杆菌DPPH自由基清除率为2.29%~8.48%,本研究从传统发酵浆水中可筛选出DPPH自由基清除率>30%的乳酸菌,说明传统发酵浆水是筛选抗氧化乳酸菌的较好材料来源。
2.2.2 抗氧化乳酸菌的复选
羟自由基清除能力和超氧阴离子自由基清除能力也是评价乳酸菌抗氧化能力的重要指标。对DPPH自由基清除率>30%的10株乳酸菌进行羟自由基清除能力和超氧阴离子自由基清除能力评价,结果见图3和图4。由图3可知,10株乳酸菌的羟自由基清除率为39.58%~55.83%,其中Z41菌株表现出最高的羟自由基清除率,为55.83%,其次是Z33、Z45、Z12和Z13菌株,分别为51.13%、50.55%、50.51%、50.44%,Z19菌株的清除率最低,仅为39.58%。从10株乳酸菌的超氧阴离子自由基清除率(图4)可以看出,10株乳酸菌均有一定的超氧阴离子自由基清除能力,且清除率差异不大,为38.36%~44.30%,其中Z12菌株的超氧阴离子自由基清除能力最强,为44.30%,其次是Z41、Z45、Z33和Z13菌株,分别为44.25%、44.24%、44.21%和44.03%,Z19菌株的清除率最低,仅为38.36%。乳酸菌的抗氧化能力是一个复杂的体系,同一菌株的抗氧化评价指标可能表现出一定的差别,李丹丹等[25]从牦牛酥油中分离纯化的植物乳杆菌C19的羟自由基清除率为11.46%,超氧阴离子自由基清除率为24.59%,凌洁玉等[26]从腌制泡菜中分离纯化的戊糖片球菌L2的羟自由基清除率为7.84%,超氧阴离子自由基清除率为18.79%。本研究应用DPPH自由基清除能力对分离纯化的乳酸菌进行初选,应用羟自由基清除能力和超氧阴离子自由基清除能力进行复选,发现菌株Z12、Z13、Z45、Z33、Z41的DPPH自由基清除率>30%、羟自由基清除率>50%、超氧阴离子自由基清除率>40%,表明这5株乳酸菌具有较高的抗氧化能力。

图2 120株菌株的DPPH自由基清除活性
Fig.2 DPPH free radical scavenging activity of 120 strains
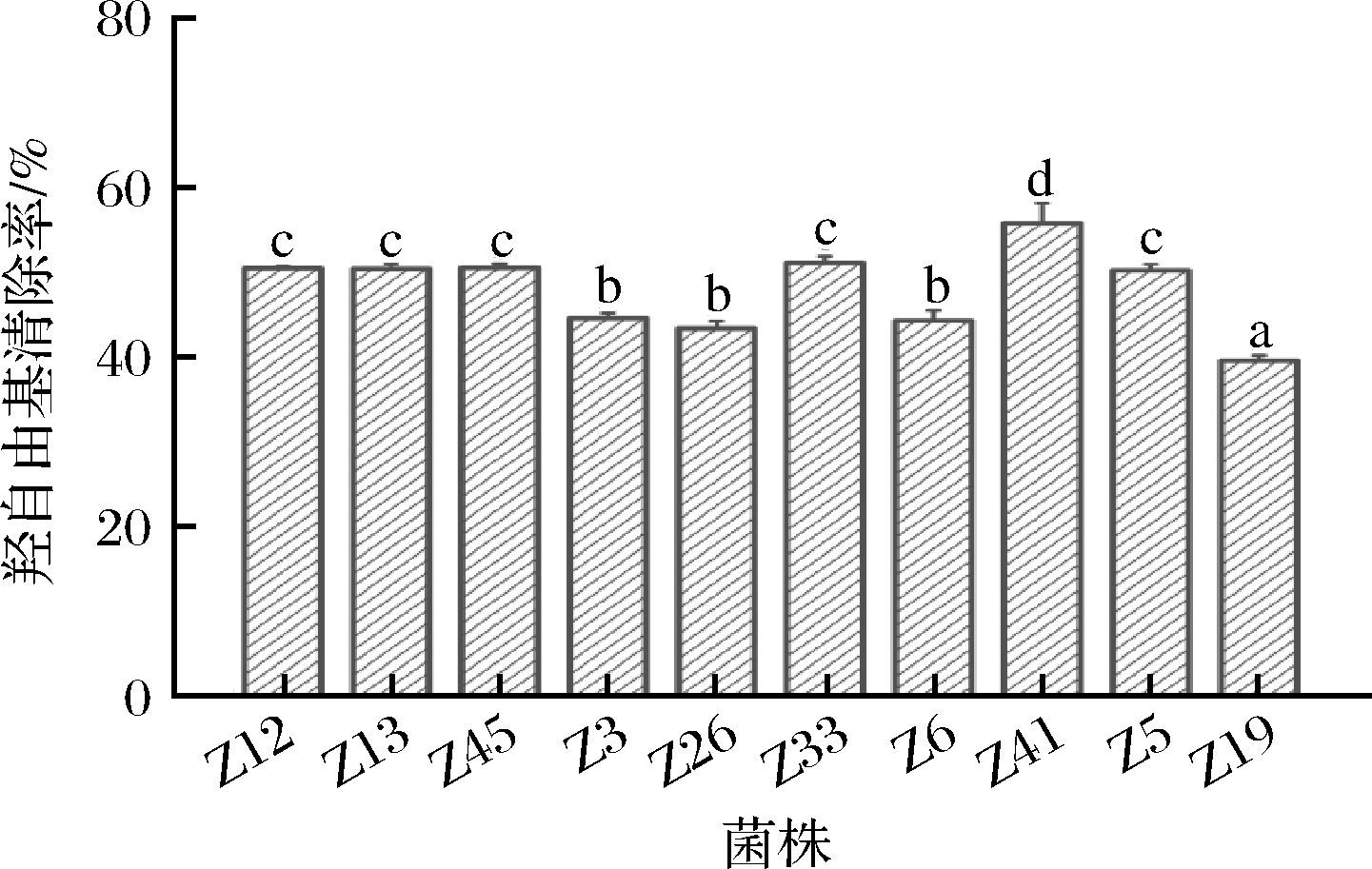
图3 10株菌株的羟自由基清除活性
Fig.3 Hydroxyl radical scavenging activity of 10 strains
注:不同小写字母表示乳酸菌间差异显著(P<0.05)(下同)
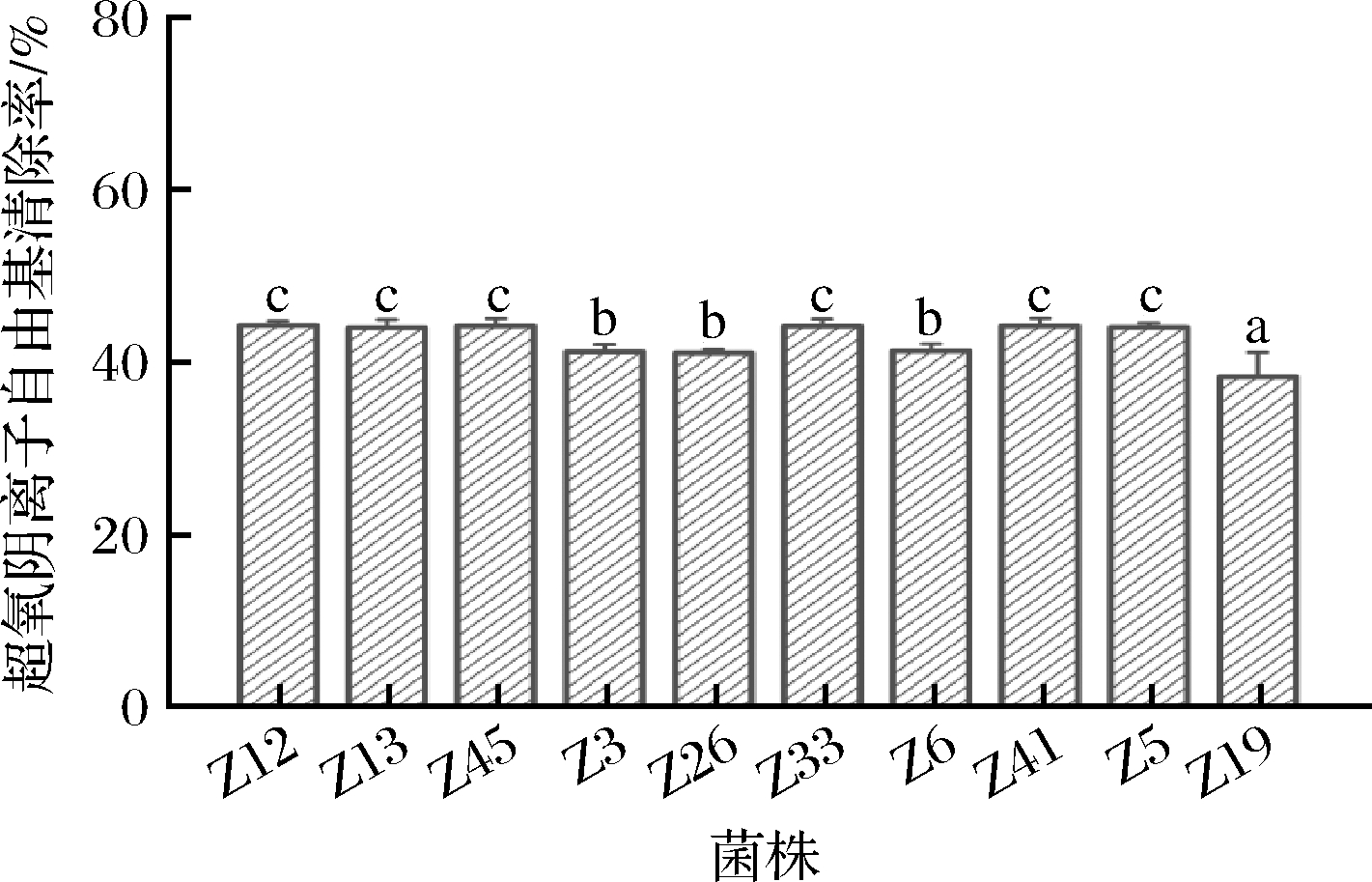
图4 10株菌株的超氧阴离子自由基清除活性
Fig.4 Superoxide anion scavenging activity of 10 strains
2.3 菌株16S rDNA鉴定
对筛选出5株具有较高抗氧化能力的乳酸菌进行16S rDNA序列鉴定,结果见表1,5株乳酸菌与GeneBank数据库中已知乳酸菌均有99%及以上的同源性,2株为植物乳杆菌(Z12、Z13)、2株为副干酪乳杆菌(Z45、Z33),1株为鼠李糖乳杆菌(Z41)。
表1 16S rDNA序列鉴定5株菌株结果
Table 1 Identification of 5 strains by 16S rDNA sequences
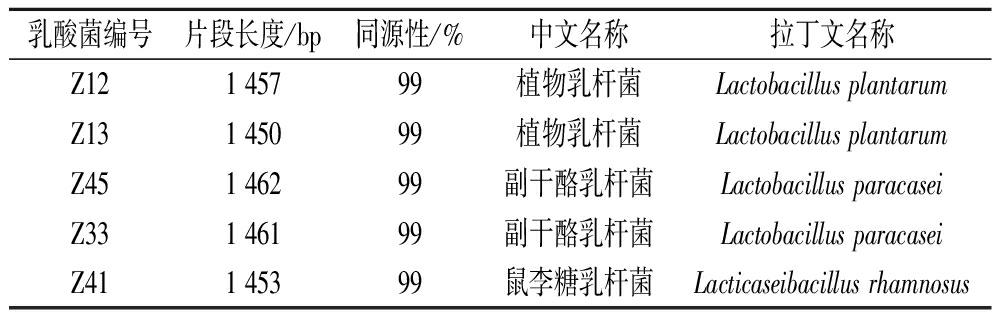
乳酸菌编号片段长度/bp同源性/%中文名称拉丁文名称Z121 45799植物乳杆菌Lactobacillus plantarumZ131 45099植物乳杆菌Lactobacillus plantarumZ451 46299副干酪乳杆菌Lactobacillus paracaseiZ331 46199副干酪乳杆菌Lactobacillus paracaseiZ411 45399鼠李糖乳杆菌Lacticaseibacillus rhamnosus
2.4 乳酸菌的耐酸能力
乳酸菌的耐酸能力是评价其益生特性的主要指标,具有良好耐酸能力的乳酸菌才能通过胃酸屏障,以活菌形式到达胃肠道并发挥其益生作用。通常人在空腹时胃液pH在2.5左右,适量进食后可升至3.0,食物在胃中通过的时间一般是0~3 h[27]。5株乳酸菌在pH 2.0、pH 2.5、pH 3.0 MRS培养基中培养3 h后,结果如图5所示,5株乳酸菌随着pH升高,其存活率也逐渐升高。Z33菌株在pH 2.0、pH 2.5、pH 3.0的培养基中存活率显著高于其余菌株(P<0.05),分别为60.12%、65.10%、68.56%,Z41菌株在pH 3.0的培养基中存活率仅为20.85%,且在pH 2.0和pH 2.5时存活率更低,而Z12、Z45、Z33菌株均能在pH 2~3的培养基中存活,且存活率超过50%。杨郁等[28]从腌制雪菜中分离纯化的植物乳杆菌XC-10在pH 2.0时的存活率仅为1.54%,金成武等[29]从自然发酵酸菜中分离纯化的植物乳杆菌Q12在pH 2.0时的存活率为44.20%,可见本研究中菌株Z12、Z45、Z33具有较强的耐酸能力。FADARE等[30]研究发现在pH 2.0时副干酪乳杆菌DB3的存活率高于植物乳杆菌AM3和植物乳杆菌NG13,本研究中在pH 2.0时副干酪乳杆菌Z45和Z33的存活率同样高于植物乳杆菌Z12,这说明乳酸菌的耐酸能力与其种类有关。
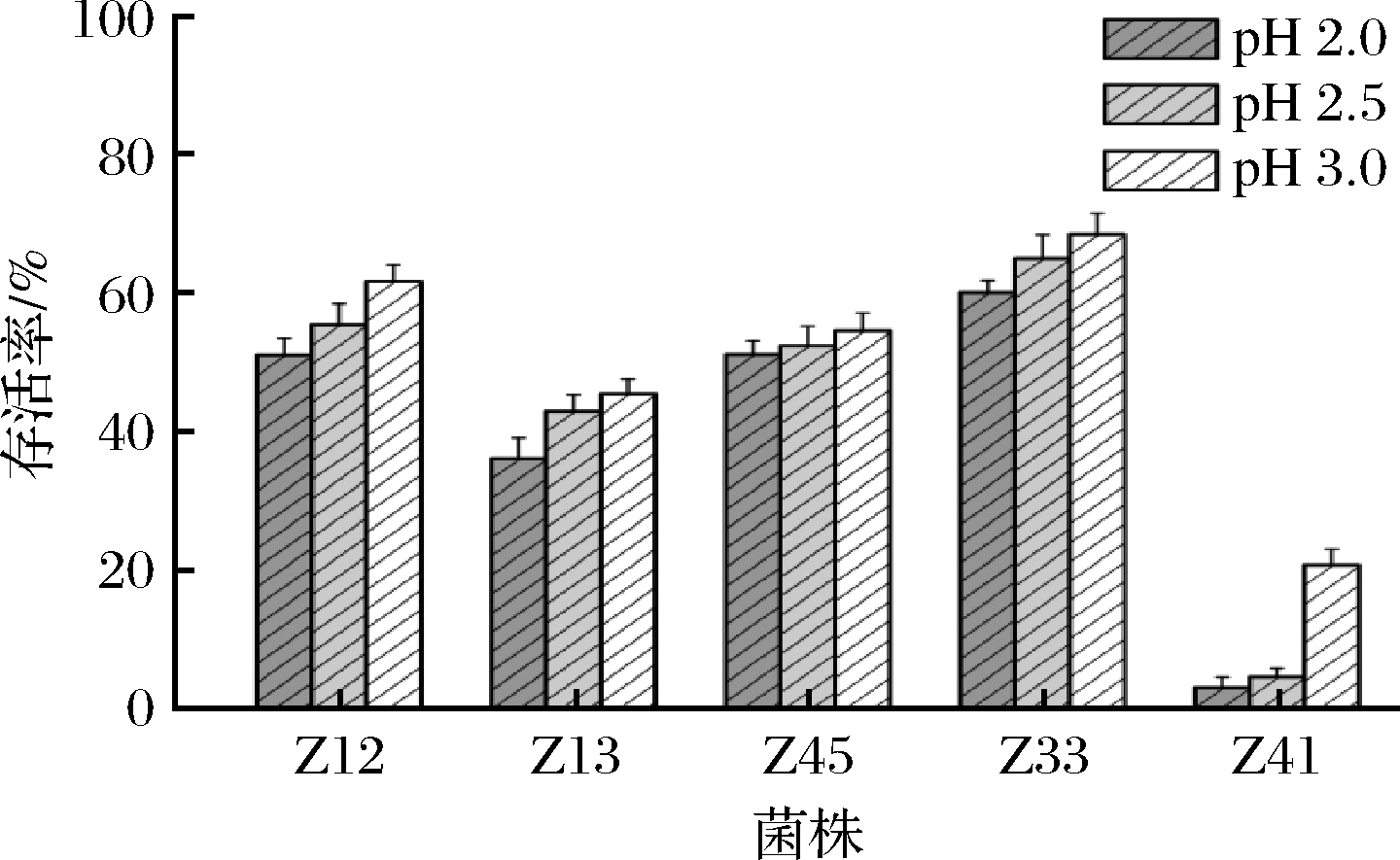
图5 乳酸菌在低pH中的存活率
Fig.5 The survival rate of lactic acid bacteria in low pH
2.5 乳酸菌的耐胆盐能力
乳酸菌要发挥其益生作用,必须要耐受肠道中高浓度胆盐环境,人体肠道中胆盐质量分数通常在0.03%~0.3%,胆盐会破坏乳酸菌细胞的细胞膜,使其失去活性。5株乳酸菌在0.1%~0.5%(质量分数)胆盐环境下的存活率见图6,随着胆盐浓度的增加,5株乳酸菌的生长均受到不同程度抑制,5株乳酸菌在胆盐质量分数为0.1%时存活率均超过30%,其中Z33菌株的存活率最高,达到45.22%。5株乳酸菌在胆盐质量分数为0.2%时存活率均超过20%,其中Z45菌株的存活率最高,为33.35%。胆盐质量分数为0.3%时,Z33、Z45、Z12菌株的存活率分别为20.43%、19.60%、14.81%,显著高于Z13、Z41菌株的存活率(P<0.05)。陈欢等[31]从传统奶酪分离出的8株乳酸菌在含0.3%和0.4%(质量分数)胆盐培养基中存活率均低于5%,本研究中Z12、Z45、Z33菌株在胆盐质量分数为0.5%的培养基中存活率仍高于10%,说明这3株乳酸菌具有较强的耐胆盐能力。
2.6 乳酸菌的黏附能力
乳酸菌要发挥其益生功能不仅要有耐受胃酸及肠道中胆盐的能力,还要具有肠道黏附能力,自凝聚率能反映乳酸菌对肠道上皮细胞的黏附能力,自凝聚率越高,乳酸菌附着在肠上皮细胞的能力就越强[32]。如图7所示,5株乳酸菌均显示出一定的自凝聚率,其中自凝聚率最高的是Z45菌株,达到30.90%,其次为Z12、Z33、Z13菌株,分别为30.84%、29.40%、25.29%,最低的是Z41菌株,仅为17.65%,Z12、Z45、Z33菌株的自凝聚率显著高于其余菌株(P<0.05),表明Z12、Z45、Z33菌株对肠上皮细胞黏附能力较强。DAS等[33]测定了分离自印度西海岸的3株乳酸菌处理3 h后的自凝聚率,为22.20%~25.00%,在本研究中植物乳杆菌Z12、副干酪乳杆菌Z33和Z45在处理3 h后自凝聚率均超过29%,表现出较高的自凝聚率。
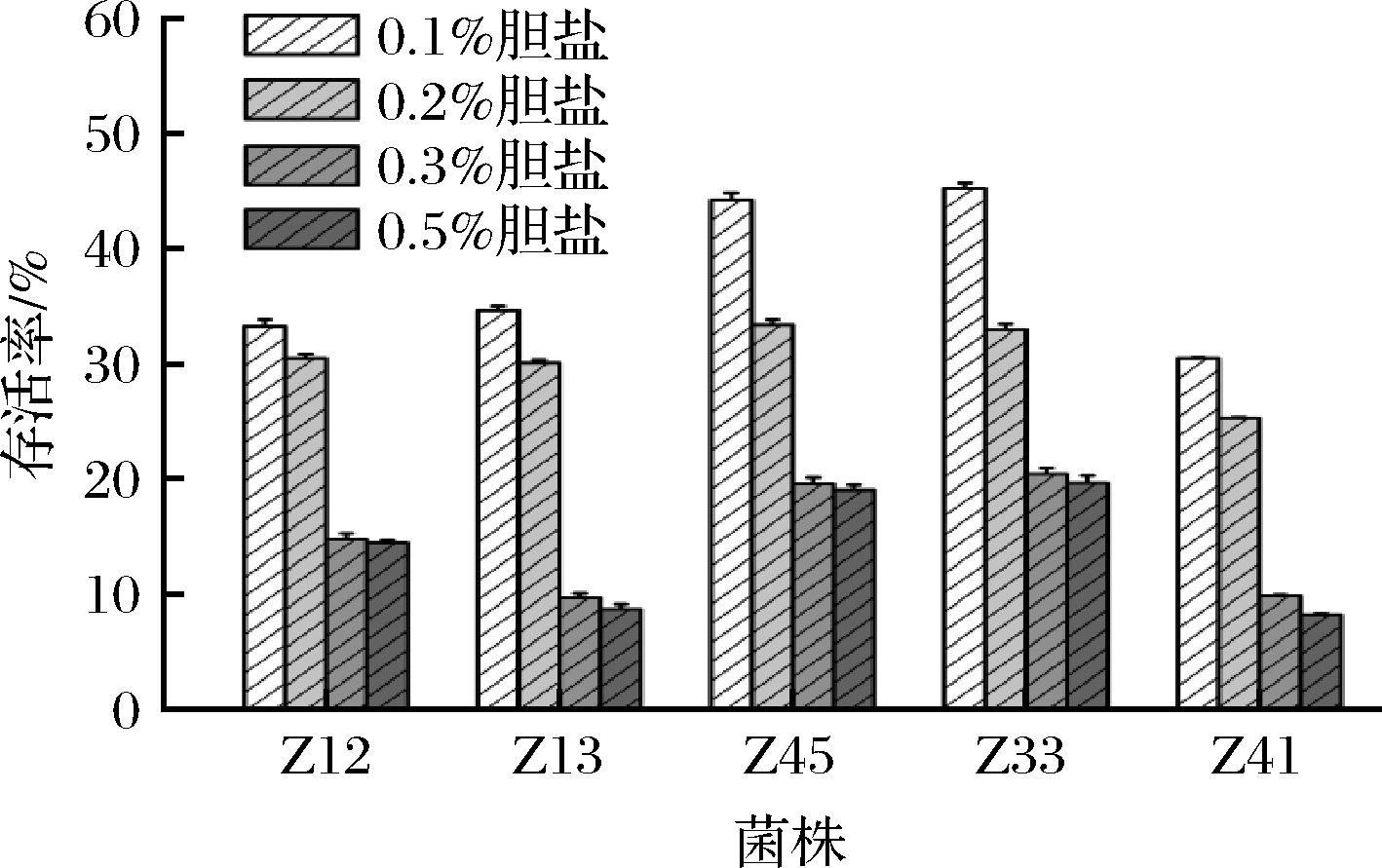
图6 乳酸菌在不同浓度胆盐中的存活率
Fig.6 The survival rate of lactic acid bacteria in different concentrations of bile salts

图7 乳酸菌的自凝聚能力
Fig.7 Auto-aggregation ability of lactic acid bacteria
3 结论与讨论
本研究从传统发酵浆水中分离纯化出120株乳酸菌,对其进行3个方面的抗氧化能力指标测定,经DPPH自由基清除能力初筛,得到10株DPPH自由基清除能力较强的乳酸菌,再经羟自由基、超氧阴离子自由基清除能力复筛,获得5株抗氧化能力较强的乳酸菌。经16S rDNA基因鉴定,5株乳酸菌分别为植物乳杆菌(Z12、Z13)、副干酪乳杆菌(Z33、Z45)和鼠李糖乳杆菌(Z41)。本实验筛选出的5株乳酸菌均为乳杆菌属,最近的研究表明乳杆菌的抗氧化能力受多方面因素影响,如产抗氧化活性物质能力、清除自由基能力和调节信号通路能力等[34]。部分乳杆菌可产生抗氧化活性物质,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)等抗氧化酶、硫氧还蛋白、谷胱甘肽等还原性物质,这些物质可将体内的ROS分解以减缓氧化应激造成的损伤。乳杆菌的自由基清除系统可以控制体内自由基的数量,避免由于自由基过多引起的细胞损伤。部分乳杆菌也可通过调控宿主细胞氧化应激相关信号通路发挥其抗氧化能力,如Nrf2通路。本研究结果显示不同乳杆菌的抗氧化能力有显著差异,同一乳杆菌对不同自由基的清除能力也不相同,对于乳杆菌的抗氧化机制仍需进一步研究。与其他来源的乳酸菌相比,从传统发酵浆水中筛选出的5株乳酸菌抗氧化能力较强,表明传统发酵浆水是筛选抗氧化乳酸菌的较好材料来源。对5株乳酸菌的益生特性研究表明,Z12、Z45、Z33菌株对低pH、高浓度胆盐均有较强的耐受性且自凝聚率较高,显著优于其余菌株,表明这3株乳酸菌具有良好的抗氧化能力和耐酸、耐胆盐及肠道黏附能力,具有在功能食品开发中的应用潜力。
[1] SALMINEN A, KAARNIRANTA K, KAUPPINEN A.Inflammaging:Disturbed interplay between autophagy and inflammasomes[J].Aging, 2012, 4(3):166-175.
[2] NOBARI H, SAEDMOCHESHI S, CHUNG L H, et al.An overview on how exercise with green tea consumption can prevent the production of reactive oxygen species and improve sports performance[J].International Journal of Environmental Research and Public Health, 2021, 19(1):218.
[3] OKTAVIANI L, ASTUTI D I, ROSMIATI M, et al.Fermentation of coffee pulp using indigenous lactic acid bacteria with simultaneous aeration to produce cascara with a high antioxidant activity[J].Heliyon, 2020, 6(7):e04462.
[4] KONG Y D, LI M, LI R M, et al.Evaluation of cholesterol lowering property and antibacterial activity of two potential lactic acid bacteria isolated from the intestine of snakehead fish (Channa argus)[J].Aquaculture Reports, 2020, 17:100342.
[5] SUN X Q, SHI J J, KONG L Y, et al.Recent insights into the hepatoprotective effects of lactic acid bacteria in alcoholic liver disease[J].Trends in Food Science &Technology, 2022, 125:91-99.
[6] SUZUKI H, JOUNAI K, OHSHIO K, et al.Administration of plasmacytoid dendritic cell-stimulative lactic acid bacteria enhances antigen-specific immune responses[J].Biochemical and Biophysical Research Communications, 2018, 503(3):1 315-1 321.
[7] 胡莹莹, 赵丽, 史力学, 等.浆水发酵中的优势乳酸菌分离鉴定[J].甘肃农业科技, 2021, 52(4):43-48.
HU Y Y, ZHAO L, SHI L X, et al.Isolation and identification of dominant lactic acid bacteria in fermented pickle juice[J].Gansu Agricultural Science and Technology, 2021, 52(4):43-48.
[8] 吴燕, 伏二伟, 桑学财, 等.传统浆水中乳酸菌的筛选及抑菌性能分析[J].食品研究与开发, 2019, 40(22):42-48.
WU Y, FU E W, SANG X C, et al.Isolation of lactic acid bacteria in Jiangshui celery and analysis of antimicrobial properties[J].Food Research and Development, 2019, 40(22):42-48.
[9] JUN Z, WU S S, LIHUA Z, et al.Culture-dependent and-independent analysis of bacterial community structure in Jiangshui, a traditional Chinese fermented vegetable food[J].LWT-Food Science and Technology, 2018, 96:244-250.
[10] 刘宏宇, 汪立平, 艾连中, 等.乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J].食品工业科技, 2014, 35(2):92-96;99.
LIU H Y, WANG L P, AI L Z, et al.Study on antioxidant activity and acid, bile salts tolerance of lactic acid bacteria[J].Science and Technology of Food Industry, 2014, 35(2):92-96;99.
[11] DE AMORIM TRINDADE D P, BARBOSA J P, MARTINS E M F, et al.Isolation and identification of lactic acid bacteria in fruit processing residues from the Brazilian Cerrado and its probiotic potential[J].Food Bioscience, 2022, 48:101739.
[12] TARIFA M C, PIQUERAS C M, GENOVESE D B, et al.Microencapsulation of Lactobacillus casei and Lactobacillus rhamnosus in pectin and pectin-inulin microgel particles:Effect on bacterial survival under storage conditions[J].International Journal of Biological Macromolecules, 2021, 179:457-465.
[13] 刘珊春. 传统发酵酸乳中抗氧化乳酸菌的筛选与功能评价[D].重庆:西南大学, 2017.
LIU S C.Screening and functional evaluating of anti-oxidative lactic acid bacteria in traditional fermented milk[D].Chongqing:Southwest University, 2017.
[14] 张书文. 抗氧化乳酸菌的筛选及其特性研究[D].呼和浩特:内蒙古农业大学, 2009.
ZHANG S W.Screening and study of lactic acid bacteria with antioxidative activity[D].Hohhot:Inner Mongolia Agricultural University, 2009.
[15] YU H S, JANG H J, LEE N K, et al.Evaluation of the probiotic characteristics and prophylactic potential of Weissella cibaria strains isolated from kimchi[J].LWT-Food Science and Technology, 2019, 112:108229.
[16] ANAZ M, SASIDHARAN N, REMAKANTHAN A, et al.ITS 2 and RNA secondary structure-based analysis reveals a clear picture on phylogeny of South Indian Salacia spp.[J].Computational Biology and Chemistry, 2021, 91:107438.
[17] 刘璐, 吴江丽, 杨金桃,等.发酵鱼酱酸产GABA乳酸菌的分离筛选及发酵特性[J].食品科学, 2021, 42(18):73-79.
LIU L, WU J L, YANG J T, et al.Isolation and fermentation characteristics of γ-aminobutyric acid-producing lactic acid bacteria from Yujiangsuan, a traditional Miao ethnic fermented condiment[J].Food Science, 2021, 42(18):73-79.
[18] 杨泽敏, 李双, 金正雨, 等.1株鲤鱼源植物乳杆菌的分离鉴定及其生物学特性分析[J].中国畜牧兽医, 2022, 49(7):2 805-2 811.
YANG Z M, LI S, JIN Z Y, et al.Isolation, identification and biological characteristics of a strain of Lactobacillus plantarum from carp[J].China Animal Husbandry &Veterinary Medicine, 2022, 49(7):2 805-2 811.
[19] 杨振泉, 靳彩娟, 张咪, 等.高粘附性戊糖片球菌的筛选、标记及其表面疏水与自凝聚性特征[J].食品与生物技术学报, 2015, 34(9):926-934.
YANG Z Q, JIN C J, ZHANG M, et al.Screening and molecular marking of highly adhesive Pediococcus pentosaceus and the characteristics of their surface hydrophobicities and autoaggregation abilities[J].Journal of Food Science and Biotechnology, 2015, 34(9):926-934.
[20] 李艳, 董振玲, 李佳, 等.羊羔美酒大曲中乳酸菌多样性及分子鉴定[J].食品科学, 2015, 36(13):167-171.
LI Y, DONG Z L, LI J, et al.Diversity and molecular biological identification of lactic acid bacteria from Yanggaomeijiu Daqu, a traditional Chinese liquor fermentation starter[J].Food Science, 2015, 36(13):167-171.
[21] 丁丽丽, 吕欣然, 高永悦, 等.鱼肠道中抗氧化活性乳酸菌的筛选及鉴定[J].食品科学, 2021, 42(10):127-132.
DING L L, LV X R, GAO Y Y, et al.Screening for and identification of lactic acid bacteria with antioxidant activity from the intestinal tract of fish[J].Food Science, 2021, 42(10):127-132.
[22] SANZANI S M, MONTEMURRO C, RIENZO V D, et al.Genetic structure and natural variation associated with host of origin in Penicillium expansum strains causing blue mould[J].International Journal of Food Microbiology, 2013, 165(2):111-120.
[23] 刘珊春, 赵欣, 李键, 等.高抗氧化乳酸菌的筛选鉴定[J].食品与发酵工业, 2017, 43(8):59-66.
LIU S C, ZHAO X, LI J, et al.Screening and identification of high antioxidant lactic acid bacteria[J].Food and Fermentation Industries, 2017, 43(8):59-66.
[24] 甘奕. 乳酸菌的特性研究及发酵山楂液对大鼠脂质代谢的影响[D].重庆:西南大学, 2019.
GAN Y.The characteristics of lactic acid bacteria and the effect of fermented hawthorn juice on the lipid metabolism of rats[D].Chongqing:Southwest University, 2019.
[25] 李丹丹, 蒋婷婷, 张炎, 等.高海拔地区传统牦牛酥油中抗氧化乳酸菌的筛选[J].食品与机械, 2020, 36(6):50-55.
LI D D, JIANG T T, ZHANG Y, et al.Screening of Lactobacillus with antioxidant properties from traditional yak ghee in high altitude area of Tibet[J].Food &Machinery, 2020, 36(6):50-55.
[26] 凌洁玉, 龚文秀, 包梦莹, 等.泡菜中乳酸菌的分离鉴定及其抗氧化能力的比较研究[J].中国调味品, 2015, 40(7):32-36.
LING J Y, GONG W X, BAO M Y, et al.Comparative study on isolation and identification of lactic acid bacteria from pickle and their antioxidant activity[J].China Condiment, 2015, 40(7):32-36.
[27] 王祎然, 韦明明, 张涵, 等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技, 2020, 41(16):121-126;139.
WANG Y R, WEI M M, ZHANG H, et al.Identification, acid and bile salt tolerance, and antioxidant ability of lactic acid bacteria isolated from sour soup[J].Science and Technology of Food Industry, 2020, 41(16):121-126;139.
[28] 杨郁, 罗伊丝, 刘小涛, 等.腌制雪菜中适用发酵乳生产的耐酸性乳酸菌的筛选[J].食品与发酵科技, 2016, 52(3):6-10.
YANG Y, LUO Y S, LIU X T, et al.Screening of acid-resisting Lactobacillus filling for fermented milk production from pickled potherb mustard[J].Food and Fermentation Technology, 2016, 52(3):6-10.
[29] 金成武, 杜林晓, 陈鑫, 等.泡菜中兼具耐酸性和亚硝酸盐分解活性的乳酸菌株的筛选和鉴定[J].中国调味品, 2018, 43(12):32-35;43.
JIN C W, DU L X, CHEN X, et al.Screening and identification of lactic acid bacteria capable of nitrite degradation and acid tolerance from pickles[J].China Condiment, 2018, 43(12):32-35;43.
[30] FADARE O S, SINGH V, ENABULELE O I, et al.In vitro evaluation of the synbiotic effect of probiotic Lactobacillus strains and garlic extract against Salmonella species[J].LWT, 2022, 153:112439.
[31] 陈欢, 王斌, 史学伟, 等.新疆哈萨克族传统奶酪中潜在益生乳酸菌的筛选[J].中国调味品, 2019, 44(12):50-54.
CHEN H, WANG B, SHI X W, et al.Screening of potential probiotic lactic acid bacteria in Xinjiang Kazak traditional cheese[J].China Condiment, 2019, 44(12):50-54.
[32] 加勒哈斯别克·塞力克, 孙昕, 阿曼古丽·杰木斯, 等.新疆传统发酵乳品中益生菌的益生特性[J].中国微生态学杂志, 2019, 31(5):502-508.
JIALEHASIBIEKE S, SUN X, AMANGULI J, et al.Probiotic characteristics of probiotics in Xinjiang traditional fermented dairy products[J].Chinese Journal of Microecology, 2019, 31(5):502-508.
[33] DAS P, KHOWALA S, BISWAS S.In vitro probiotic characterization of Lactobacillus casei isolated from marine samples[J].LWT-Food Science and Technology, 2016, 73:383-390.
[34] 赵彤, 钟宜科, 荀一萍,等.乳酸菌抗氧化性及其作用机制研究进展[J].中国食品添加剂, 2018(9):202-209.
ZHAO T, ZHONG Y K, XUN Y P, et al.Research progress on antioxidation and regulation mechanism of lactic acid bacteria[J].China Food Additives, 2018(9):202-209.