益生菌指对人体有益的微生物,目前市场上常见的益生菌例如乳杆菌一般以内用的方式发挥功效[1],随着研究的深入,有证据表明益生菌也可以在肠道以外的地方发挥作用[2]。KIM等[3]研究发现,植物乳杆菌K8裂解物可通过上调HaCaT细胞中透明质酸合成酶-2和水通道蛋白-3的表达来增强皮肤保湿活性。GUÉNICHE等[4]研究发现,益生菌裂解物可以显著抑制由神经元引起的降钙素基因相关肽(alcitonin gene-related peptide, CGRP)释放,促进敏感性皮肤恢复和屏障修复,说明裂解物可能通过降低神经元反应性和神经元可及性来降低皮肤敏感性。
一些外界的因素例如光照、化学刺激等会造成细胞活性氧(reactive oxygen species, ROS)的过度积累从而导致DNA损伤[5-6],这也是很多皮肤疾病产生的根本原因。过去的研究发现,益生菌具有清除ROS的潜力[7],但大多都是基于紫外线和H2O2刺激模型来研究细胞氧化应激调控,存在一定的局限性。十二烷基硫酸钠(sodium lauryl sulfate, SLS)是一种常见的阴离子表面活性剂,常存在于洗涤剂中,对皮肤也会产生刺激性,所以本研究建立SLS刺激模型[8]。作为天然来源的活性物质,益生菌溶胞物难以进行定向生物活性改良。有研究表明[9],在外源胁迫下,酵母菌胞内谷胱甘肽含量及抗氧化酶系活力显著上升,从而抵御该胁迫,这意味着胁迫环境有利于刺激益生菌的益生物质分泌,可能提升外用功效。因此本研究利用SLS胁迫黏膜乳杆菌 XWL,并探究其对受SLS刺激的HaCaT细胞的保护作用。
作为常用的化妆品原料,益生菌外用安全性受到广泛关注,这也是其研究和应用价值的前提。近年来,化妆品的安全性评价逐步由传统的动物实验过度到体外替代学测试[10],包括鸡胚绒毛尿囊膜(Hen′s egg test on the chorioallantoic membrane,HET-CAM)试验在内的越来越多的替代检测方法通过验证并为国际所认可。
本研究通过代谢组学分析1 mmol/L SLS胁迫对粘膜乳杆菌 XWL代谢的影响,判断其潜在功效,建立SLS诱导的细胞模型进行功效验证,同时结合安全性研究,旨在开发具有高抗氧化活性、高安全性、能够针对性解决表面活性剂刺激的益生菌原料,提升益生菌在外用护肤领域的应用前景。
1 材料与方法
1.1 材料与试剂
黏膜乳杆菌XWL(Lactobacillus mucosae XWL),保藏于武汉大学中国典型培养物保藏中心(CCTCC),菌株编号CCTCC M 2022551 XWL;总超氧化物歧化酶(superoxide dismutase,SOD)活力检测试剂盒、BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;HaCaT人永生化角质形成细胞,北纳创联生物技术有限公司;SLS,生工生物工程(上海)股份有限公司;DMEM高糖培养基、青霉素-链霉素双抗、胰蛋白酶溶液、PBS缓冲液,美国Hyclone公司;SPF白莱杭鸡受精鸡胚,北京梅里亚维通实验动物技术有限公司;鼠伤寒沙门氏菌组氨酸缺陷型菌株,美国Moltox公司;其余试剂均为AR级,上海国药集团。
1.2 仪器与设备
Tecan Infinite 200 Pro多功能酶标仪,Tecan;Thermo Vanquish UHPLC超高效液相色谱仪,Thermo Fisher Scientific;Q-Exactive HF质谱仪,Thermo Fisher Scientific。
1.3 试验方法
1.3.1 菌株培养和溶胞物制备
取适量活化的菌体在MRS液体培养基中培养12 h,以10%接种量将一级种子液接种到新鲜MRS液体培养基中继续培养12 h。培养完成后,8 000 r/min离心10 min去除培养基,将菌体沉淀用无菌的生理盐水洗涤2遍,用培养基1/5体积的生理盐水重悬菌体。将重悬的菌80 MPa高压均质破壁3个循环,8 000 r/min离心10 min,0.22 μm滤膜过滤,取过滤清液,得到菌体溶胞物,-20 ℃保存备用。
胁迫处理的乳杆菌需将一级种子液接种到含有1 mmol/L SLS的MRS培养基中继续培养12 h,后续操作同上。
1.3.2 DPPH自由基清除活性检测
将6.0 mg DPPH溶于10 mL的无水甲醇,稀释5倍制得0.3 mmol/L的DPPH溶液。在96孔板中加入100 μL待测溶胞物并于517 nm处测得吸光度Ab,再加入100 μL上述DPPH溶液,反应30 min后再次测定,记为As。去离子水为空白组,两次操作的吸光值分别为Acb和Ac。按公式(1)计算DPPH的清除率:
DPPH清除率![]()
(1)
1.3.3 ABTS阳离子自由基清除活性检测
将6.6 mg过硫酸钾溶解于10 mL去离子水中,制得2.45 mmol/L的过硫酸钾溶液;精确称取7.7 mg ABTS溶于2 mL过硫酸钾溶液,反应16 h制得母液。反应结束后将母液用去离子水在734 nm处调整为吸光度为0.9的ABTS阳离子工作液。在96孔板中加入50 μL待测溶胞物后加入150 μL ABTS阳离子工作液,反应10 min,检测734 nm处吸光度A1。去离子水为空白组,其反应后吸光度为Ac。ABTS阳离子自由基的清除率如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
1.3.4 总SOD活力测试
按照1.3.1培养各个菌株,将收集到的菌体沉淀用样品裂解液充分裂解,离心取上清液,再按照试剂盒的步骤进行总SOD活力测试,并用BCA试剂盒测定个样品蛋白含量。37 ℃反应30 min后在450 nm下测定吸光度,样品的总SOD活力计算如公式(3)、公式(4)所示:
SOD抑制率![]()
(3)
SOD活力/(U·mg-1)=
(4)
式中:Ab1为空白对照组1吸光度;As2为样品组吸光度;Ab2为空白对照组2吸光度;V为样品体积,mL;Cpr为蛋白质质量浓度,mg/mL。
1.3.5 样品处理及LC/MS分析
参考王宇航[11]的方法,向培养结束的发酵液中加入预冷的20%(体积分数)甲醇和0.9%(质量分数)NaCl,10 min后低温离心去除上清液。将淬灭剂与0.9% NaCl溶液按体积比4∶1混合,用其洗涤菌体后再次离心。利用V(乙腈)∶V(甲醇)∶V(水)=2∶2∶1的混合液提取菌体,于液氮中反复冻融后离心取上清液。利用LC-MS对胁迫前后菌株溶胞物进行非靶向代谢物分析,同时取等量体积的各个样品提取液混合组成质控样品(quality control,QC)。
色谱分离条件:柱温30 ℃;流速0.3 mL/min;流动相组成A:水+0.1%甲酸,B:纯乙腈;进样量为2 μL,自动进样器温度4 ℃。质谱条件:加热电喷雾离子源(HESI);质谱扫描范围100~1 500 m/z;扫描速度1 000 Da/s;喷雾电压3.50 kV;离子传输管温度330 ℃;加热器温度325 ℃。
1.3.6 生物信息学分析
使用Compound Discoverer 3.1处理数据并利用数据库等进行鉴定(Thermo mz Cloud;Thermo mz Valut;ChemSpider)。差异代谢物筛选标准为将倍数变化(fold change,FC)取以2为底的对数,选取|log2(FC)|≥1的代谢物,差异为2倍以上或0.5以下的代谢物则差异显著;使用t-检验假设检验选取P<0.05的代谢物;同时正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型第一主成分的变量投影重要度(variable importance in the projection, VIP)>0。
利用KEGG数据库对筛选出的差异代谢物进行注释,利用MetaboAnalystR[12]进行KEGG通路富集。
1.3.7 细胞培养及细胞毒性测定
HaCaT细胞生长于DMEM完全培养基(10%胎牛血清及1%双抗)中,在37 ℃,5%(体积分数)CO2,饱和湿度下培养。细胞长满后以1×105 个/mL的密度接种在96孔板中培养24 h后用PBS漂洗2~3遍,加入待测样品。12 h后去液,用PBS漂洗2次后,每孔加入100 μL用DMEM配制的0.5 g/mL的噻唑蓝溶液,放入培养箱4 h后每个孔添加100 μL二甲基亚砜,并用酶标仪在490 nm处测量吸光值,计算细胞活力。
1.3.8 ROS含量测定
按1.3.7所述方法培养细胞,以104 个/孔接种于黑壁透明底的96孔板中,24 h后,分别加入用DMEM配制的体积分数为10%、20%、30%、40%的黏膜乳杆菌 XWL溶胞物(LM)和SLS胁迫培养的黏膜乳杆菌XWL溶胞物(LM+)继续培养12 h后PBS洗涤,再加入100 μL用DMEM配制的25 μg/mL SLS刺激4 h。4 h后用PBS洗涤,加入20 μmol/L活性氧荧光探针溶液并在培养箱中孵育30 min,去液洗涤后加入0.6 mmol/L的偶氮二异丁基脒(Hank缓冲液配制)。避光反应1 h后用荧光酶标仪检测,发射波长485 nm,激发波长535 nm,增益70。同时设置对照组(正常生长细胞)和损伤组(仅用SLS刺激)。
1.3.9 鸡胚绒毛尿囊膜试验测定眼刺激性
将殷庆飞等[13]的方法进行略微修改,受精鸡胚置于恒温恒湿培养箱中(37 ℃, 70%相对湿度)下培养9 d,每日轻轻翻动鸡胚5~6次。将发育完成的鸡胚进行用灭菌弯头镊打开气室,用1 mL生理盐水润湿后去除内膜,保证血管的完整性。将100 μL受试样品滴加于尿囊膜表面后开始计时,观察5 min内的血管变化并拍照记录。同时设置对照组(0.9% NaCl溶液,阴性对照;0.1 mol/L NaOH溶液,1.0% SLS溶液,阳性对照),每组设置6次平行。刺激评分(irritation score,IS)计算如公式(5)所示:
![]()
(5)
式中:tH,出血平均用时,s;tL,血管溶解平均用时,s;tC,凝血平均用时,s;其中,IS<1表示无刺激性;1≤IS<5表示轻度刺激;5≤IS<9为重度刺激;IS≥9表示强刺激性。
1.3.10 Ames试验
选择经鉴定且符合标准的组氨酸缺陷型的5种(TA97a、TA98、TA100、TA102、TA1535)鼠伤寒沙门氏菌株,评估受试样品对缺陷型菌株的恢复或补偿能力从而初步判断其致突变性[14]。每皿设50、25、12.5、6.25 μL 4个浓度梯度,0.22 μm滤膜除菌。采用平板掺入法,在2 mL保温的顶层培养基中依次加入受试样品及0.1 mL新鲜菌液,混匀后迅速倒入凝固的底层培养基,37 ℃恒温培养箱静置培养48 h后观察菌落生长情况。根据我国《化妆品安全技术规范》,设置空白对照组及阳性对照组,每个样品设置3次平行。
2 结果与分析
2.1 菌株的筛选及胁迫
2.1.1 不同菌株的体外抗氧化能力
如图1-a所示,5种乳杆菌的DPPH自由基清除能力排序为发酵乳杆菌(58.32%)>黏膜乳杆菌(52.20%)>德氏乳杆菌(45.66%)>嗜酸乳杆菌(45.12%)>植物乳杆菌(18.81%)。由图1-b可知,5种乳杆菌ABTS阳离子自由基清除能力排序为黏膜乳杆菌(100.00%)>德氏乳杆菌(98.97%)>植物乳杆菌(66.55%)>嗜酸乳杆菌(65.88%)>发酵乳杆菌(62.69%)。
SOD具有良好的清除自由基的功效,因此SOD活力是评价机体抗氧化能力的重要指标之一。图1-c 5种乳杆菌的SOD活力排序分别为植物乳杆菌(606.13 U/mg)>嗜酸乳杆菌(586.81 U/mg)>黏膜乳杆菌(437.91 U/mg)>德氏乳杆菌(327.71 U/mg)>发酵乳杆菌(135.62 U/mg)。
虽然黏膜乳杆菌的DPPH自由基清除率以及SOD活力并非最强,但综合上述3个抗氧化指标,黏膜乳杆菌的综合抗氧化能力最优异,具有较大的应用前景,因此选用该菌株继续开展后续研究。
2.1.2 不同浓度SLS对菌株生长的影响
如图2-a所示,随着SLS胁迫浓度增加,黏膜乳杆菌 XWL的相对生长率逐渐降低。在保证一定相对生长率的同时,应尽可能选浓度更高的胁迫条件从而达到更好的改良效果,因此选用培养基中SLS浓度1 mmol/L作为改良黏膜乳杆菌 XWL胁迫浓度。
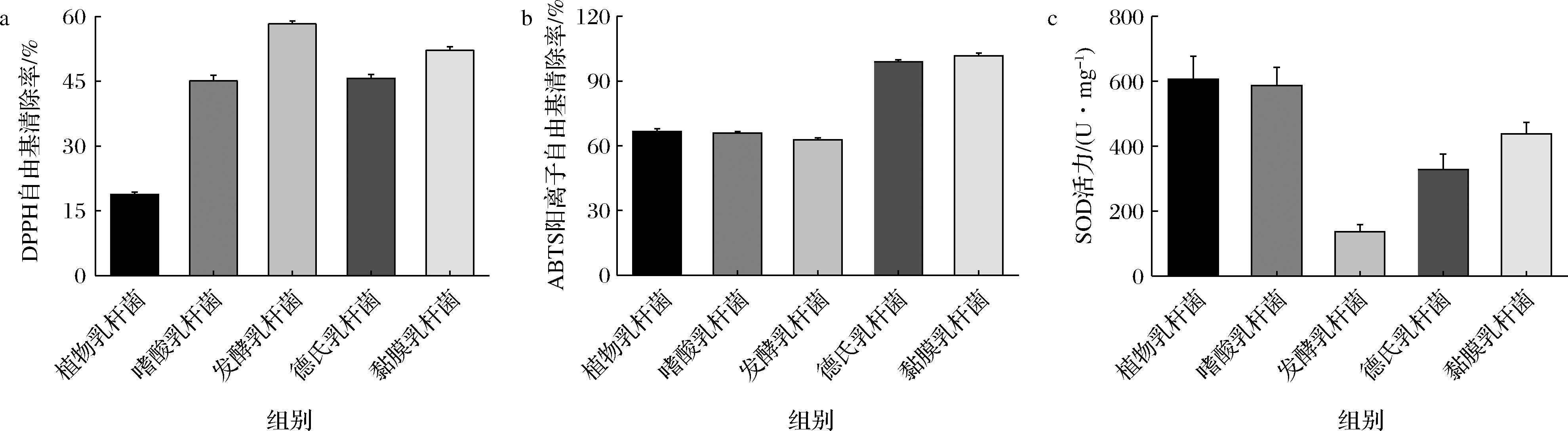
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-SOD活力
图1 不同乳杆菌体外抗氧化能力
Fig.1 Antioxidant capacities of different lactobacillus
如图2-b所示,两种培养条件下的菌株表现出相同的生长趋势,均在12 h左右达到饱和菌体量,此时未经胁迫培养的菌株OD600=5.22±0.16,暴露在1 mmol/L SLS环境下的菌株OD600=3.16±0.10。

a-存活率;b-生长曲线
图2 SLS胁迫浓度的筛选及生长曲线测定
Fig.2 Screening the concentration of SLS and measuring the growth curve
2.2 LM和LM+的代谢组学分析
2.2.1 主成分分析
利用主成分分析法,将一组观测的可能相关变量,通过正交变换转换为线性不相关变量(即主成分),用于观察实验模型中的组间分离趋势。如图3所示,LM和LM+组内样品距离较近,主成分相似,说明结果重复性好,模型可靠。两组样品组间差异较大,说明SLS胁迫对黏膜乳杆菌XWL的代谢起调控作用。
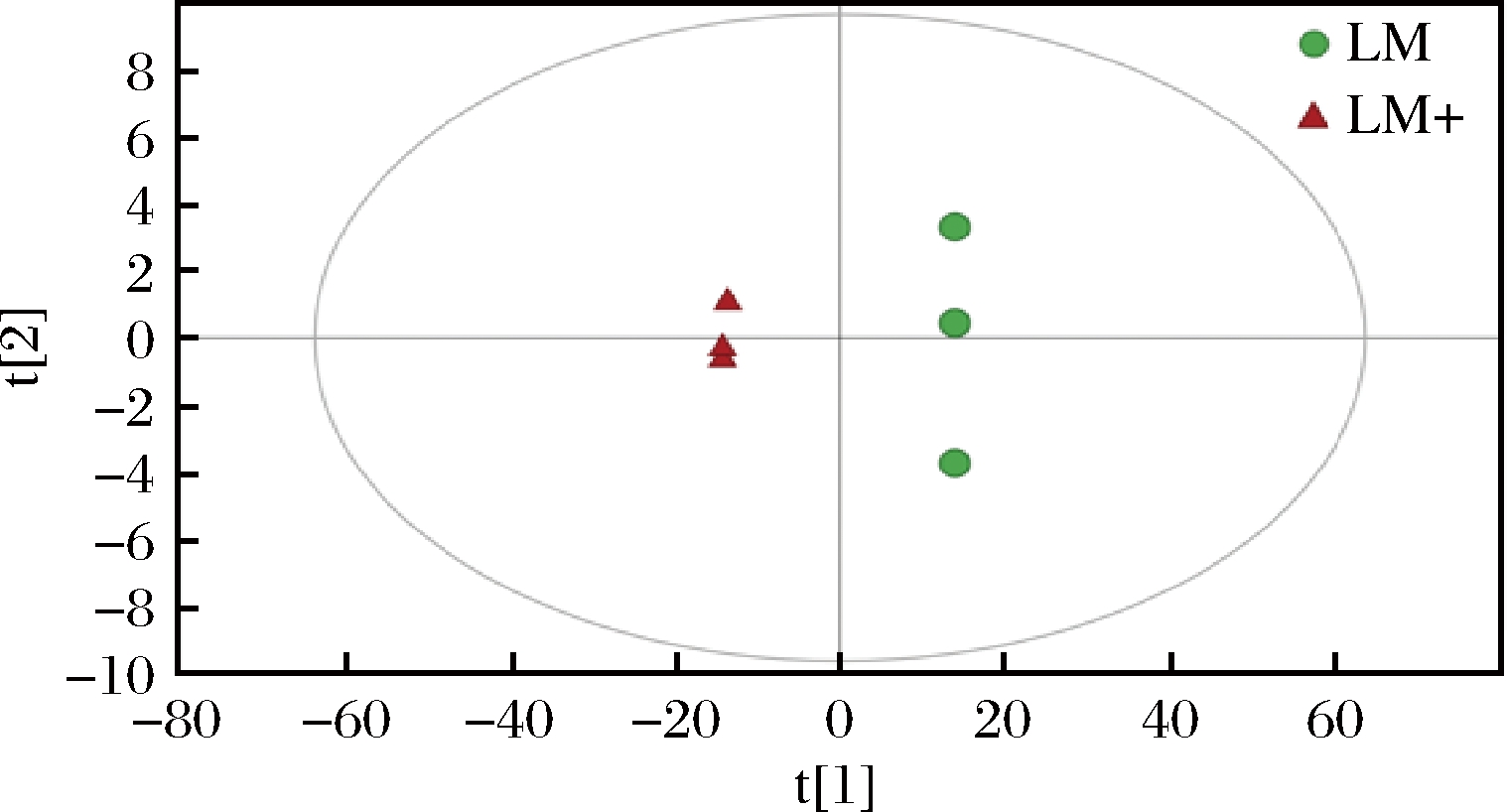
图3 LM和LM+的主成分分析
Fig.3 Principal component analysis of LM and LM+
2.2.2 差异代谢物的筛选
共筛选出差异代谢物192种,其中63种表现出上调,129种表现出下降。筛选出的所有差异代谢物的分布情况如图4所示,与LM相比,LM+中代谢物表达水平发生了显著的变化。为了进一步探究SLS胁迫对菌株抗氧化能力的影响,将差异代谢物中与抗氧化相关的重要物质进行筛选分析。表1列举了部分具有保护修复功效及氧化应激相关且存在显著性差异表达的代谢物,该结果证明相比于LM,LM+中益生物质的含量显著上升(log2FC>1),而刺激性物质含量有所下降(log2FC<-1)。
2.2.3 差异代谢物KEGG功能注释
对筛选出的差异代谢产物进行KEGG代谢通路富集分析,从而判断SLS胁迫对菌株代谢通路的影响。如图5所示,共富集28条差异代谢通路,涉及到能量代谢、脂质代谢、氨基酸代谢、辅酶因子和维生素代谢、转运系统等几大类,还包括氨酰-tRNA生物合成等。由此可知,黏膜乳杆菌 XWL通过调节上述通路来抵抗SLS的胁迫。

图4 LM和LM+差异代谢物分布火山图
Fig.4 Volcano plot of significantly differential metabolites between LM and LM+
注:红色点表示上调代谢物,绿色点表示下调代谢物,灰色 表示无显著性差异的代谢物;横坐标表示倍数变化(取以2为底 的对数),纵坐标表示P值(取以10为底的对数);点大小代表 OPLS-DA模型的VIP值,散点越大VIP值越大,筛选得到的差异 表达代谢物越可靠
表1 氧化应激相关的主要代谢物
Table 1 Main metabolites related to oxidative stress
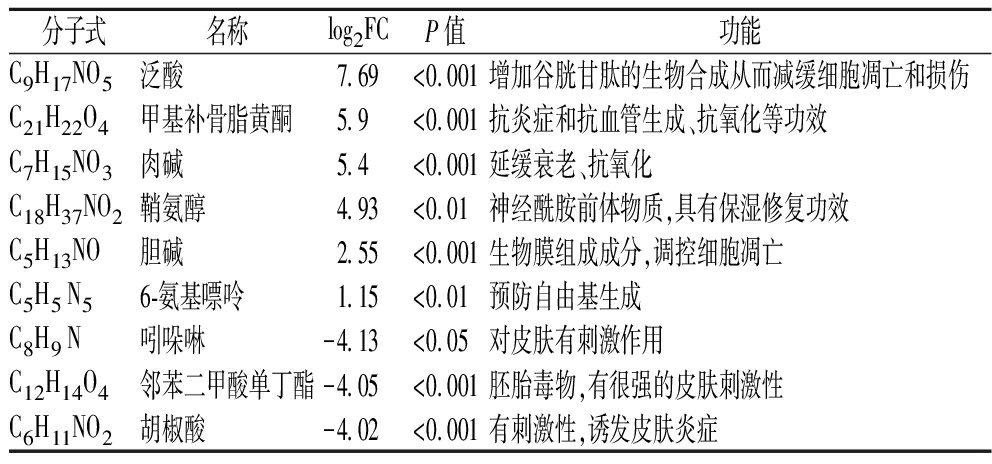
分子式名称log2FCP值功能C9H17NO5泛酸7.69<0.001增加谷胱甘肽的生物合成从而减缓细胞凋亡和损伤C21H22O4甲基补骨脂黄酮5.9<0.001抗炎症和抗血管生成、抗氧化等功效C7H15NO3肉碱5.4<0.001延缓衰老、抗氧化C18H37NO2鞘氨醇4.93<0.01神经酰胺前体物质,具有保湿修复功效C5H13NO胆碱2.55<0.001生物膜组成成分,调控细胞凋亡C5H5 N56-氨基嘌呤1.15<0.01预防自由基生成C8H9 N吲哚啉-4.13<0.05对皮肤有刺激作用C12H14O4邻苯二甲酸单丁酯-4.05<0.001胚胎毒物,有很强的皮肤刺激性C6H11NO2胡椒酸-4.02<0.001有刺激性,诱发皮肤炎症

图5 差异代谢物KEGG富集分析
Fig.5 KEGG enrichment analysis of differential metabolite
注:散点大小代表该通路差异代谢物的数量;颜色代表P值(取以 10为底的对数);横坐标富集倍数为差异代谢物在通路中的比例 和所有代谢物在通路中的比例的比值,该值越大表示富集程度越大
2.3 LM和LM+对HaCaT细胞毒性作用
LM和LM+对HaCaT细胞的活力影响如图6所示,体积分数在30%以下的LM和LM+处理的HaCaT细胞存活率与正常条件下的细胞相比均无显著性差异,表明该浓度的两种溶胞物均对HaCaT细胞没有细胞毒性。在两种样品添加量达到40%时,细胞存活率仍达到85%以上,可视为安全添加量。当溶胞物添加量达到50%以上时,两种溶胞物对细胞均表现出明显的毒性,其中,LM+毒性显著低于LM。当溶胞物含量为70%时,经LM处理的细胞基本全部死亡,而LM+作用的细胞却依旧保持60%以上的存活率。该结果表明经过胁迫,胞内更多益生物质的分泌导致LM+在高浓度(≥50%)下对HaCaT细胞的毒性降低。
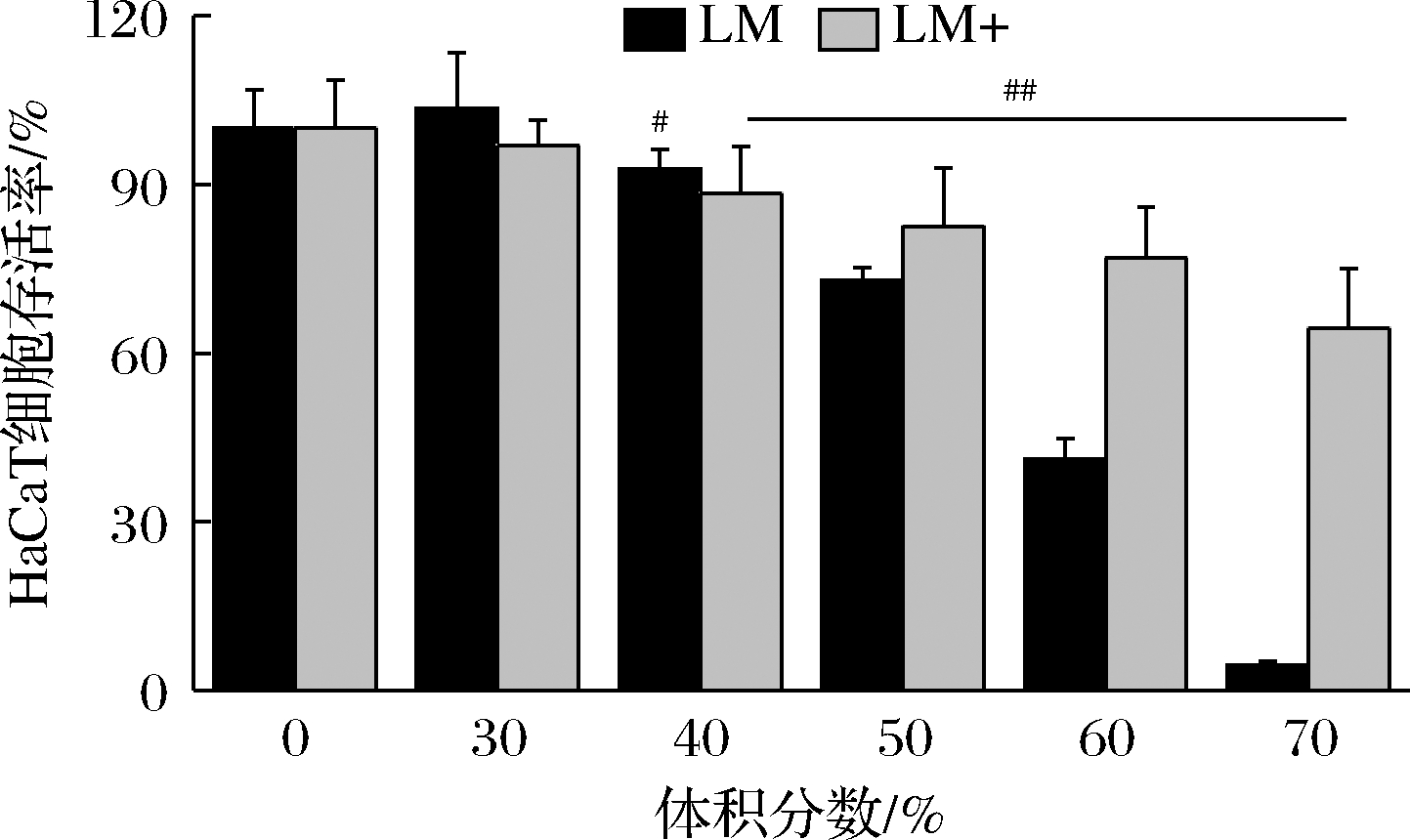
图6 不同浓度下的LM和LM+对HaCaT细胞生长的影响
Fig.6 The survival effects of LM and LM+ at different concentrations on HaCaT cells
注:与对照组相比,#表示显著差异(P<0.05), ##表示极显著差异 (P<0.01)(下同)
2.4 对SLS诱导的HaCaT细胞内ROS含量的影响
氧化应激是指由于生物化学反应、有害物质刺激或内源能力有限而诱导的ROS大幅度积累并导致细胞内抗氧化剂系统失衡[15-17]。ROS升高会造成炎症反应过度活化从而导致组织损伤,还会引起细胞内DNA的损伤[18]。如图7所示,经过SLS刺激的HaCaT细胞ROS含量发生了显著变化(P<0.01),上升59.91%。体积分数为30%和40%的LM预处理会使受到SLS诱导的细胞ROS含量分别下降6.52%和10.63%,10%及20%的LM反而会引起ROS含量上升。而LM+在4种添加量下对SLS诱导的HaCaT细胞ROS有显著清除效果,分别为9.63%,21.36%,24.58%和33.35%。该结果表明LM在体积分数为30%和40%时能够降低细胞中ROS含量,而LM+在10%~40%时均能够通过清除ROS降低细胞的氧化应激反应来保护细胞。
这一结果对应了上述代谢组学分析。在1 mmol/L的SLS胁迫下,黏膜乳杆菌 XWL胞内抗氧化物质等含量有了显著上升,从而其使抗氧化应激能力明显增强。

图7 不同浓度LM和LM+对荧光强度的影响
Fig.7 Effect of different concentrations of LM and LM+ on fluorescence intensity
注:与损伤组相比,*表示显著差异(P<0.05),**表示极显著 (P<0.01)
2.5 安全性评价
2.5.1 HET-CAM试验
实验结果如图8及表2所示,空白对照组0.9% NaCl无刺激性(IS<1),阳性对照组1.0% SLS及0.1 mol/L NaOH溶液均表现出强刺激性(IS>10),说明本次试验有效。鸡胚在10%~40%体积分数的两种样品作用下,轮廓清晰,无出血、血管融解、凝血现象,IS值均<1,可认为两组样品在该浓度范围内对鸡胚没有刺激性。

图8 HET-CAM试验
Fig.8 HET-CAM assay
2.5.2 致突变性测定
实验结果如表3所示,在阳性对照物的作用下,5种缺陷型鼠伤寒杆菌回变菌落数发生显著性变化,均超过空白对照组的2倍以上。而2种溶胞物在4个浓度下均未使回变菌落数有明显上升,可判定其不存在致突变性。
表2 HET-CAM试验结果
Table 2 The result of HET-CAM assay

组别出血血管溶解凝血刺激评分LM 10%///0LM 20%///0LM 30%///0LM 40%///0LM+10%///0LM+20%///0LM+30%///0LM+40%///00.9% NaCl///01.0% SLS204024012.600.1 mol/L NaOH52015015.77
注:/ 表示无该现象发生
表3 Ames试验结果(n=3)
Table 3 The result of Ames assay (n=3)

组别回变菌落数TA97aTA98TA100TA102TA153550 μL/皿85.00±7.8738.00±3.56135.33±7.41227.33±13.4730.67±2.87LM25 μL/皿93.67±9.4634.67±0.94141.33±6.94245.67±11.9034.00±1.6312.5 μL/皿78.67±5.4434.33±3.30126.67±4.78257.00±3.7435.33±2.056.25 μL/皿90.33±2.3631.67±1.89140.67±3.40235.00±7.8727.67±2.8750 μL/皿77.00±8.6033.67±2.49128.00±6.16233.67±16.7630.67±1.70LM+25 μL/皿96.33±4.6434.67±2.05139.33±8.73229.67±12.6629.33±1.8912.5 μL/皿93.33±2.0533.00±2.16140.33±13.10257.33±3.8633.00±2.166.25 μL/皿89.33±8.6540.67±5.25134.00±8.64249.00±11.2233.67±2.05对照组空白对照84.67±3.3040.67±5.25134.67±6.85240.67±20.5332.67±2.05阳性对照2 394.67±72.471 752.00±137.64466.00±28.651 206.67±121.21209.33±8.65
3 结论与讨论
益生菌作为自然界广泛存在的物质,其潜在护肤功效相较于人工合成原料更加突出且多元化,但目前为止,很少有研究报道黏膜乳杆菌在化妆品中的应用。
本研究首先在5株乳杆菌中筛选出抗氧化活性最强的黏膜乳杆菌 XWL,代谢组学结果证明SLS胁迫使黏膜乳杆菌 XWL的代谢物和代谢通路产生明显差异。代谢物中泛酸、黄酮类等物质含量显著上升,这物质已被证明具有良好的抗氧化作用,对多种皮肤问题具有缓解效果[19-20],而吲哚琳等对皮肤有刺激性的成分分泌量减少,说明该胁迫提升了菌株的益生潜力。在细胞内的进一步验证发现,SLS胁迫使黏膜乳杆菌 XWL溶胞物在高浓度时的细胞毒性显著降低,提升了益生菌应用时的安全浓度。同时,对SLS诱导的氧化应激产生的ROS清除效果显著上升,说明胁迫使菌株抗氧化能力有所提高,再一次印证了代谢组学的结果。安全性试验的结果也表明LM和LM+在体积分数40%以内时外用无对鸡胚的刺激性和对组氨酸缺陷型的5种(TA97a、TA98、TA100、TA102、TA1535)鼠伤寒沙门氏菌株的致突变性,是潜在的护肤品原料。综上,本研究筛选出了一株全新的具有高抗氧化能力的益生菌,并首次应用SLS进行胁迫提升其外用功效,结合代谢组学进行分析并在细胞中进一步验证,为益生菌在外用护肤领域的进一步应用提供了新的思路。
[1] AL-GHAZZEWI F H, TESTER R F.Impact of prebiotics and probiotics on skin health[J]. Beneficial Microbes,2014, 5(2):99-107.
[2] 吴佳慧, 纪瑞, 谭俊, 等.益生菌对皮肤健康的影响及其作用机制研究[J].工业微生物, 2018, 48(5):13-18.
WU J H, JI R, TAN J, et al.Effects of probiotics on skin health and its mechanisms[J].Industrial Microbiology, 2018, 48(5):13-18.
[3] KIM H, JEON B, KIM W J, et al.Effect of paraprobiotic prepared from Kimchi-derived Lactobacillus plantarum K8 on skin moisturizing activity in human keratinocyte[J].Journal of Functional Foods, 2020, 75:104244.
[4] GUÉNICHE A, BASTIEN P, OVIGNE J M, et al.Bifidobacterium longum lysate, a new ingredient for reactive skin[J]. Experimental Dermatology, 2010, 19(8):e1-e8.
[5] DIZDAROGLU M, JARUGA P.Mechanisms of free radical-induced damage to DNA[J].Free Radical Research, 2012, 46(4):382-419.
[6] PARK S, KIM K, BAE I H, et al.TIMP3 is a CLOCK-dependent diurnal gene that inhibits the expression of UVB-induced inflammatory cytokines in human keratinocytes[J].FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2018, 32(3):1 510-1 523.
[7] MAJEED M, MAJEED S, NAGABHUSHANAM K, et al.Skin protective activity of LactoSporin-the extracellular metabolite from Bacillus coagulans MTCC 5856[J].Cosmetics, 2020, 7(4):76.
[8] 周利丹, 卢伊娜, 王新亮, 等.复合植物提取物对皮肤刺激的舒缓作用研究[J].中国美容医学, 2022, 31(11):112-117.
ZHOU L D, LU Y N, WANG X L, et al. Study on the soothing effect of compound plant extracts on skin irritation[J]. Chinese Journal of Aesthetic Medicine, 2022, 31(11):112-117.
[9] 王定康, 张敏, 黄钧, 等.盐胁迫对鲁氏酵母菌生理特性的影响[J].食品科学技术学报, 2019, 37(4):35-41.
WANG D K, ZHANG M, HUANG J, et al.Effect of salt stress on physiological characterization of Zygosacchromyces rouxii[J].Journal of Food Science and Technology, 2019, 37(4):35-41.
[10] 刘颖. 国内化妆品安全性评价体系现况及分析[J].广东化工, 2021, 48(12):103-104.
LIU Y.Status and analysis of domestic cosmetics safety evaluation system[J].Guangdong Chemical Industry, 2021, 48(12):103-104.
[11] 王宇航. 两种农药对谷皮菱形藻(Nitzschia palea)毒理效应及代谢影响的研究[D].哈尔滨:哈尔滨师范大学, 2021.
WANG Y H. Study on toxicological effects and metabolic effects of two pesticides on Nitzschia palea[D]. Harbin: Harbin Normal University, 2021.
[12] CHONG J, XIA J G.MetaboAnalystR:An R package for flexible and reproducible analysis of metabolomics data[J].Bioinformatics, 2018, 34(24):4 313-4 314.
[13] 殷庆飞, 陈媛祺, 郭奕光, 等.TRPV1受体稳转细胞株构建及化妆品原料致痛性评价[J].毒理学杂志, 2021, 35(3):255-261.
YIN Q F, CHEN Y Q, GUO Y G, et al. Construction of TRPV1 receptor stably transformed cell line and evaluation of the pain of cosmetic raw materials[J]. Journal of Toxicology, 2021, 35(3):255-261.
[14] 江漪, 吴剑辉, 朱素珍,等.178件染发类化妆品细菌回复突变试验结果分析[J].癌变·畸变·突变, 2022, 34(5):384-387.
JIANG Y, WU J H, ZHU S Z, et al. Analysis of bacterial recovery mutation test results of 178 pieces of hair dye cosmetics[J]. Carcinogenesis, Teratogenesis &Mutagenesis, 2022, 34(5):384-387.
[15] BICKERS D R, ATHAR M.Oxidative stress in the pathogenesis of skin disease[J].Journal of Investigative Dermatology, 2006, 126(12):2 565-2 575.
[16] FRANCO R, S NCHEZ-OLEA R, REYES-REYES E M, et al.Environmental toxicity, oxidative stress and apoptosis:Ménage à trois[J].Mutation Research, 2009, 674(1-2):3-22.
NCHEZ-OLEA R, REYES-REYES E M, et al.Environmental toxicity, oxidative stress and apoptosis:Ménage à trois[J].Mutation Research, 2009, 674(1-2):3-22.
[17] HODJAT M, REZVANFAR M A, ABDOLLAHI M, et al.A systematic review on the role of environmental toxicants in stem cells aging[J].Food and Chemical Toxicology, 2015, 86:298-308.
[18] MITTAL M, SIDDIQUI M R, TRAN K, et al.Reactive oxygen species in inflammation and tissue injury[J]. Antioxidants &Redox Signaling, 2014, 20(7):1 126-1 167.
[19] 李青仁, 王月梅, 丁雪飞. 维生素的护肤功效与应用[J]. 日用化学品科学, 2007, 30(1):16-17; 30.
LI Q R, WANG Y M, DING X F. Effect and application of vitamin in skin care[J]. Detergent &Cosmetics, 2007, 30(1):16-17; 30.
[20] 王忠雷, 杨丽燕, 张小华, 等.中药黄酮类抗氧化活性成分研究进展[J].世界科学技术-中医药现代化, 2013, 15(3):551-554.
WANG Z L, YANG L Y, ZHANG X H, et al. Research progress of flavonoids with antioxidant activity constituents from Chinese materia medica[J]. Modernization of Traditional Chinese Medicine and Materia Materia-World Science and Technology, 2013, 15(3):551-554.