核黄素又称维生素B2,是人体必需的13种维生素之一,是维持人和动物机体正常物质代谢所必须的营养物质。由于动物和人缺少内源性核黄素生成途径,需要从外界补充适量的核黄素,因而,核黄素被世界卫生组织列为评价人体生长发育和营养状况的六大指标之一[1]。在医疗方面,核黄素常被用作辅助药物用于多种疾病的治疗[2];在食品工业方面,通常作为色素和营养添加剂;在畜牧业方面,作为饲料添加剂可避免禽畜生长滞后及腹泻等症状[3]。
目前,工业生产核黄素的方法已经完全由化学合成法和半化学合成法转为微生物发酵法。培养基作为微生物发酵法中关键的一部分,对微生物的生长代谢影响巨大。而金属离子作为培养基中的重要成分,参与细胞中多种生化反应,其具体功能表现为金属离子的多功能性,如在异型乳酸发酵中,Mn2+、Mg2+是多个关键酶的辅酶因子[4];金属离子的不可或缺性,如Mg2+在5×10-3~10×10-3 mol/L的浓度下可激活NADH+合酶,但在低于或不添加Mg2+的情况下NADH+合酶就无法激活;金属离子之间的相互取代,如Mn2+离子可以取代Mg2+激活的激酶[4];金属离子之间的相互抑制,如Fe2+会抑制Mn2+和Co2+的吸收等[5]。磷酸吡哆醛(pyridoxal phosphate,PLP)是细胞内多数酶的辅酶,参与生物体内多种代谢反应,如转胺作用、脱羧作用等[6]。生物素(维生素H)作为酶的组成成分,参与三大营养物质代谢,是不可或缺的重要营养物质之一。当维生素H含量过高时会产生菌体大量繁殖,耗糖速率加快,糖酸转化率大幅降低的问题;当维生素H含量较低或没有时,会导致菌体生长缓慢,生物量偏低,产量偏低等问题[7]。枯草芽孢杆菌作为主要的核黄素生产菌株,由于其生长特性,当培养基中营养成分不足时,发酵过程中就会出现产孢现象,导致菌体量和产量的严重下降。为解决这种问题,传统的核黄素发酵会添加过量的金属离子和生长因子,以保证发酵的正常进行,但同时也造成了原料,时间和能耗的高消耗问题。
本实验为解决上述问题对核黄素发酵过程中的金属离子及生长因子进行优化,以菌体生物量、核黄素产量、糖酸转化率和有机酸等为指标,确定最适的金属离子和生长因子添加量及添加方式,避免了核黄素发酵培养基中金属离子及生长因子用量模糊、副产物有机酸含量过高等问题,对后续的研究生产有指导意义。
1 材料与方法
1.1 菌种
核黄素枯草芽孢杆菌生产菌,由天津科技大学代谢工程研究室保藏。
1.2 培养基
活化培养基(g/L):葡萄糖2,胰蛋白胨10,牛心浸粉17.5,氯化钠5,磷酸氢二钠2.5,琼脂粉25。
种子培养基(g/L):葡萄糖30,酵母粉4,蛋白胨3,七水硫酸镁0.5,磷酸二氢钾3,硫酸铵8,甜菜碱0.5,红霉素0.01,氯霉素0.01。
发酵培养基(g/L):葡萄糖60,酵母粉6,蛋白胨4,磷酸二氢钾3,磷酸氢二钾2,甜菜碱0.5,七水硫酸镁1.5,谷氨酸6,硫酸铵10,红霉素0.01,氯霉素0.01。
1.3 仪器与设备
SW-CJ-1C超净台,浙江孚夏医疗科技有限公司;FR522CN大量程电子天平,美国奥豪斯公司;LDZH-100KBS型全自动立式蒸汽灭菌器,天津博鑫生物科技有限公司;MQD-B1T叠加式振荡培养箱,上海旻泉仪器有限公司;LRH-250-A生化培养箱,广东省医疗器械厂;5 L自动控制发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;752分光光度计,上海精密科学仪器有限公司;OLYMPUS生物显微镜,日本OLYMPUS会社;LC-20A高效液相色谱(紫外-示差),日本SHIMADZU(岛津)公司。
1.4 培养方案
1.4.1 菌种活化
将菌种从甘油管中接到斜面培养基进行活化,于37 ℃培养箱中活化培养14 h。
1.4.2 摇瓶培养
1.4.2.1 摇瓶种子培养
使用500 mL挡板瓶,种子培养基200 mL,将活化后的菌株用接种环接到种子培养基中,苯酚红为酸碱指示剂,期间通过手动补加氨水调节pH值维持在7.0,温度37 ℃,220 r/min培养12 h。
1.4.2.2 摇瓶发酵培养
使用500 mL挡板瓶,接种量为摇瓶种子培养基体积分数的10%,苯酚红为酸碱指示剂,期间通过手动补加氨水调节pH值维持在7.0,温度37 ℃,220 r/min培养48 h。
1.4.3 5 L发酵罐培养
1.4.3.1 发酵菌种活化
利用斜面培养基对甘油管中的菌种进行二代活化:(1)将菌种从甘油管中接到斜面培养基中活化培养14 h;(2)将斜面培养基上的菌株接到茄形瓶中进行二次传代培养10 h。
1.4.3.2 发酵罐种子培养
使用200 mL无菌水将茄形瓶中的菌体洗脱,倒入种子培养基中进行培养。发酵总体积为2 L,发酵温度37 ℃,pH值维持在7.0,溶氧与转速联动,维持在40%~50%,OD600>20时接入发酵培养基中,进行发酵培养。
1.4.3.3 分批补料发酵培养
按30%的接种量将种子液接入发酵培养基中进行发酵培养,发酵时间50 h,发酵温度37 ℃,通过流加氨水控制发酵pH值在6.8~7.0,溶氧保持在40%~50%,发酵中后期,流加80%的葡萄糖控制糖质量浓度在15 g/L以下。
1.5 实验方法
1.5.1 金属离子添加种类及添加量的测定
为满足菌体的基本生长,以0.5 mg/L添加除目标金属离子之外的其他离子,其他发酵条件不变,按照表1所示的6种不同种类的金属离子,设置5个浓度梯度进行实验。
表1 金属离子添加量 单位:mg/L
Table 1 Amount of metal ions added
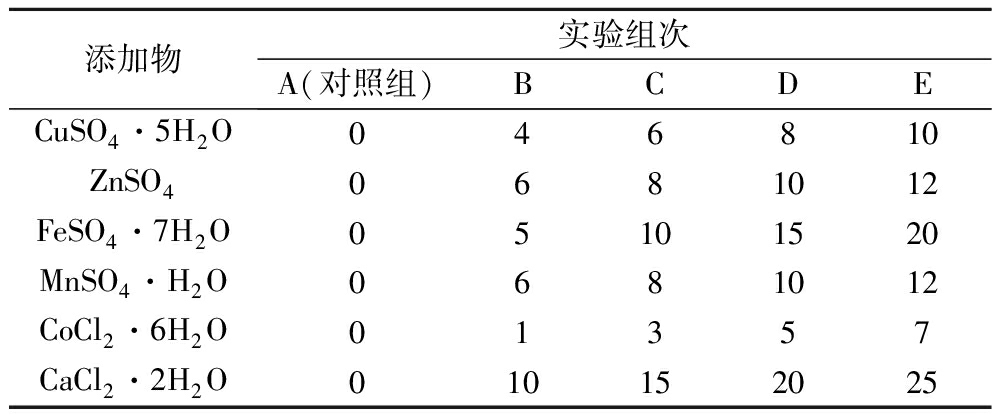
添加物实验组次A(对照组)BCDECuSO4·5H2O046810ZnSO40681012FeSO4·7H2O05101520MnSO4·H2O0681012CoCl2·6H2O01357CaCl2·2H2O010152025
1.5.2 生长因子添加量的测定
在培养基其他成分和发酵条件不变的条件下,按照表2所示的2种不同种类的生长因子,设置5个浓度梯度进行实验。
表2 生长因子添加量 单位:mg/L
Table 2 Growth factor addition
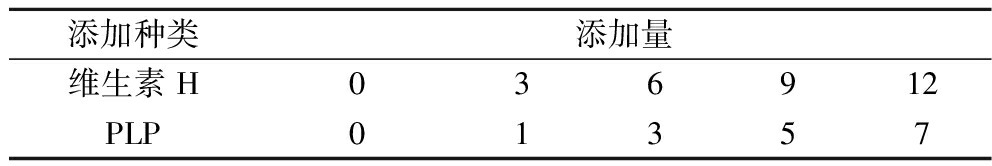
添加种类添加量维生素H036912PLP01357
1.5.3 正交试验确定金属离子及生长因子的最适添加量
根据2.1和2.2的实验结果,金属离子的影响顺序为CuSO4·5H2O、FeSO4·7H2O、ZnSO4、MnSO4·H2O、CaCl2·H2O和CoCl2·6H2O,后3种金属离子的影响远小于前3种。正交试验在单因素试验的基础上,以CuSO4·5H2O(A)、FeSO4·7H2O(B)、ZnSO4(C)、PLP(D)和维生素H(E)添加量为研究对象,以菌体生物量(OD600)、核黄素产量为指标,选用L16(54)正交试验表进一步分析,正交试验因素水平表如表3所示。
表3 正交试验因素水平表 单位:mg/L
Table 3 Orthogonal experiment factor level table
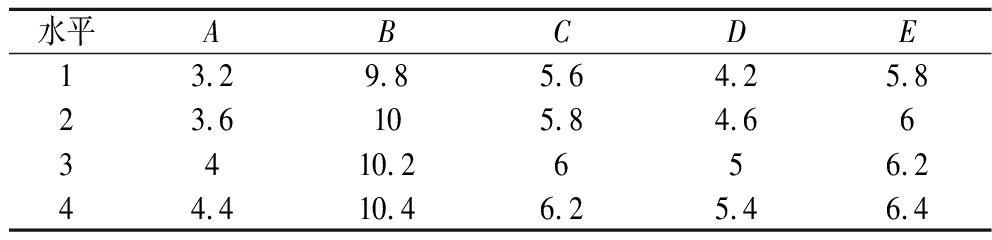
水平ABCDE13.29.85.64.25.823.6105.84.663410.2656.244.410.46.25.46.4
1.5.4 生长因子添加方式的测定
由2.4.1的实验结果可知,在优化添加量后,菌体生物量与核黄素产量均有所提升但并未达到实验预期。因此设置3种发酵过程控制方法(生长因子添加方式)即在底物中添加(a)、固定时间(发酵8、16、24、32 h)添加(b)和从发酵8 h开始持续流加(c)。通过5 L发酵罐检验3种不同过程控制方法对菌体生物量、产量及副产物的影响,3种添加方式添加量的总浓度相同。
1.6 检测与分析方法
1.6.1 pH、温度、溶氧测定
pH、温度、溶氧通过发酵罐的实时检测系统进行检测。
1.6.2 菌体生物量(OD600值)测定
在发酵过程中的特定时间进行取样,稀释相应倍数后,将样品放于紫外分光光度计600 nm下测量菌体生物量[8]。
1.6.3 残糖测定
取1 mL发酵液,13 000 r/min离心2 min,取上清液并稀释100倍后,使用SBA生物传感分析仪测定发酵液内的残糖量[9]。
1.6.4 核黄素产量测定[10]
取核黄素发酵液于容量瓶中,加入NaOH稀释1 000倍;
定容稀释后的溶液进行13 000 r/min、2 min离心,使菌体分离;
取离心后的上清液,以水为空白对照在445 nm处测量其吸光度。按照公式(1)计算核黄素的浓度:
核黄素![]()
(1)
1.6.5 发酵副产物的测定
发酵液副产物采用HPLC法测定,使用色谱柱Aminex® HPX-87H色谱柱(7.8 mm×300 mm),RID-20A折光率检测器。流动相为5 mmol/L硫酸溶液,流速为0.5 mL/min。
1.6.6 糖酸转化率的测定
糖酸转化率(sugar acid,SA)的计算如公式(2)所示:
糖酸转化率![]()
(2)
式中:ρ,核黄素质量浓度,g/L;V,发酵液总体积,L;m,总耗糖量,g。
1.6.7 数据分析方法
数据采用3次平行实验的平均值与标准差,其中“*”表示P<0.05,差异显著;“**”表示P<0.01,差异极其显著。
2 结果与分析
2.1 金属离子添加种类及添加量的测定
2.1.1 金属离子添加种类及添加量对菌体生物量的影响
如图1所示,从菌体生物量来看,CuSO4·5H2O、ZnSO4、MnSO4·H2O、FeSO4·7H2O和CaCl2·H2O 5种金属离子在添加后均比未添加时的菌体生物量有所提高,其中CuSO4·5H2O和MnSO4·H2O相较于其他3种金属离子对菌体生物量的影响最大。以CuSO4·5H2O为例,当CuSO4·5H2O的添加量为4 mg/L时菌体生物量最高达到了69.5,较对照组提高了9.4%;但随着添加量的增加,菌体生物量不升反降,最终菌体生物量甚至低于未添加时的菌体生物量。添加CoCl2·6H2O后的情况与其他5种金属离子的截然不同,添加CoCl2·6H2O后并未出现菌体生物量升高的现象,相反在随着添加量逐渐增大后菌体生物量出现大幅度的下降,当添加质量浓度为7 mg/L时菌体生物量仅有18.2,相较于对照组下降了24.4%,与王敏[11]的实验结果一致。由于合成核黄素的代谢途径过长,涉及酶的种类繁多,金属离子作为一部分生物物质的组成部分和一些酶类的激活剂在这个过程中发挥了重要的作用,故不难解释在添加金属离子后对菌体生物量的正向作用。但当金属离子添加量过高时,对菌体生长的抑制作用也随之出现;各种金属离子之间相互抑制,影响代谢途径中关键酶的活力,不利于菌体的生长甚至出现毒害作用,菌体OD600值出现了较大的降低[12-13]。
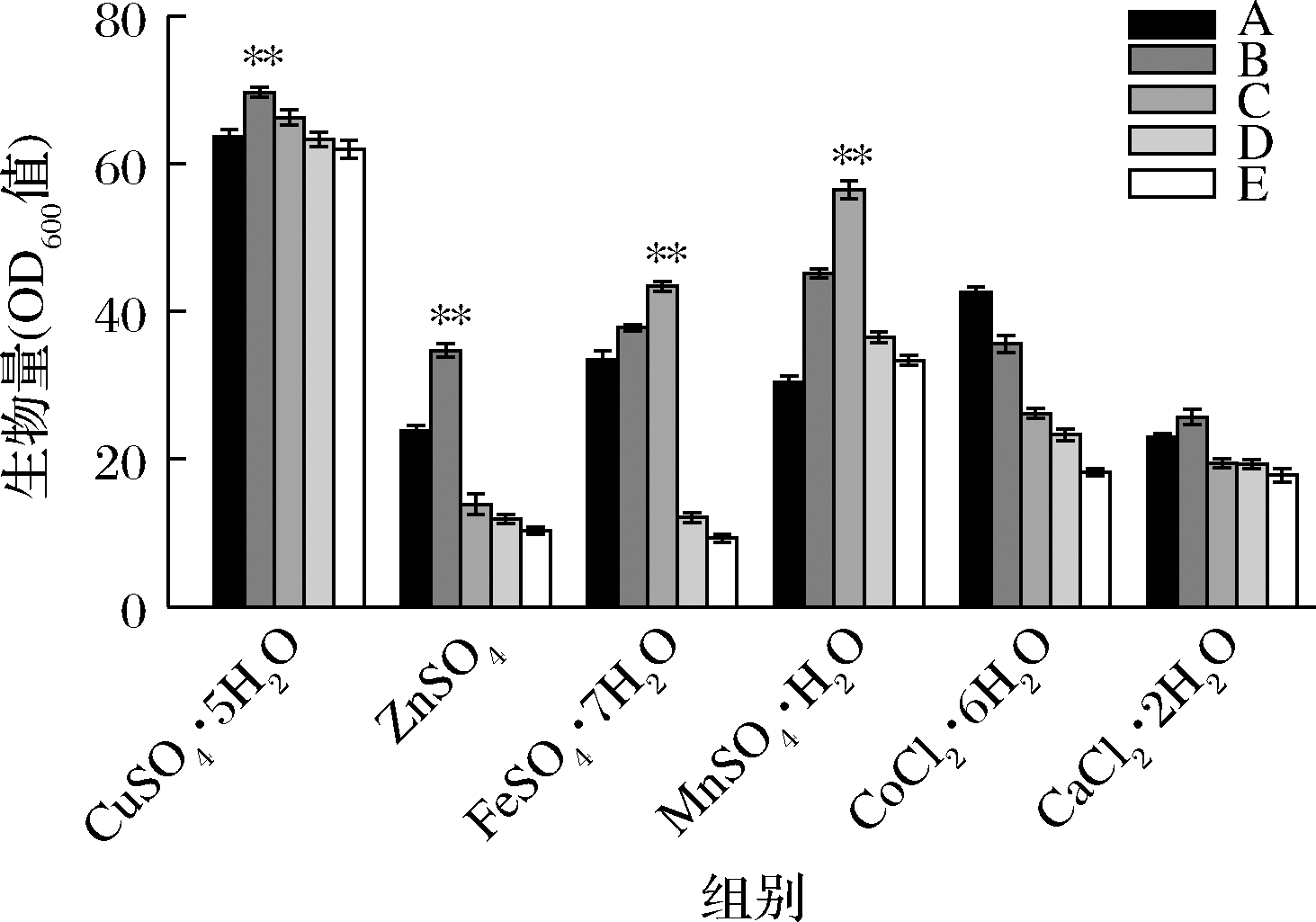
图1 金属离子对菌体生物量(OD600值)的影响
Fig.1 Effects of metal ions on OD600 of bacterial biomass
注:A、B、C、D、E指相应金属离子不同浓度梯度;*表示差异显著 (P<0.05),**表示差异极显著(P<0.01)(下同)
2.1.2 金属离子对核黄素产量的影响
如图2所示,6种金属离子对核黄素产量均有明显影响。当CuSO4·5H2O的添加量≤10 mg/L时,核黄素的产量随着CuSO4·5H2O的增加而增加,当CuSO4·5H2O的添加量为10 mg/L时,核黄素产量达到12.2 g/L,当CuSO4·5H2O的添加量>10 mg/L时,核黄素的产量开始下降;当ZnSO4的添加量在≤3 mg/L时,核黄素产量逐步上升,最高达到8.4 g/L,但当添加量≥3 mg/L时,核黄素产量出现较大的降低,表现出负增长趋势。过高的铁离子抑制核黄素的合成[14],FeSO4·7H2O和MnSO4·H2O的核黄素产量与ZnSO4相似,在添加量分别为13、24 mg/L时核黄素产量达到最大,即10.0 g/L和7.1 g/L。在添加CoCl2·6H2O后,核黄素的产量并未随着菌体生物量的减少而下降,由此推断Co2+对菌体生物量有抑制作用但对核黄素的生成却有促进作用。添加CaCl2增强了异柠檬酸脱氢酶(isocitrate dehydrogenase, ICDH)、谷氨酸脱氢酶(glutamate dehydrogenase, GDH)和α-酮戊二酸脱氢酶复合物(oxoglutarate dehydrogenase complex,OGDC),这些酶参与了α-酮戊二酸转化为谷氨酸的过程[15]。谷氨酸作为谷氨酰胺的前体,而谷氨酰胺作为三磷酸鸟苷(guanosine triphosphate, GTP)合成所需的物质,GTP又作为合成核黄素的直接前体物影响着产物的积累[16]。
2.2 生长因子对核黄素的影响
2.2.1 PLP添加量对菌体生物量及核黄素产量的影响
如图3所示,由于PLP是细胞内大多数酶的辅酶,涉及生物体内多种代谢反应,如转胺作用、脱羧作用等[6]。因此不难解释,添加PLP后对菌体生物量(OD600值)和核黄素产量产生的正向效果。但当PLP添加量≥5 mg/L时,这种正向效果就不再明显,继续添加PLP只会造成营养过剩,菌体无法吸收。综合来看,当PLP的添加量为5 mg/L时效果最佳。
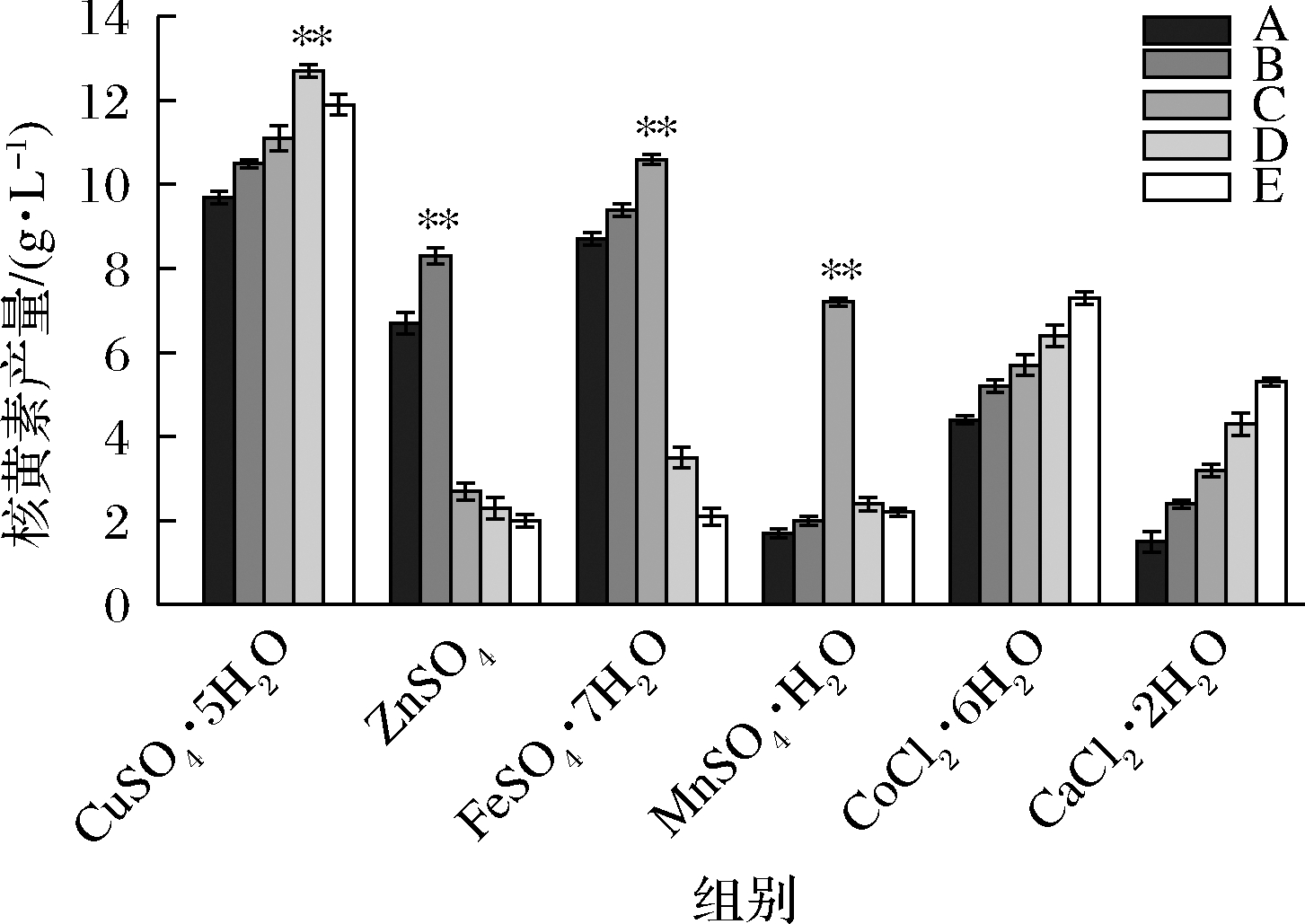
图2 金属离子对核黄素产量的影响
Fig.2 Effects of metal ions on riboflavin yield
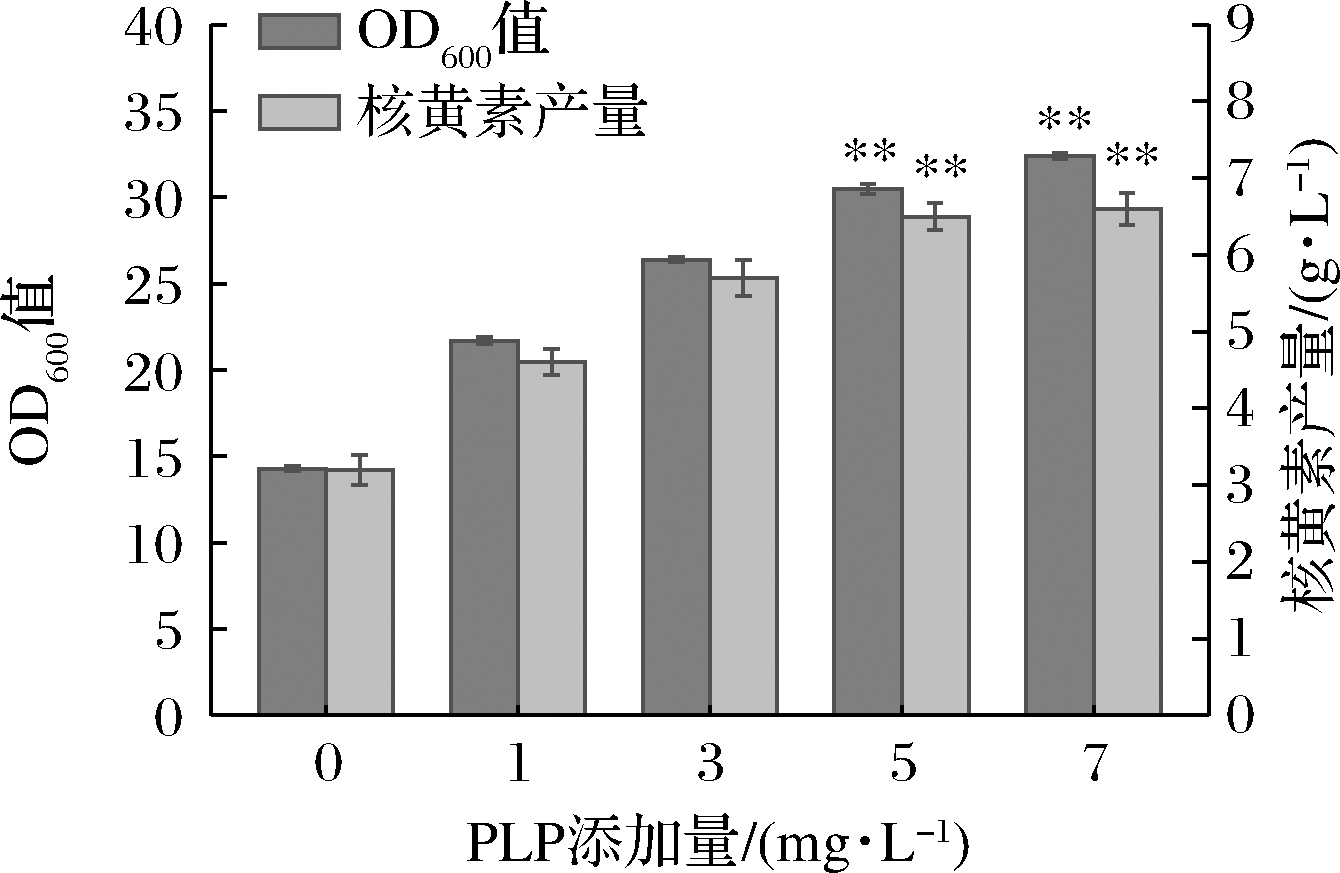
图3 PLP添加量对菌体生物量(OD600值)及核黄素产量的影响
Fig.3 Effect of PLP addition on bacterial biomass OD600 and riboflavin production of bacteriophage biomass
2.2.2 维生素H添加量对核黄素菌体生物量及产量的影响
如图4所示,当维生素H添加量逐渐增加,菌体生物量明显提升,当添加量为12 mg/L时,OD600值达到33.2,较未添加时提高了132%。分析原因:生物素维生素H作为极其重要的生长因子,直接影响着菌体细胞的生长、增值和代谢。例如维生素H作为催化脂肪酸生物合成反应乙酰CoA羧化酶的辅酶,参与脂肪酸的生物合成并影响磷脂的合成,是限制细胞生长的主要因素,因此维生素H的添加量越高,菌体生物量越大。但当维生素H的添加量为9 mg/L和12 mg/L时,核黄素产量相较之前的涨幅趋势有了明显下降,此时核黄素产量为6.71 g/L和5.67 g/L。大量维生素H的添加导致菌体将大量能量用于生长繁殖,少量用于产物合成,出现能量分配不均的问题。综合来看添加6 g/L的维生素H能够平衡菌体生长与产物合成之间的关系。
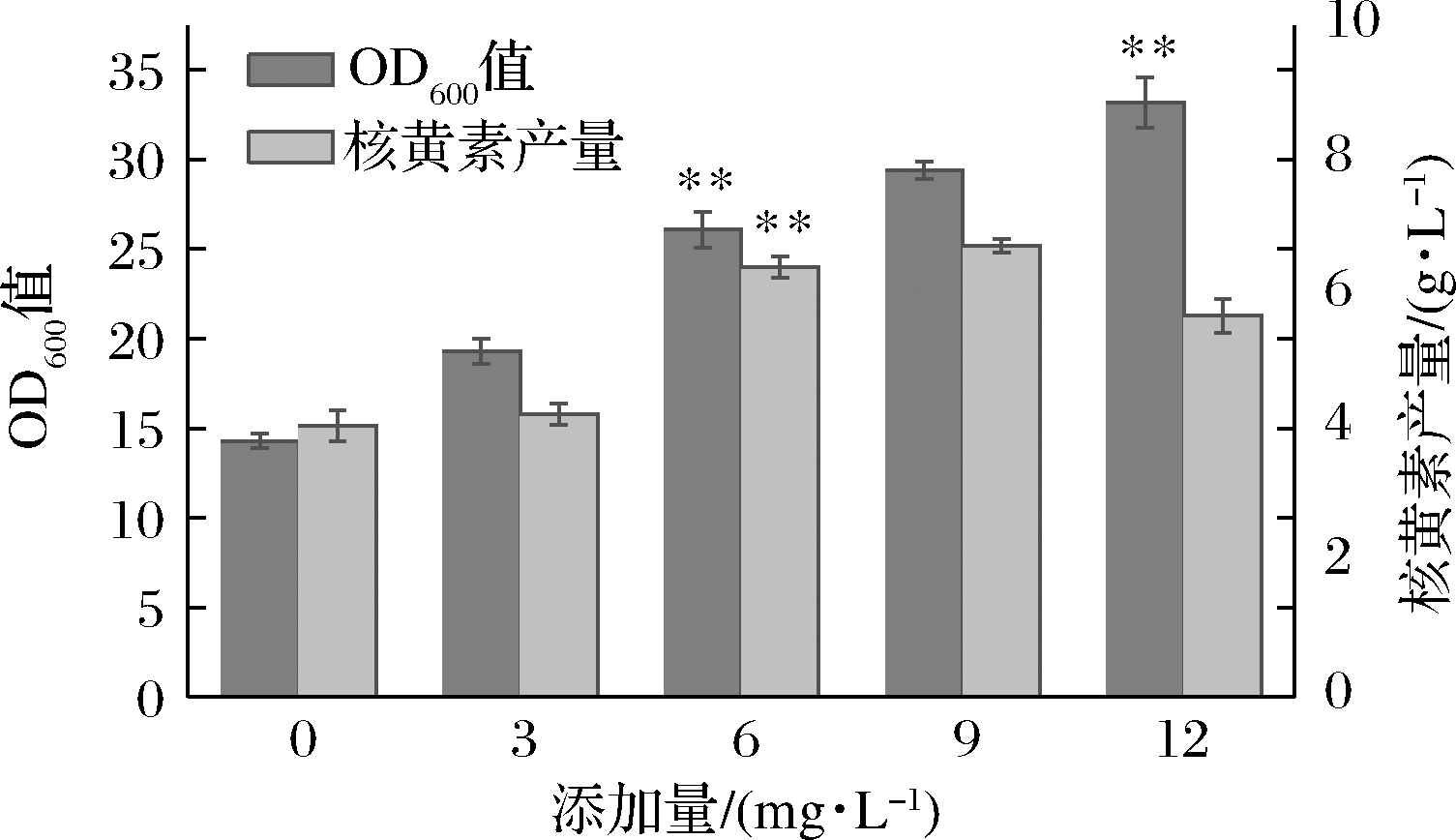
图4 维生素H添加量对菌体生物量(OD600值)及核黄素产量的影响
Fig.4 Effect of vitamin H addition on bacterial biomass OD600 and riboflavin production of bacteriophage biomass
2.3 正交试验分析金属离子和生长因子的最适用量
根据表3的实验方案设置L16(54)正交试验,以菌体生物量、核黄素产量为指标,实验结果及分析如表4所示。
由表4可知,5种因素对菌体生物量和核黄素产量的影响有所差异,但本实验最终以提高核黄素产量为目的,故以核黄素产量为指标讨论5种因素的影响。通过比较均值,CuSO4·5H2O均值3最大,即CuSO4·5H2O的最佳添加量为4 g/L;FeSO4·7H2O的均值3最大,即FeSO4·7H2O的最佳添加量为10.2 g/L;ZnSO4的均值4最大,即ZnSO4的最佳添加量为6.2 g/L;PLP的均值1最大,即PLP的最佳添加量为4.2 g/L;维生素H的均值3最大,即维生素H的最佳添加量为6.2 g/L。综合来看,在优化金属离子和生长因子的用量后,以核黄素产量为指标,金属离子和生长因子的最适添加量,即CuSO4·5H2O 4 g/L,FeSO4·7H2O 10.2 g/L,ZnSO4 6.2 g/L,PLP 4.2 g/L和维生素H6.2 g/L。
表4 菌体生物量及核黄素产量正交试验结果
Table 4 Orthogonal experiment results of bacterial biomass and riboflavin yield
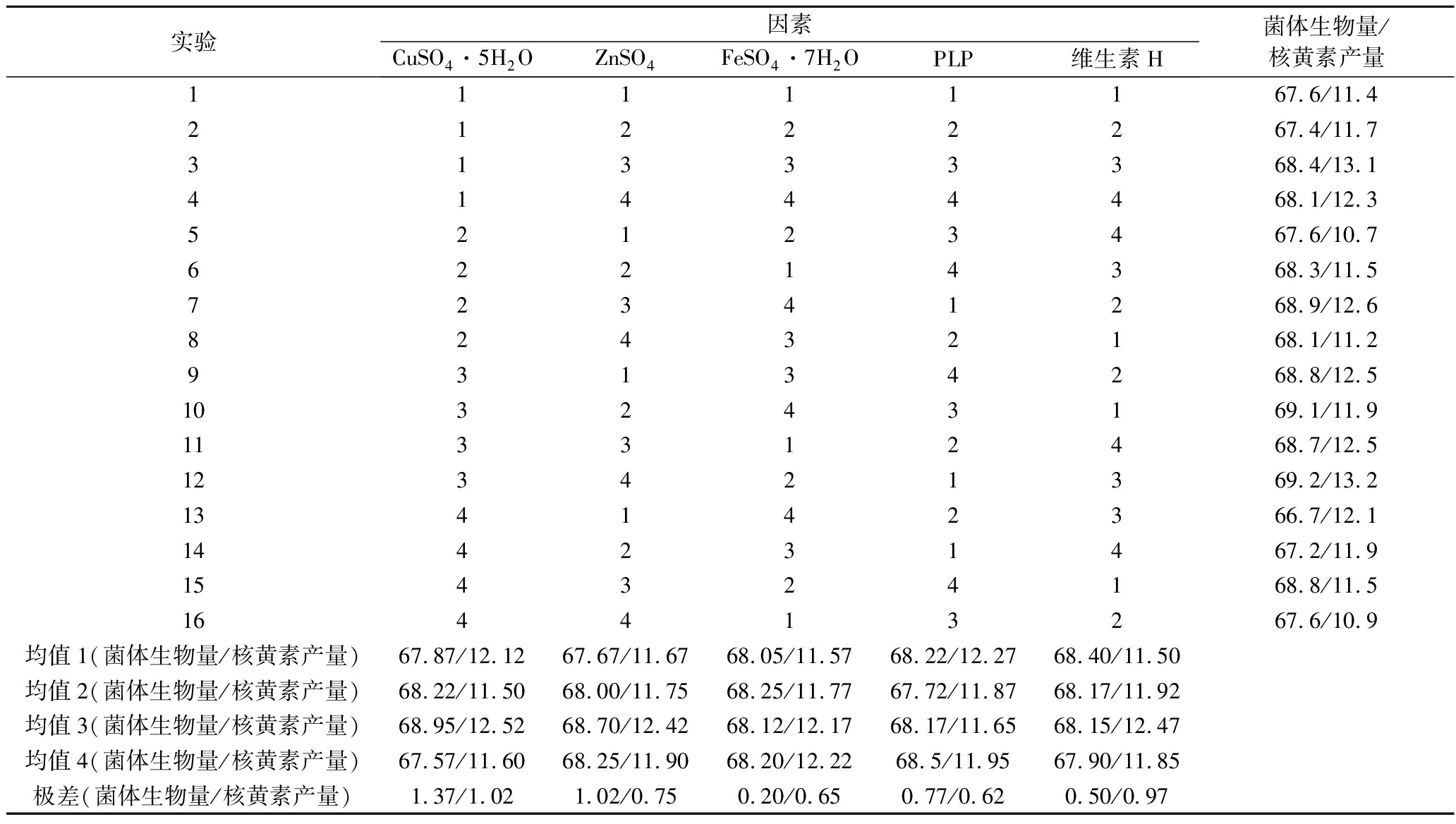
实验因素CuSO4·5H2OZnSO4FeSO4·7H2OPLP维生素H菌体生物量/核黄素产量11111167.6/11.421222267.4/11.731333368.4/13.141444468.1/12.352123467.6/10.762214368.3/11.572341268.9/12.682432168.1/11.293134268.8/12.5103243169.1/11.9113312468.7/12.5123421369.2/13.2134142366.7/12.1144231467.2/11.9154324168.8/11.5164413267.6/10.9均值1(菌体生物量/核黄素产量)67.87/12.1267.67/11.6768.05/11.5768.22/12.2768.40/11.50均值2(菌体生物量/核黄素产量)68.22/11.5068.00/11.7568.25/11.7767.72/11.8768.17/11.92均值3(菌体生物量/核黄素产量)68.95/12.5268.70/12.4268.12/12.1768.17/11.6568.15/12.47均值4(菌体生物量/核黄素产量)67.57/11.6068.25/11.9068.20/12.2268.5/11.9567.90/11.85极差(菌体生物量/核黄素产量)1.37/1.021.02/0.750.20/0.650.77/0.620.50/0.97
2.4 5 L发酵罐实验
2.4.1 5 L发酵罐验证金属离子及生长因子添加量
前期实验确定了金属离子和生长因子的添加种类及添加量,并对具有正向效果的金属离子及生长因子通过正交试验进一步筛选出对发酵结果影响最大的实验条件。由于摇瓶实验的发酵条件有限,调控过程粗糙,导致菌体的发酵潜力无法完全表达。因此在保证培养基其他成分及发酵条件不变的情况下,对优化后的添加量进行5 L发酵罐验证,进一步研究实验的可行性和优越性[17],实验结果如图5所示。
由图5可知,实验组在优化金属离子及生长因子的添加量后增长速率始终高于对照组,50 h菌体生物量为198.3,明显高于对照组173.0,直至发酵结束菌体生物量没有出现下降趋势。由于核黄素为生长偶联型产物,产物的生成直接受到菌体生物量的影响,在发酵前17 h实验组与对照组菌体生物量较为接近,核黄素产量差别不大,17 h后,实验组菌体生物量开始迅速提高,核黄素产量也随之增加,最终核黄素产量为15.1 g/L,较对照组提高了11.1%。
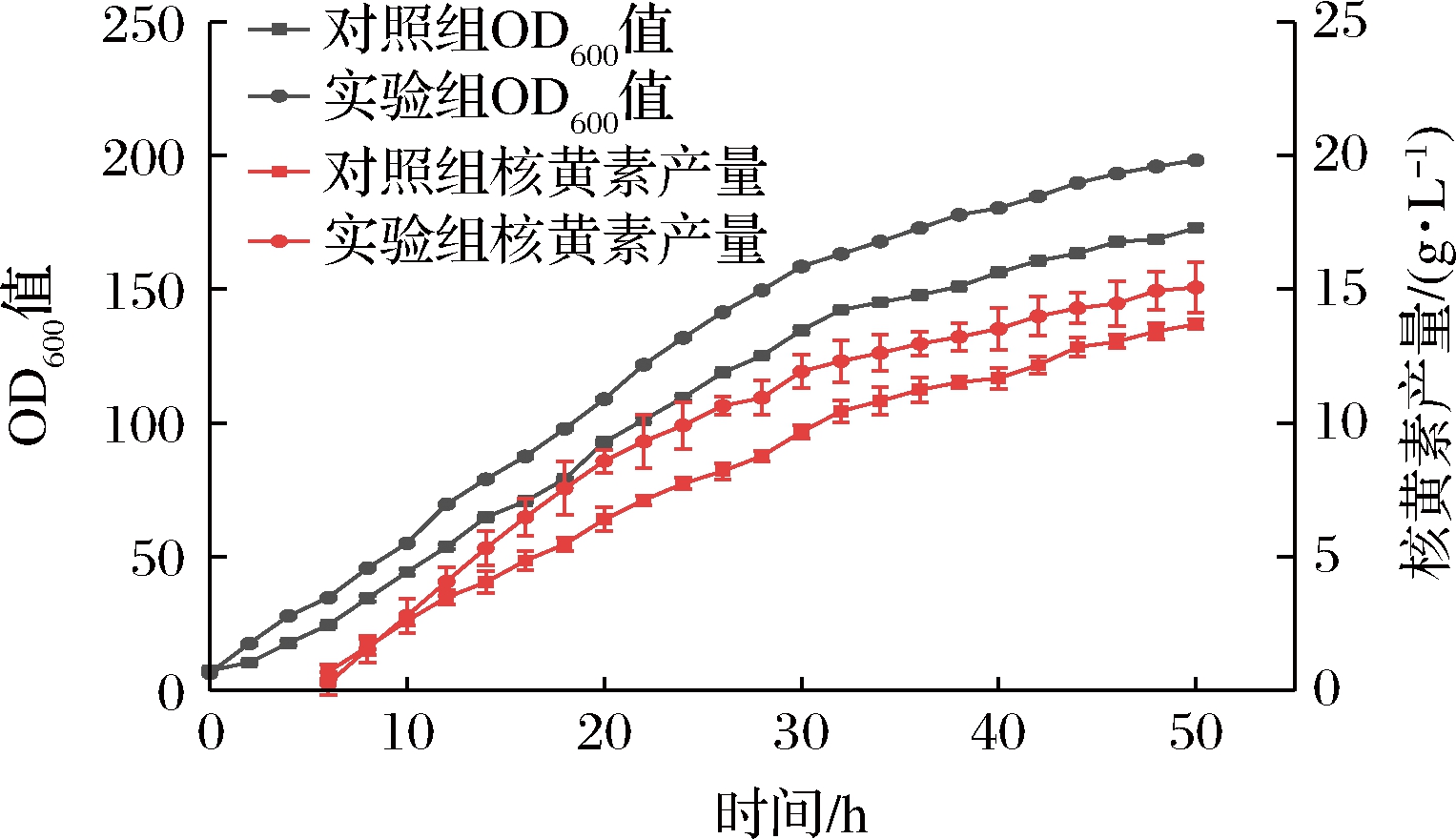
图5 5 L发酵罐中菌体生物量OD600值与核黄素产量的对比
Fig.5 Comparison of OD600 of bacterial biomass and riboflavin yield in 5 L fermentation tank
2.4.2 生长因子添加方式对核黄素发酵的影响
菌体从培养基中摄取生长因子的速度是很快的,远远超过菌体繁殖所消耗的生长因子的量[17]。在发酵过程中,体系内生长因子含量由丰富向贫乏过度,导致菌体后期生长所需营养不足,环境恶劣,菌体生物量下降,产量下降等问题的出现。保证足够浓度的生长因子来维持菌体正常代谢生长,使用合适的发酵过程控制(生长因子添加方式)成为一个提高核黄素发酵产量的方法。
如图6所示,添加方式a在培养基中一次性加入生长因子,体系中营养充足,菌体在前10 h生物量和产量的增长速度均是最快的,但随着发酵的进行,添加方式a的弊端逐渐显露,生长因子的浓度下降,菌体的生存环境变差,菌体无法保持前期的生长态势,最终菌体生物量OD600值为198.2,核黄素产量为15.1 g/L。添加方式b在8、16、24、32 h添加生长因子,在添加后的4 h菌体生物量有非常明显的提升,随后涨幅逐渐下降,最终菌体生物量和产量较添加方式a提高了24.6%和36.4%。添加方式c在发酵8 h开始持续流加,使菌体所需的营养物质在整个发酵周期内都处于一个相对稳定的水平,从最终结果来看添加方式c展现出了持续流加的优势,最终菌体生物量较添加方式a和b提高了29.2%和3.6%,产量较添加方式a和b提高了52.9%和14.3%。
2.4.3 发酵副产物有机酸及糖酸转化率的测定
枯草芽孢杆菌发酵时,由于三羧酸循环(tricarboxylic acid cycle,TCA cycle)中碳源的消耗与前体合成之间存在能量分配不均的现象,导致有机酸在发酵体系中不断积累[18]。对本实验中产生的主要有机酸含量进行了测定分析,结果如图7所示。

图6 不同添加方式对菌体生物量OD600值及 核黄素产量的影响
Fig.6 Effects of different addition methods on OD600 of bacterial biomass and riboflavin yield
注:a-在底物中添加;b-在8、16、24、32 h添加;c-从8 h持续流加(下同)
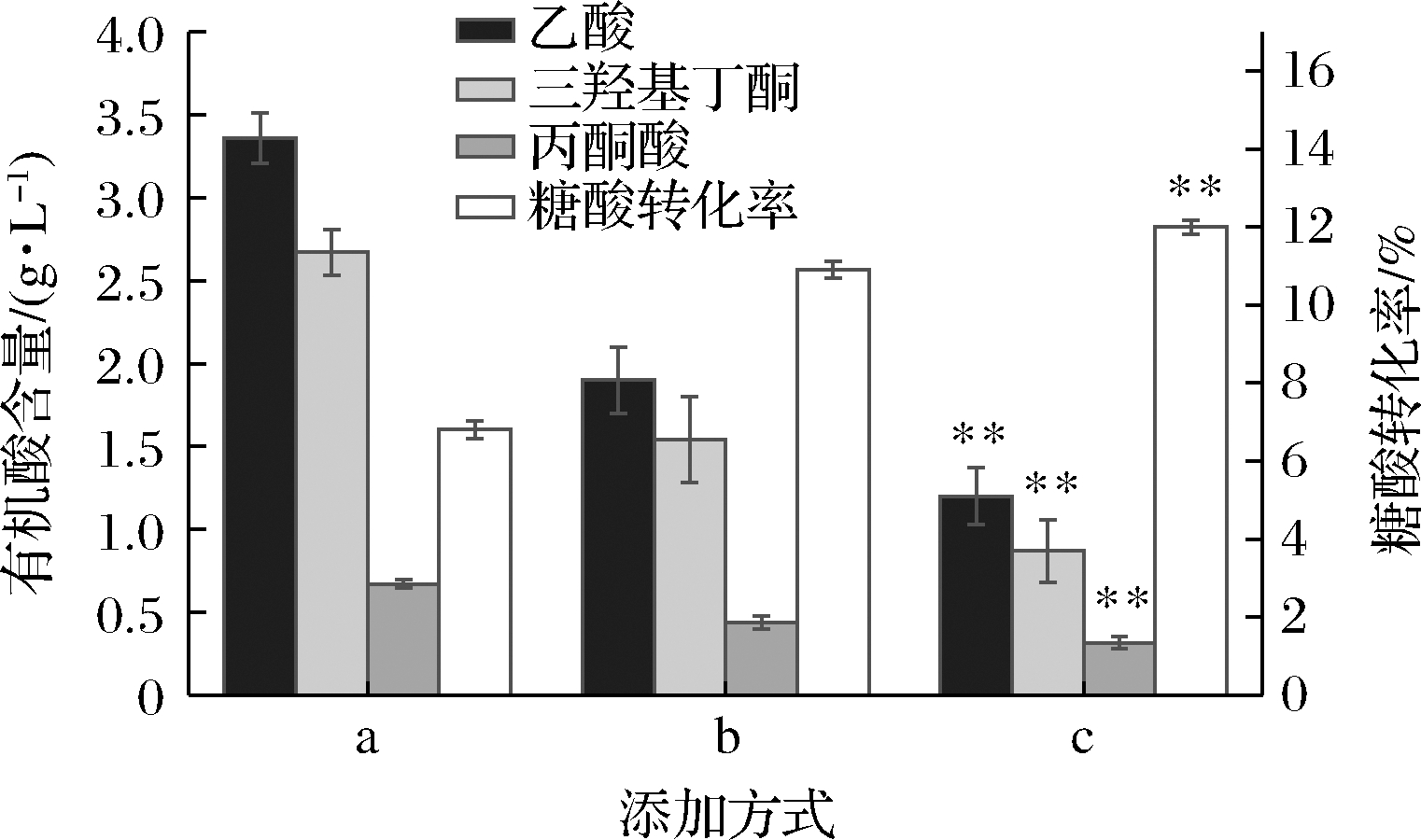
图7 三种添加方式中有机酸含量及糖酸转化率的对比
Fig.7 Comparison of organic acid content and sugar-acid conversion rate in three addition methods
对上述结果分析发现,发酵液中丙酮酸、乙酸、和三羟基丁酮的含量在优化添加方式后均呈现下降趋势,其中丙酮酸下降是由于金属离子与生长因子优化后提高了磷酸戊糖途径的通量,从而造成流向糖酵解的碳流减少,导致乙酸,丙酮酸等溢流途径产物的量也随之减少[19]。同时,丙酮酸还可转化成三羟基丁酮,减少发酵过程中丙酮酸的积累。乙酸下降是菌体生物量和糖酸转化率上升的一个主要原因。乙酸是对菌体生长极其不利的一种物质,乙酸过量积累影响发酵过程的稳定。有研究表明,乙酸对DNA、RNA和蛋白质等合成存在抑制作用[20],同时乙酸积累导致代谢溢流直接造成转化率低等问题。三羟基丁酮减少的原因为碳源耗尽时,三羟基丁酮可以分泌到胞外作为碳源存储物[21],由图7可以看出添加方式c中的三羟基丁酮含量明显低于添加方式a和b,且由图6可知优化添加方式后,核黄素产量明显高于未优化前。DAUNER等[22]采用葡萄糖与三羟基丁酮共同补料的方式,实现了核黄素产量的提高,这与本实验的结果相同。
由图7可知,添加方式a的糖酸转化率仅为6.8%,副产物有机酸的含量为3组中最高。添加方式B和C的糖酸转化率分别为10.9%和12%,优化添加方式后,增加了菌体对培养基的正向利用率,使代谢主流导向理想的代谢途径,有机酸含量明显下降,核黄素发酵的糖酸转化率有了明显的提升。
3 结论
本研究为解决枯草芽孢杆菌发酵核黄素过程中菌体生物量低,核黄素产量低,糖酸转化率低、有机酸含量高等常见问题,对培养基中的金属离子和生长因子作了初步探究,通过单因素试验、正交试验和5 L发酵罐验证,以菌体生物量和核黄素产量为指标,确定添加:CuSO4·5H2O 4 g/L,FeSO4·7H2O 10.2 g/L,ZnSO4 6.2 g/L,PLP 4.2 g/L,维生素H 6.2 g/L,同时生长因子采取从8 h持续流加的策略。以优化前的条件为对照组,优化后发酵周期缩短至50 h,菌体生物量OD600值达到了256.1,较优化前提高了29.1%;核黄素产量达到了23.1 g/L,较对照组提高了53.0%;副产物有机酸含量明显下降;糖酸转化率达到12%。本研究通过对金属离子及生长因子的具体添加量和发酵过程控制进行优化,使枯草芽孢杆菌生产核黄素的产量有了明显的提升,缩短了无效发酵周期,节约生产成本,对后续核黄素的生产研究具有参考意义。
[1] 石婷. 高产核黄素枯草芽孢杆菌代谢工程研究[D].天津:天津大学.2014.
SHI T.Construction of high riboflavin producing Bacillus subtilis by metabolic engineering[D].Tianjin:Tianjin University.2014.
[2] 黄灿. 核黄素高产枯草芽孢杆菌选育和发酵优化[D].天津:天津大学,2018.
HUANG C.Screening of Bacillus subtilis for riboflavin production ang optimization of riboflavin fermentation[D].Tianjin:Tianjin University.2018.
[3] AVERIANOVA L A, BALABANOVA L A, SON O M, et al.Production of vitamin B2 (Riboflavin) by microorganisms:An overview[J].Frontiers in Bioengineering and Biotechnology, 2020,8:570828.
[4] 王镜岩, 生物化学第三版[M].北京:高等教育出版社, 2009:380-381.
WANG J Y, Biochemistry Third Edition[M].BeiJing:Higher Education Press, 2009:380-381.
[5] 陈志超,王金多,徐庆阳.微量元素与生长因子对L-苯丙氨酸发酵的影响[J].食品与发酵工业, 2022, 48(8):82-89.
CHEN Z C, WANG J D, XU Q Y, et al.Effects of trace elements and growth factors on L-phenylalanine fermentation[J].Food and Fermentation Industeies, 2022, 48(8):82-89.
[6] TONEY M D.Reaction specificity in pyridoxal phosphate enzymes[J].Archives of Biochemistry and Biophysics, 2005, 433(1):279-287.
[7] 徐达, 梅漫莉, 徐庆阳, 等.生物素对L-缬氨酸发酵的影响[J].食品科学, 2019, 40(22):213-218.
XU D, MEI M L, XU Q Y, et al.Effect of biotin addition on microbial production of L-valine[J].Food Science, 2019, 40(22):213-218.
[8] 张玉富, 熊海波, 徐庆阳, 等.生物素及膜偶联间歇透析发酵对黄色短杆菌生产L-亮氨酸的影响[J].食品与发酵工业, 2019, 45(9):15-20.
ZHANG Y F, XIONG H B, XU Q Y, et al.Effects of biotin and membrane-coupled intermittent dialysis fermentation on the production of L-leucine production by Brevibacterium flavum[J].Food and Fermentation Industries, 2019, 45(9):15-20.
[9] 熊海波, 刘云鹏, 徐庆阳.超声对谷氨酸棒杆菌发酵L-异亮氨酸的影响[J].食品与发酵工业, 2021, 47(4):40-46.
XIONG H B, LIU Y P, XU Q Y.Effect of ultrasound on L-isoleucine fermented by Corynebacterium glutamate[J].Food and Fermentation Industries,2021,47(4):40-46.
[10] 张续, 班睿, 刘露, 等.枯草芽孢杆菌基因修饰生产核黄素[J].微生物学通报, 2017, 44(1):59-67.
ZHANG X, BAN R, LIU L, et al.Riboflavin production by a genetically modified Bacillus subtilis[J].Microbiology China, 2017,44(1):59-67.
[11] 王敏. 核黄素发酵工艺优化及代谢调控机理的初步研究[D].杭州:浙江工业大学, 2009.
WANG M.Riboflavin fermentation process optimization and preliminary study on mechanism of metabolic regulation[D].Hangzhou:Zhejiang University of Technology, 2009.
[12] STEPHENS C M, BAUERLE R H.Analysis of the metal requirement of 3-deoxy-D-arabino-heptulosonate-7-phosphate synthase from Escherichia coli[J].The Journal of Biological Chemistry, 1991, 266(31):20 810-20 817.
[13] WEI Y H, LAI C C, CHANG J S.Using Taguchi experimental design methods to optimize trace element composition for enhanced surfactin production by Bacillus subtilis ATCC 21332[J].Process Biochemistry, 2007, 42(1):40-45.
[14] BORETSKY Y R, PROTCHENKO O V, PROKOPIV T M, et al.Mutations and environmental factors affecting regulation of riboflavin synthesis and iron assimilation also cause oxidative stress in the yeast Pichia guilliermondii[J].Journal of Basic Microbiology, 2007, 47(5):371-377.
[15] 朱亚鑫. γ-聚谷氨酸的高效生物合成及其立体构型调控[D].无锡:江南大学, 2021.
Zhu Y X.Improving biosynthesis of poly-γ-glutamic acid and regulating its stereochemical configuaration.[D] Wuxi:Jiangnan University,2021.
[16] 尉文,张梦雪,王学东.无机氮源在枯草芽孢杆菌补料分批发酵核黄素中的作用[J].华东理工大学学报(自然科学版), 2020, 46(4):543-548.
YU W, ZHANG M X, WANG X D.Effect of inorganic nitrogen on riboflavin production by fed-batch culture of Bacillus subtilis[J].Journal of East China University of Science and Technology, 2020, 46(4):543-548.
[17] 陈宁. 氨基酸工艺学[M].北京:中国轻工业出版社, 2013:42-46.
CHEN N. Amino Acid Technology[M].BeiJing:China Light Industry Press, 2013:42-46.
[18] 林振泉. 重组大肠杆菌生产核黄素和β-胡萝卜素的途径构建与改造[D].天津:天津大学, 2015.
LIN Z Q.Construction and improvement of recombinant Escherichia coil for the production of riboflavin and β-carotene[D].Tianjin:Tianjin University.2015.
[19] 程毅鹏. 高产核黄素枯草芽孢杆菌构建及其发酵优化[D].无锡:江南大学, 2015.
CHENG Y P.Constructing of a riboflavin high-producer Bacillus subtilis and optimization of riboflavin production[D].Wuxi:Jiangnan University.2015.
[20] 李晓静. 枯草芽孢杆菌核黄素操纵子及呼吸链的代谢工程改造[D].天津:天津大学, 2006.
Li X J.Metabolic engineering of riboflavin operon and respiratory chain of Bacillus subtilis[D].Tianjin:Tianjin University, 2006.
[21] RENNA M C, NAJIMUDIN N, WINIK L R, et al.Regulation of the Bacillus subtilis alsS, alsD, and alsR genes involved in post-exponential-phase production of acetoin[J].Journal of Bacteriology, 1993, 175(12):3 863-3 875.
[22] DAUNER M, STORNI T, SAUER U.Bacillus subtilis metabolism and energetics in carbon-limited and excess-carbon chemostat culture[J].Journal of Bacteriology, 2001,183(24):7 308-7 317.