随着肉牛产业的持续发展,中国牛骨的年产量超过1 200万t。由于加工技术不成熟及处理手段低下,大量牛骨被简单加工成饲料或以骨粉等初级产品出售,造成资源浪费和处理成本的增加[1],因此,牛骨的高值化利用成为畜骨行业亟待解决的产业问题。牛骨中含有丰富的蛋白质、脂肪、矿物质等营养成分,被人类期望成为优质蛋白质的有效替代来源[2],随着分离纯化技术的不断成熟,利用骨蛋白水解制备的多肽已逐渐成为各领域学者的研究热点。
胶原蛋白肽是胶原蛋白的水解产物,与胶原蛋白相比,肽分子中的生物活性氨基酸具有明显的抗氧化作用,可以延缓皮肤老化、预防动脉粥样硬化、促进骨细胞生长等。传统的提取方法有酸法提取、碱法提取和生物酶法提取,其中生物酶法与二者相比反应条件温和,水解程度较高,对氨基酸破坏小,在骨副产物加工过程中已获得广泛应用[3]。SHEN等[4]利用双酶法水解猪骨,成功提取出鲜味肽和抗氧化活性肽,肽的鲜味评分达到8.9分,DPPH自由基清除率达到62.90%。李晓瑞等[5]研究了组合酶对牛骨蛋白水解度及呈味特性的影响,发现碱性蛋白酶和风味蛋白酶组合可提高蛋白水解度,并且明显增加了游离氨基酸和核苷酸等物质含量。李露园等[6]以鲟鱼皮为原料,利用碱性蛋白酶从中提取出4种不同分子质量的胶原蛋白肽,并发现1 000~5 000 Da的胶原蛋白肽抗氧化活性最高,半抑制清除浓度IC50为5.938 g/L。酶法水解一定程度上改善了蛋白质的水解效果,但仍具有耗时、提取率低等问题。近年来,多项研究已经证实超声波辅助酶解技术在食品工业中的巨大潜力,不仅能提高生物活性,改变蛋白质结构,还可以增加蛋白质转化率和酶的水解速率。然而大多数研究主要在植物源成分的提取和开发,对于动物副产物的辅助加工利用却鲜有报道。
本文以牛骨为研究对象,采用超声波辅助酶法提取牛骨胶原蛋白肽,利用响应面法优化提取工艺条件,探讨超声条件下游离氨基酸含量、肽分子质量分布及多肽液浓度对DPPH自由基和超氧阴离子自由基的清除能力,旨在为功能活性肽的开发及牛骨类副产物的转化利用提供理论指导。
1 材料与方法
1.1 材料与试剂
牛骨,经高温蒸煮,烘干粉碎后过80目筛备用,宁夏夏华食品股份有限公司;碱性蛋白酶(酶活力20万U/g)、风味蛋白酶(酶活力3万U/g),北京索莱宝科技有限公司;DPPH、连苯三酚,美国Sigma公司;氢氧化钠、盐酸、甲醇等化学试剂,均为分析级,国药集团化学试剂有限公司(中国上海)。
1.2 仪器与设备
MJ-54A高压灭菌锅,上海施都凯仪器设备有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;BSA224S-CW电子天平,赛多利斯科学仪器有限公司;HH-4恒温数显水浴锅,国华电器有限公司;KQ-500DE超声波清洗机,昆山舒美超声仪器有限公司;冷冻离心机,上海卢湘仪离心机仪器有限公司;1260高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 牛骨粉基本成分测定
牛骨粉中水分、灰分、蛋白质、脂肪、钙含量分别按GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法、GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》高温灰化法、GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法、GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》索氏提取法、GB 5009.92—2003《食品安全国家标准 食品中钙的测定》原子吸收分光光度法进行测定。
1.3.2 牛骨胶原蛋白肽提取工艺流程
牛骨→高压蒸煮→烘干→破碎磨粉→80目过筛→溶解→超声波处理→分步酶解→灭酶(95 ℃,10 min)→冷却→离心分离(4 000 r/min,20 min)→浓缩→冷冻干燥→胶原蛋白肽
1.3.3 单因素试验
在超声波辅助提取牛骨胶原蛋白肽的实验中,使用碱性蛋白酶和风味蛋白酶,添加质量比为1∶1,酶解时间共4 h,考察在超声功率(250、300、350、400、450 W)、超声时间(30、60、90、120、150 min)、底物浓度(2、3、4、5、6 g/100 mL)以及酶添加量(4 000、5 000、6 000、7 000、8 000 U/g)对水解度的影响。
1.3.4 响应面试验
根据单因素试验结果,运用Design-Expert 8.0.6软件,依据Box-Behnken设计原理,以Y(水解度)为响应值,选取X1(超声功率)、X2(超声时间)、X3(底物浓度)、X4(加酶量)为自变量,设计响应面优化试验,因素水平见表1。
表1 试验因素水平表
Table 1 Test factors and levels
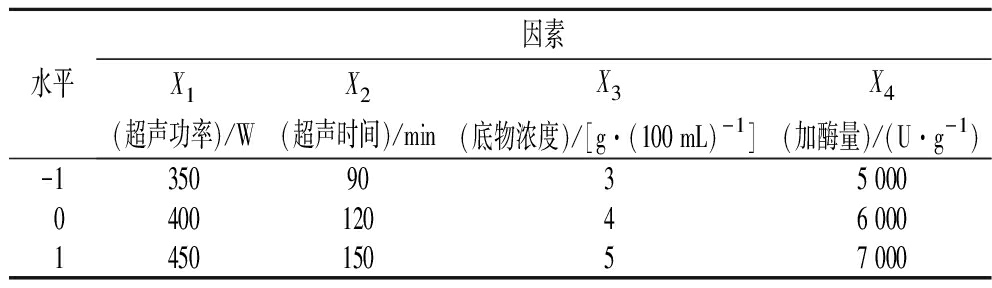
水平因素X1(超声功率)/WX2(超声时间)/minX3(底物浓度)/[g·(100 mL)-1]X4(加酶量)/(U·g-1)-13509035 000040012046 000145015057 000
1.3.5 水解度(degree of hydrolysis,DH)测定
水解度是衡量蛋白质水解程度的重要指标。参考CHI等[7]的方法,采用甲醛滴定法测定牛骨蛋白的水解度,将5 mL牛骨蛋白水解物的上清液与60 mL蒸馏水混合。然后将该溶液用0.05 mol/L NaOH(标准滴定溶液)滴定至pH 8.2,记录消耗的NaOH体积。接着向溶液中加入10 mL甲醛,继续滴定至pH 9.2。然后将消耗的NaOH体积记录为V1。对照组相应消耗的NaOH体积记为V2。水解度计算见公式(1):
(1)
式中:CNaOH,标准滴定NaOH的浓度;V1,pH 8.2至pH 9.2滴定时样品组上清液消耗0.05 mol/L NaOH的体积;V2,对照组上清液从pH 8.2滴定至pH 9.2时消耗0.05 mol/L NaOH的体积;V为骨蛋白水解物的总体积;m,骨粉原料的质量。
1.3.6 游离氨基酸测定
分别用5 mL甲醇、5 mL水对C18净化小柱进行活化,加入2.5 mL酶解样品,1.5 mL 0.02 mol/L盐酸,过柱后的样品准确取100 μL于15 mL离心管中,放入真空干燥箱中,60 ℃干燥2 h(将溶剂全部烘干),离心管中充氮,准确加入50 μL衍生试剂:V(乙醇)∶V(异硫氰酸苯酯)∶V(水)∶V(三乙胺)=7∶1∶1∶1(现用现配,配制时充氮),常温下衍生30 min,加入流动相A 0.45 mL,混合均匀后过0.45 μm滤膜,待HPLC测定。
高效液相色谱条件:色谱柱为C18柱(4.6 mm×250 mm×5 μm),柱温为40 ℃,紫外检测波长为254 nm,进样量为10 μL,流速为1.0 mL/min。流动相A为pH 6.5无水乙酸钠和乙腈的混合溶液,流动相B为乙腈的水溶液,检测时间为45 min。
1.3.7 肽分子质量分布
采用凝胶色谱法对样品的肽分子质量分布进行测定。选用的标准品包括细胞色素C(12 384 Da)、抑肽酶(6 512 Da)、杆菌酶(1 423 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(451 Da)、乙氨酸-乙氨酸-乙氨酸 (189 Da),制作分子质量标准曲线,以确定肽分子质量大致分布。
高效液相色谱条件:流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=40∶60∶0.05,流速0.5 mL/min。取1 mg冷冻干燥后的样品用1 mL流动相溶解,高速离心,取上清液进样。紫外检测波长为220 nm,柱温设置为30 ℃。
1.3.8 DPPH自由基清除能力
参考刘倩霞等[8]的方法稍作修改,用95%的乙醇溶解DPPH,配制成0.2 mmol/L的DPPH溶液,取2 mL样品与之混合均匀,样品分别是超声处理、未超声处理得到的多肽,配制成1~5 mg/mL的多肽液,对照组为同浓度的维生素C。避光反应30 min后,3 000 r/min离心15 min,517 nm波长处测定吸光度,DPPH自由基清除率计算见公式(2):
DPPH自由基清除率![]()
(2)
式中:A0为2 mL样品与2 mL DPPH溶液的吸光度;A1为 2 mL样品与2 mL 95%(体积分数)乙醇溶液的吸光度;A2为2 mL 95%乙醇溶液与2 mL DPPH溶液的吸光度。
1.3.9 超氧阴离子自由基清除能力
参考魏洁琼等[9]的方法稍作修改,取2 mL样品于试管中与2 950 μL Tris-HCl(pH 7.4)溶液和50 μL 5 mmol/L联苯三酚混合,样品分别是超声处理、未超声处理得到的多肽,配制成1~5 mg/mL的多肽液,对照组为同浓度的维生素C。快速振荡后,在325 nm处测定30 s时的吸光度A1,300 s时为A2,超氧阴离子自由基清除率计算见公式(3):
超氧阴离子自由基清除率![]()
(3)
式中:ΔAC=A2-A1;ΔAB为空白组吸光度;双蒸水取代样品。
1.4 数据统计分析
绘图采用Origin 2021软件,显著性分析(P<0.05)及相关性分析采用SPSS 19.0软件进行处理,每个实验在相同条件下重复3次。
2 结果与分析
2.1 牛骨的基本成分
由表2可知,牛骨中含有丰富的蛋白含量和钙含量,适用于骨肽类产品的研制和开发。
表2 牛骨的基本成分
Table 2 Component analysis of bovine bone
成分蛋白质脂肪水分灰分钙含量/%28.04±0.5410.50±0.383.90±0.260.12±0.0321.06±0.74
2.2 单因素试验结果与分析
2.2.1 超声功率对水解度的影响
如图1-a所示,牛骨胶原蛋白的水解度随超声波功率的增加呈先上升后下降的趋势,在400 W时水解度达到最大值19.08%,原因可能是随着超声波功率的增加,因超声空化效应产生的能量,一定程度破坏了蛋白质的结构,暴露出更多的酶的作用位点,增加了酶的利用率[10]。另外,在超声波作用过程中,高速振荡将骨粉分散均匀,使酶与底物充分接触,从而加快了酶促反应的进行。表明适当的超声处理可以增加蛋白质的水解度。但随着超声波功率的增加,在400 W之后水解度开始降低。这可能是超声产生了强烈的空化效应,蛋白质的内部结构和活性位置受到了破坏,导致水解度降低。刘伟[11]探讨了超声波处理对河蚌肉酶解物的影响,同样发现随着超声波的增加,酶解物水解度呈现先上升后下降的趋势,与本实验研究结果一致。因此选择超声处理的功率为400 W。
2.2.2 超声时间对水解度的影响
如图1-b所示,在超声时间为30~120 min时,水解度随超声时间的延长而增加,在120 min达到最大值为17.78%,原因可能是超声波处理产生了较高强度的剪切力和冲击力,进一步导致蛋白质变性以释放出亲水基团,增加了蛋白质的溶解性并使酶与更多的底物结合[12]。随后水解度在120~150 min内呈现下降的趋势,150 min水解度降低为16.43%。可能随着能量的积累,蛋白质的活性位点得到破坏,水解度也随之下降,因此,本文选择的超声预处理的时间为120 min。
2.2.3 底物浓度对水解度的影响
由图1-c可知,在底物浓度为2~4 g/100 mL时,蛋白质水解度随底物浓度的增加而增加,并在4%时水解度达到最大值18.02%,原因可能是酶解反应初期,骨粉中的蛋白质充分溶解,蛋白质提供较多的活性部位,促进了酶促反应的发生。在底物浓度为4~6 g/100 mL,水解度呈下降趋势,底物浓度为6 g/100 mL时,水解度降到16.83%。这可能是底物浓度较大,酶与底物的接触不充分,阻碍酶解反应的进行,从而导致蛋白的水解度下降[13],因此4 g/100 mL是酶解较合适的底物浓度。
2.2.4 加酶量对水解度的影响
由图1-d可知,在加酶量为4 000~6 000 U/g时,蛋白质水解度随加酶量的增加而逐步上升,之后加酶量继续增加,水解度上升平缓,6 000 U/g时水解度已经达到18.32%。可能在酶解初期,随着酶添加量的增加,酶与底物的结合位点增加,产生较多的游离氨基酸和小分子物质,使水解度增加。当添加量到一定值时,酶解反应接近饱和状态,酶继续添加,水解度增加平缓,这与YANG等[14]的研究结果基本一致。考虑到经济成本,选择6 000 U/g的酶添加量较为合适。
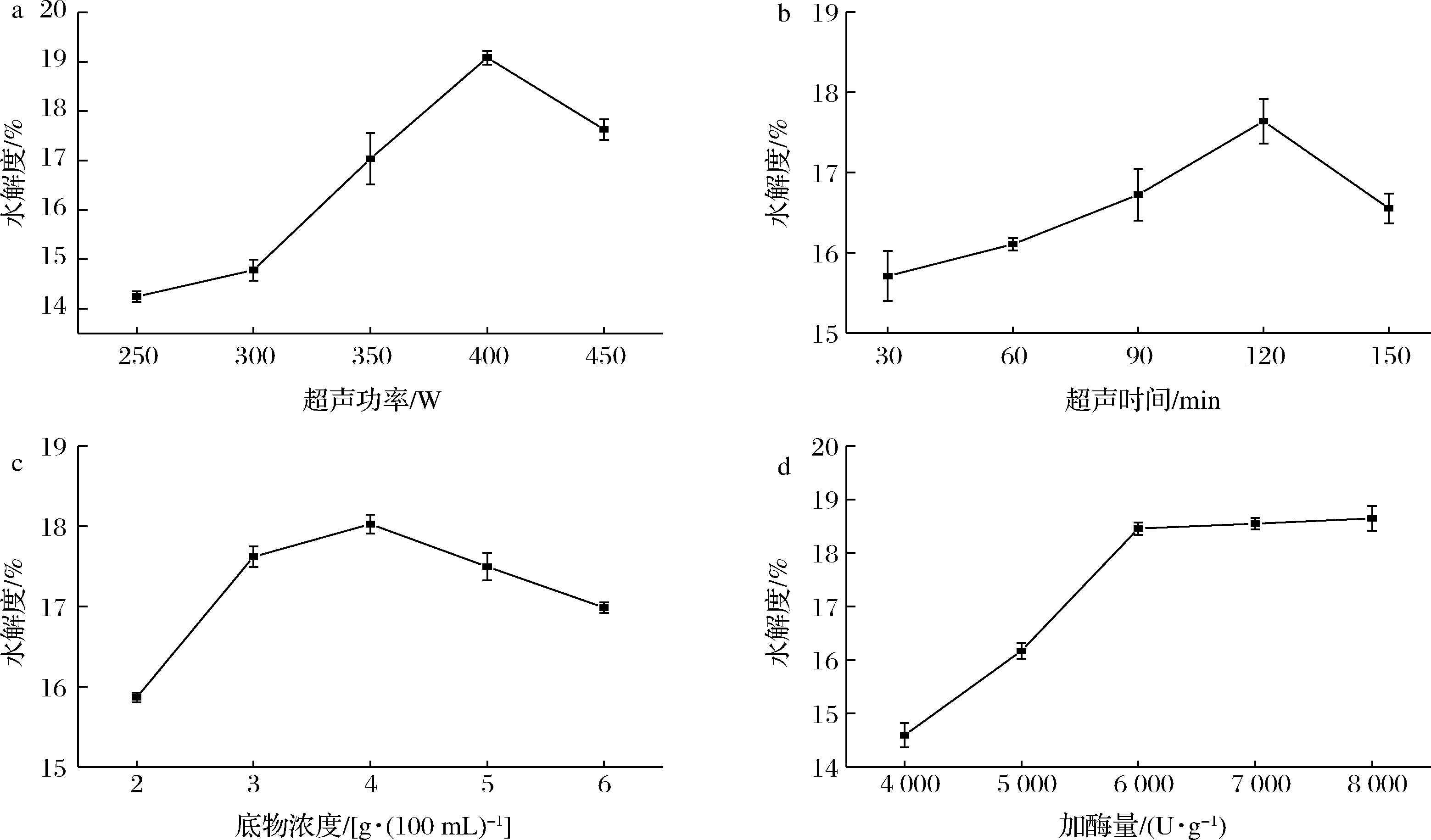
a-超声功率;b-超声时间;c-底物浓度;d-加酶量
图1 不同单因素条件对水解度的影响
Fig.1 The impact of different single factors on the degree of hydrolysis
2.3 响应面优化结果与分析
2.3.1 响应面实验设计及结果
根据单因素的试验结果,以X1(超声功率)、X2(超声时间)、X3(底物浓度)、X4(加酶量)4个因素为自变量,以Y(水解度)为响应值,设计出4因素3水平共29组响应面优化实验,具体试验设计及结果见表3。
2.3.2 二次回归模型的建立及显著性分析
运用Design Expert 8.0.6软件对响应面实验结果进行回归拟合,得到以水解度Y为响应值的二次多项回归方程:
Y/%=20.95+X1+0.16X2+1.29X3+1.10X4+0.18X1X2-0.25X1X3-0.79X1X4-0.44X2X3-0.11X2X4-0.35X3X4-![]()
回归模型方差分析如表4所示,模型的P值<0.000 1,说明模型极其显著,失拟项P值为0.083 1>0.05,不显著,相关系数R2=0.956 8,说明该方程可以较好地反映在酶解提取牛骨胶原蛋白肽的过程中,酶解条件与响应值的关系并预测最佳的水解条件。由P值可知,X1、X3、X4显著,交互项X1X4、X2X3显著,其他交互项不显著,说明各因素对水解度的影响并不是简单地线性关系。二次项均显著,其余不显著。由F值可知,各因素对蛋白质水解的影响顺序为:底物浓度(X3)>加酶量(X4)>超声功率(X1)>超声时间(X2)。
表3 响应面设计及结果
Table 3 Response surface design and results
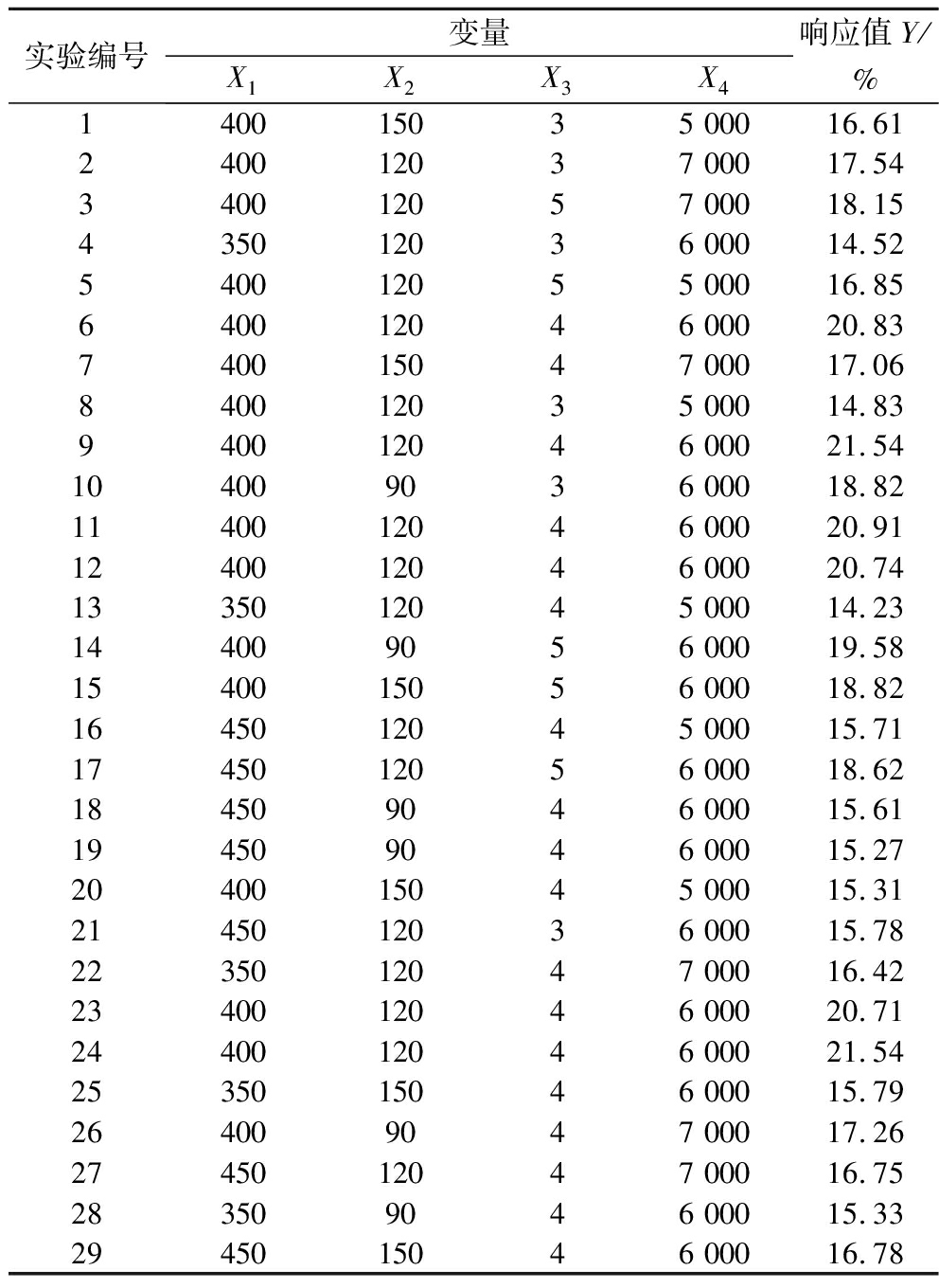
实验编号变量响应值Y/X1X2X3X4%140015035 00016.61240012037 00017.54340012057 00018.15435012036 00014.52540012055 00016.85640012046 00020.83740015047 00017.06840012035 00014.83940012046 00021.54104009036 00018.821140012046 00020.911240012046 00020.741335012045 00014.23144009056 00019.581540015056 00018.821645012045 00015.711745012056 00018.62184509046 00015.61194509046 00015.272040015045 00015.312145012036 00015.782235012047 00016.422340012046 00020.712440012046 00021.542535015046 00015.79264009047 00017.262745012047 00016.75283509046 00015.332945015046 00016.78
表4 回归模型方差分析表
Table 4 Analysis of variance of regression model
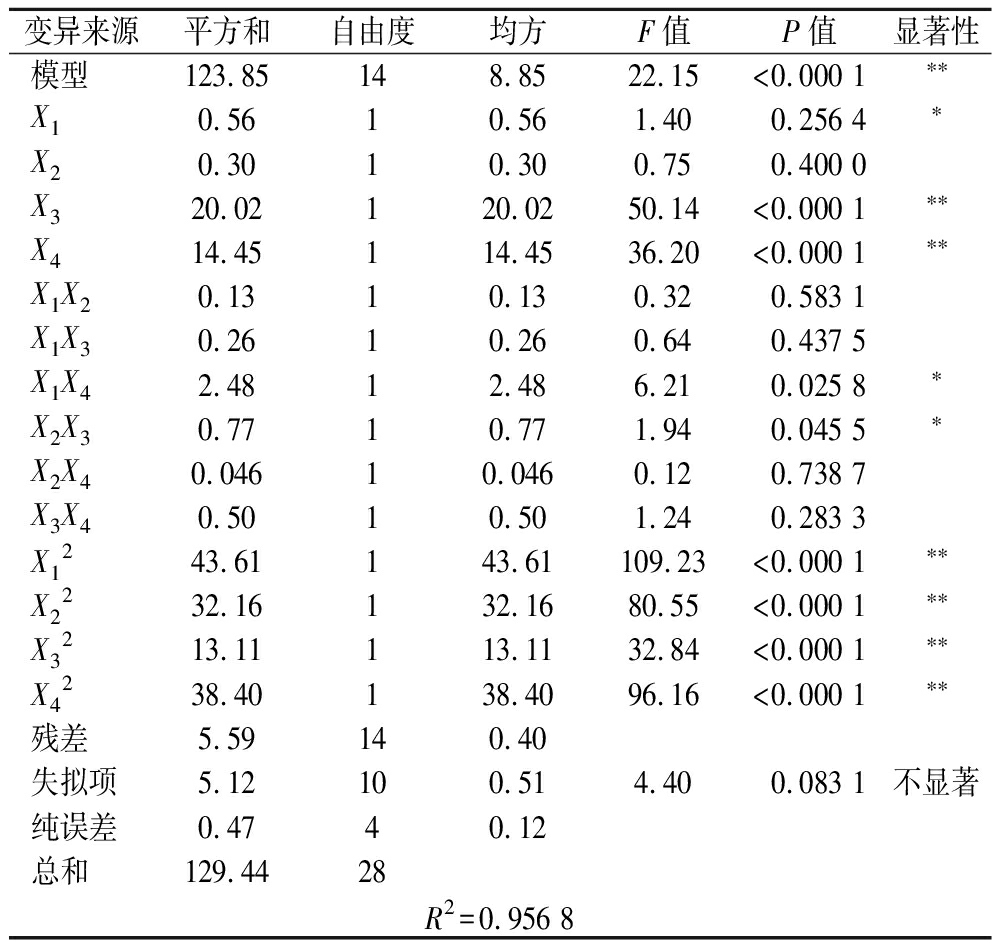
变异来源平方和自由度均方F值P值显著性模型123.85148.8522.15<0.000 1∗∗X10.5610.561.400.256 4∗X20.3010.300.750.400 0X320.02120.0250.14<0.000 1∗∗X414.45114.4536.20<0.000 1∗∗X1X20.1310.130.320.583 1X1X30.2610.260.640.437 5X1X42.4812.486.210.025 8∗X2X30.7710.771.940.045 5∗X2X40.04610.0460.120.738 7X3X40.5010.501.240.283 3X1243.61143.61109.23<0.000 1∗∗X2232.16132.1680.55<0.000 1∗∗X3213.11113.1132.84<0.000 1∗∗X4238.40138.4096.16<0.000 1∗∗残差5.59140.40失拟项5.12100.514.400.083 1不显著纯误差0.4740.12总和129.4428R2=0.956 8
注:*表示差异显著(0.01<P<0.05);**表示差异极显著(P<0.01)
2.3.3 响应面分析
运用Design Expert 8.0.6软件并分析响应面优化试验结果,得到响应曲面图。曲面的坡度大小反映了各因素对水解度的影响程度,曲面越陡峭,说明该因素对水解度的影响越大。曲面越缓,说明该因素对水解度的影响不显著[15]。由图2可知,所有的响应曲面图均为凸面,随着超声功率、超声时间和底物浓度的增加,水解度均呈现先上升后其下降的趋势,与单因素试验结果一致。
2.3.4 响应面验证试验
通过回归拟合得出牛骨胶原蛋白肽的最优提取参数为超声功率399.49 W、超声时间119.62 min、底物浓度4.43 g/100 mL、加酶量6 196.42 U/g,在该条件下预测得出牛骨胶原蛋白的水解度为21.33%,为了操作方便,实际取值为超声功率400 W、超声时间120 min、底物浓度4.4%、加酶量6 000 U/g,在此条件下测得牛骨胶原蛋白的水解度为20.94%,与预测值接近,说明该模型适用于超声波辅助酶法提取牛骨胶原蛋白肽的工艺优化。

图2 不同因素对牛骨蛋白蛋水解度影响的响应面图
Fig.2 The response surface diagram of different factors affect the hydrolysis of beef protein eggs
2.4 游离氨基酸测定结果
利用优化后的超声工艺对牛骨粉溶液充分酶解,酶解液中游离氨基酸组成及含量如表5所示。酶解液中共检测出16种游离氨基酸,其中含量较高的氨基酸为Gly、Ala、Arg和Val,是牛骨多肽液主要的氨基酸成分。从氨基酸的种类来看,疏水性氨基酸含量达到35.67%,对牛骨胶原蛋白肽的抗氧化活性有一定的促进作用,必需氨基酸含量达到了45.67%,可能是超声预处理改变了蛋白质的结构,增加了酶和蛋白质的亲和力,从而促进了蛋白质的酶解效果,最终产生了较多的游离氨基酸。
表5 牛骨酶解液中游离氨基酸种类及含量
Table 5 Types of amino acids and content in bovine bonesenes
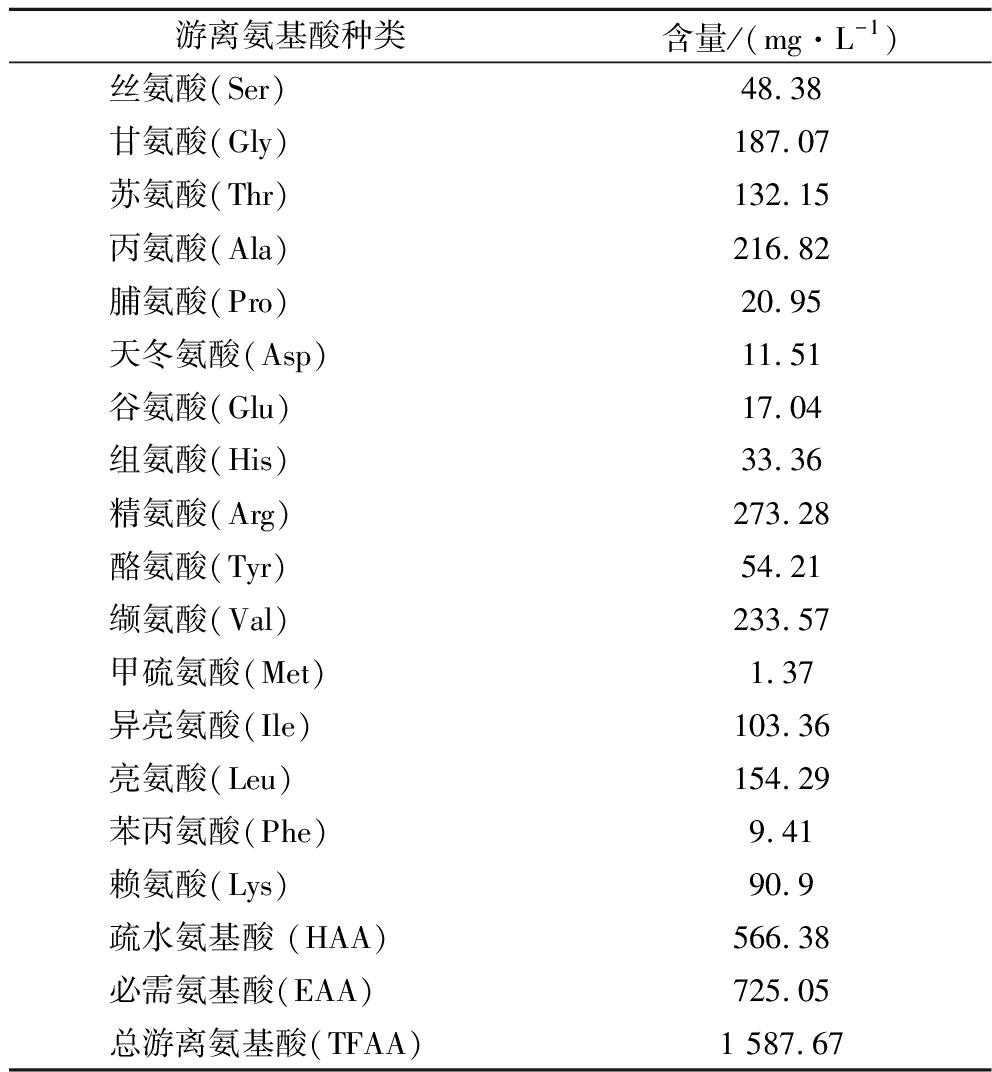
游离氨基酸种类含量/(mg·L-1)丝氨酸(Ser)48.38甘氨酸(Gly)187.07苏氨酸(Thr)132.15丙氨酸(Ala)216.82脯氨酸(Pro)20.95天冬氨酸(Asp)11.51谷氨酸(Glu)17.04组氨酸(His)33.36精氨酸(Arg)273.28酪氨酸(Tyr)54.21缬氨酸(Val)233.57甲硫氨酸(Met)1.37异亮氨酸(Ile)103.36亮氨酸(Leu)154.29苯丙氨酸(Phe)9.41赖氨酸(Lys)90.9疏水氨基酸 (HAA)566.38必需氨基酸(EAA)725.05总游离氨基酸(TFAA)1 587.67
2.5 牛骨胶原蛋白肽分子质量分布
采用高效液相色谱技术检测牛骨胶原蛋白肽的分子质量分布情况,结果如表6所示。在超声辅助酶解的最优条件下,多肽的分子质量基本在3 000 Da以下,肽分子质量在1 000~3 000 Da的肽段含量为10.16%,1 000 Da以下的肽段含量最多,达到86.83%,通常,分子质量低于5 000 Da的肽段即被称为低分子质量肽,将近90%都会被人体消化吸收,低分子质量肽可以抑制自由基的产生,加速蛋白质合成,提高矿物质的吸收和利用,增强人体免疫力[16]。因此,超声辅助酶解法为牛骨胶原蛋白肽的生产利用提供了一定的技术支持。
表6 牛骨胶原蛋白肽的分子质量分布
Table 6 Molecular weight distribution of oxide collagen peptide
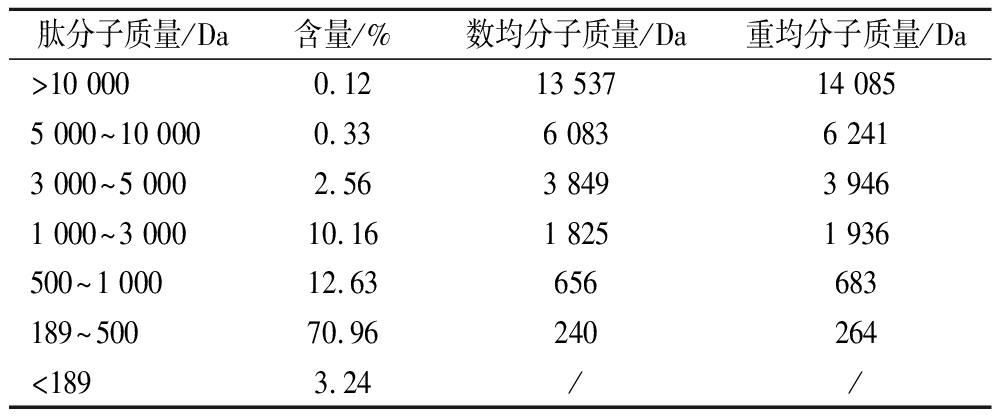
肽分子质量/Da含量/%数均分子质量/Da重均分子质量/Da>10 0000.1213 53714 0855 000~10 0000.336 0836 2413 000~5 0002.563 8493 9461 000~3 00010.161 8251 936500~1 00012.63656683189~50070.96240264<1893.24//
2.6 体外抗氧化活性分析
2.6.1 DPPH自由基清除能力
蛋白质适度酶解产生的多肽具有一定的抗氧化能力,可通过DPPH指标评价其抗氧化能力的强弱[17]。由图3可知,在1~5 mg/mL内,随多肽液质量浓度的增加,DPPH自由基清除能力增强,表明多肽液浓度和DPPH自由基清除能力具有一定的量效关系,这和南学敏[18]在研究羊骨胶原蛋白肽的抗氧化活性结果趋于一致。和维生素C对照组相比,相同浓度下超声预处理和未预处理的多肽液均不及维生素C对DPPH自由基清除能力,并且二者对DPPH自由基清除能力有显著差异(P<0.05),当多肽液质量浓度在5 mg/mL时清除率最大,其值分别为43.80%和37.33%,说明超声预处理后酶解得到的牛骨胶原蛋白肽具有一定的抗氧化能力,这和YU等[19]在超声辅助酶解提高花生酶解物抗氧化活性的研究结果一致,超声处理对DPPH自由基清除能力的提高具有促进作用。
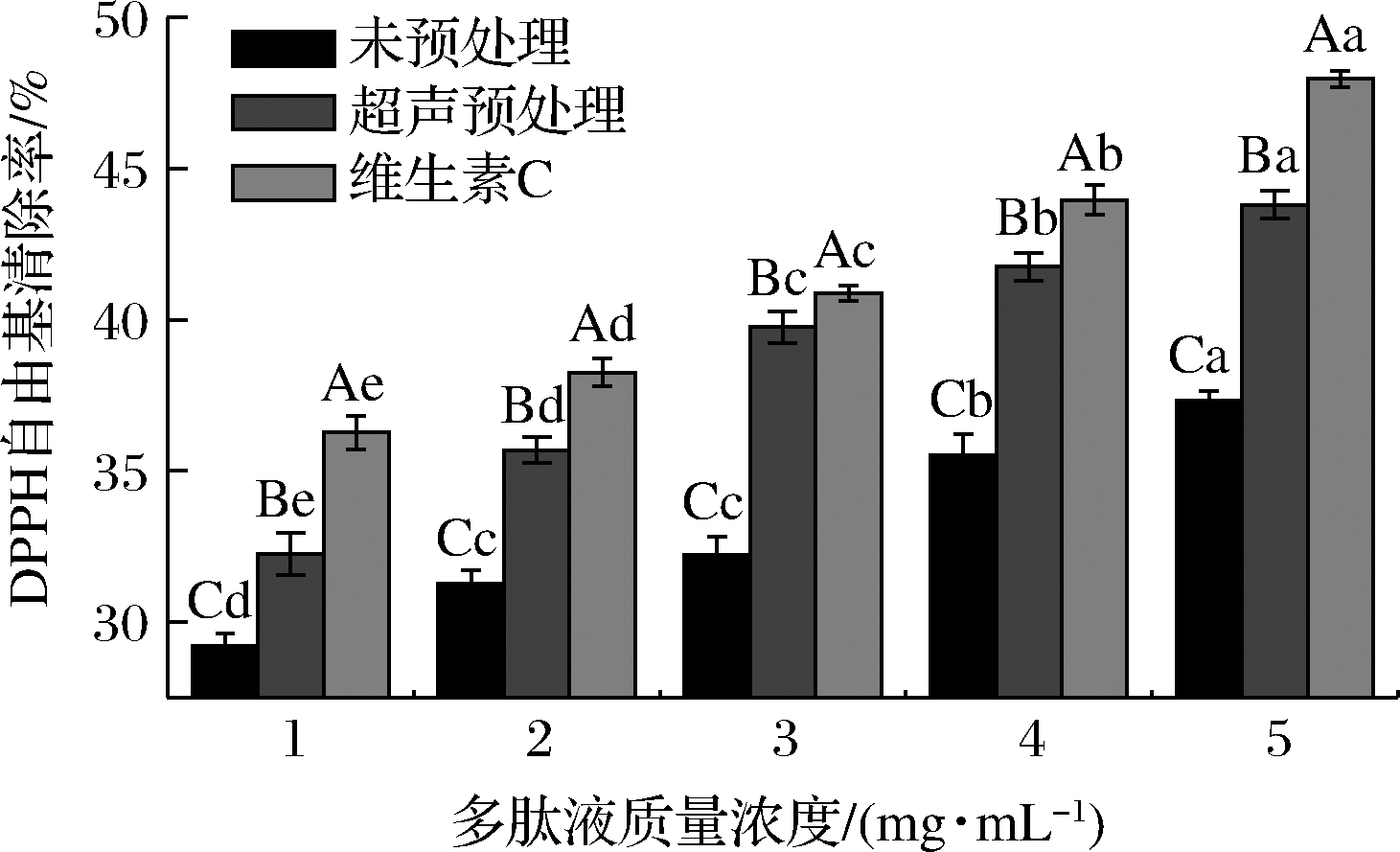
图3 多肽液质量浓度对DPPH自由基清除能力的影响
Fig.3 The effect of different peptides concentration on DPPH free radical clearance ability
注:不同的小写字母代表组间差异显著,不同的大写字母 代表组内差异显著(P<0.05)(下同)
2.6.2 超氧阴离子自由基清除能力
超氧阴离子是在人体内产生的一种活性氧自由基,过量的超氧阴离子会导致细胞损伤,从而破坏人体正常的生理机能,常常和DPPH自由基等一同作为评价体外抗氧化性的重要指标[20]。由图4可知,在质量浓度1~3 mg/mL内,多肽液对超氧阴离子自由基清除能力显著上升(P<0.05),在3~5 mg/mL内,超声预处理组的多肽液对超氧阴离子自由基的清除能力接近于维生素C对照组,在5 mg/mL时达到最大值,分别为64.74%和65.82%,而未进行预处理的组别则显著低于超声处理组和维生素C对照组(P<0.05),超氧阴离子自由基清除率为57.41%。说明超声预处理明显提升了牛骨胶原蛋白肽对超氧阴离子自由基的清除能力,这和YANG等[14]在研究超声辅助双酶酶解对提取肽抗氧化活性中的影响中结果一致。
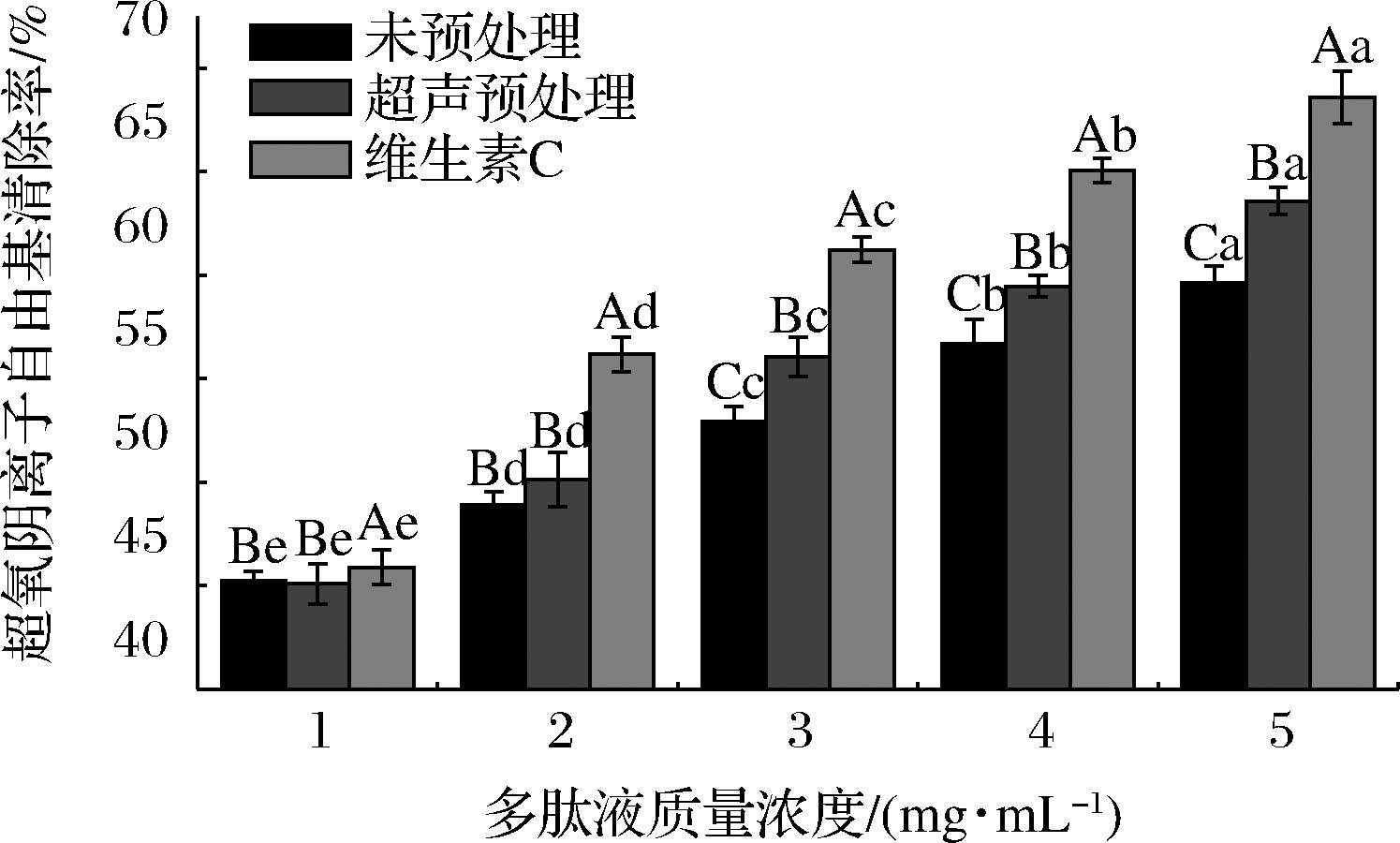
图4 多肽液质量浓度对超氧阴离子自由基清除能力的影响
Fig.4 The effect of different peptides concentration on the ability of super oxygen ion free radicals
3 结论
采用超声波辅助酶法提取牛骨胶原蛋白肽,通过响应面法优化得出最优的提取工艺条件,并研究了超声条件下游离氨基酸种类、肽分子质量分布及多肽液浓度对DPPH自由基和超氧阴离子自由基的清除能力。结果表明,在超声功率为400 W,超声时间120 min,底物浓度4.4 g/100 mL和加酶量6 000 U/g的酶解条件下,胶原蛋白水解度达到21.54%,多肽提取效果最优,各因素对多肽提取的影响顺序为底物浓度<加酶量<超声功率<超声时间。多肽液中疏水性氨基酸和必需氨基酸含量分别达到35.67%和45.67%,肽分子质量基本在3 000 Da以下其中1 000 Da以下的肽段含量最高为86.83%。牛骨胶原蛋白肽对DPPH自由基和超氧阴离子自由基表现出良好的清除能力,在5 mg/mL时分别达到了43.80%和64.74%,由此可见,超声处理后的牛骨胶原蛋白肽具有明显的抗氧化活性。本文证实了超声波辅助酶解技术可有效提高牛骨牛骨胶原蛋白肽的提取率及抗氧化能力,可为畜骨副产物的高值化提供理论参考。
[1] SONG S Q, LI S S, FAN L, et al.A novel method for beef bone protein extraction by lipase-pretreatment and its application in the Maillard reaction[J].Food Chemistry, 2016, 208:81-88.
[2] CHIANG J H, HARDACRE A K, PARKER M E.Effects of Maillard-reacted beef bone hydrolysate on the physicochemical properties of extruded meat alternatives[J].Journal of Food Science, 2020, 85(3):567-575.
[3] 刘斯汝, 罗龙龙, 任卫合, 等.牛肉酶解工艺优化及其氨基酸组成分析[J].肉类研究, 2020, 34(11):21-26.
LIU S R, LUO L L, REN W H, et al.Optimization of enzymatic hydrolysis of beef and analysis of amino acid composition of hydrolysate[J].Meat Research, 2020, 34(11):21-26.
[4] SHEN D Y, BEGUM N, SONG H L, et al.In vitro and in vivo antioxidant activity and umami taste of peptides (<1 kDa) from porcine bone protein extract[J].Food Bioscience, 2021, 40:100901.
[5] 李晓瑞, 王梓, 刘贵珊, 等.组合酶对复合骨素酶解液呈味物质的影响[J].食品工业科技, 2020, 41(22):50-56.
LI X R, WANG Z, LIU G S, et al.Effects of combined enzymes on flavoring substances of compound osteolysin hydrolysate[J].Science and Technology of Food Industry, 2020, 41(22):50-56.
[6] 李露园, 王升帆, 朱有贵, 等.酶法制备鲟鱼皮胶原蛋白多肽及其抗氧化活性研究[J].食品与发酵工业, 2019, 45(20):138-143.
LI L Y, WANG S F, ZHU Y G, et al.Enzymatic preparation and antioxidant activity of sturgeon skin collagen polypeptide[J].Food and Fermentation industries, 2019, 45(20):138-143.
[7] CHI C F, WANG B, HU F Y, et al.Purification and identification of three novel antioxidant peptides from protein hydrolysate of bluefin leatherjacket (Navodon septentrionalis) skin[J].Food Research International, 2015, 73:124-129.
[8] 刘倩霞, 刘东, 张俊, 等.2种蛋白酶酶解曲拉干酪素条件优化及抗氧化性比较[J].食品科学, 2019, 40(8):225-234;218.
LIU Q X, LIU D, ZHANG J, et al.Optimization of hydrolysis conditions of Qula casein with two proteases and comparative antioxidant activity of hydrolysates[J].Food Science, 2019, 40(8):225-234;218.
[9] 魏洁琼, 余群力, 韩玲, 等.牛骨胶原蛋白肽制备工艺优化及抗氧化活性分析[J].甘肃农业大学学报, 2020, 55(5):203-211;218.
WEI J Q, YU Q L, HAN L, et al.Optimization of preparation process and antioxidant activity analysis of bovine bone collagen peptide[J].Journal of Gansu Agricultural University, 2020, 55(5):203-211;218.
[10] UMEGO E C, HE R H, REN W B, et al.Ultrasonic-assisted enzymolysis:Principle and applications[J].Process Biochemistry, 2021, 100:59-68.
[11] 刘伟. 超声波处理对河蚌肉酶解物美拉德反应的影响及其微囊化调味料制备[D].长春:吉林大学, 2019.
LIU W.Effect of ultrasonic treatment on Maillard reaction of mussel meat hydrolysate and preparation of microencapsulated seasoning[D].Changchun:Jilin University, 2019.
[12] DONG Z Y, LI M Y, TIAN G, et al.Effects of ultrasonic pretreatment on the structure and functionality of chicken bone protein prepared by enzymatic method[J].Food Chemistry, 2019, 299:125103.
[13] 董海英. 鸭骨的酶法水解及产物的初步应用研究[D].武汉:武汉工业学院, 2010.
DONG H Y.Enzymatic hydrolysis of duck bone and prelimlinary application of the product[D].Wuhan:Wuhan Polytechnic University, 2010.
[14] YANG L H, GUO Z L, WEI J Q, et al.Extraction of low molecular weight peptides from bovine bone using ultrasound-assisted double enzyme hydrolysis:Impact on the antioxidant activities of the extracted peptides[J].LWT, 2021, 146:111470.
[15] 李云嵌, 杨曦, 刘江, 等.超声波辅助碱法提取美藤果分离蛋白及其加工性质研究[J].食品与发酵工业, 2021, 47(9):128-135.
LI Y Q, YANG X, LIU J, et al.Ultrasonic-assisted alkaline extraction of Plukenetia volubilis protein isolate and its processing properties[J].Food and Fermentation Industry, 2021, 47(9):128-135.
[16] YAMAMOTO S, DEGUCHI K, ONUMA M, et al.Absorption and urinary excretion of peptides after collagen tripeptide ingestion in humans[J].Biological &Pharmaceutical Bulletin, 2016, 39(3):428-434.
[17] 王子涵, 向敏, 徐茂, 等.响应面优化黑果腺肋花楸汁澄清工艺及其抗氧化活性评价[J].食品与发酵工业, 2021, 47(8):189-196.
WANG Z H, XIANG M, XU M, et al.Optimization of clarification process of Aornia melanocarpa juice by response surface methodology and its antioxidant activity evaluation[J].Food and Fermentation Industries, 2021, 47(8):189-196.
[18] 南学敏. 羊骨胶原蛋白肽抗氧化活性及氨基酸组成分析[D].呼和浩特:内蒙古农业大学, 2019.
NAN X M.Analysis of antioxidant activity and amino acid composition of sheep bone collagen peptide[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[19] YU L N, SUN J, LIU S F, et al.Ultrasonic-assisted enzymolysis to improve the antioxidant activities of peanut (Arachin conarachin L.) antioxidant hydrolysate[J].International Journal of Molecular Sciences, 2012, 13(7):9 051-9 068.
[20] RAGHAVAN S,KRISTINSSON H G. ACE-inhibitory activity of tilapia protein hydrolysates[J].Food Chemistry, 2009, 117(4):582-588.