白酒,是一种具有数千年历史的传统蒸馏酒,在中国文化中具有重要地位[1-2]。白酒以富含淀粉和蛋白质的粮谷类(高粱、大麦、豌豆等)为主要酿酒原料,以酒曲为糖化剂,多种微生物(酵母菌、细菌、霉菌等)混菌培养,经半固态、固态和液态发酵,甑桶蒸馏,长期贮存,勾兑调配而成。与以谷物为原料的威士忌、伏特加等西方蒸馏酒相比,白酒的酿造工艺相对独特[3],因此形成了香型多样、化合物组成复杂的中国白酒,其中乙醇和水(占总量98%~99%)是白酒的主要成分,剩余微量成分(占总量1%~2%)是构成白酒典型风味特征的物质基础[4],决定着白酒的风格和质量。
凤香型白酒,源于浓香型和清香型白酒[5]。西凤酒,作为凤香型白酒之宗[6],选取大麦、豌豆混合制曲,以优质的高粱为原料,配以天赋甘美的柳林井水,采用土暗窖固态续楂法,老五甑混蒸混烧而得新酒,经酒海贮存3年以上,待自然老熟后,以酒勾酒,精心调制而成。白酒虽然不是人们生活的必需品,但却是过节、好友聚会、欢庆胜利必不可少的助兴消费性饮品,所以白酒对人体健康的影响是值得关注的热点[7]。
在前期试验过程中,本课题组通过不同前处理方法结合不同检测手段对西凤酒中的微量成分进行了分析,结果显示,红西凤作为西凤酒的高端白酒,微量成分种类和总含量都是最突出的,这些成分中含有多种对人体健康有益的功能性组分(酯类、酸类、酚类、吡嗪类、典型生物活性成分等)[8]。当前,孙宝国等[9]提出为了白酒行业的健康发展,白酒乃至整个酿酒行业应朝着“风味与健康”双导向方向发展,因此本研究在前期试验基础上,以红西凤为研究对象,食用酒精为对照,探讨不同剂量红西凤全酒干预对人正常肝细胞(LO2细胞)和健康小鼠肠道菌群的影响,以期为西凤酒的健康消费提供理论支撑。
1 材料与方法
1.1 材料与试剂
红西凤(Hongxifeng,hxf)、食用酒精(edible alcohol,EdOH),由陕西西凤酒股份有限公司提供;LO2细胞,由中国微生物菌种保藏中心提供;40只健康的清洁级雄性昆明小鼠,4周龄,体重25~27 g,西安交通大学实验动物中心,生产许可证号:SCXK(陕)2020-008。
二氯甲烷(色谱纯)、氯化钠,天津市科密欧化学试剂有限公司;N-甲基-N-(三甲基硅烷)三氟乙酰胺[N-methyl-N-(trimethylsilane) trifluoroacetamide,MSTFA]、四甲基偶氮唑盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT]、二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma-Aldrich公司;PBS缓冲液、含10%胎牛血清的PRMI1640培养基,美国Hyclone公司;谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总甘油三酯(total triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
GC-MS-2030气相色谱-质谱联用仪,岛津企业管理(中国)有限公司;ZGDCY-12干式氮吹仪,上海梓桂仪器有限公司;CT15 RT台式冷冻离心机,长沙湘仪离心机仪器有限公司;MK3酶标检测仪、BB150细胞培养箱,美国Thermo Fisher Scientific公司;IX71荧光倒置显微镜,日本OLYMPUS公司。
1.3 实验方法
1.3.1 西凤酒全酒干预对LO2细胞的影响
1.3.1.1 细胞培养
(1)细胞扩大培养后,收集对数生长期LO2细胞,消化细胞后取少量细胞悬液计数,调整细胞悬液浓度为0.8×104个/mL,接种于96孔培养板中,每孔加入100 μL 1640培养基,边缘孔加入PBS,置于37 ℃、5%(体积分数)CO2培养箱培养;
(2)待细胞均匀铺满孔底,加入乙醇体积分数分别为1%、3%和5%的hxf和EdOH,设置3个复孔,培养48 h后倒置显微镜观察。
1.3.1.2 细胞增殖抑制率测定
(1)培养48 h后的细胞,每孔加入MTT溶液(5 mg/mL)20 μL,置于恒温培养箱中继续孵育,4 h后吸去上清液,每孔加入200 μL DMSO,于摇床振荡10 min;
(2)酶标仪492 nm处测OD值,将不添加乙醇时的OD值作为空白组,根据公式(1)计算不同乙醇浓度下的细胞增殖抑制率。
细胞增殖抑制率![]()
(1)
式中:A0,空白组平均OD值,nm;A1,对照组平均OD值,nm;A2,实验组平均OD值,nm。
1.3.1.3 ALT、AST活性测定
(1)收集对数生长期细胞,接种于6孔培养板中,每孔加入3 mL 1640培养基,调整细胞密度为5×105 个/mL,置于37 ℃、5% CO2培养箱内孵育48 h;
(2)加入乙醇体积分数分别为1%、3%和5%的hxf和EdOH,设置3个复孔,培养48 h;
(3)48 h后收集上清液于无菌EP管中,置于全自动生化仪检测ALT和AST含量。
1.3.2 西凤酒全酒干预对健康小鼠的影响
1.3.2.1 西凤酒全酒干预对小鼠肝损伤的影响
(1)EdOH化学成分分析
为了排除EdOH中是否含有除乙醇以外的其他成分对试验结果造成干扰,采用课题组建立的涡旋辅助液液微萃取(vortex-assisted liquid-liquid microextraction,VA-LLME)和MSTFA衍生化结合GC-MS对其成分进行分析。
(2)hxf干预的小鼠模型建立
小鼠饲养在温度恒定为(22±1) ℃,湿度恒定为50%~60%,光照设定为12 h光/暗循环,照度为15~20 lx的实验室。整个干预期间,各组小鼠自由摄入水和基础饲料。hxf干预之前,小鼠适应性饲养1周,1周之后将小鼠随机分为5组,每组8只,组别设置及灌胃剂量如表1所示。灌胃剂量参考相关文献[10-11]报道及美国国立卫生研究院推荐的标准饮酒计量。
表1 实验动物分组与处理 单位:mL/(kg·d)
Table 1 Grouping and treatment of experimental animals

组别灌胃剂量正常组(Control)0.93(0.9%生理盐水)低剂量-食用酒精组(L-EdOH)0.93高剂量-食用酒精组(H-EdOH)4.66低剂量-红西凤组(L-hxf)0.93高剂量-红西凤组(H-hxf)4.66
注:灌胃前,先将食用酒精稀释至与红西凤相同酒精度
(3)样本采集
整个试验周期为12周,每周监测1次体重,12周后将小鼠禁食(不禁水)12 h,乙醚麻醉后处死,收集血液、肝脏、盲肠等器官,根据试验需要进行称重,一部分固定于4%多聚甲醛溶液中,一部分立即贮存于-80 ℃,采集的血液在4 ℃下静置30 min后,3 000 r/min离心20 min,取上清液立即贮存于-80 ℃待测。
(4)生化指标测定
AST、ALT、TG、TC、HDL-C、LDL-C测定程序严格按照试剂盒说明书操作。
(5)肝脏病理学分析
小鼠解剖后,将新鲜的肝脏组织切取0.5 cm×0.5 cm固定在4%多聚甲醛溶液中超过12 h,经梯度酒精脱水,二甲苯透明化后,将组织包埋在石蜡中切片约4 μm,苏木精-伊红(hematoxylin-eosin,HE)染色,电子显微镜观察肝脏病变程度,对相应区域拍照。
1.3.2.2 西凤酒全酒干预对小鼠肠道菌群的影响
将收集的各处理组小鼠粪便通过干冰运输至北京诺禾致源科技股份有限公司进行高通量测序。测序结束后,参照文献[12-14]中的方法对所有样本的全部有效数据(effective tags)以97%的相似度进行聚类,划分操作分类单元(operational taxonomic units,OTUs)。使用Qiime软件计算Observed-species、ACE、PD-whole-tree、Chao l、Shannon、Simpson指数评价微生物群落的α-多样性,通过主坐标分析(principal co-ordinates analysis,PCoA)评价微生物群落的β-多样性,通过线性判别分析(linear discriminant analysis,LDA)和线性判别分析效果大小(linear discriminant analysis effect size,LEfSe)识别差异菌落,LDA阈值设为4.0。
1.4 数据分析
数据表示为平均值±标准差,统计学分析采用SPSS 19和GraphPad Prism 6软件,图形绘制采用Origin 2018等相关软件。
2 结果与分析
2.1 西凤酒全酒干预对LO2细胞的影响
2.1.1 细胞增殖抑制率测定
由图1可知,细胞增殖抑制率与乙醇浓度呈正相关性,乙醇浓度越高,细胞增殖抑制率越大。同乙醇浓度下,hxf和EdOH干预组之间具有显著性差异(P<0.05),hxf干预组的细胞增殖抑制率显著低于EdOH。众所周知,hxf和EdOH的区别在于前者中除了含有乙醇外,还有多种微量组分,因此这一结果提示,hxf中的微量成分对酒精引起的LO2细胞损伤具有一定保护作用,表现为对LO2细胞的损伤程度轻于EdOH。

图1 不同乙醇浓度下的细胞增殖抑制率
Fig.1 Cell proliferation inhibition rate at different ethanol concentrations
注:不同小写字母代表组间具有显著性差异(P<0.05)(下同)
2.1.2 ALT、AST活性测定
由图2可知,细胞ALT和AST泄漏量与乙醇浓度呈正相关性,乙醇浓度越高,ALT和AST泄漏量越大。同乙醇浓度下,hxf和EdOH干预组之间具有显著性差异(P<0.05),hxf干预组的ALT和AST泄露量低于EdOH组,表明hxf对LO2细胞的损伤程度轻于EdOH,这与MTT结果相吻合,进一步说明hxf中的微量组分之间可能具有协同增效的作用,表现为对酒精引起的LO2细胞损伤具有一定程度的保护作用。

a-ALT;b-AST
图2 不同乙醇浓度下细胞内ALT、AST的含量
Fig.2 The content of ALT and AST in cells under different ethanol concentrations
2.2 西凤酒全酒干预对小鼠肝脏的影响
2.2.1 EdOH成分分析
由图3-a和图3-b可知,EdOH挥发性化合物总离子流图中仅出现了乙醇峰,难挥发性化合物总离子流图中峰数量也明显很少。然而,由图3-c和图3-d可知,hxf挥发性和难挥发性化合物总离子流图中的峰数量均明显多于EdOH。这一结果基本可以排除EdOH中除乙醇之外的其他成分对后续试验结果产生干扰。

a-EdOH挥发性化合物;b-EdOH难挥发性化合物;c-hxf挥发性化合物;d-hxf难挥发性化合物
图3 EdOH和hxf中挥发性、难挥发性化合物的总离子流图
Fig.3 Total ion flow diagram of volatile and non-volatile compounds in EdOH and hxf
2.2.2 西凤酒全酒干预对小鼠表型的影响
连续12周灌胃不同剂量EdOH和hxf结束后,对小鼠的表型进行了分析,结果见图4。
由图4可知,与Control组相比,不同剂量EdOH和hxf干预均显著降低小鼠体重(L-EdOH P<0.01,H-EdOH、H-hxf P<0.001)(图4-a),显著升高小鼠肝重体重比(L-EdOH P<0.01,L-hxf P<0.05,H-EdOH、H-hxf P<0.001)(图4-b)。这可能是因为EdOH和hxf中的酒精长期积蓄导致小鼠食欲下降,从而造成小鼠体重下降,此外,根据酒精在体内的代谢途径可知,长期的酒精刺激会给肝脏带来不可避免的损伤,因此导致小鼠肝重增加。在同剂量下,L-EdOH与L-hxf之间均无显著性差异,而H-EdOH与H-hxf组之间在小鼠体重上存在差异(P<0.05),小鼠肝重体重比仍无差异。不同剂量hxf干预结果表明,随着干预剂量的加大,小鼠体重显著下降(P<0.01),肝重体重比显著升高(P<0.001)。
综上,EdOH和hxf干预均会导致小鼠体重下降,肝重体重比上升,但hxf干预对小鼠的影响轻于EdOH,且L-hxf干预产生的影响最轻,这一结果提示hxf中的微量成分在协同作用下可以缓解酒精对小鼠表型产生的负面影响。
2.2.3 西凤酒全酒干预对小鼠生化指标的影响
AST和ALT是反映肝脏功能的重要指标,为了验证不同剂量EdOH和hxf干预对小鼠肝脏的损伤情况,对小鼠血清中AST、ALT的活性进行了分析,结果见图5。
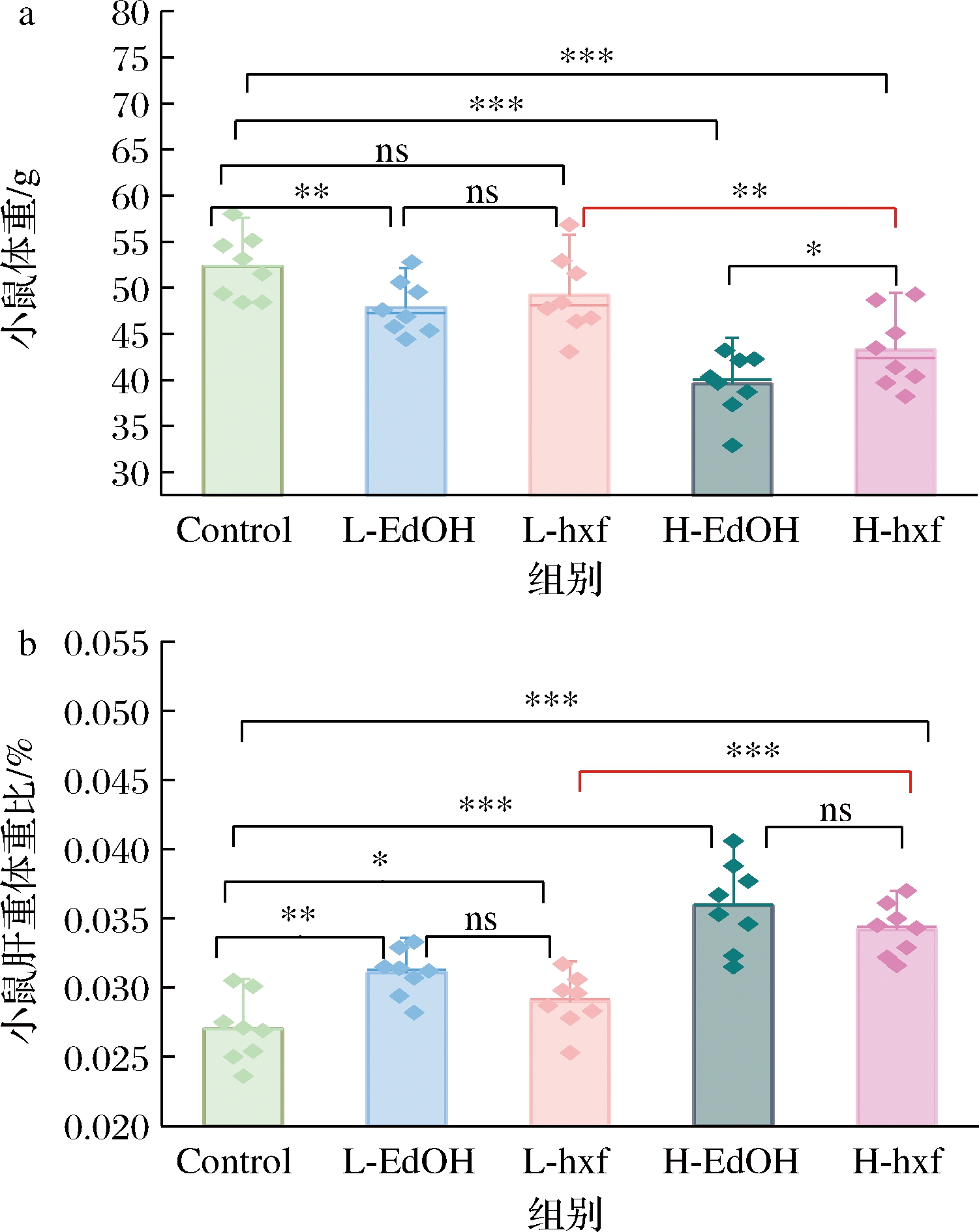
a-体重;b-肝重体重比
图4 hxf干预对小鼠体重、肝重体重比的影响
Fig.4 Effects of hxf intervention on body weight, liver weight to body weight ratio in mice
注:*表示P<0.05;**表示P<0.01;***表示P<0.001; ns表示无显著性差异(下同)
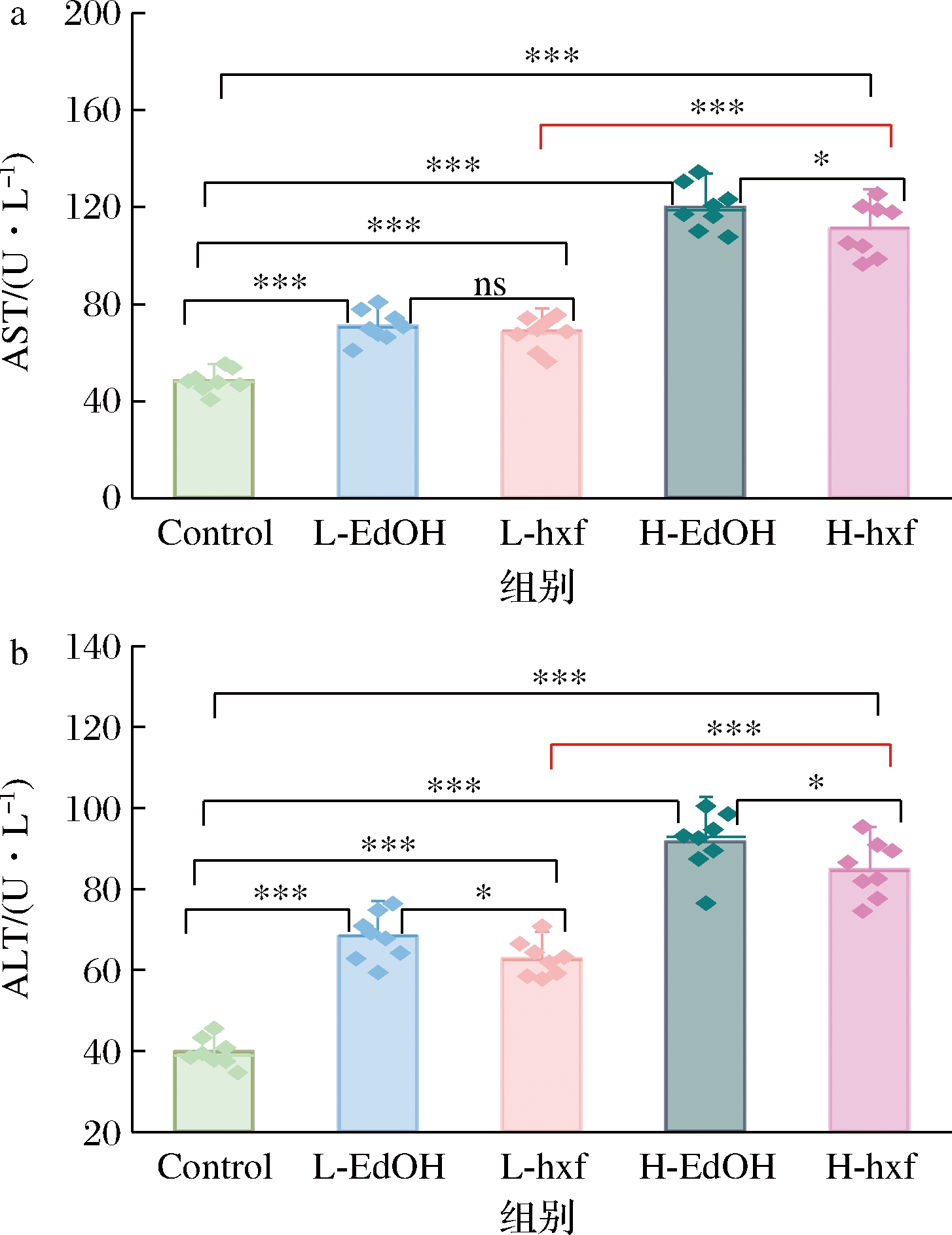
a-AST;b-ALT
图5 hxf干预对小鼠血清AST、ALT活性的影响
Fig.5 Effects of hxf intervention on serum AST and ALT activities in mice
由图5可知,与Control组相比,不同剂量EdOH和hxf干预均导致小鼠血清中的AST、ALT活性显著升高(P<0.001),并具有明显的剂量依赖性。在同剂量下,L-EdOH和L-hxf干预组小鼠血清中的AST活性无显著性差异,ALT活性存在差异(P<0.05),但H-EdOH和H-hxf干预组中2种酶活性均明显上升(P<0.05)。不同剂量hxf干预结果表明,随着干预剂量的加大,2种酶的活性显著增大(P<0.001)。
综上,EdOH和hxf干预均可显著提高小鼠血清中AST、ALT的活性,hxf干预对小鼠的影响轻于EdOH,且L-hxf干预产生的影响最轻,这一结果提示hxf中的微量成分在协同作用下可以缓解酒精对AST、ALT活性产生的负面影响。
2.2.4 西凤酒全酒干预对小鼠脂代谢的影响
为了明确不同剂量EdOH和hxf干预是否会造成小鼠脂代谢的紊乱,对小鼠肝脏TG、TC、LDL-C、HDL-C进行了分析,结果见图6。

a-TG;b-TC;c-LDL-C;d-HDL-C
图6 hxf干预对小鼠脂代谢的影响
Fig.6 Effects of hxf intervention on lipid metabolism in mice
由图6-a和图6-b可知,与Control组相比,不同剂量EdOH和hxf干预导致小鼠肝脏TG、TC水平均明显上升(L-EdOH P<0.01、H-EdOH、H-hxf P<0.001,L-hxf组TG水平无显著性差异,TC水平P<0.01),并随干预剂量的不断增大而上升。由图6-c和图6-d可知,与Control组相比,不同剂量EdOH和hxf干预导致小鼠LDL-C水平上升(L-EdOH 、L-hxf P<0.05,H-EdOH、H-hxf P<0.001);HDL-C水平下降(H-EdOH、H-hxf P<0.001,低剂量EdOH和hxf干预对HDL-C水平均无显著性差异),结果表明酒精对小鼠脂代谢的影响呈现剂量依赖性。在同剂量下,L-EdOH与L-hxf干预对小鼠肝脏TG、TC水平均无显著性差异,而H-EdOH与H-hxf干预在TG水平之间无显著性差异,但在TC水平上存在显著性差异(P<0.01)。有趣的是,L-EdOH与L-hxf及H-EdOH与H-hxf干预后,小鼠LDL-C和HDL-C水平彼此之间均无显著性差异。不同剂量hxf干预结果显示,随着干预剂量的增大,TG、TC、LDL-C水平均显著增大(P<0.001),HDL-C水平显著降低(P<0.01)。
综上,EdOH和hxf干预导致小鼠脂代谢水平发生不同程度的紊乱,但hxf干预对小鼠的影响轻于EdOH,且L-hxf干预产生的影响最轻,这一结果提示hxf中的微量成分在协同作用下可能具有缓解酒精引起小鼠脂代谢紊乱的作用。
2.2.5 西凤酒全酒干预对小鼠肝脏病理的影响
为了确定不同剂量EdOH和hxf干预所引起的小鼠表型、血清生化因子及脂代谢变化情况是否能够直接转化为病理上的变化,因此,通过HE染色观察肝脏组织的病理形态特征,结果见图7。
由图7可知,Control组(图7-a)肝细胞形态正常,无明显脂滴和炎性细胞浸润。与此相反,EdOH组中可见部分肝细胞胞质内有许多不着色的圆形脂滴,以H-EdOH组最明显(图7-d),说明大量摄入酒精会导致部分肝细胞发生脂肪变性。然而,hxf组中虽然也可见少量空泡或不着色的圆形脂滴,但肝脏病变的数量却显著减少,其中L-hxf组(图7-c)小鼠肝脏细胞形态更接近Control组。
综上,EdOH和hxf干预均会导致肝脏实质细胞发生不同程度的病变,但hxf干预所引起的小鼠肝脏病变程度轻于EdOH,且L-hxf干预的影响最小,这一结果提示hxf中的微量成分在协同作用下能够缓解酒精引起的小鼠肝脏组织的病变程度。

a-Control;b-L-EdOH;c-L-hxf;d-H-EdOH; e-H-hxf
图7 hxf干预对小鼠肝脏组织病理学的影响
Fig.7 Effect of hxf intervention on liver histopathology in mice
2.3 西凤酒全酒干预对小鼠肠道菌群的影响
2.3.1 西凤酒全酒干预对小鼠肠道菌群多样性的影响
2.3.1.1 α-多样性分析
利用高通量技术对小鼠盲肠菌群结构进行分析,从不同剂量EdOH和hxf干预组中随机挑选5只小鼠(即25个盲肠样品),一共获得1 085 800个细菌的16S rRNA原始序列,每个样品的平均序列为43 432。对小鼠盲肠菌群的α多样性分析结果见图8。

a-Observed-species;b-ACE;c-PD-whole-tree;d-Chao l;e-Shannon;f-Simpson
图8 hxf干预对小鼠肠道微生物α多样性的影响
Fig.8 Effect of hxf intervention on α diversity of cecal microbiota in mice
由图8可知,与Control组相比,不同剂量EdOH和hxf干预导致小鼠肠道微生物的Observed-species、ACE、PD-whole-tree、Chao l、Shannon和Simpson指数均呈上升趋势,具体地,这种上升趋势随着干预剂量的变化而变化。在同剂量下,以上α多样性指数在低剂量EdOH和hxf干预组之间均无显著性差异,而高剂量EdOH和hxf干预组在ACE、Chao l、Shannon之间具有显著性差异,在Observed-species、PD-whole-tree、Simpson之间无显著性差异。不同剂量hxf干预结果显示,以上α多样性指数均随着干预剂量的增大而上升。
综上,EdOH和hxf干预会不同程度地导致小鼠肠道微生物α多样性发生变化,hxf干预对小鼠的影响均轻于EdOH,且L-hxf干预产生的影响最轻。
2.3.1.2 β-多样性分析
PCoA模式中,样本距离越接近,表示物种组成结构越相似。为进一步明确不同剂量EdOH和hxf干预是否会导致小鼠肠道菌群结构发生变化,进行了PCoA,结果如图9所示。

图9 hxf干预对小鼠肠道微生物β多样性的影响
Fig.9 Effect of hxf intervention on β diversity of cecal microbiota in mice
由图9可知,不同剂量EdOH和hxf干预组可以与Control组明显的区分开来,且L-hxf组的样本距离更接近于Control组。综上,不同剂量EdOH和hxf干预导致小鼠肠道菌群结构发生了变化,这种变化与干预剂量有关,重要的是,hxf干预后小鼠肠道菌群中的物种组成更接近Control组,以L-hxf干预最为明显。以上α、β多样性结果提示,hxf中的微量成分在协同作用下对酒精干预导致的小鼠肠道微生物多样性变化可能具有正向调节作用。
2.3.2 西凤酒全酒干预对小鼠肠道菌群结构的影响
2.3.2.1 菌群结构分析
上述肠道菌群多样性分析结果显示,不同剂量EdOH和hxf干预导致小鼠肠道菌群α、β多样性发生了变化,因此继续对各干预组小鼠肠道微生物的结构做进一步分析,以期明晰不同剂量EdOH与hxf干预对小鼠肠道菌群结构和组成的影响情况,结果见图10。
由图10-a可知,门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是小鼠肠道中的主要菌群,正常情况下它们之间的比例是相对稳定的,一旦二者比例紊乱,可能会导致多种慢性疾病的发生(如肝硬化、肥胖、糖尿病等)[15-17]。本研究结果显示,Firmicutes和Bacteroidetes在Control组小鼠盲肠中占肠道菌群的37.12%和25.19%,在L-EdOH组中占34.60%和26.91%,在L-hxf组中占36.10%和25.94%,而在H-EdOH组中占32.32%和28.18%,在H-hxf组中占33.96%和27.35%,这一结果提示EdOH和hxf干预会影响Firmicutes和Bacteroidetes的相对丰度,导致二者比例下降(图10-b),这与方程[10]的研究结果相符,但hxf干预产生的影响却轻于EdOH,说明在剂量范围内hxf能够减缓Firmicutes与Bacteroidetes比例的紊乱。
然而,在肠道菌群中除了Firmicutes和Bacteroidetes两个占比较大的菌门外,还包括占比较小的其他菌门,如脱铁杆菌门(Deferribacteres)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)等[18]。有研究指出,Deferribacteres的铁代谢能力与肠道中的铁平衡有关,而铁代谢异常会增加患疾病(如肿瘤)的风险[19],本研究结果显示(图10-a),相比于Control组,EdOH和hxf干预导致小鼠盲肠中的Deferribacteres相对丰度明显升高(L-EdOH、H-hxf P<0.01,L-hxf P<0.05,H-EdOH P<0.001),与LIU等[20]研究结果相符,hxf干预产生的影响轻于EdOH,说明在剂量范围内hxf能够减缓肠道中铁代谢能力的异常。
进一步地,本研究对属水平上相对丰度排名前10的肠道菌群做了分析,结果如图10-c所示。乳酸杆菌属(Lactobacillus)和毛螺菌属(Lachnospira)在不同剂量EdOH和hxf干预组中均为优势菌属。与Control组相比,不同剂量EdOH和hxf干预组中的Lactobacillus、Lachnospira、葡萄球菌属(Staphylococcus)、阿克曼氏菌(Akkermansia)、Escherichia-Shigella相对丰度减少,幽门螺杆菌属(Helicobacter)、链球菌属(Streptococcus)、Mucispirillum、拟杆菌属(Bacteroides)相对丰度增加;然而,无论是低剂量还是高剂量干预,hxf干预组中的Lactobacillus、Lachnospira、Dubosiella、Akkermansia的相对丰度均高于EdOH组,说明hxf干预可以缓解肠道菌群中以上菌属相对丰度的下降幅度;而Helicobacter、Lachnospira、Bacteroides、Mucispirillum的相对丰度均低于EdOH组,说明hxf干预可以缓解肠道菌群中以上菌属相对丰度的上升幅度。值得注意的是,L-hxf干预组中Lactobacillus、Lachnospira相对丰度明显高于H-hxf干预组,说明在剂量范围内hxf可以减缓肠道内有益菌属相对丰度的下降幅度。

a-门水平上相对丰度排名前10的肠道菌群;b-厚壁菌门与拟杆菌门的比例;c-属水平上相对丰度排名前10的肠道菌群
图10 hxf干预对小鼠肠道菌群结构的影响
Fig.10 Effect of hxf intervention on the structure of intestinal flora in mice
2.3.2.2 差异肠道菌分析
肠道菌群多样性和结构分析结果显示,不同剂量EdOH和hxf干预均导致小鼠肠道菌群发生了不同程度的变化,且EdOH与hxf干预组之间存在差异。基于此,为了解不同剂量干预组中丰富度差异显著的物种及在各组中起重要作用的微生物类群,又对各组小鼠盲肠菌群做了LEfSe分析,结果如图11所示。

a-LDA值分布柱状图;b-进化分支图
图11 hxf干预小鼠盲肠菌群的LEfSe分析
Fig.11 LEfSe analysis of cecal flora in mice intervened by hxf
由图11-a显示了各处理组中LDA阈值>4的物种,在各处理组中丰富度差异显著的物种共21种。由图11-b可知,在各处理组中一共发现了10种具有重要作用的微生物类群,L-hxf组2种,L-EdOH组2种,H-hxf组3种,H-EdOH组3种。这一结果说明,EdOH和hxf干预后小鼠盲肠菌群差异明显,这种差异与EdOH和hxf干预剂量有一定关系,且高剂量摄入对小鼠盲肠菌群的影响有扩大的趋势,这与方程[10]的研究结果相符。
3 结论
本研究基于细胞和动物实验探讨了不同剂量hxf和EdOH干预对LO2细胞和健康小鼠的影响。结果表明,不同剂量hxf和EdOH干预均会导致LO2细胞和小鼠产生不同程度的影响,但同剂量下均以hxf干预产生的影响明显轻于EdOH。进一步地在对小鼠肠道菌群分析结果中发现,hxf干预对小鼠产生的影响轻于EdOH主要体现在:门水平上,在剂量范围内hxf干预能够减缓Firmicutes与Bacteroidetes比例的紊乱;属水平上,Lactobacillus和Lachnospira是不同剂量EdOH和hxf干预组中的优势菌属,且hxf干预可以缓解肠道菌群中Lactobacillus、Lachnospira等菌属相对丰度的下降幅度和Helicobacter、Lachnospira、Bacteroides等菌属相对丰度的上升幅度,不同剂量EdOH和hxf干预引起的肠道菌群结构变化与干预剂量有关,低剂量hxf产生的影响最轻,但高剂量摄入对小鼠肠道菌群的影响有扩大的趋势。以上结果说明,高品质白酒hxf中的微量成分在协同作用下能够通过调节宿主肠道微生态的平衡减缓对肝脏的损伤程度。综上,适量摄入hxf在一定程度上可以缓解酒精对LO2细胞及小鼠肠道菌群带来的负面影响。
[1] 郑福平, 马雅杰, 侯敏, 等.世界6大蒸馏酒香气成分研究概况与前景展望[J].食品科学技术学报, 2017, 35(2):1-12.
ZHENG F P, MA Y J, HOU M, et al.Progress and prospect in aroma components in top six distilled spirits[J].Journal of Food Science and Technology, 2017, 35(2):1-12.
[2] ZHENG X W, HAN B Z.Baijiu (白酒), Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[3] HE X, ![]() H H.Comprehensive two-dimensional gas chromatography-time of flight mass spectrometry (GC×GC-TOFMS) in conventional and reversed column configuration for the investigation of Baijiu aroma types and regional origin[J].Journal of Chromatography.A, 2021, 1 636:461774.
H H.Comprehensive two-dimensional gas chromatography-time of flight mass spectrometry (GC×GC-TOFMS) in conventional and reversed column configuration for the investigation of Baijiu aroma types and regional origin[J].Journal of Chromatography.A, 2021, 1 636:461774.
[4] 丁海龙, 敖灵, 邓波, 等.中国白酒微量健康成分分析[J].中国酿造, 2018, 37(2):11-14.
DING H L, AO L, DENG B, et al.Analysis of trace healthy components of Chinese Baijiu[J].China Brewing, 2018, 37(2):11-14.
[5] 张治刚, 张彪, 赵书民, 等.中国白酒香型演变及发展趋势[J].中国酿造, 2018, 37(2):15-18.
ZHANG Z G, ZHANG B, ZHAO S M, et al.Evolution and development trend of Chinese Baijiu flavor types[J].China Brewing, 2018, 37(2):15-18.
[6] 白莉圆, 陈雪, 张艳, 等.西凤酒酒醅发酵过程中挥发性风味物质分析[J].酿酒科技, 2021(10):29-35.
BAI L Y, CHEN X, ZHANG Y, et al.Analysis of volatile flavor compounds in fermented grains of Xifeng liquor[J].Liquor-Making Science &Technology, 2021(10):29-35.
[7] 龙亚飞, 唐佳代, 王相勇, 等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造, 2022, 41(2):23-28.
LONG Y F, TANG J D, WANG X Y, et al.Research progress on health factors and their enrichment pathways in Baijiu[J].China Brewing, 2022, 41(2):23-28.
[8] 范文来, 徐岩, 黄永光.白酒对健康有益还是有害?[J].酿酒科技, 2014(11):1-5.
FANG W L, XU Y, HUANG Y G.Is drinking harmful or beneficial to consumer′s health[J].Liquor-Making Science &Technology, 2014(11):1-5.
[9] 孙宝国, 黄明泉, 王娟.白酒风味化学与健康功效研究进展[J].中国食品学报, 2021, 21(5):1-13.
SUN B G, HUANG M Q, WANG J.Research progress on flavor chemistry and healthy function of Baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):1-13.
[10] 方程. 基于组学的白酒肝损伤和肠道菌群干预调节机制研究[D].无锡:江南大学, 2019.
FANG C.Study on the intervention and regulation mechanism of liver injury and intestinal flora in liquor based on genomics[D].Wuxi:Jiangnan University, 2019.
[11] PRUETT S, TAN W, HOWELL G E, et al.Dosage scaling of alcohol in binge exposure models in mice:An empirical assessment of the relationship between dose, alcohol exposure, and peak blood concentrations in humans and mice[J].Alcohol, 2020, 89:9-17.
[12] HAAS B J, GEVERS D, EARL A M, et al.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].Genome Research, 2011, 21(3):494-504.
[13] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high- throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[14] ROGNES T, FLOURI T, NICHOLS B, et al.VSEARCH:A versatile open source tool for metagenomics[J].PeerJ, 2016, 4:e2584.
[15] 何春阳, 邓英, 唐艳, 等.饮酒对肠道微生态的影响研究[J].中国微生态学杂志, 2016, 28(10):1 238-1 241.
HE C Y, DENG Y, TANG Y, et al.Effects of drinking on intestinal microbiota[J].Chinese Journal of Microecology, 2016, 28(10):1 238-1 241.
[16] TURNBAUGH P J, LEY R E, MAHOWALD M A, et al.An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature, 2006, 444(7 122):1 027-1 031.
[17] 王艳辉, 赵成玉.肠道菌群对疾病相关影响的研究进展[J].临床医学进展, 2022(5):4 735-4 739.
WANG Y H, ZHAO C Y.Progress in the influence of intestinal flora on disease-related studies[J].Advances in Clinical Medicine, 2022(5):4 735-4 739.
[18] 陈玉艳, 王荣, 张娟红, 等.肠道菌群对药物代谢影响的研究进展[J].中国药理学通报, 2019, 35(2):168-172.
CHEN Y Y, WANG R, ZHANG J H, et al.Effects of intestinal microflora on drug metabolism[J].Chinese Pharmacological Bulletin, 2019, 35(2):168-172.
[19] LI Y M, LUAN Y P, YUE X G, et al.Effects of Codonopis bulleynana forest ex diels on Deferribacteres in constipation predominant intestine tumor:Differential analysis[J].Saudi Journal of Biological Sciences, 2018, 26(2):395-401.
[20] LIU X X, ZHAO K, YANG X B, et al.Gut microbiota and metabolome response of Decaisnea insignis seed oil on metabolism disorder induced by excess alcohol consumption[J].Journal of Agricultural and Food Chemistry, 2019, 67(38):10 667-10 677.