高内相乳液(high internal phase emulsions, HIPEs)是指分散相体积分数大于74%的高浓缩型乳液[1]。HIPEs因液滴相互挤压具有较大的界面面积,极大地提高了乳液内部凝胶网络结构的黏弹性,可塑性强,在生产流通过程中稳定性好且不易发生变质。因此,HIPEs在活性物质和药物递送等领域具有良好的发展前景。HIPEs的乳化剂主要有表面活性剂和固体胶体颗粒[2]。近年来,植物蛋白稳定HIPEs因具有绿色健康安全的特点受到了国内外研究学者的广泛关注[3]。
大豆分离蛋白(soy protein isolate,SPI)的等电点在4.5左右[4-5],且球状分子结构阻碍了疏水残基的暴露,影响其溶解性和乳化性,限制了蛋白乳液在活性物质递送体系中的可行性。目前,蛋白质化学改性的方法主要有羧甲基化、酰基化、糖基化和磷酸化等[6-9]。研究证实磷酸化处理是改善蛋白质性质的有效方法[10]。三偏磷酸钠(sodium trimetaphosphate,STMP)是食品药品监督管理局批准的安全性食品添加剂,环形的分子结构使得其化学反应速率远远高于直链磷酸盐。磷酸化大豆蛋白(phosphorylated soy protein isolate,P-SPI)分子中含有大量带负电荷的亲水性磷酸基团,极大地提高了吸附在两相界面的可溶性蛋白质含量,解决了大豆蛋白的低溶解性和乳化性问题[9]。然而,磷酸化大豆蛋白的研究主要集中在蛋白质空间结构、功能性质[11]和工艺优化等方面[12],关于磷酸化大豆蛋白稳定乳液的研究鲜有报道。本文采用STMP对SPI进行磷酸化改性制备P-SPI,通过调节油相体积分数(φ),研究P-SPI对HIPEs性质的影响,期望为植物蛋白质基高内相乳液在食品、医药、材料等领域的应用提供一种新型乳化剂。
大豆分离蛋白购于麦克林实业有限公司(纯度为92.5%);大豆油购于当地大润发超市;三偏磷酸钠购于麦克林实业有限公司;其他实验试剂均为分析纯级别。
Hoffen-10型傅里叶红外光谱仪,美国铂金埃尔默公司;FD-1B-50型冷冻干燥机,北京博医康有限公司;T18型高速剪切乳化机,德国IKA公司;Bettersize2000型百特激光粒度仪、MM-800型光学显微镜,日本Nikon公司;DHR-3型旋转流变仪,美国TA公司;G1-20G-Ⅱ型高速离心机,中国上海安亭科学仪器厂。
1.3.1 磷酸化大豆蛋白的制备
制备质量浓度为40 g/L的SPI溶液,将pH值调至11.50,按照STMP∶SPI=50∶1、100∶1、150∶1、200∶1、250∶1(g∶kg)的质量比加入STMP,45 ℃下水浴搅拌3 h。反应结束后,用2 mol/L的HCl调节蛋白溶液的pH值到3.80,终止磷酸化反应。冷却至室温后,在10 000 r/min的转速下离心5 min,去除磷酸化蛋白溶液的上清液,沉淀用水洗2遍,回调pH值到7,4 ℃下透析24 h,除去过量的STMP及其钠盐。冷冻干燥24 h后得到磷酸化大豆蛋白,分别以STMP添加量对其进行命名,并将未改性大豆蛋白作为对照组。
1.2.2 磷酸化程度的测定
根据WANG等[13]的方法稍加修改测定大豆蛋白的磷酸化程度。向5 mL磷酸化反应结束后的蛋白溶液中加入10 mL质量浓度为100 g/L的三氯乙酸溶液,以8 000 r/min的速度离心10 min,去除沉淀。向上清液中加入1 mol/L 乙酸锌溶液,调节pH值到3.8~3.9,10 000 r/min的转速下离心5 min,使上清液中的焦磷酸锌沉淀。向沉淀中加入一定量的氨缓冲液使沉淀充分溶解,滴加2滴铬黑T指示剂,混匀后,用0.02 mol/L EDTA二标准溶液滴定Zn2+,当溶液的颜色由紫红色转变成蓝色时,立刻终止滴定;根据公式(1)计算磷酸化程度(degree of phosphorylation,DP):
(1)
式中:DP,磷酸化程度,mg/g;C,EDTA二钠标准溶液的浓度,mol/L;V1,滴定对照组所用EDTA二钠标准溶液的体积,mL;V2,滴定实验组所用EDTA二钠标准溶液的体积,mL;Mp,磷的相对原子质量,30.97;m,样品中蛋白质的质量,g。
1.3.3 傅里叶红外光谱(Fourier-transform infrared spectroscopy,FT-IR)
将蛋白样品和KBr晶体以1∶100(g∶g)的质量比压制成透明薄片,以KBr为背景,使用红外光谱仪进行全波段范围(4 000~400 cm-1)扫描,扫描次数和分辨率分别为32次和4 cm-1,每次扫描前扣除背景。
1.3.4 高内相乳液的制备
将4 g SPI和STMP添加量为100 g/kg的P-SPI分别溶于100 mL的去离子水中,用2 mol/L的HCl和NaOH溶液将蛋白溶液pH值调节到7.0,室温下置于磁力搅拌器上搅拌4 h,4 ℃下过夜充分水合。以蛋白溶液为水相,大豆油为油相。向蛋白溶液中加入不同体积分数的大豆油(φ=74%、76%、78%、80%、82%、84%、86%、88%),用高速剪切乳化机将混合物于10 000 r/min的条件下剪切1 min,制备的乳液于4 ℃下保存备用。以未改性大豆蛋白作为对照组,重复上述实验操作。
1.3.5 乳液类型判断
根据王一丹[14]的方法稍加修改,取一定量新鲜制备的乳液于油相或水相中,通过观察乳液的分散情况判断高内相乳液的类型。
1.3.6 乳液粒径
将乳液滴于去离子水中,使用百特激光粒度仪测定液粒径。保证折光率在规定区间范围内,具体参数设置如下:大豆油的折光系数是1.456,水的折光系数是1.33。乳液粒径用体积平均直径D(4,3)和表面积平均直径D(3,2)表示。
1.3.7 乳液流变性
采用旋转流变仪测定乳液的表观黏度和黏弹性[15]。将1.5 mL的乳液置于直径为40 mm的平板之间,抹去多余的蛋白溶液,测量间距和应变值分别设置为1 000 μm和0.2%。在静态剪切扫描实验下测定黏度变化,设置剪切速率范围为0.1~100 s-1。在动态频率扫描模式下测定黏弹性变化,设置频率范围为0.01~10 Hz。
1.3.8 乳液微观结构
取50 μL乳液置于500 μL的去离子水中,混合均匀。取适量液滴于光学显微镜载玻片上,盖上盖玻片。先用4倍镜观察,待找到清晰的乳液微观结构时,再用40倍镜观察。
1.3.9 乳液离心稳定性
将5 mL新鲜制备的HIPEs置于10 mL的离心管中,记录乳液的总高度HT,以10 000 r/min的转速离心5 min,测定下清液的高度HS。将离心后的离心管放在电子天平上进行称重,得到总质量m1,用注射器将乳液上层析出的大豆油完全去除,再次称重得到总质量m2。分别按照公式(2)、公式(3)计算乳液的乳析指数(creaming index, CI)和上层析出的大豆油质量m:
m/mg=m1-m2
(2)
(3)
式中:CI,乳析指数,%;HS,下清液高度,cm;HT,乳液总高度,cm;m,离心后乳液上层析出的大豆油质量,mg;m1,离心后乳液和离心管的总质量,mg;m2,去除乳液上层析出的大豆油后,乳液和离心管的总质量,mg。
所有的实验均重复3次。使用Origin软件绘制图形,采用SPSS 19.0软件分析数据间显著性差异。
磷酸化程度越高,蛋白质中引入的![]() 越多。如表1所示,随着STMP添加量的增加,大豆蛋白的磷酸化程度随之增大,大豆蛋白与STMP发生磷酸化反应。在pH=11.5时,STMP的环状分子结构打开,蛋白质氨基酸侧链的活性基团活性增强;随着STMP添加量的增加,提高了STMP与大豆蛋白分子侧链基团的碰撞概率,
越多。如表1所示,随着STMP添加量的增加,大豆蛋白的磷酸化程度随之增大,大豆蛋白与STMP发生磷酸化反应。在pH=11.5时,STMP的环状分子结构打开,蛋白质氨基酸侧链的活性基团活性增强;随着STMP添加量的增加,提高了STMP与大豆蛋白分子侧链基团的碰撞概率,![]() 不断地与蛋白质丝氨酸侧链上的—OH结合,生成α-磷酸丝氨酸磷酸酯[16]。
不断地与蛋白质丝氨酸侧链上的—OH结合,生成α-磷酸丝氨酸磷酸酯[16]。
表1 不同STMP添加量下磷酸化大豆分离蛋白的磷酸化 程度
Table 1 The phosphorylated degree of phosphorylated P-SPI at different STMP additions
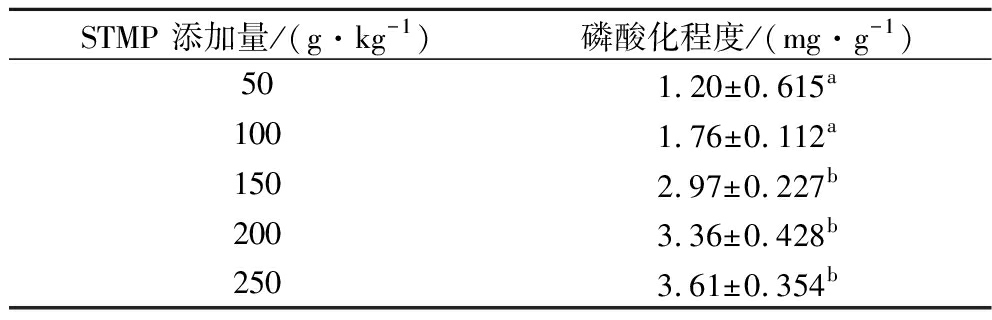
STMP 添加量/(g·kg-1)磷酸化程度/(mg·g-1)501.20±0.615a1001.76±0.112a1502.97±0.227b2003.36±0.428b2503.61±0.354b
注:表中不同英文字母表示差异显著(P<0.05)
如图1所示,与SPI相比,所有P-SPI在1 125.62 cm-1都有一个明显的肩峰出现,吸收峰强度明显增强。S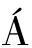 NCHEZ-RESÉNDIZ等[10]证实STMP改性大豆蛋白和花生蛋白分别在1 168.06 cm-1和1 311.39 cm-1处存在磷酸酯基团,故此吸收峰是
NCHEZ-RESÉNDIZ等[10]证实STMP改性大豆蛋白和花生蛋白分别在1 168.06 cm-1和1 311.39 cm-1处存在磷酸酯基团,故此吸收峰是![]() 与—OH发生缔合产生的。P-SPI在3 293.06 cm-1处波峰形状明显变得尖锐,吸收峰强度增强。磷酸基团的加入导致—OH伸缩振动以及氢键缔合伸缩振动发生变形;同时,酰胺Ⅰ区(1 700~1 600 cm-1)和酰胺Ⅱ区(1 600~1 500 cm-1)中吸收峰强度明显增强,表明磷酸化反应过程中,大豆蛋白二级结构发生变化。综上所述,磷酸化改性成功地向蛋白质分子中引进了
与—OH发生缔合产生的。P-SPI在3 293.06 cm-1处波峰形状明显变得尖锐,吸收峰强度增强。磷酸基团的加入导致—OH伸缩振动以及氢键缔合伸缩振动发生变形;同时,酰胺Ⅰ区(1 700~1 600 cm-1)和酰胺Ⅱ区(1 600~1 500 cm-1)中吸收峰强度明显增强,表明磷酸化反应过程中,大豆蛋白二级结构发生变化。综上所述,磷酸化改性成功地向蛋白质分子中引进了![]()
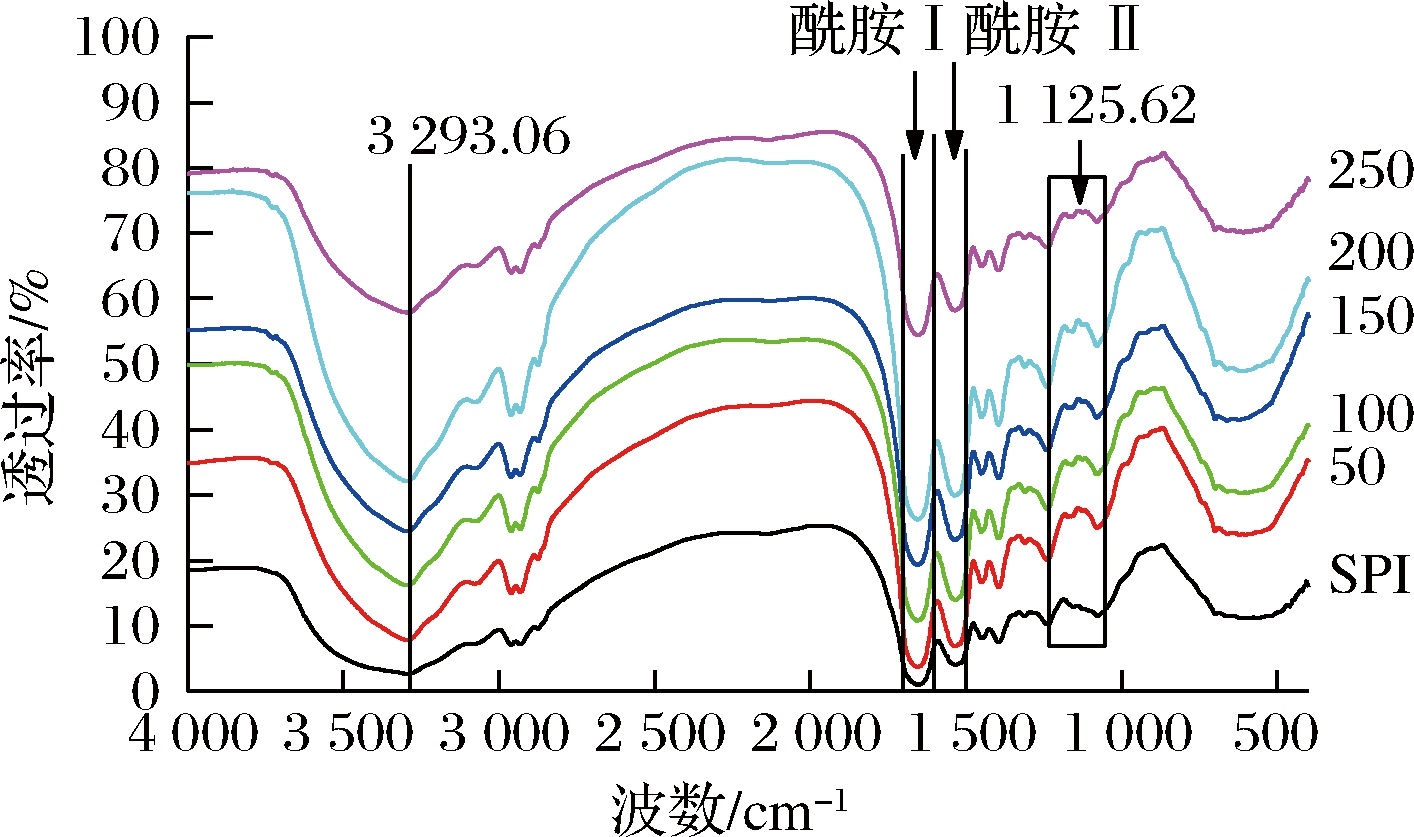
图1 SPI和P-SPI的红外光谱图
Fig.1 FT-IR of SPI and P-SPI
图2是在86%的油相体积分数下P-SPI稳定HIPEs置于水相(A)和油相(B)中的分散情况。乳液在水相中呈分散状态,在油相中沉淀在底部,不发生变化。证明P-SPI稳定HIPEs是水包油型乳液。

A-水相;B-油相
图2 P-SPI稳定HIPEs在水相和油相中的分散情况
Fig.2 Dispersion of HIPEs by stabilized P-SPI in water phases and oil phases
如图3所示,P-SPI稳定HIPEs在74%~86%的油相体积分数内可以制备稳定的乳液,具有更高的载油量;而SPI稳定HIPEs的油相体积分数远远低于前者。大豆蛋白经过磷酸化处理,卷曲折叠的蛋白质分子结构舒展,暴露了更多的疏水基团和其他非极性基团,提高了蛋白质的表面疏水性和亲水亲油平衡,在剪切力作用下,大量的疏水基团牢牢的锚定在油滴表面,能将更多的油滴束缚在凝胶网络结构中。因此,P-SPI稳定HIPEs具有更高的载油量。这种不流动的黏弹性半固体形态常见于无机离子、蛋白质、多糖、复合物纳米粒子等稳定的HIPEs和Pickering HIPEs中[17]。此后继续增加油相体积分数,超过了蛋白溶液的最高界面覆盖能力,油滴发生大面积聚结,即油水两相分离,无法形成高内相乳液。

图3 SPI和P-SPI稳定HIPEs的外观
Fig.3 Appearance of HIPEs stabilized by SPI and P-SPI
如表2所示,随着油相体积分数的增加,P-SPI稳定HIPEs液滴的D(4,3)和D(3,2)随之增大。这主要是增加油相体积分数,单位面积内吸附在油滴表面的蛋白颗粒数量减少,界面蛋白吸附层的厚度变薄;此时,油滴之间产生极强的排斥力,为维持体系能量处于最低状态,小液滴往往聚集合并成大液滴,在油滴的合并作用下,液滴倾向于增大比表面积和粒径来保持乳液的稳定[18],在微观上表现为液滴之间挤压,发生变形。
表2 不同油相体积分数下SPI和P-SPI稳定HIPEs 液滴粒径
Table 2 Droplet size of HIPEs stabilized by SPI and P-SPI at the different volume fraction of oil phase
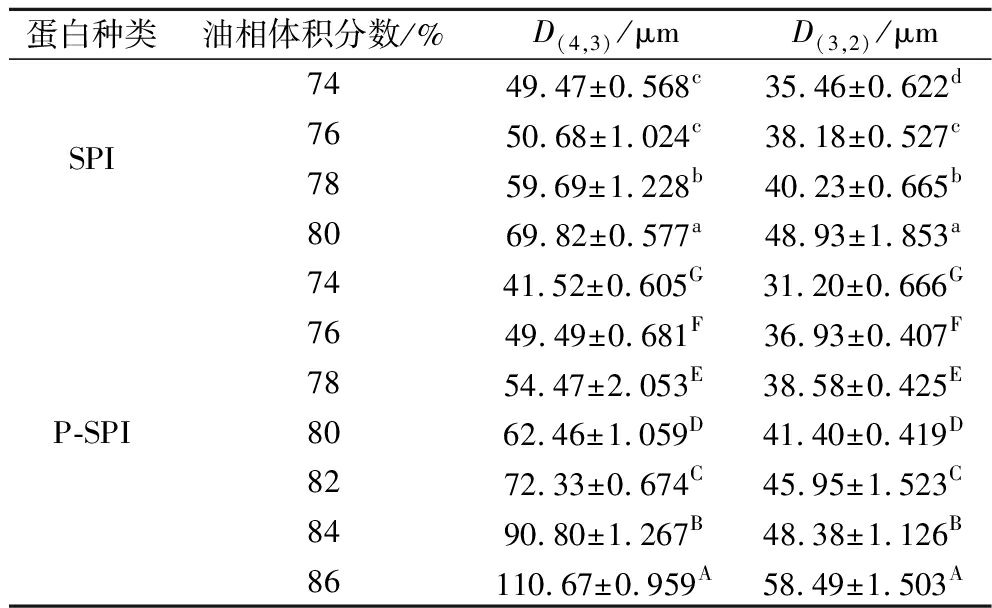
蛋白种类油相体积分数/%D(4,3)/μmD(3,2)/μm7449.47±0.568c35.46±0.622dSPI7650.68±1.024c38.18±0.527c7859.69±1.228b40.23±0.665b8069.82±0.577a48.93±1.853a7441.52±0.605G31.20±0.666G7649.49±0.681F36.93±0.407F7854.47±2.053E38.58±0.425EP-SPI8062.46±1.059D41.40±0.419D8272.33±0.674C45.95±1.523C8490.80±1.267B48.38±1.126B86110.67±0.959A58.49±1.503A
注:表中小写字母表示SPI,大写字母表示P-SPI;不同英文字母表示差异显著(P<0.05)(下同)
与SPI稳定HIPEs相比,在74%~80%的油相体积分数内,P-SPI稳定HIPEs液滴粒径更小。一方面,研究证明SPI的粒径在6~9 μm[19],本文制备的P-SPI粒径在203 nm左右,P-SPI的颗粒分散性高,均匀性更好,易形成较小粒径的液滴。另一方面,P-SPI分子中引入了亲水性磷酸基团,蛋白质与水分子之间形成了大量的氢键,增强了蛋白质与水分子之间的水合作用,P-SPI的溶解性高于SPI,溶液体系中的可溶性蛋白数量增多,在形成乳液的过程中,有更多的蛋白质吸附在油滴表面,形成了更强的物理屏障效应;同时,![]() 的加入极大地提高了液滴界面膜离子层的负电荷量,增大了液滴之间的静电排斥力,有效地阻碍了液滴之间的聚集和絮凝,这与WANG等[20]的研究结论一致。P-SPI稳定HIPEs具有较小的液滴粒径。
的加入极大地提高了液滴界面膜离子层的负电荷量,增大了液滴之间的静电排斥力,有效地阻碍了液滴之间的聚集和絮凝,这与WANG等[20]的研究结论一致。P-SPI稳定HIPEs具有较小的液滴粒径。
如图4-A和图4-B所示,在固定油相体积分数下,与SPI稳定HIPEs相比,P-SPI稳定HIPEs的表观黏度更高。这主要是P-SPI分子链舒展,施加剪切力后,分子链之间的相互缠绕作用高于SPI,阻碍了乳液的流动。蛋白质分子链间的缠绕作用与吸附到界面的蛋白质含量成正相关关系,界面的改性蛋白质含量越高,分子链间的缠绕作用越大。此外,磷酸化大豆蛋白暴露了更多的疏水位点,促进了P-SPI之间的聚集和液滴之间的结合,HIPEs的黏度增大,流动性变差。研究表明HIPEs主要通过物理非共价键进行内部连接[21],油相体积分数越高,油滴间接触面积越大和挤压程度越强,乳液内部形成的三维网络结构越紧凑致密。P-SPI稳定HIPEs的表观黏度与剪切速率呈负相关,HIPEs具有剪切变稀的特性,剪切力对乳液的破坏速率大于乳液的恢复速率,HIPEs表现出假塑性行为。

a-SPI;b-P-SPI
图4 SPI和P-SPI稳定HIPEs的表观黏度
Fig.4 Apparent viscosity of HIPEs stabilized by SPI and P-SPI
储能模量(G′)和损耗模量(G″)反映了乳液弹性和黏性变化。如图5-A和图5-B所示,在相同的油相体积分数下,P-SPI稳定HIPEs的G′和G″远远高于对照组,且P-SPI稳定HIPEs的G′高于G″,形成了以弹性为主的类凝胶网络结构。与SPI相比,P-SPI具有柔性分子结构,更容易在界面上发生构象重排,同时,P-SPI具有较小的粒径,提高了蛋白质在油水界面的吸附速率和重排速率,降低了界面张力,提高界面活性;随着界面吸附行为的持续进行,界面处吸附的蛋白质分子之间通过二硫键发生共价交联,表面疏水性的提高也促进了蛋白质与界面的相互作用,P-SPI稳定HIPEs形成了黏弹性更好的界面吸附膜,有助于增强乳液网络结构的强度[22]。在油相体积分数为82%~86%内,P-SPI稳定HIPEs的G′呈现先增加后减小的趋势。这表明乳液凝胶化减弱,黏性增强[23]。

A-SPI;B-P-SPI
图5 SPI和P-SPI稳定HIPEs的储能模量(G′)和 损耗模量(G″)
Fig.5 Storage modulus (G′) and loss modulus (G″) of HIPEs stabilized by SPI and P-SPI
图6是HIPEs在光学显微镜下的微观结构。在油相体积分数为74%时,P-SPI稳定HIPEs的油滴体积小,形态呈圆形;此后继续增大油相体积分数,相邻2个液滴之间接触挤压,共享相同的蛋白质层,油滴形态趋向多边形结构。与SPI相比,P-SPI稳定HIPEs的液滴直径更小,这是因为P-SPI在界面形成了致密的界面膜,阻碍了油滴的絮凝,这与HIPEs的粒径变化一致。随着油相体积分数的增大,液滴间距离减小促使乳液逐渐向弹性更强的凝胶状乳液转变,不易发生相对滑动,提高乳液的稳定性。这种独特的性质可赋予食品不同的外观性状和口感。此时,油滴间的静电排斥作用力和聚集作用促进了HIPEs凝胶网络的重排,形成了凝胶性较强的HIPEs[24]。

图6 SPI和P-SPI稳定HIPEs的微观结构
Fig.6 Microstructure of HIPEs stabilized by SPI and P-SPI
乳液的离心稳定性受油相体积分数,蛋白种类,蛋白浓度,离心力等因素的影响。如表3所示,在74%~80%的油相体积分数内,P-SPI稳定HIPEs的乳析指数均低于对照组,且上层没有出现漏油现象。一方面,液滴表面的P-SPI吸附层厚度大于SPI,P-SPI稳定HIPEs的内部形成了具有更高黏弹性和强度的凝胶网络结构,限制了液滴在离心过程中的运动,具有一定的抗离心作用力的能力[25];另一方面,SPI具有较大的粒径,在油水界面的扩散速度慢。吸附在两相界面的SPI分子排列不够紧密,形成的界面膜强度较弱,在离心力作用下界面膜破裂,油滴析出。SPI经过磷酸化处理可以提高其稳定HIPEs的离心稳定性。
表3 离心后SPI和P-SPI稳定HIPEs的 乳析指数和上层析出的大豆油质量
Table 3 Mass of soybean oil in the upper layer and creaming index of HIPEs stabilized by SPI and P-SPI after centrifugation
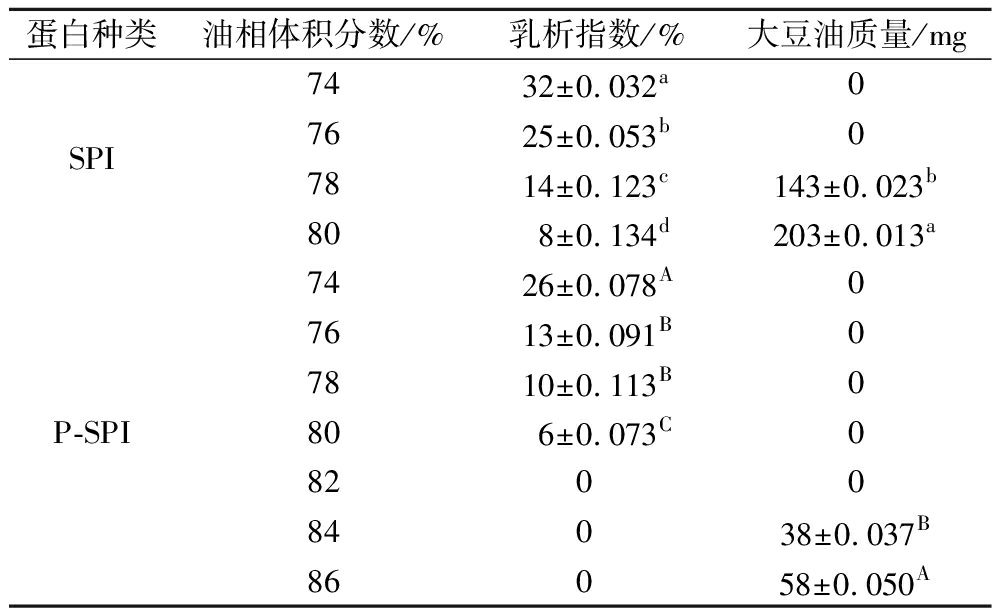
蛋白种类油相体积分数/%乳析指数/%大豆油质量/mg7432±0.032a0SPI7625±0.053b07814±0.123c143±0.023b808±0.134d203±0.013a7426±0.078A07613±0.091B07810±0.113B0P-SPI806±0.073C0820084038±0.037B86058±0.050A
本研究通过制备磷酸化大豆蛋白,调节油相体积分数,研究磷酸化大豆蛋白对高内相乳液的性质影响。结果表明,SPI与STMP成功地发生了磷酸化反应;与SPI稳定HIPEs相比,P-SPI稳定HIPEs的油相体积分数达到86%,离心稳定性更好;流变学结果表明P-SPI稳定HIPEs的表观黏度和黏弹性更高;乳液的微观形态呈多边形空间网络结构。P-SPI稳定HIPEs拓宽了植物蛋白乳化剂在新型高脂食品中的应用和发展。
[1] 金银霜. 天然大豆分离蛋白稳定高内相乳液的制备及表征[J].现代食品科技, 2019, 35(8):55-61;41.
JIN Y S.Fabrication and characterization of high internal phase emulsions stabilized by natural soy protein isolates[J].Modern Food Science and Technology, 2019, 35(8):55-61;41.
[2] ZHANG R J, CHENG L R, LUO L, et al.Formation and characterisation of high-internal-phase emulsions stabilised by high-pressure homogenised quinoa protein isolate[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 631:127688.
[3] 姜曼. 蛋白质基Pickering乳液的研究进展[J].食品与发酵工业, 2021, 47(3):259-264.
JIANG M.Advance in protein-based Pickering emulsion[J].Food and Fermentation Industries, 2021, 47(3):259-264.
[4] 熊拯. 大豆分离蛋白溶解性的影响因素研究[J].农产品加工, 2013(8):30-31.
XIONG Z.Study on influencing factors of solubility of soybean protein isolate[J]. Farm Products Processing, 2013(8):30-31.
[5] WANG D, SUN X S, YANG G, et al.Improved water resistance of soy protein adhesive at isoelectric point[J].Transactions of the ASABE, 2009, 52(1):173-177.
[6] ZHU Z F, SONG Y Z, XU Z Z, et al.Introduction of octenylsuccinate and carboxymethyl onto starch for strong bonding to fiber and easy removal from sized yarn[J].Carbohydrate Polymers, 2021, 269:118249.
[7] ZHANG K S, LI Y Y,REN Y X.Research on the phosphorylation of soy protein isolate with sodium tripoly phosphate[J].Journal of Food Engineering, 2007, 79(4):1 233-1 237.
[8] LI M, YU R, FU R X, et al.Limited hydrolysis of glycosylated whey protein isolate ameliorates the oxidative and physical stabilities of conjugated linoleic acid oil-in-water emulsions[J].Food Chemistry, 2021, 362:130212.
[9] ZHENG Y J, TIAN H L, LI Y, et al.Effects of carboxymethylation, hydroxypropylation and dual enzyme hydrolysis combination with heating on physicochemical and functional properties and antioxidant activity of coconut cake dietary fibre[J].Food Chemistry, 2021, 336:127688.
[10] S NCHEZ-RESÉNDIZ A, RODR
NCHEZ-RESÉNDIZ A, RODR GUEZ-BARRIENTOS S, RODR
GUEZ-BARRIENTOS S, RODR GUEZ-RODR
GUEZ-RODR GUEZ J, et al.Phosphoesterification of soybean and peanut proteins with sodium trimetaphosphate (STMP):Changes in structure to improve functionality for food applications[J].Food Chemistry, 2018, 260:299-305.
GUEZ J, et al.Phosphoesterification of soybean and peanut proteins with sodium trimetaphosphate (STMP):Changes in structure to improve functionality for food applications[J].Food Chemistry, 2018, 260:299-305.
[11] 海日罕,迟玉杰.微波辅助磷酸化改性提高大豆分离蛋白乳化性的研究[J].中国粮油学报, 2009, 24(6):36-40.
HAI R H,CHI Y J.Modifying soy protein isolate by microwave-assisted phosphorylation to improve emulsification properties[J].Journal of the Chinese Cereals and Oils Association, 2009, 24(6):36-40.
[12] 何洋. 微波辅助大豆分离蛋白磷酸化改性的工艺探究[J].黑龙江科技信息, 2017 (1):159-162.
HE Y.Study on microwave-assisted phosphorylation modification of soybean protein isolate[J]. Scientific and Technological Innovation, 2017 (1):159-162.
[13] WANG Y R, ZHANG B, FAN J L, et al.Effects of sodium tripolyphosphate modification on the structural, functional, and rheological properties of rice glutelin[J].Food Chemistry, 2019, 281:18-27.
[14] 王一丹. 芝麻蛋白提取物的功能性质、乳液性质及其递送体系的研究[D].合肥:合肥工业大学, 2021.
WANG Y D.Study on functional properties, emulsion properties and delivery system of sesame protein extract[D].Hefei:Hefei University of Technology, 2021.
[15] CHEN Q, TAI X M, LI J Y, et al.High internal phase emulsions solely stabilized by natural oil-based nonionic surfactants as tea tree oil transporter[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 616:126320.
[16] HU Z Y, QIU L, SUN Y, et al.Improvement of the solubility and emulsifying properties of rice bran protein by phosphorylation with sodium trimetaphosphate[J].Food Hydrocolloids, 2019, 96:288-299.
[17] 杜杰. 食品级高稳定明胶高内相乳液的制备、表征及应用[D].重庆:西南大学, 2021.
DU J.Preparation, characterization and application of food-grade high stability gelatin high internal phase emulsion[D].Chongqing:Southwest University, 2021.
[18] XU F R, PAN M M, LI J W, et al.Preparation and characteristics of high internal phase emulsions stabilized by rapeseed protein isolate[J].LWT, 2021, 149:111753.
[19] 王依凡. 基于不同制备方法的大豆蛋白微粒结构及性质研究[D].沈阳:沈阳师范大学, 2021.
WANG Y F.Research on the structure and properties of soy protein particles based on different preparation methods[D].Shenyang:Shenyang Normal University, 2021.
[20] WANG Y R, ZHANG B, FAN J L, et al.Effects of sodium tripolyphosphate modification on the structural, functional, and rheological properties of rice glutelin[J].Food Chemistry, 2019, 281:18-27.
[21] DICKINSON E, YAMAMOTO Y.Rheology of milk protein gels and protein-stabilized emulsion gels cross-linked with transglutaminase[J].Journal of Agricultural and Food Chemistry, 1996, 44(6):1 371-1 377.
[22] 姜晓丽. 辛烯基琥珀酸藜麦淀粉酯的制备及其在稳定Pickering乳液中的性能研究[D].沈阳:沈阳师范大学, 2021.
JIANG X L.Study on structure and properties of soybean protein particles based on different preparation methods[D].Shenyang:Shenyang Normal University, 2021.
[23] 赵萌. 大米谷蛋白溶解性与稳定性的改善及其应用研究[D].南京:南京财经大学, 2021.
ZHAO M.Improvement of solubility and stability of rice gluten and its application[D].Nanjing:Nanjing University of Finance and Economics, 2021.
[24] ZHU X F, ZHENG J, LIU F, et al.Freeze-thaw stability of Pickering emulsions stabilized by soy protein nanoparticles.Influence of ionic strength before or after emulsification[J].Food Hydrocolloids, 2018, 74:37-45.
[25] TANG Y R,GHOSH S.Stability and rheology of canola protein isolate-stabilized concentrated oil-in-water emulsions[J].Food Hydrocolloids, 2021,113:106399.