长时间的高强度运动,机体容易产生运动性疲劳,不能维持预定的运动状态。运动性疲劳的产生主要与体内抗氧化剂与氧化剂之间的平衡稳态被破坏有关[1-2],大量氧自由基的生成不仅影响骨骼肌的正常收缩,也抑制血管扩张,造成骨骼肌、大脑等器官供氧不足,致使出现疲劳感[3-4]。为了减轻人体的运动疲劳,提高机体的运动耐力,运动饮料的开发已成为当今食品科学研究的热点。
酵素饮料是利用微生物发酵天然物质生成的含有多种营养物质的功能饮品。这些营养物质,如:超氧化物歧化酶 (superoxide dismutase, SOD)、多酚、有机酸和皂苷等,既有助于维持机体正常的免疫功能,又可以清除活性氧自由基,避免氧化应激造成的细胞损伤[5-6]。郭红莲等[7]发现枸杞酵素对超氧自由基的清除率由发酵前39.57%增长至发酵后89.95%;蒋增良等[8]证明葡萄酵素在体外具有良好的自由基清除作用;韦仕静等[9]发现桑葚酵素中部分有机酸具有提高机体运动能力的功能,而从现有公开文献可知,越来越多的天然物质已被开发成具有抗运动疲劳作用的酵素饮料[10-11]。
百香果 (Passiflora edulis)原产地巴西,是一种亚热带特色水果,被称为“果汁之王”,在我国两广、福建、台湾等地区均有种植,百香果皮约占单果总重一半,但在榨汁时其常被作为废料丢弃。百香果皮富含多糖、黄酮及多酚等营养物质,具有抗菌消炎、抗氧化、增强机体免疫等生理功能。多位研究人员先后通过体外试验发现百香果皮中可溶性纤维、花青素、果胶、多糖、黄酮等物质对羟自由基、DPPH自由基、超氧阴离子自由基和ABTS阳离子自由基均有较强的清除作用[12-14]。本研究以百香果皮为原料,经复合乳酸菌接种发酵制备百香果皮酵素饮料,以饮料的感官得分与SOD的活力为考察指标,探讨该酵素饮料的最佳发酵工艺,同时考察其对机体运动耐力的影响,从而为百香果皮的利用提供参考。
1 材料与方法
1.1 材料与试剂
百香果购于山西太原农贸市场;果胶酶(100 kU/g)、纤维素酶(40 kU/g),河南聚硕生物科技有限公司;复合乳酸杆菌(保加利亚复合乳酸菌、嗜热链球菌、双歧杆菌,活力≥1010 CFU/g),山东中科嘉亿生物工程有限公司;西洋参口服液,浙江新光药业股份有限公司;尿素氮(blood urea nitrogen, BUN)、乳酸(lactic acid, LA)、肝糖原(liver glycogen, LG)、肌糖原(muscle glycogen, MG)试剂盒,南京建成生物工程研究所;其他试剂均为分析纯,国药集团化学试剂有限公司。试验动物信息:健康雄性小鼠100只,体重16~25 g,山西省疾病预防控制中心[动物许可证号:SYXK(晋)2020-0005]。
1.2 仪器与设备
FA2004型电子天平,浙江明德仪器有限公司;TU-1901PC型紫外可见分光光度计,上海析谱仪器有限公司;SHA-B型水浴恒温摇床,常州国华电器有限公司;LSH-18B型高压灭菌锅,上海力辰器科技有限公司;LRH-100-M型恒温培养箱,成都市宜邦科析仪器有限公司;pHS-3E型酸度计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 酵素饮料制备工艺流程
酵素饮料制备工艺流程如下:
百香果皮→清洗打浆→酶解过滤→调整糖度→灭菌→接种复合发酵剂→过滤除菌→无菌灌装→成品
1.3.2 操作要点
1.3.2.1 发酵基质
选取未腐烂的百香果取皮后,用蒸馏水清洗,晾干表面水分。称取20 g百香果皮加入5倍质量的蒸馏水破碎打浆,再加入匀浆总质量0.05%的果胶酶和0.1%的纤维素酶,置于40 ℃水浴中2 h后,采用5层纱布过滤,然后向滤液中加入蔗糖调节适宜的糖度,并经0.22 μm滤膜过滤,即得发酵基质。
1.3.2.2 接种与发酵
解冻后的复合乳酸杆菌接种至MRS液体培养基于37 ℃恒温培养至对数生长中后期。取适量菌种培养液离心(10 000 r/min,10 min),菌体经无菌注射用水洗涤后,在无菌环境下,取适量接种至灭菌后的发酵基质中,密封后置于固定温度下振荡培养。
1.3.2.3 饮料成品
将培养一段时间后的发酵液离心(8 000 r/min,10 min),上清液在无菌环境下经0.22 μm滤膜过滤分装,即得百香果皮酵素饮料。
1.3.3 酵素饮料感官评价标准
参考文献[15]中酵素饮料的感官评价标准,以饮料的色泽、口感、气味与组织形态作为评价指标,选择10位具有饮料感官评价经验的人员,按照表1评价标准,对不同发酵条件制得的饮料样品进行感官评价,以平均值作为不同饮料的感官得分。
1.3.4 发酵条件考察
以百香果皮酵素饮料的感官得分和SOD活力作为评价指标,分别考察菌体接种量、初始糖度、发酵温度和发酵时间的影响,具体试验设计如下:(1) 菌体接种量(指相对发酵基质质量的百分比,下同) 分别设置为5%、10%、15%、20%、25%,在发酵基质初始糖度10 °Brix、35 ℃下振荡培养30 h;(2)发酵基质的初始糖度分别设置为2、6、10、14、18 °Brix,在15%接种量、35 ℃下振荡培养30 h;(3)发酵温度分别设置为25、30、35、40、45 ℃,在15%接种量、发酵基质初始糖度10 °Brix下振荡培养30 h;(4)发酵时间分别设置为20、25、30、35、40 h,在15%接种量、发酵基质初始糖度10 °Brix、35 ℃下振荡培养。
表1 酵素饮料的感官评价指标
Table 1 Sensory evaluation indexes of ferment beverage

指标评价标准得分/分色泽均一、有透亮感15~20色泽(20分)静置后溶液色泽稍有差异7~15饮料色泽不均一、不透亮0~7百香果皮清香味浓郁 20~25气味(25分)百香果皮清香味寡淡,酸味突出10~20无百香果皮清香味,单一酸味0~10酸甜适宜、有百香果皮发酵后风味20~25口感(25分)百香果皮发酵后风味不明显,酸味或甜味明显10~20无百香果皮发酵后风味,仅有酸味或甜味0~10形态均一、静置后未见分层或沉淀20~30组织形态(30分)静置后未见分层,但稍有沉淀10~20分层明显、静置后有沉淀0~10
1.3.5 发酵工艺优化
在单因素试验结果的基础上,根据Box-Benhkem试验设计原理,考察复合乳酸菌接种量、初始糖度、发酵温度与发酵时间对百香果皮酵素饮料中SOD活力的影响,确定最佳发酵工艺条件,具体试验因素与水平见表2。
表2 响应面试验设计因素与水平
Table 2 Design factors and levels of response surface test

水平A(接种量)/%B(初始糖度)/°BrixC(发酵温度)/℃D(发酵时间)/h-11063025015103530120144035
1.3.6 指标考察
SOD活力:采用邻苯三酚自氧化法测定百香果皮酵素饮料SOD活力[16];pH:采用pH计测定饮料的pH值;糖度:利用糖度仪测定饮料的糖度;总酸:采用GB 12456—2021《食品中总酸的测定》中滴定法测定饮料的酸度;复合乳酸菌:按照GB 4789.35—2016《食品安全国家标准 食品微生物检验 复合乳酸菌检验》测定饮料的复合乳酸菌含量;菌落总数:按照GB 4789.2—2016《食品卫生微生物学检验 菌落总数测定》测定饮料的菌落总数;大肠杆菌:按照GB 4789.3—2016《食品卫生微生物学检验 大肠杆菌测定》测定饮料的大肠杆菌总数。
1.3.7 动物运动耐力的影响
1.3.7.1 动物模型建立
所有动物适应性喂养5 d后,随机平均分为空白对照组、阳性对照组、低剂量组、中剂量组和高剂量组。根据《保健食品功能评价》要求,低、中、高剂量组动物按照功能饮料人体摄入量的5、10、20倍,即10、20、40 mL/(kg·bw)剂量灌胃,空白对照组与阳性对照组动物则分别按照40 mL/(kg·bw)的剂量灌胃生理盐水与西洋参口服液,所有动物每日灌胃1次,连续灌胃30 d,灌胃期间各组动物喂饲条件相同[17]。
1.3.7.2 负重游泳试验
所有动物末次灌胃后,随机选取10只小鼠,在鼠尾末端绑系5%自身质量的铁丝后,置于恒温泳箱内自由游泳,记录动物入水至头部完全沉没不能浮出水面10 s的时间,作为负重游泳时间[18]。
1.3.7.3 体内生化指标检测
各取剩余小鼠置于恒温泳箱游泳20 min后,取出休息5 min,眼眶釆血离心(8 000 r/min,5 min),利用相关试剂盒,检测其血清中LA与BUN浓度。随后,处死小鼠,取出肝脏与腿部肌肉,分别采用生理盐水漂洗,经滤纸吸干后,加入生理盐水进行匀浆离心,制备10%组织匀浆液,采用相关试剂盒测定LG、MG浓度[19]。
1.4 结果处理
所有检测试验平行测定5次,结果以平均值±标准差表示,并通过SPSS 18.0软件分析比较组间结果的差异,P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异。
2 结果与分析
2.1 复合乳酸菌接种量选择
图1为不同复合乳酸菌接种量对酵素饮料的SOD活力与感官得分影响。由图1可知,随着复合乳酸菌接种量的增大,饮料的感官得分与SOD活力均呈先增大后减小趋势。当复合乳酸菌接种量为15%时,感官得分与SOD活力最高,这归因于复合乳酸菌接种量过少时,基质营养物质未被充分利用,活菌数增加缓慢,发酵后的饮料中SOD活力偏低,然而接种量过多,使得过饱和的菌种快速发酵,代谢产物增多,既影响了乳酸菌的活性,又使得饮料酸味较为突出[20],掩盖了饮料的特有风味,综合考虑选择复合乳酸菌接种量10%、15%、20%作为响应面因素考察水平。
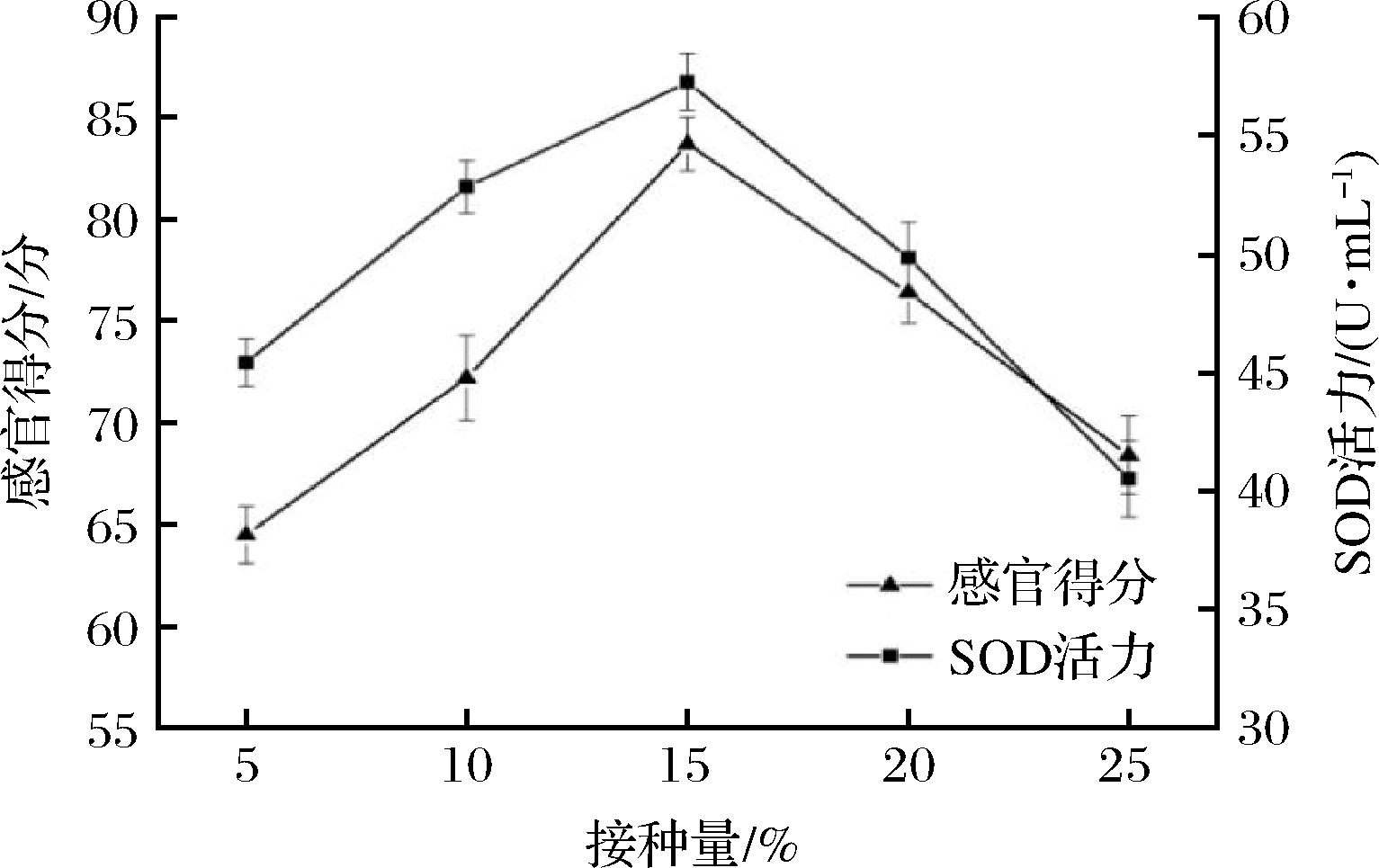
图1 复合乳酸菌接种量对饮料感官得分与SOD活力的影响
Fig.1 Effect of multiple lactobacillus amount on sensory score and SOD activity of beverage
2.2 初始糖度选择
图2为不同初始糖度对酵素饮料的SOD活力与感官得分影响。由图2可知,随着基质糖度的提高,酵素饮料的SOD活力与感官得分均先增大后减小。当初始糖度为6 °Brix时,饮料的感官得分最高,但当初始糖度为10 °Brix时,饮料的SOD活力最高。这源于初始糖度过低时,菌种利用的基质碳源不足,繁殖速率较慢,但初始糖度过高时,饮料的酸甜口感不协调,造成口感得分下降,这与李明芝等[21]研究刺玫果发酵饮料的最佳工艺条件结果相近,因此选择初始糖度6、10、14 °Brix作为响应面因素考察水平。

图2 初始糖度对饮料感官得分与SOD活力的影响
Fig.2 Effect of initial sugar content on sensory score and SOD activity of beverage
2.3 发酵温度选择
图3为不同发酵温度对酵素饮料的SOD活力与感官得分影响。由图3可知,随着发酵温度的升高,饮料的感官得分与SOD活力均先增大后减小。当发酵温度控制在35 ℃时,饮料的感官得分最高,但40 ℃时SOD活力最大。由于发酵温度较高时,可能影响微生物的繁殖与代谢,从而抑制乳酸菌的生长,使得SOD活力下降,另外温度过高也使得饮料色泽偏深,影响色泽得分,为此考虑选择发酵温度30、35、40 ℃作为响应面因素考察水平。
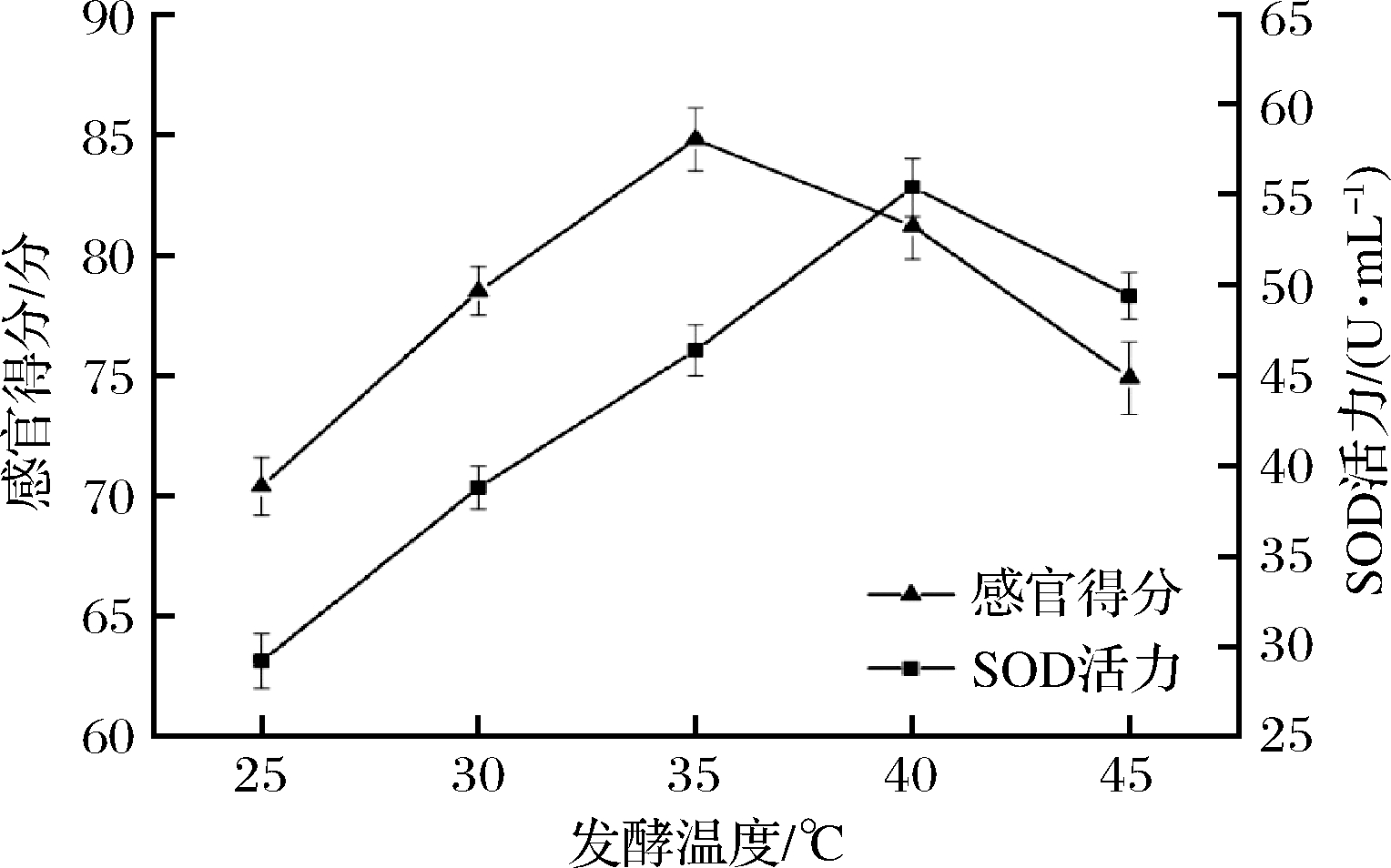
图3 发酵温度对饮料感官得分与SOD活力的影响
Fig.3 Effect of fermentation temperature on sensory score and SOD activity of beverage
2.4 发酵时间选择
图4为不同发酵时间对酵素饮料SOD活力与感官得分的影响。由图4可知,发酵时间的延长有助于饮料SOD活力的增大,但发酵时间过长,SOD活力与感官得分均明显呈下降趋势,而当发酵时间为30 h时,饮料中SOD活力与感官得分均达到最高。这归因于在起始时复合乳酸菌的快速繁殖对酵素饮料的风味产生积极作用,但发酵时间过长不仅使得复合乳酸菌利用的碳水化合物偏少,发酵速度减慢,同时各种有机酸也转化为次级代谢产物,致使饮料的口感偏酸[22],因此选择发酵时间25、30、35 h作为响应面因素考察水平。
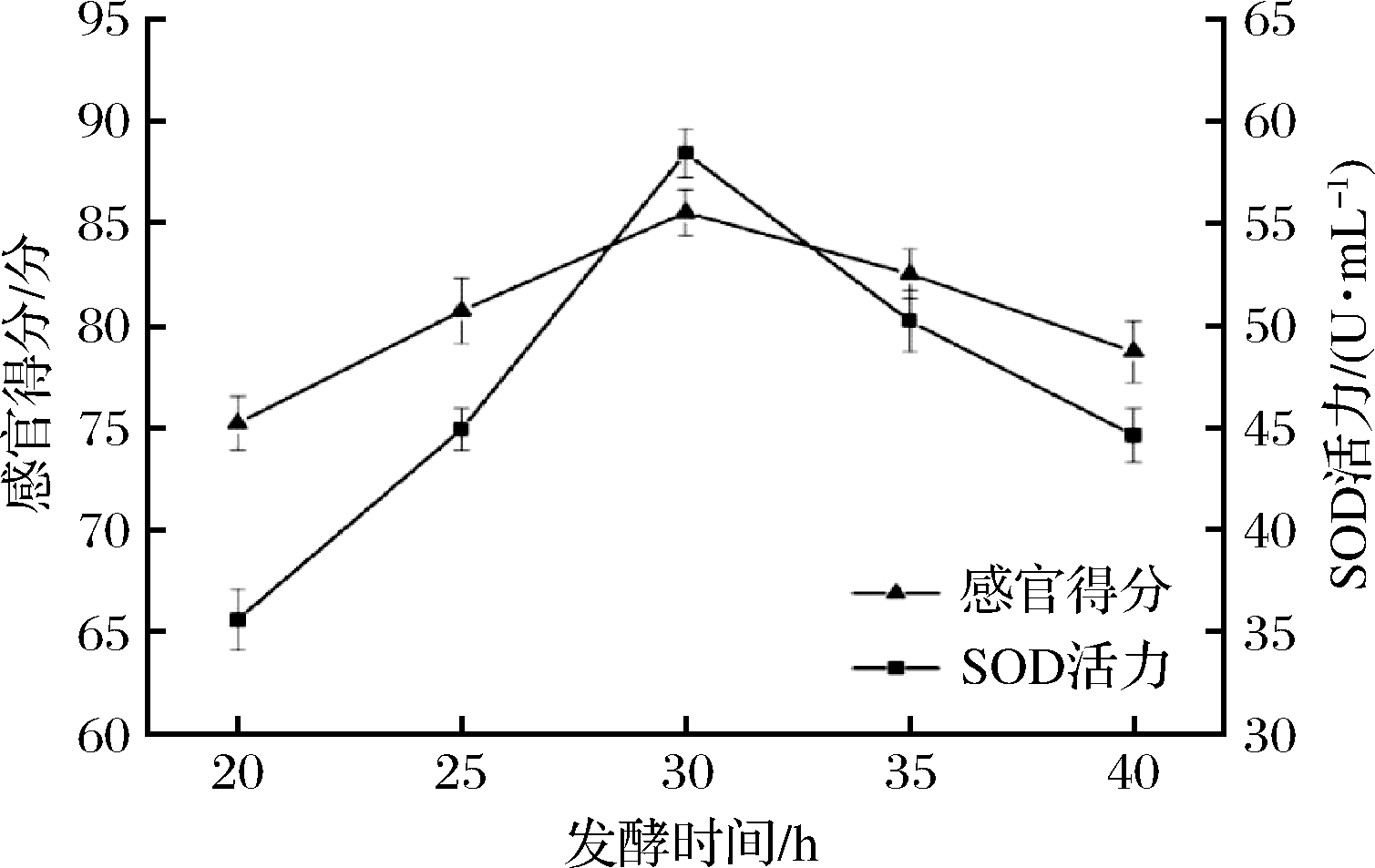
图4 发酵时间对饮料感官得分与SOD活力的影响
Fig.4 Effect of fermentation time on sensory score and SOD activity of beverage
2.5 响应面分析
2.5.1 试验结果
基于2.1~2.4单因素试验结果,以SOD活力作考察指标,通过对接种量(A)、初始糖(B)、发酵温度(C)与发酵时间(D)进行四因素三水平响应面试验和结果分析,确定最佳发酵工艺条件,试验方案与结果见表3。
表3 响应面试验方案与结果
Table 3 Scheme and results of response surface test
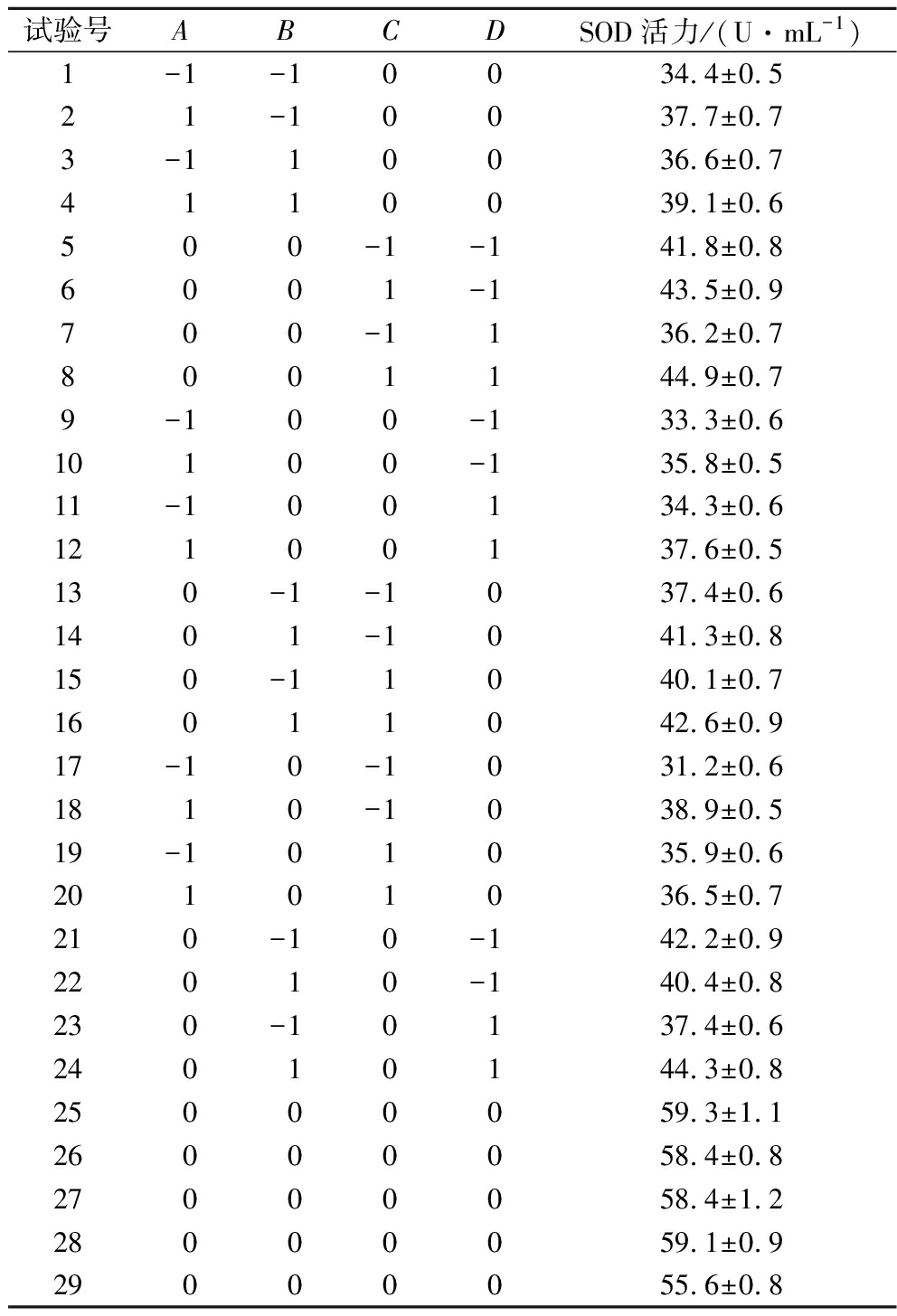
试验号ABCDSOD活力/(U·mL-1)1-1-10034.4±0.521-10037.7±0.73-110036.6±0.74110039.1±0.6500-1-141.8±0.86001-143.5±0.9700-1136.2±0.78001144.9±0.79-100-133.3±0.610100-135.8±0.511-100134.3±0.612100137.6±0.5130-1-1037.4±0.61401-1041.3±0.8150-11040.1±0.716011042.6±0.917-10-1031.2±0.61810-1038.9±0.519-101035.9±0.620101036.5±0.7210-10-142.2±0.922010-140.4±0.8230-10137.4±0.624010144.3±0.825000059.3±1.126000058.4±0.827000058.4±1.228000059.1±0.929000055.6±0.8
2.5.2 试验结果分析
通过对试验结果进行多元回归拟合分析,得到酵素饮料SOD活力对各因素水平的二次回归拟合方程:Y=58.16+1.61A+1.22B+1.35C-0.17D-0.23AB-1.75AC+0.24AD-0.38BC+2.18BD+1.77CD-13.62A2-8.35B2-8.74C2-8.59D2。由表4可知,该模型具有极显著性(P<0.01),而失拟项不显著(P>0.05),相关系数为0.981 7,调整后相关系数为0.963 4,表明该多元回归模型具有较好的拟合性,稳定性较好。另外还可知接种量与发酵温度对发酵后饮料的SOD活力具有极显著性影响 (P<0.01),初始糖度对其具有显著性影响(P<0.05),但发酵时间对其影响不显著(P>0.05)。从显著性检验结果可知,所有因素对酵素饮料SOD活力的影响顺序依次为接种量(A)>发酵温度(C)>初始糖度(B)>发酵时间(D)。
表4 响应面试验方差分析
Table 4 Variance analysis of response surface test

来源平方和自由度均方F值P值显著性A33.00133.0013.190.002 7∗∗B19.00119.007.600.015 5∗C23.24123.249.290.008 7∗∗D0.4410.440.180.681 0AB0.1610.160.0640.804 0AC12.60112.605.040.041 5∗AD0.1610.160.0640.804 0BC0.4910.490.200.664 8BD18.92118.927.560.015 6∗CD12.25112.254.900.044 0∗A21207.2511 207.25482.64<0.000 1∗∗B2454.151454.15181.56<0.000 1∗∗C2498.611498.61199.34<0.000 1∗∗D2478.901478.90191.46<0.000 1∗∗模型1 878.3814134.1753.64<0.000 1∗∗残差35.02142.50失拟项26.17102.621.180.472 6误差项8.8542.21总和1 913.4028
注:*表示显著性差异(P<0.05);**表示极显著性差异(P<0.01)
2.5.3 最佳工艺确认
通过拟合的多元回归模型预测的最佳发酵工艺条件为接种量17.28%、初始糖度为12.29 °Brix、发酵温度为38.37 ℃、发酵时间为31.03 h,预测SOD活力可达60.2 U/mL。为了便于实际操作,采取如下发酵条件:接种量17.3%、初始糖度为12.3 °Brix、发酵温度为38.4 ℃、发酵时间为31 h,发酵后的饮料SOD活力可达(65.8±1.1) U/mL,同预测值相近,表明该模型可较好预测百香果皮酵素饮料的最佳发酵工艺。
2.6 酵素饮料品质指标结果
最佳发酵工艺制得的百香果皮酵素饮料色泽透亮、均一,酸甜适中,发酵后的百香果皮清香味浓郁,静置一段时间后,溶液澄清未见明显沉淀,感官得分为 (88.4±2.2)分,最终饮料成品见图5。表5为饮料理化与微生物指标的检测结果,另外未有大肠杆菌和其他致病菌检出,结果符合GB/T 710—2022《食品安全国家标准 饮料》中微生物限度要求。

图5 百香果皮酵素饮料
Fig.5 Ferment beverage of Passiflora edulis peel
表5 饮料的品质指标
Table 5 The quality index of the beverage

品质指标结果pH4.12总酸/(g·L-1)2.66糖度/°Brix9.8乳酸菌/(CFU·mL-1)1.5×106细菌总数/(CFU·mL-1)<100
2.7 动物运动耐力影响的结果
2.7.1 负重游泳时间比较
负重游泳时间常被用于评价机体的运动耐力,不同组小鼠的负重游泳时间比较见表6。随着酵素饮料灌胃剂量的增大,小鼠负重游泳时间延长。与空白对照组相比,低、中、高剂量组的小鼠负重游泳时间分别延长1.1、2.2、2.9 min,其中低剂量组的力竭游泳时间较空白对照组具有显著性差异 (P<0.05),而中、高剂量组较其则有极显著性差异(P<0.01),表明百香果皮酵素饮料有利于提高机体的运动耐力,延长运动时间。
表6 不同组小鼠的负重游泳时间
Table 6 The time of weight-bearing swimming in mice of different groups

组别负重游泳时间/min平均延长时间/min空白对照组13.7±1.9阳性对照组17.8±1.74.1低剂量组 14.8±2.5∗1.1中剂量组 15.9±1.5∗∗2.2高剂量组 16.6±2.1∗∗2.9
注:与空白对照组相比,*表示具有显著性差异 (P<0.05);**表示具有极显著性差异 (P<0.01)(下同)
2.7.2 肝糖原与肌糖原含量比较
高强度运动使得体内供能物质葡萄糖消耗加快,而其源于LG与MG的分解,因此增加体内上述物质的储备量,有利于维持运动时体内的血糖稳定,减小机体疲劳感,从而延长运动时间[23]。表7为运动后不同组小鼠的LG与MG含量的比较,随着增大酵素饮料的灌胃剂量,运动后小鼠体内的LG与MG含量逐渐升高。
与空白对照组相比,低剂量组小鼠LG含量提高3.3 mg/g,具有极显著性差异 (P<0.01),MG含量提高0.4 mg/g,具有显著性差异 (P<0.05),而中剂量组LG与MG含量分别提高4.8 mg/g与1.3 mg/g,高剂量组分别提高7.2 mg/g与2.0 mg/g,均有极显著性差异 (P<0.01)。这可能是酵素饮料中SOD在清除超氧阴离子自由基的同时,可修复运动氧化过激造成的肝细胞损伤,并能够阻止细胞中产生氧化性更强的氧化自由基,从而提高体内LG与MG的含量。郑聪等[24]研究发现不同剂量的余甘子圣女果发酵饮料较空白对照组可提高小鼠MG含量0.20~0.47 mg/g,LG含量1.11~2.34 mg/g,有效缓解运动后小鼠的疲劳,结合表7中结果可知,百香果皮酵素饮料也能通过提高机体LG与MG的储备量,增强机体的运动耐力。
表7 不同组小鼠的肝糖原与肌糖原含量 单位:mg/g
Table 7 Content of LG and MG in mice of different groups

组别LGMG空白对照组5.2±1.01.1±0.3阳性对照组11.6±1.54.0±0.2低剂量组 8.5±1.3∗∗ 1.5±0.4∗中剂量组 10.0±1.8∗∗2.4±0.5∗∗高剂量组 12.4±1.2∗∗3.1±0.4∗∗
2.7.3 乳酸与尿素氮含量比较
高强度运动下,血液供氧不足致使葡萄糖采取无氧酵解转化成能量,产生的代谢产物LA既会影响肌肉组织的收缩性能,也会打破体内酸碱环境的平衡,致使机体运动耐力下降[25],同时体内蛋白质分解速率加快,以满足机体能量需求,导致代谢产物BUN含量升高[26]。表8为运动后不同组小鼠的LA与BUN含量比较。伴随增大酵素饮料的灌胃剂量,运动后小鼠体内的LA与BUN含量均逐渐降低。与空白对照组相较,低剂量组小鼠的LA与BUN含量分别下降0.7、0.7 mmol/L,具有显著性差异 (P<0.05),中剂量组分别下降1.4、1.2 mmol/L,高剂量组分别下降2.1、1.8 mmol/L,均有极显著性差异 (P<0.01)。相关研究结果表明,体内肝脏或骨骼肌中SOD活力与血清中LA和BUN含量成反比关系[27],由于百香果皮酵素饮料中SOD活力较高,有助于增强体内肝脏及骨骼肌中SOD的活性,从而抑制运动时体内乳酸的生成和蛋白质的分解,具有增强机体运动耐力的作用。
表8 不同组小鼠的血乳酸与尿素氮含量 单位:mmol/L
Table 8 Content of LA and BUN in mice of different groups
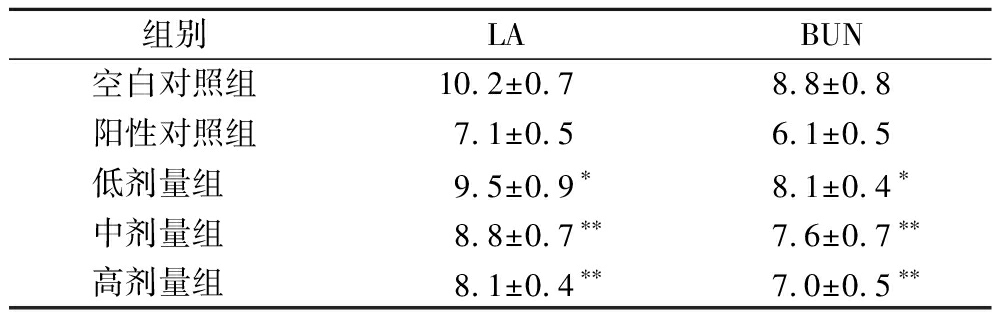
组别LABUN空白对照组10.2±0.78.8±0.8阳性对照组7.1±0.56.1±0.5低剂量组 9.5±0.9∗ 8.1±0.4∗中剂量组 8.8±0.7∗∗7.6±0.7∗∗高剂量组 8.1±0.4∗∗7.0±0.5∗∗
3 结论
本研究以百香果皮为原料,饮料的SOD活力与感官得分为评价指标,通过单因素与响应面试验确定百香果皮酵素饮料的最佳制备工艺为复合乳酸菌接种量17.3%、初始糖度为12.3 °Brix、发酵温度为38.4 ℃、发酵时间为31 h,制得的酵素饮料SOD活力达到 (65.8±1.1) U/mL,感官得分为 (88.4±2.2)分,所得饮料溶液色泽均一、透亮,发酵后的百香果皮清香味浓郁,酸甜适中,静置后未见明显沉淀。通过动物实验结果可知,百香果皮酵素饮料有助于提高机体LG与MG的储备水平,减小运动时体内LA与BUN的生成,从而可增强机体的运动耐力,具有较好的抗运动疲劳作用。该研究可为百香果皮深度开发与利用提供参考,但其具体抗运动疲劳作用机制,尚需深入研究。
[1] MASON S A, MORRISON D, MCCONELL G K, et al.Muscle redox signalling pathways in exercise.Role of antioxidants[J].Free Radical Biology and Medicine, 2016, 98:29-45.
[2] FAN W W, WAIZENEGGER W, LIN C S, et al.PPAR δ promotes running endurance by preserving glucose[J].Cell Metabolism, 2017, 25(5):1 186-1 193.e4.
[3] TRINITY J D, BROXTERMAN R M, RICHARDSON R S.Regulation of exercise blood flow:Role of free radicals[J].Free Radical Biology and Medicine, 2016, 98:90-102.
[4] SIES H, BERNDT C, JONES D P.Oxidative stress[J].Annual Review of Biochemistry, 2017, 86:715-748.
[5] CHO D H, LIM S T.Germinated brown rice and its bio-functional compounds[J].Food Chemistry, 2016, 196(1):259-271.
[6] OGUNREMI O R, SANNI A I, AGRAWAL R.Probiotic potentials of yeasts isolated from some cereal-based Nigerian traditional fermented food products[J].Journal of Applied Microbiology, 2015, 119(3):797-808.
[7] 郭红莲, 邢紫娟, 余巧银, 等.天然枸杞酵素发酵的代谢产物分析[J].食品研究与开发, 2018, 39(5):48-55.
GUO H L, XING Z J, YU Q Y, et al. Analysis of metabolites produced by ferment of natural Lycium barbarum L[J]. Food Research and Development, 2018, 39(5):48-55.
[8] 蒋增良,刘晓庆,王珍珍,等.葡萄酵素有机酸分析及其体外抗氧化性能[J].中国食品学报,2017,17(5):255-262.
JIANG Z L, LIU X Q, WANG Z Z, et al. Analysis of organic acids and in vitro antioxidant activity of grape-rment[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(5):255-262.
[9] 韦仕静. 桑葚酵素发酵工艺及花青素生物转化的研究[D].广州:华南理工大学, 2018.
WEI S J.The research on fermentation process of mulberry jiaosu and biotransformation of anthocyanins[D].Guangzhou:South China University of Technology, 2018.
[10] 龚希丹.天然酵素运动饮料的抗疲劳性研究进展[J].食品安全质量检测学报, 2021, 12(12):4 947-4 952.
GONG X D. Research progress on fatigue resistance of natural enzyme sports drinks[J]. Journal of Food Safety &Quality, 2021, 12(12):4 947-4 952.
[11] 郭伟峰, 王红梅, 邹晓桐, 等.桑葚酵素饮料的发酵工艺研究及其质量评价[J].食品研究与开发, 2019, 40(5):88-93.
GUO W F, WANG H M, ZOU X T, et al.Research on fermentation process of mulberry ferment beverage and its quality evaluation[J].Food Research and Development, 2019, 40(5):88-93.
[12] LIU M, SU Y J, LIN Y L, et al.Optimization of green extraction of anthocyanins from purple passion fruit peels by response surface methodology[J].Journal of Food Processing and Preservation, 2018, 42(10):e13756.
[13] 杭瑜瑜, 于淑池, 王和飞.响应曲面法优化百香果皮可溶性膳食纤维的制备工艺及其理化性质研究[J].中国食品添加剂, 2021, 32(9):79-89.
HANG Y Y, YU S C, WANG H F.Soluble dietary fiber extraction from passion fruit peel by response surface method and its physicochemical properties[J].China Food Additives, 2021, 32(9):79-89.
[14] 滕浩, 颜小捷, 林增学, 等.百香果皮多糖的组成及其体外抗氧化活性分析[J].食品与发酵工业, 2019, 45(15):176-181.
TENG H, YAN X J, LIN Z X, et al.Composition and in vitro antioxidant activity of polysaccharides from passion fruit shell[J].Food and Fermentation Industries, 2019, 45(15):176-181.
[15] 和东芹, 袁玮聪, 李慧婉, 等.黄瓜乳酸菌酵素饮料的发酵优化及其质量评价[J].食品科技, 2021, 46(10):69-73.
HE D Q, YUAN W C, LI H W, et al.Fermentation optimization and quality evaluation of cucumber Lactobacillus ferment beverage[J].Food Science and Technology, 2021, 46(10):69-73.
[16] 申晗,李红涛.藿香玫瑰复合饮料研制及抗运动疲劳作用研究[J].食品工业科技,2022,43(4):205-213.
SHEN H, LI H T.Development and anti-exercise fatigue of compound beverage of Agastache rugosa and rose[J].Science and Technology of Food Industry, 2022, 43(4):205-213.
[18] TAN W, YU K Q, LIU Y Y, et al.Anti-fatigue activity of poly saccharides extract from Radix Rehmanniae preparata[J].International Journal of Biological Macromolecules, 2012, 50(1):59-62.
[19] 刘文静.雪樱子石榴复合饮料研制及其抗运动性疲劳作用[J].食品工业科技, 2021, 42(12):203-208.
LIU W J.Preparation of Amaranthus caudatus L.and Punica granatum composite beverage and its resisting exercise fatigue effect[J].Science and Technology of Food Industry, 2021, 42(12):203-208.
[20] 宁楚洁, 赵倩, 谢春阳, 等.玉米须果蔬复合酵素饮料的研制及其抗氧化活性[J].食品研究与开发, 2019, 40(20):116-122.
NING C J, ZHAO Q, XIE C Y, et al.Extraction of functional components from corn stigma and preparation of corn stigma, fruit and vegetable complex enzyme beverage[J].Food Research and Development, 2019, 40(20):116-122.
[21] 李明芝, 王举翠.响应面法优化刺玫果发酵饮料工艺及对运动耐力的影响[J].中国食品添加剂, 2022, 33(4):172-180.
LI M Z, WANG J C.Optimization of fermentation process of Rosa davurica Pall.beverage by response surface methodology and study of its effect on exercise endurance[J].China Food Additives, 2022, 33(4):172-180.
[22] 吴丽, 周文斌, 谢娜娜, 等.老鹰茶发酵饮料及抗氧化活性研究[J].食品工业科技, 2021, 42(11):168-173.
WU L, ZHOU W B, XIE N N, et al.Study on fermentation technology of hawk tea and its antioxidant activity[J].Science and Technology of Food Industry, 2021, 42(11):168-173.
[23] WANG J, LI S S, FAN Y Y, et al.Anti-fatigue activity of the water-soluble polysaccharides isolated from Panax ginseng C.A.Meyer[J].Journal of Ethnopharmacology, 2010, 130(2):421-423.
[24] 郑聪, 李胜楠.余甘子圣女果复合饮料发酵工艺及对运动耐力的影响[J].食品工业科技, 2022, 43(4):358-365.
ZHENG C, LI S N.Fermentation process of compound beverage with Phyllanthus emblica and cherry tomato and its effect on exercise endurance[J].Science and Technology of Food Industry, 2022, 43(4):358-365.
[25] YANG D S, LIAN J H, WANG L Y, et al.The anti-fatigue and anti-anoxia effects of Tremella extract[J].Saudi Journal of Biological Sciences, 2019, 26(8):2 052-2 056.
[26] ØRTENBLAD N, WESTERBLAD H, NIELSEN J.Muscle glycogen stores and fatigue[J].The Journal of Physiology, 2013, 591(18):4 405- 4 413.
[27] 赵云龙.芜菁山楂复合饮料配方优化及其对运动耐力的影响[J].食品工业科技, 2022, 43(14):401-408.
ZHAO Y L.Optimization of formula of Brassica rapa L.and hawthorn compound beverage and its effect on exercise endurance[J].Science and Technology of Food Industry, 2022, 43(14):401-408.