黑胡萝卜 (Daucus carota L.) 原产于土耳其、巴基斯坦等地区,表皮呈紫黑色,具有3 000多年的历史。黑胡萝卜营养丰富,含有多种维生素、矿物质、多酚、类胡萝卜素等营养素与生物活性化合物,其花青素含量比其他根色的胡萝卜更高[1]。已有研究表明,部分品种的黑胡萝卜花青素含量可达1 750 mg/kg鲜重[2],花青素不仅具有很强的抗氧化、抗癌变、护肝等功效,还可以降低心血管疾病、糖尿病、肥胖症的患病风险[3]。因此,黑胡萝卜是一种营养丰富并且极具保健功能的食品。然而高含量的萜烯类化合物是黑胡萝卜风味和香气的决定性成分,这导致未加工的黑胡萝卜生青味较重,不受消费者的喜爱,尤其是处于生长发育期的儿童与青少年[4]。因此,黑胡萝卜通常在加工或者烹饪后被食用。
益生菌发酵作为一种新兴的食品加工方式,近年来在食品领域应用广泛。果蔬汁中丰富的营养物质和植物化合物的特殊结构使其成为益生菌发酵的理想基质,益生菌发酵果蔬汁因其丰富的营养、乳酸发酵后特有的风味以及广泛的健康益处受到了人们的关注[5]。研究表明,基于生物转化作用的益生菌发酵可使果蔬中的化学成分以及生物活性物质的结构、类型发生改变,对于果蔬制品的感官、营养、功能特性都具有积极影响[6]。苦瓜中的皂苷以糖苷形式存在,是苦瓜苦味的决定性因素,MAZLAN等[7]利用植物乳酸菌发酵苦瓜时发现酶的生物转化破坏了糖苷结构,致使苦味减弱,显著改善了不良风味。WANG等[8]利用嗜酸乳杆菌、瑞士乳杆菌和植物乳杆菌发酵徐香、红阳两个品种的猕猴桃汁,发现花青素、类黄酮、总酚含量显著提升。YAN等[9]使用植物乳杆菌与发酵乳杆菌混合发酵胡柚汁,发现发酵胡柚汁可以有效改善由肥胖引起的肠道生态失调,对于治疗高脂饮食引起的肥胖具有潜在作用。
总之,采用益生菌发酵技术开发具有营养保健功能的发酵果蔬汁产品,不仅可以改善果蔬制品的风味,还可增强其营养、功能特性。其中,乳酸菌(lactic acid bacteria) 是目前果蔬发酵中常用的益生菌。综上,本研究以黑胡萝卜为原料,利用不同乳酸菌发酵黑胡萝卜汁,并综合比较5种不同的乳酸菌发酵对黑胡萝卜汁发酵特性、理化指标、功能特性及感官品质的影响,从中筛选最适合黑胡萝卜汁发酵的乳酸菌种。本研究以期为发酵黑萝卜汁的开发与生产提供理论依据与技术参考,同时对黑胡萝卜的精深加工与资源利用具有重要意义。
1 材料与方法
1.1 材料与设备
新鲜黑胡萝卜(紫美人胡萝卜),购自立源美农品牌,实验用黑胡萝卜无机械损伤,无病虫害,无腐烂变质现象。
ABTS、2,4,6-三吡啶基三嗪[2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ]、2,6-二叔丁基对甲基苯酚 (butylated hydroxytoluene,BHT) 、类胡萝卜素、葡萄糖标准品,美国Sigma公司;浓盐酸、醋酸钠、氯化铁、碳酸钠、焦性没食子酸、氢氧化钠、浓硫酸、蒽酮、丙酮、甲醇、无水乙醇、氢氧化钾、氢氧化钠、MRS培养基、氯化钠、过硫酸钾、百里酚蓝、6-羟基-2,5,7,8-四甲基色烷-2-羧酸 (Trolox)(分析纯),上海源叶科技有限公司;福林酚,北京索莱宝科技有限公司。
PAL-1手持糖度仪,日本爱拓公司;雷磁phs-3e pH计,上海仪电科学仪器股份有限公司;TGL-16G离心机,上海安亭科学仪器厂;UV2800紫外分光光度计,上海尤尼柯仪器有限公司;Ci760003040489色度仪,上海爱色丽色彩科技有限公司;PEN 3电子鼻,德国Airsense公司;ATPIO-1000D超声波处理器、XODC-0515-II恒温器,中国江苏南京先欧有限公司。
1.2 发酵黑胡萝卜汁制备
将新鲜黑胡萝卜清洗去皮后切分为厚度为1 cm的薄片,置于90 ℃ 2 g/L维生素C水溶液热烫5 min,随后添加黑胡萝卜总重70%的热烫水混合打浆,用200目纱布过滤后于25 ℃, 7 000 r/min离心15 min。取离心后上清液于沸水浴处理3 min杀菌灭酶,待冷却至室温后,接种乳酸菌,使黑胡萝卜汁中初始细胞浓度为7.5 lg CFU/mL左右,将接种乳酸菌后的黑胡萝卜汁于37 ℃下培养36 h。在相同的培养条件下,以灭菌后未接种乳酸菌的黑胡萝卜汁作为对照。
1.3 活菌数测定
参考WANG等[8]的方法将菌种进行保藏,参考CAI等[10]的方法进行活化并得到菌悬液。取5 mL菌悬液至装有45 mL无菌生理盐水的锥形瓶中,混匀。取1 、2 、3 、4 、5 、6 、7 、8 、9 、10 mL锥形瓶中的菌液加入装有9 、8 、7 、6 、5 、4 、3 、2 、1 、0 mL无菌生理盐水的试管中进行梯度稀释,并混匀。参考MARKKINEN等[11]的方法建立光密度(OD600值) 线性回归模型,即以平板计数获得的菌落数为横坐标,以OD600值为纵坐标建立线性回归模型。
取1 mL发酵黑胡萝卜汁,于4 ℃,5 000 r/min离心10 min,弃去上清液,使沉淀重新均匀分布在无菌生理盐水中,获得菌悬液,以离心重悬后的同条件培养的未接种的黑胡萝卜汁为对照测定OD600值并带入线性回归模型进行计算,获得发酵黑胡萝卜汁的活菌数。
1.4 理化指标测定
采用pH计测定黑胡萝卜汁的pH值。使用手持糖度计测定黑胡萝卜汁的可溶性固形物含量 (total soluble solid, TSS),结果以°Brix表示。参考GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》,采用酸碱滴定法测定黑胡萝卜汁的可滴定酸(titratable acidity, TA),结果以g/L表示(以乳酸计)。采用硫酸-蒽酮法[12]测定可溶性糖 (soluble sugar content, SSC),结果以mg/mL表示[以葡萄碳当量(glucose equivalent,GE)]计。
1.5 功能指标测定
黑胡萝卜汁的花色苷含量 (total anthocyanin content, TAC) 采用pH示差法进行测定,结果以mg/L表示[以花青素-3-葡萄糖苷当量 (cyanoside-3-glycoside equivalent, C3GE) 计] 。总酚含量 (total polyphenol content, TPC) 采用Folin-Ciocalteu法进行测定[13],结果以g/L表示[以没食子酸当量 (gallic acid equivalent, GAE) 计] 。总类胡萝卜素含量 (total carotenoid content, TCC) 采用萃取-比色法测定[14],结果以mg/L表示 (以β-胡萝卜素当量计)。
1.6 抗氧化活性测定
抗氧化活性采用两种方法,包括对ABTS阳离子自由基清除能力和铁离子还原能力(ferric ion reducing antioxidant power, FRAP)的测定,FRAP参考SARASWATI等[15]的方法进行测定,ABTS阳离子自由基清除能力参考AYYANNA等[16]的方法进行测定,结果均以mmol/L表示[以水溶性维生素E当量(trolox equivalent, TE)计]。
1.7 色度检测
采用色度仪在全透射模式下测定发酵黑胡萝卜汁样品的颜色特征,每组样品重复测定3次,所测参数包括亮度L*、红绿度a*、黄蓝度b*、色相角h°和饱和度C*。总色差ΔE、h°和C*由色度仪自带的软件计算得出。
1.8 电子鼻检测
使用配有10个金属氧化物半导体的电子鼻对发酵后黑胡萝卜汁的气味特征进行评估,参考CAO等[17]的测定方法稍作修改。取10 mL样品放入20 mL顶空瓶中25 ℃下平衡5 min开始检测,每组样品平行测定8次。电子鼻检测的具体参数为载气流速300 mL/min,检测时间60 s,清洗时间300 s。
1.9 感官评价
组织15名经过训练的西北农林科技大学师生(7男,8女,年龄20~50周岁)进行感官品评,感官品评标准表由感官品评员品尝样品后讨论调整,最终确定感官品评标准见表1。将20 mL黑胡萝卜汁倒入透明品尝杯当中并随机编码,由感官品评员从外观、香气、滋味、色泽和总体可接受性方面进行正式评估。
1.10 数据分析
本实验使用WPS 2019对数据进行整理,除特殊说明外,实验结果均以3次平行测定结果的平均值±标准差 (SD) 表示,使用Origin 2022软件进行数据可视化分析,SPSS 20 (SPSS Inc., IBM) 用于实现数据的方差分析、多重比较和线性判别分析 (linear discriminant analysis, LDA),以P<0.05表示差异显著。
表1 感官品评标准表
Table 1 Sensory evaluation criteria

感官特性评分标准分值/分外观(20分)澄清,透明,无沉淀,不分层,暗紫色、光泽好16~20微浑浊略有沉淀,分层现象,紫色较深或较淡、有光泽11~15较混浊有少量沉淀或轻微分层,褐色或几乎无色、光泽差6~10严重浑浊或沉淀较多,有分层现象,褐色或无色、无光泽1~5香气(20分)香气浓郁,无蒸煮味等不良气味16~20香气一般,无不良气味11~15香气较淡,带有轻微不良气味6~10基本没有香气,带有明显的蒸煮味等不良气味1~5滋味(20分)口感甘甜圆润,酸甜可口,无涩、苦等不良味道16~20口感宜人,有略微涩味、无苦味、无异味11~15口感单薄,有略微涩味、无苦味、略带异味6~10口感单薄,有较重涩味、苦味及异味1~5色泽(20分)色泽均匀一致,呈宜人的紫色或紫红色16~20色泽较均匀,紫色或紫红色稍暗11~15色泽较不均匀,紫色或紫红色偏暗6~10色泽不均匀,呈暗紫色或暗紫红色1~5总体可接受性(20分)非常乐意接受16~20基本能接受11~15基本不能接受6~10完全不能接受1~5
2 结果与分析
2.1 不同乳酸菌在黑胡萝卜汁中的发酵特性
在相同的发酵基质和发酵条件下,细菌的活力会因所选用菌株的个体适应性而不同[18]。本研究中5株乳酸菌在黑胡萝卜汁中的生长曲线及菌落增长数如图1所示。
由图1可知5株菌在0~6 h处于对数期,活菌数显著增多,12 h时进入稳定期,36 h时发酵基本结束。其中,短乳杆菌在黑胡萝卜汁中的生长优势明显,发酵结束时活菌数达9.46 lg CFU/mL,活菌增长数达1.75 lg CFU/mL,显著高于其他菌株 (P<0.05)。这主要是因为短乳杆菌在糖化和发酵时可以同时利用木糖和葡萄糖等多种糖类生长[19]。发酵乳杆菌、植物乳杆菌,戊糖乳杆菌和干酪乳杆菌在发酵结束时活菌数依次减少,但均保持了108 CFU/mL以上的菌落数,符合益生菌经消化道后可对宿主健康起到有利影响的最低存活水平 (106~107 CFU/mL)[18]。
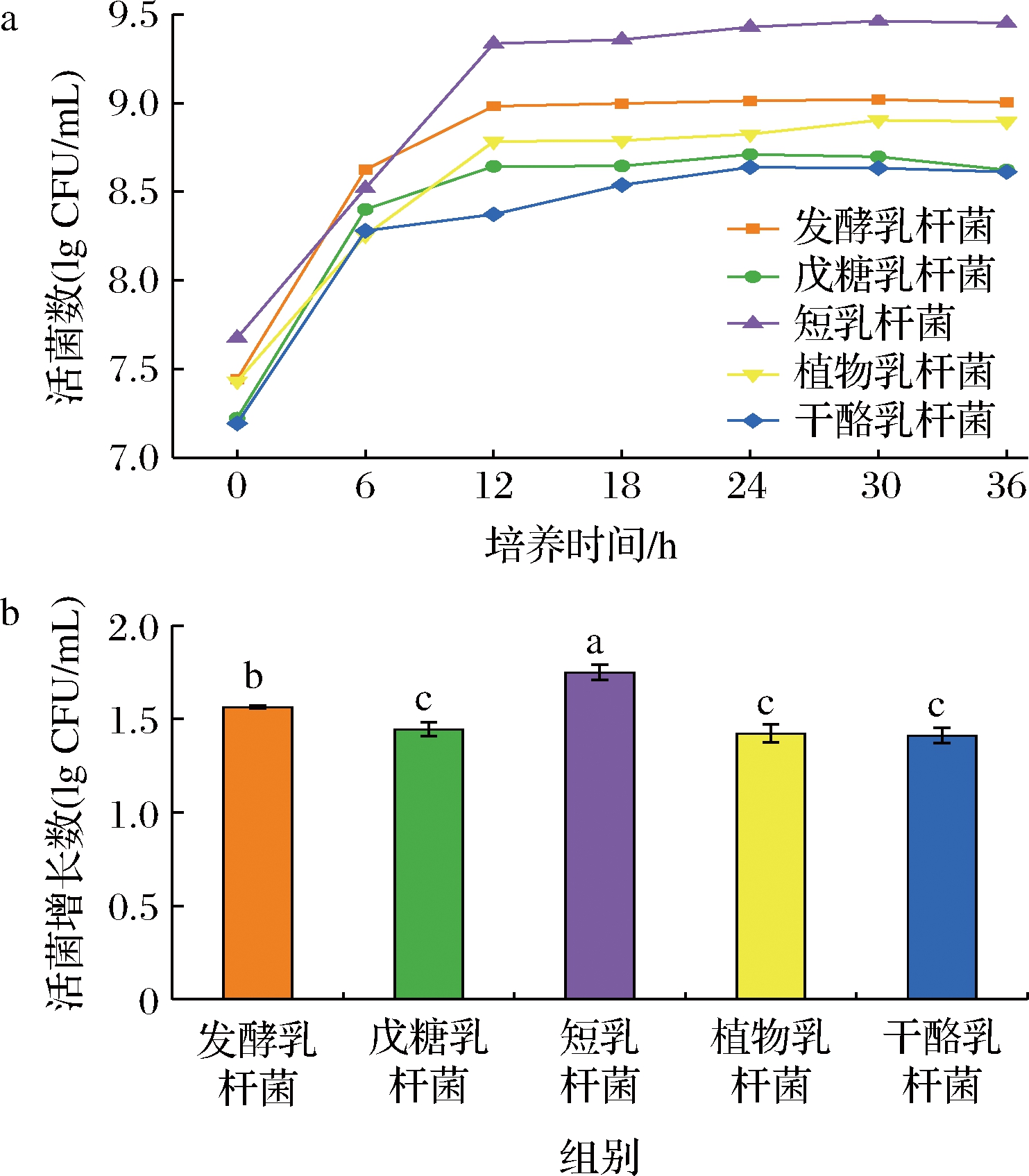
a-不同乳酸菌生长曲线;b-发酵前后的菌落增长数
图1 五株益生菌发酵黑胡萝卜汁的发酵特性结果
Fig.1 Fermentation characteristics of black carrot juice fermented by five probiotics fermentation
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 不同乳酸菌发酵对黑胡萝卜汁理化指标的影响
乳酸菌发酵过程中,产酸量和可溶性糖消耗量可以间接反应菌株的生长特性,是重要的发酵特性指标。不同乳酸菌发酵对黑胡萝卜汁理化指标的影响如图2-a~图2-d所示。
由图2-a、图2-b可知,对照组黑胡萝卜汁的pH值和TSS分别为5.2和6.7 °Brix,本研究中5株乳酸菌发酵均使黑胡萝卜汁pH和TSS显著下降 (P<0.05),这表明不同乳酸菌发酵过程中均发生了碳水化合物的消耗与酸类物质的生成。图2-c表明乳酸菌发酵可以显著提高黑胡萝卜汁中的TA含量 (P<0.05),其中短乳杆菌发酵后黑胡萝卜汁的TA含量最高,为11.95 g/L(以乳酸计),这可能与其突出的生长优势有关。由图2-d可知,短乳杆菌发酵黑胡萝卜汁后SSC最低,为30 mg/mL,约为对照组的一半,且显著低于其他乳酸菌发酵后的黑胡萝卜汁(P<0.05)。这是因为短乳杆菌生长优势大,利用黑胡萝卜汁中的糖类物质维持自身繁殖增长,大量产酸,故总糖大量消耗导致SSC最低。其余乳酸菌发酵也均使黑胡萝卜汁的SSC显著下降 (P<0.05),植物乳杆菌、戊糖乳杆菌、干酪乳杆菌和发酵乳杆菌发酵后黑胡萝卜汁的SSC分别下降了24.91%、24.97%、25.42%、36.04%,SSC含量递减规律与可溶性固形物变化规律基本一致。

a-pH值;b-TSS;c-TA含量;d-SSC含量
图2 五株益生菌发酵黑胡萝卜汁理化指标测定结果
Fig.2 Physicochemical characteristic of black carrot juice fermented by five probiotics
2.3 不同乳酸菌发酵对黑胡萝卜汁中功能性物质和抗氧化活性的影响
乳酸菌在发酵过程中与植物酶共同代谢可以提高各种食物的营养价值和消化率,并将主要食物基质转化为功能性生物活性物质,从而改善其健康功能特性[20]。不同乳酸菌发酵黑胡萝卜汁的TAC、TCC、TPC以及FRAP、ABTS阳离子自由基清除能力结果见图3。
由图3-a可知,对照组黑胡萝卜汁中TAC为46.96 mg C3GE/L,5种乳酸菌发酵均使TAC显著提高 (P<0.05),其中短乳杆菌发酵黑胡萝卜汁的TAC提升最多,高达155.72 mg/L,约为对照组的3.3倍。这一方面是由于乳酸菌发酵过程中释放的水解酶有利于花青素从细胞中释放出来[21],另一方面是由于花青素在较低的pH下结构稳定,不易降解,因而TAC显著提高。由图3-b可知,对照组黑胡萝卜汁中TCC为19.78 mg β-胡萝卜素/L,5种乳酸菌发酵分别使黑胡萝卜汁的TCC显著提升了14%~39% (P<0.05),其中短乳杆菌发酵使TCC提升至27.51 mg β-胡萝卜素/L,由图3-c可知,对照组黑胡萝卜汁中TPC为1.25 g GAE/L,除发酵乳杆菌外其余乳酸菌发酵均可显著提高黑胡萝卜汁中TPC (P<0.05),这与近年来乳酸菌发酵果蔬汁的报道结果相一致[22]。一方面可能是由于多酚易与黑胡萝卜汁中的蛋白质结合,以多酚-蛋白质复合体的形式存在,乳酸菌发酵过程中,由于酶的代谢作用,破坏复合体间结合键,发生一系列解聚转化过程,致使黑胡萝卜汁中多酚含量明显提升;另一方面可能是由于乳酸菌生长繁殖过程中代谢酶促使可溶性或者不溶性的酚类物质从细胞壁基质中释放出来。
图3-d、图3-e为乳酸菌发酵黑胡萝卜汁的抗氧化能力,对照组的FRAP和ABTS阳离子自由基清除能力分别为15.43、11.59 mmol TE/L。5种乳酸菌当中只有短乳杆菌显著提升了FRAP和ABTS阳离子自由基清除能力(P<0.05),戊糖乳杆菌发酵后的黑胡萝卜汁与对照组的抗氧化能力并无显著差异(P>0.05),而干酪乳杆菌发酵使黑胡萝卜汁的两种抗氧化能力均显著下降(P<0.05)。研究表明果蔬汁的抗氧化活性能力与其花色苷、类胡萝卜素、多酚等功能性成分的含量密切相关[23],而短乳杆菌发酵使黑胡萝卜汁中的TAC、TCC和TPC均显著提升(P<0.05),这可能是其抗氧化能力得到显著提高的主要原因。综上可知,短乳杆菌发酵可显著提高黑胡萝卜汁的功能性成分含量和抗氧化活性,这对于提升黑胡萝卜汁的营养价值具有积极作用,因此,就发酵对功能特性的影响而言,短乳杆菌在5种乳酸菌中优势显著。

a-TAC含量;b-TCC含量;c-TPC含量;d-ABTS阳离子自由基清除能力;e-FRAP
图3 五株益生菌发酵黑胡萝卜汁功能特性测定结果
Fig.3 Functional characteristics of black carrot juice fermented by five probiotics
2.4 感官品质
2.4.1 色度测定结果
色泽也是评判益生菌发酵果蔬汁感官品质的重要指标之一。图4表示不同乳酸菌发酵后黑胡萝卜汁样品的颜色特征,由图4-c可知乳酸菌发酵后黑胡萝卜汁的ΔE值均>20,当ΔE>3时,即可通过肉眼分辨出色彩差异[24],说明5种乳酸菌发酵均使黑胡萝卜汁的色泽特征发生了显著改变。由图4-a、图4-b可知对照组黑胡萝卜汁的a*值、b*值、C*值、L*值、h°值分别为1.98、0.34、1.93、0.38、10.24,发酵后以上色泽参数均显著增大 (P<0.05),这表明发酵后黑胡萝卜汁样品的红度、黄度、色彩饱和度、亮度均得到了显著提升,即不同乳酸菌发酵后黑胡萝卜汁的颜色特征向理想方向变化,发酵后的色泽特性更受消费者喜爱。其中植物乳杆菌和发酵乳杆菌发酵使黑胡萝卜汁的L*值提升了9倍以上,C*值提升了13倍以上,使黑胡萝卜汁的颜色明亮度、色彩饱和度显著提高,从图4-b、图4-d中也可观察到该结果。综合色度参数的分析可知,发酵乳杆菌和植物乳杆菌对于黑胡萝卜汁的色度改善效果最好。
2.4.2 电子鼻测定结果
果汁的香气特征是影响消费者购买的重要因素,研究表明,乳酸菌发酵可以显著改善果蔬汁的香气特征及挥发性风味物质的形成[6]。采用电子鼻对黑胡萝卜汁样品的整体气味特征进行了检测,结果如图5所示。图5-a为电子鼻不同传感器对黑胡萝卜汁中气味物质的响应雷达图。由图5-a可知,6组黑胡萝卜汁样品均对传感器W5S(氮氧化物)、W1S(甲基化合物)、W2S(醇类物质与醛酮类物质)和W1W(硫化物与萜烯类物质)的响应较高,且与对照相比,乳酸菌发酵后黑胡萝卜汁对W2S传感器的响应值显著升高(P<0.05),对W5S传感器的响应值显著下降(P<0.05)。
进一步选择电子鼻50~55 s的稳定信号对黑胡萝卜汁样品的响应值进行LDA,图5-b为分析结果,其中LD1贡献率为90.6%,LD2贡献率为7.3%,LD1和LD2的累计贡献率达97.9%,说明LD1和LD2可以较好地解释电子鼻数据结果。乳酸菌发酵后黑胡萝卜汁的气味特征与对照组有明显区分,同一种乳酸菌发酵黑胡萝卜汁的数据聚集性好,实验重复性高。不同乳酸菌发酵黑胡萝卜汁的区分度好,相互独立,说明不同乳酸菌发酵对黑胡萝卜汁气味特征的影响显著。其中戊糖乳杆菌与发酵乳杆菌的距离较为接近,这表明这两株菌发酵后黑胡萝卜汁的气味特征较为接近;而植物乳杆菌和短乳杆菌与对照组的距离最远,这表明这两株菌发酵后黑胡萝卜汁的气味特征有较大变化。

a、b、d-色度分布图;c-L*、C*、h°和ΔE值
图4 五株益生菌发酵黑胡萝卜汁色度测定结果
Fig.4 Chromaticity of black carrot juice fermented by five probiotics
注:图4-b、图4-d中不同小写字母表示a*值差异显著 (P<0.05),不同大写字母表示b*值差异显著 (P<0.05)
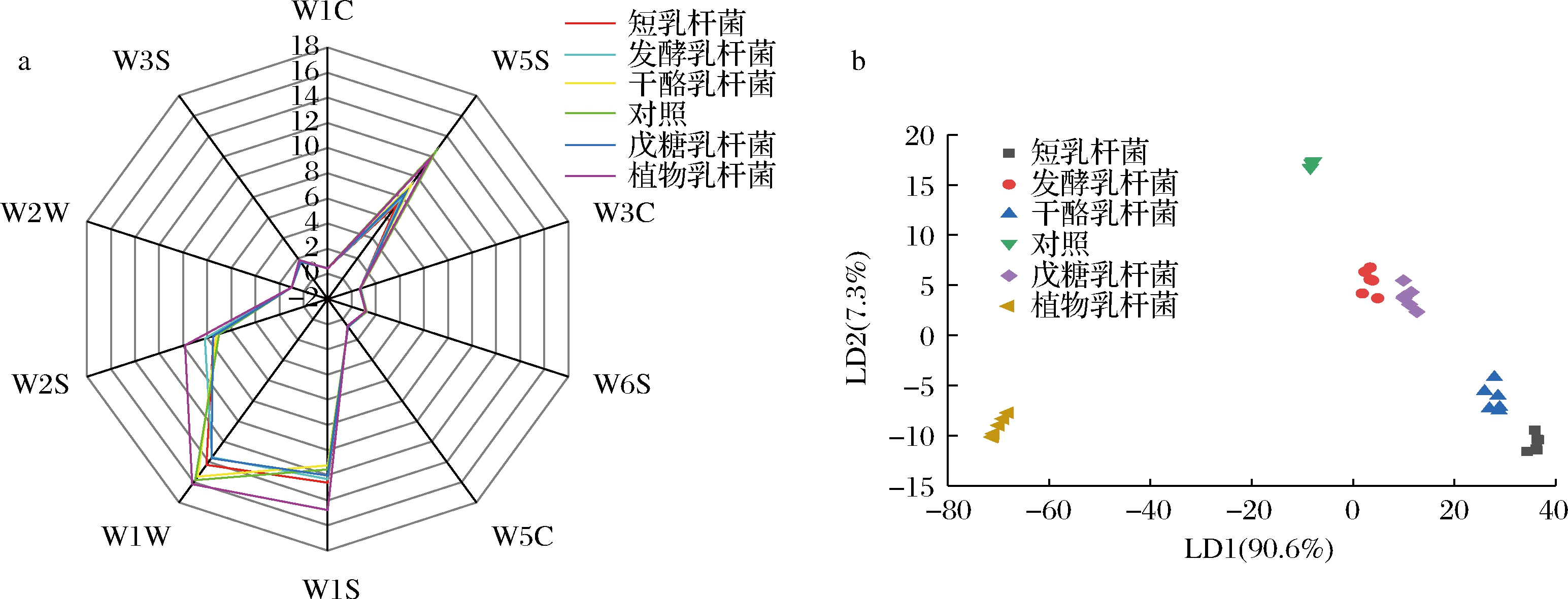
a-电子鼻传感器的响应值雷达图;b-LDA
图5 五株益生菌发酵黑胡萝卜汁的电子鼻测定结果
Fig.5 Results of electronic nose assay of black carrot juice fermented by five probiotics
2.4.3 感官评价结果
感官评价结果见图6,5种乳酸菌发酵后黑胡萝卜汁的感官总分及外观、香气、滋味、色泽和总体可接受性等单项得分均显著高于未发酵黑胡萝卜汁 (P<0.05),即乳酸菌发酵能显著改善黑胡萝卜汁的感官品质。其中发酵乳杆菌和植物乳杆菌的色泽得分最高,其余乳酸菌发酵后黑胡萝卜汁的色泽得分无显著性差异 (P>0.05),这与色度测定结果相一致。此外,发酵乳杆菌和戊糖乳杆菌的滋味得分最高,这可能与其在发酵过程中产酸量少,SSC保留率高有关。植物乳杆菌发酵后黑胡萝卜汁的香气得分显著高于其他乳酸菌 (P<0.05),在不同乳酸菌发酵大麦麦芽的实验中[25],植物乳杆菌发酵后香气改善明显,这一点与本实验结果相符。就外观而言,5种乳酸菌发酵的黑胡萝卜汁并未表现出显著差异 (P>0.05)。综上可知,发酵乳杆菌在色泽、滋味及总体可接受性方面表现优异,并且感官总分显著最高 (61.96),植物乳杆菌感官总分排名第二 (60.32),而干酪乳杆菌和短乳杆菌的感官总分均较低,并且两者没有显著性差异。因此,发酵乳杆菌和植物乳杆菌对于提高黑胡萝卜汁的感官品质及消费者的总体可接受性有积极影响。

a-感官总分;b-感官评价雷达图
图6 人工感官评价结果
Fig.6 Sensory evaluation results of black carrot juice fermented by five probiotics
3 结论
本研究用5种不同的乳酸菌发酵黑胡萝卜汁,比较发酵后的理化品质、功能特性和感官品质差异,筛选出一株最适合黑胡萝卜发酵的乳酸菌。结果表明,乳酸菌在黑胡萝卜汁中发酵特性良好,乳酸菌发酵显著提高了黑胡萝卜汁中的功能性物质含量并显著改善了黑胡萝卜汁的感官品质,具体来讲,不同乳酸菌对于黑胡萝卜汁感官品质、营养品质的提升各有侧重。
其中短乳杆菌在黑胡萝卜汁中生长优势明显,发酵后黑胡萝卜汁TAC、TCC和TPC均有显著提升,并且对TAC、TCC的提升度最高,分别提升了3.3倍、1.4倍。FRAP和ABTS阳离子自由基清除能力均位于前列,说明短乳杆菌发酵对于提高黑胡萝卜汁的营养价值和抗氧化活性具有积极作用。然而由于其产酸量大,带来了不好的滋味体验,因此感官总分较低。植物乳杆菌和发酵乳杆菌发酵可显著改善黑胡萝卜汁的感官特性,其发酵后的黑胡萝卜汁在感官评价中总体得分最高。因此,在未来的研究中可以将短乳杆菌、植物乳杆菌和发酵乳杆菌进行混菌发酵,并优化最适比例,以期得到营养风味更佳的发酵黑胡萝卜汁。
[1] AKHTAR S, RAUF A, IMRAN M, et al.Black carrot (Daucus carota L.), dietary and health promoting perspectives of its polyphenols:A review[J].Trends in Food Science &Technology, 2017, 66:36-47.
[2] KHANDARE V, WALIA S, SINGH M, et al.Black carrot (Daucus carota ssp. Sativus) juice:Processing effects on antioxidant composition and color[J].Food and Bioproducts Processing, 2011, 89(4):482-486.
[3] CAI D B, LI X S, CHEN J L, et al.A comprehensive review on innovative and advanced stabilization approaches of anthocyanin by modifying structure and controlling environmental factors[J].Food Chemistry, 2022, 366:130611.
[4] MUCHLINSKI A, IBDAH M, ELLISON S, et al.Diversity and function of terpene synthases in the production of carrot aroma and flavor compounds[J].Scientific Reports, 2020, 10(1):9989.
[5] XU Y, HLAING M M, GLAGOVSKAIA O, et al.Fermentation by probiotic Lactobacillus gasseri strains enhances the carotenoid and fibre contents of carrot juice[J].Foods, 2020, 9(12):1803.
[6] 吴彩云, 张晓荣, 徐怀德, 等.益生菌发酵果蔬汁生物活性成分及功能特性研究进展[J].中国食品学报, 2021, 21(12):323-334.
WU C Y, ZHANG X R, XU H D, et al.Research progress on bioactive components and functional properties of fruit and vegetable juice fermented by probiotics[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):323-334.
[7] MAZLAN F A, ANNUAR M S, SHARIFUDDIN Y.Biotransformation of Momordica charantia fresh juice by Lactobacillus plantarum BET003 and its putative anti-diabetic potential[J].PeerJ, 2015, 3(10):e1376.
[8] WANG Z N, FENG Y Z, YANG N N, et al.Fermentation of kiwifruit juice from two cultivars by probiotic bacteria:Bioactive phenolics, antioxidant activities and flavor volatiles[J].Food Chemistry, 2022, 373:131455.
[9] YAN X, WANG F J, WENG P F, et al.The effect of fermented Huyou juice on intestinal microbiota in a high-fat diet-induced obesity mouse model[J].Journal of Food Biochemistry, 2020, 44(12):e13480.
[10] CAI Y X, WANG J H, MCAULEY C, et al.Fermentation for enhancing the bioconversion of glucoraphanin into sulforaphane and improve the functional attributes of broccoli puree[J].Journal of Functional Foods, 2019, 61:103461.
[11] MARKKINEN N, PARIYANI R, JOKIOJA J, et al.NMR-based metabolomics approach on optimization of malolactic fermentation of sea buckthorn juice with Lactiplantibacillus plantarum[J].Food Chemistry, 2022, 366:130630.
[12] LAO Y X, YU Y Y, LI G K, et al.Effect of sweet corn residue on micronutrient fortification in baked cakes[J].Foods, 2019, 8(7):260.
[13] AYDIN C, MAMMADOV R.Phenolic composition, antioxidant, antibacterial, larvacidal against Culex pipiens, and cytotoxic activities of Hyacinthella lineata steudel extracts[J].International Journal of Food Properties, 2017, 20(10):2 276-2 285.
![]() GARC
GARC A JIMÉNEZ F, MELÉNDEZ GORDILLO R M.Comparative study of carotenoid composition in three mexican varieties of Capsicum annuum L[J].Food Chemistry, 2005, 90(1-2):109-114.
A JIMÉNEZ F, MELÉNDEZ GORDILLO R M.Comparative study of carotenoid composition in three mexican varieties of Capsicum annuum L[J].Food Chemistry, 2005, 90(1-2):109-114.
[15] SARASWATI, GIRIWONO P E, ISKANDRIATI D, et al.In-vitro anti-inflammatory activity, free radical (DPPH) scavenging, and ferric reducing ability (FRAP) of Sargassum cristaefolium lipid-soluble fraction and putative identification of bioactive compounds using UHPLC-ESI-ORBITRAP-MS/MS[J].Food Research International, 2020, 137:109702.
[16] AYYANNA R, ANKAIAH D, ARUL V.Anti-inflammatory and antioxidant properties of probiotic bacterium Lactobacillus mucosae AN1 and Lactobacillus fermentum SNR1 in wistar albino rats[J].Frontiers in Microbiology, 2018, 9:3063.
[17] CAO Y X, WU Z F, WENG P F.Comparison of bayberry fermented wine aroma from different cultivars by GC-MS combined with electronic nose analysis[J].Food Science &Nutrition, 2020, 8(2):830-840.
[18] SZUTOWSKA J.Functional properties of lactic acid bacteria in fermented fruit and vegetable juices:A systematic literature review[J].European Food Research and Technology, 2020, 246(3):357-372.
[19] KIM J H, SHOEMAKER S P, MILLS D A.Relaxed control of sugar utilization in Lactobacillus brevis[J].Microbiology, 2009, 155(4):1 351-1 359.
[20] FILANNINO P, DI CAGNO R, GOBBETTI M.Metabolic and functional paths of lactic acid bacteria in plant foods:Get out of the labyrinth[J].Current Opinion in Biotechnology, 2018, 49:64-72.
[21] LANDETE J M, CURIEL J A, RODR GUEZ H, et al.Aryl glycosidases from Lactobacillus plantarum increase antioxidant activity of phenolic compounds[J].Journal of Functional Foods, 2014, 7:322-329.
GUEZ H, et al.Aryl glycosidases from Lactobacillus plantarum increase antioxidant activity of phenolic compounds[J].Journal of Functional Foods, 2014, 7:322-329.
[22] GAN R Y, SHAH N P, WANG M F, et al.Lactobacillus plantarum WCFS1 fermentation differentially affects antioxidant capacity and polyphenol content in mung bean (Vigna radiata) and Soya bean (Glycine max) milks[J].Journal of Food Processing and Preservation, 2017, 41(1):e12944.
[23] YILDIZ O, CAN Z, LAGHARI A Q, et al.Wild edible mushrooms as a natural source of phenolics and antioxidants[J].Journal of Food Biochemistry, 2015, 39(2):148-154.
[24] CEJUDO-BASTANTE M J, RODRíGUEZ-MORGADO B, JARA-PALACIOS M J, et al.Pre-fermentative addition of an enzymatic grape seed hydrolysate in warm climate winemaking.Effect on the differential colorimetry, copigmentation and polyphenolic profiles[J].Food Chemistry, 2016, 209:348-357.
[25] SALMER N I, THOMAS K, PANDIELLA S S.Effect of potentially probiotic lactic acid bacteria on the physicochemical composition and acceptance of fermented cereal beverages[J].Journal of Functional Foods, 2015, 15:106-115.
N I, THOMAS K, PANDIELLA S S.Effect of potentially probiotic lactic acid bacteria on the physicochemical composition and acceptance of fermented cereal beverages[J].Journal of Functional Foods, 2015, 15:106-115.