随着现代农业的发展,农产品在生产过程中不可避免地使用到农药,然而在实践过程中,由于某种原因可能导致农药残留超标,从而造成环境和农产品污染[1]。长期食用农药残留超标的农产品,人体会出现头晕、恶心、充血、皮疹和溃疡等不良反应,如摄入量过多还有可能造成意识模糊、昏迷、休克甚至猝死[2]。农药残留是食品安全中重要的化学危害因素, 是衡量食品安全水平的重要指标。近年来,食品安全越来越受到政府监管部门和消费者的关注,为了保护我国人民身体健康不受农药残留侵害,大力发展农药残留检测技术尤其是多组分残留检测技术非常必要。
农产品中农残检测技术正朝着简单、快速、便利、准确、高效和环保的方向发展[3],但因农药极性差异大、基质成分较为复杂等诸多因素影响[4],给快速分离和准确测定带来了很大的困难。农药残留分析中,基质效应现象普遍存在, 基质效应是指样品中除分析物以外的其他成分对分析结果的影响[5],基质效应的强弱与基质含量[6]、农药品种、农药的基团、极性等特性有关[7],给农药残留定性定量分析造成干扰[8]。减小基质效应的干扰[9]、提高检测结果的准确性在农药残留分析检测实验中至关重要[10]。在研究基质对有机磷农药检测结果影响的过程中,加标回收率通常体现出一个比较大的范围(70%~120%)[11]。不同农药的加标回收率相差较大,日常检测尤其是批量多农药检测过程中,如何引入加标回收率是个值得探讨的问题。本文选取易产生基质干扰的有机磷农药作为研究对象,对NY/T 761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》标准方法的样品前处理进行改进,以苹果作为加标样品,采用不含目标农药的且与样品相近的基质配制[12]浓度相近的标准溶液进行校准[13],得到较高的农药加标回收率及精密度[14],并研究利用加标回收率校正检测结果,将检测结果引入一个合适的修正因子,从而得到便捷、准确的农药检测方法,可用于对多批次农产品中多种农药残留的快速筛选检测。
1 材料与方法
1.1 材料与试剂
苹果、梨、葡萄、青枣等水果均购于永康市;乙腈(色谱级),美国天地有限公司;丙酮(色谱级),上海凌峰化学试剂有限公司;氯化钠(分析纯),江苏强盛功能化学股份有限公司;敌敌畏、甲胺磷、乙酰甲胺磷、甲拌磷、氧乐果、毒死蜱、倍硫磷、马拉硫磷、对硫磷、甲基异柳磷、水胺硫磷、丙溴磷标准品,质量浓度1 000 μg/mL,农业部环境保护科研检测所。
1.2 仪器与设备
7890B气相色谱仪(配FPD含磷滤光片检测器及7693型自动进样器)、DB-1701毛细管柱(30 m×0.25 mm×0.25 μm)、5183-4711衬管,美国Agilent公司;N-EVAP111氮吹仪,美国Organomation公司;3205 FP3010食品加工机搅拌机,德国BRAUN公司;T18高速分散均质机,德国IKA公司;UNIVERSAL 320离心机,德国Andreas hettich公司;XW-80A漩涡混合器,上海精科实业有限公司。
1.3 实验方法
1.3.1 色谱条件
进样口温度:220 ℃,不分流进样;程序升温条件:90 ℃保留1 min,以20 ℃/min速度升温至140 ℃后保留1 min,以5 ℃/min速度升温至200 ℃后保留5 min,以3 ℃/min速度升温至212 ℃后保留8 min,以20 ℃/min速度升温至260 ℃后保留8 min;检测器温度250 ℃;进样量1 μL;氮气流速50 mL/min;空气流速60 mL/min;氢气流速60 mL/min;毛细管柱DB-1701 (30 m×0.25 mm×0.25 μm);柱流速1 mL/min。
1.3.2 样品提取
准确称取粉碎后的待测样15.00 g于80 mL离心管,加入15 mL乙腈,在均质机中12 000 r/min匀浆2 min后,8 000 r/min离心5 min,取上清液于50 mL具塞比色管,加入5 g左右氯化钠,剧烈振荡1 min,静置30 min,使乙腈相和水相分层。
吸取1 mL有机相放入5 mL刻度试管,放置于50 ℃水浴的氮吹仪,缓慢氮吹至近干,加入1 mL丙酮置换,最后定容至1 mL,在漩涡混合器上混匀,移入自动进样器样品瓶,供色谱测定。
1.3.3 进样次数对检测结果的影响试验
将各农药标准品分别用丙酮和苹果基质配制0.1 μg/mL标准溶液,采用1.3.1方法进行气相色谱分析。采用丙酮配制的标准溶液对检测结果进行校准,依次选取第1次(丙酮配标)、第4、14、26、38、50、62次检测结果。
1.3.4 方法的回收率和精密度试验
选择对试验目标农药峰不产生干扰的苹果作为试验样品,在苹果样品中分别添加1、2、5、10倍定量限(limit of quantitation,LOQ)值浓度(LOQ值为方法定量限)的混合农药标准工作液,各种农药的LOQ值如表1所示,按1.3.2方法进行样品前处理,按1.3.1方法进行气相色谱测定,每个添加水平重复测定6次,采用苹果空白基质配制相应浓度的标准溶液进行校准。
表1 农药品种及LOQ值 单位:mg/kg
Table 1 Pesticide varieties and LOQ value
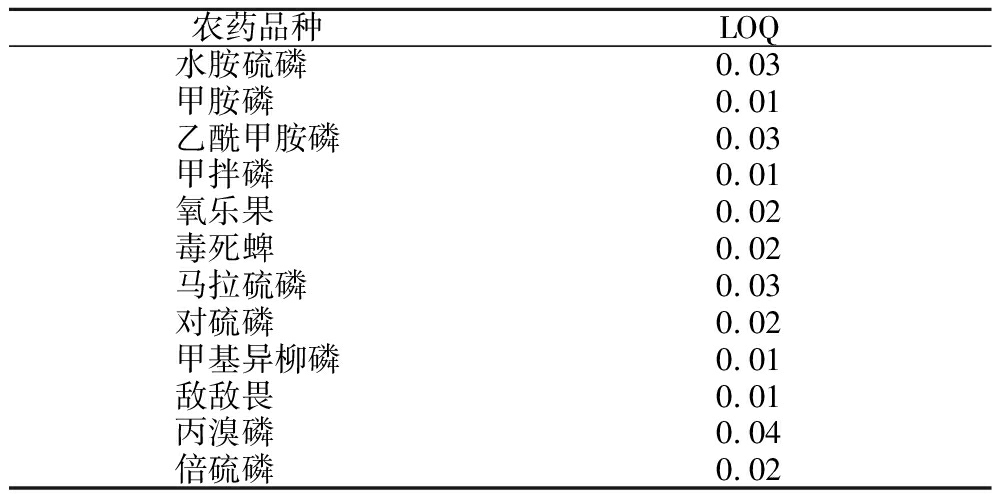
农药品种LOQ水胺硫磷 0.03甲胺磷 0.01乙酰甲胺磷0.03甲拌磷 0.01氧乐果 0.02毒死蜱 0.02马拉硫磷 0.03对硫磷 0.02甲基异柳磷0.01敌敌畏 0.01丙溴磷 0.04倍硫磷 0.02
1.3.5 用加标回收率校正测定结果[15-16]
加标回收试验是向样品中加入一定质量的待测物(通常加入一定量的标准溶液,这种样品称为加标水平),然后将其与该样品同时测定,进行对照试验,观察加入的待测物的质量能否定量回收。加标回收试验在一定程度上反映测试结果的准确度。当分析方法能够排除基体干扰,加标回收率能够准确反映测定结果时,此时的回收率就是一个系统误差修正值,由此可以得出一个修正因子f(>1或<1):f=1/P[其中P为加标回收率(%)],修正后的测定结果则表示为ρ×f, 系统误差虽然有可能是零,但是其不确定度不会是零,虽然有可能十分接近于零,因此修正因子f有可能十分接近于1(即加标回收率为100%),用于校正结果的回收率应该是平均回收率。对检测结果是否需要用回收率进行校正,需做显著性检验。
采用SPSS 19.0软件中的比较均值分析程序对添加量为5LOQ值的检测结果进行单样本t检验分析,置信区间百分比为95%,按分析顺序排除个案,结果输出单个样本统计量。
1.3.6 农药残留检测过程中的基质效应
不同蔬菜含有的成分可能会在气相色谱分析过程中产生背景峰,从而对样品峰形成干扰。选择蔬菜基质时,首选选择那些对目标峰不产生干扰的蔬菜作为试验样品,将农药混合标准品分别用15种蔬菜基质配制成0.5 μg/mL标准溶液,采用1.3.1方法进行气相色谱分析,用0.5 μg/mL丙酮标准溶液作为溶剂标考察不同蔬菜的基质效应。采用SPSS 19.0软件的聚类分析程序对15种蔬菜的农药色谱图的峰面积进行聚类分组。
2 结果与分析
2.1 有机磷农药混合标准溶液色谱分离
将各农药标准品分别用丙酮稀释成100 μg/mL的单一标准储备液,再稀释成1 μg/mL单一使用液,在同一色谱条件下确定各自的保留时间及出峰先后顺序,采用1.3.1方法进行气相色谱分析。气相分离效果如图1所示,12种有机磷农药能在此条件下完全分离,DB-1701为中等极性柱,对12种有机磷农药的分离效果较好。
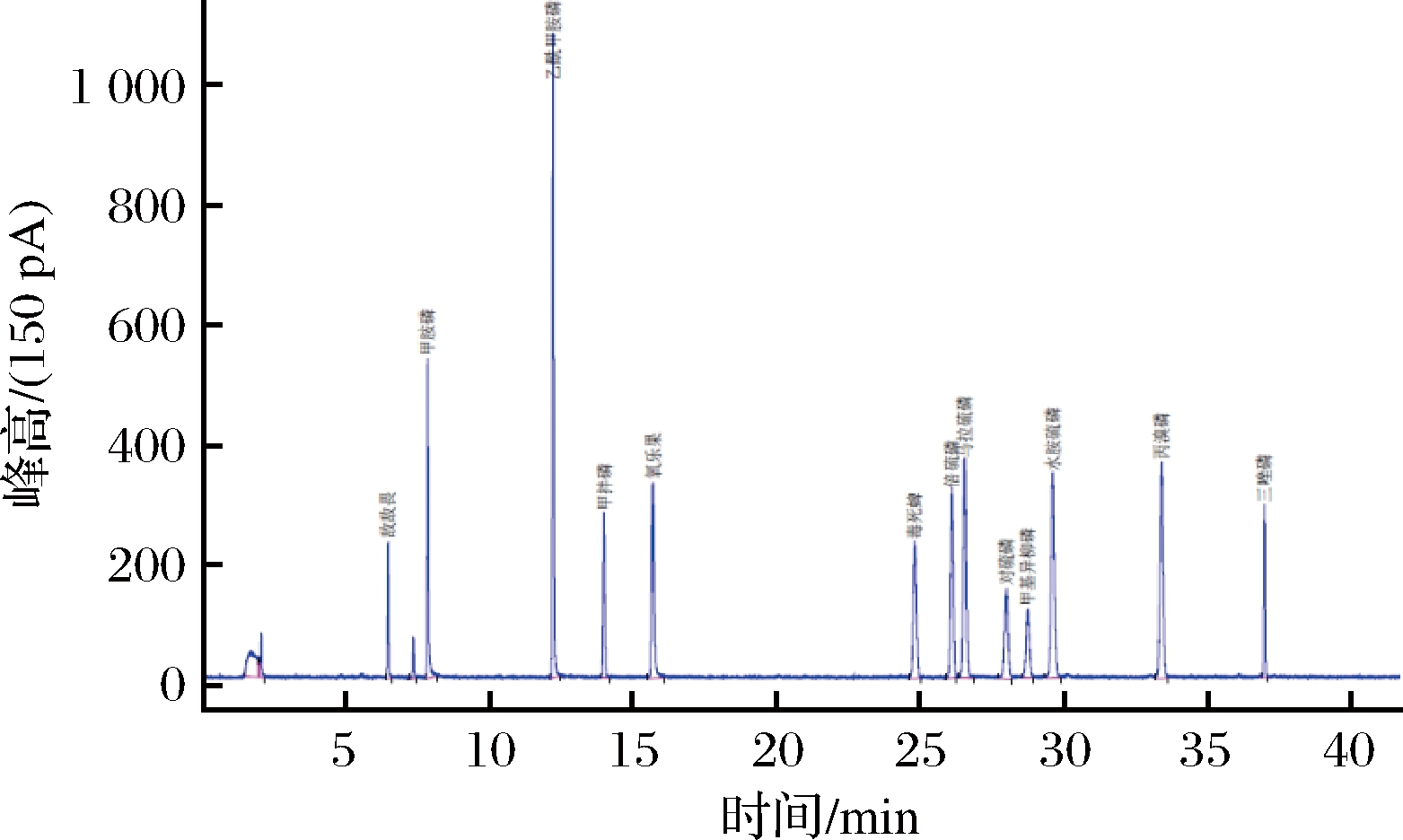
图1 有机磷农药色谱图
Fig.1 Chromatogram of organophosphorus pesticides
2.2 进样次数对检测结果的影响
将第1次保留时间和积分结果减去第4、14、26、38、50、62次保留时间和积分结果,得到保留时间偏移值和检测结果的绝对差值,结果如图2和图3所示。由图2可知,随着批量检测的样品量的增加,13种农药的保留时间均发生漂移,随着出峰顺序增加,保留时间发生漂移的绝对值明显增大,若以NY/T 761—2008标准中定性分析±0.05 min为鉴定标准,氧乐果第50次偏移为0.05 min,若继续进样,则可能会导致检测结果发生误判情况。出现保留时间漂移情况是由于重组分残留在柱头,重组分在不断进样过程中聚集,积累起来的重组分引起保留时间漂移。由图2可知,其他农药也或多或少存在这种基质干扰效应,所以批量进样时,应根据不同的农药检测项目,选择合适的进样数量,否则可能会出现误判情况出现。

图2 保留时间随着样品数量增加发生偏移
Fig.2 The retention time shifts as the number of samples increases
由图3可知,氧乐果、乙酰甲胺磷、对硫磷检测结果变化最大,其中苹果基质对氧乐果、乙酰甲胺磷初始呈现基质增强效应,随着进样次数的增加,检测结果越来越小,呈现逐渐衰减现象,乙酰甲胺磷绝对差值大于30%,氧乐果绝对差值甚至达到50%,基质效应非常显著。苹果基质对对硫磷初始呈现基质减弱效应,随着进样次数的增加,检测结果越来越大,呈现逐渐增强现象,且绝对差值大于30%,基质效应非常显著。考虑到可能出现的系统误差,其他10种农药品种结果影响不够显著。基质效应的强弱与农药品种、农药的基团、极性等特性有关[17]。
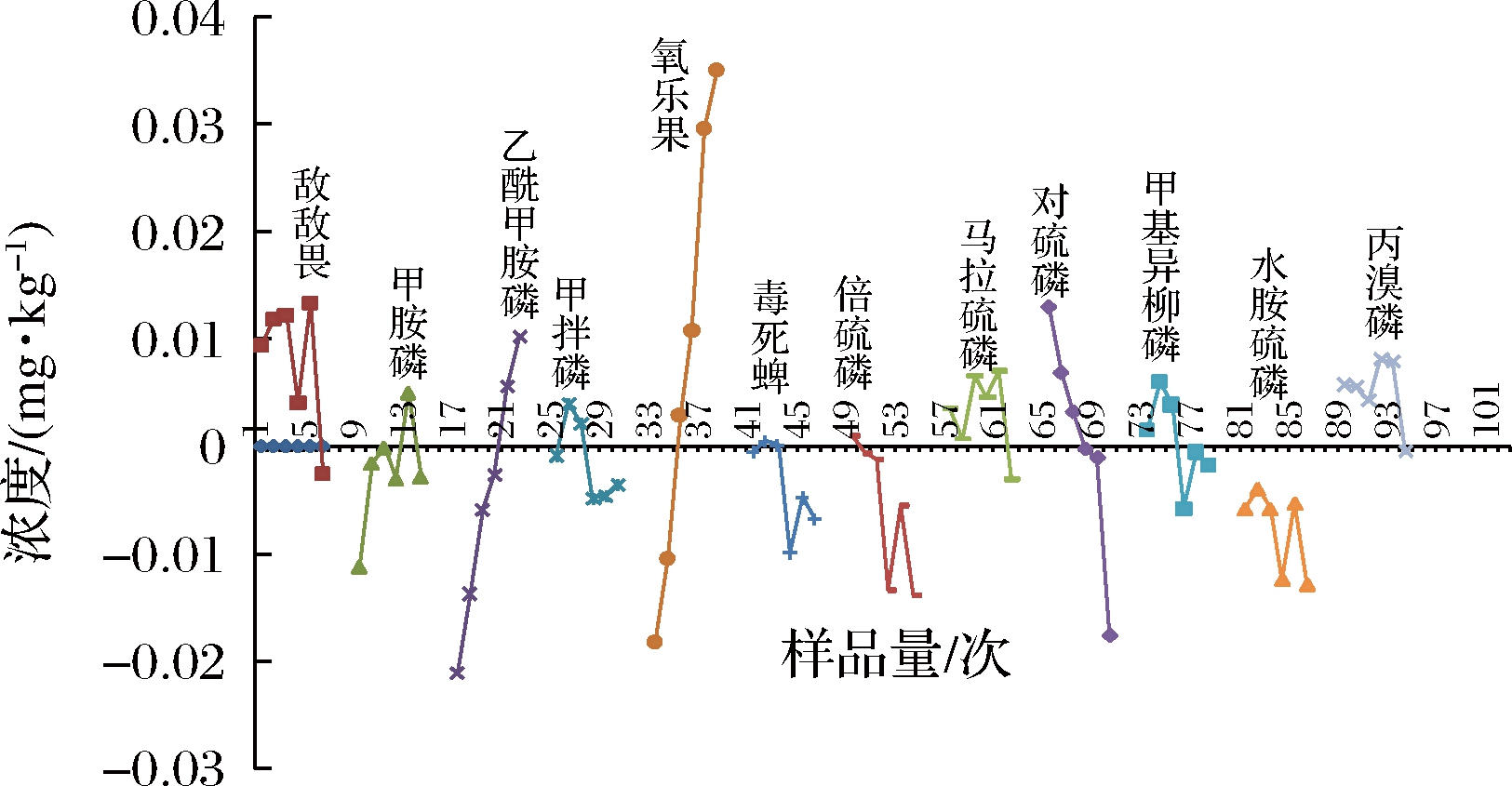
图3 检测结果的绝对值随着样品数量增加发生改变
Fig.3 The absolute value of the test results changes with the increase of the number of samples
2.3 有机磷农药的加标回收率和精密度
加标回收和精密度检测结果如表2所示。由表2可知,当添加水平为1、2、5、10倍LOQ值时,12种有机磷加标回收率为70.93%~104.02%,相对标准偏差RSD为3.01%~18.41%,能够满足农药残留分析检测质量控制的要求[18]。其中甲胺磷、乙酰甲胺磷、氧乐果加标回收率为70%~90%,而其他农药品种的加标回收率均为90%~104.02%,由此可见,采用此方法对甲胺磷、乙酰甲胺磷、氧乐果进行定量检测时,检测结果受到干扰较大。
表2 有机磷农药的加标回收率和精密度
Table 2 Recoveries and precisions of organophosphorus pesticides
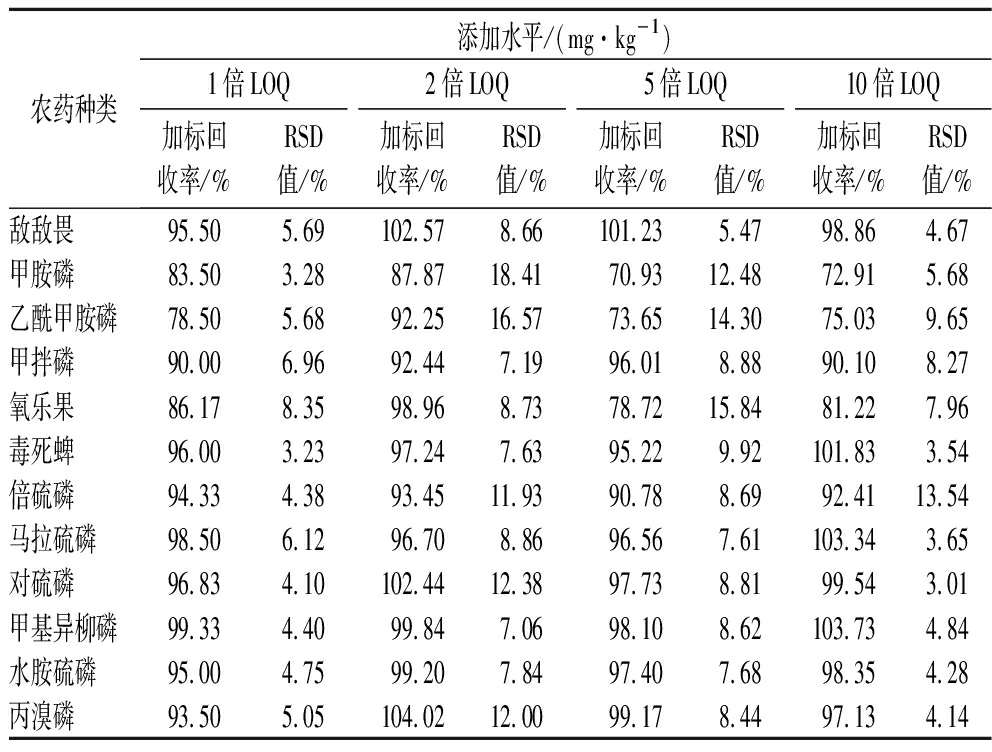
农药种类添加水平/(mg·kg-1)1倍LOQ2倍LOQ5倍LOQ10倍LOQ加标回收率/%RSD值/%加标回收率/%RSD值/%加标回收率/%RSD值/%加标回收率/%RSD值/%敌敌畏95.505.69102.578.66101.235.4798.864.67甲胺磷83.503.2887.8718.4170.9312.4872.915.68乙酰甲胺磷78.505.6892.2516.5773.6514.3075.039.65甲拌磷90.006.9692.447.1996.018.8890.108.27氧乐果86.178.3598.968.7378.7215.8481.227.96毒死蜱96.003.2397.247.6395.229.92101.833.54倍硫磷94.334.3893.4511.9390.788.6992.4113.54马拉硫磷98.506.1296.708.8696.567.61103.343.65对硫磷96.834.10102.4412.3897.738.8199.543.01甲基异柳磷99.334.4099.847.0698.108.62103.734.84水胺硫磷95.004.7599.207.8497.407.6898.354.28丙溴磷93.505.05104.0212.0099.178.4497.134.14
2.4 用加标回收率校正测定结果
通过SPSS 19.0软件单样本t检验分析得出均值、标准差、均值的标准误差值,如表3所示。运用t检验计算公式得出各种农药的t值,如表4所示。查双侧t值表,在自由度为5,置信概率95%时,t95(v)为2.57,比较t与t95(v)的大小。
由表5可知,12种农药的显著性检验-t检验结果显示加标回收率与1(即加标回收率为100%)存在显著性差异,检测结果需要用修正因子f进行校正,即ρ=ρ测×f,此不确定度分量纳入到测定结果的不确定度中去。
表3 单个样本统计量
Table 3 Single sample statistics

农药种类N均值标准差均值的标准误敌敌畏6101.228 35.520 442.253 71甲胺磷670.926 78.866 983.619 93乙酰甲胺磷673.651 710.528 044.298 05甲拌磷696.005 08.500 003.470 11氧乐果678.721 712.474 375.092 64毒死蜱695.220 09.432 543.850 82倍硫磷690.778 37.903 953.226 77马拉硫磷696.556 77.353 633.002 11对硫磷697.731 78.642 763.528 39甲基异柳磷698.100 08.498 953.469 68水胺硫磷697.401 77.491 763.058 50丙溴磷699.171 78.375 883.419 44
表4 单个样本t检验(检验值=0)
Table 4 Single sample t-test(taste value=0)
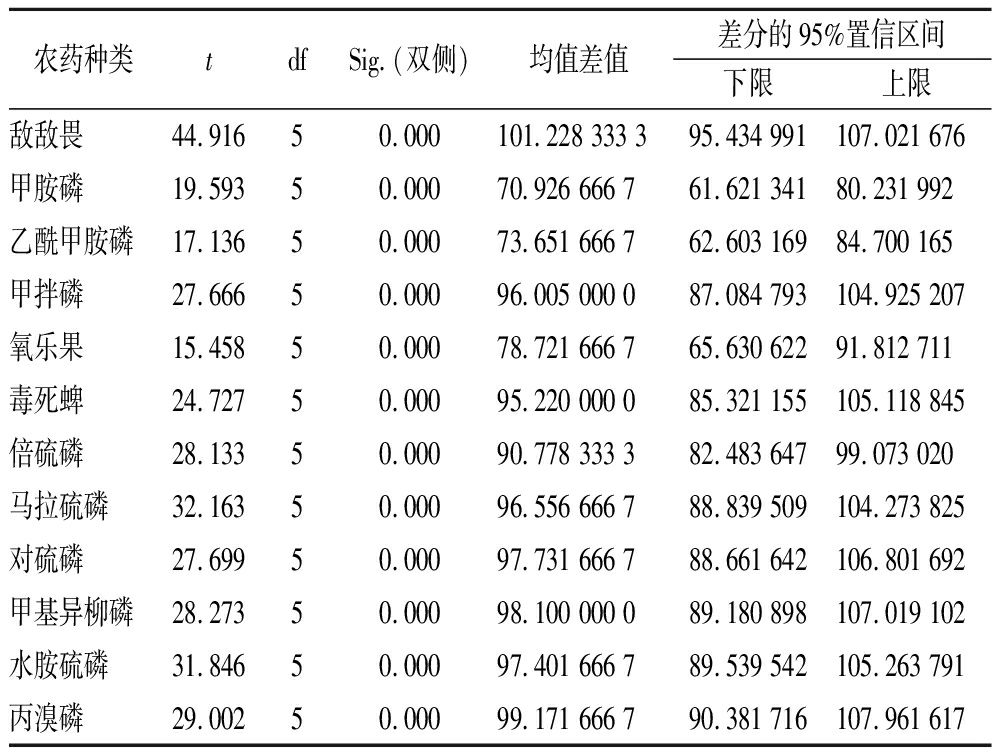
农药种类tdfSig.(双侧)均值差值差分的95%置信区间下限上限敌敌畏44.91650.000101.228 333 395.434 991107.021 676甲胺磷19.59350.00070.926 666 761.621 34180.231 992乙酰甲胺磷17.13650.00073.651 666 762.603 16984.700 165甲拌磷27.66650.00096.005 000 087.084 793104.925 207氧乐果15.45850.00078.721 666 765.630 62291.812 711毒死蜱24.72750.00095.220 000 085.321 155105.118 845倍硫磷28.13350.00090.778 333 382.483 64799.073 020马拉硫磷32.16350.00096.556 666 788.839 509104.273 825对硫磷27.69950.00097.731 666 788.661 642106.801 692甲基异柳磷28.27350.00098.100 000 089.180 898107.019 102水胺硫磷31.84650.00097.401 666 789.539 542105.263 791丙溴磷29.00250.00099.171 666 790.381 716107.961 617
2.5 农药残留检测过程中的基质效应
采用SPSS 19.0软件的聚类分析程序中组间联接聚类方法对15种蔬菜的12种农药色谱图的峰面积进行聚类分组,度量标准的区间为平方Euclidean距离,可输出农药系统聚类分析图[19],如图4所示。当临界值为5时,系统将12种农药分成3组,氧乐果受蔬菜基质效应影响最大,其次是乙酰甲胺磷,其他10种农药相对较小。在蔬菜农药残留检测中基质效应普遍存在,同一蔬菜品种不同农药品种基质效应差异显著[20],不同的农药种类可能会呈现出不同的基质效应,且基质效应的强弱与农药本身的化学属性有关。去除氧乐果和乙酰甲胺磷这两种基质干扰很大的农药,将其他10种农药进行聚类分析,度量标准的区间为平方Euclidean距离,可输出蔬菜系统聚类分析图,如图5所示。当临界值介于10~25时,系统将蔬菜大致分为3组,从结果来看,甜椒针对这些农药呈现基质减弱效应,其他蔬菜呈现强弱不一的基质效应。
表5 显著性t检验及修正因子f值
Table 5 Significance t-test and correction factor f
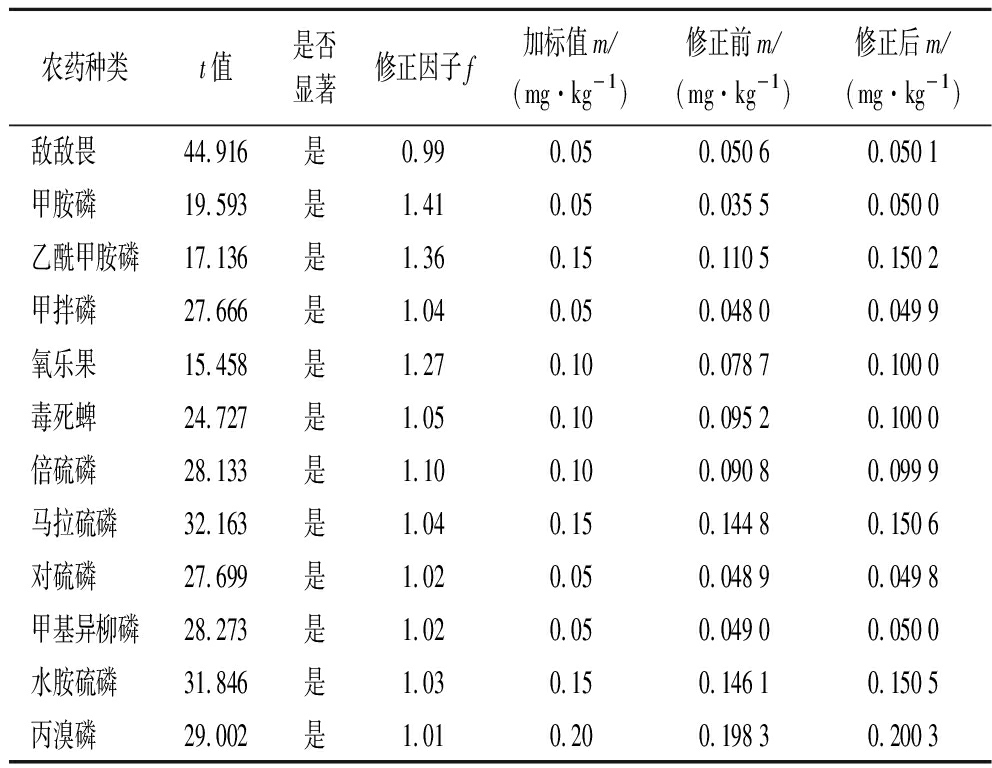
农药种类t值是否显著修正因子f加标值m/(mg·kg-1)修正前m/(mg·kg-1)修正后m/(mg·kg-1)敌敌畏44.916是0.990.050.050 60.050 1甲胺磷19.593是1.410.050.035 50.050 0乙酰甲胺磷17.136是1.360.150.110 50.150 2甲拌磷27.666是1.040.050.048 00.049 9氧乐果15.458是1.270.100.078 70.100 0毒死蜱24.727是1.050.100.095 20.100 0倍硫磷28.133是1.100.100.090 80.099 9马拉硫磷32.163是1.040.150.144 80.150 6对硫磷27.699是1.020.050.048 90.049 8甲基异柳磷28.273是1.020.050.049 00.050 0水胺硫磷31.846是1.030.150.146 10.150 5丙溴磷29.002是1.010.200.198 30.200 3

图4 农药系统聚类分析图
Fig.4 Pesticide system cluster analysis diagram

图5 蔬菜系统聚类分析图
Fig.5 Systematic cluster analysis diagram of vegetables
3 结论
(1)在苹果作为试验样品的条件下,此方法在检测12种农药时各种农药的加标回收率为70.93%~104.02%,相对标准偏差RSD为3.01%~18.41%,能够满足农药残留分析检测质量控制的要求。
(2)采用此方法对甲胺磷、乙酰甲胺磷、氧乐果进行定量检测时,检测结果受到干扰较大,在日常食品中农药残留检测过程中尤其需要注意在序列进样时控制样品的数量。
(3)在置信度为95%时,本试验所用农药的显著性检验结果显示加标回收率均与1(即加标回收率为100%)存在显著性差异,检测结果需要用修正因子f进行校正。该方法引入修正因子,为食用农产品的农药残留实践检测过程中如何运用加标回收率修正检测结果提供一定的理论参考价值。
(4)通过系统聚类的方法,根据基质效应的影响大小,将农药和蔬菜进行简单的分类,其中氧乐果受基质干扰最大,其次是乙酰甲胺磷,在日常食品中农药残留检测过程中可运用加标回收率对检测结果进行校准。
[1] 翟嘉华. 果汁中有机磷(毒死蜱)农药残留量的不确定度评估报告[J].食品安全导刊, 2020(25):64-66.
ZHAI J H.Uncertainty evaluation report of organophosphorus (chlorpyrifos) pesticide residues in fruit juice[J].China Food Safety Magazine, 2020(25):64-66.
[2] 魏巍, 张宝华.蔬菜中农药残留现状及其检测技术研究[J].江西农业, 2018(6):116-117.
WEI W, ZHANG B H.Study on the present situation and detection technology of pesticide residues in vegetables[J].Jiangxi Agriculture, 2018(6):116-117.
[3] 杭广林. 基质固相分散-气相色谱法测定苹果中的多种农药残留[J].河南农业, 2021(35):52-53.
HANG G L.Determination of pesticide residues in apples by matrix solid phase dispersion-gas chromatography[J].Agriculture of Henan, 2021(35):52-53.
[4] 骆瑜, 刘志斌, 王维亚, 等.食品农药残留检测中样品前处理技术研究进展[J].现代食品, 2019(19):127-129.
LUO Y, LIU Z B, WANG W Y, et al.Research progress of sample pretreatment technology in food pesticide residues detection[J].Modern Food, 2019(19):127-129.
[5] 王毓三. 基质效应[J].临床检验杂志, 2002, 20(U08):112-115;38.
WNAG Y S.Matrix effect[J].Journal of Clinical Laboratory Science, 2002, 20(U08):112-115;38.
[6] 蔡振辉. 基质效应对芹菜中17种有机磷农药残留检测的影响[J].农药科学与管理, 2021, 42(9):46-53.
CAI Z H.Matrix effect on determination of 17 organophosphorus pesticide residues in celery[J].Pesticide Science and Administration, 2021, 42(9):46-53.
[7] 金雅慧, 俞华芬, 殷燕, 等.基质效应对丝瓜中21种有机磷农药残留检测的影响[J].广西植保, 2022, 35(1):1-5.
JIN Y H, YU H F, YIN Y, et al.Influence of matrix effect on detection of 21 organophosphorus pesticide residues in Luffa[J].Guangxi Plant Protection, 2022, 35(1):1-5.
[8] 强生军, 刘玉荣, 李刚, 等.溶剂标、基质标对农药残留检测结果的影响及校正[J].中国农学通报, 2022, 38(4):99-106.
QIANG S J, LIU Y R, LI G, et al.Influence and correction of solvent standard and matrix standard on pesticide residue detection results[J].Chinese Agricultural Science Bulletin, 2022, 38(4):99-106.
[9] 周非凡. 蔬菜水果农药残留中基质效应的分析[J].食品安全导刊,2021(12):114-115.
ZHOU F F.Analysis of matrix effect in pesticide residues in vegetables and fruits[J].China Food Safety Magazine, 2021(12):114-115.
[10] 颜李秀, 黎良菊.基质效应在农药残留检测中的影响[J].乡村科技, 2020, 11(26):108-111.
YAN L X, LI L J.Influence of matrix effect on pesticide residue detection[J].Rural Science and Technology, 2020, 11(26):108-111.
[11] 吴晖, 朱珍, 风华亮, 等.蔬菜中11种有机磷农药残留的气相色谱检测及其对蔬菜基质的影响[J].食品科学, 2011, 32(6):198-203.
WU H, ZHU Z, FENG H L, et al.Determination of 11 organophosphorus pesticide residues in vegetables by gas chromatography and its effect on matrix[J].Food Science, 2011, 32(6):198-203.
[12] 尹戈, 范军, 史晓磊, 等.GC-MS/MS农药残留基质效应[J].环境化学, 2019, 38(9):2 162-2 165.
YIN G, FAN J, SHI X L, et al.Matrix effect on pesticides in vegetables by GC-MS/MS analysis[J].Environmental Chemistry, 2019, 38(9):2 162-2 165.
[13] 邬能英,黄安香,王忠伟, 等.气相色谱法测定食用林产品有机磷农药残留基质效应研究[J].农业与技术, 2022, 42(5):19-24.
WU N Y, HUANG A X, WANG Z W, et al.Study on matrix effect of determination of organophosphorus pesticide residues in edible forest products by gas chromatography[J].Agriculture and Technology, 2022, 42(5):19-24.
[14] 李建华, 吕伯龙, 刘晓兵, 等.蔬菜农药残留基质效应影响的检测质控试验研究[J].安徽农业科学, 2021, 49(6):193-196.
LI J H, LYU B L, LIU X B, et al.Experimental study on detection and quality control of matrix effect of pesticide residues in vegetables[J].Journal of Anhui Agricultural Sciences, 2021, 49(6):193-196.
[15] 魏滨, 于维森, 殷茂荣, 等.生活饮用水标准检验方法不确定度评定[M].北京:人民卫生出版社, 2015:55-56.
WEI B, YU W S, YIN M R, et al.Uncertainty Evaluation of Standard Test Methods for Drinking Water[M].Beijing:People′s Medical Publishing House, 2015:55-56.
[16] 王霞, 张维谊, 韩奕奕, 等.高效液相色谱法测定水果和蔬菜中维生素C含量的不确定度评定[J].食品与机械, 2021, 37(5):73-77.
WANG X, ZHANG W Y, HAN Y Y, et al.Uncertainty evaluation of the determination of vitamin C in fruits and vegetables by high performance liquid chromatography[J].Food &Machinery, 2021, 37(5):73-77.
[17] 田培, 金银银, 刘之炜, 等.气相色谱-质谱联用仪测定果蔬中农药残留的基质效应[J].浙江农业科学, 2022, 63(3):610-613:618.
TIAN P, JIN Y Y, LIU Z W, et al.Matrix effect of determination of pesticide residues in fruits and vegetables by gas chromatography-mass spectrometry[J].Journal of Zhejiang Agricultural Sciences, 2022, 63(3):610-613;618.
[18] 张洁, 王谢, 马青青, 等.QuEChERS结合磁性纳米材料前处理GC-MS/MS法同时检测蔬菜水果中28种农药残留[J].预防医学, 2021, 33(9):963-967.
ZHANG J, WANG X, MA Q Q, et al.Simultaneous determination of 28 pesticide residues in vegetables and fruits by QuEChERS combined with magnetic nano-materials pretreatment GC-MS/MS[J].Preventive Medicine, 2021, 33(9):963-967.
[19] 王丽丽, 王聪, 潘再法, 等.铁皮石斛的裂解气相色谱指纹图谱及其系统聚类分析[J].色谱, 2008, 26(5):613-617.
WANG L L, WANG C, PAN Z F, et al.Pyrolysis-gas chromatographic fingerprints with hierarchical cluster analysis for Dendrobium candidum Wall.ex Lindl[J].Chinese Journal of Chromatography, 2008, 26(5):613-617.
[20] 陈廷春, 林思思, 罗贵文, 等.不同蔬菜品种中基质效应对5种杀虫剂农药残留检测影响的对比试验[J].农业科技通讯, 2020(9):159-162.
CHEN T C, LIN S S, LUO G W, et al.Comparative experiment on the influence of matrix effect on the detection of pesticide residues of five pesticides in different vegetable varieties[J].Bulletin of Agricultural Science and Technology, 2020(9):159-162.