麦角硫因(ergothioneine, EGT)的学名为2-巯基-L-组氨酸三甲基内盐,是食用菌中最重要的生理活性物质之一,同时也广泛存在于各类动植物食品,存在硫醇硫酮共振结构(图1),仅由放线菌、蓝细菌以及某些真菌合成[1],而哺乳动物和人主要通过膳食获取。人体摄食EGT后会被高度吸收,且在组织中呈现差异性累积,这与转运蛋白OCTN1(organic cation transporter novel type-1,OCTN1)密切相关[2]。最近研究表明,EGT在预防糖尿病、肾脏疾病、组织纤维化、眼部疾病和癌症,抗紫外损伤,抗炎症,促进神经元分化,以及增强记忆力和学习能力等方面均有良好的应用前景[3-9]。此外,从20世纪末到现在,研究人员一直在探究将EGT用于各种用途的食品中[10-12]。欧洲食品安全局和美国食品药品监督管理局均肯定了EGT在新型功能食品中的重要地位,并且认可了通过发酵生产EGT的安全性,甚至认为可以将EGT添加到妊娠期妇女膳食和母婴食品中[13]。
论文综述了EGT的来源以及影响其生成量的因素,EGT的特殊生理活性,此外,还对EGT在食品工业中的应用进行了介绍。

图1 EGT的共振结构
Fig.1 Resonance structure of ergothioneine
1 EGT的来源
食用菌是EGT的主要来源之一,而其他一些食物如大蒜、豆类、麦麸皮和鸡蛋等中的含量远不及食用菌。真菌和部分酵母菌是合成EGT的主要微生物,尽管放线菌、蓝藻和其他甲基营养细菌也能合成EGT,但合成量相对较少[14]。其他植物则能够通过与土壤中真菌的共生关系从根部吸收EGT[15]。
1.1 EGT的食物来源
EGT是微生物的次级代谢产物,在合成过程中会受到前体物质、能量代谢和信号物质的调控。食用菌中的EGT来源于合成EGT的富集;而其他食物含有的EGT可能归因于环境中的真菌或细菌。
1.1.1 食用菌中的EGT
食用菌被称为健康食品或具有药用价值,原因之一是富含EGT这种有效的抗氧化剂,食用菌的EGT含量受到种类、营养物质供给和栽培环境等的影响。
(1)不同食用菌品种对EGT含量的影响
EGT的含量在不同食用菌品种之间变化很大,为0.02~7.27 mg/g干重。表1给出了不同食用菌的EGT的含量,牛肝菌的EGT含量(7.27 mg/g干重)明显高于其他食用菌,含量较多的还有紫丁香菇、平菇、姬菇、金顶侧耳、鸡油菇等,均大于3 mg/g干重。
表1 不同食用菌中的EGT含量
Table 1 Contents of EGT in different edible fungi

序号品种部位含量/(mg·g-1干重)参考文献1杏鲍菇(Pleurotus eryngii)子实体0.78~1.41[16, 17]菌丝 0.03[18]2香菇(Lentinula edodes)子实体0.60~1.32[16, 19, 20]3紫丁香菇(Lepista nuda)子实体5.54[21]4豹皮新香菇 (Neolentinus lepideus)子实体2.41[21]5灰树花(Ramalina maitake)子实体0.67~1.31[16, 17, 19]6平菇(Pleutotus ostreatus)子实体0.20~3.78[16, 17, 20, 21]菌丝 0.71[22]7姬菇(Pleurotus cornucopiae)子实体3.50[16]菌丝 0.03[18]8茶树菇(Agrocybe aegerita)子实体0.24~1.29[16, 17]9牛肝菌(Boletus edulis)子实体1.09~7.27[16, 17]10双孢蘑菇(Agaricus bisporus)子实体0.41~1.21[17, 19]12金顶侧耳(Pleurotus citrinopileatus)子实体3.94[19]菌丝 1.30[22]13灵芝(Ganoderma lucidum)子实体0.06~0.56[17, 19]14猴头菇(Hericium erinaceus)子实体0.53~1.12[17, 19, 21]15松茸(Tricholoma matsutake)子实体0.74~2.56[17, 19]16鸡油菇(Cantharellus cibarius)子实体0.2~4.09[17, 19]17羊肚菌(Morchella esculenta)子实体0.47[19]18金针菇(Flammulina velutipes)子实体1.86~2.00[21, 23]19淡红侧耳(P.djamor)菌丝 0.03~0.71[18, 22]20鸡腿菇(Coprinus comatus)菌盖 1.61[21]菌柄 0.76[21]
(2)食用菌不同部分对EGT含量的影响
在大部分被检测到的蘑菇中观察到2种趋势:菌丝的EGT含量小于子实体;菌柄的含量小于菌盖。表1中杏鲍菇、平菇、姬菇等的菌丝EGT含量均小于子实体,这可能是因为真菌孢子而不是菌丝体具有合成EGT的能力[15]。表1还显示出,鸡腿菇菌柄EGT含量小于菌盖,在KALARAS等[19]的研究中发现了相同的趋势,如图2所示,菌柄的EGT含量显著低于菌盖。这一趋势的一个可能的解释是,菌盖组织是大多数新陈代谢和生殖过程发生的地方,而不是菌柄[19]。综上所述,EGT在蘑菇不同部位含量还需要进一步的研究,可能是品种、非生物胁迫和代谢所共同决定的。
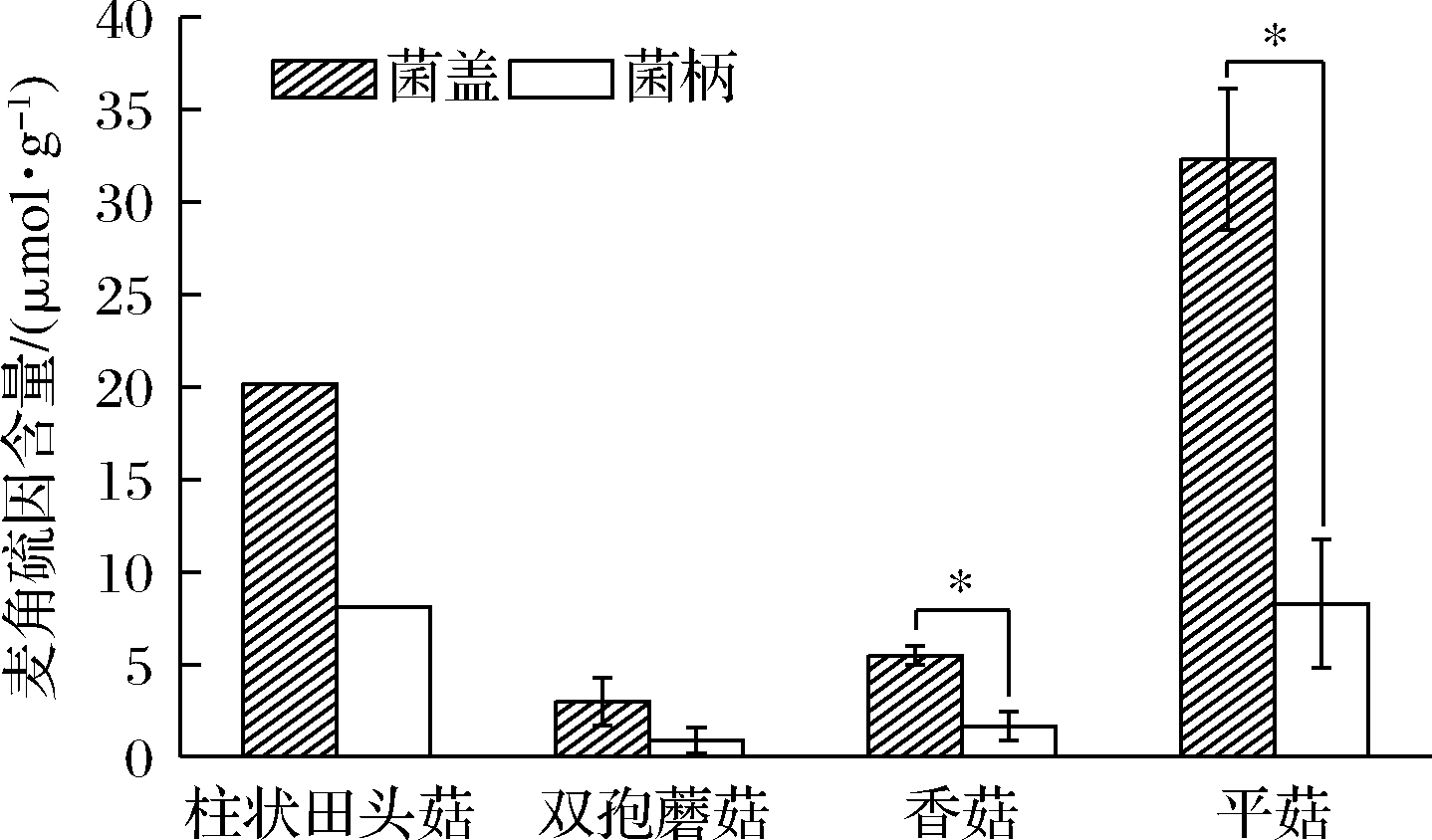
图2 蘑菇不同部位EGT含量的差异[19]
Fig.2 Difference of EGT content in different parts of mushroom[19]
注:*表示菌柄和菌盖之间存在显著性差异(P<0.05)
(3)不同栽培条件对EGT含量的影响
同一种食用菌的EGT含量也常存在差异,因为食用菌的培养基质类型和营养成分以及压力因素都对EGT的累积有着重要影响[19]。CHILANTI等[24]评估了9种侧耳属蘑菇在松木屑、葡萄废料和咖啡渣3种不同培养基中EGT的累积量,发现在葡萄废料培养基和咖啡渣培养基生长的担子组中获得了更高浓度的EGT。DUBOST等[25]使用不同营养成分的堆肥对双孢菇进行培养,发现深袋堆肥中添加组氨酸可以显著增加EGT量;KALARAS等[19]研究发现,与1个冲洗周期相比,3个冲洗周期后收获的双孢蘑菇EGT含量显著增加,这可能源于冲洗后堆肥养分耗尽、废物堆积和堆肥中可用水减少引发的压力因素。
1.1.2 其他食物中的EGT
果蔬、谷物、坚果和奶豆类等(表2)大多数日常膳食不含或只含有微量的EGT,其浓度不仅在不同食物间差异巨大,而且在特定食物组内也表现出很高的变异性。例如,在豆制品中,大豆发酵食品含量较高而豆腐和豆奶含量较少,甚至因为芦笋的产地不同,EGT含量产生了巨大的差异,这是因为芦笋本身是不产生EGT的,而是由于这些植物与土壤真菌或细菌存在的共生关系而累积了EGT,这反映了环境中的微生态对植食性食物功能成分的影响。
表2 不同食物中的EGT含量
Table 2 EGT content in different foods

类别食物名称含量/(μg·g-1干重)参考文献西蓝花0.18~0.38[15, 26]洋葱0.13~0.34[15]芦笋(马来西亚)0.57[26]果蔬芦笋(泰国)10.24[26]芦笋(墨西哥)163.25[26]白芦笋18.2[26]菠菜0.06~0.14[15]罗勒叶4.92[26]玉米1.68~2.46[27]开心果1.9[26]芸豆2.09[26]谷物、坚果、香料燕麦1.84~8.53[15, 27]麦麸0.74~0.98[15]小麦胚芽0.46~0.85[15]全麦面包0.44~0.58[15]糙米0.04[26]发酵米30.94~80.2[28]大豆1.61~2.47[27]大豆发酵食品201.13[26]蛋黄0.62~0.74[15]蛋、奶、豆类蛋白0.33~0.41[15]豆奶2.31[26]鲜奶0.25[26]猪肝8.06~9.84[15]肉类猪里脊1.54~1.82[15]鸡胸肉1.02~1.24[15]海鲜类鲑鱼0.05~0.07[15]其它海产品ND[15]
注:ND表示未检出
1.2 微生物合成EGT
SEEBECK[29]在分枝杆菌中确定了合成EGT的基因簇,该基因簇编码了合成EGT的5种酶,将其命名为EgtA, B, C, D, E,并验证了5种酶的功能(表3)。图2为耻垢分枝杆菌中EGT的合成过程,整个合成过程包含了5个步骤。在添加EGT合成前体物质或饥饿应激条件下可以提高微生物的EGT产量。如裂殖酵母(Schizosaccharomyces pombe)营养细胞、氮饥饿细胞、葡萄糖饥饿细胞和egt1+(融合蛋白酶,具有EgtD和EgtB活性,用于真菌合成EGT)过表达细胞中的EGT含量分别为0.3 mmol/L、157.4 mmol/L、41.6 mmol/L和1 606.3 mmol/L[30]。此外,OSAWA等[31]用分枝杆菌EGT合成酶在大肠杆菌中异源表达时发现,添加L-蛋氨酸、L-组氨酸和硫代硫酸盐的培养基中可以显著提高EGT的产量。因此,利用应激条件和增加前体物质等方法能够大大增加EGT的产量。
表3 分枝杆菌中的EGT合成酶
Table 3 EGT synthase in Mycobacteria

现名称原名称作用EgtAγ-谷氨酰半胱氨酸合成酶合成 γ-谷氨酰半胱氨酸EgtB非血红素铁酶合成中间体亚砜EgtC谷氨酰胺转移酶脱谷氨酰基EgtDα-N-甲基转移酶使组氨酸甲基化EgtE吡哆醛依赖性β-裂合酶裂解C—S键

图3 耻垢分枝杆菌中EGT的合成
Fig.3 Synthesis of ergothioneine from Mycobacterium smegmatis
2 EGT的生物活性
EGT是一种极强的天然抗氧化剂,氧化为赫西宁和硫酸盐可能是还原当量的丰富来源,涉及6个电子不可逆地转移给细胞内的氧化剂[32]。它的还原电势为-60 mV,而其他抗氧化剂的还原电势在-200~-320 mV[33],因此EGT在生理条件下十分稳定。EGT较强的金属离子结合能力防止了金属诱导的氧化损伤、DNA损伤和脂质过氧化等[34]。除此之外,EGT还可以显著抑制炎性因子基因表达,增强免疫细胞的活性[35]。
2.1 EGT的基本抗氧化作用
EGT被称为强抗氧化剂,是因为在体内,EGT发挥着清除活性氧簇(reactive oxygen/nitrogen species, ROS/RNS)、螯合金属离子(Cu2+、Fe2+)和抗炎作用[35]。据报道,EGT提供的还原力远高于其他抗氧化剂,它比谷胱甘肽(glutathione, GSH)能够更好地清除过氧亚硝酸盐(ONOO-),与单线态氧(1O2)[36]、羟基自由基(·OH)的反应几乎是瞬间发生,而与过氧化氢(H2O2)和超氧阴离子自由基![]() 的反应速度则较慢[37]。线粒体是产生机体绝大多数ROS的细胞器,EGT能够保护线粒体DNA和其他成分免受炎症产生ROS造成的损害,维持线粒体的正常功能[38]。EGT不仅可以直接清除ROS,更重要的是可以络合二价金属离子,使其不能与H2O2发生类似芬顿反应而产生大量ROS和自由基。
的反应速度则较慢[37]。线粒体是产生机体绝大多数ROS的细胞器,EGT能够保护线粒体DNA和其他成分免受炎症产生ROS造成的损害,维持线粒体的正常功能[38]。EGT不仅可以直接清除ROS,更重要的是可以络合二价金属离子,使其不能与H2O2发生类似芬顿反应而产生大量ROS和自由基。
2.2 EGT的“适应性抗氧化”
EGT的“适应性抗氧化”能力与其抗自氧化能力和OCTN1的基因多态性相关。哺乳动物和植物虽不能合成EGT,但EGT会在几乎所有细胞和组织中积累,它的摄取主要依靠OCTN1(图4-a)[2]。EGT在体内的分布归因于OCTN1基因SLC22A4基因的差异性表达,它会优先在暴露于氧化应激和损伤的细胞和组织中积累[4](图4-b)。此外,该基因在氧化胁迫较高的部位异常活跃,例如组织损伤、肾纤维化、心肌梗死和先兆子痫患者的OCTN1活性增加,EGT累积到相应的部位阻止进一步的伤害[4, 8],这种独特性质使EGT被誉为“适应性抗氧化剂”。这是EGT的一个有用的特性:使它在发挥抗氧化作用的过程中,不干扰ROS/RNS在健康组织中的正常作用。

a-OCTN1介导的转运过程;b-OCTN1基因在人体不同组织的表达量,柱长短表示表达量大小
图4 EGT的转运及程序性分布
Fig.4 Transport and programmed distribution of EGT
2.3 EGT的抗炎作用
EGT对于胁迫条件诱导的炎症反应具有很强的调节作用。中波紫外线(ultraviolet B, UVB)辐射角质形成细胞会释放促炎细胞因子和趋化因子,并导致皮肤光老化,包括出现皱纹、变得粗糙和过度色素沉着[3]。EGT预处理角质形成细胞可显著抑制UVB诱导的Nrf2/HO-1通路和热休克蛋白70(heat shock proteins 70, HSP70)的下调,并通过抑制ROS的产生和半胱天冬蛋白酶caspase-8、DNA修复酶PARP等促凋亡蛋白的裂解来保护角质形成细胞[5]。在心血管疾病和糖尿病患者中,EGT对7-酮胆固醇(7-ketocholesterol, 7KC)诱导的促炎因子包括白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)和环氧合酶-2(COX-2)等的表达量的增加有显著的抑制作用[6],从而预防炎症的产生。
2.4 EGT的免疫调节作用
人体的主要免疫细胞是中性粒细胞(白细胞的一种)。中性粒细胞氧化爆发时会产生大量ROS,在产生ROS的细胞中可以检测到EGT的二硫化物(ergothioneine disulphide, ESSE)[39],这说明EGT可能作为抗氧化剂来清除ROS从而减少免疫过程中发生的细胞损伤,维持免疫细胞的正常功能。YOSHIDA等[7]研究了EGT的免疫增强特性,发现它是骨髓来源巨噬细胞Toll样受体蛋白(Toll-like receptors, TLR)信号的增强剂,能够激活巨噬细胞产生细胞因子TNF-α、IL-6、IL-1β和白介素-12p40(IL-12p40),并产生极化作用,对感染细胞有直接杀伤作用。EGT还可以增强机体对癌细胞的免疫作用,它可以增加神经标记物免疫阳性细胞数,减少星形胶质细胞标记物胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)的阳性细胞数,并伴随神经元分化激活基因Math1的上调,从而抑制癌细胞的增殖[9]。
2.5 EGT的其他生理作用
除了上述功能,EGT在调节细胞生长、分化,平衡体内能量代谢,维持细胞氧化还原稳态和延缓细胞衰老等方面也具有一定的生理作用。SAMUEL等[40]研究发现EGT在氧化应激条件下通过降低端粒缩短率和保持端粒长度而在保持健康和抗衰老中具有潜在作用。ZHAO等[41]首次报道了EGT和霉菌硫巯(mycothiol, MSH)这2种细菌硫醇在林可霉素A生物合成中的建设性作用,为EGT相关的生化过程和知之甚少的生物转化提供了第一个范例。
3 EGT在食品工业中的应用
食品工业中常用的与人类健康相关的天然抗氧化剂主要有生育酚、维生素C、类胡萝卜素和酚类化合物。但是这些传统的天然抗氧化剂存在一定的缺陷,例如维生素C在食品加工过程中极易被分解,而酚类化合物容易与蛋白质发生相互作用而变得难以被消化吸收或产生促氧化的醌类物质[42]。EGT作为一种新型的天然抗氧化活性成分克服了这些缺点,它强大的抗氧化特性促使研究人员开始探索其在食品和非食品中的新应用[26]。食用菌是EGT的极好来源,可能是控制食品腐败变质的重要候选者。食用菌提取物具有防止海鲜类食品发生黑变,肉类食品肌红蛋白氧化、脂质过氧化,以及防止食品中的多酚类物质分解等功能,能够保持食品的感官品质和延长食品的货架期。并且动物实验和细胞实验表明,即使在高剂量情况下,EGT也不会造成任何不良的临床病理、组织病理学变化和细胞毒性[43]。
3.1 EGT的护色作用
食品的颜色变化与羰氨反应、氧化反应和酶促反应等相关,食用菌提取物中的EGT是一种强有力的抗氧化剂,不仅可以控制肉类中脂质的氧化,还可以控制肌红蛋白的氧化,从而延缓肉类在低温贮存过程中的变色[44]。在肉类食品中,脂质和胺氧化产生醛而发生非酶褐变是造成颜色和品质的变化的重要原因之一[45]。在低温保存过程中,由于脂肪的氧化,肉类食品会形成一种深色,随后的反应在冷冻条件下继续进行,使品质发生进一步劣变[11]。鲶鱼肌肉中积累的EGT显示了对脂质氧化过程的抑制效果,并延缓了颜色的变化[11]。用含EGT的金针菇提取物浸泡活蟹能有效地抑制中华绒螯蟹黑变,降低酚氧化酶活性和酚氧化酶原基因的表达[12]。
3.2 EGT的抗脂质过氧化作用
脂质过氧化会让食品产生不愉快的气味,并且生成有害人体健康的物质,其产生的原因可以归结为1O2的产生以及自由基链式反应的发展,它们会引发一系列具有高氧化活性的物质,进而造成脂质的进一步氧化。EGT能够猝灭1O2和自由基,分解次氯酸和抑制血红素化合物生成,从而抑制过氧化物引起的脂质过氧化反应,可作为加工肉制品中良好的抗氧化剂[39]。BAO等[44]发现在鱼肉和牛肉中加入10%富含EGT的金针菇提取物,其总脂质过氧化氢和硫代巴比妥酸活性物含量减少,脂质氧化水平降低,货架期延长。
3.3 EGT对其他生物活性成分的保护作用
EGT在正常生理条件下,具有抗氧化作用,与其他生物活性成分共存时,还可以作为它们的保护剂,使自己被氧化分解。PAHILA等[23]在研究鲑鱼肌中虾青素稳定性时发现,金针菇提取物在延缓虾青素降解速率方面效果显著。靳祯亮等[46]在4 ℃条件下考察了不同浓度(0.03, 0.06, 0.12 mmol/L)外源ETG喷洒处理对采后双孢菇品质的影响,结果表明,在贮藏过程中,EGT处理组的抗坏血酸和多酚分解速度显著低于对照组,且EGT的喷洒浓度越高,延缓抗坏血酸和多酚降解的效果越好。SOHN等[47]将金针菇边角料作为鸡的膳食补充剂,发现鸡蛋中累积了EGT,蛋黄中磷脂含量显著增加,残留氧显著降低,这大大提高了鸡蛋的营养价值,并延缓了营养物质的分解。
3.4 EGT对食品的保鲜作用
由于EGT的抗氧化、护色作用,对脂质膜和细胞结构的保护作用以及对食品中其他活性成分的保护作用,使其在食品保鲜和延长食品贮藏期方面有很好的效果。吕华等[48]使用了低浓度和高浓度富含EGT的针金菇提取物浸泡冰藏的南美白对虾,发现金针菇提取物浸泡可以抑制贮藏过程中南美白对虾的黑变、腐败变质、脂质过氧化和菌落生长,达到了保鲜和延长贮藏期的作用,且在所有考察的指标中,高剂量处理组的抑制作用优于低剂量组。陶冶等[49]在猪肉糜中直接添加富含EGT的金针菇提取物,结果表明金针菇提取物的添加可以减缓猪肉糜的脂肪氧化和蛋白质氧化提高猪肉糜的新鲜度和感官品质。
4 结论与展望
EGT是一种天然抗氧化活性物质,主要来源于食用菌和微生物发酵。EGT具有抗氧化、螯合金属离子、抗炎和提高免疫等作用,作为一种“适应性的抗氧化剂”,具有优先分布在氧化损伤较重的部位,而不影响正常活性氧功能的特性,有着极强的药用价值。除了上述生理作用,作为一种小分子硫巯,EGT发挥功能的其他机制正在被探索中。此外,EGT在食品工业中具有护色、抗脂质氧化和保护生物活性成分等作用,它的安全性也得到了欧洲食品安全局和美国食品药品监督管理局的认可,并被批准作为天然防腐剂在食品当中使用。因此,今后围绕EGT的研究可以从以下几个方面来进一步开展。首先,通过优化食用菌的栽培环境和微生物的培养方式提高EGT的产量;其次,继续开展EGT与酶相关反应的探索,从而推动其生理功能的挖掘和作用机制的进一步解析;最后,EGT作为一个潜在的功能性防腐剂,在食品中具有广阔的应用前景,因此可以探究它在食品保藏中发挥的作用,以及与食品组分的相互作用,使其更好地应用于食品工业。
[1] KHONDE P L, JARDINE A.Improved synthesis of the super antioxidant, ergothioneine, and its biosynthetic pathway intermediates[J].Organic &Biomolecular Chemistry, 2015, 13(5):1 415-1 419.
[2] GRÜNDEMANN D, HARLFINGER S, GOLZ S, et al.Discovery of the ergothioneine transporter[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(14):5 256-5 261.
[3] WU R R, ZHANG H C, ZHAO M X, et al.Nrf2 in keratinocytes protects against skin fibrosis via regulating epidermal lesion and inflammatory response[J].Biochemical Pharmacology, 2020, 174:113846.
[4] MAKIISHI S, FURUICHI K, YAMAMURA Y, et al.Carnitine/organic cation transporter 1 precipitates the progression of interstitial fibrosis through oxidative stress in diabetic nephropathy in mice[J].Scientific Reports, 2021, 11(1):9093.
[5] KO H J, KIM J, AHN M, et al.Ergothioneine alleviates senescence of fibroblasts induced by UVB damage of keratinocytes via activation of the Nrf2/HO-1 pathway and HSP70 in keratinocytes[J].Experimental Cell Research, 2021, 400(1):112516.
[6] KOH S S, OOI S C Y, LUI N M Y, et al.Effect of ergothioneine on 7-ketocholesterol-induced endothelial injury[J].NeuroMolecular Medicine, 2021, 23(1):184-198.
[7] YOSHIDA S, SHIME H, FUNAMI K, et al.The anti-oxidant ergothioneine augments the immunomodulatory function of TLR agonists by direct action on macrophages[J].PLoS One, 2017, 12(1):e0169360.
[8] VALACHOVA K, SVIK K, BIRO C, et al.Impact of ergothioneine, hercynine, and histidine on oxidative degradation of hyaluronan and wound healing[J].Polymers, 2020, 13(1):95.
[9] ISHIMOTO T, NAKAMICHI N, HOSOTANI H, et al.Organic cation transporter-mediated ergothioneine uptake in mouse neural progenitor cells suppresses proliferation and promotes differentiation into neurons[J].PLoS One, 2017, 9(2):e89434.
[10] TAO Y, XIAO S, CAI J M, et al.Effects of ergothioneine-enriched mushroom extract on oxidative stability, volatile compounds and sensory quality of emulsified sausage[J].Animal Bioscience, 2021, 34(10):1 695-1 704.
[11] HA N C, HIEP L T M, T AN L V, et al.Ergothioneine accumulated in the catfish muscle by supplementation of Flammulina velutipes extract prevents lipid oxidation, improves color stability, and limits soft structure of the fillet during frozen storage[J].Journal of Food Processing and Preservation, 2021, 45(4):e15340.
AN L V, et al.Ergothioneine accumulated in the catfish muscle by supplementation of Flammulina velutipes extract prevents lipid oxidation, improves color stability, and limits soft structure of the fillet during frozen storage[J].Journal of Food Processing and Preservation, 2021, 45(4):e15340.
[12] ENCARNACION A B, FAGUTAO F, SHOZEN K I, et al.Biochemical intervention of ergothioneine-rich edible mushroom (Flammulina velutipes) extract inhibits melanosis in crab (Chionoecetes japonicus)[J].Food Chemistry, 2011, 127(4):1 594-1 599.
[13] TURCK D, BRESSON J, BURLINGAME B, et al.Statement on the safety of synthetic L-ergothioneine as a novel food - supplementary dietary exposure and safety assessment for infants and young children, pregnant and breastfeeding women[J].EFSA Journal, 2017, 15(11):5060.
[14] BORODINA I, KENNY L C, MCCARTHY C M, et al.The biology of ergothioneine, an antioxidant nutraceutical[J].Nutrition Research Reviews, 2020, 33(2):190-217.
[15] EY J, SCHÖMIG E, TAUBERT D.Dietary sources and antioxidant effects of ergothioneine[J].Journal of Agricultural and Food Chemistry, 2007, 55(16):6 466-6 474.
[16] HAN Y W, TANG X Y, ZHANG Y T, et al.The current status of biotechnological production and the application of a novel antioxidant ergothioneine[J].Critical Reviews in Biotechnology, 2021, 41(4):580-593.
[17] MARTINEZ-MEDINA G A, CHáVEZ-GONZáLEZ M L, VERMA D K, et al.Bio-funcional components in mushrooms, a health opportunity:Ergothionine and huitlacohe as recent trends[J].Journal of Functional Foods, 2021, 77:104326.
[18] 殷朝敏, 范秀芝, 刘纯友, 等.12株侧耳属食用菌菌丝中主要营养成分分析[J].核农学报, 2019, 33(1):96-102.
YIN C M, FAN X Z, LIU C Y, et al.Analysis of the main nutrient components in the mycelia of 12 Pleurotus mushroom[J].Journal of Nuclear Agricultural Sciences, 2019, 33(1):96-102.
[19] KALARAS M D, RICHIE J P, CALCAGNOTTO A, et al.Mushrooms:A rich source of the antioxidants ergothioneine and glutathione[J].Food Chemistry, 2017, 233:429-433.
[20] WOLDEGIORGIS A Z, ABATE D, HAKI G D, et al.Antioxidant property of edible mushrooms collected from Ethiopia[J].Food Chemistry, 2014, 157:30-36.
[21] 张翠, 赵艳敏, 白淑芳, 等.HPLC法测定不同品种蘑菇中麦角硫因的含量[J].食品工业科技, 2013, 34(23):307-310.
ZHANG C, ZHAO Y M, BAI S F, et al.HPLC determination of ergothioneine in mushrooms of different species[J].Science and Technology of Food Industry, 2013, 34(23):307-310.
[22] KRAKOWSKA A, ZIE,BA P, W ODARCZYK A, et al.Selected edible medicinal mushrooms from Pleurotus genus as an answer for human civilization diseases[J].Food Chemistry, 2020, 327:127084.
ODARCZYK A, et al.Selected edible medicinal mushrooms from Pleurotus genus as an answer for human civilization diseases[J].Food Chemistry, 2020, 327:127084.
[23] PAHILA J, KANEDA H, NAGASAKA R, et al.Effects of ergothioneine-rich mushroom extracts on lipid oxidation and discoloration in salmon muscle stored at low temperatures[J].Food Chemistry, 2017, 233:273-281.
[24] CHILANTI G, DA ROSA L O, POLETO L, et al.Effect of different substrates on Pleurotus spp.cultivation in Brazil—Ergothioneine and lovastatin[J].Journal of Food Composition and Analysis, 2022, 107:104367.
[25] DUBOST N J, BEELMAN R, ROYSE D.Influence of selected cultural factors and postharvest storage on ergothioneine content of common button mushroom Agaricusbisporus (J.Lge) imbach (Agaricomycetideae)[J].International Journal of Medicinal Mushrooms, 2007, 9:163-176.
[26] HALLIWELL B, CHEAH I K, TANG R M Y.Ergothioneine—A diet-derived antioxidant with therapeutic potential[J].Febs Letters, 2018, 592(20):3 357-3 366.
[27] BEELMAN R B, RICHIE J P, PHILLIPS A T, et al.Soil disturbance impact on crop ergothioneine content connects soil and human health[J].Agronomy, 2021, 11(11):2278.
[28] HORIE Y, GOTO A, IMAMURA R, et al.Quantification of ergothioneine in Aspergillus oryzae-fermented rice bran by a newly-developed LC/ESI-MS/MS method[J].LWT -Food Science and Technology, 2020, 118:108812.
[29] SEEBECK F P.In vitro reconstitution of mycobacterial ergothioneine biosynthesis[J].Journal of the American Chemical Society, 2010, 132(19):6 632-6 633.
[30] PLUSKAL T, UENO M, YANAGIDA M.Genetic and metabolomic dissection of the ergothioneine and selenoneine biosynthetic pathway in the fission yeast, S.pombe, and construction of an overproduction system[J].PLoS One, 2014, 9(5):e97774.
[31] OSAWA R, KAMIDE T, SATOH Y, et al.Heterologous and high production of ergothioneine in Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2018, 66(5):1 191-1 196.
[32] SERVILLO L, CASTALDO D, CASALE R, et al.An uncommon redox behavior sheds light on the cellular antioxidant properties of ergothioneine[J].Free Radical Biology and Medicine, 2015, 79:228-236.
[33] JOCELYN P C.Biochemistry of the SH Group the Occurrence, Chemical Properties, Metabolism and Biological Function of Thiols and Disulphides[M].London:Academic Press, 1972.
[34] 朱本占, 毛莉, 范瑞梅, 等.天然抗氧化剂麦角硫因保护铜所致DNA和蛋白质氧化损伤的作用机理[J].科学通报, 2011, 56(27):2 283-2 288.
ZHU B Z, MAO L, FAN R M, et al.Mechanism of protection by natural antioxidant ergothioneine against copper-induced oxidative damage to DNA and protein[J].Chinese Science Bulletin, 2011, 56(27):2 283-2 288.
[35] 李轶群, 周念波.麦角硫因的生物学功能及其应用[J].食品工程, 2010(3):26-28.
LI Y Q, ZHOU N B.Ergothioneine biological function and major applications[J].Food Engineering, 2010(3):26-28.
[36] ROUGEE M, BENSASSON R V, LAND E J, et al.Deactivation of singlet molecular oxygen by thiols and related compounds, possible protectors against skin photosensitivity[J].Photochemistry and Photobiology, 1988, 47(4):485-489.
[37] FAHEY R C.Novel thiols of prokaryotes[J].Annual Review of Microbiology, 2001, 55(1):333-356.
[38] PAUL B D, SNYDER S H.The unusual amino acid L-ergothioneine is a physiologic cytoprotectant[J].Cell Death and Differentiation, 2010, 17(7):1 134-1 140.
[39] CUMMING B M, CHINTA K C, REDDY V P, et al.Role of ergothioneine in microbial physiology and pathogenesis[J].Antioxidants &Redox Signaling, 2018, 28(6):431-444.
[40] SAMUEL P, TSAPEKOS M, DE PEDRO N, et al.Ergothioneine mitigates telomere shortening under oxidative stress conditions[J].Journal of Dietary Supplements, 2022, 19(2):212-225.
[41] ZHAO Q F, WANG M, XU D X, et al.Metabolic coupling of two small-molecule thiols programs the biosynthesis of lincomycin A[J].Nature, 2015, 518(7537):115-119.
[42] CIRKOVIC VELICKOVIC T D, STANIC-VUCINIC D J.The role of dietary phenolic compounds in protein digestion and processing technologies to improve their antinutritive properties[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(1):82-103.
[43] MARONE P A, TRAMPOTA J, WEISMAN S.A safety evaluation of a nature-identical L-ergothioneine in spraguedawley rats[J].International Journal of Toxicology, 2016, 35(5):568-583.
[44] BAO H N D, USHIO H, OHSHIMA T.Antioxidative activity and antidiscoloration efficacy of ergothioneine in mushroom (Flammulina velutipes) extract added to beef and fish meats[J].Journal of Agricultural and Food Chemistry, 2008, 56(21):10 032-10 040.
[45] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al.The effect of antioxidants on the quality changes of cuttlefish (Sepia pharaonis) muscle during frozen storage[J].LWT-Food Science and Technology, 2008, 41(1):161-169.
[46] 靳祯亮, 黄琦辉, 周巧丽, 等.麦角硫因处理对采后双孢蘑菇品质的影响[J].中国食品学报, 2017, 17(3):194-200.
JIN Z L, HUANG Q H, ZHOU Q L, et al.Effect of ergothioneine treatment on main quality of postharvest Agaricus bisporu[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(3):194-200.
[47] SOHN J, SAGARA Y, OHSHIMA T.Effects of dietary supplemaentation by hydrophilic extract from edible mashroom (Flammulina velutipes) to laying hens on oxidative stability of hen eggs[C].61 st International Congress of Meat Science and Technology.France:Clermont-Ferrand, 2015.
[48] 吕华, 余成龙, 袁高峰.金针菇提取物对冰藏南美白对虾保鲜作用研究[J].食品科技, 2014, 39(11):147-150.
LYU H, YU C L, YUAN G F.Effect of Flammulina extract on pacific white shrimp(Litopenaeus vannamei) during iced storage[J].Food Science and Technology, 2014, 39(11):147-150.
[49] 陶冶, 肖珊, 蔡嘉铭, 等.富含麦角硫因的金针菇提取物对冷冻猪肉糜品质的影响[J].食品工业科技, 2021, 42(9):306-312.
TAO Y, XIAO S, CAI J M, et al.Effect of Flammulina velutipes extract rich in ergothioneine on the quality of frozen pork patties[J].Science and Technology of Food Industry, 2021, 42(9):306-312.