蛋白质二级结构是多肽链通过氢键连接盘旋而形成的结构,包括α-螺旋、β-折叠、β-转角和无规则卷曲4种结构,其中前两者为规则有序结构,后两者相较于前两者表现得更加无序[1-2]。当蛋白质受到外界条件影响时,蛋白质二级结构会发生一定程度的改变,从而导致其功能特性发生变化,如凝胶性、持水能力、溶解性、乳化性和流变性等,因此研究蛋白质二级结构的变化,有助于预测蛋白的功能特性,进而了解原料的加工特性。
目前国内外研究蛋白质二级结构的方法有傅里叶红外光谱法、拉曼光谱法、X-射线衍射法、圆二色谱法以及核磁共振法,其中傅里叶红外光谱法和拉曼光谱法是最常用的方法[3-5]。本文将从定义、原理、测定方法、优缺点、应用等方面分别对这2种测定方法进行介绍和对比。
1 傅里叶红外光谱法测定蛋白质二级结构
1.1 傅里叶红外光谱法的定义及原理
傅里叶红外光谱法是将傅里叶变换和红外光谱相结合的方法。其测定原理是:分子由原子组成,原子以一定的频率振动,若一束红外光照射在样品上,原子吸收光子能量发生跃迁,即入射光的光子能量刚好满足2个振动能级之差(ΔE=E1-E2),这些变化产生在得到的干涉图上,利用傅里叶变换技术,得到红外光谱。通过红外光谱可鉴定化学物质的官能团、检测物质的纯度、测定蛋白质的二级结构等[6]。傅里叶红外光谱仪由固定镜、动镜、分束器、样品池、探测器、放大滤波器和记录仪组成。当光源照射在分束器上,光源被分为两束,一束光透过分束器到达动镜,另一束光反射到达固定镜,经过二次反射到达分束器。动镜具有可移动性,移动期间会产生光程差,这就是干涉的形成过程。干涉光透过样品池,将携带样品信息的光经过放大滤波器处理,利用傅里叶变换技术进行信息处理,得到光谱。蛋白质红外光谱由酰胺Ⅰ带、酰胺II带、酰胺III带、酰胺Ⅳ、酰胺Ⅴ、酰胺Ⅵ、酰胺Ⅶ、酰胺A带及酰胺B带组成,在9个特征吸收带中酰胺Ⅰ(1 600~1 700 cm-1)带对蛋白质二级结构的研究最有意义[7]。
1.2 傅里叶红外光谱法测定蛋白质二级结构的方法及优缺点
傅里叶红外光谱法可检测不同状态的蛋白样品,包括固体样品和液体样品,但因水在1 640 cm-1附近的吸收会对测定产生强大干扰,因此通常情况下固体样品更多被选择。固体样品制备方法有很多,最常用的是KBr压片法,参考文吉昌等[8]的方法具体制备流程如图1所示。样品薄片制备后,置于红外光谱仪中进行测定,常用的测定参数为:扫描范围400~4 000 cm-1,以KBr空白片做参比,分辨率设置为4 cm-1,扫描次数为128次,得出图谱,将图谱在傅里叶红外光谱仪中进行初步处理,用PeakFit V4.12进行基线校正、去卷积以及二阶导数拟合(直至R2不变为止),确定各个子峰与二级结构对应关系,根据各子峰面积百分比计算各部分二级结构含量,每组样品平行测定多次,取平均值[9]。
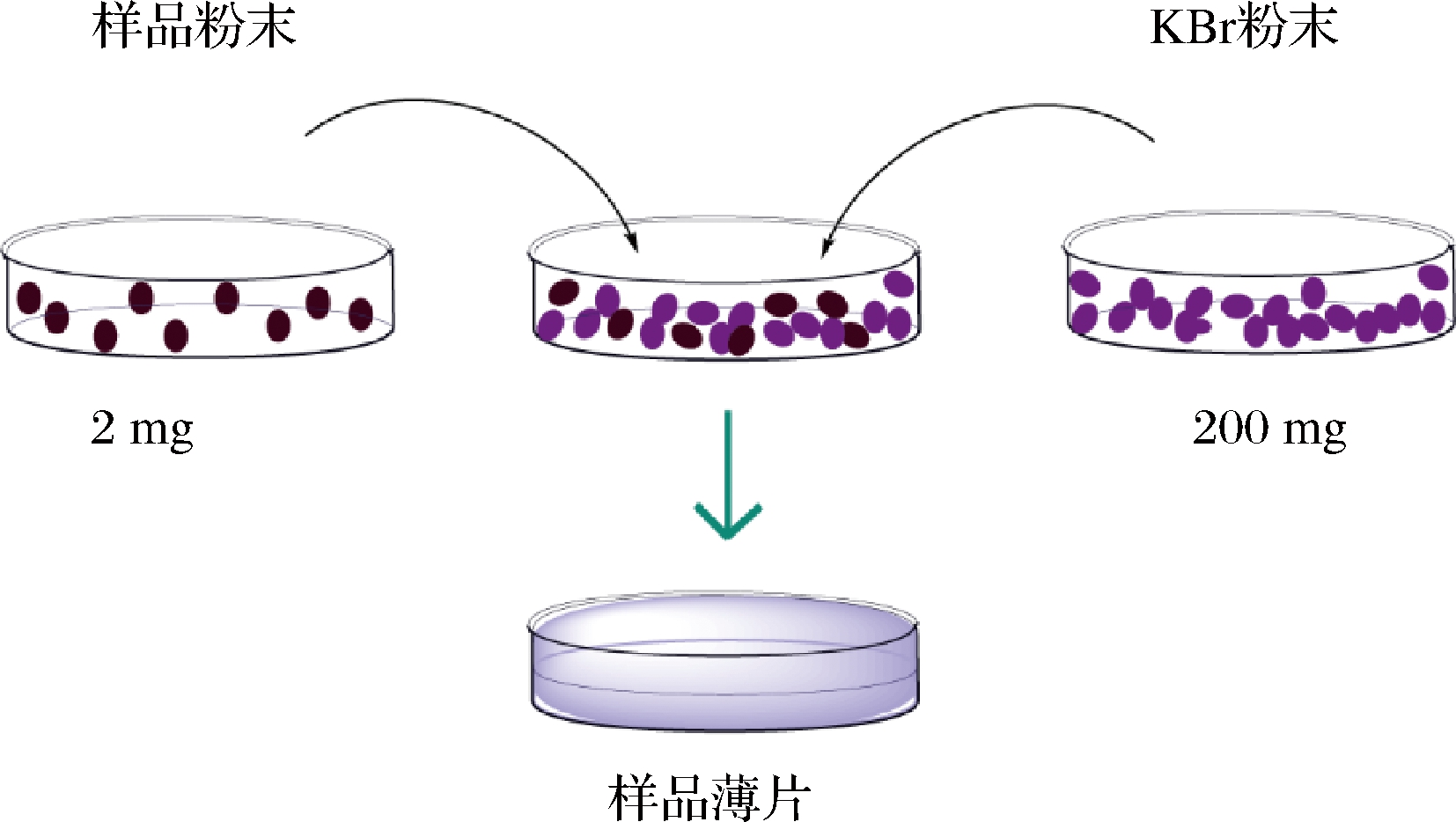
图1 固体样品KBr压片制备方法
Fig.1 Preparation method of solid sample KBr tablet
傅里叶红外光谱法具有操作简单、灵敏度高、分辨率好、扫描速度快、信噪比高、能检测蛋白质结构微小变化等特点[10]。有如下优势:(1)不受官能团、相对分子质量等条件限制,测定样品量少,对样品没有特殊要求,可以对水溶液、晶体和固体中的蛋白质进行构象分析,可鉴定多种成分。(2)傅里叶红外光谱法应用范围广,不但能够直接进行检测分析,还可以跟其他色谱、质谱仪联用,极大提高了检测准确性[11]。(3)不受其他物质干扰,可从复杂的物质体系中快速识别目标物质,且无需重复检测,检测重现性好。当前肉制品市场鱼龙混杂,采用传统的化学检测方法,不仅速度慢而且过程繁琐,傅里叶红外光谱技术可快速准确达到检测目的。傅里叶红外光谱法也因此在生物医学、食品检测、材料鉴定、化学等领域深受人们喜爱[12]。
但由于整个系统设备体积大、价格高、测量气体样品时易受其他气体干扰,使用压片法测量时制得的样品易碎且必须严格干燥,增加了操作的复杂性。
1.3 傅里叶红外光谱法在蛋白二级结构测定中的应用
借助于傅里叶红外光谱法测定蛋白二级结构,可以判定凝胶网络结构、蛋白乳化性、面筋形成能力及水分分布等情况。
![]() 等[13]在采用傅里叶红外光谱法研究辐照对肌肉蛋白结构和凝胶性能影响时发现,采用γ射线对乳清分离蛋白进行辐照处理,其二级结构中β-折叠和β-转角呈现增加趋势,α-螺旋含量显著减少,这有利于凝胶网络结构的形成。康怀彬等[14]采用傅里叶红外光谱法研究高温对牛肉肌原纤维蛋白结构的影响发现,随着温度的升高和时间的延长,α-螺旋结构含量呈降低趋势,且向无规则卷曲结构转变,这对蛋白的凝胶性和保水性是不利的。SUN等[15]采用傅里叶红外光谱法研究氧化对肌原纤维蛋白乳化性能影响时发现,随着氧化剂浓度增加,α-螺旋和无规则卷曲含量下降,伴随着β-折叠含量增加,乳化指数降低。苏靖等[16]在采用傅里叶红外光谱法分析河套春小麦贮藏期蛋白质二级结构变化时发现,随着贮藏期的延长,峰位红移,说明蛋白质结构展开;贮藏期内小麦蛋白二级结构中维持α-螺旋、β-折叠的氢键断裂,由有序的α-螺旋、β-折叠转化为β-转角和无规则卷曲,这些变化导致小麦蛋白网状结构受到破坏,使其形成面筋能力减弱,品质下降。刘瑞莉等[17]采用傅里叶红外光谱法研究焦磷酸钠、三聚磷酸钠、六偏磷酸钠对面筋蛋白影响时发现,前两者随浓度的增加,β-折叠含量增加,面筋蛋白结构稳定,六偏磷酸钠在添加量较低时,α-螺旋和β-转角含量降低,使面筋蛋白结构趋于不稳定。ZHENG等[18]采用傅里叶红外光谱法研究肉糜加工制备过程中水分迁移和蛋白质构象间关系时,将实验样品分为纯肉糜组、加盐肉糜组和加盐-水肉糜组,结果表明二级结构发生变化主要受到盐的影响,不易流动水占比与β-折叠呈负相关;与α-螺旋、β-转角和无规则卷曲呈正相关,后者使得不易流动水含量增加而自由水减少,增加了持水能力,改善了肉糜的嫩度,提高了肉糜品质。
等[13]在采用傅里叶红外光谱法研究辐照对肌肉蛋白结构和凝胶性能影响时发现,采用γ射线对乳清分离蛋白进行辐照处理,其二级结构中β-折叠和β-转角呈现增加趋势,α-螺旋含量显著减少,这有利于凝胶网络结构的形成。康怀彬等[14]采用傅里叶红外光谱法研究高温对牛肉肌原纤维蛋白结构的影响发现,随着温度的升高和时间的延长,α-螺旋结构含量呈降低趋势,且向无规则卷曲结构转变,这对蛋白的凝胶性和保水性是不利的。SUN等[15]采用傅里叶红外光谱法研究氧化对肌原纤维蛋白乳化性能影响时发现,随着氧化剂浓度增加,α-螺旋和无规则卷曲含量下降,伴随着β-折叠含量增加,乳化指数降低。苏靖等[16]在采用傅里叶红外光谱法分析河套春小麦贮藏期蛋白质二级结构变化时发现,随着贮藏期的延长,峰位红移,说明蛋白质结构展开;贮藏期内小麦蛋白二级结构中维持α-螺旋、β-折叠的氢键断裂,由有序的α-螺旋、β-折叠转化为β-转角和无规则卷曲,这些变化导致小麦蛋白网状结构受到破坏,使其形成面筋能力减弱,品质下降。刘瑞莉等[17]采用傅里叶红外光谱法研究焦磷酸钠、三聚磷酸钠、六偏磷酸钠对面筋蛋白影响时发现,前两者随浓度的增加,β-折叠含量增加,面筋蛋白结构稳定,六偏磷酸钠在添加量较低时,α-螺旋和β-转角含量降低,使面筋蛋白结构趋于不稳定。ZHENG等[18]采用傅里叶红外光谱法研究肉糜加工制备过程中水分迁移和蛋白质构象间关系时,将实验样品分为纯肉糜组、加盐肉糜组和加盐-水肉糜组,结果表明二级结构发生变化主要受到盐的影响,不易流动水占比与β-折叠呈负相关;与α-螺旋、β-转角和无规则卷曲呈正相关,后者使得不易流动水含量增加而自由水减少,增加了持水能力,改善了肉糜的嫩度,提高了肉糜品质。
2 拉曼光谱法
2.1 拉曼光谱法的定义及原理
拉曼光谱法是一种分子振动光谱技术,是以拉曼散射效应为基本原理发展起来的。该效应是指当光源照射在样品上时,测定物质吸收光子能量,但有一小部分光在通过样品时会发生散射现象,这种散射现象又分为弹性散射和非弹性散射。弹性散射,也称为瑞丽散射,会使入射光与测定物质之间发生能量交换,但光的传播方向没有改变。非弹性散射是指入射光和测定物质之间的能量和方向均发生了改变[19]。
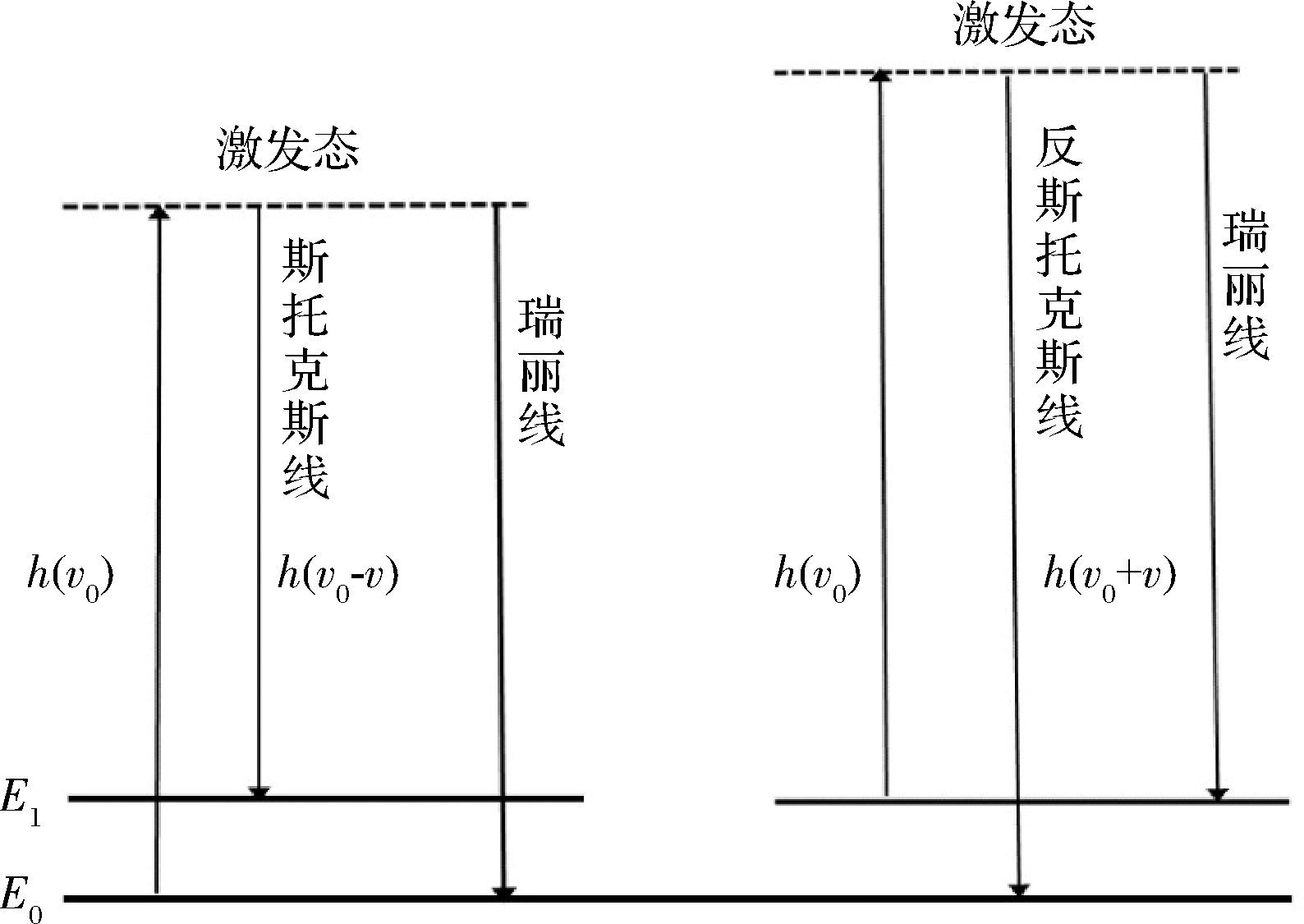
图2 拉曼散射过程原理图
Fig.2 Schematic diagram of Raman scattering process
参考胡成龙等[20]绘制如图2所示的拉曼散射原理图。将光照射在样品上,使处于基态E0的样品分子受激吸收hv0的能量,跃迁至受激态,受激态不稳定,分子会立即回到基态,从而产生瑞丽线。若分子没有返回基态E0而到达比基态频率稍高的激发态E1,则分子在返回途中释放出h(v0-v)的能量,从而产生斯托克斯线。但也有分子的初始状态位于E1而非基态E0,当其受到光子激发时可能重新回到E1,发生弹性散射,或者回到基态E0,释放出h(v0+v)的能量,由此产生反斯托克斯线。但由Boltzmann(玻尔兹曼)分布可知,常温下大多数为基态分子,这就是拉曼光谱主要研究斯托克斯散射的原因。
2.2 拉曼光谱法测定蛋白质结构的方法及优缺点
采用拉曼光谱法检测蛋白样品时,与傅里叶红外光谱法不同,蛋白提纯后可直接置于拉曼光谱仪中进行测定,常用的测定参数设定为:扫描波长为785 nm,激光功率为300 mW,扫描范围:400~4 000 cm-1,扫描时间每次60 s,4次扫描进行累加,以苯丙氨酸[(1 003±1) cm-1]作为归一化因子,并用显微镜进行观察,将光谱用Origin 8.5进行平滑处理,采用Peakfit进行拟合分析并通过峰面积比得到各二级结构含量[21-23]。
拉曼光谱法具有灵敏度高,样品量少(μg级),分析速度快、操作简单快速等特点,可进行无损分析,试样可直接通过光纤探头进行测量[24-25]。有如下优势:(1)此方法对样品状态不设限制,可检测固、液、气多种状态样品物质。(2)拉曼光谱法无需对样品进行预处理,样品可在其本征状态下直接进行测试,避免了对样品的破坏及检测过程中人为导致的误差,深受检测行业人们的喜爱[26-27]。(3)由于水的拉曼散射很弱,因此拉曼光谱法非常适合研究水体系,且在进行气体检测时,无需分离样品气体,可同时检测多组分气体样品,大大节约了时间成本[28]。(4)拉曼光谱法还可进行远程在线分析,即使在距离拉曼分析仪几百米远也可以实施精控操作[29-30]。
2.3 拉曼光谱法在蛋白二级结构测定中的应用
借助拉曼光谱测定蛋白二级结构可以判定凝胶特性、保藏、医学鉴定等方面的情况。
YANG等[31]在采用拉曼光谱法研究低场核磁共振提高猪肉糜凝胶特性时发现,经低场核磁共振处理过的猪肉糜样品相较于对照组,α-螺旋含量占比更少,β-折叠含量占比更高,这一变化促使蛋白质和水紧密结合,且降低了水的流动性,提高了肉糜凝胶的保水性。江连洲等[32]采用拉曼光谱法研究不同贮藏期大豆蛋白对千页豆腐品质影响时发现,随着贮存期的延长,大豆分离蛋白的二级结构发生重大改变。在贮藏期0~18 d内,α-螺旋含量呈上升趋势,β-折叠和β-转角含量随着贮藏期的延长而逐渐增加,无规则卷曲含量逐渐减少,表明在此期间蛋白质有序结构含量较多,二级结构比较稳定;随着贮藏期的延长,在18~30 d内α-螺旋含量下降,无规则卷曲含量上升,表明蛋白质结构遭到了破坏,维持二级结构稳定的氢键断裂,由有序的状态逐渐成为无序状态,导致凝胶强度下降。蔡路昀等[33]在采用拉曼光谱法研究不同超声辅助解冻方式对海鲈鱼肌原纤维蛋白的影响时发现,样品经解冻后,蛋白质二级结构中α-螺旋含量均下降,经超声解冻处理的样品,其α-螺旋含量仅为33.95%,明显低于新鲜鱼肉和其他解冻方式,但无规则卷曲含量为25.25%,高于其他解冻方式,这说明超声解冻处理破坏了蛋白质二级结构的有序状态,在维持二级结构稳定性上表现力最差,而超声微波解冻和超声真空解冻组的α-螺旋含量和新鲜样品最接近,表明这2种方式是最适合鱼肉解冻的处理方式。CLAUDIO等[34]在采用共聚焦拉曼光谱法鉴别正常和异常甲状腺组织中蛋白质二级结构变化时发现,β-折叠结构在正常甲状腺组织中的含量为20%,在甲状腺肿组织中为17%,在乳头状癌组织和滤泡癌组织中依次是15%、14%。α-螺旋含量在乳头状癌组织中显著高于正常甲状腺组织和滤泡癌组织,但在甲状腺肿样品中没有此结构,310-螺旋结构只出现在甲状腺肿组织和滤泡癌组织中。β-转角在正常甲状腺组织、滤泡癌组织、乳头状癌组织中的含量约是甲状腺肿组织中的2倍。因此采用拉曼光谱法测定样品组织中的二级结构含量,可协助医生快速鉴别甲状腺病变组织类型,极大辅助了临床诊断。
3 两种方法测定牛霖肉蛋白二级结构结果比较
傅里叶红外光谱法和拉曼光谱法测定蛋白质二级结构各有千秋,为了比较这2种方法的异同,选取牛霖肉为实验对象,分别采用傅里叶红外光谱法和拉曼光谱法进行蛋白二级结构的测定。
样品采购:巴西进口牛霖肉购于市场,分割处理后装入保鲜袋,置于0~4 ℃泡沫箱中运输至实验室,在冰柜(-20 ℃)中保存。样品处理:将-20 ℃冷冻的牛霖肉置于-4 ℃冷库中解冻24 h,剔除筋膜和多余脂肪组织后,分隔成小块于绞肉机中绞成肉糜。肌原纤维蛋白提取参考何悦珊等[35]的方法进行。测定方法:将样品均匀涂抹在载玻片上,放在拉曼光谱仪中进行测定,测定参数:激光波长为535 nm,功率为25 mW,使用单晶硅进行校准,单晶硅有一个520 nm的发射峰,狭缝宽度为200 MHz,600 g/mm的光栅,分辨率选定为2 cm-1,扫描时间60 s,扫描范围在400~4 000 cm-1,多次扫描进行累加;傅里叶红外光谱法测定时需将蛋白进行冻干处理,研磨成粉,置于样品池中进行检测。常用的测定参数有:扫描范围400~4 000 cm-1,样品扫描时间为32 s,分辨率为4 cm-1。对上述2种方法得到的图谱进行平滑处理,根据各子峰面积得到的各个二级结构含量。
2种方法测定牛霖肉蛋白二级结构含量如图3所示,傅里叶红外光谱法和拉曼光谱法测得的α-螺旋结构含量基本一致,依次为18.88%、20.75%。β-折叠和β-转角在傅里叶红外光谱法中测得的含量明显高于拉曼光谱法,但无规则卷曲结构并没有在傅里叶红外光谱法中检出,这是其与拉曼光谱法测定结果的显著不同。原因可能是:在制样时,傅里叶红外光谱法在蛋白提纯后将样品进行了冻干处理,除去水分,再磨粉进行测定;而拉曼光谱法是在提纯蛋白本征状态下直接进行的测定,未经任何处理。这提示,在傅里叶红外光谱法测定蛋白结构过程中的某些操作可能会改变其二级结构比例。
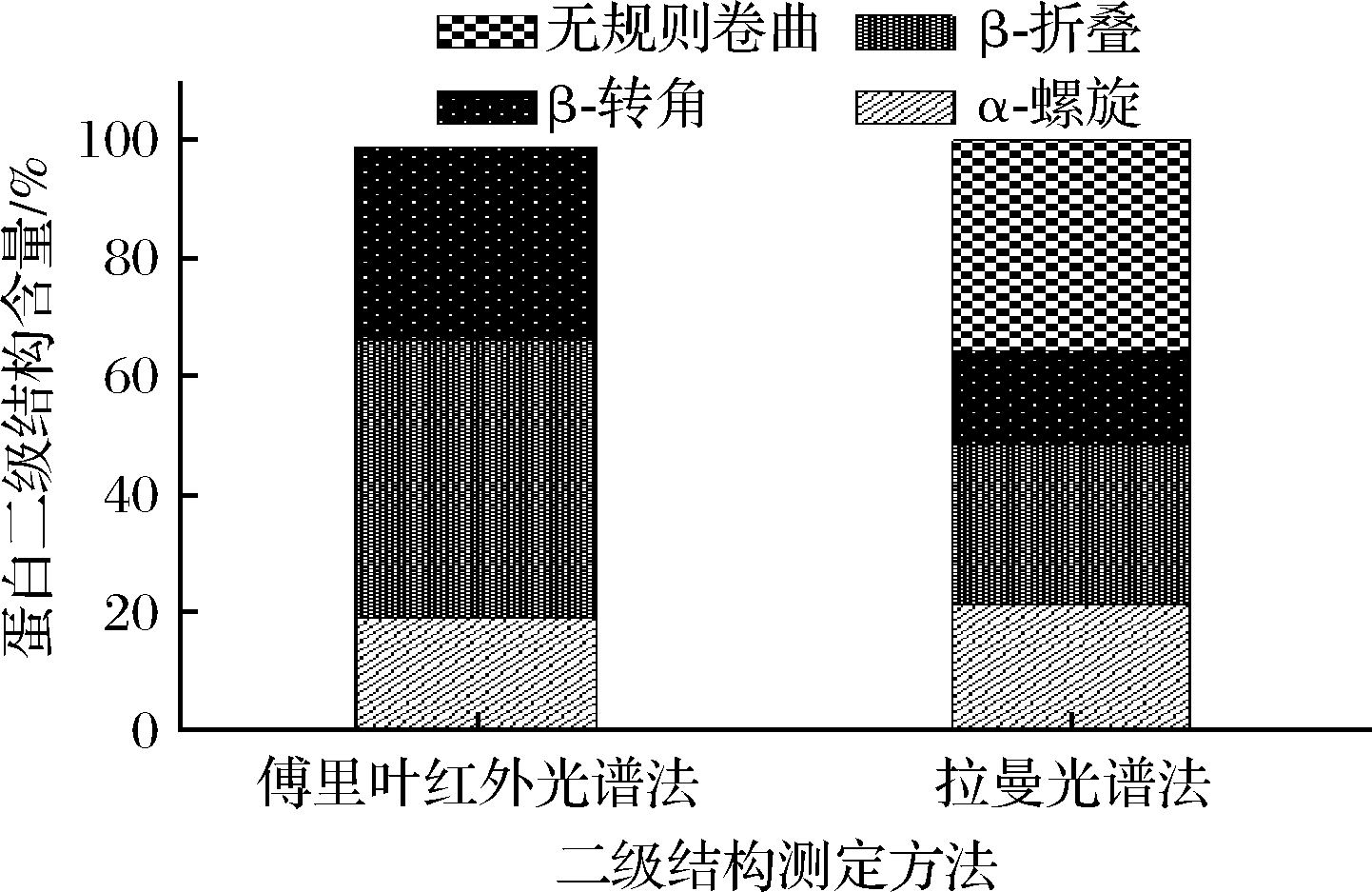
图3 傅里叶红外光谱法和拉曼光谱法测定牛霖二级 结构含量图
Fig.3 Secondary structure content of topside meat determined by Fourier infrared spectroscopy and Raman spectroscopy
表1 傅里叶红外光谱法和拉曼光谱法测定牛霖 二级结构含量表
Table 1 secondary structure content of topside determined by Fourier infrared spectroscopy and Raman spectroscopy

方法α-螺旋/%β-折叠/%β-转角/%无规则卷曲结构/%傅里叶红外光谱法18.88±0.1848.17±1.1832.46±0.300.00±0.00拉曼光谱法 20.75±1.0628.00±1.4119.00±4.2432.25±4.60
注:平均值±标准差
4 展望
傅里叶红外光谱法和拉曼光谱法已成为表征蛋白质二级结构强有力的工具,通过对图谱的处理分析,可获取蛋白质二级结构信息。但这2种方法各有优缺点,傅里叶红外光谱法更适合干燥易磨粉的样品,拉曼光谱法则对样品状态没有限制。在使用2种方法对牛霖肉二级结构进行测定的试验中,傅里叶红外光谱法测定的结果中无规则卷曲结构未检出,β-折叠和β-转角结构相较于拉曼光谱法显著上升,α-螺旋结构略有下降,这可能是在傅里叶红外光谱法测定蛋白结构过程中的某些操作对二级结构比例产生了影响,因此采用拉曼光谱法进行蛋白二级结构的测定更简捷,但设备更昂贵。
[1] 毕文雅, 张来林, 石天玉.偏高水分优质稻在储藏期间蛋白质二级结构与质构特性变化关系研究[J].中国粮油学报, 2020, 35(12):56-61.
BI W Y, ZHANG L L, SHI T Y.The relationship between secondary structure of protein and texture characteristics of high quality paddy with slightly high moisture during storage[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(12):56-61.
[2] 梁恽红, 卢涵, 张香美.蛋白二、三级结构对鱼糜凝胶质构和持水力的影响及其测定方法研究进展[J].东北农业大学学报, 2021, 52(10):87-96.
LIANG Y H, LU H, ZHANG X M.Research progress on the effects of protein secondary and tertiary structures on texture and water-holding capacity of surimi gel and protein structure determination methods[J].Journal of Northeast Agricultural University, 2021, 52(10):87-96.
[3] PELTON J T, MCLEAN L R.Spectroscopic methods for analysis of protein secondary structure[J].Analytical Biochemistry, 2000, 277(2):167-176.
[4] 张秋会, 黄现青, 李苗云, 等.傅里叶红外光谱法研究肌肉蛋白质的二级结构[J].食品与发酵工业, 2015, 41(10):247-251.
ZHANG Q H, HUANG X Q, LI M Y, et al.Study on secondary structure of meat protein by FTIR[J].Food and Fermentation Industries, 2015, 41(10):247-251.
[5] 胡瑞省, 张宝华, 周冉, 等.红外光谱法分析酵母蛋白质的二级结构[J].理化检验-化学分册, 2015, 51(3):277-280.
HU R S, ZHANG B H, ZHOU R, et al.Study on secondary structure of yeast protein by infrared spectroscopy[J].Physical Testing and Chemical Analysis [Part B (Chemical Analysis)], 2015, 51(3):277-280.
[6] 陈乃鹏. 傅里叶变换红外光谱对酒的鉴定综述[J].当代化工研究, 2019(6):22-24.
CHEN N P.Review on identification of wine by Fourier transform infrared spectroscopy[J].Modern Chemical Research, 2019(6):22-24.
[7] 高红艳, 许强, 杨志怀.FT-IR在研究蛋白质二级结构中的应用[J].宝鸡文理学院学报(自然科学版), 2009, 29(3):47-53.
GAO H Y, XU Q, YANG Z H.Research on protein secondary structure by Fourier transformation infrared spectroscopy[J].Journal of Baoji University of Arts and Sciences (Natural Science Edition), 2009, 29(3):47-53.
[8] 文吉昌, 王加凤.红外光谱在分析制样技术中的应用研究[J].安徽农业科学, 2014, 42(29):10 063-10 065.
WEN J C, WANG J F.Research of application in sample preparation technology for infrared spectrum[J].Journal of Anhui Agricultural Sciences, 2014, 42(29):10 063-10 065.
[9] 刘爱成, 李墨翰, 张正翰, 等.牛乳、驴乳乳清蛋白二级结构及其功能对比研究[J].乳业科学与技术, 2021, 44(3):6-11.
LIU A C, LI M H, ZHANG Z H, et al.Comparative study on secondary structure and function of whey protein from milk and donkey milk[J].Journal of Dairy Science and Technology, 2021, 44(3):6-11.
[10] 杜谷, 王坤阳, 冉敬, 等.红外光谱/扫描电镜等现代大型仪器岩石矿物鉴定技术及其应用[J].岩矿测试, 2014, 33(5):625-633.
DU G, WANG K Y, RAN J, et al.Application of IR/SEM and other modern instruments for mineral identification[J].Rock and Mineral Analysis, 2014, 33(5):625-633.
[11] 周鹏. 电喷雾萃取电离质谱技术在毒物快速筛查中的应用研究[D].抚州:东华理工大学, 2017.
ZHOU P.Application of electrospray extraction ionization mass spectrometry in rapid screening of poisons[D].Fuzhou:East China Institute of Technology, 2017.
[12] 严福林, 魏怡冰, 黄明喆, 等.基于傅里叶变换红外光谱的黔产薯蓣属植物鉴别探究[J].种子, 2019, 38(12):25-29.
YAN F L, WEI Y B, HUANG M Z, et al.Identification of Dioscorea from Guizhou province based on Fourier transform infrared spectroscopy[J].Seed, 2019, 38(12):25-29.
[13] ![]() , SALMIERI S, LACROIX M, et al.Gamma irradiation influence on physical properties of milk proteins[J].Radiation Physics and Chemistry, 2004, 71(1-2):95-99.
, SALMIERI S, LACROIX M, et al.Gamma irradiation influence on physical properties of milk proteins[J].Radiation Physics and Chemistry, 2004, 71(1-2):95-99.
[14] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23):80-86.
KANG H B, ZOU L L, ZHANG H Y, et al.Effect of high temperature treatment on chemical forces of beef proteins and structure of myofibrillar protein[J].Food Science, 2018, 39(23):80-86.
[15] SUN W Z, ZHOU F B, SUN D W, et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology, 2013, 6(7):1 703-1 712.
[16] 苏靖, 石晶红, 王金帅, 等.基于红外光谱分析河套春小麦储藏期蛋白质二级结构变化[J].粮食与油脂, 2021, 34(11):24-27;35.
SU J, SHI J H, WANG J S, et al.Changes in secondary structure of Hetao spring wheat protein under storage analyzed by Fourier transform infrared spectroscopy[J].Cereals &Oils, 2021, 34(11):24-27;35.
[17] 刘瑞莉, 陆啟玉, 王法林, 等.磷酸盐对面筋蛋白特性的影响[J].中国食品学报, 2021, 21(2):171-178.
LIU R L, LU Q Y, WANG F L, et al.Effect of phosphate on the properties of gluten[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(2):171-178.
[18] ZHENG J Y, SUN D, LIU D Y, et al.Low-field NMR and FTIR determination relationship between water migration and protein conformation of the preparation of minced meat[J].International Journal of Food Science &Technology, 2022, 57(1):235-241.
[19] ![]() J, EDWARDS H G M, OREN A.Analysis of brown, violet and blue pigments of microorganisms by Raman spectroscopy[J].TrAC Trends in Analytical Chemistry, 2022, 146:116501.
J, EDWARDS H G M, OREN A.Analysis of brown, violet and blue pigments of microorganisms by Raman spectroscopy[J].TrAC Trends in Analytical Chemistry, 2022, 146:116501.
[20] 胡成龙, 陈韶云, 陈建, 等.拉曼光谱技术在聚合物研究中的应用进展[J].高分子通报, 2014(3):30-45.
HU C L, CHEN S Y, CHEN J, et al.Application progress of Raman spectroscopy in polymer study[J].Polymer Bulletin, 2014(3):30-45.
[21] 张萍, 郑大威, 刘晶, 等.基于表面增强拉曼光谱技术的豆芽6-BA残留快速检测方法[J].光谱学与光谱分析, 2012, 32(5):1 266-1 269.
ZHANG P, ZHENG D W, LIU J, et al.Rapid detection of 6-benzylaminopurine residues in sprout beans by surface-enhanced Raman spectroscopy[J].Spectroscopy and Spectral Analysis, 2012, 32(5):1 266-1 269.
[22] 江连洲, 胡继莹, 张潇元, 等.不同品种大豆分离蛋白体外消化产物的结构特性[J].中国食品学报, 2019, 19(9):21-36.
JIANG L Z, HU J Y, ZHANG X Y, et al.Structural characteristics of in vitro digested products of different soybean protein isolates[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):21-36.
[23] 李杨, 孙禹凡, 赵城彬, 等.体外模拟消化过程中大豆分离蛋白拉曼光谱和荧光光谱分析[J].中国食品学报, 2019, 19(2):266-272.
LI Y, SUN Y F, ZHAO C B, et al.Analysis of Raman spectroscopy and fluorescence spectroscopy for soy protein isolate during vitro simulated digestion process[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):266-272.
[24] 宣芳, 许子旋, 胡耀娟.表面增强拉曼光谱在食品添加剂检测方面的应用进展[J].南京晓庄学院学报, 2020, 36(6):6-12.
XUAN F, XU Z X, HU Y J.Application progress of surface enhanced Raman spectroscopy in the detection of food additives[J].Journal of Nanjing Xiaozhuang University, 2020, 36(6):6-12.
[25] 杨坤宇, 郭晗, 姚晓飞.拉曼光谱技术对常见毒品的检测研究[J].山东化工, 2021, 50(18):107-108.
YANG K Y, GUO H, YAO X F.Study on detection of common drugs by Raman spectroscopy[J].Shandong Chemical Industry, 2021, 50(18):107-108.
[26] KINALWA M N, BLANCH E W, DOIG A J.Accurate determination of protein secondary structure content from Raman and Raman optical activity spectra[J].Analytical Chemistry, 2010, 82(15):6 347-6 349.
[27] 李杨, 和铭钰, 吴长玲, 等.空化微射流对生物酶法豆渣蛋白结构影响的拉曼光谱分析[J].食品科学, 2020, 41(1):105-111.
LI Y, HE M Y, WU C L, et al.Raman spectroscopy analysis of the effect of cavitation microjet on the structure of soybean dreg protein from aqueous enzymatic extraction of soybean oil[J].Food Science, 2020, 41(1):105-111.
[28] 朱华东, 罗勤, 周理, 等.激光拉曼光谱及其在天然气分析中的应用展望[J].天然气工业, 2013, 33(11):110-114.
ZHU H D, LUO Q, ZHOU L, et al.Application prospect of natural gas component analysis using laser Raman spectroscopy[J].Natural Gas Industry, 2013, 33(11):110-114.
[29] KEIDERLING T A.Structure of condensed phase peptides:Insights from vibrational circular dichroism and Raman optical activity techniques[J].Chemical Reviews, 2020, 120(7):3 381-3 419.
[30] ROACH C A, SIMPSON J V, JIJI R D.Evolution of quantitative methods in protein secondary structure determination via deep-ultraviolet resonance Raman spectroscopy[J].The Analyst, 2012, 137(3):555-562.
[31] YANG K, ZHOU Y H, GUO J J, et al.Low frequency magnetic field plus high pH promote the quality of pork myofibrillar protein gel:A novel study combined with low field NMR and Raman spectroscopy[J].Food Chemistry, 2020, 326:126896.
[32] 江连洲, 冉安琪, 贾子璇, 等.不同贮藏期大豆蛋白对千页豆腐品质的影响[J].农业工程学报, 2019, 35(20):311-318.
JIANG L Z, RAN A Q, JIA Z X, et al.Effect of soy protein on the quality of Qianye tofu in different storage periods[J].Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(20):311-318.
[33] 蔡路昀, 许晴, 曹爱玲.不同超声辅助解冻方式对海鲈鱼肌原纤维蛋白的影响[J].食品与发酵工业, 2020, 46(20):1-8.
CAI L Y, XU Q, CAO A L.Effects of different ultrasound-assisted thawing methods on the myofibrillar protein of the sea bass(Perca fluviatilis)[J].Food and Fermentation Industries, 2020, 46(20):1-8.
[34] TÉLLEZ SOTO C A, MEDEIROS-NETO L P, DOS SANTOS L, et al.Infrared and confocal Raman spectroscopy to differentiate changes in the protein secondary structure in normal and abnormal thyroid tissues[J].Journal of Raman Spectroscopy, 2018, 49(7):1 165-1 173.
[35] 何悦珊, 马长明, 师瑞, 等.不同部位牛肉肌原纤维蛋白乳化特性研究[J].食品与发酵工业, 2022, 48(24):91-96.
HE Y S, MA C M, SHI R, et al.Study on emulsification characteristics of beef myofibrillar protein in different parts[J].Food and Fermentation Industries, 2022, 48(24):91-96.