生物传感器是基于生物分子与分析物特异性结合,并通过信号转换器转换为可读信号从而获取样品中分析物含量的分析方法。随着纳米技术的发展并与生物传感器结合所构建的纳米生物传感器,为生物传感器提供了广阔的应用前景[1-2]。银纳米粒子(silver nanoparticles,Ag NPs)是指其尺寸小于100 nm的银粒子。根据不同的反应条件可制得包括球形、立方体、线棒状、六边形、五边形以及三角形等形状各异的Ag NPs。Ag NPs表面的负电荷(例如柠檬酸根负电荷)或正电荷(例如聚乙烯亚胺阳离子聚合物)使得Ag NPs分散均匀。此外,Ag NPs具有比金纳米粒子高100倍的消光系数。基于Ag NPs比表面积大、合成成本低、表面可修饰等特性[3],被广泛用作比色探针构建生物传感器用于食品、药品、环境中危害因子的检测。Ag NPs对分析物的亲和力和选择性受Ag NPs表面功能化配体和官能团性质的控制,通过对Ag NPs表面进行修饰,以颜色信号为检测对象构建的比色生物传感器在食品安全检测领域得到广泛的研究。
由于Ag NPs的表面活性高,易发生团聚,因此,对Ag NPs进行有效地表面功能化尤为重要。在Ag NPs制备中或制备后,利用不同的修饰方法和修饰剂改变Ag NPs表面的性质,提高其在传感器应用中的稳定性、灵敏度和选择性。目前表面功能化Ag NPs生物传感器在食品检测[4]、环境监测[5]、生物医疗[6]等领域得到广泛的应用。本文主要对Ag NPs表面修饰的方法及其在生物传感器中的应用进行了综述(图1),以期为新的修饰方法和新的研究提供思路。

图1 Ag NPs的表面功能化方法及功能化Ag NPs 在构建生物传感器的应用
Fig.1 Surface functionalization methods of Ag NPs and the application of functionalized Ag NPs in biosensors construction
1 Ag NPs表面修饰方法
采用不同的表面修饰方法,提高了Ag NPs的稳定性和分析适用性,从而扩宽Ag NPs的应用和研究。因此,Ag NPs的表面功能化为纳米生物传感器提供了创新机遇和应用前景。Ag NPs表面修饰的方法多种多样,根据反应性质的不同,可分为物理修饰法和化学修饰法。此外,通过表1可知Ag NPs表面基团可通过共价键、非共价键或掺杂等方法实现Ag NPs的表面功能化。共价键是一种稳定的化学键,可以利用修饰物基团与Ag NPs表面基团之间的共价结合实现Ag NPs的表面功能化。通常情况下,共价结合的形成是由于含有巯基的靶分子通过Ag—SH键等对Ag NPs进行表面修饰。Ag NPs与修饰物之间的离子键、金属键以及分子间作用力是非共价键功能化的主要方式。掺杂复合功能化则是在制备纳米材料的过程中,通过不同纳米材料的掺杂,纳米微粒进一部复合产生不同于原有纳米微粒功能性质的Ag NPs表面修饰方法。
1.1 表面物理修饰法
表面物理修饰法是指通过包裹、吸附等物理手段将表面活性剂修饰在Ag NPs表面,最终改变Ag NPs的性能。表面物理修饰法主要包括:表面沉积法、表面吸附法。表面沉积法指的是将表面修饰剂沉积到Ag NPs表面,形成与Ag NPs表面无化学结合的异质包裹层。表面吸附法是指表面修饰剂通过范德华力、氢键吸附在Ag NPs表面。以硅纳米线和碳量子点为例:设计、合成特定荧光分子,并利用其对硅纳米线(silicon nanowires,Si NWs)进行表面修饰,获得了一系列具有优异传感性能的体系;通过简单的表面修饰,改变碳量子点(carbon quantum dots,CQDs)的表面基团,使其荧光强度增强了4倍,而且修饰之后的碳量子点吸潮性明显改善,为其固态应用奠定了基础。
1.2 表面化学修饰法
化学修饰法是利用Ag NPs表面的活性基团和有机分子中的特定官能团发生反应,从而将修饰分子通过共价、S—Ag等方式结合到Ag NPs表面。相比于物理修饰,化学修饰具有更好的稳定性,而且往往可以获得单分子层表面修饰。化学修饰又可以细分为共价键、非共价键或掺杂等。
由于Ag NPs的表面可修饰性,因而可以利用Ag NPs表面基团与修饰基团之间的化学结合实现Ag NPs表面的功能化。在丰富的表面化学修饰法中,一步合成表面修饰的Ag NPs(化学还原一步法)和二次小分子标记法有着突出而又重要的地位。
化学还原一步法是指表面修饰物作为保护剂和还原剂参与Ag NPs的合成过程,化学物质[7]、微生物组织、天然提取物[8]等可以作为功能化的表面修饰物。相比于化学物质的表面修饰剂,微生物组织以及植物提取物在表面修饰Ag NPs合成中具有环境友好、反应条件温和可控、无毒、良好的生物相容性等特点,非常适宜在生物医药领域的应用。MOHAMMADI等[9]发现在NaHB4还原下,壳聚糖(chitosan, ChTS)修饰的Ag NPs与生物硫醇作用后发生颜色的变化,由此提出以ChTS—Ag NPs作为比色探针选择性检测生物硫醇的方法。ChTS的—NH3与硫醇的—OH形成氢键,显著提高检测的灵敏度。XIONG等[10]合成由对磺化环[4]芳烃(p-sulfonatocalix[4], pSC4)修饰的Ag NPs溶液检测组氨酸的含量。由于pSC4具有能容纳咪唑的富电子环状腔结构,可通过静电、阳离子-π相互作用与组氨酸的咪唑和氨基结合,实现组氨酸的特异性检测。
1.2.1 共价键合功能化
利用不同修饰物对Ag NPs表面进行功能化的过程中,修饰物与Ag NPs间存在不同的作用方式。共价键是一种稳定的化学键,可以利用修饰物基团与Ag NPs表面基团之间的共价结合实现Ag NPs的表面功能化。通常情况下,共价结合的形成是由于含有巯基的靶分子通过Ag—SH键等对 Ag NPs进行表面修饰。其中,巯基配体包括硫醇[11]、半胱氨酸(Cys)[12]、蛋白质[13]、巯基乙酸[14]、巯基乙胺[15]和谷胱甘肽(glutathione,GSH)[16]。另外,Ag NPs与修饰物之间形成的Ag—C、Ag—N共价键也是共价键合功能化修饰Ag NPs的一种重要途径。KAWAI等[17]利用富含π电子的芳香环通过Ag—C键将聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)共价键合到Ag NPs表面,得到PVP功能化的Ag NPs。PVP修饰的Ag NPs在水相系统中具有好的分散性,可以作为有机反应的催化剂。GUZM N-SOTO等[18]基于硫辛酸(lipoic acid,LA)的二巯基与Ag NPs表面形成强的Ag—SH共价键得到LA修饰的Ag NPs。LA末端羧基之间的静电斥力使得LA—Ag NPs在溶液中保持稳定存在,该功能化方法同样适用于其他含有巯基的修饰物。
N-SOTO等[18]基于硫辛酸(lipoic acid,LA)的二巯基与Ag NPs表面形成强的Ag—SH共价键得到LA修饰的Ag NPs。LA末端羧基之间的静电斥力使得LA—Ag NPs在溶液中保持稳定存在,该功能化方法同样适用于其他含有巯基的修饰物。
基于已合成的Ag NPs表面原子与表面修饰剂基团通过化学键结合实现Ag NPs表面修饰的方法称为二次小分子标记法。MEHTA等[19]利用NaHB4还原合成Ag NPs溶液后,将多巴胺二硫代氨基甲酸酯(dopamine dithiocarbamate, DDTC)共价键合到Ag NPs表面得到DDTC功能化的Ag NPs,用于农药代森锰锌的检测。通过DDTC-Ag NPs与裸露Ag NPs的比较,发现代森锰锌不能诱导裸露Ag NPs的聚集,从而表明Ag NPs表面修饰的DDTC在检测中起到识别代森锰锌的作用。ZHANG等[20]先利用NaHB4还原合成Ag NPs,GSH在Ag NPs表面自主装得到GSH—Ag NPs。由于GSH—Ag NPs之间的电荷静电斥力使得GSH-Ag NPs在水相体系中具有较好的分散度。
1.2.2 非共价键合功能化
非共价键合功能化指的是表面修饰物与Ag NPs表面通过非共价键结合,实现Ag NPs表面功能化的一种方法。Ag NPs与修饰物之间的离子键、金属键以及分子间作用力是非共价键功能化的主要方式。ABDEL-MOHSEN等[21]利用三螺旋裂叶多糖(schizophyllan, SPG)作为还原剂和修饰剂,银离子很容易通过离子键作用在SPG链上,绿色合成SPG修饰的Ag NPs。由于SPG的—OH电负性,SPG—Ag NPs在水相体系中具有好的分散性。ChTS的氨基与金属表面的阴离子(AgNO3的![]() 之间形成的离子对是ChTS—Ag NPs稳定存在的驱动力。WEN等[22]研究了细胞骨架蛋白对Ag NPs的非共价键功能化,细胞骨架蛋白通过氢键、静电相互作用、疏水作用力与柠檬酸根涂层的Ag NPs相互作用,合成细胞骨架蛋白修饰的Ag NPs对纳米粒子与生物分子的相互作用、毒理性等研究领域具有重要的研究意义。URYUPINA等[23]将非共价键合在Ag NPs表面,ChTS的羟基和氨基在银离子的还原和Ag NPs表面修饰中都发挥着重要的作用。
之间形成的离子对是ChTS—Ag NPs稳定存在的驱动力。WEN等[22]研究了细胞骨架蛋白对Ag NPs的非共价键功能化,细胞骨架蛋白通过氢键、静电相互作用、疏水作用力与柠檬酸根涂层的Ag NPs相互作用,合成细胞骨架蛋白修饰的Ag NPs对纳米粒子与生物分子的相互作用、毒理性等研究领域具有重要的研究意义。URYUPINA等[23]将非共价键合在Ag NPs表面,ChTS的羟基和氨基在银离子的还原和Ag NPs表面修饰中都发挥着重要的作用。
1.2.3 掺杂复合功能化
掺杂复合功能化是指复合材料在制备过程中,将纳米材料与碳物质(石墨烯、碳纳米管、量子点等)或金属纳米粒子(金纳米粒子等)结合制备的复合材料。掺杂复合材料不仅保留了Ag NPs的特性,同时材料兼备了掺杂物的优良性能,拓宽了新型复合材料的应用范围。石墨烯/Ag NPs复合材料不但具有石墨烯的物理化学性质,而且还具有Ag NPs的高电子转移速率和高催化活性[24];金纳米粒子的掺杂强化了Ag NPs的电传导性,提升了电化学传感器的性能[25]。Ag NPs的掺杂复合功能化也是丰富Ag NPs生物传感器应用的途径之一。掺杂复合后的Ag NPs因其具有巨大的应用前景已经成为研究者关注的热点。ZHONG等[26]以木质素为模板,原位合成木质素基Ag NPs复合材料。Ag NPs能很好的固定在木质素表面,具有良好的分散性能。木质素相对耐微生物分解,合成的木质素基纳米银复合物可作为潜在的抗菌材料。
表1 Ag NPs表面修饰方法
Table 1 Functionalization methods of Ag NPs

方法分类概念表面沉积法表面沉积法指的是将表面修饰剂沉积到Ag NPs表面,形成与Ag NPs表面无化学结合的异质包裹层表面物理修饰法表面吸附法表面吸附法是指表面修饰剂通过范德华力、氢键吸附在Ag NPs表面共价键合功能化共价键是一种稳定的化学键,可以利用修饰物基团与 Ag NPs表面基团之间的共价结合实现 Ag NPs 的表面功能化表面化学修饰法非共价键合功能化Ag NPs与修饰物之间的离子键、金属键以及分子间作用力是非共价键功能化的主要方式表面修饰物与Ag NPs表面通过非共价键结合,实现Ag NPs表面功能化的一种方法掺杂复合功能化掺杂复合功能化是指复合材料在制备过程中,将纳米材料与碳物质(石墨烯、碳纳米管、量子点等)或金属纳米粒子(金纳米粒子等)结合制备的复合材料
2 表面功能化的Ag NPs在生物传感器中的应用
表面功能化Ag NPs生物传感器相较于未进行表面修饰的Ag NPs生物传感器而言,在灵敏度及稳定性等方面均有显著地提高。而且不同的修饰方法以及修饰基团对Ag NPs表面进行修饰后,即赋予其新的物理化学性能,又提高Ag NPs溶液体系的分散性和化学稳定性。通过引入多种新的官能团,提高了Ag NPs的灵敏度、扩宽了Ag NPs的应用前景。表2为表面功能化Ag NPs构建的不同种类生物传感器的概念以及各自的优点。
2.1 基于表面修饰Ag NPs构建光学生物传感器
由于表面功能化Ag NPs在生物传感器中的作用机理不同,由其构建的光学生物传感器也具有不同的种类。
2.1.1 表面修饰Ag NPs构建荧光生物传感器
荧光生物传感器是以荧光信号为检测对象,通过荧光增强、猝灭或发射波长的移动进行定性或定量分析的方法。纳米技术的发展为荧光生物传感器突破式的进步提供了可行的方案。将表面修饰Ag NPs与荧光生物传感器结合发展了一种具有灵敏度高、专一性强等特点的纳米荧光生物传感器。基于表面修饰Ag NPs是否具有荧光性能,所构建的荧光生物传感器包括Ag NPs作为荧光团的Ag NPs荧光探针生物传感器以及以荧光素等荧光物质为荧光团的荧光共振能量转移(fluorescence resonance energy transfer, FRET)和荧光内率效应(inner filter effect, IFE)。表面修饰Ag NPs构建荧光生物传感器的制备在生物标记、生物传感、环境检测等领域有着广阔的应用前景[27-29]。
2.1.1.1 表面修饰Ag NPs荧光探针生物传感器
Ag NPs具有依赖尺寸的荧光性能,其中银纳米簇(1~10 nm)相较于大尺寸的Ag NPs具有独特的荧光性能,可作为一种选择性和敏感的荧光探针用于重金属离子等的快速检测。MAKWANA等[30]利用八甲氧基间苯二酚[4]四肼芳烃(octa-O-methoxy resorcin[4]arene tetrahydrazide, OMRTH)还原修饰制备尺寸为3~7 nm的银团簇,OMRTH-Ag NPs作为荧光探针,通过荧光猝灭的方式进行镉离子定性检测的荧光探针生物传感器。镉离子与OMRTH的络合诱导Ag NPs的聚集,通过荧光强度的变化检测工业废水中的镉离子。MAKWANA等[31]同样利用苯二酚环芳烃聚酰肼(calix[4]resorcinarene polyhydrazide, CPH)标记Ag NPs检测Fe3+。CPH-Ag NPs具有荧光性能,但Fe3+的存在会专一性的猝灭CPH-Ag NPs的荧光,以此实现Fe3+的检测。
2.1.1.2 FRET生物传感器
FRET为一种非辐射的能量转移过程,即能量从受激供体分子转移到受体分子的物理过程。在FRET过程中,供体分子的发射光谱与受体的吸收光谱有明显重叠,且供受体之间的距离在1~10 nm时,供体激发产生的荧光能量转移到受体,同时供体本身的荧光强度减弱(荧光猝灭)。供体分子包括荧光素、罗丹明、量子点等物质。Ag NPs具有较高的消光系数不但可以提高荧光能量转移的效率,而且可以明显扩大供受体之间的有效距离,故Ag NPs常作为FRET过程中的受体(图2)。当分析物加入供体-Ag NPs能量转移体系时,分析物与功能化Ag NPs表面的基团结合,Ag NPs聚集,供体与Ag NPs光谱重叠减少,供体的荧光恢复[32]。基于分析物表面修饰Ag NPs的特异性结合,利用供体-Ag NPs之间的FRET可实现分析物高灵敏、高选择性的检测。WANG等[33]研究了噻唑吡啶酸(5-oxo-5H-thiazolo[3,2-a]pyridine-7-carboxylic acid, TPCA)/环糊精修饰(β-CD@Ag NPs)能量转移体系,并利用该体系建立了测定有机磷农药(organophosphate, OP)的新方法。OP的加入使TPCA/β-CD@Ag NPs体系发生荧光恢复,且OP的浓度与体系荧光恢复强度在一定范围内有良好的线性关系,据此建立了TPCA/β-CD@Ag NPs-OP体系测定痕量OP的方法。

图2 基于功能化Ag NPs构建FRET传感器检测 分析物的方法示意图
Fig.2 Schematic representation of constructing FRET sensor to detect analyte by functionalized Ag NPs
2.1.1.3 IFE生物传感器
IFE为一种辐射能量转移模型,其作用机理是荧光供体受到激发或(和)发射波长处的荧光能量被共存荧光受体吸收,荧光供体是荧光强度减弱的现象。通过IFE检测分析物,无需对荧光供体进行复杂修饰,且不受供受体距离的限制,应用范围更广。IFE检测分析物的传感模型分为turn-on模型、turn-off模型以及ratiometric fluorescence assay模型。在turn-on检测模型中,首先荧光受体吸收系统的荧光,然后随着分析物的加入荧光逐渐恢复。turn-off模型检测是基于荧光受体的吸收能力随分析物浓度的增加而增强,导致荧光受体的荧光衰减。ratiometric fluorescence assay模型是随着分析物加入同时测定一个激发波长上两种波长的光致发光强度。表面功能化Ag NPs具有高的消光系数,常作为IFE系统中turn-on检测模型的荧光受体,可实现分析物低检出限、高灵敏度的检测(图3)。WANG等[34]制备半胱胺盐酸盐修饰的Ag NPs作为能量供体探针,CDs为能量受体探针,构建了一种基于IFE的传感器用于检测草甘膦。基于IFE效应,Ag NPs可以抑制CDs的荧光强度。草甘膦的负电荷通过静电作用诱导半胱氨盐酸盐-Ag NPs聚集,CDs的荧光恢复。

图3 基于功能化Ag NPs构建IFE传感器检测 分析物的方法示意图
Fig.3 Schematic representation of constructing IFE sensor to detect analyte by functionalized Ag NPs
2.1.2 表面修饰Ag NPs构建比色生物传感器
Ag NPs具有光吸收性能,随着分析物的加入发生聚集或分散而呈现不同的光学特性,以反应中溶液颜色的变化作为信号输出,从而实现可视化的现场检测。Ag NPs胶体溶液颜色的变化是粒子间表面等离子体共振耦合的结果,随着粒子间距的减小,等离子体耦合效应增强,导致(localised surface plasmon resonance, LSPR)在UV-vis光谱上的红移以及颜色的变化。Ag NPs对分析物的亲和力和选择性受Ag NPs表面功能化配体和官能团性质的控制,利用表面修饰Ag NPs作为比色探针构建的比色生物传感器包括聚集法比色生物传感器和反聚集法比色生物传感器[35-37]。
2.1.2.1 聚集法比色生物传感器
通常情况下,稳定、单分散状态的Ag NPs胶体溶液呈现亮黄色,分析物与Ag NPs表面修饰的DNA、蛋白质、多肽等分子之间可以通过静电相互作用、氢键等作用力促使Ag NPs发生聚集,导致胶体溶液颜色变为红色,通过裸眼观察体系颜色的变化或根据分光光度计检测溶液吸光度的方法对分析物进行定性定量分析(图4)。基于表面修饰Ag NPs构建聚集法比色生物传感器在食品添加剂、金属离子、非法添加剂等领域已得到广泛应用[38]。
MINH等[39]合成氧化石墨烯纳米片包裹的Ag NPs(Ag@rGO)用于Cr离子的比色检测。其原理为pH=2~5时,HCrO4—与rGO表面的正电荷通过静电力以及阴离子—π键相互作用,诱导Ag@rGO的聚集。
除了重金属离子,水体和食品中维生素、亚硝酸盐的快速定量分析也至关重要。KHALKHO等[40]通过合成带有负电荷的L-半胱氨酸修饰的Ag NPs与带有正电荷的维生素B1发生强烈的静电相互作用,Ag NPs发生聚集,导致Uv-vis光谱中LSPR的红移以及颜色的变化,从而实现食品以及水样品中维生素B1的可视化快速灵检测。IBRAHIM等[41]通过合成对氨基苯甲酸(para-amino benzoic acid, PABA)修饰的Ag NPs实现不同水样中亚硝酸盐含量的测定。
此外,SHRIVAS等[42]利用蔗糖修饰的Ag NPs高度立体选择性地检测食品中杀虫剂(异狄氏剂)。异狄氏剂分子通过内位的氧原子选择性的附着在Ag NPs表面,Ag NPs溶液的颜色发生变化,但外位含氧的异构体分子(狄氏剂)却不能使蔗糖—Ag NPs聚集。利用该方法对异狄氏剂的检出限为0.015 mg/mL。
2.1.2.2 反聚集法比色生物传感器
在聚集法比色生物传感器基础上引入反聚集剂构建了反聚集法比色生物传感器。在反聚集法比色生物传感器中,聚集剂诱导Ag NPs团聚,导致溶液颜色变为红色,紫外吸收峰红移(图5)。当反聚集剂(分析物)加入后,反聚集剂和Ag NPs竞争性的与聚集剂发生反应。由于反聚集剂可以特异性识别聚集剂或与聚集剂的作用力强于Ag NPs,反聚集剂与聚集剂反应后,只有少量的聚集剂与Ag NPs反应或聚集剂丧失了诱导Ag NPs聚集的能力,Ag NPs的聚集度减少,颜色逐渐恢复为亮黄色[43]。利用Ag NPs的反聚集比色法用于重金属离子的检测被不断报道。6-硫鸟嘌呤作为富含硫基的聚集剂与Ag NPs通过形成Ag-SH共价键取代表面的柠檬酸根,Ag NPs发生聚集。Hg2+作为抗聚集剂,与6-硫鸟嘌呤的作用力强于Ag NPs。6-硫鸟嘌呤与Hg2+反应后,6-硫鸟嘌呤失去了诱导Ag NPs的能力,Ag NPs溶液的颜色逐渐恢复为亮黄色。在整个实验过程中,Hg2+作为抗聚集剂,能够使6-硫鸟嘌呤诱导的Ag NPs的聚集度减少,从而实现对水样品中Hg2+的痕量检测[44]。

图4 功能化Ag NPs聚集比色法检测分析物的示意图
Fig.4 Schematic representation of detection of analytes by functionalized Ag NPs aggregation colorimetry
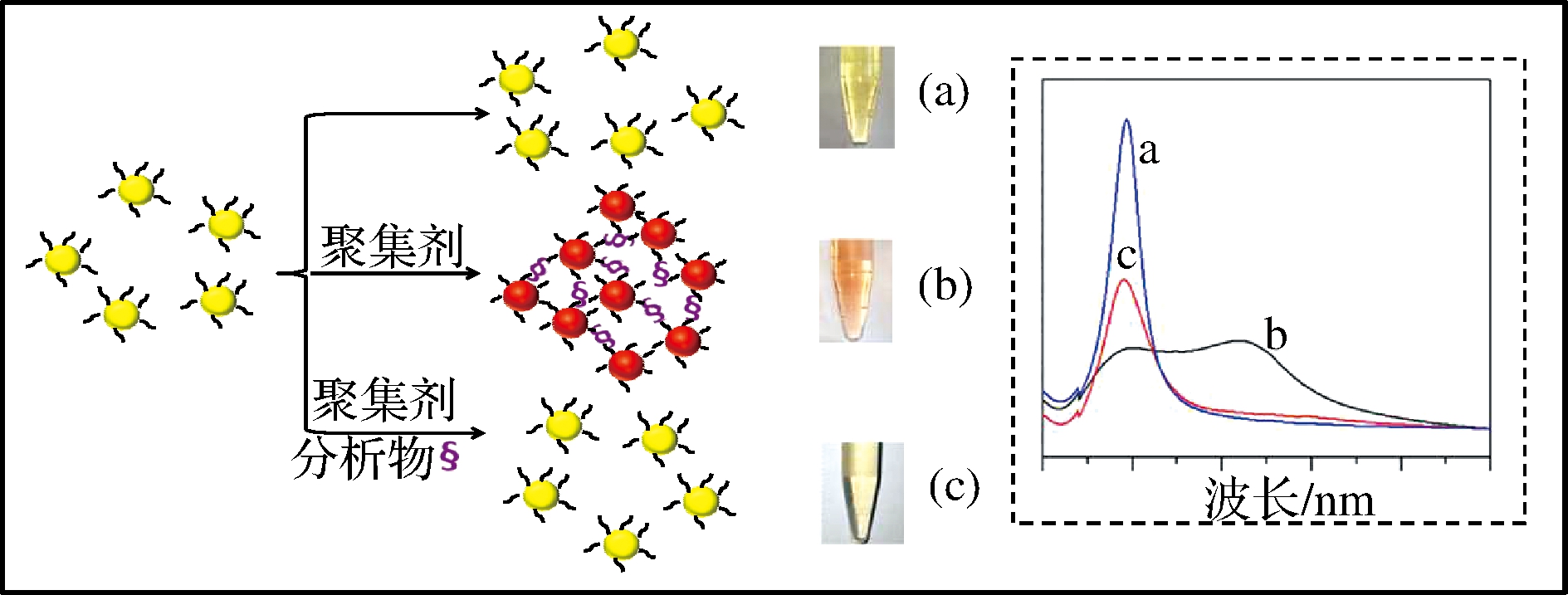
a-Ag NPs;b-Ag NPs/6-硫鸟嘌呤;c-Ag NPs/6-硫鸟嘌呤/Hg2+
图5 功能化Ag NPs反聚集比色法检测分析物的方法原理图
Fig.5 Schematic representation of detection of analytes by functionalized Ag NPs anti-aggregation colorimetry
2.2 基于表面修饰Ag NPs构建电化学免疫生物传感器
Ag NPs因其本身具有的特性,在电化学免疫传感器中发挥着重要的作用[45]。表面修饰基团可以通过静电相互作用与带相反电荷的识别分子结合或形成例如Ag—SH等稳定的共价键使识别分子牢固在电极上,增加了识别分子的特异性吸附量,传感器的检测灵敏度大幅提高;Ag NPs具有很好的导电性能,在电化学免疫传感器中可以将电极与生物分子之间连接起来,加快电子的转移速率,起到信号放大作用;此外,Ag NPs具有高的电化学催化性能及活性,对过氧化氢具有很好的催化效应。因此,Ag NPs在电化学免疫传感器中已得到广泛的研究。KHESUOE等[46]合成Ag NPs掺杂聚苯胺(polyaniline, PANI)的复合纳米材料,将其修饰在玻碳电(glassy carbon electrode, GCE)表面形成GCE/ PANI/Ag NPs复合材料,通过与戊二醛(glutaraldehyde, GA)共价键固定多克隆抗多氯联苯(polychlorinated biphenyls, PCB)抗体(antibody, Ab),建立了一种检测水和果汁中多氯联苯的电流型免疫传感器。ABBASPOUR等[47]报道了一种检测水中金黄色葡萄球菌(Staphylococcus aureus)的双适配体夹心免疫传感器。其中,初级适配体是固定在作为亲和配体载体的磁珠(magnetic beads, MB)表面用于捕获S.aureus,用于信号放大的Ag NPs结合的次级适配体(magnetic beads, MB)提供了明确的电化学特性,最后在MB表面形成Apt/S.aureus/apt—Ag NPs的夹层复合物,显著提高了传感器的灵敏度,最后通过伏安法得到的计算结果与与平板计数法相一致。
2.3 基于表面修饰Ag NPs构建表面等离子体共振生物传感器
表面等离子体共振(surface plasmon resonance, SPR)传感器是基于金属与电解质之间一种特殊的光学特性,即表面等离子体共振而建立的一种广泛应用于免疫分析、疾病诊断、食品分析等领域的传感器。与荧光等其他方法相比,SPR传感器具有无需标记样品、复杂的样品前处理过程、应用范围广等优点。在SPR传感器中,光源提供在一定波长范围内具有良好光强度、连续的发射光;由棱镜和金属薄层构成的传感芯片是SPR传感器的核心器件,光通过棱镜折射进而衰变全反射、金属薄层在检测系统中用于键合靶分子(图6)。此外,光学检测系统、流通池、数据处理分析系统也是SPR传感器的重要组成部分。在SPR传感器中,被测物质(靶分子)键合在传感芯片上,含有能与被测物质相互作用的生物分子(分析物)的溶液流经传感器表面后,被测物质与分析物发生反应引起被测物质的结构和厚度发生相应的变化,进而折射指数按同样比例增加。SPR传感器产生与分析物表面质量呈线性关系的光学信号,进而测定样品中分析物的含量[48-49]。Ag NPs具有局部表面等离子体共振效应以及催化活性,应用于SPR传感器中不但可以作为功能性的纳米探针而且与金属薄膜间可通过表面等离子体的共振耦合引起共振角的位移增强,进而增强SPR传感器的信号强度,提高SPR传感器的灵敏度。ZHOU等[50]通过合成Ag NPs-rGO纳米复合材料制备出用于检测水样品和果汁中大肠杆菌的SPR传感器。辅助信号放大作用的Ag NPs-rGO固定在光纤表面并通过化学法覆盖一层金膜,抗肽菌蛙皮素作为识别原件固定在金膜表面,能特异性的捕获大肠杆菌,该传感器展现了良好的灵敏度、特异性和重现性。WANG等[51]以改性壳聚糖(modified chitosan, MCS)薄膜为活性层,优化银/金(Ag/Au)复合膜为基础,研制了一种快速检测铜离子(Cu2+)的可重复使用 SPR传感器。MCS膜在吸附Cu2+前后具有良好的稳定性,灵敏度可达到1.8×10-8,实现Cu2+的痕量检测。

图6 NPs SPR传感器相应机制
Fig.6 Mechanism of functionalized Ag NPs surface plasmon resonance sensor
表2 表面功能化的Ag NPs在生物传感器中的应用
Table 2 Ag NPs of surface functionalization and their application in biosensors

应用概念优点 荧光生物传感器荧光生物传感器是以荧光信号为检测对象,通过荧光增强、猝灭或发射波长的移动进行定性或定量分析的方法灵敏度高、专一性强比色生物传感器比色生物传感器Ag NPs具有光吸收性能,随着分析物的加入发生聚集或分散而呈现不同的光学特性,以反应中溶液颜色的变化作为信号输出,从而实现可视化的现场检测快速、灵敏、可视化检测 电化学免疫生物传感器表面修饰基团可以通过静电相互作用与带相反电荷的识别分子结合或形成例如Ag—SH等稳定的共价键使识别分子牢固在电极上,增加了识别分子的特异性吸附量,传感器的检测灵敏度大幅提高 灵敏度高等离子体共振生物传感器表面等离子体共振传感器是基于金属与电解质之间一种特殊的光学特性即表面等离子体共振而建立的一种广泛应用于免疫分析、疾病诊断、食品分析等领域的传感器样品前处理简单,应用范围广
3 总结和展望
Ag NPs具有独特光学、磁学、电学特性,在环境、生物医药等领域得到广泛的应用。为了赋予Ag NPs 丰富的表面性质,扩宽Ag NPs的应用范围,Ag NPs的表面功能化显得尤为重要。Ag NPs的可修饰性为其表面功能化提供了良好的平台,Ag NPs的功能化不仅稳定Ag NPs,而且提供了通过配位反应与分析物相互作用的可能性,尤其应用表面功能化Ag NPs构建生物传感器方面取得了很多重要的成果。近年来,Ag NPs功能化的方法已经取得快速的发展,但为了充分发挥Ag NPs独特的性质,扩宽纳米生物传感器的应用领域,仍需研发和完善新的修饰方法。随着Ag NPs研究的不断深入,功能化方法的不断完善,功能化Ag NPs生物传感器在未来的生物成像、食品检测、环境监测、生物医药等领域应用会越来越广。
[1] 张文毓.纳米生物传感器的研究进展[J].传感器世界,2013,19(5):7-12.
ZHANG W Y.Research progress of nano biosensors[J].Sensor World,2013,19(5):7-12.
[2] 眭翔,辛改芳.纳米生物传感技术在医疗中的应用[J].传感器与微系统,2021,40(6):1-4;15.
SUI X, XIN G F. Application of nano-biosensor technology in medicine[J]. Transducer and Microsystem Technologies, 2021, 40(6):1-4;15.
[3] NAKAMURA S, SATO M, SATO Y, et al.Synthesis and application of silver nanoparticles (Ag NPs) for the prevention of infection in healthcare workers[J].International Journal of Molecular Sciences, 2019, 20(15):3620.
[4] SONG W, ZHAO B, WANG C, et al.Functional nanomaterials with unique enzyme-like characteristics for sensing applications[J].Journal of Materials Chemistry B, 2019, 7(6):850-875.
[5] 吴芳芳.功能化纳米材料的制备及其在电致化学发光生物传感器中的应用[D].重庆:西南大学,2018.
WU F F.Preparation of functionalized nanomaterials and its application in electrochemiluminescence biosensor [D].Chongqing:Southwest University,2018.
[6] 何颖.金属纳米材料和功能化的碳纳米材料在生物传感器中的应用研究[D].重庆:西南大学,2015.
HE Y.Application of metal nanomaterials and functionalized carbon nanomaterials in biosensors [D].Chongqing:Southwest University,2015.
[7] KAKKAR R, SHERLY E D, MADGULA K, et al.Synergetic effect of sodium citrate and starch in the synthesis of silver nanoparticles[J].Journal of Applied Polymer Science, 2012, 126(S1):E154-E161.
[8] PENG H, YANG A, XIONG J.Green, microwave-assisted synthesis of silver nanoparticles using bamboo hemicelluloses and glucose in an aqueous medium[J].Carbohydrate Polymers, 2013, 91(1):348-355.
[9] MOHAMMADI S, KHAYATIAN G.Colorimetric detection of biothiols based on aggregation of chitosan-stabilized silver nanoparticles[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2017, 185:27-34.
[10] XIONG D J, CHEN M L, LI H B.Synthesis of para-sulfonatocalix [4] arene-modified silver nanoparticles as colorimetric histidine probes[J].Chemical Communications, 2008 (7):880-882.
[11] SHARMA P, MOURYA M, CHOUDHARY D, et al.Thiol terminated chitosan capped silver nanoparticles for sensitive and selective detection of mercury (Ⅱ) ions in water[J].Sensors and Actuators B:Chemical, 2018, 268:310-318.
[12] JUNG J M, KIM C, HARRISON R G.A dual sensor selective for Hg2+ and cysteine detection[J].Sensors and Actuators, B:Chemical,2018,255:2 756-2 763.
[13] KWON D, YOO H, LEE H, et al.Colorimetric detection of penicillin G in milk using antibody-functionalized dendritic platinum nanoparticles[J].Sensors and Actuators B:Chemical, 2018, 255:552-556.
[14] ULAR N, ÜZER A, DURMAZEL S, et al.Diaminocyclohexane-functionalized/thioglycolic acid-modified gold nanoparticle-based colorimetric sensing of trinitrotoluene and tetryl[J].ACS sensors, 2018, 3(11):2 335-2 342.
[15] ENSAFI A A, KAZEMIFARD N, REZAEI B.A simple and sensitive fluorimetric aptasensor for the ultrasensitive detection of arsenic (Ⅲ) based on cysteamine stabilized CdTe/ZnS quantum dots aggregation[J].Biosensors and Bioelectronics, 2016, 77:499-504.
[16] HUANG Z M, CAI Q Y, DING D C, et al.A facile label-free colorimetric method for highly sensitive glutathione detection by using manganese dioxide nanosheets[J].Sensors and Actuators B:Chemical, 2017, 242:355-361.
[17] KAWAI K, KAWAKAMI H, NARUSHIMA T, et al.Selective and reactive hydration of nitriles to amides in water using silver nanoparticles stabilized by organic ligands[J].Journal of Nanoparticle Research, 2015, 17(2):60.
[18] GUZM N-SOTO I, OMOLE M, ALARCON E I, et al.Lipoic acid capped silver nanoparticles:A facile route to covalent protein capping and oxidative stability within biological systems[J].RSC Advances, 2020, 10(54):32 953-32 958.
N-SOTO I, OMOLE M, ALARCON E I, et al.Lipoic acid capped silver nanoparticles:A facile route to covalent protein capping and oxidative stability within biological systems[J].RSC Advances, 2020, 10(54):32 953-32 958.
[19] MEHTA V N, MUNGARA A K, KAILASA S K.Dopamine dithiocarbamate functionalized silver nanoparticles as colorimetric sensors for the detection of cobalt ion[J].Analytical Methods, 2013, 5(7):1 818-1 822.
[20] ZHANG S Y, HU R, LI H B.Glutathione modified Ag nanoparticles as efficient detector for pyrimethanil[J].Nanotechnology, 2019, 30(11):115502.
[21] ABDEL-MOHSEN A M, ABDEL-RAHMAN R M, FOUDA M M G, et al.Preparation, characterization and cytotoxicity of schizophyllan/silver nanoparticle composite[J].Carbohydrate Polymers, 2014, 102:238-245.
[22] WEN Y, GEITNER N K, CHEN R, et al.Binding of cytoskeletal proteins with silver nanoparticles[J].RSC Advances, 2013, 3(44):22 002-22 007.
[23] URYUPINA O Y, URODKOVA E K, ZHAVORONOK E S, et al.Synthesis of monodisperse silver nanoparticles in chitosan solutions[J].Colloid journal, 2019, 81(2):194-198.
[24] CHENG Y L, LI H, FANG C Q, et al.Facile synthesis of reduced graphene oxide/silver nanoparticles composites and their application for detecting heavy metal ions[J].Journal of Alloys and Compounds, 2019, 787:683-693.
[25] LIU Y F, TSAI J J, CHIN Y T, et al.Detection of allergies using a silver nanoparticle modified nanostructured biosensor[J].Sensors and Actuators B:Chemical, 2012, 171:1 095-1 100.
[26] ZHONG J F, XU L, QIN X L.Efficient antibacterial silver nanoparticles composite using lignin as a template[J].Journal of Composite Materials, 2015, 49(19):2 329-2 335.
[27] 马琳. 免标记型荧光传感器的构建及其在生物标志物检测中的应用[D].曲阜:曲阜师范大学,2019.
MA L.Construction of label-free fluorescence sensor and its application in biomarker detection[D].Qufu:Qufu Normal University,2019.
[28] 王瑞平. 几种荧光纳米材料的合成及在传感分析中的应用研究[D].太原:山西大学,2020.
WANG R P.Synthesis of several fluorescent nanomaterials and their application in sensing analysis [D].Taiyuan:Shanxi University,2020.
[29] 冯婷婷. 纳米荧光生物传感器研究进展及应用[J].生物化工,2017,3(6):78-81.
FENG T T.Research progress and application of nano fluorescence biosensor[J].Biological chemical Engineering,2017,3(6):78-81.
[30] MAKWANA B A, VYAS D J, BHATT K D, et al.Novel fluorescent silver nanoparticles:Sensitive and selective turn off sensor for cadmium ions[J].Applied Nanoscience, 2016, 6(4):555-566.
[31] MAKWANA B A, VYAS D J, BHATT K D, et al.Highly stable antibacterial silver nanoparticles as selective fluorescent sensor for Fe3+ ions[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 134:73-80.
[32] LI W J, LIU C, LIU D, et al.Ratiometric fluorescent sensing of mercury (Ⅱ) ion based on the Pt nanozyme-triggered fluorescence resonance energy transfer between Si quantum dots and 2, 3-diaminophenazine[J].Sensors and Actuators A:Physical, 2021, 331:112976.
[33] WANG M, SU K, CAO J, et al.“Off-On” non-enzymatic sensor for malathion detection based on fluorescence resonance energy transfer between β-cyclodextrin@ Ag and fluorescent probe[J].Talanta, 2019, 192:295-300.
[34] WANG L, BI Y D, HOU J, et al.Facile, green and clean one-step synthesis of carbon dots from wool:Application as a sensor for glyphosate detection based on the inner filter effect[J].Talanta, 2016, 160:268-275.
[35] 魏晨崴,曹暾.基于α-MoO3的可调谐法布里-珀罗谐振腔比色生物传感器[J].物理学报,2021,70(4):373-381.
WEI C W, CAO T.α-MoO3 based tunable Fabry-Pérot cavity colormeteric biosensor[J].Acta Physica Sinica, 2021,70(4):373-381.
[36] KHORIS I M, TAKEMURA K, LEE J, et al.Enhanced colorimetric detection of norovirus using in situ growth of Ag shell on Au NPs[J].Biosensors and Bioelectronics, 2019, 126:425-432.
[37] RASTOGI L, SASHIDHAR R B, KARUNASAGAR D, et al.Gum kondagogu reduced/stabilized silver nanoparticles as direct colorimetric sensor for the sensitive detection of Hg2+ in aqueous system[J].Talanta, 2014, 118:111-117.
[38] PING H, ZHANG M W, LI H K, et al.Visual detection of melamine in raw milk by label-free silver nanoparticles[J].Food Control, 2012, 23(1):191-197.
[39] MINH P N, HOANG V T, DINH N X, et al.Reduced graphene oxide-wrapped silver nanoparticles for applications in ultrasensitive colorimetric detection of Cr (ⅵ) ions and the carbaryl pesticide[J].New Journal of Chemistry, 2020, 44(18):7 611-7 620.
[40] KHALKHO B R, KURREY R, DEB M K, et al.L-cysteine modified silver nanoparticles for selective and sensitive colorimetric detection of vitamin B1 in food and water samples[J].Heliyon, 2020, 6(2):e03423.
[41] IBRAHIM M H, XUE Z H, ABDU H I, et al.Sensitive and selective colorimetric nitrite ion assay using silver nanoparticles easily synthesized and stabilized by AHNDMS and functionalized with PABA[J].Nanoscale Advances, 2019, 1(3):1 207-1 214.
[42] SHRIVAS K, WU H F.Applications of silver nanoparticles capped with different functional groups as the matrix and affinity probes in surface-assisted laser desorption/ionization time-of-flight and atmospheric pressure matrix-assisted laser desorption/ionization ion trap mass spectrometry for rapid analysis of sulfur drugs and biothiols in human urine[J].Rapid Communications in Mass Spectrometry:RCM, 2008, 22(18):2 863-2 872.
[43] PINYOROSPATHUM C, RATTANARAT P, CHAIYO S, et al.Colorimetric sensor for determination of phosphate ions using anti-aggregation of 2-mercaptoethanesulfonate-modified silver nanoplates and europium ions[J].Sensors and Actuators B:Chemical, 2019, 290:226-232.
[44] DUAN J L, YIN H Z, WEI R R, et al.Facile colorimetric detection of Hg2+ based on anti-aggregation of silver nanoparticles[J].Biosensors and Bioelectronics, 2014, 57:139-142.
[45] 杨玉晓. 银纳米粒子构建电化学免疫传感器的研究[D].石河子:石河子大学, 2019.
YANG Y X.Study on electrochemical immunosensor constructed by Silver nanoparticles [D].Shihezi:Shihezi University, 2019.
[46] KHESUOE M P, OKUMU F O, MATOETOE M C.Development of a silver functionalised polyaniline electrochemical immunosensor for polychlorinated biphenyls[J].Analytical Methods, 2016, 8(39):7 087-7 095.
[47] ABBASPOUR A, NOROUZ-SARVESTANI F, NOORI A, et al.Aptamer-conjugated silver nanoparticles for electrochemical dual-aptamer-based sandwich detection of Staphylococcus aureus[J].Biosensors and Bioelectronics, 2015, 68:149-155.
[48] QU J H, DILLEN A, SAEYS W, et al.Advancements in SPR biosensing technology:An overview of recent trends in smart layers design, multiplexing concepts, continuous monitoring and in vivo sensing[J].Analytica Chimica Acta, 2020, 1 104:10-27.
[49] ARGHIR I, DELPORT F, SPASIC D, et al.Smart design of fiber optic surfaces for improved plasmonic biosensing[J].New Biotechnology, 2015, 32(5):473-484.
[50] ZHOU C, ZOU H M, LI M, et al.Fiber optic surface plasmon resonance sensor for detection of E.coli O157:H7 based on antimicrobial peptides and AgNPs-rGO[J].Biosensors and Bioelectronics, 2018, 117:347-353.
[51] WANG W H, ZHOU X L, WU S X, et al.Reusable surface plasmon resonance sensor for rapid detection of Cu2+ based on modified-chitosan thin film as an active layer[J].Sensors and Actuators A:Physical, 2019, 286:59-67.