白芨(Bletilla striata)是兰科植物白芨的干燥块茎,主要分布于我国东南三省潮湿的山谷及沿海地区,除我国之外,白芨在全球分布较少,仅种植于朝鲜半岛、日本、缅甸等[1]。白芨在我国已有千年历史,中医认为白芨性苦、涩、甘、微寒,归肺、肝、胃经,具有止血、消炎、生肌、促进组织再生等作用[2]。现代研究表明,白芨具有多种药理活性,包括抗氧化、抗炎、止血愈合、抗纤维化和体外免疫调节活性等[3]。白芨富含多种活性成分,如多糖、黄酮、皂苷、菲类、联苄类及其他化学物质,在所有的活性成分中,多糖是各种生物功能的主要活性成分[4]。从白芨中提取出的白芨多糖(Bletilla striata polysaccharide,BSP),采用不同纯化方法分离的白芨多糖已被证实是具有不同结构功能的生物大分子[5]。白芨多糖在治疗皮肤皲裂、预防皮肤冻伤、加速皮肤恢复、改善血液循环、增强免疫活性、伤口敷料和药物输送等方面得到广泛关注[3,6-7],因此,白芨多糖被广泛应用于食品和医药行业。尽管白芨多糖具有很高的应用价值,但至今也没有文章对白芨多糖提取、纯化以及结构特性和生物活性研究成果进行全面总结。
本文主要对白芨多糖的提取、纯化技术以及结构和药理作用进行全面综述,并进一步阐明白芨多糖的结构和生物活性之间的关系,为白芨多糖在生物医药领域的开发利用提供参考。
1 提取和纯化
在一定温度下水提取是实验室乃至工业提取的经典方法,也是最方便的方法[8-9]。提取时间和提取温度对多糖提取率有较大影响,且提取料液比(g∶mL)一般为1∶5~1∶50。不同的提取条件,如原料的来源、提取温度、提取时间、提取料液比、提取溶剂等因素对白芨多糖提取率有显著影响[3,10-11]。表1总结了近年来白芨多糖的提取方法。
表1 白芨多糖提取方法
Table 1 Extraction method of polysaccharide from Bletilla striata

序号时间/h温度/℃料液比(g∶mL)其他条件提取率/%参考文献14.1791∶104提取1次4.2[12]231001∶34提取3次26.44[13]30.83501∶35超声功率400 W8.18[14]41.5601∶15提取4次75.22[15]53901∶15先冷水浸提6 h28.43[16]61.3301∶30超声功率126 W,表面活性剂聚乙二醇0.1 g21.81[17]70.83601∶50超声功率400 W,提取2次26.02[18]82.5751∶53红外辅助提取43.95[19]90.2801∶25超声500 W,提取3次60.81[20]10352-果胶酶添加12%64.8[21]110.083-1∶63聚乙二醇(polyethylene glycol,PEG)-400(PEG400)质量浓度5 g/L,微波功率504 W,pH 732.48[22]
注:-表示无数据(下同)
董建新等[13]采用响应面优化优化提取白芨多糖,得到最优提取条件为料液比1∶34,提取温度100 ℃,提取时间3 h,在此条件下多糖最终得率达到20.44%。然而,与其他方法相比,热水浸提存在耗时、效率低等缺点。为了提高白芨多糖的提取率,还采用了现代技术辅助提取,如超声波[14,18,20]、微波[22]和红外[19]辅助提取,来破坏白芨细胞壁结构。例如,何晓梅等[18]采用超声辅助提取白芨多糖提高多糖提取效率,得到最佳提取条件为:超声功率400 W、提取温度60 ℃、时间50 min、料液比(g∶mL)1∶50提取2次,此时白芨多糖提取率增加到26.02%。为了最大限度提高白芨多糖提取率,有研究探索了微波辅助提取,最佳提取条件为:微波功率504 W、提取时间5 min、料液比1∶63、PEG400浓度5 g/L,此时多糖提取率为32.48%[22]。此外,基于响应面设计的红外辅助提取可以大幅度提高多糖提取率,多糖最佳提取条件为:提取温度75 ℃、提取时间2.5 h、料液比1∶53,提取率达到43.95%[19]。综上所述,利用上述辅助提取方法有助于缩短提取时间,增加提取效率。
为了研究白芨多糖的组成、分子质量和基本化学结构,还需对粗多糖进一步纯化。目前主要的纯化方法是柱层析结合各种吸附剂和洗脱剂,在洗脱过程中含有多糖的部分被收集、透析、浓缩和冷冻干燥,以得到纯净的多糖[23]。采用离子交换树脂法(DEAE-Cellulose、DEAE-Sepharose Fast Flow)利用盐梯度将中性多糖从酸性多糖中分离出来,而凝胶过滤色谱(Sephadex-G、Sephacryl-S、Bio-Gel P column)根据多糖分子质量的不同将多糖分离出来[24-25]。例如,WANG等[26]采用DEAE-Cellulose-52 column(3 cm×55 cm),将中性多糖分离出来,又经Sephadex G-200 column (1 cm×100 cm)进一步纯化,得到2种均一的多糖BSP-1和BSP-2,平均分子质量分别为83.54 kDa和12.60 kDa。
从白芨中分离纯化白芨多糖方法如图1所示,将白芨块茎干燥、粉碎、过筛,然后将白芨粉末在热水中提取,过滤,得到白芨提取物,加入4倍体积的乙醇4 ℃条件下放置过夜,离心得到沉淀,然后复溶,除杂、浓缩、冷冻干燥,得到白芨粗多糖。粗提取物溶解,应用上述不同色谱柱洗脱,收集、透析、浓缩、冷冻干燥得到纯化白芨多糖[3,5,27]。然后采用苯酚-硫酸法[28]和考马斯亮蓝法[29]测定白芨多糖总糖和蛋白质含量。

图1 白芨多糖提取、纯化及生物活性示意图
Fig.1 Schematic representation of the extraction, purification, and bioactivity of polysaccharides from Bletilla striata
2 理化性质及结构特性
植物多糖结构特征包括分子质量、单糖组成、糖苷键的类型、连结位点和连接方式是决定其独特理化性质的关键[30]。目前,对白芨多糖单糖组成和基本化学结构的研究方法主要有红外光谱法、核磁共振法、气相色谱-质谱法、气相色谱、高效液相色谱法、酸水解法、甲基化法、高碘酸氧化法和Smith降解法等[11,16,26,31]。
2.1 分子质量
植物多糖分子质量的测定方法通常采用HPLC和凝胶渗透色谱。陈姿燕[32]采用DEAE-Sepharose Fast Flow凝胶柱对白芨多糖纯化得到2种分子质量分别为328 kDa和91.1 kDa的2种不同组分。WANG等[26]采用Sephadex G-200 Column对白芨多糖纯化得到2种分子质量分别为83.54 kDa和12.60 kDa的2种组分。据研究表明,白芨多糖分子质量一般在104~105Da,且不同的提取条件也会对多糖分子质量产生影响。
2.2 单糖组成
一般情况下,通过酸水解可导致糖苷键断裂,在经过GC和HPLC定量测定多糖单糖组成。如表2所示,大多数的白芨多糖主要是由摩尔比相近的葡萄糖和甘露糖组成,且不同来源、不同提取方法得到的多糖单糖组成不同[5]。WANG等[26]从白芨多糖中分离出2种组分BSP-1和BSP-2,用GC分析单糖组成,结果如表2所示。不同的白芨多糖在不同的摩尔比下可能具有相似的单糖组成。
2.3 化学结构
除了单糖组成和分子质量之外,白芨多糖的结构或构象信息已得到证实,如表2所示,白芨多糖是一种葡甘聚糖[3,5]。早在1993年发表的一篇文章首先报道了白芨多糖中含有摩尔比为1∶3葡萄糖和甘露糖,其主链由1,4-吡喃糖基残基组成[38]。此外,通过甲基化、GC-MS、傅里叶变换红外光谱、核磁共振法对白芨多糖(BSP-2)的结构特征进行研究。结果表明,BSP-2的主要结构为→4)-β-D-Glcp(1→4)-β-D-Manp(1→4)- β-D-Manp(1→4)-β-D-Manp(1→,如图2-C所示[26]。PENG等[34]采用化学分析和仪器分析相结合的方法,确定了白芨多糖(BSPF2)的一级结构,分子质量为2.35×105 Da;单糖组成由摩尔比为9.4∶2.6∶1.0的甘露糖、葡萄糖和半乳糖组成;主链结构由摩尔比为2∶1的(1→4)-Manp 和(1→4)-Glcp组成。如图2所示,白芨多糖组成的结构由直链和支链2种类型以不同比例的甘露糖和葡萄糖组成[3]。
2.4 高级结构
多糖生物活性与其分子质量、化学结构和高级结构密切相关。因此,白芨多糖高级结构表征必不可少,这有助于深入探究多糖构效关系。QU等[19]研究发现,白芨多糖水溶液的最大吸收波长(503~512 nm)的偏移比不含白芨多糖的刚果红溶液中(487~498 nm)的偏移要长,这表明白芨多糖表现出三螺旋结构。白芨多糖表面呈疏松的丝状网络结构,在网络结构中还观察到形状不一的空洞,这些可能是由于冰晶在冷冻干燥过程中升华留下的[41]。而且白芨多糖可制备出具有力学性能的纤维,将其编织成具有柔韧性的织物对皮肤创伤的治疗方面具有潜在的应用前景[42]。为进一步确定白芨多糖的高级结构还需其他检测技术,如圆二色谱技术、扫描电子显微镜及原子力显微镜等。
尽管学者在白芨多糖的基本结构表征方面取得了重大进展,但关于其精确结构仍需大量研究。对精确的空间结构的深入研究可以促进白芨多糖作为治疗剂或功能性食品补充剂的发展。因此,开发新型、高效的技术以更好地表征白芨多糖精确结构成为研究方向。
表2 白芨多糖理化特性及药理活性
Table 2 Physicochemical properties and pharmacological activities of polysaccharide from Bletilla striata

序号多糖名称分子质量/kDa单糖组成化学结构生物活性参考文献1BSP-183.54Man、Glc摩尔比为4∶1主链(1→4)-β-Manp免疫调节[26]2BSP-212.6Man、Glc摩尔比为3∶1主链(1→4)-β-Glcp-[26]3BSP373Man、Glc摩尔比为2.946∶1主链(1→4)-β-D-Manp抗炎[33]4BSPF2235Man、Glc、Gal摩尔比为9.4∶2.6∶1主链(1→4)-Manp和(1→4)-Glcp免疫调节[34]5BSPb260Man、Glc摩尔比为1∶3主链(1→2)-Manp和(1→4)-Glcp抗纤维化、抗炎[35-36]6pFSP91Man、Glc、Gal摩尔比为3.45∶1∶2.03主链(1→4)-α-D-Glcp和(1→4)-β-D-Manp和(1→3,6)-β-D-Manp支链(1→6)-β-D-Galp抗氧化[37]7BSP135Man、Glc摩尔比为2.4∶1主链(1→4)-Manp抗炎[38]8BOP493Man、Glc摩尔比为7.88∶2.12主链(1→4)-Manp和(1→4)-Glcp抗肿瘤[39]9BSP-1473Man、Glc摩尔比为8∶1主链(1→4)-β-Manp抗肿瘤[40]
3 生物活性
近年来,植物多糖由于具有多种生物学特性和药理功能,在生物和医学界引起了广泛的关注。无论是对人体健康的有益作用,还是其药理价值,多糖都是白芨中主要的生物活性物质。近年来,细胞实验和动物实验证实白芨多糖具有广泛的生物活性,包括抗氧化、免疫调节、抗炎、止血、抗肿瘤、抗纤维化及胃肠黏膜保护等生物活性,以下是对白芨多糖的多种生物活性和保健作用进行的总结和比较。
3.1 免疫调节
天然多糖作为免疫调节剂或生物反应调节剂,在免疫调节中发挥着重要的生物学作用。多糖的免疫调节活性可能与它们的结构有关,包括分子质量、化学组成和糖苷键[30]。PENG等[34]研究白芨多糖组分BSPF2显著诱导脾细胞增殖,且呈剂量依赖性。刘文立等[43]研究不同剂量白芨多糖对小鼠免疫调节作用的影响,研究表明高剂量的白芨多糖对小鼠胸腺指数、脾脏淋巴细胞活性及脾脏组织中TLR4、MyD88、NF-κB p65蛋白表达水平显著上升,而低剂量的白芨多糖均无显著性差异,可见白芨多糖通过调节免疫作用抑制肿瘤细胞生长。WANG等[26]在环磷酰胺治疗的大鼠中研究了白芨多糖(BSP-1和BSP-2)的免疫调节活性。结果表明,BSP-1和BSP-2对小鼠胸腺指数的抑制率分别为23.5%和3.3%,对免疫功能障碍小鼠脾脏指数的抑制率也有所提高,分别为36.0%和24.4%。BSP-1能显著改善环磷酰胺免疫抑制小鼠的免疫功能,提高小鼠体内胸腺指数。
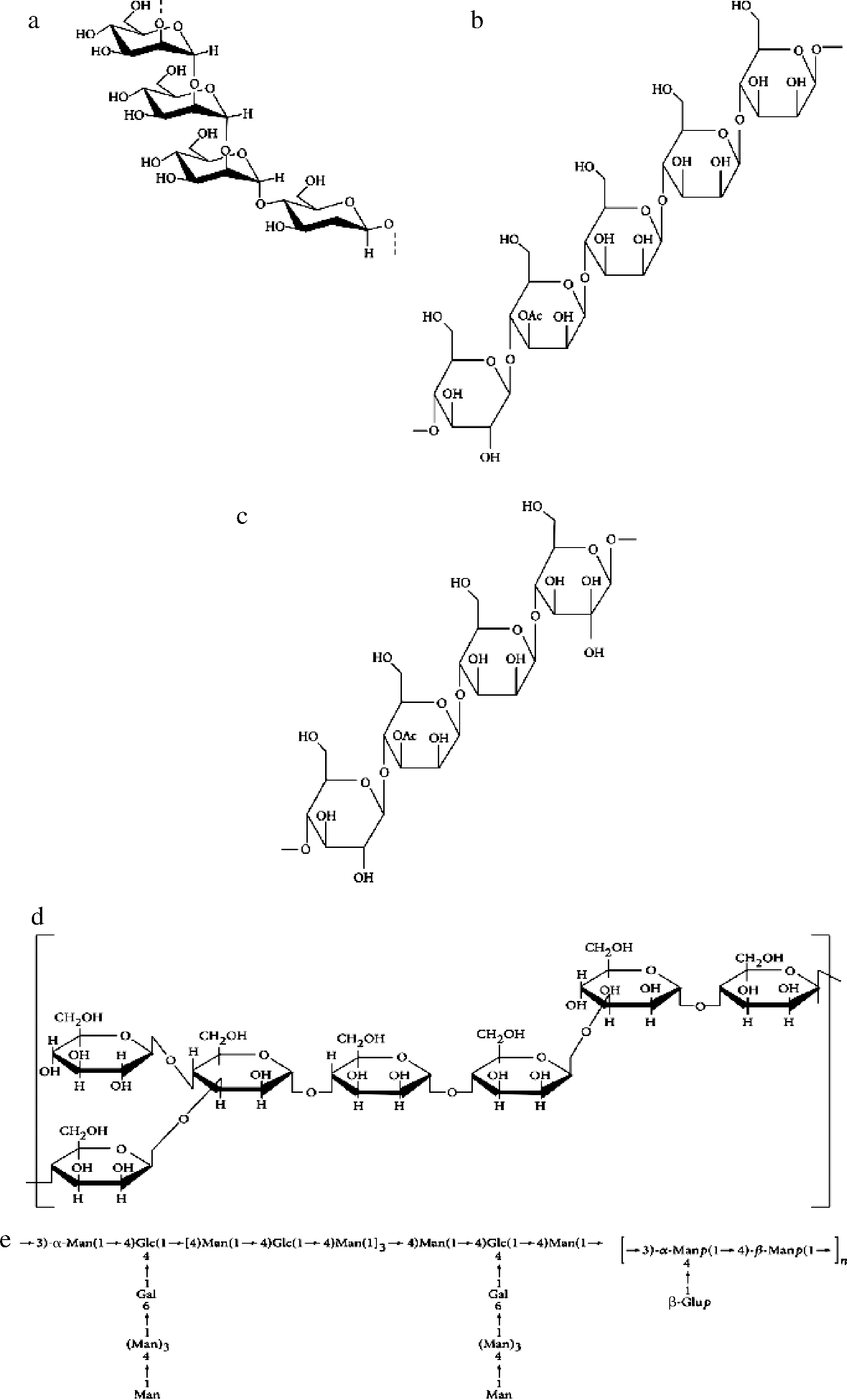
a-BSPb;b-BSP-1;c-BSP-2;d-BSP;e-BSPF2;f-白芨多糖
图2 白芨多糖结构示意图[5]
Fig.2 Schematic structures of Bletilla striata polysaccharides
3.2 抗氧化活性
为了研究中药作为治疗药物的机制,对抗氧化活性的研究是许多研究的重点,其测定方法和活性指标多种多样[44]。植物、真菌和动物的多种生物功能成分都具有很强的抗氧化活性,多糖是其中颇具代表性的一种[45]。
已有研究证明了白芨多糖的体外抗氧化活性,如QU等[19]证实白芨多糖在羟自由基、DPPH自由基、超氧阴离子自由基中具有一定的抗氧化活性。白芨多糖对羟自由基清除率为35.97%,对DPPH自由基清除率为42.20%,对超氧阴离子自由基的清除率为43.70%。此外,吴诗惠等[20]和周美等[46]发现,通过超声波辅助以及酶辅助提取的白芨多糖具有显著的自由基清除能力,且呈现显著的浓度依赖性,但清除能力不同,且均弱于阳性对照。CHEN等[37]研究根须部白芨多糖,发现根须部白芨多糖DPPH和超氧阴离子自由基清除能力为64.47%和72.27%,均高于白芨块茎多糖。然而,关于白芨多糖体内抗氧活化性研究较少。
3.3 抗炎活性
多糖的抗炎作用受许多因素的影响,如分子大小、形态、支化度以及在水中的溶解性。许多研究表明多糖通过调节多种炎症因子,如NO、白细胞介素(interleukin,IL)、干扰素-γ、肿瘤坏死因子(tumor necrosis factor,TNF)等发挥强大的抗炎活性[45]。YUE等[35]研究发现,白芨多糖通过氧化酶和TLR2/My88途径在血管紧张素诱导的人肾小球系膜细胞中具有显著的抗炎和抗氧化活性,有效地阻碍氧化酶和Toll样受体2的表达,从而抑制活性氧和炎性细胞因子的产生。LAI等[31]的研究表明,白芨多糖可显著下调炎症标志物IL-1β、TNF-α、诱生型同工酶、诱导型一氧化氮合酶,上调促炎因子基质金属蛋白酶抑制剂-1和转化生长因子-β(transforming growth factor beta,TGF-β),且其抗炎作用可能与氧化应激调节有关。
3.4 抗纤维化活性
目前只有少数研究证实了白芨多糖直接抗纤维化作用,需大量研究阐明白芨多糖的组成特征和抗纤维化活性。WANG等[36]从白芨根部分离的BSPb对人肾小球系膜细胞的增殖呈显著的浓度依赖性。BSPb对肾纤维化效应具有重要的保护作用,这可能是通过体外下调转化生长因子受体(TGF-β RI和TGF-β RII)和α-平滑肌肌动蛋白导致的。已有研究证实,白芨多糖可以减少细胞募集保护肺组织,使羟脯氨酸含量及胶原的沉淀明显下降,研究证明了白芨多糖通过抑制肺组织羟脯氨酸的表达与分泌来改善肺组织纤维化[47]。
3.5 止血活性
植物多糖的药理研究为药物传递治疗出血、瘀伤和烧伤提供了新的思路。多糖通过不同生长因子促进组织修复,通过诱导巨噬细胞内皮细胞增殖、血管内皮生长因子表达或促炎因子表达产生愈合作用[3]。
早前研究报道了白芨多糖在体外可以上调血管内皮生长因子的表达,促进血管内皮细胞的增殖,伤口愈合的机制可能是白芨多糖通过诱导型一氧化氮合酶、TNF-α、IL-1β的mRNA水平的协同变化,从而增强这些细胞因子的表达,但其对干扰素-γ水平无影响[38,48]。白芨多糖增强了小鼠成纤维细胞的增殖和迁移,显著加速了皮肤缺损损伤模型的创面愈合过程。白芨多糖水凝胶通过TGF-β/Smad信号通路激活,促进创面愈合,促进再生上皮化和胶原沉积[49]。
3.6 胃肠黏膜保护活性
白芨多糖具有保护胃肠黏膜的生物活性,这些多糖可通过不同的生长因子促进组织修复,并通过抑制肠上皮组织中性粒细胞/细胞因子的级联反应而发挥抗炎作用。LUO等[50]发现白芨多糖能够降低硫代乙酰胺诱导的肝硬化大鼠的肠上皮屏障的破坏。研究发现BSP显著降低了内毒素水平,抑制了炎症细胞因子IL-6和TNF-α,提高了闭锁小带蛋白-1和闭合蛋白在紧密连接处的表达,从而改善了细胞间的紧密连接。白芨多糖的胃肠黏膜保护作用机制可能与减轻氧化应激、中性粒细胞浸润以及炎性细胞因子聚集有关。白芨多糖对丝裂原活化蛋白激酶/核因子-κB信号通路激活的抑制作用由其介导,且其预处理可促进酸性黏液的产生,上调内源性前列腺素E2的产生,从而保护胃黏膜免受乙醇损伤[51]。
3.7 其他生物活性
研究表明,白芨多糖具有显著的体外抗肿瘤活性以及在新型递药系统和生物材料方向具有广泛的应用前景。LI在探讨紫杉醇纳米颗粒负载的BSP对人胃癌细胞的体内和体外影响,发现紫杉醇纳米颗粒负载白芨多糖在体内和体外均能增强药物传递,对人胃腺癌细胞株具有高效、安全的抗增殖作用[52]。
4 构效关系
对白芨多糖结构解析发现,分子质量一般在104~105 Da,分子质量过低不能形成具有活性的聚合结构,如三螺旋构象,而分子质量过高不利于多糖进入细胞发挥生物活性,因此白芨多糖分子质量只有在最佳范围内才具有特定生物活性;白芨多糖主要由葡萄糖和甘露糖按照不同摩尔比通过糖苷键连接组成,研究表明单糖组成越复杂其生物活性越强,且通过β构型连接的糖苷键比α构型连接的糖苷键生物活性更强;与初级结构相比高级结构(如空间构象)对白芨多糖生物活性影响较大[10]。WANG等[26]研究发现,高分子质量多糖BSP-1(83.54 kDa)比低分子质量多糖BSP-2(12.6 kDa)的免疫调节活性强;且WANG等[36]从白芨多糖中分离出BSPb组分,具有较好的抗纤维化活性,另外存在β-(1→4)-D-Glc和α-(1→2)-D-Man以及三螺旋结构的白芨多糖组分抗纤维化活性较强。
5 结论与展望
近年来,白芨多糖以特殊的生物学特性和药理学特性已成为研究热点。国内外学者对白芨多糖的提取、分离、纯化、结构表征和生物活性进行了大量研究。研究发现,通过不同提取、分离、纯化得到的白芨多糖的结构不同,多糖的结构、空间构象在很大程度上决定了它们的生物活性。白芨多糖通常采用水提法,利用超声或微波等辅助提取方法能大幅提高多糖提取率。将粗多糖通过离子交换色谱柱和凝胶渗透色谱柱进行分离纯化得到均匀组分,在此基础上对其进行结构解析和活性研究,并推测其可能的构效关系。尽管白芨多糖的研究已经取得了一定的成果,但对白芨多糖的缺乏广度和深度探索,下面是白芨多糖未来的挑战和发展趋势。
首先,各种新技术已经广泛应用于白芨多糖的提取,但每种提取方法的最优条件尚未定论,且重复性差,给大规模工业生产带来巨大挑战。这些又极大地阻碍了多糖的基础研究。其次,白芨多糖结构特征与生物活性密切相关,然而由于白芨多糖分子详细的化学结构和链构象特征尚不完全清楚,其结构与生物活性之间关系尚未完全阐明。因此,未来有必要利用更先进的技术,深入研究白芨多糖结构与生物活性,阐明其构效关系。此外,关于白芨多糖生物活性作用机制是一个难题。为更好地研究白芨多糖对人体健康的影响,有必要开展动物研究或临床试验,仅依靠细胞体外实验很难真正反映体内真实情况;并且运用基因组学、转录组学、代谢组学、蛋白质组学及生物信息学等前沿技术阐明白芨多糖对生物活性复杂的作用机制。最后,白芨多糖的分子修饰可以改变其结构和理化性质,从而提高其生物活性,分子修饰将是研究白芨多糖构效关系的新方向。
[1] 孔伟华, 徐建波, 崔琦, 等.白及化学成分、药理作用和白及多糖提取工艺的研究进展[J].中医药信息, 2021, 38(9):69-78.
KONG W H, XU J B, CUI Q, et al.Research progress in chemical components and pharmacological actions of Bletilla striata and extraction technology of its polysaccharide[J].Information on Traditional Chinese Medicine, 2021, 38(9):69-78.
[2] 瞿燕, 张晨, 廖祯诚, 等.白及多糖应用于医用生物材料的探讨[J].中药与临床, 2017, 8(5):54-58.
QU Y, ZHANG C, LIAO Z C, et al.Exploration on pharmaceutical applications of Bletilla striata polysaccharide in medical biomaterials[J].Pharmacy and Clinics of Chinese Materia Medica, 2017, 8(5):54-58.
[3] CHEN Z Y, CHENG L Z, HE Y C, et al.Extraction, characterization, utilization as wound dressing and drug delivery of Bletilla striata polysaccharide:A review[J].International Journal of Biological Macromolecules, 2018, 120:2 076-2 085.
[4] 吕洪乐, 张同华, 李倩.白芨多糖药理作用的研究进展[J].中国药房, 2015, 26(28):4 014-4 016.
LYU H L, ZHANG T H, LI Q, et al.Research progress on pharmacological effects of Bletilla striata polysaccharide[J].China Pharmacy, 2015, 26(28):4 014-4 016.
[5] JI X L, YIN M S, NIE H, et al.A review of isolation, chemical properties, and bioactivities of polysaccharides from Bletilla striata[J].BioMed Research International, 2020, 2020:5391379.
[6] 马子豪, 马婕, 吕金盈, 等.白及多糖在新型递药系统和生物材料中的应用进展[J].中国中药杂志, 2021, 46(18):4 666-4 673.
MA Z H, MA J, LYU J Y, et al.Progress in application of Bletilla striata polysaccharide in novel drug delivery systems and biomaterials[J].China Journal of Chinese Materia Medica, 2021, 46(18):4 666-4 673.
[7] 胡雨涛, 叶欣, 徐伟, 等.中药白芨止血作用的及其应用的研究进展[J].药物资讯, 2021, 10(3):152-157.
HU Y T, YE X, XU W, et al.Advances in the study of the hemostation effect and its application of Chinese medicine Bletilla striata[J].Pharmacy Information, 2021, 10(3):152-157.
[8] 李雪营, 林先燕, 梁黔生, 等.不同炮制方法对白芨多糖含量的影响[J].海峡药学, 2021, 33(2):51-52.
LI X Y, LIN X Y, LIANG Q S, et al.Effects of different processing methods on polysaccharide content of Bletilla striata[J].Strait Pharmaceutical Journal, 2021, 33(2):51-52.
[9] 李笑眉. 白芨多糖水凝胶促进糖尿病创面愈合的应用研究[D].大连:大连医科大学, 2021.
LI X M.Study on the application of Bletilla striata polysaccharide hydrogel in promoting the healing of diabetic wounds[D].Dalian:Dalian Medical University, 2021.
[10] 葛雯, 陈宏降, 罗益远, 等.白及多糖的研究进展[J].人参研究, 2021, 33(3):55-59.
GE W, CHEN H J, LUO Y Y, et al.Research progress on Bletilla striata polysaccharide[J].Ginseng Research, 2021, 33(3):55-59.
[11] XU D L, PAN Y C, CHEN J S.Chemical constituents, pharmacologic properties, and clinical applications of Bletilla striata[J].Frontiers in Pharmacology, 2019, 10:1168.
[12] 唐森, 梁冰娜, 覃逸明, 等.响应面优化白芨水溶性多糖提取工艺的研究[J].山东化工, 2019, 48(22):3-7.
TANG S, LIANG B N, QIN Y M, et al.Extraction process of polysaccharide in Bletilla striata optimized by response surface method[J].Shandong Chemical Industry, 2019, 48(22):3-7.
[13] 董建新, 俞涵, 姜伟, 等.响应面法优化白及多糖的提取和醇沉工艺[J].基因组学与应用生物学, 2019, 38(8):3 681-3 689.
DONG J X, YU H, JIANG W, et al.Optimization of extraction and alcohol precipitation process of Bletilla striata polysaccharides based on response surface methodology[J].Genomics and Applied Biology, 2019, 38(8):3 681-3 689.
[14] 吴梦晴. 白芨多糖的超声辅助提取工艺及抗氧化活性研究[J].巢湖学院学报, 2019, 21(6):95-101.
WU M Q.Ultrasound-assisted extraction process and antioxidant activity of Bletilla striata polysaccharide[J].Journal of Chaohu University, 2019, 21(6):95-101.
[15] 刘长命, 王洁.白芨多糖提取的工艺优化[J].商洛学院学报, 2018, 32(4):49-53.
LIU C M, WANG J.Extraction conditions optimization of polysaccharide from Bletilla striata[J].Journal of Shangluo University, 2018, 32(4):49-53.
[16] LI Q, LI K, HUANG S S, et al.Optimization of extraction process and antibacterial activity of Bletilla striata polysaccharides[J].Asian Journal of Chemistry, 2014, 26(12):3 574-3 580.
[17] 刘煜, 韩伟.超声辅助提取白芨多糖的研究[J].机电信息, 2017(32):35-40;59.
LIU Y, HAN W.Ultrasonic-assisted extraction of polysaecharide from Bleailla striata[J].Mechanical and Electrical Information, 2017(32):35-40;59.
[18] 何晓梅, 谷仿丽, 黄仁术, 等.白芨多糖超声波辅助提取工艺优化及体外抗氧化活性[J].皖西学院学报, 2017, 33(2):1-5.
HE X M, GU F L, HUANG R S, et al.Ultrasonic-assisted extraction and in vitro antioxidant activities evaluation of polysaccharides from Blettila striata[J].Journal of West Anhui University, 2017, 33(2):1-5.
[19] QU Y, LI C X, ZHANG C, et al.Optimization of infrared-assisted extraction of Bletilla striata polysaccharides based on response surface methodology and their antioxidant activities[J].Carbohydrate Polymers, 2016, 148:345-353.
[20] 吴诗惠, 王剑波, 开拓, 等.白芨多糖超声提取工艺及其抗氧化活性研究[J].世界中医药, 2020, 15(17):2 556-2 560.
WU S H, WANG J B, KAI T, et al.Study on ultrasonic extraction technology and antioxidant activity of Bletilla striata polysaccharides extraction process[J].World Chinese Medicine, 2020, 15(17):2 556-2 560.
[21] 朱富成, 罗书岚, 郑宣, 等.大别山白芨多糖酶法辅助提取及活性研究[J].天然产物研究与开发, 2020, 32(8):1 389-1 395;1 323.
ZHU F C, LUO S L, ZHENG X, et al.Enzyme-assisted extraction of polysaccharides of Ta-pieh Mountains Bletilla striata and its activities study[J].Natural Product Research and Development, 2020, 32(8):1 389-1 395;1 323.
[22] 韩伟, 彭茹洁, 赵少甫.PB试验-响应面优化白芨多糖的提取工艺研究[J].徐州工程学院学报(自然科学版), 2018, 33(4):19-26.
HAN W, PENG R J, ZHAO S F.Extraction optimization of total polysaecharide from Bletilla striataby response surface methodology with plackett-burman design[J].Journal of Xuzhou Institute of Technology (Natural Sciences Edition), 2018, 33(4):19-26.
[23] JI X L, PENG B X, DING H H, et al.Purification, structure and biological activity of pumpkin polysaccharides:A review[J].Food Reviews International, 2023,39(1):307-319.
[24] 冀晓龙, 尹明松, 侯春彦, 等.红枣多糖提取、分离纯化及生物活性研究进展[J].食品工业科技, 2020, 41(23):346-353;358.
JI X L, YIN M S, HOU C Y, et al.Recent advances in jujube (Zizyphus jujuba Mill.) polysaccharides:Extraction, isolation and purification and bioactivities[J].Science and Technology of Food Industry, 2020, 41(23):346-353;358.
[25] ZHU J X, GUO X X, GUO T T, et al.Novel pH-responsive and self-assembled nanoparticles based on Bletilla striata polysaccharide:Preparation and characterization[J].RSC Advances, 2018, 8(70):40 308-40 320.
[26] WANG Y R, HAN S W, LI R F, et al.Structural characterization and immunological activity of polysaccharides from the tuber of Bletilla striata[J].International Journal of Biological Macromolecules, 2019, 122:628-635.
[27] CHEN J K, LYU L Y, LI Y, et al.Preparation and evaluation of Bletilla striata polysaccharide/graphene oxide composite hemostatic sponge[J].International Journal of Biological Macromolecules, 2019, 130:827-835.
[28] 戴洁, 周子明, 刘敬.苯酚-硫酸比色法检测白芨多糖含量的分析[J].中国处方药, 2021, 19(3):33-35.
DAI J, ZHOU Z M, LIU J.The analyzing of detecting Bletilla striata polysaccharide by phenol sulfuric acid colorimetry[J].Journal of China Prescription Drug, 2021, 19(3):33-35.
[29] 车向前, 陈芳, 常明泉, 等.白芨溶胶中植物蛋白的定性定量方法研究[J].实用药物与临床, 2018, 21(7):815-818.
CHE X Q, CHEN F, CHANG M Q, et al.Study on the qualitative and quantitative methods for plant protein in Rhizoma Bletillae sol[J].Practical Pharmacy and Clinical Remedies, 2018, 21(7):815-818.
[30] JI X L, PENG Q, YUAN Y P, et al.Isolation, structures and bioactivities of the polysaccharides from jujube fruit (Ziziphus jujuba Mill.):A review[J].Food Chemistry, 2017, 227:349-357.
[31] LAI Y L, LIN Y Y, SADHASIVAM S, et al.Efficacy of Bletilla striata polysaccharide on hydrogen peroxide-induced apoptosis of osteoarthritic chondrocytes[J].Journal of Polymer Research, 2018, 25(2):49.
[32] 陈姿燕. 白芨源多糖的分离纯化、结构解析以及抗氧化活性研究[D].上海:上海交通大学, 2020.
CHEN Z Y.Isolation purification, structural analysis and antioxidant activity of polysaccharides from Bletilla striata[D].Shanghai:Shanghai Jiao Tong University, 2020.
[33] LIAO Z C, ZENG R, HU L L, et al.Polysaccharides from tubers of Bletilla striata:Physicochemical characterization, formulation of buccoadhesive wafers and preliminary study on treating oral ulcer[J].International Journal of Biological Macromolecules, 2019, 122:1 035-1 045.
[34] PENG Q, LI M, XUE F, et al.Structure and immunobiological activity of a new polysaccharide from Bletilla striata[J].Carbohydrate Polymers, 2014, 107:119-123.
[35] YUE L, WANG W, WANG Y, et al.Bletilla striata polysaccharide inhibits angiotensin II-induced ROS and inflammation via NOX4 and TLR2 pathways[J].International Journal of Biological Macromolecules, 2016, 89:376-388.
[36] WANG Y, LIU D, CHEN S J, et al.A new glucomannan from Bletilla striata:Structural and anti-fibrosis effects[J].Fitoterapia, 2014, 92:72-78.
[37] CHEN Z Y, ZHAO Y, ZHANG M K, et al.Structural characterization and antioxidant activity of a new polysaccharide from Bletilla striata fibrous roots[J].Carbohydrate Polymers, 2020, 227:115362.
[38] WANG C M, SUN J T, LUO Y, et al.A polysaccharide isolated from the medicinal herb Bletilla striata induces endothelial cells proliferation and vascular endothelial growth factor expression in vitro[J].Biotechnology Letters, 2006, 28(8):539-543.
[39] 王尚萍. 黄花白芨多糖结构解析及其抗肿瘤活性研究[D].西安:陕西师范大学, 2017.
WANG S P.Structural analysis and anti-tumor activity of polysaccharide from Bletilla striata[D].Xi′an:Shaanxi Normal University, 2017.
[40] 陈思思, 吴蓓, 谭婷, 等.白芨多糖BSP-1的分离纯化、结构表征及抗肿瘤活性研究[J].中草药, 2019, 50(8):1 921-1 926.
CHEN S S, WU B, TAN T, et al.Isolation, purification, structural characterization of Bletilla striata polysaccharides and its antitumor activity[J].Chinese Traditional and Herbal Drugs, 2019, 50(8):1 921-1 926.
[41] KONG L S, YU L, FENG T, et al.Physicochemical characterization of the polysaccharide from Bletilla striata:Effect of drying method[J].Carbohydrate Polymers, 2015, 125:1-8.
[42] ZHUANG Y, WANG L F, LIU C J, et al.A novel fiber from Bletilla striata tuber:Physical properties and application[J].Cellulose, 2019, 26(9):5 201-5 210.
[43] 刘文立, 莫海云.白芨多糖通过调节免疫作用抑制结肠癌CT26荷瘤小鼠肿瘤生长[J].中国免疫学杂志, 2021, 37(8):941-945.
LIU W L, MO H Y.Bletilla striata polysaccharide inhibits tumor growth in colon cancer CT26 tumor-bearing mice by regulating immunity[J].Chinese Journal of Immunology, 2021, 37(8):941-945.
[44] WANG J Q, HU S Z, NIE S P, et al.Reviews on mechanisms of in vitro antioxidant activity of polysaccharides[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:5692852.
[45] ZHU F M, DU B, XU B J.Anti-inflammatory effects of phytochemicals from fruits, vegetables, and food legumes:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(8):1 260-1 270.
[46] 周美, 万科, 马风伟, 等.响应面法优化白芨多糖酶解工艺及其抗氧化、免疫活性研究[J].食品研究与开发, 2020, 41(10):128-135.
ZHOU M, WAN K, MA F W, et al.Response surface methodology for optimization of enzymatic hydrolysis on Bletilla striata (Thunb.) Reiehb.f.polysaccharides and antioxidant, in vitro immunostimulatory activities analysis[J].Food Research and Development, 2020, 41(10):128-135.
[47] 郭琪, 孟烨, 赵阳, 等.白芨提取物对博莱霉素致大鼠肺纤维化的治疗作用[J].国际药学研究杂志, 2016, 43(3):518-523.
GUO Q, MENG Y, ZHAO Y, et al.Inhibitory effect of Bletilla striata extracts on bleomycin-induced pulmonary fibrosis in rats[J].Journal of International Pharmaceutical Research, 2016, 43(3):518-523.
[48] DIAO H J, LI X, CHEN J N, et al.Bletilla striata polysaccharide stimulates inducible nitric oxide synthase and proinflammatory cytokine expression in macrophages[J].Journal of Bioscience and Bioengineering, 2008, 105(2):85-89.
[49] ZHANG C, HE Y N, CHEN Z J, et al.Effect of polysaccharides from Bletilla striata on the healing of dermal wounds in mice[J].Evidence-based Complementary and Alternative Medicine:ECAM, 2019, 2019:9212314.
[50] LUO L, ZHOU Z, XUE J, et al.Bletilla striata polysaccharide has a protective effect on intestinal epithelial barrier disruption in TAA-induced cirrhotic rats[J].Experimental and Therapeutic Medicine, 2018, 16(3):1 715-1 722.
[51] 李雨芯, 余雪嫣, 黄雪.白芨多糖上调溃疡性结肠炎小鼠肠黏膜紧密连接蛋白occludin的表达[J].基础医学与临床, 2021, 41(7):941-945.
LI Y X, YU X Y, HUANG X.Bletilla striata polysaccharide up-regulates the expression of tight junction protein occludin in intestinal mucosa of mice with ulcerative colitis[J].Basic and Clinical Medicine, 2021, 41(7):941-945.
[52] LI X C, BAI G.In vivo and in vitro effects of Bletilla striata polysaccharide-loaded paclitaxel nanoparticles on human gastric cancer cells[J].Tropical Journal of Pharmaceutical Research, 2019, 18(1):13.