新疆位于我国西北地区,是中国最大的葡萄产区,距离内地消费市场甚远[1]。在贮运过程中葡萄果梗极易褐变,这严重影响了葡萄的感官品质和外运销售,是鲜食葡萄电商物流保鲜技术面临的巨大挑战[2]。目前,新疆鲜食葡萄的外销渠道以电商物流平台为主,而在物流过程中安全高效的包装保鲜技术是鲜食葡萄优良品质的保障[3]。
果梗褐变是鲜食葡萄采后贮藏及货架期间影响品质的主要问题之一,其作为葡萄新鲜度的衡量标准,严重影响着鲜食葡萄的外观销售品质[4]。由于葡萄的生理特性,其果梗与果实呼吸类型不同,果梗为呼吸跃变型,葡萄贮藏期间果梗因呼吸速率的跃变,极易过多积累活性氧,导致衰老与酶促褐变的进行[5]。酚类作为酶促褐变的底物,当果梗细胞的细胞膜完整性受损时,细胞区室化分布被破坏,使得酚类底物与多酚氧化酶结合生成醌类化合物,醌类化合物进一步聚集呈褐色。因此保证细胞膜完整性是降低果梗褐变的关键因素[6]。
在贮藏过程中细胞膜完整性与细胞内活性氧的积累有关,果梗伴随着呼吸高峰的出现,活性氧作为呼吸的副产物随之积累[7]。H2O2作为活性氧代谢的关键产物,其含量的高低与膜脂过氧化密切相关,而过多的活性氧积累会加速果实衰老,破坏果实细胞膜结构,从而致使果实发生褐变,表明活性氧水平与果梗褐变密切相关[8]。
近年来,如何减少葡萄采后贮藏及货架过程中腐烂现象的发生成为研究热点,而对果梗中活性氧代谢与褐变的研究相对较少[9]。商标保鲜卡作为一种安全美观便捷的包装产品,对果蔬的采后保鲜有着重要的应用价值。在前期试验确定巨峰葡萄的商标保鲜卡生产配比的基础上,本试验针对鲜食葡萄电商物流保鲜包装“个性化”的技术需求,采用商标结合含硫保鲜剂和层状硅酸盐处理鲜食葡萄的方法,分析商标保鲜卡对果梗活性氧和褐变的影响,商标保鲜卡能提升葡萄的商品价值、延长货架时间;减少葡萄中二氧化硫(SO2)残留量,为鲜食葡萄电商物流贮运保鲜技术的应用提供新的研究思路;同时为控制鲜食葡萄果梗褐变与活性氧代谢机理方面提供理论基础。
巨峰葡萄:于2021年9月采自新疆乌市头屯河区兵团二师头屯河农场,挑选无机械损伤、无病害、果梗新鲜的葡萄,采后均用冷链保鲜车立即运往乌市格瑞德保鲜技术有限公司的冷库,在(0±0.5) ℃条件下预冷24 h。
层状硅酸盐、焦亚硫酸钠(Na2S2O5)、硅油膜、乙烯/醋酸乙烯酯共聚物(EVA)、干燥剂纸、不干胶,乌市格瑞德保鲜科技有限公司;丙酮、L-苯丙氨酸、β-疏基乙醇、聚乙烯吡咯烷酮、H2O2溶液、愈创木酚、EDTA、邻苯二酚,天津致远化学试剂有限公司(以上试剂均为分析纯)。
DELT-A320分析天平,天津市德安特传感技术有限公司 ;SIM-F140ADL制冰机,上海君翼仪器设备有限公司;DZKW-D-4电热恒温水浴锅,上海一恒科学仪器有限公司;GL-20G-1高速冷冻离心机,上海安亭设备;UV2600型紫外可见分光光度计,日本岛津公司;DW-HL668 -40℃超低温冰箱,中科美菱;IKA®A11研磨机,苏州赛恩斯仪器有限公司;18 cm×14 cm×8 cm无盖包装盒,江苏九邦新材料科技发展有限公司。
1.3.1 样品处理
选取果梗翠绿、果实无病虫害、无机械损伤且大小、色泽以及成熟度一致的整串巨峰葡萄。将葡萄装入有吸水纸和无纺布的周转筐中,并及时运送至乌鲁木齐市格瑞德保鲜技术有限公司,置于(0±0.5) ℃、相对湿度为(85±5)%冷库中预冷。随机分组,放入包装盒(2.0 L)内,底层铺吸水纸并放置商标保鲜卡,单盒葡萄约重600.00 g。处理方式如表1所示:
表1 试验设计
Table 1 Experimental design
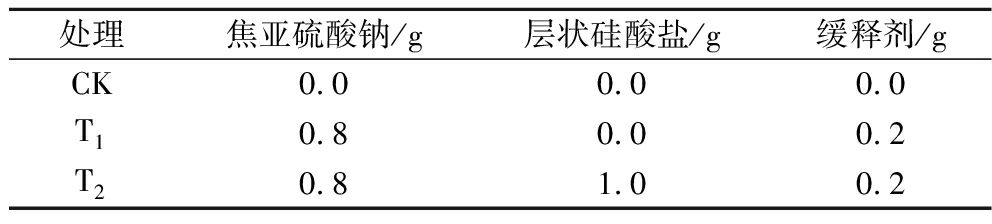
处理焦亚硫酸钠/g层状硅酸盐/g缓释剂/gCK0.00.00.0T10.80.00.2T20.81.00.2
将商标保鲜卡T1、T2置于巨峰葡萄包装盒中,并用PE膜封口,用针在PE膜上均匀扎4个孔,孔径为20~30 μm。将所有处理放置在温度为(12±1) ℃、相对湿度为(85±5)%的环境中贮藏,每个处理3次重复,同时设置对照组,每隔3 d取样。
1.3.2 指标测定方法
1.3.2.1 乙烯生成速率、呼吸强度的测定
乙烯生成速率的测定:分别从各处理组中,随机称量0.60 kg葡萄,放在在2.0 L的密闭盒子中,密闭4 h后,抽取气体。用气相色谱仪检测乙烯释放量,单位为μL/(kg·h),每个处理重复测3次。
呼吸强度的测定:采用Check Point Ⅲ便携式顶空分析仪测定密封包装盒内的CO2体积分数(φ1,%),用胶带密封并于2 h后再次测定密封包装盒内的CO2体积分数(φ2,%),记录样品质量(m0,g),做3个重复,呼吸强度计算如公式(1)所示:
呼吸强度/[mg·(kg·h)-1]=
(1)
式中:V为密封包装盒中的总体积,mL;M为CO2的摩尔质量,44 g/mol;V0为CO2的摩尔体积,22.4 L/mol;t为测定时间,h。
1.3.2.2 果梗褐变指数的测定
果梗褐变级数为:0级,果梗、穗轴部位均未出现褐变;1级,果梗或穗轴部位出现褐变现象,面积不超过总面积的1/4;2级,果梗或穗轴部位出现褐变现象,面积占总面积的1/4~1/2;3级,果梗或穗轴部位出现褐变现象,面积占总面积的1/2~3/4;4级,果梗穗轴部位褐变面积超过3/4或全部褐变。褐变指数计算如公式(2)所示:
果梗褐变指数![]()
(2)
1.3.2.3 果梗H2O2含量、超氧阴离子自由基![]() 产生速率的测定
产生速率的测定
H2O2含量的测定:取1 mL提取液,加入100 μL 10% TiCl4和200 μL氨水。混匀、反应5 min后,于10 000×g、4 ℃离心15 min。去上清液,加入适量预冷丙酮反复洗涤沉淀直至无色后,用3 mL 2 mol/L硫酸溶解沉淀,于412 nm处测定其吸光值。H2O2含量用nmol/g表示。每个处理测定3次。
![]() 产生速率的测定:1 mL提取液,加入1.0 mL 50 mmol/L磷酸钾缓冲液(pH 7.8)和1.0 mL 1 mmol/L的盐酸羟胺溶液,摇匀后于25 ℃保温1 h。取出后加入1.0 mL 17 mmol/L对氨基苯磺酸和1.0 mL 7 mmol/L α-萘胺,混匀后于25 ℃保温20 min进行显色反应。在530 nm处测定显色液的吸光度值。单位:nmol/(min·g)。每个处理测定3次。
产生速率的测定:1 mL提取液,加入1.0 mL 50 mmol/L磷酸钾缓冲液(pH 7.8)和1.0 mL 1 mmol/L的盐酸羟胺溶液,摇匀后于25 ℃保温1 h。取出后加入1.0 mL 17 mmol/L对氨基苯磺酸和1.0 mL 7 mmol/L α-萘胺,混匀后于25 ℃保温20 min进行显色反应。在530 nm处测定显色液的吸光度值。单位:nmol/(min·g)。每个处理测定3次。
1.3.2.4 果梗过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)活性的测定
分别向试管中加入5 mL磷酸缓冲溶液(pH 5.5,100 mmol/L)、200 μL 0.3%愈创木酚,取0.5 mL酶提取液加入,在加入0.5 mol/L H2O2后迅速启动反应,每20 s时测定470 nm处吸光度的变化。以1单位POD酶活定义为1 min内吸光度值增加0.01,POD活性表示为U/g。
SOD活性的测定:以每分钟每克鲜重果蔬组织的反应体系对氮蓝四唑(nitro-blue tetrazolium,NBT)光化还原的抑制为50%时为1个SOD活性单位(U),单位:U/g。
1.3.2.5 果梗过氧化氢酶(catalase, CAT)活性的测定
以每克鲜重果蔬样品每分钟在240 nm处的吸光度变化值增加0.01时为1个过氧化物酶活性单位(U)表示,单位:U/g。
1.3.2.6 果梗抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性的测定
以每克鲜重果蔬样品每分钟吸光度变化值增加0.01时为1个过氧化物酶活性单位(U),单位:U/g。
1.3.2.7 果梗相对电导率、丙二醛(malondialdehyde,MDA)含量的测定
相对电导率的测定:称取0.25 g葡萄果梗,剪成长度为0.10 cm左右的段状,放于100 mL烧杯中,加入50 mL蒸馏水,振荡1 min,立即测定此时电导率记为P0;用保鲜膜盖上烧杯,静止30 min,测定电导率记为P1,随后在沸水浴中放置15 min,待冷却后测定电导率记为P2。相对电导率计算如公式(3)所示:
相对电导率![]()
(3)
MDA含量的测定:将2.0 mL提取液加入至2.0 mL 0.67%硫代巴比妥酸中,混匀。经沸水浴煮沸20 min后,于4 ℃、12 000×g条件下离心10 min。取上清液,分别在450、532、600 nm处测定其吸光值,单位:nmol/g。每个处理测定3次。
1.3.2.8 果梗总酚含量的测定
使用预冷的1% HCl-甲醇溶液3 mL在冰浴条件下将3 g冻样研成匀浆,再用2 mL HCl-甲醇溶液冲洗研钵。合并2次的匀浆液于离心管内置于暗处4 ℃条件下放置20 min。然后在4 ℃、12 000×g条件下离心15 min,上清液在280 nm波长条件下测定其吸光度,总酚含量用A280nm/g表示。
1.3.2.9 果梗多酚氧化酶(polyphenol oxidase, PPO)活性的测定
取5.0 g冻样加入缓冲液5 mL(1 mmol/L聚乙二醇、40 g/L聚乙烯吡咯烷酮、1%(体积分数)Triton X-100),在冰浴条件下匀浆,于4 ℃,10 000×g离心5 min,收集上清液,用于测定PPO的活性。在试管中分别加入4 mL乙酸-乙酸钠缓冲液(50 mmol/L,pH 5.5)、50 mmol/L的邻苯二酚溶液1 mL和100 μL的混合酶提取液,420 nm处测定吸光度。PPO的活性结果以U/g为单位表示。
使用Graph Pad Prism 8软件作图,使用SPSS 20.0对数据进行方差分析(ANOVA)并采用Duncan法比较均值。P≤ 0.05表示差异显著,P≤ 0.01表示差异极显著。
果梗乙烯释放量呈先上升后下降的趋势(图1-A)。T1、T2处理组较对照组乙烯高峰分别延迟了3~6 d,乙烯峰值较对照组分别降低了11.29%、17.86%(P<0.05)。葡萄果梗为呼吸跃变型,乙烯高峰出现后,果梗衰老进程加快,从而影响葡萄品质[10]。T2组中添加的层状硅酸盐可能通过多孔空间结构的特性起到吸附乙烯的作用,从而减少了包装中的乙烯含量。
呼吸作用会消耗果梗自身养分而导致其品质下降,较低的呼吸强度可以延缓乙烯的合成和果梗褐变的发生,从而保持果梗的品质[11]。呼吸强度在整个货架期间呈现先上升后下降的趋势(图1-B)。货架第3天时,对照组呼吸强度达到峰值[22.03 mg/(kg·h)],是货架6 d时T1和9 d时T2组的1.04、1.11倍(P<0.05)。说明商标保鲜卡处理均可有效推迟呼吸高峰的出现,从而达到抑制货架初期葡萄果梗呼吸强度的效果。货架12~21 d,处理组的呼吸强度高于对照组是因为处理组可有效延缓葡萄果梗的褐变与衰老,使呼吸强度下降速度趋于平缓[11]。Na2S2O5处理可有效抑制贮藏初期葡萄果梗的呼吸强度,而层状硅酸盐则可通过减少贮藏环境中的乙烯,从而降低呼吸强度[10]。由此可知,T2组采用层状硅酸盐与Na2S2O5复合处理巨峰葡萄优于单独使用Na2S2O5的T1处理组。
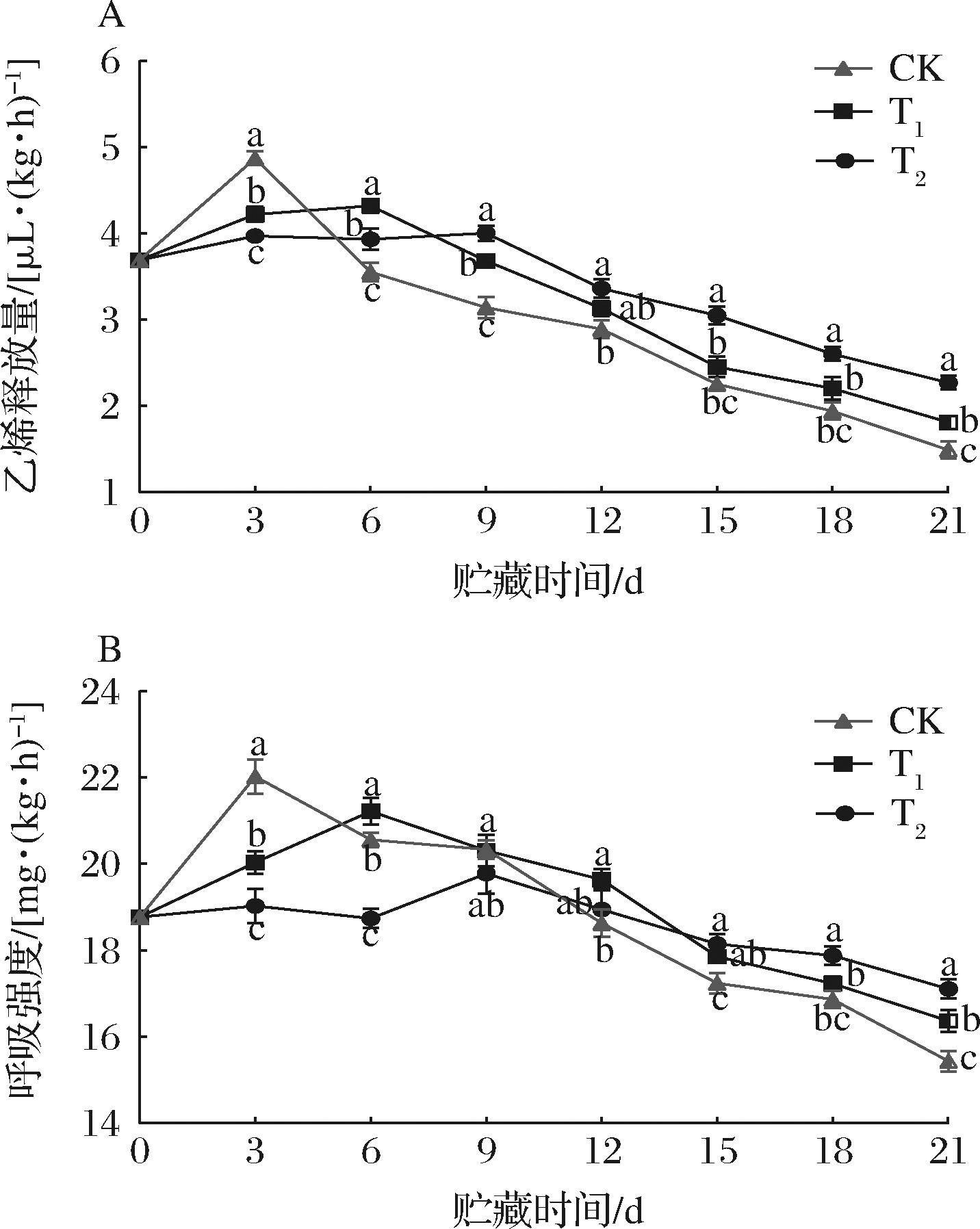
A-乙烯释放量;B-呼吸强度
图1 商标保鲜卡对果梗乙烯释放量和呼吸强度的影响
Fig.1 Effects of Table grape preservation pad on the ethylene release and respiratory strength of fruit stalk
注:同列不同小写字母代表在P<0.05水平下有显著性差异(下同)
在整个货架期间褐变指数呈现上升趋势(图2)。货架前3 d,T2组果梗均未出现褐变现象,此后对照组的褐变指数迅速增加,从第18天开始均显著高于各处理组的果梗褐变指数。第21天时果梗褐变指数高达81.78%,是T1、T2组的1.27、3.41倍(P<0.05)。商标保鲜卡中SO2可以通过与H2O结合生成![]() 造成葡萄中pH呈碱性,抑制多酚氧化酶活性,减少与酚类物质接触的机会,延缓果梗褐变现象的发生[12]。乙烯可以加速葡萄采后果梗的褐变,过高的乙烯含量能够加快葡萄衰老,进而引发自身膜保护系统的破坏,不利于贮藏[2],而硅酸盐能够起到减少贮藏环境中乙烯的作用[10]。在本试验中,商标保鲜卡使两者协同作用,达到有效延缓果梗褐变指数上升的目的,其中T2组果梗褐变指数显著低于T1和对照组。
造成葡萄中pH呈碱性,抑制多酚氧化酶活性,减少与酚类物质接触的机会,延缓果梗褐变现象的发生[12]。乙烯可以加速葡萄采后果梗的褐变,过高的乙烯含量能够加快葡萄衰老,进而引发自身膜保护系统的破坏,不利于贮藏[2],而硅酸盐能够起到减少贮藏环境中乙烯的作用[10]。在本试验中,商标保鲜卡使两者协同作用,达到有效延缓果梗褐变指数上升的目的,其中T2组果梗褐变指数显著低于T1和对照组。
如图3所示,巨峰葡萄的果梗随着货架时间的延长,都存在不同程度的褐变现象,鲜绿色逐渐消失。货架末期,对照组果实有严重的腐烂变质症状且果梗全部褐变;T1组的果梗一部分褐变,另一部分呈黄绿色;T2组的果梗部分仍然保持鲜绿状态。货架后期果肉腐烂和果梗褐变相互影响,加快了品质下降的进程[13]。
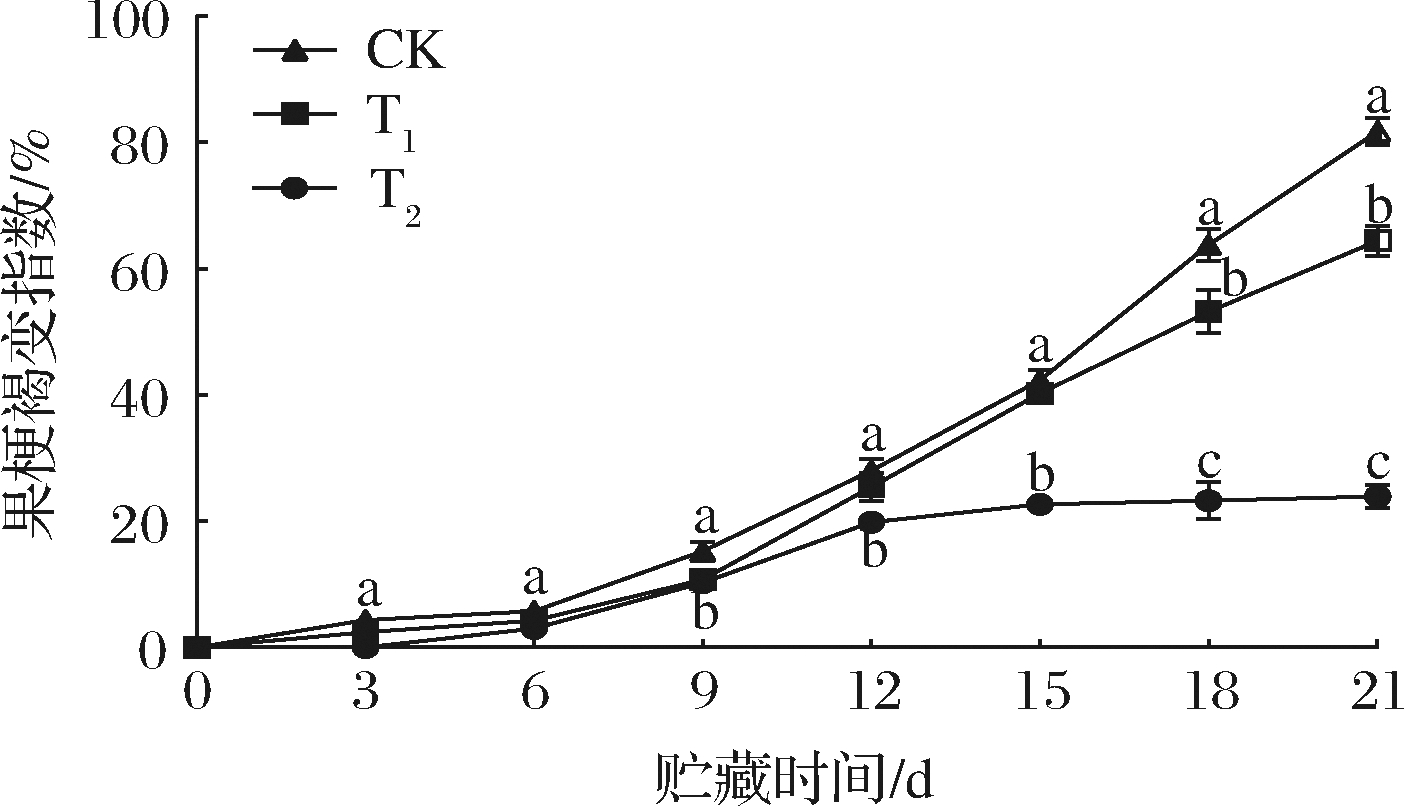
图2 商标保鲜卡对果梗褐变指数的影响
Fig.2 Effects of Table grape preservation pad on the stem browning index

图3 商标保鲜卡处理巨峰葡萄的果梗变化图
Fig.3 Change of fruit stalk of Kyoho grapes treated with Table grape preservation pad
超氧阴离子是一种对细胞具有氧化损伤作用的自由基,能经SOD转化成H2O2和![]() 采后货架期间,巨峰葡萄果梗的
采后货架期间,巨峰葡萄果梗的![]() 产生速率呈先上升后下降的趋势(图4)。货架第3~12 d超氧阴离子产生速率呈上升趋势,货架第12天时,对照组的
产生速率呈先上升后下降的趋势(图4)。货架第3~12 d超氧阴离子产生速率呈上升趋势,货架第12天时,对照组的![]() 产生速率是T1、T2组的1.22、1.82倍(P<0.05)。在整个货架期间,除15 d和21 d外,T2组果梗的
产生速率是T1、T2组的1.22、1.82倍(P<0.05)。在整个货架期间,除15 d和21 d外,T2组果梗的![]() 产生速率显著低于T1和对照组(P<0.05)。由于葡萄果梗对氧化损伤的抗性得到保持,从而避免了细胞结构受到严重损伤,因此商标保鲜卡的应用均能降低货架期间果梗
产生速率显著低于T1和对照组(P<0.05)。由于葡萄果梗对氧化损伤的抗性得到保持,从而避免了细胞结构受到严重损伤,因此商标保鲜卡的应用均能降低货架期间果梗![]() 产生速率,其中T2组的效果更为显著。
产生速率,其中T2组的效果更为显著。
积累过量的H2O2会造成细胞膜中的磷脂双分子层受到氧化损伤,从而破坏DNA结构,导致细胞死亡[15]。随着货架天数的增加,果梗中H2O2含量逐渐累积(图4)。相比对照组,T1和T2处理组能显著抑制果梗中H2O2的生成(P<0.05);第15天时,T1、T2组比对照组分别低11.07%和39.87%。其原因可能是随着货架时间的延长,商标保鲜卡中的SO2释放量的减少和层状硅酸盐的吸附能力降低,造成了货架末期各组果梗H2O2含量之间无显著差异。而在整个货架期间,商标保鲜卡T2能更为有效地减少果梗中H2O2的积累。由于商标保鲜卡抑制了果梗H2O2的积累,降低其积累位点代谢功能被破坏的程度,避免破坏细胞膜的完整性,减轻植物组织的氧化损伤,从而达到延缓葡萄果梗褐变的目的[16]。

A-H2O2含量;![]() 产生速率
产生速率
图4 商标保鲜卡对果梗H2O2含量和 ![]() 产生速率的影响
产生速率的影响
Fig.4 Effects of Table grape preservation pad on H2O2 content and ![]() of fruit stalk
of fruit stalk
POD广泛存在于植物体内,能催化还原型辅酶Ⅰ氧化形成超氧阴离子产生H2O2,也能与POD一样参与分解H2O2的过程[17]。图5-A表明,果梗POD活性呈先上升后下降的趋势。货架第6天时对照组与各处理组间出现显著性差异,第12天时差异最显著。此时T2组的POD活性是对照组、T1的1.58、1.35倍(P<0.05)。分析得出商标保鲜卡T2可有效延缓POD活性的下降。
SOD可将![]() 迅速转化成H2O2和O2,从而有效清除
迅速转化成H2O2和O2,从而有效清除![]() 保护参与氧代谢的细胞免受
保护参与氧代谢的细胞免受![]() 的伤害[18]。巨峰葡萄果梗中SOD活性在货架期间呈现出先增加后降低的趋势(图5-B)。对照组SOD活性上升比各处理组更快。货架15 d时SOD活性达到峰值,T2组(1.54 U/g)比对照组(0.94 U/g)、T1组(1.16 U/g)酶活性分别高62.11%、32.76%(P<0.05)。说明商标保鲜卡T2组具有延缓SOD活性上升的作用。
的伤害[18]。巨峰葡萄果梗中SOD活性在货架期间呈现出先增加后降低的趋势(图5-B)。对照组SOD活性上升比各处理组更快。货架15 d时SOD活性达到峰值,T2组(1.54 U/g)比对照组(0.94 U/g)、T1组(1.16 U/g)酶活性分别高62.11%、32.76%(P<0.05)。说明商标保鲜卡T2组具有延缓SOD活性上升的作用。
CAT的主要作用是清除H2O2的伤害,使生物体呈现自我防卫机能,CAT活性越高,表明果品褐变衰老速度减慢[19]。由图5-C可知,随着货架时间的延长,巨峰葡萄果梗的CAT活性呈先上升后下降的趋势。货架第12天时对照组与各处理组出现显著性差异,T2处理组CAT活性是对照组、T1组的2.10、1.31倍(P<0.05)。因此,整个货架期间商标保鲜卡T2处理显著抑制了CAT活性的降低。
APX可以清除植物体内的H2O2,防止植物中叶绿素的降解和细胞组织的伤害[20]。巨峰葡萄采后货架期间,对照和处理组果梗的APX活性均呈先上升后下降的趋势(图5-D)。货架前期,对照和处理组的APX活性之间无显著差异(P> 0.05)。货架12 d时果梗的APX活性开始下降,货架末期T2组APX活性是对照组、T1组的1.30、1.20倍(P<0.05)。由此可见,T2处理可有效抑制APX活性的降低。
随着巨峰葡萄货架时间的延长,果梗呼吸代谢所产生的活性氧随之升高,虽然活性氧在果实抵御逆境胁迫的过程中起关键作用,但是未及时清除则可能会造成细胞膜脂过氧化损伤从而加剧褐变的发生。POD、SOD、CAT、APX作为清除活性氧的关键酶,其活性的高低影响着活性氧的清除能力。在本实验中商标保鲜卡的应用可显著提升活性氧清除酶POD、SOD、CAT、APX的活性。一方面,SO2可有效抑制POD、SOD、CAT、APX活性的下降,显著增强葡萄的抗氧化性能[11]。另一方面,商标保鲜卡中添加的层状硅酸盐能够通过吸附乙烯使果梗呼吸速率得到降低,从而减少活性氧的产生[10]。

A-POD活性;B-SOD活性;C-CAT活性;D-APX活性
图5 商标保鲜卡对果梗POD、SOD、CAT和APX的影响
Fig.5 Effects of Table grape preservation pad on POD、SOD、CAT and APX activity of fruit stalk
整个货架期间,葡萄果梗的相对电导率呈逐渐上升的趋势(图6-A)。整个货架期间,商标保鲜卡处理的葡萄果梗相对电导率显著高于对照组。货架21 d时,T2组果梗相对电导率比对照组和T1组分别低46.34%、26.21%(P<0.05)。由此可见,商标保鲜卡的应用均可有效延缓巨峰葡萄果梗相对电导率的上升,而T2组应用效果更为显著。
MDA含量体现了细胞膜脂过氧化的程度,膜脂过氧化程度越高,细胞所受到的氧化损伤就越严重[21]。葡萄果梗中MDA含量随着货架时间的增加,呈逐渐上升趋势(图6-B)。商标保鲜卡处理显著抑制了贮藏过程中葡萄果梗MDA含量的增长,且T2处理显著优于T1组处理(P<0.05)。T1与对照果梗的MDA含量从货架12 d后积累速度加快,直至货架结束,对照组、T1和T2处理组果梗MDA含量是货架初期的5.34、2.71和1.59倍。说明商标保鲜卡的应用可显著降低鲜食葡萄货架期间MDA含量。
相对电导率与MDA含量是影响膜完整性的关键因素,而膜损伤是导致褐变的主要原因之一[22]。本试验结果表明,商标保鲜卡的应用可降低相对电导率与MDA的含量,其原因可能是焦亚硫酸钠作为商标保鲜卡的主要成分,可在巨峰葡萄贮藏或货架期间释放SO2,一定浓度的SO2能够抑制相对电导率的上升和MDA的积累[23];而层状硅酸盐能够减少贮藏环境中的乙烯,进而避免自身膜保护系统受到破坏[10]。

A-相比电导率;B-MDA含量
图6 商标保鲜卡对果梗相对电导率和MDA 含量的影响
Fig.6 Effects of Table grape preservation pad on relative conductivity and MDA of fruit stalk
由图7-A可知,货架第3天时T2组的果梗总酚含量与T1和对照组出现显著性差异;第15 d时,T2组果梗总酚含量最高,分别是对照组、T1组的1.38、1.5倍(P<0.05)。由此可见,商标保鲜卡的应用能够提高巨峰葡萄采后货架期间果梗的总酚含量。
PPO的催化反应导致果梗褐变,产生异味或损失营养成分[24]。随着货架时间的延长,PPO活性呈现先上升后下降的趋势(图7-B)。巨峰葡萄PPO活性在货架第15天时出现峰值,此时对照组、T1和T2组PPO活性分别为1.28、1.04和0.85 U/g,其中T2复合处理组活性最低,与其他处理相比差异显著(P<0.05)。说明商标保鲜卡具有延缓PPO活性上升的作用,而T2组效果更为显著。
果梗中富含酚类物质,具有较高的抗氧化性能,采后当果梗出现衰老或逆境胁迫时,细胞完整性遭到破坏,从而使细胞区室化分布被破坏,从而加快PPO与酚类底物、醌类化合物的氧化反应,醌类化合物进一步聚合形成呈现褐色、棕色或黑色的聚合物,促进褐变进程[25]。商标保鲜卡的应用可提升酚类物质的积累,增强果梗的抗氧化性能,从而有效降低细胞膜的受损,进一步避免PPO与酚类底物接触,延缓褐变的发生的进程。
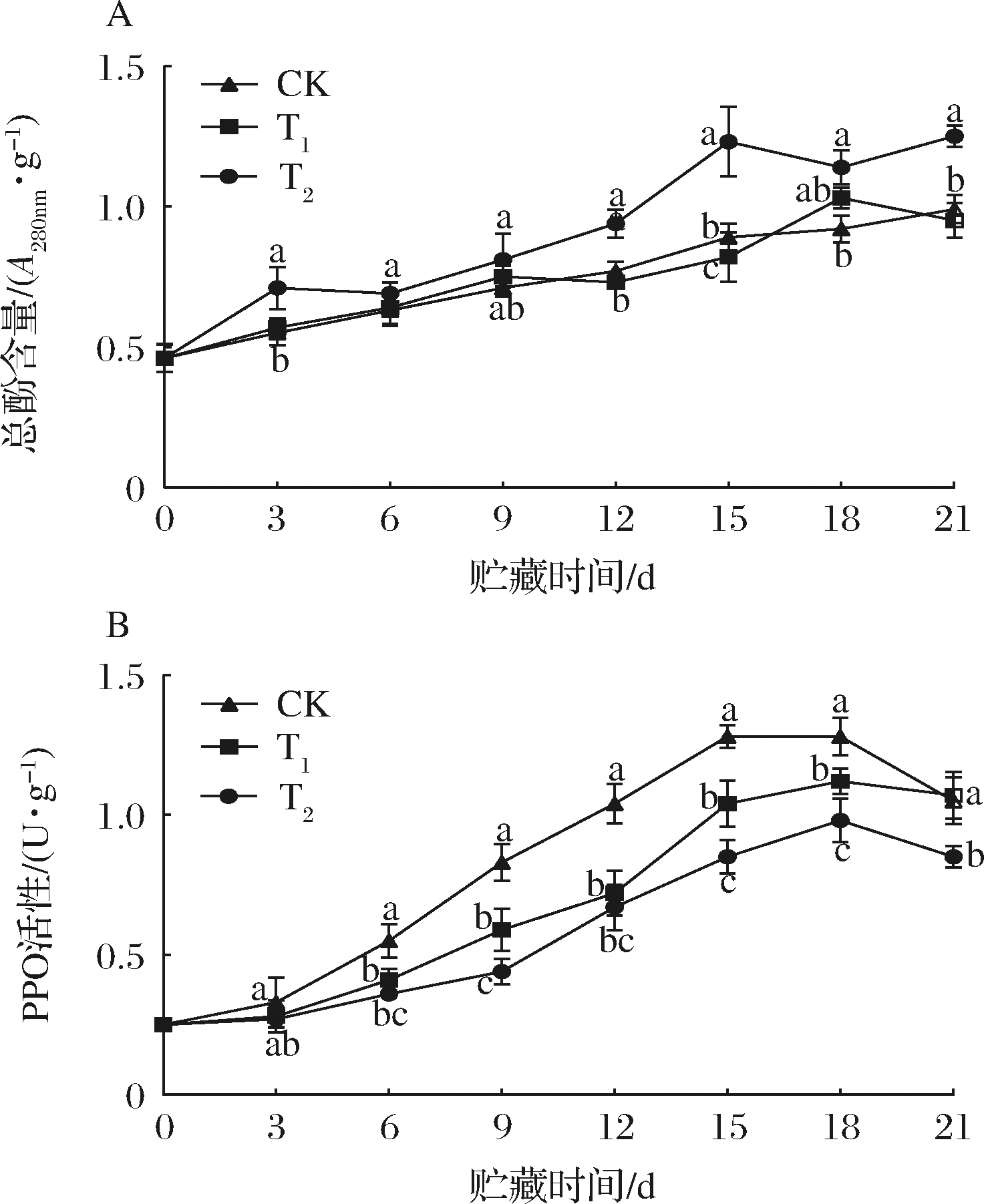
A-总酚含量;B-PPO活性
图7 商标保鲜卡对果梗总酚含量和PPO活性的影响
Fig.7 Effects of Table grape preservation pad on total phenol content and PPO activity of fruit stalk
商标保鲜卡作为一种安全美观便捷的电商物流包装产品,对果蔬的采后保鲜有着重要的应用价值。商标保鲜卡的应用能够抑制巨峰葡萄果梗乙烯释放量和呼吸强度,通过提升果梗中POD、SOD、CAT、APX的活性,清除H2O2和![]() 降低MDA的积累,从而保护细胞膜的完整性,避免酚类物质和PPO的接触,从而延缓果梗褐变的发生。采用商标结合含硫保鲜剂和层状硅酸盐处理鲜食葡萄的方法能够延缓葡萄果梗褐变,对果梗有较好的护绿效果,提高了葡萄的商品价值;减少葡萄中SO2残留量,从而提高鲜食葡萄采后食用的安全性。本研究为葡萄果梗保鲜产品在鲜食葡萄电商物流方面的应用提供了新的研究思路,同时为控制鲜食葡萄果梗褐变与活性氧代谢机理研究提供理论基础。
降低MDA的积累,从而保护细胞膜的完整性,避免酚类物质和PPO的接触,从而延缓果梗褐变的发生。采用商标结合含硫保鲜剂和层状硅酸盐处理鲜食葡萄的方法能够延缓葡萄果梗褐变,对果梗有较好的护绿效果,提高了葡萄的商品价值;减少葡萄中SO2残留量,从而提高鲜食葡萄采后食用的安全性。本研究为葡萄果梗保鲜产品在鲜食葡萄电商物流方面的应用提供了新的研究思路,同时为控制鲜食葡萄果梗褐变与活性氧代谢机理研究提供理论基础。
[1] 刘宏, 牛荣.新疆特色林果业现状和发展趋势[J].山西农经, 2018(9):29-30.
LIU H, NIU R.Present situation and development trend of characteristic forest and fruit industry in Xinjiang[J].Shanxi Agricultural Economy, 2018(9):29-30.
[2] 张琼琼, 魏佳, 李杰, 等.葡萄采后果梗抗氧化系统与褐变的关系[J].现代食品科技, 2021, 37(9):128-137;206.
ZHANG Q Q, WEI J, LI J, et al.Relationship between antioxidant systemand browning of postharvest grape rachis[J].Modern Food Science and Technology, 2021, 37(9):128-137;206.
[3] 龚琳玲. 农产品生鲜电商冷链物流包装的问题与对策[J].物流科技, 2019, 42(10):66-67.
GONG L L.Problems and countermeasures of cold chain logistics packaging for fresh agricultural products E-commerce[J].Logistics Sci-Tech, 2019, 42(10):66-67.
[4] 吴忠红. 基于RNA-seq技术解析NO延缓葡萄果梗采后褐变的作用机理[D].石河子:石河子大学, 2021.
WU Z H.Mechanism of NO delaying postharvest browning of grape stems based on RNA-seq technology[D].Shihezi:Shihezi University, 2021.
[5] 左志强, 何庆, 吴斌, 等.复合保鲜剂对无核白葡萄保鲜效果研究[J].食品科技, 2021, 46(11):28-35.
ZUO Z Q, HE Q, WU B, et al.Fresh-keeping effect of compound preservative on seedless white grapes[J].Food Science and Technology, 2021, 46(11):28-35.
[6] ZHANG Z K, HU M J, YUN Z, et al.Effect of tea seed oil treatment on browning of litchi fruit in relation to energy status and metabolism[J].Postharvest Biology and Technology, 2017, 132:97-104.
[7] YANG S S, LIAN G J.ROS and diseases:Role in metabolism and energy supply[J].Molecular and Cellular Biochemistry, 2020, 467(1-2):1-12.
[8] YI C, JIANG Y M, SHI J, et al.ATP regulation of antioxidant properties and phenolics in litchi fruit during browning and pathogen infection process[J].Food Chemistry, 2010, 118(1):42-47.
[9] 何庆. 采前喷施水杨酸对红地球葡萄采后灰霉病抗性和品质的影响[D].乌鲁木齐:新疆农业大学, 2021.
HE Q.Effects of salicylic acid spraying before harvest on postharvest gray mold resistance and quality of red globe grape[D].Urumqi:Xinjiang Agricultural University, 2021.
[10] 许耀辉, 路帆, 梁佳睿, 等.BioSuee膜和硅酸盐对鲜杏采后果实转色的抑制作用[J].食品科学, 2022, 43(3):203-212.
XU Y H, LU F, LIANG J R, et al.Inhibitory effect of BioSuee film and silicate material on postharvest color changes in fresh apricot fruit[J].Food Science, 2022, 43(3):203-212.
[11] 陈浩. 1-MCP与Na2S2O5复合新型保鲜剂对红提葡萄采后生理的影响及保鲜技术研究[D].西安:陕西师范大学, 2019.
CHEN H.Effects of 1-MCP and Na2S2O5 compound new preservative on postharvest physiology of red grapes and its preservation technology[D].Xi'an:Shaanxi Normal University, 2019.
[12] 袁军伟, 赵胜建, 魏建梅, 等.葡萄采后生理及贮藏保鲜技术研究进展[J].河北农业科学, 2009, 13(4):80-83.
YUAN J W, ZHAO S J, WEI J M, et al.Research progress on postharvest physiology and storage technique of grape[J].Journal of Hebei Agricultural Sciences, 2009, 13(4):80-83.
[13] 王辰. 葡萄贮藏期果实褐变现象及影响因素研究[D].天津:天津商业大学, 2016.
WANG C.Study on browning phenomenon and influencing factors of grape fruit during storage[D].Tianjin:Tianjin University of Commerce, 2016.
[14] WOLFE-SIMON F, GRZEBYK D, SCHOFIELD O, et al.The role and evolution of superoxide dismutases in algael[J].Journal of Phycology, 2005, 41(3):453-465.
[15] KANG K A, PIAO M J, KIM K C, et al.Fisetin attenuates hydrogen peroxide-induced cell damage by scavenging reactive oxygen species and activating protective functions of cellular glutathione system[J].In Vitro Cellular and Developmental Biology Animal, 2014, 50(1):66-74.
[16] IMAHORI Y, KODERA K, ENDO H, et al.The seasonal variation of redox status in komatsuna (Brassica rapa var.perviridis) leaves[J].Scientia Horticulturae, 2016, 210:49-56.
[17] LISZKAY A, VAN DER ZALM E, SCHOPFER P. Production of reactive oxygen intermediates ![]() H2O2, and ·OH) by maize roots and their role in wall loosening and elongation growth[J]. Plant Physiology, 2004, 136(2):3 114-3 123.
H2O2, and ·OH) by maize roots and their role in wall loosening and elongation growth[J]. Plant Physiology, 2004, 136(2):3 114-3 123.
[18] FRIDOVICH I.Superoxide dismutases:Defence against endogenous superoxide radical[M]//Novartis Foundation Symposia. Chichester: John Wiley &Sons, Ltd., 2008:77-93..
[19] 王良艳, 张有林, 张润光, 等.1-甲基环丙烯复合焦亚硫酸钠处理对厚皮甜瓜的保鲜效果[J].食品科学, 2012, 33(12):294-298.
WANG L Y, ZHANG Y L, ZHANG R G, et al.Fresh-keeping effect of 1-MCP combined with Na2S205 on muskmelon (Cucumis melo)[J].Food Science, 2012, 33(12):294-298.
[20] ASADA K.Ascorbate peroxidase a hydrogen peroxide-scavenging enzyme in plants[J].Physiologia Plantarum, 1992, 85(2):235-241.
[21] MØLLER I M, JENSEN P E, HANSSON A.Oxidative modifications to cellular components in plants[J].Annual Review of Plant Biology, 2007, 58:459-481.
[22] WANG T, HU M J, YUAN D B, et al.Melatonin alleviates pericarp browning in litchi fruit by regulating membrane lipid and energy metabolisms[J].Postharvest Biology and Technology, 2020, 160:111066.
[23] 周江. 二氧化硫(SO2)间歇熏蒸对红地球葡萄采后品质的影响[D].乌鲁木齐:新疆农业大学, 2016.
ZHOU J.Effects of SO2 intermittent fumigation on postharvest quality of red globe grapes during storage[D].Urumqi:Xinjiang Agricultural University, 2016.
[24] ZHAN L J, LI Y, HU J Q, et al.Browning inhibition and quality preservation of fresh-cut romaine lettuce exposed to high intensity light[J].Innovative Food Science and Emerging Technologies, 2012, 14:70-76.
[25] 孙扬扬. 基于膜脂代谢的常温贮藏南果梨果心褐变机理及调控研究[D].沈阳:沈阳农业大学, 2020.
SUN Y Y.Study on browning mechanism and regulation of Nanguo pear core stored at room temperature based on membrane lipid metabolism[D].Shenyang:Shenyang Agricultural University, 2020.