樟芝(Antrodia cinnamomea/camphorata或Taiwanofungus camphoratus),又名牛樟芝、牛樟菇、樟生薄孔菌等[1],是一种隶属于担子菌亚门、层菌纲、非褶菌目、多孔菌科、薄孔菌属的珍稀药食两用真菌[2]。樟芝野生子实体多呈红色或黄棕色,形状不规则,有板状、马蹄状或塔状等[3]。樟芝唯一的天然宿主是牛樟树(Cinnamomum kanehirae Hay),常分布在海拔450~2 000 m温暖湿润及土壤肥沃的山坡或山谷中[4]。樟芝子实体或菌丝体中拥有众多活性物质,如三萜、多糖、腺苷、氨基酸、马来酸及琥珀酸衍生物及泛琨衍生物等[5-7]。这些活性物质表现出多种生物活性,如保肝、抗炎、抗氧化、抗肿瘤、抗病毒、降血压、降血脂及调节免疫等[8-10]。由于其出众的生物活性,樟芝具有较大的市场需求,但野生樟芝子实体生长缓慢,数量稀少,价格昂贵且供不应求[11]。为了弥补樟芝资源,人们对樟芝的人工培养进行了大量研究[12-14]。其中,基于樟芝无性孢子接种的深层发酵法,由于具有发酵周期短、生产效率高、易于规模化等优点,已成为目前最普遍、最高效的人工培养方式[15]。
但是,樟芝深层发酵大规模生产过程中仍然存在一些问题,如作为种子的樟芝无性孢子产量低且培养周期长[16],从而增加了种子制备成本,在一定程度上限制了樟芝深层发酵生产效率及效益。因此,提高樟芝深层发酵产孢量及产孢速度,进而提高种子制备效率,是进一步提高樟芝深层发酵工业化生产效率、降低生产成本的关键所在[16]。研究表明,添加金属离子能影响真菌产孢。如朱炎平等[17]发现,Zn2+及Fe2+能够显著促进虫生真菌粉虱座壳孢(Aschersonia aleyrodis Webber)产孢,Cu2+则强烈抑制其菌丝体的生长;刘雨佳[18]发现,低浓度的Fe3+显著促进玉米小斑病菌(Cochliobolus heterostrophus)产孢;李芳等[19]发现,低浓度的锌离子对球孢白僵菌(Beauveria bassiana)的产孢量有显著促进作用;王震[20]发现,Fe2+能够促进虫生真菌扁座壳孢菌(Aschersonia placenta)产孢;![]() 等[21]发现,在培养基中添加Cu2+可以显著增加黑曲霉(Aspergillus niger)的产孢量。
等[21]发现,在培养基中添加Cu2+可以显著增加黑曲霉(Aspergillus niger)的产孢量。
以上研究表明,金属离子对真菌产孢具有较为明显的影响,但关于金属离子对樟芝深层发酵无性产孢的影响及其组合优化的研究相对较少。因此,本文从常见金属离子中筛选出能显著促进樟芝深层发酵无性产孢的金属离子并优化其组合及添加浓度,以提高樟芝深层发酵产孢量及产孢速度,进而提高樟芝深层发酵大规模生产效率及效益。
1 材料与方法
1.1 材料与仪器
本文所用樟芝菌株购自“美国菌种保藏中心”(American Type Culture Collection,ATCC),编号为ATCC 200183;PDA培养基购自生工生物工程(上海)股份有限公司;ZnCl2、FeCl2·4H2O、CaCl2、MgCl2·6H2O、AlCl3、CuCl2·2H2O及培养基组分等常规试剂均购自国药集团化学试剂有限公司,纯度均为分析纯。
BSA124S电子天平,德国Sartorius公司;HH-2恒温水浴锅,常州国华公司;QT-3多功能摇床,上海琪特公司;SW-CJ-2F无菌操作台,苏州华宇公司;TG-16 WS台式高速离心机、移液枪/枪头,德国Eppendorf公司;MDF-U5386S西门子冰箱,德国Siemens公司;XSP-18A显微镜,上海彼爱姆公司。
1.2 培养基
1.2.1 斜面培养基
本文所用斜面培养基为商用PDA培养基。
1.2.2 种子培养基
葡萄糖2%(质量分数,下同),酵母粉0.1%,KH2PO4 0.3%,MgSO4·7H2O 0.3%,pH 4.5,121 ℃灭菌20 min后,冷却备用。
1.2.3 发酵培养基
葡萄糖2%,酵母粉0.4%,MgSO4·7H2O 0.3%,KH2PO4 0.3%,初始pH 4.5,121 ℃灭菌20 min后,冷却备用。
1.3 樟芝种子制备及孢子计数
用接种铲将培养好的樟芝斜面菌丝体接种到装有100 mL种子培养基的500 mL锥形瓶中并用转子通过磁力搅拌打碎,26 ℃、150 r/min振荡培养12~14 d后,用4层无菌纱布过滤,滤液即为樟芝种子(即无性孢子悬浮液)。吸取50 μm樟芝孢子悬浮液,用血球计数板在显微镜下计数,并计算产孢量,单位为“个/mL”。
1.4 樟芝深层发酵
将计数后的樟芝种子按1.0×106个/mL的接种量接种到装有100 mL发酵培养基的500 mL锥形瓶中,26 ℃,150 r/min培养11 d。
1.5 金属离子对樟芝深层发酵无性产孢的影响
1.5.1 单因素试验
将CaCl2配制成浓度为10 mol/L的母液,即Ca2+母液(下同);将CuCl2·2H2O、NaCl、AlCl3、MgCl2·6H2O、ZnCl2及FeCl2·4H2O等6种金属离子氯化物分别配制成浓度为1 mol/L的母液。在配制培养基时,根据所需添加浓度吸取相应体积对应的金属离子母液加入樟芝发酵培养基中,然后按1.4中的方法进行接种及发酵培养,在6~11 d取样检测产孢量和/或生物量。以添加相同体积去离子水为对照组。
1.5.2 响应面试验
首先,根据单因素试验结果,选择促进产孢效果较好的Ca2+、Fe2+及Zn2+进行响应面优化,并确定3种金属离子的中心点及步长;随后,采用Design-Expert软件设计三因素三水平组合表,在配制樟芝发酵培养基时,各组按软件设计组合表中的浓度添加相应体积的Ca2+、Fe2+及Zn2+母液,然后按1.4中的方法进行接种及发酵培养,在6~11 d取样检测产孢量和/或生物量;最后,采用Design-Expert软件对数据进行分析、作图及拟合方程,然后根据所得三元二次方程计算出Ca2+、Fe2+及Zn2+各自的最佳添加浓度及理论最大产孢量。
1.6 检测方法
1.6.1 生物量的检测
将发酵液用4层纱布过滤,收集滤渣,75 ℃烘干至恒重,称重并计算生物量。
1.6.2 胞内多糖含量的检测
参照文献[16]中的方法采用称重法测定樟芝胞内多糖含量。即准确称取干燥并粉碎后的菌粉2 g于10 mL比色管中,加10 mL去离子水,95 ℃水浴提取1 h,重复提取3次,将上清转移至50 mL离心管中,浓缩至10 mL后加入30 mL无水乙醇,4 ℃静置过夜,8 000 r/min离心10 min,将沉淀75 ℃烘干后称重,即得胞内粗多糖的质量。
1.6.3 总三萜含量的检测
参照文献[22]中的方法采用香草醛-高氯酸法测定樟芝菌丝体中总三萜含量。即,先以齐墩果酸为标准品绘制标准曲线。再精确称取干燥并粉碎后的菌粉100 mg于2 mL EP管中,加入1 mL甲醇,50 Hz超声30 min后振荡提取1 h,8 000 r/min离心10 min后,吸取上清液100 μL于10 mL具塞试管中,60 ℃水浴蒸干,加入0.3 mL新鲜配制的质量浓度为50 g/L的香草醛-冰醋酸溶液和1 mL的高氯酸,60 ℃反应20 min,冰水冷却,加10 mL冰醋酸,摇匀,在550 nm波长下测定吸光度,根据标准曲线计算总三萜的含量。
1.7 数据统计及分析
本文所有实验组均设置至少3个生物重复,所有数据均采用“平均值±标准差”的形式展示,用Origin Pro 8.0软件进行绘图,用SPASS PASW Statistics 18.0软件进行差异显著性分析,差异显著水平为P<0.05。
2 结果与分析
2.1 不同金属离子对樟芝深层发酵无性产孢的影响
2.1.1 不同浓度Cu2+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Cu2+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.2、2.0、20 mmol/L的CuCl2·2H2O母液(Cu2+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图1所示。
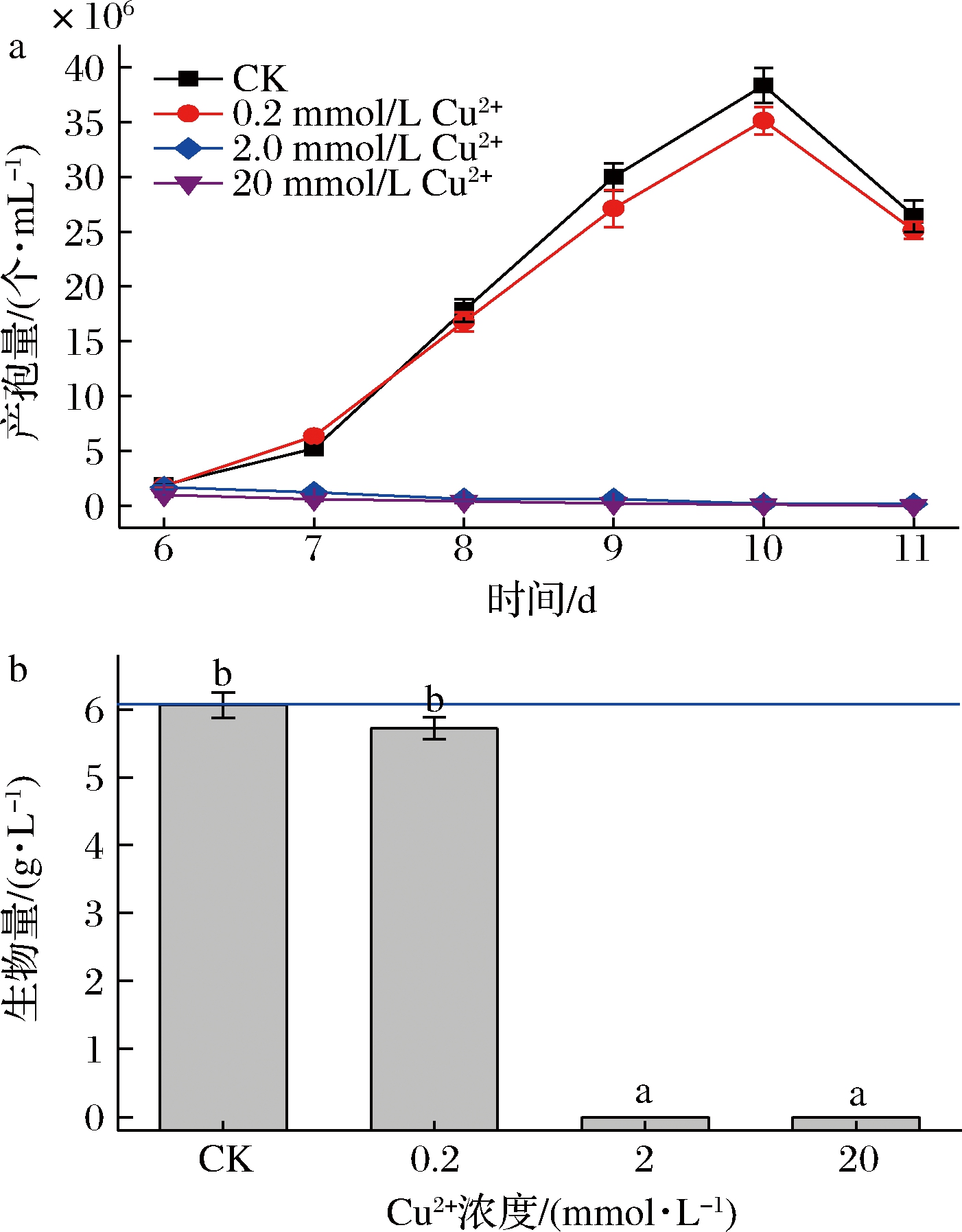
a-产孢量;b-生物量
图1 不同浓度Cu2+对樟芝深层发酵产孢量及生物量的影响
Fig.1 Effects of the different concentrations of Cu2+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
注:CK表示空白对照,即不添加任何金属离子;不同小写字母 表示差异显著(P<0.05)(下同)
从图1可以看出,添加0.2~20 mmol/L的 Cu2+对樟芝深层发酵无性产孢及菌体生长均无促进效果。相反,当Cu2+浓度过高(2.0 mmol/L以上)时,还会完全抑制樟芝菌体生长,使得生物量为0,相应的产孢量亦为0。可见,添加Cu2+不利于樟芝深层发酵无性产孢。
2.1.2 不同浓度Na+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Na+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加终浓度分别为0.2、2.0、20 mmol/L的NaCl母液(Na+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图2所示。

a-产孢量;b-生物量
图2 不同浓度Na+对樟芝深层发酵产孢量及 生物量的影响
Fig.2 Effects of the different concentrations of Na+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
从图2可以看出,添加0.2~20 mmol/L的Na+对樟芝深层发酵无性产孢均无促进效果;添加2 mmol/L Na+对樟芝菌体生长有显著促进效果,此时生物量显著高于其他组,但产孢量却明显低于对照组。可见,添加Na+对樟芝深层发酵无性产孢无促进效果。
2.1.3 不同浓度Al3+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Al3+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.1、0.2、0.5、1.0、2.0 mmol/L的AlCl3母液(Al3+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图3所示。

a-产孢量;b-生物量
图3 不同浓度Al3+对樟芝深层发酵产孢量及生物量的影响
Fig.3 Effects of the different concentrations of Al3+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
从图3可以看出,添加0.1~0.2 mmol/L的Al3+对樟芝深层发酵无性产孢有一定的促进作用;其中,0.2 mmol/L的Al3+对樟芝菌体的生长表现为明显促进作用;但当Al3+的添加浓度高于0.5 mmol/L时,对樟芝深层发酵无性产孢及菌体生长均呈现出显著抑制效果;当Al3+的添加浓度达到2.0 mmol/L时,樟芝产孢量降为0,菌体生长也受到严重抑制。可见,添加低浓度(0.1~0.2 mmol/L)的Al3+对樟芝深层发酵无性产孢有一定的促进作用,但效果并不明显;且需严格控制好添加浓度,否则反而会抑制樟芝无性产孢及菌体生长。
2.1.4 不同浓度Mg2+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Mg2+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.1、0.5、1.0、5.0、10 mmol/L的MgCl2·6H2O母液(Mg2+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图4所示。
从图4可以看出,添加0.1~10 mmol/L的Mg2+对樟芝深层发酵无性产孢均呈现出不同程度的抑制作用,且抑制效果随浓度的增加而增强;添加低浓度(0.1~0.5 mmol/L)的Mg2+对樟芝深层发酵菌体生长呈现出显著(P<0.05)促进作用,但此时产孢量并没有相应地增加。可见,添加Mg2+对樟芝深层发酵无性产孢无促进效果。

a-产孢量;b-生物量
图4 不同浓度Mg2+对樟芝深层发酵产孢量及 生物量的影响
Fig.4 Effects of the different concentrations of Mg2+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
2.1.5 不同浓度Zn2+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Zn2+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.05、0.1、0.2、0.5、1.0 mmol/L的ZnCl2母液(Zn2+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图5所示。
从图5可以看出,添加0.05~0.2 mmol/L的Zn2+可明显促进樟芝深层发酵无性产孢及菌体生长;其中,添加0.1 mmol/L的Zn2+对樟芝菌体生长及无性产孢的促进效果最为显著,可使樟芝最大产孢量(5.08×107个/mL)较对照组提高35.05%;但当Zn2+的添加浓度高于0.5 mmol/L时,则对樟芝深层发酵无性产孢及菌体生长均呈现出明显抑制效果;当Zn2+的添加浓度达到1.0 mmol/L时,樟芝菌体生长受到完全抑制,生物量为0,相应的产孢量亦为0。可见,添加低浓度(0.05~0.2 mmol/L)的Zn2+对樟芝深层发酵菌体生长及无性产孢均有明显促进作用,但需严格控制好添加浓度,否则会适得其反。
2.1.6 不同浓度Fe2+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Fe2+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.05、0.1、0.2、0.3、0.4、0.5 mmol/L的FeCl2·4H2O母液(Fe2+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图6所示。

a-产孢量;b-生物量
图5 不同浓度Zn2+对樟芝深层发酵产孢量及生物量的影响
Fig.5 Effects of the different concentrations of Zn2+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin

a-产孢量;b-生物量
图6 不同浓度Fe2+对樟芝深层发酵产孢量及生物量的影响
Fig.6 Effects of the different concentrations of Fe2+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
从图6可以看出,添加0.05~0.2 mmol/L的Fe2+可明显促进樟芝深层发酵无性产孢及菌体生长;其中,添加0.1 mmol/L的Fe2+对樟芝菌体生长及无性产孢的促进效果最为显著,可使樟芝最大产孢量(6.74×107个/mL)较对照组提高72.39%;此外,添加0.2 mmol/L的Fe2+对樟芝菌体生长及无性产孢的促进效果亦较为显著,可使樟芝最大产孢量(6.01×107个/mL)较对照组提高53.66%;但当Fe2+的添加浓度高于0.4 mmol/L时,则对樟芝深层发酵菌体生长呈现出明显抑制效果,同时,完全抑制樟芝无性产孢,使得产孢量降为0。可见,添加低浓度(0.05~0.2 mmol/L)的Fe2+对樟芝深层发酵菌体生长及无性产孢均有较为显著地促进作用,但需严格控制好添加浓度,否则会适得其反。
2.1.7 不同浓度Ca2+对樟芝深层发酵无性产孢的影响
为了考察不同浓度的Ca2+对樟芝深层发酵无性产孢的影响,按1.5.1中的方法在发酵培养基中添加最终浓度分别为0.2、1.0、2.0、5.0、10 mmol/L的CaCl2母液(Ca2+),以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,在发酵第10天取样检测生物量,结果如图7所示。

a-产孢量;b-生物量
图7 不同浓度Ca2+对樟芝深层发酵产孢量 及生物量的影响
Fig.7 Effects of the different concentrations of Ca2+ on sporulation and biomass by Antrodia cinnamomea in submerged fermentatioin
从图7可以看出,添加0.2~10 mmol/L的Ca2+均可明显促进樟芝深层发酵无性产孢,但对菌体生长无显著影响;其中,当Ca2+的添加浓度为1.0 mmol/L时,对樟芝深层发酵无性产孢的促进效果最为显著,可使樟芝最大产孢量(6.76×107个/mL)较对照组提高87.21%;当Ca2+的添加浓度为0.2 mmol/L时,对樟芝深层发酵无性产孢亦有较为显著的促进效果,可使樟芝最大产孢量(5.34×107个/mL)较对照组提高47.73%;此外,当Ca2+的添加浓度为0.2~5.0 mmol/L时,对樟芝深层发酵无性产孢均有显著的促进效果,可使樟芝最大产孢量较对照组提高35.30%~75.03%。可见,添加Ca2+能极为显著地促进樟芝深层发酵无性产孢,且有效浓度范围较广,添加浓度为0.2~10 mmol/L之间均有较为显著的促进效果。
2.2 响应面优化金属离子组合
上述结果表明,在培养基中添加Ca2+、Fe2+及Zn2+对樟芝深层发酵无性产孢具有较为明显的促进效果,为了确定Ca2+、Fe2+及Zn2+组合时各自的最佳添加浓度,以最大限度地发挥3种金属离子对樟芝无性产孢的促进效果,采用响应面法对Ca2+、Fe2+及Zn2+的添加浓度进行了优化。
首先,根据前期单因素试验结果,对Fe2+、Ca2+及Zn2+的添加浓度3个水平(-1,0,1)设置如表1所示。
表1 各因素添加浓度水平表 单位:mmo/L
Table 1 The levels of factors for response surface methodology

水平Fe2+(A)Ca2+(B)Zn2+(C)-10.050.50.0500.152.00.1510.253.50.25
随后,以Fe2+、Ca2+及Zn2+的添加浓度为自变量,以最大产孢量为因变量,采用Design-Expert软件设计三因素三水平响应面优化组合,相关组合及试验结果如表2所示。
接下来,采用Design-Expert软件对响应面试验结果进行回归模型分析,分析结果如表3所示。
由表3可知,该实验模型显著(P<0.05),失拟项不显著(P> 0.05),说明用该模型对本实验结果中的数据进行拟合较为合理。此外,决定系数为0.932 7,说明该模型拟合结果可以很好地描述及反应真实情况。
同时,采用Design-Expert软件对响应面试验中各因素间交互作用进行分析,结果如图8所示。
表2 响应面实验设计及结果
Table 2 The test design and results of response surface methodology

序号ABC最大孢子量×10-6/(个·mL-1)10.050.50.1555.5020.250.50.1562.7830.053.50.1553.1640.253.50.1558.5450.052.00.0559.3960.252.00.0558.2570.052.00.2563.6380.252.00.2544.9690.150.50.0544.11100.153.50.0554.30110.150.50.2555.99120.153.50.2555.14130.152.00.1551.35140.152.00.1586.25150.152.00.1572.11160.152.00.1575.50170.152.00.1585.97
表3 回归模型方差分析
Table 3 Analysis of variance of regression model
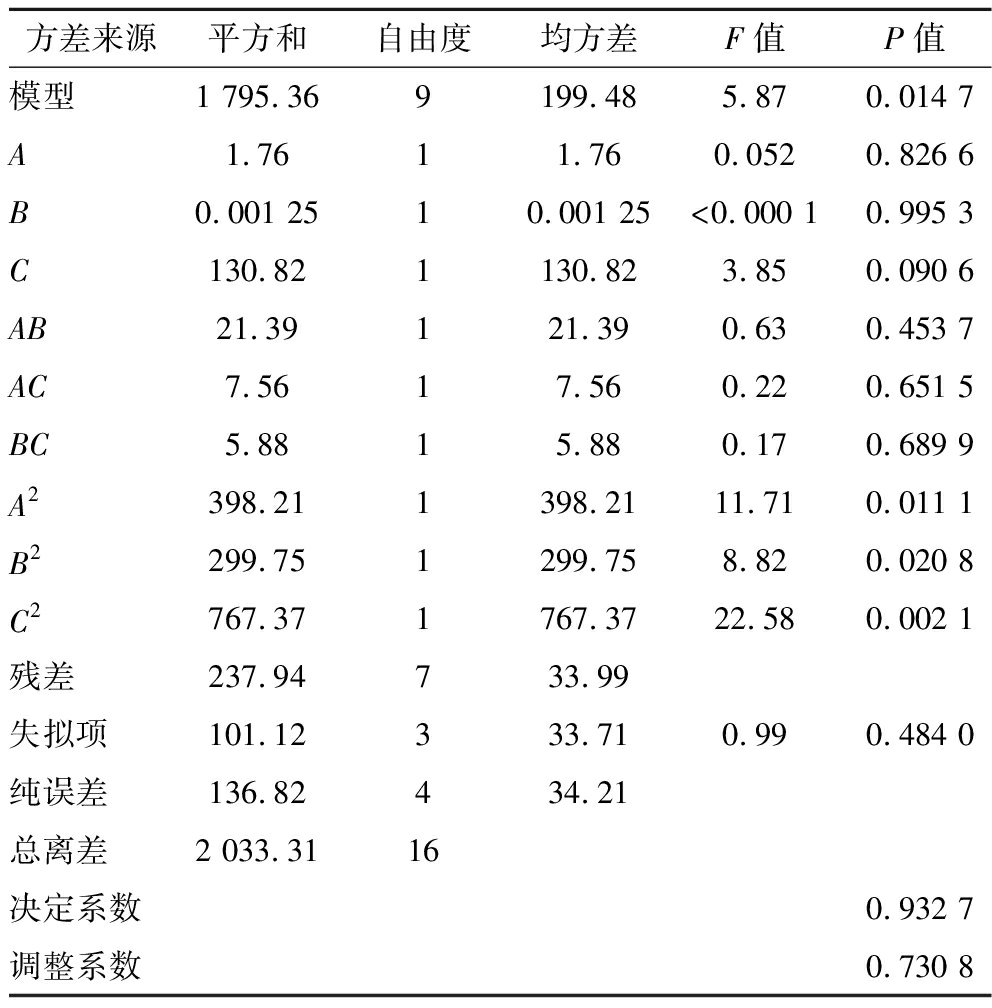
方差来源平方和自由度均方差F值P值模型1 795.369199.485.870.014 7A1.7611.760.0520.826 6B0.001 2510.001 25<0.000 10.995 3C130.821130.823.850.090 6AB21.39121.390.630.453 7AC7.5617.560.220.651 5BC5.8815.880.170.689 9A2398.211398.2111.710.011 1B2299.751299.758.820.020 8C2767.371767.3722.580.002 1残差237.94733.99失拟项101.12333.710.990.484 0纯误差136.82434.21总离差2 033.3116决定系数0.932 7调整系数0.730 8
从各因素间交互作用(图8)来看,任意2个因素之间的交互作用响应面图均为拱形曲面,说明各因素的添加浓度水平设计及最大产孢量结果均非常合理,各因素的最佳添加浓度均被覆盖且在中心点附近。

图8 各因素之间的交互作用
Fig.8 Interaction between factors
最后,用Design-Expert软件模拟出各因素与最大产孢量之间的三元二次回归方程如下:
最大产孢量=9.600 76+313.162 50A+15.707 78B+454.041 67C+17.45AB- 155.75AC-9.133 33BC-1 100A2-4.241 11B2-1 527.25C2。通过计算得出,各因素的最佳添加浓度为:A(Fe2+)0.149 mmol/L,B(Ca2+)2.01 mmol/L,C(Zn2+)0.135 mmol/L,此时响应值产孢量达到理论极大值7.94×107个/mL。
2.3 金属离子组合验证实验
为了验证响应面优化结果,在培养基中同时添加最终浓度分别为0.149 mmol/L的Fe2+、2.01 mmol/L的Ca2+及0.135 mmol/L的Zn2+,以添加相同体积去离子水为空白对照,分别在发酵6~11 d取样进行孢子计数,其中发酵第9天时取样2次,同时,在发酵第10天取样检测生物量、胞内多糖含量及总三萜产量,结果如图9所示。
从图9-a可以看出,在培养基中按最佳浓度同时添加Ca2+、Fe2+及Zn2+的组合方式对樟芝深层发酵无性产孢的促进效果较为显著,其可使樟芝深层发酵最大产孢量(8.67×107个/mL)较对照组提高133.62%,该产孢量甚至明显高于回归方程预测的极大值,效果较为理想;同时也再次证明,在培养基中同时添加Ca2+、Fe2+及Zn2+的组合确实可以大幅缩短发酵周期,将樟芝深层发酵无性孢子产量达到最大值的时间缩短了24 h,该效果进一步大幅提高了樟芝无性孢子的制备效率,在樟芝深层发酵大规模生产中较有应用价值和前景。
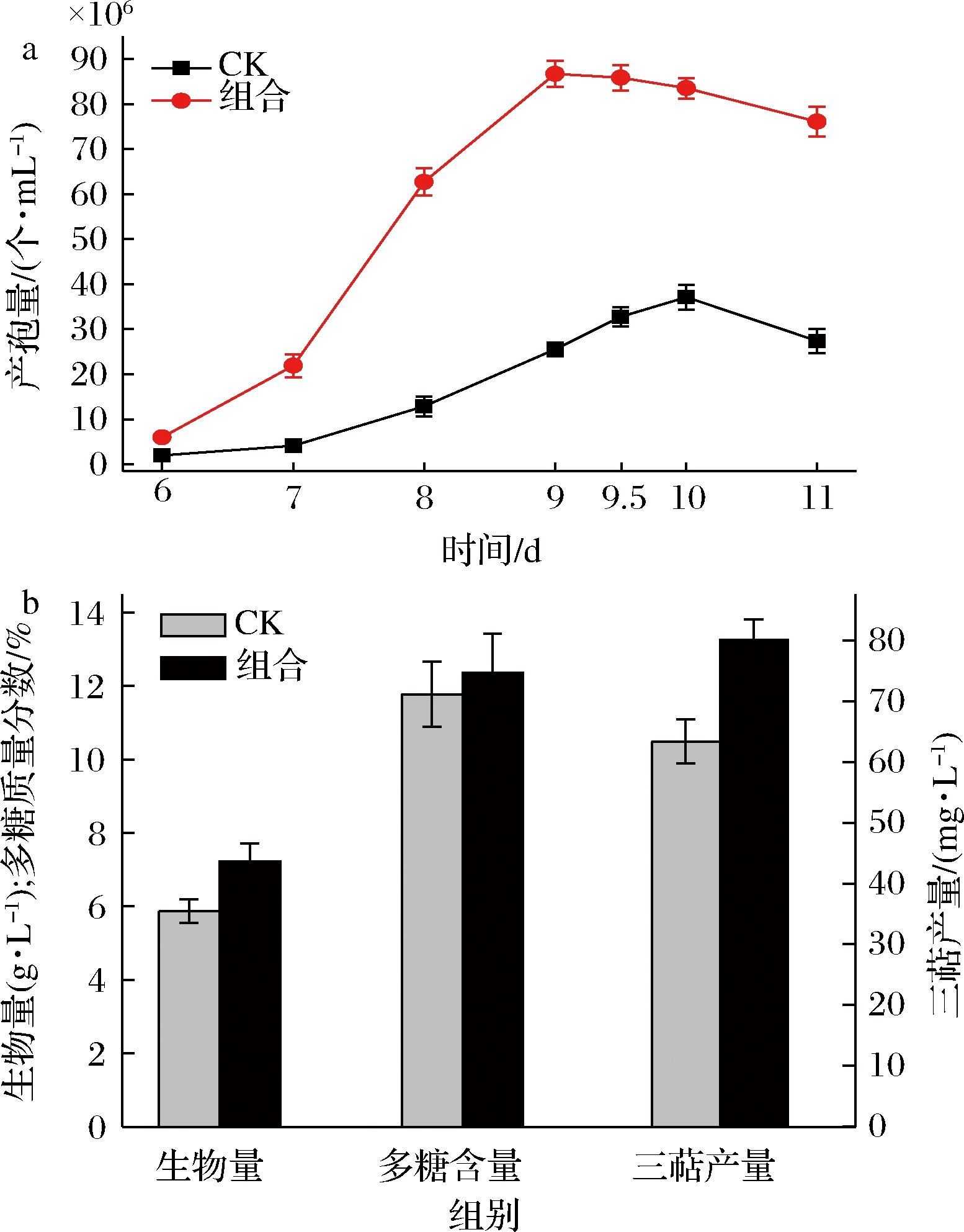
a-产孢量;b-产活性物质
图9 金属离子组合对樟芝深层发酵产孢及产活性 物质的影响
Fig.9 Effects of metal ions cocktail on spore and active substance production by Antrodia cinnamomea in submerged fermentation
注:CK表示空白对照,即培养基中不添加任何效应物; “组合”表示在培养基中同时添加最终浓度分别为0.149 mmol/L 的Fe2+、2.01 mmol/L的Ca2+及0.135 mmol/L的Zn2+
此外,从图9-b中生物量、胞内多糖含量及总三萜产量的检测结果来看,添加Ca2+、Fe2+及Zn2+的组合对樟芝菌体生长有显著促进作用,使得樟芝生物量较对照组提高了约23%;其次,这3种金属离子的组合对樟芝菌丝体中总三萜的积累也有显著促进作用,使得总三萜含量较对照组提高了约26%;但对樟芝菌丝体中的多糖质量分数无显著影响。
综上,在培养基中同时添加最终浓度分别为0.149 mmol/L的Fe2+、2.01 mmol/L的Ca2+及0.135 mmol/L的Zn2+对樟芝深层发酵无性产孢的促进效果较为显著,同时还可明显增加产孢速度,缩短发酵周期。
3 结论
考察了7种金属离子(Cu2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Ca2+)对樟芝深层发酵无性产孢的影响,发现Cu2+、Na+及Mg2+均对樟芝深层发酵无性产孢无明显促进作用;单独添加0.1 mmol/L的Zn2+、0.1 mmol/L的Fe2+及1.0 mmol/L的Ca2+均可显著促进樟芝深层发酵无性产孢,使得樟芝最大产孢量较对照组分别提高35.05%、72.39%及87.21%。在樟芝发酵培养基中同时添加0.149 mmol/L的Fe2+、2.01 mmol/L 的Ca2+及0.135 mmol/L的 Zn2+对樟芝深层发酵无性产孢的促进效果较为显著,可使樟芝深层发酵最大产孢量较对照组提高133.62%(达8.67×107个/mL),同时使樟芝无性孢子产量达到最大值的时间缩短了24 h。本研究结果使得樟芝深层发酵无性产孢量及产孢速度均显著提高,且操作方便、成本低廉,具有开发价值及应用前景。
[1] 谢春芹, 凡军民, 宋振潇, 等.牛樟芝液体发酵培养最适营养条件优化[J].北方园艺, 2019(19):106-113.
XIE C Q, FAN J M, SONG Z X, et al.Optimization of optimal nutritional conditions for liquid fermentation culture of Antrodia camphorate[J].Northern Horticulture, 2019(19):106-113.
[2] LU C L, LI H X, ZHU X Y, et al.Regulatory effect of intracellular polysaccharides from Antrodia cinnamomea on the intestinal microbiota of mice with antibiotic-associated diarrhea[J].Quality Assurance and Safety of Crops &Foods, 2022, 14(3):124-134.
[3] 黄兴连. 浅谈牛樟芝研究现状[J].南方农业, 2021, 15(21):27-28.
HUANG X L.A brief talk on the present research situation of Antrodia[J].South China Agriculture, 2021, 15(21):27-28.
[4] 李华祥, 石瑀, 罗志珊, 等. 牛樟树提取物促进樟芝深层发酵无性产孢及其应用[J]. 食品与发酵工业, 2022, 48(16):65-71.
LI H X, SHI Y, LUO Z S, et al. Cinnamomum camphora extract promotes asexual sporulation of Antrodia camphorata by submerged fermentation and its application[J]. Food and Fermentation Industries, 2022, 48(16):65-71.
[5] LU Z M, LEI J Y, XU H Y, et al.Optimization of fermentation medium for triterpenoid production from Antrodia camphorata ATCC 200183 using artificial intelligence-based techniques[J].Applied Microbiology and Biotechnology, 2011, 92(2):371-379.
[6] LI H X, LU Z M, GENG Y, et al.Efficient production of bioactive metabolites from Antrodia camphorata ATCC 200183 by asexual reproduction-based repeated batch fermentation[J].Bioresource Technology, 2015, 194:334-343.
[7] GANESAN N, BASKARAN R, VELMURUGAN B K, et al.Antrodia cinnamomea—An updated minireview of its bioactive components and biological activity[J].Journal of Food Biochemistry, 2019, 43(8):e12936.
[8] LI H X, LU Z M, ZHU Q, et al.Comparative transcriptomic and proteomic analyses reveal a flug-mediated signaling pathway relating to asexual sporulation of Antrodia camphorata[J].Proteomics 2017, 17:1700256.
[9] HSIAO H Y, WENG Y M.Hepatoprotective effect of an Antrodia cinnamomea product via a novel process on carbon tetrachloride-induced hepatotoxicity in rats[J].International Journal of Nutrition and Food Sciences, 2018, 7(4):134.
[10] 李华祥, 陆震鸣, 朱青, 等.钙离子调控樟芝深层发酵无性产孢及其分子机制[J].生物工程学报, 2017, 33(7):1 124-1 135.
LI H X, LU Z M, ZHU Q, et al.Effect of calcium on sporulation of Taiwanofungus camphoratus in submerged fermentation[J].Chinese Journal of Biotechnology, 2017, 33(7):1 124-1 135.
[11] 李华祥, 陆震鸣, 耿燕, 等.樟芝深层发酵工艺研究进展[J].菌物学报, 2017, 36(10):1 332-1 345.
LI H X, LU Z M, GENG Y, et al.Recent advance in submerged fermentation of Taiwanofungus camphoratus[J].Mycosystema, 2017, 36(10):1 332-1 345.
[12] LIU X F, XIA Y J, LAI P F H, et al.An increase in cell membrane permeability in the in situ extractive fermentation improves the production of antroquinonol from Antrodia camphorata S-29[J].Journal of Industrial Microbiology and Biotechnology, 2020, 47(2):197-207.
[13] XIA Y J, CHEN Y, LIU X F, et al.Enhancement of antroquinonol production during batch fermentation using pH control coupled with an oxygen vector[J].Journal of the Science of Food and Agriculture, 2019, 99(1):449-456.
[14] ZHANG Y T, LI D Y, WANG Z, et al.Alpha-terpineol affects synthesis and antitumor activity of triterpenoids from Antrodia cinnamomea mycelia in solid-state culture[J].Food &Function, 2018, 9(12):6 518-6 526.
[15] LU Z M, HE Z, LI H X, et al.Modified arthroconidial inoculation method for the efficient fermentation of Antrodia camphorata ATCC 200183[J].Biochemical Engineering Journal, 2014, 87:41-49.
[16] 李华祥. 樟芝无性孢子介导的高效循环发酵策略及其产孢分子机制解析[D].无锡:江南大学, 2017.
LI H X.Arthroconidia-mediated repeated batch fermentation strategy for Antrodia camphorate and underlying mechanism of asexual sporulation[D].Wuxi:Jiangnan University, 2017.
[17] 朱炎平, 邱君志, 谢雪钦, 等.碳源、氮源、金属离子和维生素对虫生真菌粉虱座壳孢孢子萌发、菌丝生长和产孢的影响[C].中国第六届海峡两岸菌物学学术研讨会.北京:中国菌物学会, 2004:123-127.
ZHU J P, QIU J Z, XIE X Q, et al.Effects of carbon sources, nitrogen sources, metal ions and vitamins on spore germination, hyphal growth and sporulation of entomopathogenic fungus Aschersonia aleyrodis Webber[C].Proceedings of the Sixth Cross-strait Symposium on Bacteriology in China.Beijing:Mycological Society of China, 2004:123-127.
[18] 刘雨佳. 玉米小斑病菌(Cochliobolus heterostrophus)转录因子ChhapX基因功能初步研究[D].沈阳:沈阳农业大学, 2020.
LIU Y J.Functional study on transcription factor ChhapX of Cochliobolus heterostrophus[D].Shenyang:Shenyang Agricultural University, 2020.
[19] 李芳, 张珏锋, 钟海英, 等.锌离子响应转录激活因子ZafA对球孢白僵菌锌离子利用及生防潜能的影响[J].菌物学报, 2022, 41(4):570-586.
LI F, ZHANG J F, ZHONG H Y, et al.Effects of zinc-responsive transcriptional activator ZafA on zinc utilization and biocontrol potential of Beauveria bassiana[J].Mycosystema, 2022, 41(4):570-586.
[20] 王震. 扁座壳孢菌生理特性及乳悬剂的初步研究[D].福州:福建农林大学, 2009.
WANG Z.Preliminary study on physiological characteristics and emulstfiable suspension of Aschersonia placenta[D].Fuzhou:Fujian Agriculture and Forestry University, 2009.
[21] ![]() G, BUJD
G, BUJD KOVA H,
KOVA H, ![]() F.Study of fungicidal and antibacterial effect of the Cu (II)-complexes of thiophene oligomers synthesized in ZSM-5 zeolite channels[J].Chemosphere, 2001, 44(3):313-319.
F.Study of fungicidal and antibacterial effect of the Cu (II)-complexes of thiophene oligomers synthesized in ZSM-5 zeolite channels[J].Chemosphere, 2001, 44(3):313-319.
[22] LU Z M, GENG Y, LI H X, et al.Alpha-terpineol promotes triterpenoid production of Antrodia cinnamomea in submerged culture[J].FEMS Microbiology Letters, 2014, 358(1):36-43.