辣椒(Capsicum annuum L.)在我国广泛种植,是重要的蔬菜和经济作物[1]。目前,我国辣椒年播种面积占我国蔬菜总播种面积的8%~10%,产量约1 821万t,产值约2 500亿,其播种面积、产量和产值均位于世界第一[2]。辣椒在我国被大量食用,不仅是调味品,而且还含有蛋白质、膳食纤维、矿物质、维生素C[3]等多种营养素,同时,也是类胡萝卜素等生物活性化合物和具有药用价值的辣椒碱的来源[4-5]。
辣椒采后病害主要有软腐病、炭疽病和灰霉病等[6],其中软腐病是辣椒最重要的细菌性病害,主要由果胶杆菌引起,对我国的辣椒产业造成了巨大的损失。辣椒在贮运过程中若存在伤口,软腐病病原菌会通过伤口侵染辣椒[7]。果实发病后,其主要特征是先出现水浸状暗绿色斑,然后变褐,软腐,并带有一股恶臭味,内部果肉腐烂,果皮变白[8]。在常温25 ℃下,经过2~3 d,辣椒果实便会完全腐烂[6]。因此,细菌性软腐病发病迅速,难以防治。目前,用于防治辣椒采后细菌性软腐病的主要方法是化学杀菌剂。然而,长期使用化学杀菌剂会产生抗药性,并且农药残留会对环境造成严重污染,威胁人体健康[9]。这迫使人们不断去寻找更环保、更安全的生物防治方法来解决辣椒采后软腐病的问题。利用拮抗菌取代化学杀菌剂或降低化学杀菌剂的使用量,是当前控制辣椒病害的一个新途径。因此,筛选新型高效的生物防治拮抗菌,研究其对辣椒病害的防治效果和作用方式,对辣椒采后软腐病控制具有重要意义。
目前,拮抗菌的研究多集中在果蔬真菌性病害控制,而拮抗菌对细菌性病害的控制鲜有报道,本文旨在筛选控制辣椒软腐病病原菌的拮抗菌,明确拮抗菌对辣椒软腐病的控制效果,并分析其控制病害的作用方式,从而降低辣椒采后由软腐病引起的腐烂损失,为辣椒的贮运保鲜提供技术参考。
1 材料与方法
1.1 材料与试剂
新鲜辣椒采自重庆市北碚区(本文所谓辣椒均指辣椒果实),品种为“美人椒”;腐烂辣椒从重庆市小苑菜市场收集得到;筛选拮抗菌的菌群来自本实验室早期从果蔬中分离保存的菌株。
氯化钠,成都科隆化学品有限公司;胰蛋白胨,北京奥博星生物技术有限公司;酵母提取物,英国OXOID;琼脂粉,biosharp;硫酸铵、次氯酸钠,成都科隆化学品有限公司;其余试剂为实验室常用试剂,所有试剂等级为分析纯。
1.2 仪器与设备
灭菌锅,厦门致微仪器有限公司;生化培养箱,上海跃进医疗器械有限公司;摇床,上海旻泉仪器有限公司;离心机,湖南可成仪器设备有限公司;超净台,苏州安泰空气技术有限公司;PCR仪、电转仪,上海伯乐生命医学产品有限公司;扫描电镜,上海复纳科学仪器有限公司;Q Exactive质谱仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 辣椒软腐病病原菌的分离及鉴定
从重庆市小苑菜市场收集到腐烂辣椒,将辣椒均质后用无菌生理盐水进行连续梯度稀释,涂布在LB琼脂平板上,37 ℃过夜培养,挑出可疑的菌落。将可疑菌株回接至新鲜辣椒,出现软腐病症状的菌株使用通用引物27F/1492R扩增16S rDNA序列并测序,利用NCBI(www.ncbi.nlm.nih.gov)BLAST对其进行菌种鉴定。
1.3.2 病原菌的致病性分析
将新鲜培养的病原菌离心,并重新悬浮于生理盐水中,使得菌体浓度分别为106、105、104、103 CFU/mL。参考NANTAWANIT等[10]的方法并稍作修改,将新鲜完好的辣椒用2%(质量分数)次氯酸钠浸泡2 min,清洗3遍,待自然晾干后剪掉果蒂。在辣椒表面用无菌打孔器打孔,每个辣椒打两个孔。每孔加入准备好的病原菌菌悬液30 μL,自然晾干后用保鲜盒包装,置于室温(25 ℃),每天记录辣椒病斑直径,并拍照。每个菌体浓度3个平行,每个平行10个辣椒。
1.3.3 病原菌基因组草图测序
病原菌接种于LB液体培养基中,培养至对数期,离心取菌体,提取基因组DNA,送诺禾致源生物科技有限公司进行Illumina HiSeq二代基因组测序。使用RAST(https://rast.nmpdr.org/rast.cgi)进行基因注释。
1.3.4 拮抗菌的筛选与鉴定
按照YI等[11]描述的双层琼脂平板法进行拮抗菌的筛选,指示菌为1.3.1筛选出的病原菌。将待测菌接种到LB液体培养基中,37 ℃摇床培养12 h,作为种子菌。用接种环将种子菌划线到LB琼脂平板上(2条平行线),37 ℃培养12 h后,倒入含0.1%指示菌的LB琼脂培养基。37 ℃静置培养12~24 h后,观察抑菌圈大小。通过16S rDNA测序进一步鉴定形成抑菌环的拮抗菌。
1.3.5 拮抗菌菌体及其抗菌肽对病原菌的体外控制活性
拮抗菌在LB培养液中培养72 h,离心分别收集菌体和上清液。菌体重新悬浮于生理盐水中。上清液经无菌滤膜过滤,参考GOH等[12]的方法,加入硫酸铵至80%饱和,4 ℃静置过夜,离心,沉淀溶于无菌水中即得抗菌肽溶液。菌体悬浮液和抗菌肽溶液的体外抑菌活性使用ASGHAR等[13]所述牛津杯法进行测定。向孔中加入100 μL样品溶液,37 ℃静置培养12~24 h后,观察并测量抑菌圈大小。重复3次测量。
1.3.6 拮抗菌菌体及其抗菌肽对辣椒软腐病的体内控制活性
辣椒清洗消毒、打孔、接种病原菌操作同1.3.2,除了病原菌菌体浓度为104 CFU/mL,晾干待用。拮抗菌菌体悬浮液与抗菌肽溶液的制取同1.3.5,然后分别加入已准备好的辣椒孔中(每孔30 μL),自然晾干后装入保鲜盒。室温(25 ℃)贮藏3 d,每天观察发病情况并记录病斑直径。30 μL无菌生理盐水代替菌体/抗菌肽的同等处理作为对照。每个处理3平行,每个平行10个辣椒。
1.3.7 拮抗菌菌体及其抗菌肽对辣椒病原菌数量的影响
将本实验室前期构建的含有绿色荧光蛋白(green fluorescent protein,GFP)的重组质粒电击转化至病原菌中。涂布于含有卡那霉素的LB平板上,37 ℃培养,挑取带有绿色荧光的阳性转化子,待用。辣椒的处理同1.3.6,除了所接种的病原菌为绿色荧光蛋白标记菌株。每天取果实伤口处植物组织进行微生物计数,样品在无菌生理盐水中研磨后,稀释涂布到含卡那霉素的LB平板,37 ℃培养,对含有绿色荧光的菌落进行计数。重复5次。
1.3.8 扫描电镜(scanning electron microscope, SEM)观察辣椒表皮结构
按照1.3.6的方法分别使用拮抗菌菌体和抗菌肽处理已接种病原菌的辣椒。参考LI等[14]方法制样,并稍作修改。贮藏第2天取样,用小刀将辣椒伤口附近的植物组织取下(约5 mm×5 mm),并在4 ℃下过夜固定于2.5%戊二醛。接着,分别用20%~100%乙醇脱水20 min,再用100%乙醇脱水30 min。最后,50 ℃真空干燥2 h,使用扫描电镜在5 000×下观察辣椒表皮结构及病原菌的分布情况。
1.3.9 LC-MS/MS鉴定抗菌肽
1.3.5制得的抗菌肽用3 K超滤管过滤,滤液通过C18固相萃取法脱盐后进行LC-MS/MS分析。样品由自动进样器上样到Zorbax 300SB-C18 peptide traps,再经过液相色谱柱(0.15 mm×150 mm,RP-C18)进行分离,A液为0.1%甲酸水溶液,B液为0.1%甲酸84%乙腈水溶液。样品经毛细管高效液相色谱分离后进行质谱分析,检测方式为正离子,全扫描后采集10个碎片图谱。质谱原始文件用MaxQuant 1.5.5.1检索抗菌肽数据库APD3(http://aps.unmc.edu/AP/main.php)进行多肽鉴定。
1.3.10 拮抗菌基因组草图测序
测序过程同1.3.3。得到的基因组序列应用于BAGEL4数据库(http://bagel4.molgenrug.nl/index.php)进行细菌素合成鉴定。
1.4 数据处理
实验数据通过IBM SPSS Statistics 23进行分析,使用GraphPad Prism 9制图,数据以平均值±标准差(SD)表示,显著性分析以Duncan tests进行方差分析(ANOVA),P<0.05被认为存在显著差异并标注显著性差异。
2 结果与分析
2.1 辣椒软腐病病原菌的分离鉴定
从自然腐烂的辣椒中共分离出11株菌,所有菌株回接至新鲜完好的辣椒后,其中菌株XC1所感染辣椒表现出明显的软腐症状。该菌株经16S rDNA鉴定为胡萝卜软腐病果胶杆菌巴西亚种(Pectobacterium carotovorum subsp.brasiliense,Pcb)。果胶杆菌是蔬菜最主要的细菌性软腐病病原菌,本研究从腐烂辣椒分离到的病原菌也是果胶杆菌。目前,研究者已鉴定出13种果胶杆菌,其中胡萝卜软腐病果胶杆菌(Pectobacterium carotovorum)是最主要的致病种属,其含有4个亚种:carotovorum、brasiliense、odoriferum和actinidiae[15]。巴西亚种已在多种腐烂蔬菜中被分离到,如马铃薯[16]、黄瓜[17]等。QI等[18]也报道了该亚种能够引起辣椒软腐病。
2.2 Pcb XC1的软腐病致病能力分析
尽管已有研究报道胡萝卜软腐病果胶杆菌巴西亚种能够引起辣椒发生软腐病,但是其对辣椒的致病能力并不清楚。Pcb XC1的致病性如图1-A所示。第1天,菌体浓度为104、105、106 CFU/mL处理的辣椒发病率都已经超过50%,第3天,发病率均达到100%。103 CFU/mL菌悬液处理的辣椒在第2天发病率超过50%,在第4天发病率达到了(81.67±8.50)%。4个浓度梯度菌悬液处理辣椒的病斑直径变化如图1-B所示,菌体浓度越高,辣椒的病斑直径越大。但是,到达第4天时,所有浓度梯度已发病辣椒都完全腐烂,他们的病斑直径已无明显差异。辣椒腐烂程度随时间的变化如图2所示。以上结果表明,在Pcb XC1浓度低至103 CFU/mL时,仍能引起辣椒严重的软腐病症,因此,Pcb XC1具有强致病能力。
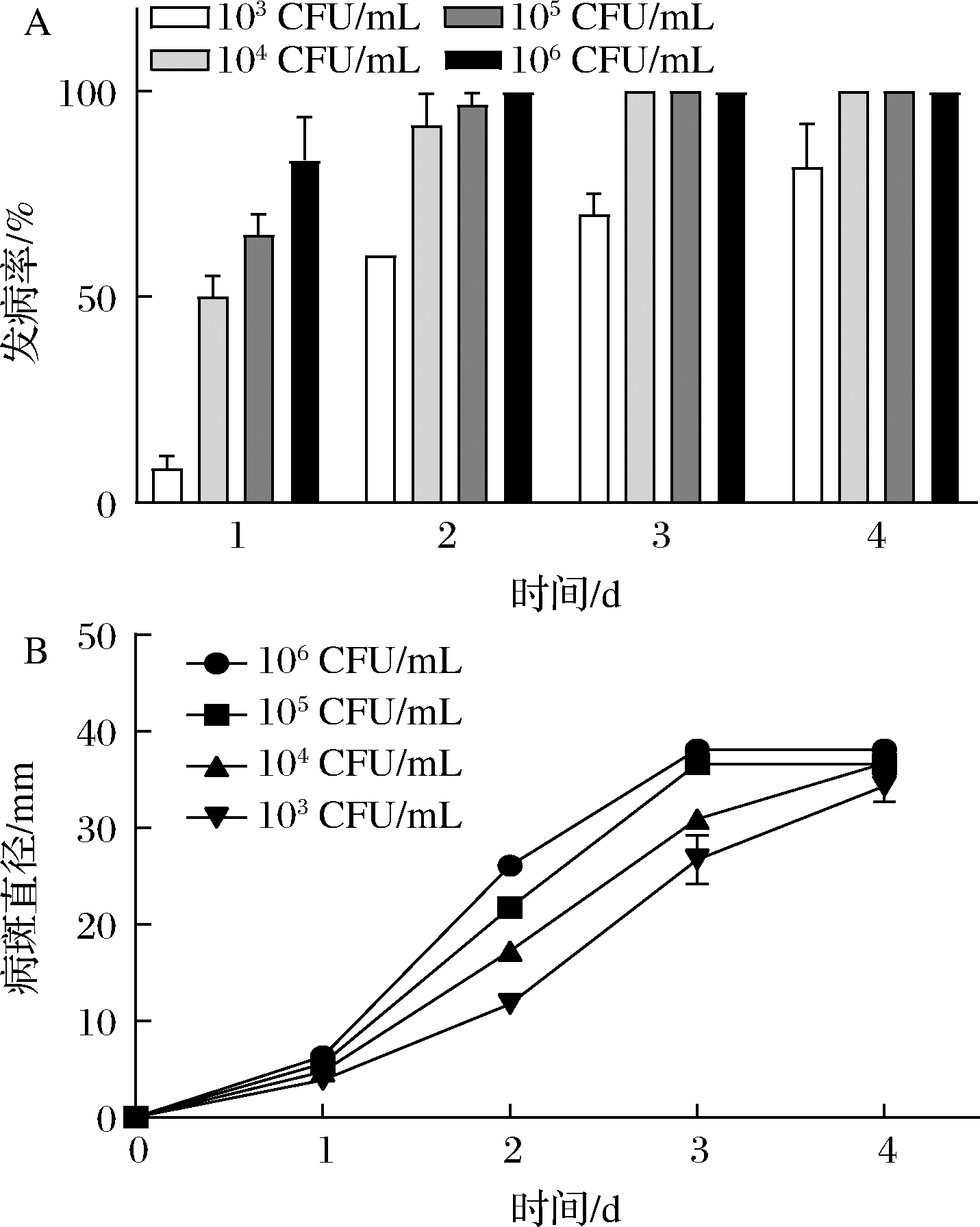
A-发病率;B-病斑直径
图1 25 ℃下不同浓度Pcb XC1菌悬液对辣椒 软腐病的影响
Fig.1 Effect of different concentrations of Pcb XC1 cell suspension on soft rot of pepper at 25 ℃

A-106 CFU/mL;B-105 CFU/mL;C-104 CFU/mL;D-103 CFU/mL
图2 不同浓度Pcb XC1菌悬液处理辣椒的腐烂程度变化
Fig.2 Changes of rot degree of pepper treated by different concentrations of Pcb XC1 cell suspension
2.3 Pcb XC1的软腐病致病因子
Pcb XC1 Illumina测序经组装后的草基因组大小为4 791 512 bp,与报道的Pcb BZA12(4 924 809 bp)[19]基因组大小接近。在Pcb XC1草基因组中鉴定到如表1所示致病的相关蛋白,包括果胶酯酶、果胶甲酯酶、果胶裂解酶、果胶降解蛋白、多聚半乳糖醛酸酶、β-半乳糖苷酶和纤维素酶。这些致病因子能够引起蔬菜细胞壁降解,从而出现软腐症状[20-21]。
表1 Pcb XC1含有的致病性相关蛋白及其氨基酸序列
Table 1 Pathogenicity related proteins and their amino acid sequences contained in Pcb XC1
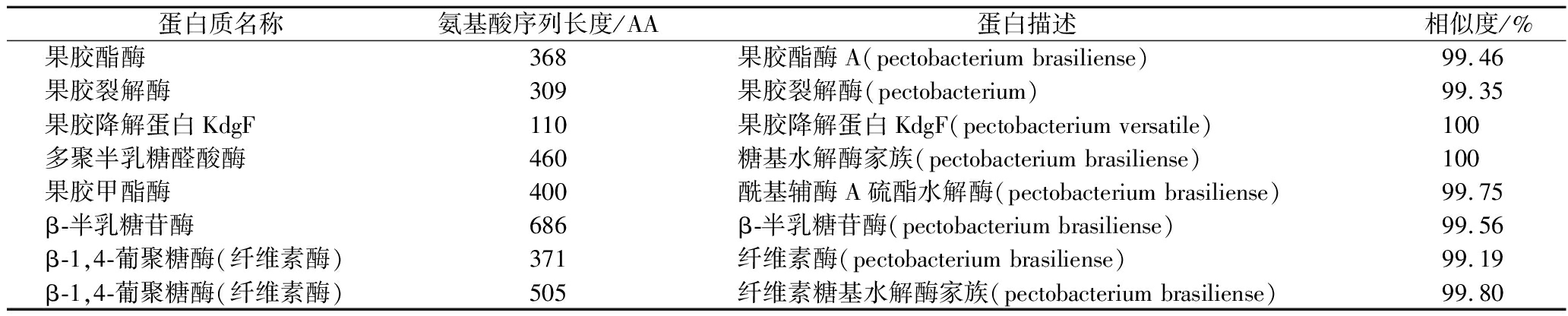
蛋白质名称氨基酸序列长度/AA蛋白描述相似度/%果胶酯酶368果胶酯酶A(pectobacterium brasiliense)99.46果胶裂解酶309果胶裂解酶(pectobacterium)99.35果胶降解蛋白KdgF110果胶降解蛋白KdgF(pectobacterium versatile)100多聚半乳糖醛酸酶460糖基水解酶家族(pectobacterium brasiliense)100果胶甲酯酶400酰基辅酶A硫酯水解酶(pectobacterium brasiliense)99.75β-半乳糖苷酶686β-半乳糖苷酶(pectobacterium brasiliense)99.56β-1,4-葡聚糖酶(纤维素酶)371纤维素酶(pectobacterium brasiliense)99.19β-1,4-葡聚糖酶(纤维素酶)505纤维素糖基水解酶家族(pectobacterium brasiliense)99.80
2.4 拮抗菌筛选及鉴定
筛选出编号为1151的拮抗菌(图3-A),其16S rDNA序列与枯草芽孢杆菌的相似度为98.8%,故命名为枯草芽孢杆菌1151。目前,已经报道过很多枯草芽孢杆菌作为拮抗菌控制蔬菜真菌和细菌病害的例子[22-23],由此可见,枯草芽孢杆菌作为生物防治方法控制蔬菜采后病害具有巨大应用潜力。但是枯草芽孢杆菌控制辣椒软腐病能力并不清楚,因此,接下来本研究进一步分析枯草芽孢杆菌1151控制辣椒软腐病的效果和作用方式。
2.5 枯草芽孢杆菌1151菌体及其抗菌肽对Pcb XC1的体外抑菌活性
枯草芽孢杆菌1151菌体及抗菌肽对病原菌Pcb XC1的体外抑菌活性如图3-B、图3-C所示。枯草芽孢杆菌1151菌体对Pcb XC1的抑菌环直径为(13.93±0.98) mm(图3-B);抗菌肽对Pcb XC1的抑菌环直径为(23.37±0.72) mm(图3-C),即抗菌肽的抑菌环直径显著大于菌体。该结果表明枯草芽孢杆菌1151对辣椒软腐病病原菌具有明显的体外抑制作用,并且该拮抗菌所产抗菌肽可能发挥了重要作用。
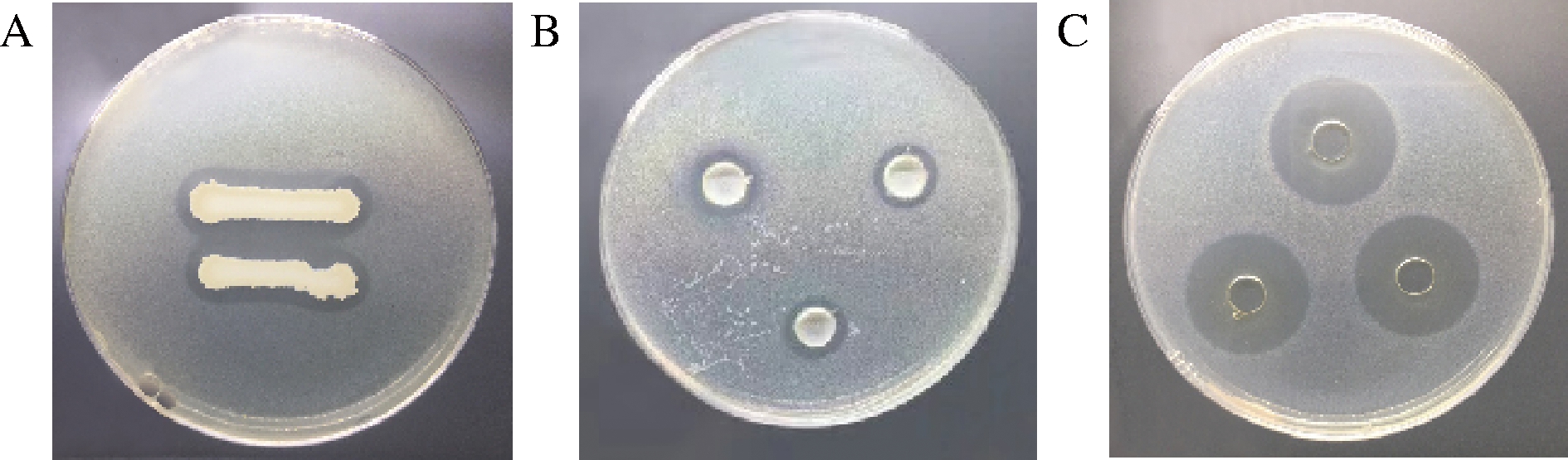
A-枯草芽孢杆菌1151(筛选过程得到); B-枯草芽孢杆菌1151菌体;C-抗菌肽
图3 枯草芽孢杆菌1151不同组分对Pcb XC1的体外抑菌活性
Fig.3 In vitro antibacterial activity of different components of B.subtilis 1151 against Pcb XC1
2.6 枯草芽孢杆菌1151菌体及其抗菌肽对辣椒软腐病的体内控制作用
2.5表明枯草芽孢杆菌1151菌体及其抗菌肽具有较好的体外抑菌活性,我们同时也测定了其对辣椒软腐病的体内控制效果,结果如图4所示。第1天,菌体和抗菌肽处理能显著降低辣椒的发病率(P<0.05),辣椒发病率分别降低了47%和22%(图4-A)。第3天,抗菌肽处理辣椒的发病率与对照相比具有显著差异(P<0.05),发病率降低了10%(图4-A)。如图4-B所示,与对照相比,菌体及抗菌肽处理后连续3 d的病斑直径都显著降低(P<0.05)。处理后的第3天,抗菌肽处理辣椒的病斑直径为(15.23±0.64) mm,菌体处理辣椒的病斑直径为(30.30±0.42) mm,而对照辣椒的病斑直径为(34.93±0.87) mm,即抗菌肽处理使得病斑直径降低了56.4%。以上结果可以看出,菌体可以显著降低辣椒的病斑直径;对发病率的控制前期效果显著,后期无效果。抗菌肽在一定程度上抑制辣椒体内Pcb XC1致病的能力更强,其可以显著降低辣椒的发病率和病斑直径。辣椒腐烂程度随时间变化如图5所示。
2.7 枯草芽孢杆菌1151菌体及其抗菌肽对辣椒体内Pcb XC1数量的影响
2.6结果表明不同方式处理能够不同程度减缓辣椒的腐烂症状,其原因可能与辣椒体内存活的病原菌数量直接相关,因此进一步分析了辣椒体内的Pcb XC1数量,结果如图6所示。不同处理下,辣椒体内绿色荧光标记Pcb XC1的数量均呈现增长趋势,这与图5中不同处理下辣椒均发生了腐烂结果一致。和对照组相比,菌体处理组病原菌的数量在第1、2天显著降低(P<0.01),随着贮藏时间进一步延长,微生物数量无显著差异。然而,抗菌肽处理组辣椒体内的绿色荧光标记Pcb XC1数量在3 d贮藏期内始终显著低于对照组(P<0.01),且最高减少了2个对数(99%)。由此可见,菌体处理组在贮藏前期能够显著抑制辣椒体内病原菌的数量,贮藏后期效果甚微;而抗菌肽处理组在整个贮藏期抑制辣椒体内病原菌生长的能力更强。该结果与2.6不同处理下辣椒腐烂程度结果一致。

A-发病率;B-病斑直径
图4 枯草芽孢杆菌1151不同组分对辣椒软腐病的 体内控制作用
Fig.4 In vivo control effect of different components of B.subtilis 1151 on pepper soft rot
注:不同小写字母表示具有显著性差异(P<0.05)
2.8 枯草芽孢杆菌1151菌体及其抗菌肽对辣椒表面结构的影响
2.6和2.7结果表明枯草芽孢杆菌1151菌体和抗菌肽处理均能减缓辣椒腐烂病症并减少病原菌数量,但控病能力不同,进一步,使用SEM观察辣椒表面组织结构和病原菌分布,结果如图7所示。各处理组之间存在着明显的差异,与只有无菌生理盐水处理的对照1(图7-A)相比,只接种病原菌Pcb XC1的对照2(图7-B)辣椒表皮组织出现了许多褶皱和碎片,这可能是由于病原菌引起辣椒组织细胞壁降解;同时,能够清晰看到Pcb XC1正在入侵辣椒的表皮。和对照2(图7-B)相比,枯草芽孢杆菌1151菌体处理(图7-C)的辣椒表皮组织也出现了一些褶皱和碎片,但程度明显减轻,该结果说明拮抗菌菌体能够减少病原菌引起的辣椒组织细胞壁降解。然而,抗菌肽处理(图7-D)的辣椒表皮却未出现明显的褶皱和碎片,仅能看见少量Pcb XC1分布在表面。该结果表明抗菌肽能够更好地维持辣椒表面结构的完整性,与上述结果一致。

A-Pcb XC1和无菌生理盐水;B-Pcb XC1和 枯草芽孢杆菌1151菌体;C-Pcb XC1和抗菌肽
图5 不同方式处理下的辣椒软腐病病症
Fig.5 Soft rot symptoms of pepper under different treatments
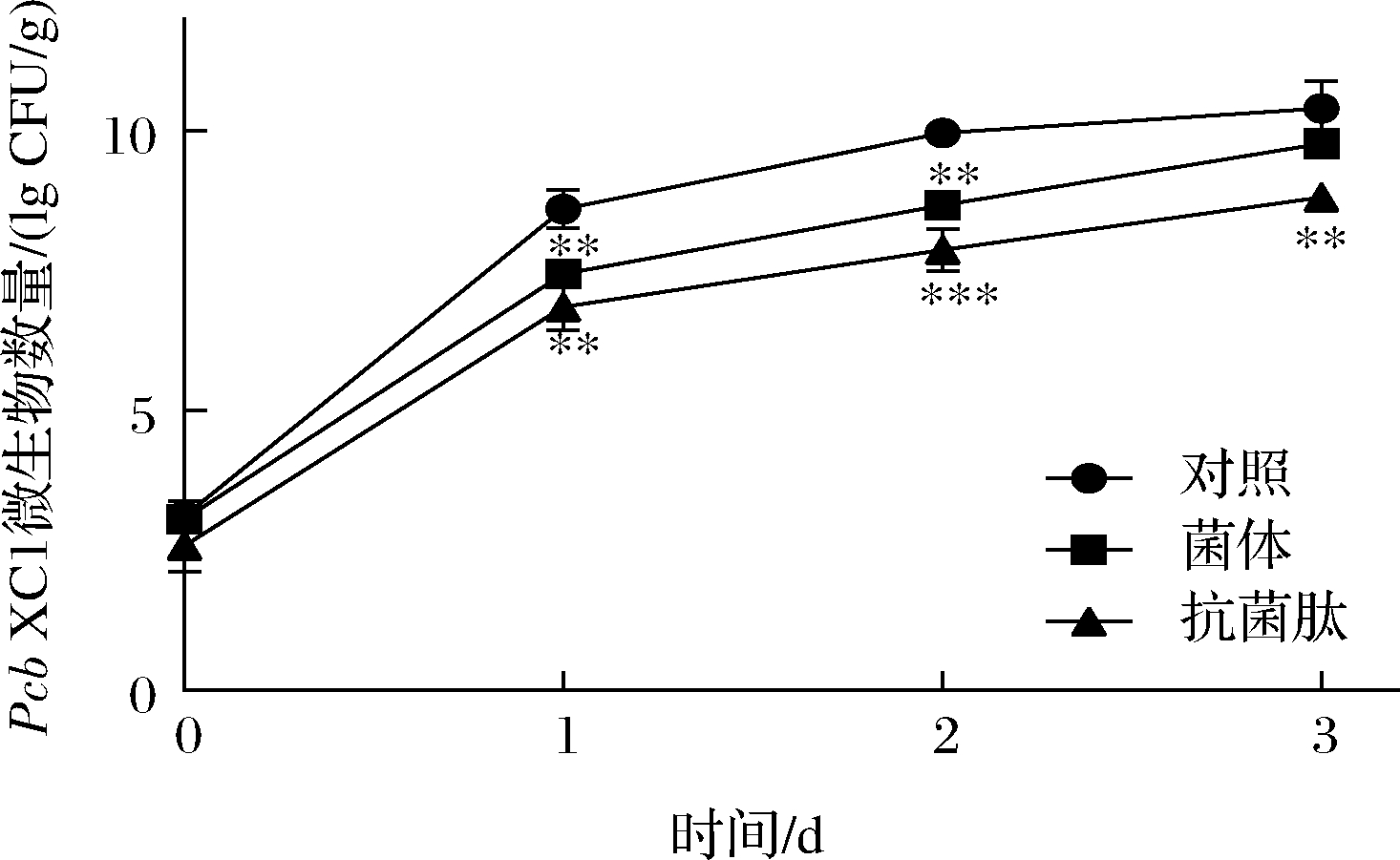
图6 不同方式处理下辣椒体内的绿色荧光标记Pcb XC1数量
Fig.6 Number of green fluorescent labelled Pcb XC1 in pepper under different treatments
注:**(P<0.01)和***(P<0.001)表示对照组与处理组相比, 存在显著差异
2.9 LC-MS/MS分析
2.6~2.8结果均表明枯草芽孢杆菌1151所产抗菌肽具有更强的控制辣椒软腐病的能力,因此使用LC-MS/MS对抗菌肽进行鉴定。经抗菌肽数据库APD3搜索,鉴定到了BHP、SP-B、Hb 98-114 3个抗菌肽,其对应的肽段序列如表2所示。
表2 抗菌肽序列
Table 2 Sequences of antimicrobial peptides

抗菌肽名称抗菌肽氨基酸序列AP01339(BHP)FLSFPTTKTYFPHFDLSHGSAQVKGHGAKAP00889(SP-B)APPGARPPPGPPPPGPPPPGPAP02860(Hb 98-114)FKLLSHSLLVTLASHLP
注:下划线表示质谱鉴定到的肽段

A-无菌生理盐水(对照1);B-Pcb XC1(对照2);C-Pcb XC1 和枯草芽孢杆菌1151菌体;D-Pcb XC1和抗菌肽
图7 辣椒表皮结构及Pcb XC1分布的SEM图
Fig.7 SEM images of pepper epidermis structure and Pcb XC1 distribution
2.10 细菌素合成鉴定
经BAGEL4挖掘,发现一个细菌素基因簇,如图8所示,一共由19个开放阅读框(orf)组成,含有细菌素结构基因、细菌素免疫基因、细菌素合成基因、细菌素调控基因等关键基因[24]。该基因簇上含有2个细菌素结构基因,第一个结构基因为orf8,其氨基酸序列为MKKAVIVENKGCATCSIGAACLVDGPIPDFEIAGATGLF GLWG,与细菌素Subtilosin A相似度为100%。第二个细菌素结构基因为orf9,其氨基酸序列为LKLPVQQVYSVYGGKDLPKGHSHSTMPFLGKLQFLTKI YLLDIHTQPFFI,与细菌素Subtilosin Sbox相似度为98%。这2个细菌素的氨基酸序列信息并未包含在APD3数据库中,因此LC-MS/MS并未搜索到相应的肽段。细菌素属于抗菌肽的一个亚类,枯草芽孢杆菌是常见的细菌素产生菌[25-26]。枯草芽孢杆菌1151产生的细菌素可能在控制辣椒软腐病病原菌时也发挥了重要作用。

图8 枯草芽孢杆菌1151细菌素基因簇
Fig.8 Bacteriocin gene cluster of B.subtilis 1151
3 结论
果胶杆菌是最主要的细菌性软腐病病原菌,在室温(25 ℃)下,果胶杆菌Pcb XC1浓度低至103 CFU/mL时,引起的辣椒腐烂率在4 d内仍达到80%以上。与已大量报道的马铃薯、白菜等蔬菜类似,果胶杆菌也能够导致辣椒严重的腐烂,造成巨大经济损失。绿色防控是降低蔬菜贮运期间腐烂损失的同时保障食品安全健康最有前景的方法。枯草芽孢杆菌1151菌体及其所产的抗菌肽对Pcb XC1表现出较强的体外抑制作用。在辣椒体内,枯草芽孢杆菌1151能够降低软腐病发病率并减小病斑直径,主要是通过其所产抗菌肽发挥作用。其产生的抗菌肽可能包括BHP、SP-B、Hb 98-114、subtilosin A和Subtilosin Sbox。枯草芽孢杆菌1151可作为拮抗菌减轻辣椒采后由细菌性软腐病引起的腐烂损失,为辣椒采后绿色保鲜提供一种可参考的新方法。
[1] CHUAH A M, LEE Y C, YAMAGUCHI T, et al.Effect of cooking on the antioxidant properties of coloured peppers[J].Food Chemistry, 2008, 111(1):20-28.
[2] 王立浩, 张宝玺, 张正海, 等.“十三五”我国辣椒育种研究进展、产业现状及展望[J].中国蔬菜, 2021(2):21-29.
WANG L H, ZHANG B X, ZHANG Z H, et al.Status in breeding and production of Capsicum spp.in China during‘the thirteenth five-year plan’Period and future prospect[J].China Vegetables, 2021, (2):21-29.
[3] KIM W-R, KIM E O, KANG K, et al.Antioxidant activity of phenolics in leaves of three red pepper (Capsicum annuum) cultivars[J].Journal of Agricultural &Food Chemistry, 2014, 62(4):850-859.
[4] CERVANTES-HERN NDEZ F, ALCAL
NDEZ F, ALCAL -GONZ
-GONZ LEZ P, MART
LEZ P, MART NEZ O, et al.Placenta, pericarp, and seeds of Tabasco chili pepper fruits show a contrasting diversity of bioactive metabolites[J].Metabolites, 2019, 9(10):206.
NEZ O, et al.Placenta, pericarp, and seeds of Tabasco chili pepper fruits show a contrasting diversity of bioactive metabolites[J].Metabolites, 2019, 9(10):206.
[5] FABELA-MOR N M F, CUEVAS-BERNARDINO J C, AYORA-TALAVERA T, et al.Trends in capsaicinoids extraction from Habanero chili pepper (Capsicum chinense jacq.):Recent advanced techniques[J].Food Reviews International, 2020, 36(2):105-134.
N M F, CUEVAS-BERNARDINO J C, AYORA-TALAVERA T, et al.Trends in capsaicinoids extraction from Habanero chili pepper (Capsicum chinense jacq.):Recent advanced techniques[J].Food Reviews International, 2020, 36(2):105-134.
[6] 谷会, 朱世江, 詹儒林.辣椒采后软腐病拮抗细菌的分离及生防效果[J].热带作物学报, 2012, 33(7):1 276-1 280.
GU H, ZHU S J, ZHAN R L.Isolation and biocontrol efficacy of antagonistic bacteria against bacterial soft rot of pepper after harvest[J].Chinese Journal of Tropical Crops, 2012, 33 (7):1 276-1 280.
[7] 谷会, 朱世江, 谢江辉.我国北运辣椒贮运保鲜存在的问题及对策[J].广东农业科学, 2011, 38(7):107-110.
GU H, ZHU S J, XIE J H.Existing issues and countermeasures in preservation during storing and transporting of peppers transported to Northern China[J].Guangdong Agricultural Sciences, 2011, 38(7):107-110.
[8] 金苹. 辣椒疮痂病、黑霉病、软腐病、病毒病、猝倒病和白绢病的识别与防治[J].农业灾害研究, 2013,3(52):6-9.
JIN P.Identification and control of scab, black mould disease, soft rot, virus disease, damping-off and southern blight of pepper[J].Journal of Agricultural Catastrophology, 2013,3(52):6-9.
[9] 胡毅, 王微, 兰吉玉, 等.黔东南州辣椒农药残留膳食摄入风险评估[J].世界农药, 2021, 43(9):49-56.
HU Y, WANG W, LAN J Y, et al. Risk assessment of dietary intake of pesticide residues in pepper in Qiandongnan prefecture[J]. World Pesticide, 2021, 43(9):49-56.
[10] NANTAWANIT N, CHANCHAICHAOVIVAT A, PANIJPAN B, et al.Induction of defense response against Colletotrichum capsici in chili fruit by the yeast Pichia guilliermondii strain R13[J].Biological Control, 2010, 52(2):145-152.
[11] YI L H, DANG J, ZHANG L H, et al.Purification, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrug-resistant strains produced by Lactobacillus coryniformis XN8[J].Food Control, 2016, 67:53-62.
[12] GOH H F, PHILIP K.Isolation and mode of action of bacteriocin BacC1 produced by nonpathogenic Enterococcus faecium C1[J].Journal of Dairy Science, 2015, 98(8):5 080-5 090.
[13] ASGHAR M A, YOUSUF R I, SHOAIB M H, et al.Antibacterial, anticoagulant and cytotoxic evaluation of biocompatible nanocomposite of chitosan loaded green synthesized bioinspired silver nanoparticles[J].International Journal of Biological Macromolecules, 2020, 160:934-943.
[14] LI T T, LIU Q W, WANG D F, et al.Characterization and antimicrobial mechanism of CF-14, a new antimicrobial peptide from the epidermal mucus of catfish[J].Fish &Shellfish Immunology, 2019, 92:881-888.
[15] LI L, YUAN L F, SHI Y X, et al.Comparative genomic analysis of Pectobacterium carotovorum subsp.brasiliense SX309 provides novel insights into its genetic and phenotypic features[J].BMC Genomics, 2019, 20(1):486.
[16] NAAS H, SEBAIHIA M, ORFEI B, et al.Pectobacterium carotovorum subsp.brasiliense and Pectobacterium carotovorum subsp.carotovorum as causal agents of potato soft rot in Algeria[J].European Journal of Plant Pathology, 2018, 151(4):1 027-1 034.
[17] ONKENDI E M, RAMESH A M, KWENDA S, et al.Draft genome sequence of a virulent Pectobacterium carotovorum subsp.brasiliense isolate causing soft rot of cucumber[J].Genome Announcements, 2016, 4(1).DOI:10.1128/genomeA.01530-15.
[18] QI T, WANG S P, DENG L L, et al.Controlling pepper soft rot by Lactobacillus paracasei WX322 and identification of multiple bacteriocins by complete genome sequencing[J].Food Control, 2021, 121(6):107629.
[19] HUANG Y F, LIU C Y, WANG H, et al.Bioinformatic analysis of the complete genome sequence of Pectobacterium carotovorum subsp.brasiliense BZA12 and candidate effector screening[J].Journal of Plant Pathology, 2019, 101(1):39-49.
[20] BHAT K A, MASOOD S D, BHAT N A, et al.Current status of post harvest soft rot in vegetables:A review[J].Asian Journal of Plant Sciences, 2010, 9(4):200-208.
[21] JOKO T, SUBANDI A, KUSUMANDARI N, et al.Activities of plant cell wall-degrading enzymes by bacterial soft rot of orchid[J].Archives of Phytopathology and Plant Protection, 2014, 47(10):1 239-1 250.
[22] SURIANI, DJAENUDDIN N, MUIS A.Utilization of antagonistic bacteria Bacillus subtilis to control Fusarium verticilloides on corn[J].IOP Conference Series Earth and Environmental Science, 2020, 484(1):012100.
[23] KUMAR A, RABHA J, JHA D K.Antagonistic activity of lipopeptide-biosurfactant producing Bacillus subtilis AKP, against Colletotrichum capsici, the causal organism of anthracnose disease of chilli[J].Biocatalysis and Agricultural Biotechnology, 2021, 36:102133.
[24] JOHNSON E M, JUNG D Y G, JIND Y Y, et al.Bacteriocins as food preservatives:Challenges and emerging horizons[J].Critical Reviews in Food Science and Nutrition, 2018, 58(16):2 743-2 767.
[25] COMPAORÉ C S, NIELSEN D S, OUOBA L I I, et al.Co-production of surfactin and a novel bacteriocin by Bacillus subtilis subsp.subtilis H4 isolated from Bikalga, an African alkaline Hibiscus sabdariffa seed fermented condiment[J].International Journal of Food Microbiology, 2013, 162(3):297-307.
[26] KAWULKA K E, SPRULES T, DIAPER C M, et al.Structure of subtilosin A, a cyclic antimicrobial peptide from Bacillus subtilis with unusual sulfur to alpha-carbon cross-links:Formation and reduction of alpha-thio-alpha-amino acid derivatives[J].Biochemistry, 2004, 43(12):3 385-3 395.