发酵肉制品是指微生物在自然或人工控制条件下,利用动物肉进行发酵加工并产生典型发酵风味的肉类产品,在肉制品发酵过程中,乳酸菌为主要优势菌[1]。传统酸肉是一种在自然条件下将猪肉、米粉、盐等原材料进行混合通过厌氧发酵而形成的肉制品。传统发酵肉生产中并没有添加外源发酵剂,依靠自然环境与原料肉中原有的微生物作用,因此发酵时间长达3个月至半年甚至1年[2-3],产品质量不易控制且存在安全问题。
乳酸菌和凝固酶阴性葡萄球菌是肉制品发酵剂的常用菌株[4]。乳酸菌作为发酵肉制品中的优势菌种,在控制发酵产品的风味和营养品质中发挥着重要的作用[5-8]。在发酵过程中,乳酸菌会降低产品的pH,抑制病原菌和腐败菌的生长,进而延长产品货架期。在乳酸菌代谢过程中,其会水解碳水化合物分解生成有机酸,最终使发酵产品呈现独特的酸味和口感[9]。NIE等[10]研究了植物乳杆菌和戊糖片球菌对发酵肉制品中蛋白质水解特性的影响,发现发酵过程中肌浆蛋白和肌原纤维蛋白存在明显的降解,同时游离氨基酸的含量有所增加,有助于发酵肉制品风味的形成。ZHANG等[11]将弯曲乳杆菌和戊糖片球菌用于酸肉的生产,结果表明在2种菌的协同作用下,酸肉制品的品质与安全性得到了大幅的改善。
葡萄球菌具有良好的分解蛋白质和脂肪的能力,使肉制品具有特有的色泽和风味[12-13]。目前已有报告说明多种葡萄球菌具有良好的发酵潜力,如木糖葡萄球菌[14]、肉葡萄球菌[15]、腐生葡萄球菌[16]和模仿葡萄球菌[17]等。蒋肇样等[18]通过在发酵驴肉香肠生产中接种干酪乳杆菌与肉葡萄球菌研究其对发酵香肠风味的影响,结果表明,接种发酵剂可以明显改善香肠的风味与滋味。L PEZ等[19]研究发现在香肠中添加含葡萄球菌的发酵剂可以使其具有更强的蛋白质水解能力,有助于提升香肠风味。
PEZ等[19]研究发现在香肠中添加含葡萄球菌的发酵剂可以使其具有更强的蛋白质水解能力,有助于提升香肠风味。
本研究从传统侗族酸肉产品中筛选分离适合用于肉制品发酵的优良菌株,并通过形态学、生理生化和16S rDNA分析鉴定,得到发酵性能良好的乳酸菌和葡萄球菌,为肉制品发酵剂的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验用肉
传统发酵酸肉购自贵州省黔东南苗族侗族自治州黎平县肇兴侗寨。
1.1.2 主要试剂
MRS Broth肉汤、MRS Agar琼脂,英国Oxoid;MSA培养基、兔血浆、细菌微量生化鉴定管套装、新生霉素,青岛海博生物技术有限公司;TSB肉汤,北京索莱宝科技有限公司;革兰氏染液,北京陆桥技术股份有限公司;葡萄糖,上海泰坦科技股份有限公司;氯化钠(分析纯),西陇科学股份有限公司。
1.2 仪器与设备
SPX-250 B-Z生化培养箱,上海博讯实业有限公司;HZ-D台式恒温振荡器,太仓市实验设备厂;PRACTUM 612-1 CN电子天平,德国赛多利斯公司;SG 403生物安全柜,美国贝克尔公司;HVE-50自动高压灭菌锅,日本Hirayama公司;M2e多功能酶标仪,美国分子器件公司;正置荧光显微镜,德国Carl Zeiss公司。
1.3 试验方法
1.3.1 酸肉样品处理
以无菌操作取肉样25 g,放入225 mL无菌生理盐水中,均质混匀,而后以体积比1∶10对均质液进行多次梯度稀释。
1.3.2 分离纯化单菌落
梯度稀释后将乳酸菌涂布于MRS固体培养基中,37 ℃厌氧培养48 h;葡萄球菌涂布于MSA固体培养基中,30 ℃厌氧培养48 h。挑取形成的单菌落分别在MRS、MSA固体培养基反复划线2~3次,直至获取纯种菌株。
1.3.3 菌株初筛
革兰氏染色:对纯化后的单菌落进行革兰氏染色,筛选革兰氏阳性菌株。
菌株产气试验:采用产气培养基对菌株发酵葡萄糖是否产气进行测定,经37 ℃培养24 h后观察杜氏小管内是否有气泡产生,筛选阴性菌株。
触酶试验:取少量质量分数为3%的 H2O2滴加于单菌落中,立即观察,产生大量气泡为阳性,不产生气泡者为阴性。
葡萄球菌新生霉素抗性检验:将待测菌株涂布在MSA固体培养基上,将新生霉素药敏纸片[最低抑菌浓度(minimum inhibitory concentration,MIC)>1.6 μg/mL]贴在平板上,30 ℃培养24 h后观察有无抑菌圈形成,无抑菌圈的菌株为微球菌,有抑菌圈的菌株为葡萄球菌[20]。
1.3.4 菌株复筛
产黏试验:直接挑取单菌落进行观察,选择不产黏的菌株。
耐盐试验:将菌株接种到含10%质量分数 NaCl的MRS、TSB液体培养基中,以空白液体培养基为对照,测量培养24 h后的菌液在600 nm处的吸光值。
耐亚硝酸盐试验:将菌株接种到含150 mg/L亚硝酸钠的液体培养基中,以空白液体培养基为对照,测量培养24 h后的菌液在600 nm处的吸光值[21]。
产H2S试验:接待测菌株于SIM生化反应管中,培养24 h后观察生化管中是否出现黑色,产生黑色为阳性,反之为阴性,筛选阴性菌株。
蛋白酶与脂肪酶活性检测:参考张雪梅[22]的方法进行检测。
乳酸菌产酸性能测定:参考潘晓倩等[23]的方法进行测定。
葡萄球菌耐酸性能测定:将菌株接种到pH值为4的TSB液体培养基中,培养24 h后测量600 nm处的OD值。
葡萄球菌凝固酶检测:取0.3 mL新鲜葡萄球菌培养液添加至2.5 mL兔血浆稀释液中在30 ℃下培养4 h后观察是否出现胶状或固状凝块,用金黄色葡萄球菌作对照[24]。
拮抗试验:通过抑菌圈方法鉴定2菌株间是否存在拮抗效果,首先将乳酸菌涂布在MRS固体培养基中,而后使用浸泡葡萄球菌培养液的6 mm圆形滤纸片贴在乳酸菌平板上,培养48 h后观察有无抑菌圈生成,反之验证乳酸菌对葡萄球菌的拮抗性。
1.3.5 优良菌株的鉴定
形态鉴定:采用平板培养法观察菌株菌落形态,采用革兰氏染色法观察菌株菌体形态[25]。
生理生化鉴定:将菌株接种于各类生化鉴定管中,检验其对各种糖醇类碳源利用情况。
16S rDNA鉴定:采用PCR扩增方法,样品送至上海凌恩生物科技有限公司测序,并与基因库中已知序列进行同源性对比分析。
1.3.6 数据处理与统计方法
试验的重复数是3,选择SAS 8.1软件进行统计分析,显著性水平为P<0.05。
2 结果与分析
2.1 菌株的分离纯化与初筛
经分离纯化,初步得到575个乳酸菌菌株及187个葡萄球菌菌株。对分离纯化出的菌株按照以下标准进行初筛:革兰氏染色阳性、乳酸菌触酶试验阴性、葡萄球菌触酶试验阳性、发酵葡萄糖产气试验阴性、葡萄球菌新生霉素抗性检验出现抑菌圈。初筛结果如表1所示。最终得到116株乳酸菌和26株葡萄球菌。
表1 乳酸菌与葡萄球菌的初筛结果
Table 1 Results of preliminary screening of lactic acid bacteria and Staphylococcus

方法结果乳酸菌分离株数量/株葡萄球菌分离株数量/株革兰氏染色阴性25685阳性319102触酶试验 阴性19049阳性12953发酵葡萄糖阴性11638产气试验 阳性7415新生霉素 有抑菌圈/26抗性检验 无抑菌圈/12
注:/表示乳酸菌并不需要此项检测
2.2 菌株的复筛
2.2.1 乳酸菌的复筛
按照肉制品发酵剂的标准对初筛得到的116株乳酸菌进一步筛选,以不产黏液、耐受10%(质量分数)NaCl、耐受150 mg/L亚硝酸钠、不产H2S和无蛋白酶与脂肪酶活性为标准进行复筛。在发酵剂筛选标准中,如具有蛋白质降解活性,则可能产生腐败现象,缩短产品的货架期;而如果发酵剂具有脂肪降解活性,则会使产品在贮存过程中出现酸败味[26-28],因此本次筛选的乳酸菌需要无脂肪酶和蛋白酶活性。乳酸菌的复筛结果见表2,最终得到2株发酵性能较好的菌株分别命名为L36与L254。
表2 乳酸菌的复筛结果
Table 2 Results of re-screening of lactic acid bacteria

试验项目分离株数量/株不产黏液97耐受10%质量分数 NaCl44耐受150 mg/L 亚硝酸钠12不产H2S5无蛋白酶活性4无脂肪酶活性2
乳酸菌能否快速产酸是鉴定其是否具有良好发酵性能的重要指标,其产酸速率越高,抑制有害菌与病原菌生长的能力越强,可使乳酸菌迅速成为发酵体系中的优势菌种,缩短产品生产周期,提高产品安全性[29]。根据肉用发酵剂的筛选标准,试验菌种能够在16~24 h内使pH值下降到5.3以下,有利于抑制杂菌生长,加速肉制品成熟[30]。高熳熳等[31]从侗族传统酸肉中分离出发酵性能较好的植物乳杆菌,可在24 h内将pH值降至3.5左右,具有优质的产酸特性。本试验将复筛得到的2株乳酸菌进行产酸性能测试。由图1可知,2株乳酸菌的产酸性能都较好,发酵体系pH均呈现明显下降趋势,试验初期,发酵体系pH为5.87,经过24 h发酵后,L254菌株将体系pH降低至3.90,但相比之下,L36菌株能在24 h内更快速的将pH从5.87降低到3.81,因此将乳酸菌L36作为酸肉发酵菌种更加合适。

图1 菌株的产酸能力
Fig.1 Acid-producing capacity of strains
2.2.2 葡萄球菌的复筛
以筛选不产黏液、耐受10%(质量分数)NaCl、耐受150 mg/L亚硝酸钠、不产H2S、具有蛋白酶与脂肪酶活性、耐酸性和凝固酶阴性为标准进行葡萄球菌的复筛。葡萄球菌的产香能力得益于其良好的蛋白酶与脂肪酶活性,进而有利于风味前体物的生成,可以使肉制品产生特殊的风味[32]。周慧敏等[33]研究了木糖葡萄球菌和肉葡萄球菌混合发酵对腊肉品质的影响,研究发现通过接种混合发酵剂,腊肉中蛋白质和脂肪水解加快,促进风味形成。在实际生产中,葡萄球菌常与乳酸菌复配作为联合发酵剂,良好的耐酸能力和低pH值适应性是其作为发酵剂的重要参考标准。王德宝等[34]使用清酒乳杆菌、木糖葡萄球菌与肉葡萄球菌的组合发酵剂生产羊肉香肠并对其品质进行研究,结果表明复合发酵剂可以显著缩短发酵周期,改善产品色泽。凝固酶阴性会使所得葡萄球菌的安全性得到保证。葡萄球菌的复筛结果如表3所示,最终得到1株发酵性能较好的葡萄球菌命名为S53。
表3 葡萄球菌的复筛结果
Table 3 Results of re-screening of Staphylococcus

试验项目分离株数量/株不产黏液18耐受10%(质量分数)NaCl9耐受150 mg/L 亚硝酸钠6不产H2S4具有蛋白酶活性3具有脂肪酶活性3耐受酸性环境1凝固酶阴性1
对复筛后的2菌株进行抑菌圈试验比较菌株之间是否具有拮抗性,从而判断能否进行复配使用,结果表明乳酸菌L36与葡萄球菌S53之间不存在拮抗作用,可以作为联合发酵剂应用于发酵肉生产中。
2.3 菌株鉴定
2.3.1 形态学观察
经初筛与复筛后,得到具有良好发酵性能的乳酸菌和葡萄球菌各1株。经形态学观察后结果显示,菌株L36为杆菌,菌落呈淡黄色,扁平状,菌落较小;菌株S53为球形,菌落为白色,表面凸起,边缘圆整。
2.3.2 生理生化鉴定
2菌株的生理生化鉴定结果如表4与表5所示,其中表4为乳酸菌L36的鉴定结果,表5为葡萄球菌S53的鉴定结果,参照《凌代文乳酸细菌分类鉴定及实验方法》和《伯杰氏细菌鉴定手册》,L36菌株为圆形菌落,边缘整齐,能够水解蔗糖、麦芽糖产酸,水解棉籽糖、甘露醇不产酸;S53菌株为白色光滑凸起菌落,同时分解蔗糖、麦芽糖、甘露醇产酸,分解木糖、鼠李糖不产酸。可初步鉴定L36为香肠乳杆菌(Lactobacillus farciminis),S53为腐生葡萄球菌(Staphylococcus saprophyticus)。
表4 乳酸菌L36糖发酵试验结果
Table 4 Results of carbohydrate fermentation of lactic acid bacteria L36

碳源结果碳源结果七叶苷 +山梨醇-纤维二糖+蔗糖 +麦芽糖 +棉籽糖-甘露醇 -菊糖 +水杨苷 +乳糖 d
注:+表示阳性;-表示阴性;d表示60%~70%阳性(下同)
表5 葡萄球菌S53糖发酵试验结果
Table 5 Results of carbohydrate fermentation of Staphylococcus S53
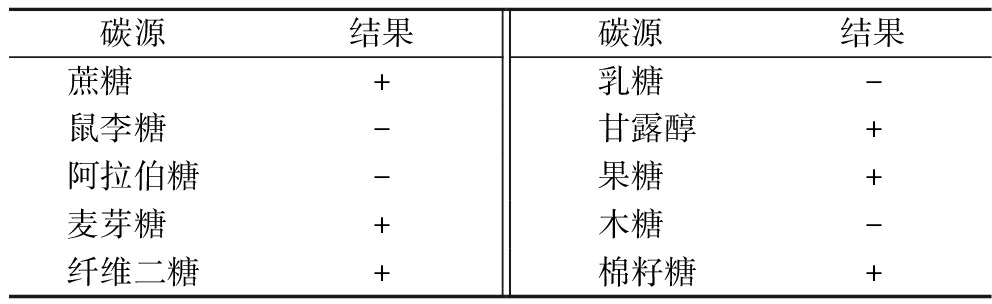
碳源结果碳源结果蔗糖 +乳糖-鼠李糖 - 甘露醇+阿拉伯糖-果糖+麦芽糖 +木糖-纤维二糖+ 棉籽糖+
2.3.3 菌株的16S rDNA序列测定及系统进化树的构建
对分离株L36与S53的16S rDNA序列进行扩增并测序,PCR扩增显示这2菌株的序列均为为1 000~2 000 bp,条带明亮(图2)。经测序得到分离株L36的16S rDNA序列为1 232 bp,分离株S53的16S rDNA序列为1 106 bp。将所测得的菌株与基因库中已知细菌的序列进行同源性比对分析,构建系统发育树确认分离株L36为香肠乳杆菌,分离株S53为腐生葡萄球菌(图3)。
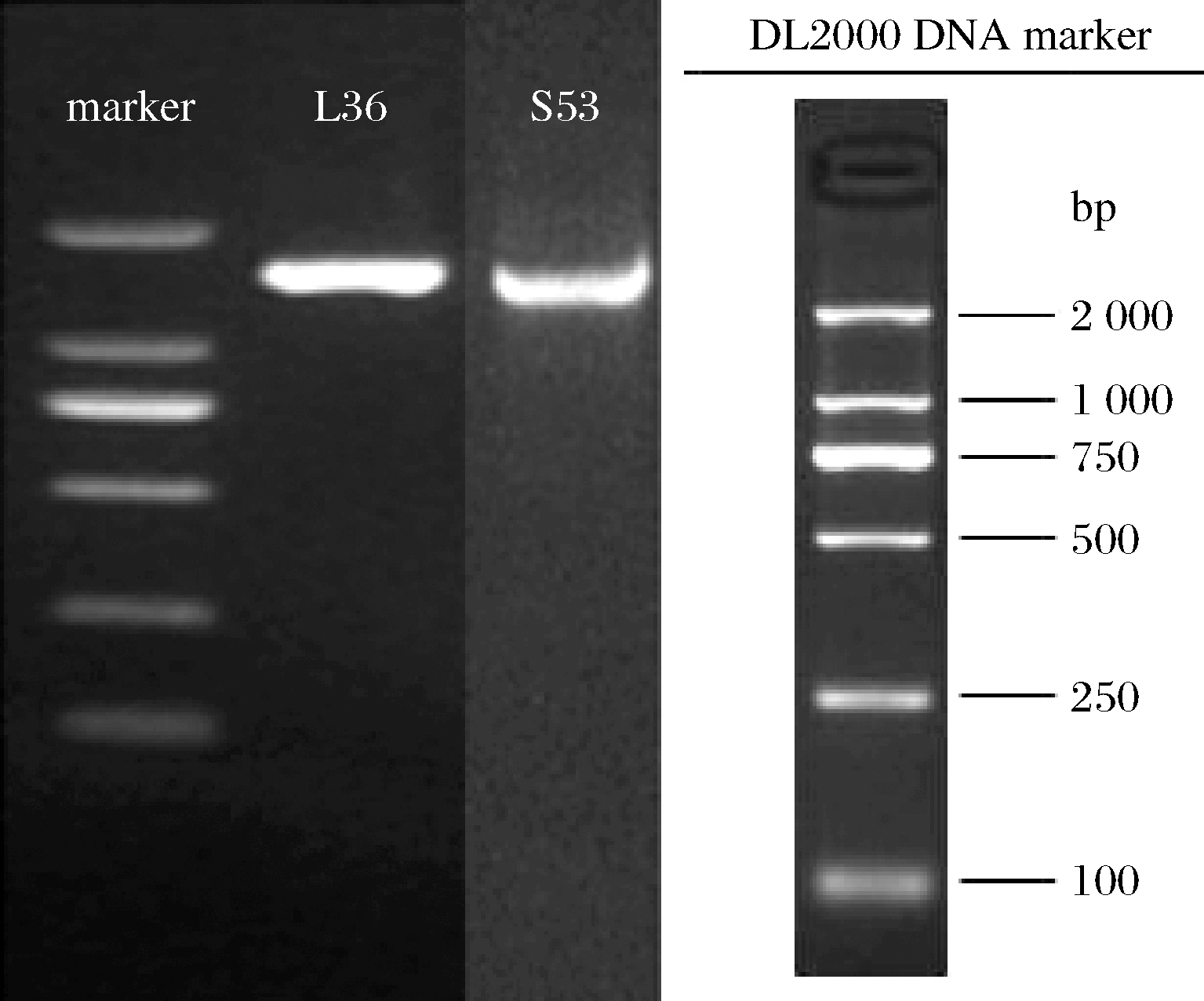
图2 L36和S53的16S rDNA PCR产物扩增图
Fig.2 Amplification of 16S rDNA PCR products of L36 and S53
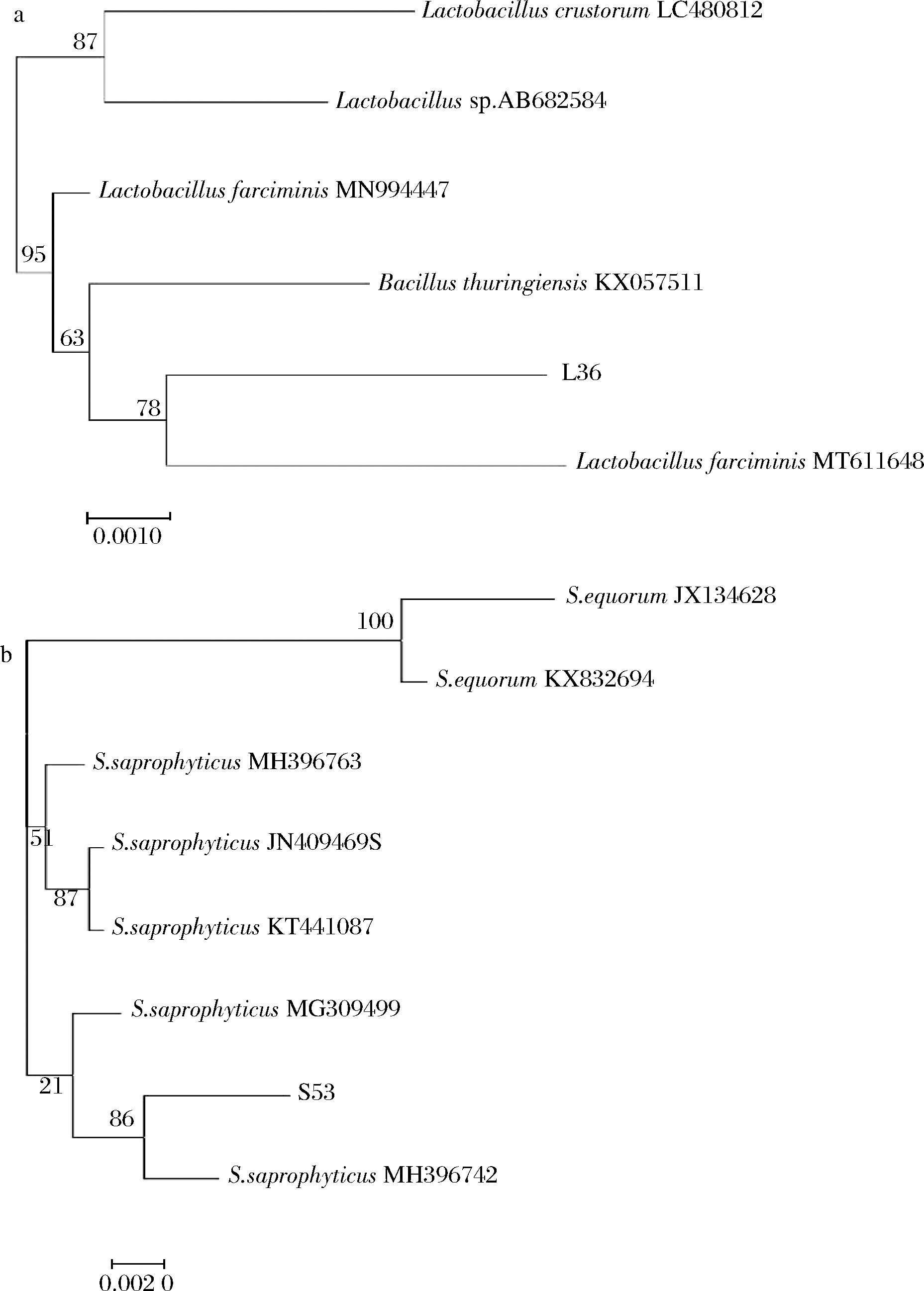
a-乳酸菌L36系统发育进化树;b-葡萄球菌S53系统发育进化树
图3 乳酸菌L36和葡萄球菌S53系统 发育进化树
Fig.3 Phylogenetic tree of lactic acid bacteria L36 and Staphylococcus S53
3 结论
本研究通过传统培养法从自然发酵酸肉纯化分离具有良好发酵性能的乳酸菌和葡萄球菌各1株,经形态学、生理生化鉴定及16S rDNA后确定乳酸菌L36为香肠乳杆菌,葡萄球菌S53为腐生葡萄球菌。香肠乳杆菌L36产酸能力强,腐生葡萄球菌S53可耐酸且具有蛋白酶与脂肪酶活性。2株菌株对食盐与亚硝酸盐的耐受性均较好,且相互间无拮抗作用。这一研究结果将为肉制品的研发提供新的菌种资源,关于2株菌的发酵性能在肉制品中的应用还需进一步验证。
[1] QUIJADA N M, DE FILIPPIS F, SANZ J J, et al.Different Lactobacillus populations dominate in "Chorizo de León" manufacturing performed in different production plants[J].Food Microbiology, 2018, 70:94-102.
[2] 谢垚垚. 乳酸菌快速发酵低盐型酸肉的工艺及品质影响研究[D].贵阳:贵州大学, 2018.
XIE Y Y.Study on the process condition and quality impact of rapid fermentation low-salt sour meat by lactic acid bacteria[D].Guiyang:Guizhou University, 2018
[3] 范晓文, 常荣, 赵珠莲, 等.酸肉发酵中挥发性风味物质的变化及对品质的影响[J].食品与发酵工业, 2019, 45(22):68-75.
FAN X W, CHANG R, ZHAO Z L, et al.The change of volatile flavor substance in sour pork fermentation and its effect on quality[J].Food and Fermentation Industries, 2019, 45(22):68-75.
[4] 王曼, 杨琛, 覃晓玉, 等.鲊肉粉中乳酸菌和葡萄球菌的筛选及鉴定[J].食品与发酵工业, 2021, 47(5):22-27.
WANG M, YANG C, QIN X Y, et al.Screening and identification of lactic acid bacteria and Staphylococcus in fermented meat rice[J].Food and Fermentation Industries, 2021, 47(5):22-27.
[5] FARNWORTH E R.Handbook of Fermented Functional Foods[M].Array Boca Raton:CRC Press, 2008:291-320.
[6] CHATA M, UCHIDA S, ZHOU L X, et al. Antioxidant activity of fermented meat sauce and isolation of an associated antioxidant peptide[J]. Food Chemistry, 2016, 194: 1 034-1 039.
[7] RATTANACHAIKUNSOPON P, PHUMKHACHORN P.Lactic acid bacteria:Their antimicrobial compounds and their uses in food production[J].Annals of Biological Research, 2010, 1(4):218-228.
[8] SINGH V P, PATHAK V, VERMA A K.Fermented meat products:Organoleptic qualities and biogenic amines:A review[J].American Journal Food of Technology, 2012, 7(5):278-288.
[9] 王俊钢, 刘成江, 李宇辉, 等.发酵肉制品中风味物质研究进展[J].江苏农业科学, 2014, 42(9):251-253;281.
WANG J G, LIU C J, LI Y H, et al. Research progress of flavor substances in fermented meat products[J]. Jiangsu Agricultural Sciences, 2014, 42(9):251-253; 281.
[10] NIE X H, LIN S L, ZHANG Q L.Proteolytic characterisation in grass carp sausage inoculated with Lactobacillus plantarum and Pediococcus pentosaceus[J].Food Chemistry, 2014, 145:840-844.
[11] ZHANG Y L, HU P, XIE Y Y, et al.Co-fermentation with Lactobacillus curvatus LAB26 and Pediococcus pentosaceus SWU73571 for improving quality and safety of sour meat[J].Meat Science, 2020, 170:108240.
[12] BERDAGUÉ J L, MONTEIL P, MONTEL M C, et al.Effects of starter cultures on the formation of flavour compounds in dry sausage[J].Meat Science, 1993, 35(3):275-287.
[13] ESSID I, HASSOUNA M.Effect of inoculation of selected Staphylococcus xylosus, and Lactobacillus plantarum, strains on biochemical, microbiological and textural characteristics of a Tunisian dry fermented sausage[J].Food Control, 2013, 32(2):707-714.
[14] LEROY S, VERMASSEN A, RAS G, et al.Insight into the genome of Staphylococcus xylosus, a ubiquitous species well adapted to meat products[J].Microorganisms, 2017, 5(3):52.
[15] SEMEDO-LEMSADDE K T, CARVALHO L, TEMPERA C, et al.Characterization and technological features of autochthonous coagulase-negative staphylococci as potential starters for Portuguese dry fermented sausages[J].Journal of Food Science, 2016, 81(5):M1 197-M1 202.
[16] 李想, 邓锋, 秦春君, 等.腐生葡萄球菌CGMCC 3475对发酵里脊猪肉脂质分解氧化及风味特性的影响[J].食品与发酵工业, 2011, 37(1):152-157.
LI X, DENG F, QIN C J, et al.Effects of Staphylococcus saprophyticus CGMCC 3475 on lipolysis -oxidation and flavor characteristic of pork loin ham during fermenting[J].Food and Fermentation Industries, 2011, 37(1):152-157.
[17] 于海, 焦玉, 刘向农, 等.不同工艺条件下模仿葡萄球菌YD25对发酵香肠挥发性化合物的影响[J].食品科学, 2009, 30(20):190-193.
YU H, JIAO Y, LIU X N, et al.Effect of Staphylococcus simulans YD25 on volatile compounds in fermented sausages under different conditions[J].Food Science, 2009, 30(20):190-193.
[18] 蒋肇样, 黄雨婷, 邓莎, 等.不同复合菌种发酵驴肉香肠的风味特性[J].食品科技, 2019, 44(12):99-104.
JIANG Z Y, HUANG Y T, DENG S, et al.Flavor properties of donkey sausages fermented by different compound bacteria[J].Food Science and Technology, 2019, 44(12):99-104.
[19] L PEZ C M, SENTANDREU M A, VIGNOLO G M, et al.Low molecular weight peptides derived from sarcoplasmic proteins produced by an autochthonous starter culture in a beaker sausage model[J].EuPA Open Proteomics, 2015, 7:54-63.
PEZ C M, SENTANDREU M A, VIGNOLO G M, et al.Low molecular weight peptides derived from sarcoplasmic proteins produced by an autochthonous starter culture in a beaker sausage model[J].EuPA Open Proteomics, 2015, 7:54-63.
[20] 赵振玲. 发酵香肠中葡萄球菌、微球菌的分离筛选及应用[D].山东:山东轻工业学院, 2008.
ZHAO Z L.Characterization and application of micrococci and staphylococci isolated from fermented sausages as starter cultures[D].Shandong:Shandong Institute of Light Industry, 2008.
[21] 葛庆丰. 金华火腿中抗氧化乳酸菌的筛选及其抗氧化作用研究[D].南京:南京农业大学, 2017.
GE Q F.The screening and antioxidation study of antioxidant lactic acid bacteria from Jinhua Ham[D].Nanjing:Nanjing Agricultural University, 2017.
[22] 张雪梅. 四川香肠生产过程中理化特性、微生物特性及产香葡萄球菌的筛选与应用[D].四川:四川农业大学, 2010.
ZHANG X M.Physical, chemical and microbial property of Sichuan sausage during processing and selection and application of Staphylococcus[D].Sichuan:Sichuan Agricultural University,2010.
[23] 潘晓倩, 赵燕, 张顺亮, 等.中温乳化香肠中一株优势腐败菌的分离鉴定与生物学特性[J].食品科学, 2016, 37(7):93-98.
PAN X Q, ZHAO Y, ZHANG S L, et al.Isolation, identification and biological characterization of a dominant spoilage strain in emulsified sausages sterilized at medium temperature[J].Food Science, 2016, 37(7):93-98.
[24] 陈瑶, 刘艳, 许艳丰, 等.发酵肉用耐高温产香葡萄球菌优质菌株的筛选[J].肉类工业, 2019(9):21-27.
CHEN Y, LIU Y, XU Y F, et al.Screening of high-quality Staphylococcus strains with high temperature resistance and aroma-producing for fermented meat[J].Meat Industry, 2019(9):21-27.
[25] YANG B, XIAO L, LIU S, et al.Exploration of the effect of probiotics supplementation on intestinal microbiota of food allergic mice[J].American Journal of Translational Research, 2017, 9(2):376-385.
[26] 李建, 李丽, 彭翠珍, 等.几株适用于发酵肉制品的乳酸菌的分离筛选及鉴定[J].食品研究与开发, 2018, 39(6):172-177.
LI J, LI L, PENG C Z, et al.Selection and identification of several lactic acid bacteria strains for fermented meat products[J].Food Research and Development, 2018, 39(6):172-177.
[27] 邓展瑞, 贠建民, 郭娟, 等.陇西腊肉加工过程中优势乳酸菌的分离及其发酵性能研究[J].生物技术进展, 2019, 9(2):200-209.
DENG Z R, YUN J M, GUO J, et al.Study on isolation and fermentation performance of dominant lactic acid bacteria during the processing of longxi bacon[J].Current Biotechnology, 2019, 9(2):200-209.
[28] 刘丽莉, 杨协力.发酵肉制品中乳酸菌菌种筛选研究[J].农业机械学报, 2006, 8:229-231.
LIU L L, YANG X L.Research on screening of Lactic Acid Bacteria in fermented meat products[J].Transactions of the Chinese Society for Agricultural Machinery, 2006, 8:229-231.
[29] 胡楠, 雷鸣, 王远一飞, 等.传统发酵蓝莓饮料中乳酸菌的分离鉴定及筛选[J].食品研究与开发, 2019, 40(23):205-211.
HU N, LEI M, WANG Y Y F, et al.Isolation, identification and screen of lactic acid bacteria from traditional fermented blueberry beverages[J].Food Research and Development, 2019, 40(23):205-211.
[30] 叶翠, 张香美, 卢涵, 等.肉制品发酵剂研究现状与趋势[J].食品科技, 2019, 44(12):290-294.
YE C, ZHANG X M, LU H, et al.Research status and trend of meat starter culture[J].Food Science and Technology, 2019, 44(12):290-294.
[31] 高熳熳, 焦新雅, 张志胜, 等.侗族传统发酵酸肉中乳酸菌的筛选、发酵特性及安全性分析[J].食品工业科技, 2020, 41(12):94-99.
GAO M M, JIAO X Y, ZHANG Z S, et al.Screening, fermentation characteristics and safety analysis of lactic acid bacteria in Dong traditional fermented sour meat[J].Science and Technology of Food Industry, 2020, 41(12):94-99.
[32] 陈亚杰, 张香美, 卢涵, 等.有益葡萄球菌对发酵肉制品品质影响[J].肉类工业, 2019(2):40-43.
CHEN Y J, ZHANG X M, LU H, et al.The effect of beneficial staphylococcus on the quality of fermented meat product[J].Meat Industry, 2019(2):40-43.
[33] 周慧敏, 张顺亮, 赵冰, 等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学, 2018, 39(22):32-38.
ZHOU H M, ZHANG S L, ZHAO B, et al.Effect of starter culture mixture of Staphylococcus xylosus and S.carnosus on the quality of dry-cured meat[J].Food Science, 2018, 39(22):32-38.
[34] 王德宝, 孙学颖, 王柏辉, 等.复合发酵剂对羊肉香肠发酵成熟过程中理化品质及安全性能的影响[J].中国食品学报, 2020, 20(6):137-145.
WANG D B, SUN X Y, WANG B H, et al.Effects of compound starters on physical-chemical quality and safety performance of fermented mutton sausages[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(6):137-145.