三七(Panax notoginseng)叶片的总皂苷含量在40~60 mg/g左右[1],并含有总黄酮、总酚等活性物质,故三七叶片既有活血化瘀功效,还有抗氧化功效[2],对抑制细胞氧化损伤、预防衰老有积极的作用。然而,三七植株多以根入药,被广泛应用于临床治疗,其叶片利用率较低。若能充分利用三七叶片,最大化发挥三七植株利用价值,在解决三七叶片资源浪费方面具有重要的现实和长远意义。
益生菌是人体肠道中的微生态调节剂,能够保持肠道菌群微生态平衡,对人体健康产生重要影响[3]。研究表明,益生菌发酵茶叶后,其抗氧化活性[4]及挥发性香气成分都有所增加[5]。例如,使用冠突散囊菌等益生菌发酵茶叶[6],其发酵液的总抗氧化能力提高65.87%,DPPH自由基清除能力提高了128.33%,且发酵后的茶叶黄酮类物质和三萜类物质分别增加4.23%和0.29%[7]。使用植物乳杆菌等益生菌发酵红茶饮料,发酵后红茶饮料香气成分较发酵前增加了11种物质,且酮类物质提升了2.46%,有利于提升红茶的香气品质[5]。
凝结芽孢杆菌(Bacillus coagulans)属于革兰氏阳性菌,兼性厌氧,具有极强的耐酸、耐盐、耐高温能力,适宜生长温度为37~45 ℃[8],适宜发酵接种量为3%左右[9]。相比一般乳酸菌,凝结芽孢杆菌产物的乳酸含量高,且有增强机体营养物质代谢水平,提高机体抗氧化能力等特点[10]。美国食品药品监督管理局(Food and Drug Administration,FDA)早在1992年批准凝结芽孢杆菌为安全可食用的益生菌,被广泛应用到巧克力、面包、饮料等食品中[11]。将凝结芽孢杆菌用于三七叶茶的发酵中可能会增加三七叶茶的抗氧化活性和香气成分。然而,现阶段有关凝结芽胞杆菌发酵叶茶的研究较为缺乏,发酵后的叶茶是否具有良好的抗氧化功能以及丰富的香气还有待研究。
基于此,本研究通过凝结芽孢杆菌接种量的单因素试验对发酵三七叶茶的功效成分、抗氧化活性、挥发性香气和感官评价进行分析,并确定发酵三七叶茶适宜的凝结芽孢杆菌接种量,以探索凝结芽孢杆菌发酵三七叶茶的发酵工艺,拟为新型凝结芽胞杆菌发酵食品的研发以及三七叶的利用提供理论基础并拓宽思路。
1 材料与方法
1.1 供试材料
凝结芽胞杆菌(Bacillus coagulans, BNCC134487)北纳生物-河南省工业微生物菌种工程技术研究中心;新鲜成熟的三七叶片来自云南省红河哈尼族彝族自治州泸西县午街铺镇三七种植基地(103°35′~103°42′ E,24°25′~24°36′ N)。
1.2 试验设计
1.2.1 凝结芽孢杆菌悬浮液的制备
取3.0 g牛肉膏,10.0 g蛋白胨,5.0 g NaCl,5 mg MnSO4·H2O溶于1.0 L蒸馏水中,将溶液pH值调至7.0,制成液体培养基后,置于121 ℃和0.1 MPa条件下灭菌15 min。取0.5 mL液体培养基注入凝结芽孢杆菌菌粉冻干管,待充分溶解后全部注入装有20 mL相同液体培养基的锥形瓶中后混匀,再置于温度为37 ℃、转速为220 r/min的摇床中振荡培养24 h后,并放于4 ℃保存。
1.2.2 发酵三七叶茶的制备
将采摘的新鲜成熟三七叶片置于阴凉通风处进行萎凋处理1.5~2.5 h后,置于250~300 ℃翻炒至叶片含水率为40%~50%(质量分数),接着在常温环境进行人工反复轻揉,至成条率达80%以上,将揉捻好的叶片平摊晾干至叶片含水率低于13%(质量分数),制得三七叶茶。
将三七叶茶置于103.4 kPa、121 ℃、15 min的条件下进行高压灭菌处理。将液体菌种按照0%、1%、3%、5%的接种量接种于灭菌后的三七叶茶中,置于温度37 ℃、湿度75%条件(预实验获得凝结芽孢杆菌适宜的温湿度)发酵72 h制成发酵的三七叶茶。以E0表示0%凝结芽孢杆菌接种量发酵的三七叶茶,即未接种凝结芽孢杆菌发酵的三七叶茶;E1、E2、E3分别表示1%、3%、5%凝结芽孢杆菌接种量发酵的三七叶茶,每个处理重复3次。
经发酵的三七叶茶冻干后研磨成粉末,并过60目筛。用超声波提取法在温度25 ℃、持续时间30 min提取样品,使用80%乙醇以1∶10(g∶mL)的料液比充分溶解。对混合物进行过滤后使用旋转蒸发浓缩器在40 ℃下浓缩滤液,最后冷冻干燥。将冻干后的样品贮存在-30 ℃,供后续实验使用。
1.3 有效成分测定
1.3.1 总酚含量测定
采用Folin-Ciocalteau法测定发酵三七叶茶的总酚含量(total phenolics content, TPC)[12]。使用分子设备SpectraMax M5微孔板阅读器在765 nm处测定吸光度,每个样品测定3次。以没食子酸为标准品做标准曲线,总酚含量用mg/g表示。
1.3.2 总黄酮含量测定
采用紫外分光光度法测定发酵三七叶茶的总黄酮含量(total flavonoids content, TFC)[13]。使用分子设备SpectraMax M5微孔板阅读器在510 nm处测定TFC的吸光度,每个样品测定3次。以芦丁为标准品做标准曲线,总黄酮含量用mg/g表示。
1.3.3 总皂苷含量测定
采用紫外分光光度法测定发酵三七叶茶的总皂苷含量(total saponin content, TSC)[14]。用SpectraMax M5微孔板读取器在560 nm处测量吸光度,每个样品测定3次。以三七皂苷Re为标准品做标准曲线,总皂苷含量用mg/g表示。
1.3.4 抗氧化活性测定
为评估凝结芽孢杆菌发酵三七叶茶的抗氧化活性,测定了发酵三七叶茶的DPPH自由基和ABTS阳离子自由基清除率[15]。DPPH自由基清除率(R1)使用SpectraMax M5微孔板读取器在517 nm处记录混合溶液的吸光度。以甲醇和DPPH的混合溶液作为空白组,以抗坏血酸(维生素C)作为阳性对照,每个样品测定3次,通过公式(1)获得:
(1)
式中:A0,4.0 mL DPPH溶液与1.0 mL蒸馏水的吸光值;As,4.0 mL DPPH溶液与1.0 mL样液的吸光值;Ac,1.0 mL样液与4.0 mL甲醇的吸光值。
ABTS阳离子自由基清除率(R2)使用SpectraMax M5微孔板读取器在734 nm处记录混合溶液的吸光度。以甲醇和ABTS的混合溶液作为空白组,以抗坏血酸(维生素C)作为阳性对照,每个样品测定3次,并通过公式(2)获得:
(2)
式中:A1,1.0 mL ABTS溶液与0.125 mL蒸馏水的吸光值;Ai,1.0 mL ABTS溶液与0.125 mL样液的吸光值, Aj,0.125 mL样液与1.0 mL甲醇的吸光值。
1.3.5 香气成分测定
使用非目标气相色谱-质谱(GC-MS)指纹图谱和QP2010 GC-MS系统(岛津,日本)分析叶茶挥发性成分。首先,用甲醇配制质量浓度为0.1 mg/mL的各样品混合液,室温超声提取处理25 min,5 000 r/min离心2 min,取上清液过0.22 μm滤膜。色谱条件:色谱柱为HP5柱(30 m×0.32 mm×0.25 μm,安捷伦科技,美国),程序升温:初始温度为45 ℃保持1 min后,以6 ℃/min的速率升温至160 ℃,随后以10 ℃/min的速率第二次升温至250 ℃,并保持5 min后,再次冷却至初始温度。进样口温度为250 ℃,进样量为1.0 μL,载气为高纯氦气(纯度99.999%),恒定流速为2.0 mL/min。质谱条件:70 eV的电子电离模式,扫描范围为35~500 m/z。MS离子源和传输线的温度分别为230 ℃和280 ℃。每个样品测定3次。
1.4 感官评价
取5 g发酵三七叶茶,用150 mL的85 ℃纯净水冲泡,采用第二泡茶水进行感官评价,根据GB/T 23776—2018 《茶叶感官审评方法》对三七叶茶进行汤色、香气和滋味等感官评价。由具有感官评价技能的10人组成感官评价小组,对冲泡好的发酵叶茶采用百分制进行评分。评分结果去除一个最高分和一个最低分,计算各项指标的平均数,再通过公式(3)计算三七叶茶的感官审评总得分[16]:
Y=0.3A+B+0.4C
(3)
式中:Y,审评总得分;A,汤色得分;B,香气得分;C,滋味得分。
1.5 数据统计与分析
使用IBM SPSS Statistics 25和Origin 2018对各处理三七叶茶醇提物的总酚、总黄酮、总皂苷含量、DPPH自由基和ABTS阳离子自由基清除率进行统计分析和单因素方差分析。若存在差异(P<0.05),则利用Duncan多重比较法进行各处理间的比较,以不同小写字母表示α=0.05显著性水平上存在的差异,并对总酚、总黄酮、总皂苷含量进行非线性拟合。
2 结果与分析
2.1 凝结芽孢杆菌发酵三七叶茶的功效成分
2.1.1 凝结芽孢杆菌发酵三七叶茶的总酚和总黄酮含量
与未接种凝结芽孢杆菌发酵的三七叶茶相比(E0),凝结芽孢杆菌发酵的三七叶茶醇提物总酚与总黄酮含量显著降低(图1)。发酵72 h后,与E0总酚含量相比(38.1 mg/g),E1、E2、E3总酚含量分别降至35.4、30.0、35.5 mg/g(图1-a),下降幅度为6.8%~21.3%。相对E0的总黄酮含量(25.7 mg/g),E1、E2、E3的总黄酮含量分别降至16.0、15.2、18.4 mg/g(图1-b),下降幅度为28.4%~40.9%。其中,E2的总酚和总黄酮含量下降幅度最大,分别为21.3%和40.9%。
随凝结芽孢杆菌接种量增加,三七叶茶的总酚含量和总黄酮含量均表现出先减小再增加的趋势(图1),且凝结芽孢杆菌接种量(E)与醇提物TPC、TFC关系均呈二项式关系(R2>0.80):TPC=38.8-5.56E+0.971E2(R2= 0.919);TFC=24.4-6.92E+1.10E2(R2=0.831)。结果表明,凝结芽孢杆菌接种量接近3%时,醇提物的质量浓度存在最小值,酚类和黄酮类物质消耗最多。

a-凝结芽孢杆菌发酵三七叶茶的总酚含量; b-凝结芽孢杆菌发酵三七叶茶的总黄酮含量
图1 凝结芽孢杆菌发酵三七叶茶的总酚和总黄酮含量
Fig.1 Total phenols and flavonoids contents in Panax notoginseng leaf tea fermented with Bacillus coagulans
注:图中不同小写字母表示差异显著(P<0.08)(下同)
2.1.2 凝结芽孢杆菌发酵三七叶茶的总皂苷含量
如图2所示,与E0相比,凝结芽孢杆菌发酵后叶茶总皂苷含量显著增加(P <0.05)。其中,E2总皂苷含量最高,为373.7 mg/g,E3和E1总皂苷含量依次降低,分别为330.1 mg/g和165.3 mg/g。相较于E0总皂苷含量,凝结芽孢杆菌发酵三七叶茶的总皂苷含量提高了0.085~1.45倍。

图2 凝结芽孢杆菌发酵三七叶茶的总皂苷含量
Fig.2 Total saponin content of Panax notoginseng leaf tea fermented with Bacillus coagulans
对总皂苷含量与凝结芽孢杆菌接种量进行非线性拟合可知,类似总酚和总黄酮,凝结芽孢杆菌接种量(E)与醇提物TSC同样符合二项式关系:TSC=122.4+112.7E-13.8E2(R2=0.855),该曲线呈先升高而后逐渐趋于平稳再略微降低的趋势,在凝结芽孢杆菌接种量为3%附近存在拐点。
2.2 凝结芽孢杆菌发酵三七叶茶的抗氧化活性
2.2.1 凝结芽孢杆菌发酵三七叶茶的DPPH自由基清除能力
凝结芽孢杆菌发酵的三七叶茶DPPH自由基清除率(E1~E3)均显著高于E0,样品质量浓度为2.0 g/L时,E0~E3的清除率分别为56.3%、68.3%、85.2%、74.4%,且呈剂量依赖关系(图3-a)。E0、E1、E2、E3的IC50值分别为1.610、1.068、0.649、1.003 g/L,其中维生素C的IC50值为0.002 8 g/L。由图3-a可知,随凝结芽孢杆菌接种量增加,DPPH自由基清除率表现先增加后减小的趋势,其中E2的DPPH自由基的清除能力最强,为85.2%(P<0.05)。
2.2.2 凝结芽孢杆菌发酵三七叶茶的ABTS阳离子自由基清除能力
图3-b显示了不同凝结芽孢杆菌接种量发酵三七叶茶ABTS阳离子自由基清除率。凝结芽孢杆菌发酵的三七叶茶(E1~E3)均表现出良好的ABTS阳离子自由基清除能力,均显著高于E0,样品质量浓度为2.0 g/L时,E0~E3的清除率分别为59.2%、73.7%、81.7%、68.8%,且呈剂量依赖关系。E0~E3的IC50值分别为1.691、1.231、0.846、1.098 g/L,其中维生素C的IC50值为0.002 9 g/L。由图3-b可知,随凝结芽孢杆菌接种量增加,ABTS阳离子自由基清除率呈现先增加后减小的趋势,与DPPH自由基清除能力类似,E2对ABTS阳离子自由基的清除作用最强,为81.7%(P<0.05)。
2.3 凝结芽孢杆菌发酵三七叶茶的香气特征
不同凝结芽孢杆菌接种量发酵三七叶茶挥发性化合物的典型总离子色谱如图4所示。与E0相比,凝结芽孢杆菌发酵的三七叶茶(E1~E3)的挥发性成分类型和丰度均有所增加。E0共检测到63种挥发性成分,E1、E2、E3共检测到86种挥发性香气成分。由挥发性化合物数量分布可知,凝结芽胞杆菌发酵三七叶茶酯类、烷烃化合物、酸类和醇类4个主要芳香化合物组占挥发性化合物总含量的80%左右,酯类和烷烃化合物数量最多,共40种,其次是酸类和醇类,共26种。对6种酯类、6种醇类、5种酸类、3种酮类、2种烷烃、1种酚类等23种芳香类物质进行分析可知(表1),发酵三七叶茶的亚油酸含量最高,为11.14%~17.02%;其次为亚麻酸乙酯,含量分别为8.21%~13.36%。相对E0,凝结芽孢杆菌发酵的三七叶茶新产生了肉豆蔻酸甲酯、山梨醇、四氢薰衣草醇、叶绿醇、环己醇、2-环己烯-1-甲醇、2-丁基-1-辛醇、十五烷、二十烷、β-紫罗兰酮、α-紫罗兰酮、生育酚等香气成分。E1、E2和E3生成了13、16、18种新的芳香类物质。分析生成的新物质可知,E1的肉豆蔻酸甲酯、山梨醇相对较多,含量分别为0.29%和2.85%;E2的α-紫罗兰酮相对较多,含量为0.32%;E3的肉桂酸、叶绿醇、生育酚相对较多,含量分别为3.78%、5.39%、4.80%。
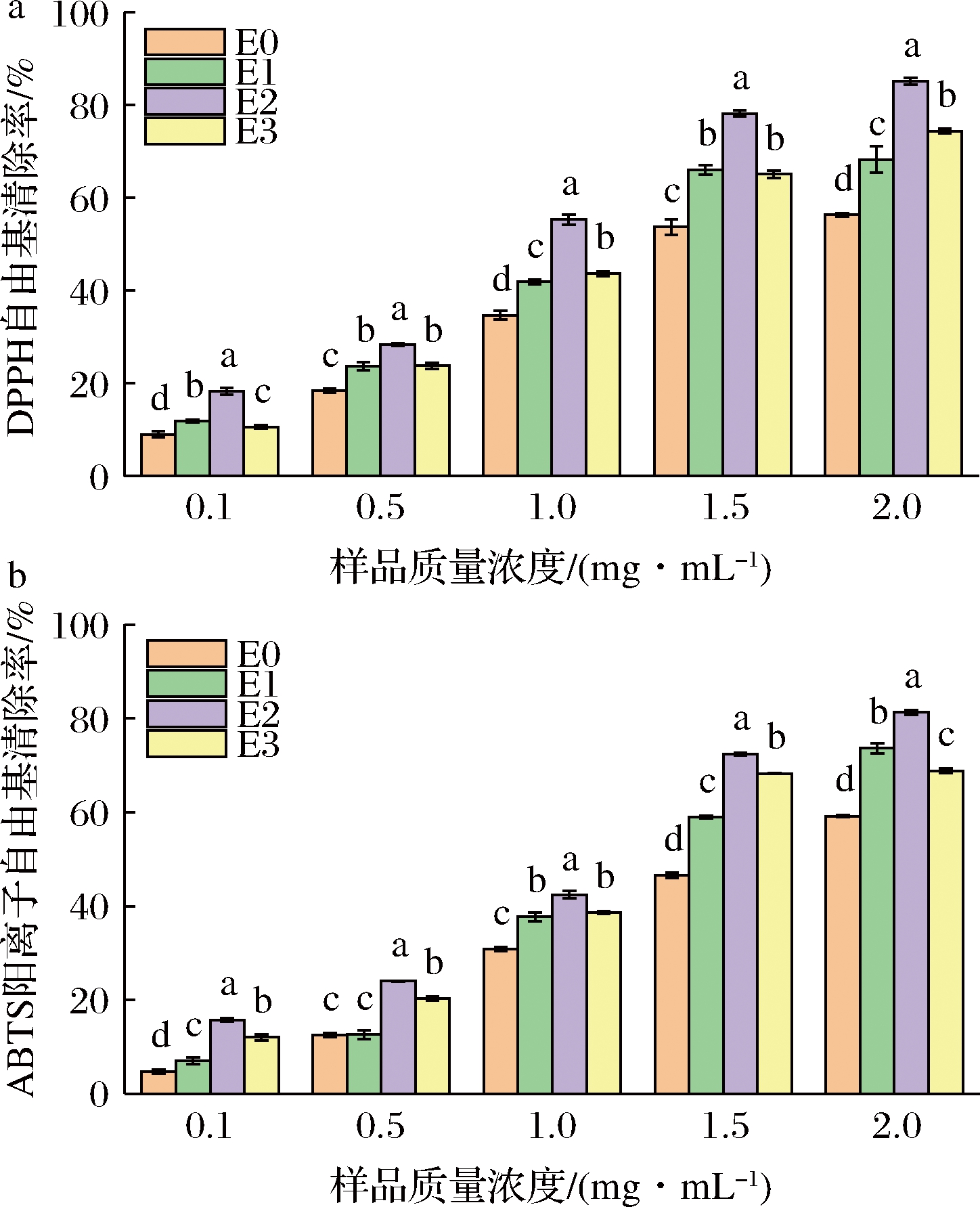
a-凝结芽孢杆菌发酵三七叶茶的DPPH自由基清除率; b-凝结芽孢杆菌发酵三七叶茶的ABTS阳离子自由基清除率
图3 凝结芽孢杆菌发酵三七叶茶的DPPH自由基、 ABTS阳离子自由基清除率
Fig.3 DPPH and ABTS free radical scavenging rates of Panax notoginseng leaf tea fermented with Bacillus coagulans
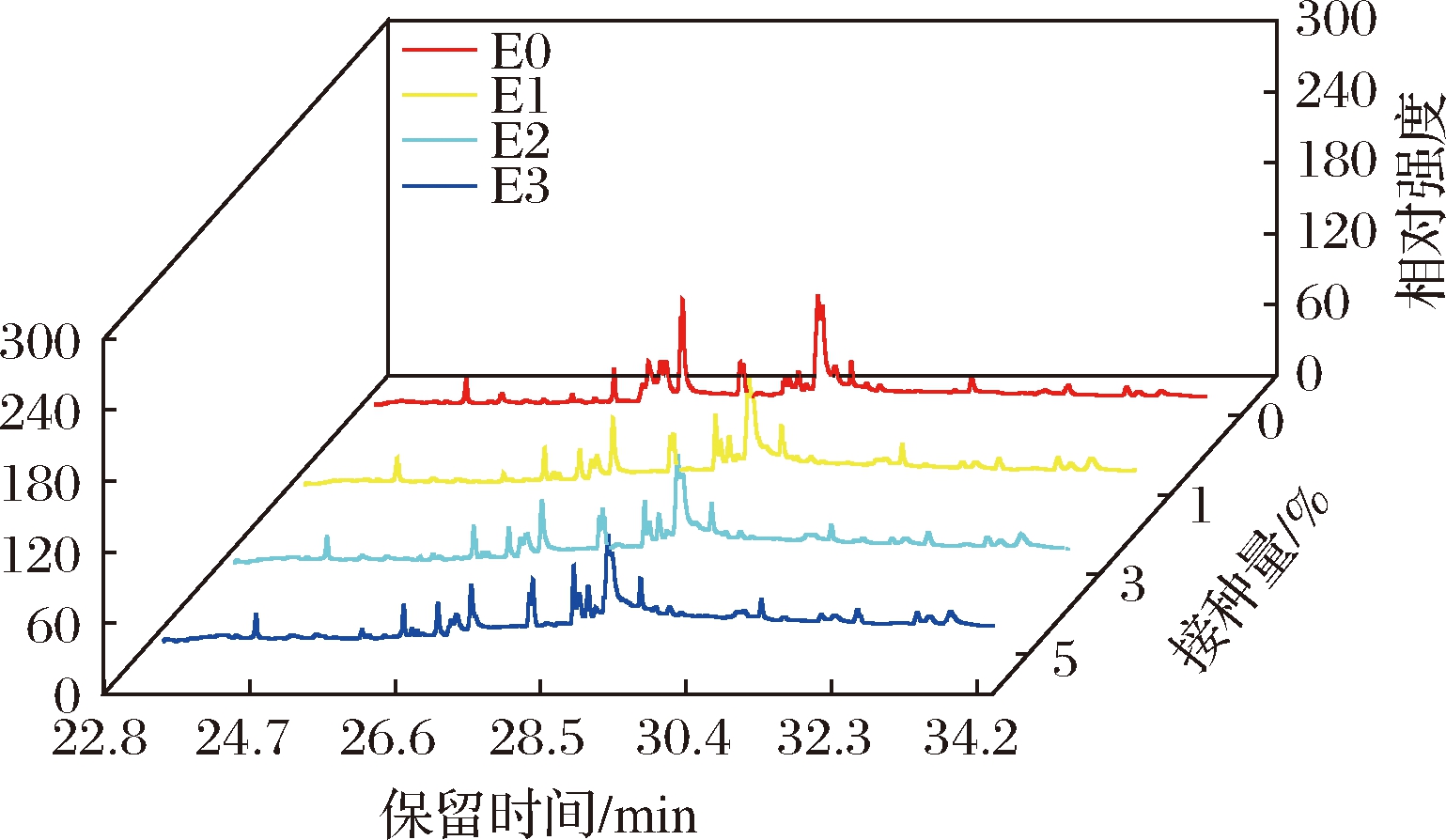
图4 凝结芽孢杆菌发酵三七叶茶的挥发性化合 物典型总离子色谱
Fig.4 Typical total ion chromatography of volatile compounds from Panax notoginseng leaf tea fermented with Bacillus coagulans
表1 凝结芽孢杆菌发酵三七叶茶的主要香气成分
Table 1 Main aroma components of Panax notoginseng leaf tea fermented with Bacillus coagulans
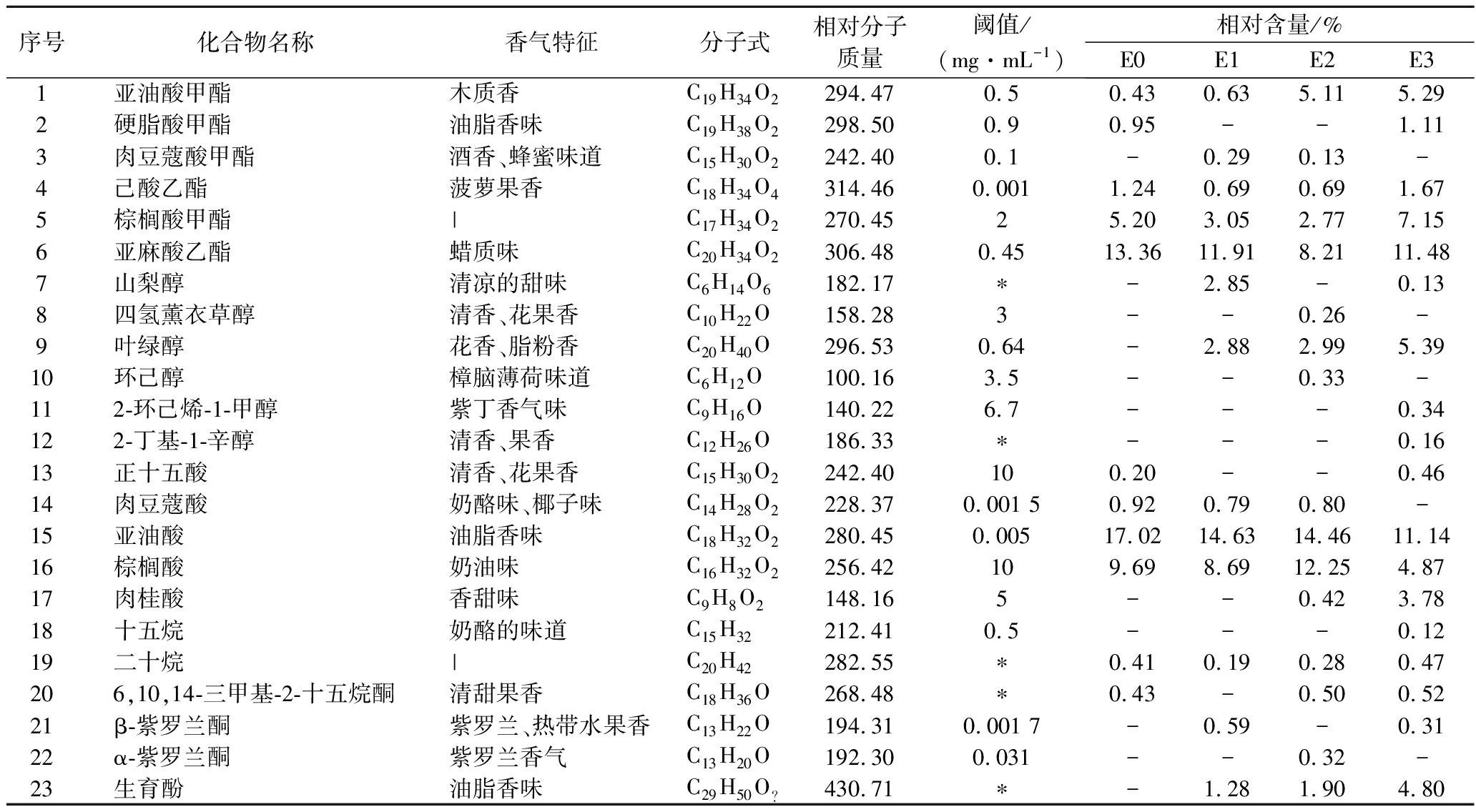
序号化合物名称香气特征分子式相对分子质量阈值/(mg·mL-1)相对含量/%E0E1E2E31亚油酸甲酯木质香C19H34O2294.470.50.430.635.115.292硬脂酸甲酯油脂香味C19H38O2298.500.90.95--1.113肉豆蔻酸甲酯酒香、蜂蜜味道C15H30O2242.400.1-0.290.13-4己酸乙酯菠萝果香C18H34O4314.460.0011.240.690.691.675棕榈酸甲酯|C17H34O2270.4525.203.052.777.156亚麻酸乙酯蜡质味C20H34O2306.480.4513.3611.918.2111.487山梨醇清凉的甜味C6H14O6182.17∗-2.85-0.138四氢薰衣草醇清香、花果香C10H22O158.283--0.26-9叶绿醇花香、脂粉香C20H40O296.530.64-2.882.995.3910环己醇樟脑薄荷味道C6H12O100.163.5--0.33-112-环己烯-1-甲醇紫丁香气味C9H16O140.226.7---0.34122-丁基-1-辛醇清香、果香C12H26O186.33∗---0.1613正十五酸清香、花果香C15H30O2242.40100.20--0.4614肉豆蔻酸奶酪味、椰子味C14H28O2228.370.001 50.920.790.80-15亚油酸油脂香味C18H32O2280.450.00517.0214.6314.4611.1416棕榈酸奶油味C16H32O2256.42109.698.6912.254.8717肉桂酸香甜味C9H8O2148.165--0.423.7818十五烷奶酪的味道C15H32212.410.5---0.1219二十烷|C20H42282.55∗0.410.190.280.47206,10,14-三甲基-2-十五烷酮清甜果香C18H36O268.48∗0.43-0.500.5221β-紫罗兰酮紫罗兰、热带水果香C13H22O194.310.001 7-0.59-0.3122α-紫罗兰酮紫罗兰香气C13H20O192.300.031--0.32-23生育酚油脂香味C29H50O?430.71∗-1.281.904.80
注:|表示无显著性风味,-表示低于检测限,*表示未找到记载;气味描述来自http://www.perflavory.com/风味库,阈值来自《化合物阈值汇编》
2.4 凝结芽孢杆菌发酵三七叶茶的感官评价
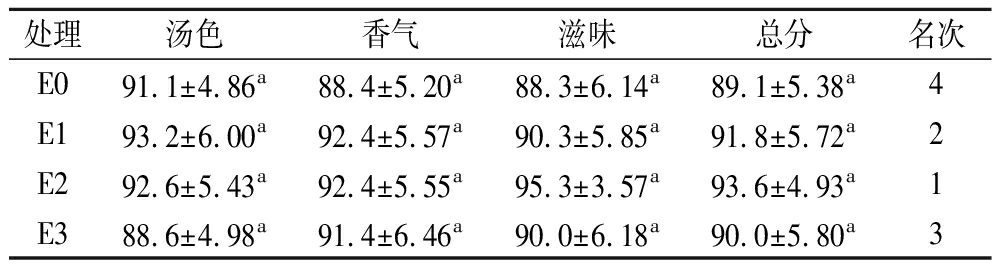
分析茶汤汤色、香气和滋味等指标的感官评分(表2)可知,虽然E0~E3的叶茶感官指标评分均无显著差异(P >0.05),但接种凝结芽孢杆菌发酵三七叶茶(E1~E3)总分均高于E0,说明接种凝结芽孢杆菌一定程度上能改善发酵三七叶茶的感官品质。E1和E2在汤色、香气、滋味的评分均高于E0,其中E1与E2汤色与香气评分较为接近,E2滋味评分(95.3±3.57)略高于E1(90.3±5.85)。E3叶茶汤色评分(88.6±4.98)低于E0(91.1±4.86),可能是较高凝结芽孢杆菌接种量会降低茶汤颜色鲜明度。4种叶茶感官总评分介于(89.1±5.38)~(93.6±4.93),其中E2感官总评分排名第1,表明E2易被审评人员接受。
表2 凝结芽孢杆菌发酵三七叶茶的感官评分
Table 2 Sensory evaluation of Panax notoginseng leaf tea fermented with Bacillus coagulans
处理汤色香气滋味总分名次E091.1±4.86a88.4±5.20a88.3±6.14a89.1±5.38a4E193.2±6.00a92.4±5.57a90.3±5.85a91.8±5.72a2E292.6±5.43a92.4±5.55a95.3±3.57a93.6±4.93a1E388.6±4.98a91.4±6.46a90.0±6.18a90.0±5.80a3
3 讨论
酚类、黄酮类、皂苷类物质皆为发酵三七叶茶的有效功能成分,具有延缓衰老、降低慢性疾病发生的功效[11]。本研究指出凝结芽孢杆菌发酵三七叶茶的总酚和总黄酮含量显著降低,总皂苷含量显著增加。总酚、总黄酮含量降低,一方面可能是多酚、黄酮类物质被凝结芽孢杆菌降解,在凝结芽孢杆菌发酵过程中通过戊糖-磷酸盐途径有效发酵分解木质素等促进了高分子量酚类化合物的解聚[17];另一方面,酚类化合物可与葡萄糖、蛋白质等组合或吸附,导致含量降低[18]。凝结芽孢杆菌发酵三七叶茶总皂苷含量增加的原因可能是凝结芽胞杆菌产生某些纤维素酶水解了三七叶木质部细胞的细胞壁[19],提高了皂苷提取率;也可能是发酵过程中产生了连接酶,将已被水解的糖苷重新连接成新的单体皂苷[20],从而导致总皂苷含量有所增加。E2皂苷含量最多,其原因可能是E1、E3菌种添加量不足或者是菌种活性受到抑制,造成三七叶茶未完全发酵。
凝结芽孢杆菌发酵三七叶茶的DPPH自由基、ABTS阳离子自由基清除能力增强。这可能是由于皂苷有一定的体外抗氧化活性,当皂苷含量增加,将使发酵三七叶茶清除自由基能力增强。另外,在发酵过程中可能产生了某种具有抗氧化活性的新物质。这些原因可能共同造成发酵三七叶茶的抗氧化活性上升。本研究还指出不同凝结芽孢杆菌接种量下三七叶茶的ABTS阳离子自由基清除率略低于DPPH自由基清除率,这种现象可能是由于不同自由基的清除机制不同造成的。其中,3%凝结芽孢杆菌接种量发酵的三七叶茶(E2)显示出更好的生物利用度,故该处理下的抗氧化活性较强。然而,发酵后叶茶的清除DPPH自由基、ABTS阳离子自由基活性的最大贡献成分仍不清晰,有可能是芦丁及槲皮素含量增加所致[21],也可能是花青素、茶多酚含量变化所致[22],具体成分还需要进一步探究。
凝结芽孢杆菌发酵后三七叶茶的芳香化合物成分及含量增加。叶茶发酵后,一些酯类是关键的芳香化合物,含量较高,为叶茶带来甜味和果味以及油性香味[23]。这些酯包括亚油酸甲酯、硬脂酸甲酯、肉豆蔻酸甲酯、己酸乙酯、亚麻酸乙酯等。其中,亚麻酸乙酯具有降血脂、降血压、抗血栓、抗过敏、抗癌[24]等生物活性,且主要为发酵茶叶提供脂肪和油性香气。除酯类外,烷烃类也检测到了较高的含量,考虑到其高阈值,不会直接产生茶叶的典型气味[25]。发酵过程中,醇类物质种类增加,使叶茶发酵后更加清香浓郁[26],其中山梨醇、四氢薰衣草醇、叶绿醇、环己醇含量显著增加。这些醇类增加的原因可能是在凝结芽胞杆菌发酵过程中产生的淀粉酶、蛋白酶水解为氨基酸[27],再由氨基酸氧化脱氨基的埃利希机制产生醇[28],为发酵三七叶茶带来花香、果香味。发酵后的亚油酸、棕榈酸含量显著降低,这可能是大多数酸在发酵过程中酯化为相应的酯,并有助于酯的形成,这些成分为发酵茶叶带来脂香、奶香味。鉴定出的6,10,14-三甲基-2-十五烷酮,α-紫罗兰酮和β-紫罗酮等是成品茯砖茶的重要挥发性组分[29],这些成分多具木香和花香。发酵后产生的生育酚具有抗氧化的作用[30]。上述生成的物质协同作用,共同赋予凝结芽孢杆菌发酵三七叶茶的独特风味。
4 结论
本项研究通过凝结芽孢杆菌发酵三七叶茶的试验,探明了凝结芽孢杆菌对发酵三七叶茶的功效成分、抗氧化活性和特征香气成分的影响,确定了凝结芽胞杆菌发酵三七叶茶的适宜接种量,主要结果如下:
(1)凝结芽孢杆菌发酵三七叶茶的总酚和总黄酮含量显著降低,总皂苷含量显著增加。随凝结芽孢杆菌接种量增加,总酚、总黄酮含量整体呈先下降后升高的趋势,总皂苷含量呈先升高后逐渐趋于平稳后稍稍降低的趋势。
(2)凝结芽孢杆菌发酵三七叶茶能提高叶茶的抗氧化活性。随凝结芽孢杆菌接种量增加,三七叶茶的DPPH自由基、ABTS阳离子自由基清除率表现为先增加后减小的趋势,且呈剂量依赖关系,其中E2表现出的抗氧化活性最高。
(3)凝结芽孢杆菌发酵三七叶茶可丰富叶茶的香气成分。凝结芽孢杆菌发酵的三七叶茶共检测到86种挥发性香气成分,并生成了四氢薰衣草醇、叶绿醇、环己醇、2-环己烯-1-甲醇、2-丁基-1-辛醇等醇类物质;β-紫罗兰酮、α-紫罗兰酮等酮类化合物;肉豆蔻酸甲酯、肉桂酸、十五烷、生育酚等香气物质。
(4)凝结芽孢杆菌能提高三七叶茶的感官总评分。对4种凝结芽孢杆菌发酵叶茶分别按照茶汤汤色、香气和滋味3项因子进行感官评价,E1处理下的叶茶汤色和香气评分最高,E2处理下的叶茶总评分和滋味评分最高。
综合考虑功效成分、抗氧化活性、香气成分以及感官评价等,推荐3%凝结芽孢杆菌接种量(E2)为发酵三七叶茶的适宜接种量,其叶茶具有较高的总皂苷含量、良好的抗氧化活性,且与未发酵的叶茶相比,香气成分更加丰富且感官评价最高。本研究可为进一步开发和利用凝结芽孢杆菌发酵食品及三七叶片在保健品行业中的应用提供参考依据。
[1] 周家明, 崔秀明, 曾江, 等.三七各部位单体皂苷成分研究进展与活性利用探讨[J].中药材, 2007, 30(12):1 615-1 618.
ZHOU J M, CUI X M, ZENG J, et al.Research progress and activity utilization of monomer saponins from various parts of Radix Notoginseng[J].Journal of Chinese Medicinal Materials, 2007, 30(12):1 615-1 618.
[2] 刘志, 夏娟, 李伟, 等.天冬氨酸降解人参二醇组皂苷及其美拉德反应产物的抗氧化活性[J].食品科学, 2018, 39(7):20-26.
LIU Z, XIA J, LI W, et al.Degradation of protopanaxadiol-type ginsenosides with aspartic acid and antioxidant activity of Maillard reaction products[J].Food Science, 2018, 39(7):20-26.
[3] 王志钢, 刘彬, 于春媛, 等.益生菌的保健功能及其在保健食品中的应用[J].食品与药品,2018, 20(1):80-85.
WANG Z G, LIU B, YU C Y, et al.Functions of probiotics and its applications in health food[J].Food and Drug, 2018, 20(1):80-85.
[4] 苏赞, 陈皓睿, 薛云, 等.三株散囊菌属真菌的茶叶液态发酵与其成分分析[J].工业微生物, 2020, 50(1):14-19.
SU Z, CHEN H R, XUE Y, et al.Liquid fermentation of tea by three Eurotium spp.fungi and their corresponding content analyses[J].Industrial Microbiology, 2020, 50(1):14-19.
[5] 刘佳奇, 彭珍, 熊涛.乳酸菌发酵对红茶饮料营养成分、香气成分及抗氧化活性的影响[J].食品科学, 2017, 38(24):130-136.
LIU J Q, PENG Z, XIONG T.Effects of lactic acid bacterial fermentation on nutritional components, aroma components and antioxidant activity of black tea beverage[J].Food Science, 2017, 38(24):130-136.
[6] 邹金美, 宋宗仁, 蔡咚玲, 等.冠突散囊菌固体发酵铁观音茶的主要活性成分及其抗氧化性分析[J].食品工业科技, 2021, 42(22):369-375.
ZOU J M, SONG Z R, CAI D L, et al.Analysis on the main active components and antioxidant activity of tieguanyin tea fermentation by Eurotium cristatum[J].Science and Technology of Food Industry, 2021, 42(22):369-375.
[7] 文治瑞, 王佳菜, 刘丽明, 等.超声波辅助提取金花茶中黄酮类物质工艺及体外抗氧化研究[J].食品安全质量检测学报, 2020, 11(13):4 364-4 370.
WEN Z R, WANG J C, LIU L M, et al.Study on the ultrasonic assisted extraction of flavonoids from Camellia chrysantha and the antioxidant in vitro[J].Journal of Food Safety &Quality, 2020, 11(13):4 364-4 370.
[8] 孙标, 陈维菁, 赵迎庆, 等.凝结芽孢杆菌的产孢条件及高密度培养工艺[J].湖南农业大学学报(自然科学版), 2021, 47(2):171-179.
SUN B, CHEN W J, ZHAO Y Q, et al.Optimization of the spore-forming and high density culture conditions for Bacillus coagulans[J].Journal of Hunan Agricultural University (Natural Sciences), 2021, 47(2):171-179.
[9] 付佳莹, 丁建, 谢冰花, 等.凝结芽孢杆菌培养基确定与高密度发酵条件优化研究[J].畜牧兽医科学(电子版), 2019(2):5-8.
FU J Y, DING J, XIE B H, et al.Determination of culture medium of Bacillus coagulans and optimization of high density fermentation conditions[J].Graziery Veterinary Sciences (Electronic Version), 2019(2):5-8.
[10] 马若霜, 方海田, 刘慧燕, 等.凝结芽孢杆菌发酵枸杞汁的工艺优化及主要成分变化[J].中国酿造, 2018, 37(12):169-174.
MA R S, FANG H T, LIU H Y, et al.Fermentation technology of goji juice by Bacillus coagulans and its major nutrients components changes[J].China Brewing, 2018, 37(12):169-174.
[11] 肖兰芳, 赵珊, 刘冬梅,等.凝结芽孢杆菌发酵乳的工艺优化[J].现代食品科技, 2022, 38(7):90-97.
XIAO L F, ZHAO S, LIU D M, et al.Optimization of preparation of fermented milk by Bacillus coagulans[J].Modern Food Science and Technology, 2022, 38(7):90-97.
[12] ZHOU J X, MA Y L, JIA Y J, et al.Phenolic profiles, antioxidant activities and cytoprotective effects of different phenolic fractions from oil palm (Elaeis guineensis Jacq.) fruits treated by ultra-high pressure[J].Food Chemistry, 2019, 288:68-77.
[13] SUN D, HUANG S Q, CAI S B, et al.Digestion property and synergistic effect on biological activity of purple rice (Oryza sativa L.) anthocyanins subjected to a simulated gastrointestinal digestion in vitro[J].Food Research International, 2015, 78:114-123.
[14] LI R, WU Z L, WANG Y J, et al.Separation of total saponins from the pericarp of Sapindus mukorossi Gaerten.by foam fractionation[J].Industrial Crops &Products, 2013, 51:163-170.
[15] MA Q, CAI S B, LIU X J, et al.Characterization of phytochemical components and identification of main antioxidants in Crateva unilocalaris Buch.shoots by UHPLC-Q-Orbitrap-MS2 analysis[J].Food Research International, 2021, 143:110264.
[16] 艾小钰, 高玮, 黄霞, 等.不同茶饮产品的抗氧化能力分析及感官评价[J].食品工业科技, 2015, 36(20):164-167;179.
AI X Y, GAO W, HUANG X, et al.Antioxidant activity and sensory evaluation of tea drinks[J].Science and Technology of Food Industry, 2015, 36(20):164-167;179.
[17] 周颖, 韦仕静, 葛亚中, 等.生姜酵素发酵过程中生物活性成分含量及其抗氧化活性的变化[J].食品工业科技, 2018, 39(18):39-44.
ZHOU Y, WEI S J, GE Y Z, et al.Changes of bioactive components and antioxidant activities about Ginger Jiaosu during the fermentation process[J].Science and Technology of Food Industry, 2018, 39(18):39-44.
[18] 韩业君, 陈洪章.植物细胞壁蛋白与木质纤维素酶解[J].化学进展, 2007,19(S2):1 153-1 158.
HAN Y J, CHEN H Z.Plant cell wall proteins &enzymatic hydrolysis of lignocellulose[J].Progress in Chemistry, 2007,19(S2):1 153-1 158.
[19] 蒋丽萍. 固定化糖苷水解酶及其制备稀有人参皂苷CK的研究[D].昆明:云南大学, 2020.
JIANG L P.Study on immobilized glycoside hydrolase and preparation of rare ginsenoside CK[D].Kunming:Yunnan University, 2020.
[20] 叶羊, 谢洁, 陈江, 等.不同冲泡条件对苦荞叶发酵茶抗氧化活性及功能成分浸出量的影响[J].食品科技, 2019, 44(10):97-104.
YE Y, XIE J, CHEN J, et al.Effects of different brewing conditions on antioxidant activity and leaching amount of functional components of Tartary buckwheat leaf fermented tea[J].Food Science and Technology, 2019, 44(10):97-104.
[21] 王燕, 冯瑛, 杨晓萍, 等.紫娟茶花青素的抗氧化活性及稳定性[J].食品工业科技, 2018, 39(18):17-21.
WANG Y, FENG Y, YANG X P, et al.Antioxidant activity and stability of anthocyanins from zijuan tea[J].Science and Technology of Food Industry, 2018, 39(18):17-21.
[22] YUE Q L, WANG Z J, YU F P, et al.Changes in metabolite profiles and antioxidant and hypoglycemic activities of Laminaria japonica after fermentation[J].LWT-Food Science and Technology, 2022, 158:113122.
[23] HIRANO J, ISODA Y, NISHIZAWA Y.Utilization of n-3 plant oils Perilla and flaxseed oils[J].Journal of Japan Oil Chemists′ Society, 1991, 40(10):942-950.
[24] 郭英, 蔡秀成, 李华娟, 等.紫苏油和松籽油对大鼠机体脂类和脂质过氧化的影响[J].营养学报, 1996, 18(3):268-273.
GUO Y, CAI X C, LI H J, et al.Effect of Perilla oil and pinon oil on lipid and lipid peroxidation in rats[J].Acta Nutrimenta Sinica, 1996, 18(3):268-273.
[25] PINO J, FUENTES V, BARRIOS O.Volatile constituents of Cachucha peppers (Capsicum chinense Jacq.) grown in Cuba[J].Food Chemistry, 2011, 125(3):860-864.
[26] 秦改花. 梨果实挥发性芳香物质组成及其形成特性分析[D].南京:南京农业大学, 2012.
QIN G H.Analysis on volatile aroma constituent and its formation characteristics of pears[D].Nanjing:Nanjing Agricultural University, 2012.
[27] 资英娟, 孔俊铭, 郭志鹏, 等.凝结芽孢杆菌NJh032产酶抑菌活性及其发酵产品性能探究[J].饲料研究, 2021, 44(7):102-106.
ZI Y J, KONG J M, GUO Z P, et al.Investigation of enzyme production and bacterial inhibition activity of Bacillus coagulans NJh032 and the performance of its fermentation products[J].Feed Research, 2021, 44(7):102-106.
[28] RAHAYU Y Y S, YOSHIZAKI Y, YAMAGUCHI K, et al.Key volatile compounds in red koji-shochu, a Monascus-fermented product, and their formation steps during fermentation[J].Food Chemistry, 2017, 224:398-406.
[29] 张亚. 陕西茯砖茶挥发性成分研究[D].杨凌:西北农林科技大学, 2016.
ZHANG Y.Study on volatile components of Shaanxi Fuzhuan tea[D].Yangling:Northwest Agriculture and Forestry University, 2016.
[30] 朱雪梅, 阮霞, 胡蒋宁, 等.α-生育酚、VC硬脂酸酯和槲皮素在含松籽油酸结构脂中抗氧化作用的研究[J].食品科学, 2013, 34(1):88-92.
ZHU X M, RUAN X, HU J N, et al.Antioxidant effects of α-tocopherol, ascorbyl palmitate and quercetin on structured lipid containing pinolenic acid[J].Food Science, 2013, 34(1):88-92.