发酵肉制品是一种高档肉制品,数百年来,传统干发酵肠因其独特的风味和质地特征一直广受消费者亲睐[1]。传统干发酵香肠通常由切碎的生猪肉与香料混合,塞入肠衣,在通风良好的室内发酵10~15 d而成[2]。近年来随着消费者对于发酵产品质量安全和营养健康的重视,一些企业开始在加工过程中使用发酵剂并在条件适宜的发酵室中进行发酵,使发酵产品的生产和加工逐渐走向标准化。干发酵香肠生产加工中添加适当的发酵剂可以大大缩短发酵时间,并赋予香肠特殊的发酵风味,这也是很多人喜欢发酵香肠的原因之一。发酵香肠的生产在欧洲国家如法国、意大利以及德国等是肉类工业中最重要最活跃的经济活动之一[3]。但由于我国在发酵肉制品研究方面起步较晚,目前仍然存在生产工艺普适性低、缺乏优质发酵剂等问题[4]。
乳酸菌(lactic acid bacteria,LAB)和凝固酶阴性葡萄球菌(Coagulase-Negative Staphylococci,CNS)是从传统干发酵香肠的内源菌群中分离出来的两大类细菌。由于它们对肉类加工环境出色的适应性和在产品中微生物区系的主导能力,常常作为优良的发酵剂而被用于发酵肉制品的加工[5]。此外LAB和CNS的使用有利于产品的酸化、发酵香肠肉色和其特有风味的形成[6]。在发酵香肠中,LAB的主要贡献是通过其抗菌代谢物(包括有机酸、细菌素和过氧化氢)抑制病原体生长[7]。CNS有助于抑制脂质氧化、促进亚硝基肌红蛋白的形成、提高还原硝酸盐的能力促使产品呈现典型的红色[8]。
本研究以不同添加量(105、106、107 CFU/g)的发酵剂(清酒乳杆菌与肉葡萄球菌1∶1复配)为试验组,以自然发酵和商业发酵剂组为对照发酵香肠。通过对发酵过程中(1、3、6、9、12、15 d)相关指标变化跟踪测定,探究不同试验组的相关测定指标间差异与发酵香肠理化性质、品质及安全指标方面的关系确定发酵时间和接种量,从而为发酵工艺的优化研究提供理论基础。
1 材料与方法
1.1 材料与试剂
牛后腿肉购于河南伊赛公司;猪背膘购于河南双汇公司;清酒乳杆菌(Lactobacillus sakei)分离自云南腊肉中;GIM 1.955肉葡萄球菌(Staphylococcus carnosus)购于广东省微生物菌种保藏中心;MF-cul 102商业用肉制品发酵菌株(乳酸片球菌、戊糖片球菌、嗜热链球菌),江苏微康生物科技有限公司;硼酸,天津市恒兴化学试剂制造有限公司;盐酸、硫酸,晋中市鑫顺源科贸有限公司;平板计数琼脂、甘露醇氯化钠琼脂、MRS琼脂培养基、肠道菌计数琼脂,青岛海博生物有限公司。
1.2 仪器与设备
AJP-20搅拌机,广州德麦机械有限公司;VF608Plus真空灌肠机,汉特曼机械贸易(上海)有限公司;Aqualab 4TE DUO水分活度仪,美国METER Group, Inc.公司;E-201-C pH计,上海仪电科学仪器股份有限公司;BioTeK Epoch 微孔板分光光度计,美国伯腾仪器有限公司;UV2600紫外分光光度计,岛津企业管理(中国)有限公司。
1.3 实验方法
1.3.1 发酵牛肉香肠的制备
工艺流程如下:
原料肉预处理→瘦肉绞碎、肥肉切丁→添加辅料、搅拌腌制→灌肠→发酵→干燥成熟→取样包装
操作要点如下:
首先将解冻后的原料肉去除脂肪和筋膜,然后分别将瘦肉绞碎、肥肉切丁,按照瘦肥比7∶3混合。接下来将葡萄糖0.5%、糖4%、盐2.2%,亚硝酸钠0.015%,异抗坏血酸钠0.05%(质量分数)等辅料用无菌水溶解后与肉糜充分混合,同时分别接入接种量为105、106、107 CFU/g发酵剂(清酒乳杆菌∶肉葡萄球菌=1∶1)和商业发酵剂,在温度为(25±0.5) ℃,相对湿度95%,发酵2 d后进行灌肠,灌肠完成后,在温度为(15±0.5) ℃,相对湿度为80%,发酵5 d;温度为(15±0.5) ℃,相对湿度为75%,发酵5 d;温度为(12±0.5) ℃,相对湿度为70%,发酵3 d。在上述条件下一共发酵15 d后得到成品,包装后用于指标的测定。
1.3.2 基本理化性质的测定
1.3.2.1 pH的测定
参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》。具体方法如下:将去皮后的发酵香肠样品用搅碎机搅碎后,称取5 g碎肉置于均质袋内,加入50 mL氯化钾溶液(0.1 mol/L),用均质机拍打2 min进行均质,随后用pH计进行检测。每组处理3个平行。
1.3.2.2 水分含量的测定
参照龚钰等[9]的方法,采用常压干燥法测定。
1.3.2.3 水分活度(water activity,Aw)的测定
水分活度仪先使用蒸馏水进行校正,将发酵香肠去除肠衣,称取5 g处理好的样品放入样品杯中,样品杯置于样品仓,合上仪器盖子进行检测,待仪器读数确定,即为样品中的水分活度[10]。
1.3.2.4 亚硝酸盐的测定
参考GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》。
1.3.2.5 丙二醛的测定
按试剂盒(南京建成生物工程研究所-A003-1)说明操作。结果表示为每毫克肉样所含丙二醛含量(nmol/mg)。
1.3.2.6 蛋白质羰基的测定
按试剂盒(南京建成生物工程研究所-A087-1)说明操作。结果表示为每毫克肉样所含羰基含量(nmol/mg prot)。
1.3.2.7 蛋白质巯基的测定
按试剂盒(南京建成生物工程研究所-A063-3-1)说明操作。结果表示为每克肉样所含巯基含量(μmol/g prot)。
1.3.3 微生物数量的测定
参照李珊珊[11]的方法,样品分别在37 ℃条件下平板计数琼脂培养基培养48 h、MRS培养基培养48 h、甘露醇氯化钠琼脂培养基培养48 h、肠道菌计数琼脂培养基培养24 h。
1.3.4 质构的测定
参考顾于滨[12]的方法,并略作修改。将发酵香肠去除肠衣后切成1 cm厚的柱状,使用P50探头进行测定,TPA参数:初始力5 N,压缩比50%,测试速度60 mm/min。
1.3.5 感官评价
邀请10名从事肉品专业研究的硕士研究生(男女各5人)对发酵牛肉香肠进行感官测定,共包含以下5个方面:色泽、风味、咀嚼性、组织状态、总体可接受性。具体评定标准如表1所示。
1.4 数据分析
对以上实验测得的实验数据均采用SPSS 24.0、Origin 2021等软件进行统计、绘图分析。各实验均设计3次平行,使用平均值±标准差作为实验数据的表示方法,显著性水平均设定为P<0.05。
2 结果与分析
2.1 牛肉香肠发酵过程中理化性质的变化
2.1.1 牛肉香肠发酵过程中pH值的变化
由图1可知,5组的pH值均在发酵开始之后均迅速降低,在发酵前6 d下降最为明显。乳酸菌在特定温度湿度条件下生长繁殖,分解糖类产酸,导致了pH的降低。接种量为105、106、107 CFU/g组在发酵过程中pH值依次降低(P<0.05),说明乳酸菌接种量越多,pH值越低。较低的pH值有利于控制发酵香肠产品中有害微生物的生长,同时,可延长发酵香肠的保质期[13]。发酵6 d后,3个复配菌株组和商业菌株组的pH值显著低于自然发酵组(P<0.05),说明乳酸菌在发酵过程中起到了降低pH值的作用。发酵12~15 d时各组的pH都略微上升,主要是由于在发酵后期,微生物作用于内源酶或外源酶,分解蛋白质产生了肽和胺等碱性物质,它们对有机酸起缓冲作用[14]。
表1 发酵牛肉香肠感官评分表
Table 1 The sensory score of fermented beef sausage
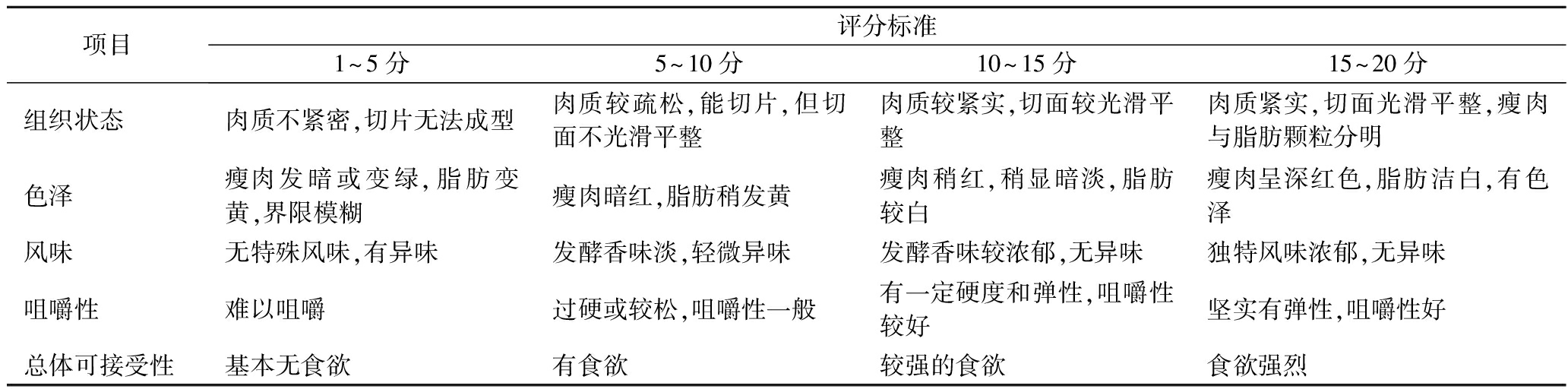
项目评分标准1~5分5~10分10~15分15~20分组织状态肉质不紧密,切片无法成型肉质较疏松,能切片,但切面不光滑平整肉质较紧实,切面较光滑平整肉质紧实,切面光滑平整,瘦肉与脂肪颗粒分明色泽瘦肉发暗或变绿,脂肪变黄,界限模糊瘦肉暗红,脂肪稍发黄瘦肉稍红,稍显暗淡,脂肪较白瘦肉呈深红色,脂肪洁白,有色泽风味无特殊风味,有异味发酵香味淡,轻微异味发酵香味较浓郁,无异味独特风味浓郁,无异味咀嚼性难以咀嚼过硬或较松,咀嚼性一般有一定硬度和弹性,咀嚼性较好坚实有弹性,咀嚼性好总体可接受性基本无食欲有食欲较强的食欲食欲强烈
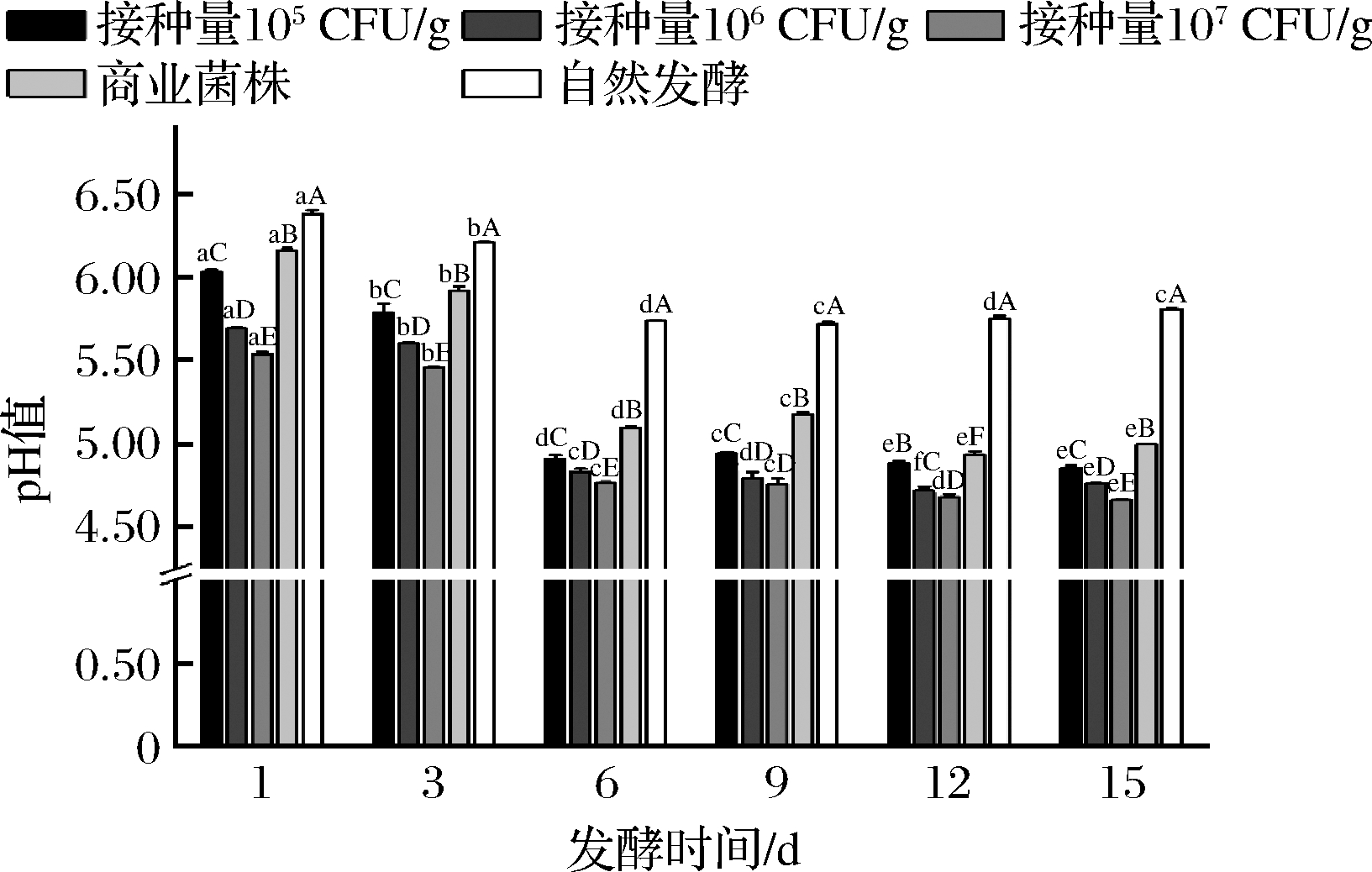
图1 牛肉香肠发酵过程中pH值的变化
Fig.1 The change of pH value during fermentation of beef sausage
注:不同小写字母表示在不同时间点同一发酵香肠组的差异显著(P<0.05), 不同大写字母表示不同发酵香肠组在同一时间点的差异显著(P<0.05)(下同)
2.1.2 牛肉香肠发酵过程中水分活度的变化
由图2可知,5组的水分活度在发酵开始之后都不断下降。由于在发酵过程中,湿度下降导致香肠内部水分向外扩散,水分活度呈显著下降趋势(P<0.05)[15]。微生物生长都有最低的水分活度。在水分活度达到0.91以下时大多数细菌停止生长,5组发酵香肠的水分活度都降到0.91以下,可以有效抑制腐败菌的生长。在15 d时,接种量为107 CFU/g组的水分活度显著低于其他2个接种量组(P<0.05),说明接种量越大水分活度越低。在一定程度上,发酵香肠的贮藏稳定性与其低水分活度有关。所以水分活度的下降有利于提高发酵香肠的安全性和稳定性。
2.1.3 牛肉香肠发酵过程中水分含量的变化
由图3可知,5组的水分含量在发酵开始之后都在持续下降。但是不同接种量组之间的水分含量没有显著差异。在发酵过程初始(1 d),5组牛肉香肠的水分含量都在60%左右,在牛肉香肠发酵过程中的前9 d水分含量急速下降,可能的原因是发酵初期,香肠内较高的水分含量有利于乳酸菌的生长产酸,从而导致pH值快速下降,逐渐接近肌肉蛋白的等电点,保水性下降,这与LORENZO等[16]研究结果一致。水分含量的下降有助于水分活度的下降,不仅可以抑制微生物的生长,对发酵香肠的色泽、风味及内源酶活性也有重要影响。
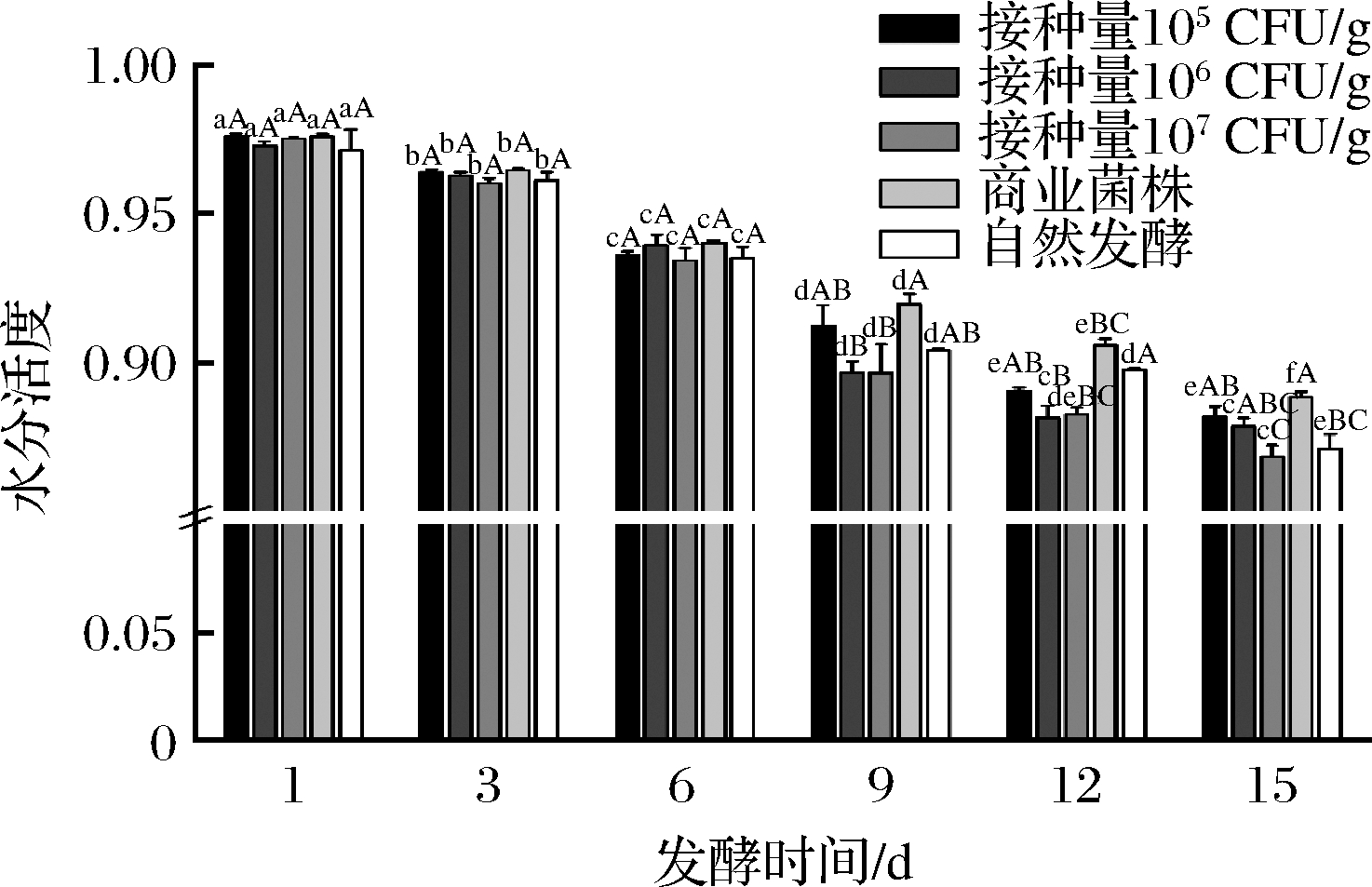
图2 牛肉香肠发酵过程中水分活度的变化
Fig.2 The Changes of the Aw value in the fermentation of beef sausage
2.2 牛肉香肠发酵过程中品质指标的变化
2.2.1 牛肉香肠发酵过程中质构的变化
由表2可知,5组牛肉发酵香肠的硬度在发酵过程中均不断增加,且复配菌株组和商业菌株组的硬度均显著高于自然发酵组(P<0.05),这可能是因为低pH的环境导致蛋白质变性,降低了产品的持水率,使其结构更紧密,这与GONZ LEZ-FERN
LEZ-FERN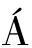 NDEZ等[17]的研究结果相似。接种量为105 CFU/g组在发酵15 d时硬度最大,为164.83 N,其次是106 CFU/g组,为159.23 N,均显著高于其余组的硬度(P<0.05),原因可能是由于蛋白质脂肪的分解产生了一部分水[18],使得接种量为107 CFU/g组在12~15 d的水分含量大于其他两个复配菌株组(图3),导致其硬度小于其他2组。对于内聚性和弹性而言,各组之间的差异并不显著(P>0.05)。自然发酵组在发酵过程中的胶黏性显著低于其余4组(P<0.05)。咀嚼性在整个发酵过程中也在不断地增加,复配菌株组和商业菌株组咀嚼性始终显著高于自然发酵(P<0.05),接种量为107 CFU/g组在发酵15 d时的咀嚼性显著高于其余4组香肠(P<0.05)。质构在发酵前期的变化主要是由于低pH环境使香肠中的肌原纤维蛋白聚合形成凝胶,后期主要取决于香肠中水分的流失[12],这也与水分活度的结果相一致(图2)。
NDEZ等[17]的研究结果相似。接种量为105 CFU/g组在发酵15 d时硬度最大,为164.83 N,其次是106 CFU/g组,为159.23 N,均显著高于其余组的硬度(P<0.05),原因可能是由于蛋白质脂肪的分解产生了一部分水[18],使得接种量为107 CFU/g组在12~15 d的水分含量大于其他两个复配菌株组(图3),导致其硬度小于其他2组。对于内聚性和弹性而言,各组之间的差异并不显著(P>0.05)。自然发酵组在发酵过程中的胶黏性显著低于其余4组(P<0.05)。咀嚼性在整个发酵过程中也在不断地增加,复配菌株组和商业菌株组咀嚼性始终显著高于自然发酵(P<0.05),接种量为107 CFU/g组在发酵15 d时的咀嚼性显著高于其余4组香肠(P<0.05)。质构在发酵前期的变化主要是由于低pH环境使香肠中的肌原纤维蛋白聚合形成凝胶,后期主要取决于香肠中水分的流失[12],这也与水分活度的结果相一致(图2)。
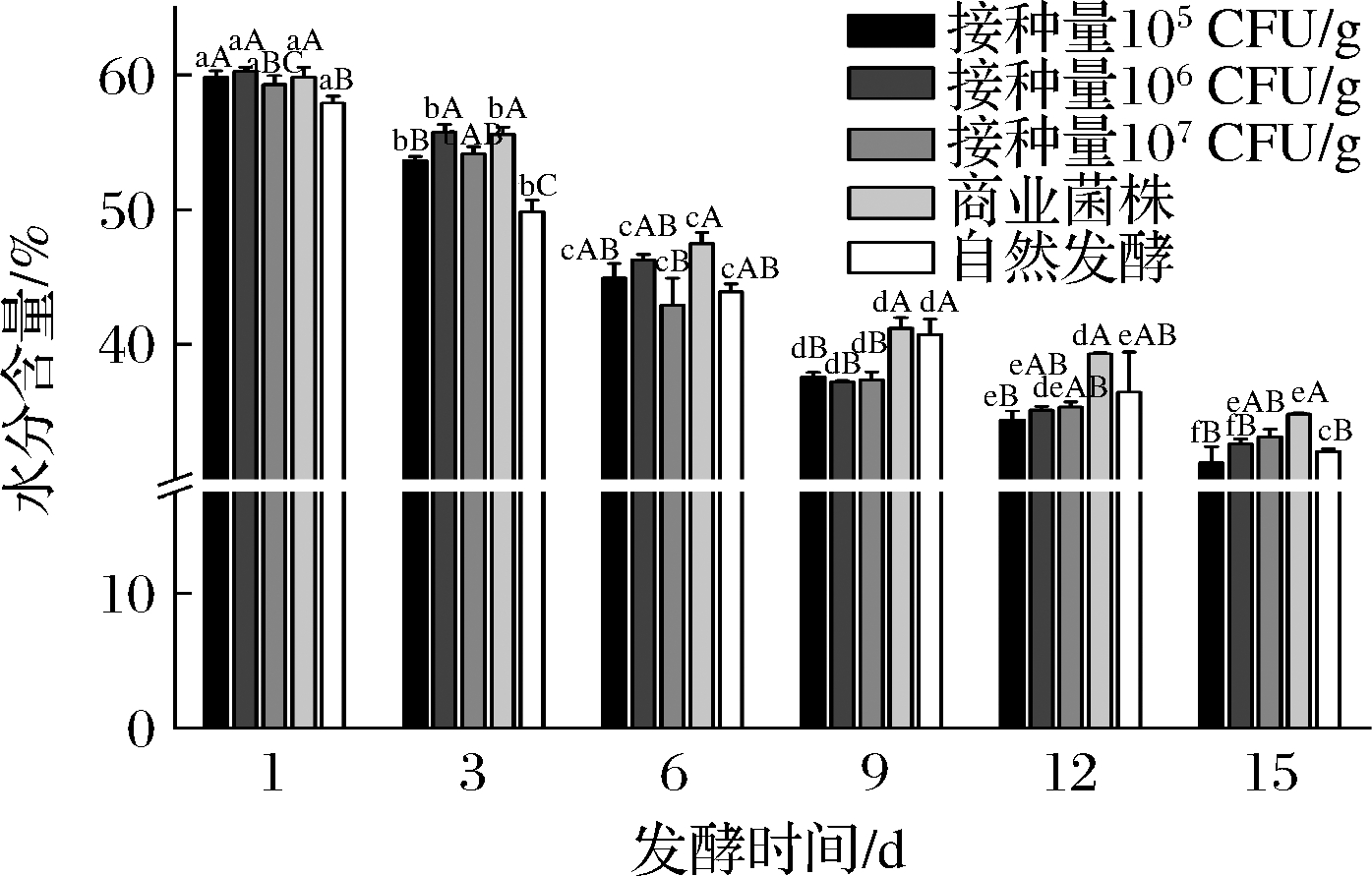
图3 牛肉香肠发酵过程中水分含量的变化
Fig.3 The changes of moisture content in beef sausage during fermentation
表2 牛肉香肠发酵过程中质构的变化
Table 2 The changes in texture of beef sausage during fermentation

发酵时间/d组别硬度/N内聚性/Ratio弹性/mm胶黏性/N咀嚼性/mJ105 CFU/g55.65±0.98eA0.29±0.01aA3.42±0.02aAB107.95±2.76eA31.75±0.71eA106 CFU/g54.32±1.00eA0.28±0.01aAB3.35±0.04aAB109.73±1.39eA30.87±1.11dA3107 CFU/g56.11±2.49eA0.25±0.01aB3.44±0.14aAB84.16±1.15eB26.59±0.68eB商业55.43±0.96eA0.31±0.02aA3.56±0.06aA68.56±0.92eC18.37±0.58eC自然32.50±2.12cB0.31±0.01aA3.22±0.07aB62.32±2.12eD14.19±0.69eD105 CFU/g92.40±1.73dA0.27±0.00bB2.97±0.03bA120.48±1.86dB37.64±0.69dC106 CFU/g91.65±1.59dA0.22±0.01bC3.00±0.09abA165.55±1.32dA46.30±0.77cB6107 CFU/g90.22±2.57dA0.20±0.01bC3.12±0.08abA120.60±1.54dB55.52±0.98dA商业89.14±1.81dA0.28±0.01abAB3.07±0.10bA83.10±3.61dC25.80±2.22dD自然72.30±1.62bB0.30±0.02aA2.89±0.10aA77.80±3.29dC17.75±0.56dE105 CFU/g110.32±2.48cA0.23±0.01cB2.77±0.10bcA192.02±2.08cA56.66±0.45cB106 CFU/g113.40±3.60cA0.20±0.01bcB2.82±0.19bcA188.82±1.23cAB59.00±1.12bB9107 CFU/g105.47±2.50cA0.20±0.02bB2.79±0.07bA185.90±0.79cB64.80±0.88cA商业106.70±1.83cA0.27±0.01bcA2.88±0.16bcA138.27±1.48cC38.50±0.73cC自然80.20±1.59bB0.28±0.01abA2.84±0.54aA85.00±1.97cD21.22±0.97cD105 CFU/g130.22±3.04bA0.21±0.01dB2.64±0.09cA211.20±0.69bC63.93±1.03bBC106 CFU/g134.50±0.84bA0.19±0.01cB2.57±0.06cA219.61±1.20bB60.35±0.95bC12107 CFU/g120.63±1.77bB0.20±0.01bB2.45±0.05cA240.45±3.59bA76.24±0.72bA商业130.24±1.61bA0.25±0.01bcA2.60±0.08cdA195.08±1.18bD65.30±2.54bB自然90.43±1.75aC0.25±0.01bA2.63±0.02aA102.71±0.83bE27.84±1.33bD105 CFU/g164.83±1.35aA0.20±0.01dB2.33±0.06dA241.66±1.52aC85.04±1.49aB106 CFU/g159.23±0.74aA0.18±0.01cB2.51±0.12cA257.38±1.46aB82.12±1.33aB15107 CFU/g147.60±1.49aB0.19±0.01bB2.42±0.15cA295.82±1.21aA126.66±1.41aA商业143.39±1.73aB0.24±0.01cA2.48±0.15dA206.31±1.48aD76.07±2.71aC自然98.33±4.47aC0.26±0.01bA2.55±0.10aA182.87±0.74aE57.03±0.62aD
注:不同小写字母表示在不同时间点同一发酵香肠组的差异显著(P<0.05),不同大写字母表示不同发酵香肠组在同一时间点的差异显著(P<0.05)
2.2.2 牛肉香肠发酵过程中感官评价的变化
图4表示的是牛肉香肠发酵过程中各实验组感官评价的变化。感官评价主要从组织状态、色泽、风味、咀嚼性、总体可接受度5个方面进行。
随着发酵时间的增加整体呈现先上升后下降的趋势(除自然发酵外)。复配菌株组发酵9 d时达到感官评价的最高值,商业菌株组在发酵12 d时达到感官评价的最高值,自然发酵组在发酵过程中的感官评价分数一直呈上升趋势,在发酵15 d时达到最大值。这可能是因为复配菌株组和商业菌株组在发酵过程中乳酸菌含量较高导致pH降低变快,比自然发酵组更早到达了感官评价的峰值。在发酵终期(15 d),接种量为107 CFU/g组、商业菌株组及自然发酵组的感官评分差异不显著(P>0.05),添加发酵剂较自然发酵总体接受度差别不大。

图4 牛肉香肠发酵过程中感官评价的变化
Fig.4 The changes in sensory evaluation during fermentation of beef sausage
2.3 牛肉香肠发酵过程中脂肪和蛋白质氧化程度
2.3.1 牛肉香肠发酵过程中丙二醛含量的变化
丙二醛是脂质过氧化的降解产物之一,可用作反映肉制品脂肪氧化的程度,丙二醛含量越高,脂肪氧化程度越深。图5表明,各组香肠的丙二醛含量随着发酵时间的增长而不断增加。在发酵过程中自然发酵组的丙二醛含量始终显著高于其他4组(P<0.05),这与BOZKURT等[19]及BAKA等[20]的结果类似。说明菌株的添加降低了脂肪氧化酸败的程度。这可能是由于乳酸菌和葡萄球菌在肉类发酵和成熟过程中产生的超氧化物歧化酶及过氧化氢酶分解了牛肉香肠发酵成熟过程中产生的过氧化物[21],从而抑制了脂肪氧化。结果表明不添加菌株的自然发酵组的脂肪氧化程度较大,并且在发酵牛肉香肠中添加发酵剂能有效延缓脂肪的氧化,提高发酵香肠的安全性。

图5 牛肉香肠发酵过程中丙二醛含量的变化
Fig.5 The change of malondialdehyde content during fermentation of beef sausage
2.3.2 牛肉香肠发酵过程中羰基数量的变化
羰基的含量反映了蛋白氧化的程度,是蛋白质氧化的一个明显标志。由图6可知,随着发酵时间的增加,5组发酵香肠的羰基质量摩尔浓度逐渐增加(P<0.05)。蛋白的某些氨基酸残基受到自由基的攻击,催化蛋白质氧化,导致羰基含量增加[22]。在发酵的6个阶段里自然发酵组的羰基含量明显高于其他4组(P<0.05),这说明自然发酵组的蛋白氧化程度比其他4组严重。且在发酵12~15 d内产生的羰基含量趋于平稳,目前很少见到关于发酵肉中蛋白氧化情况的研究,不过蛋白质氧化与脂肪氧化之间联系密切,根据相关的研究[23-24],脂肪氧化产生的过氧化物可能会与蛋白质产生交互作用,从而诱导蛋白质氧化,促进蛋白羰基类物质的产生及巯基的流失;而乳酸菌和葡萄球菌在肉类发酵和成熟过程中产生超氧化物歧化酶及过氧化氢酶能够分解猪肉香肠发酵成熟过程中产生的过氧化物,从而抑制了后续醛类和酮类等氧化产物的生成。本研究发现随着牛肉发酵香肠丙二醛含量上升,蛋白的巯基质量摩尔浓度呈现下降趋势,羰基质量摩尔浓度呈现上升趋势,也印证了这一结论。
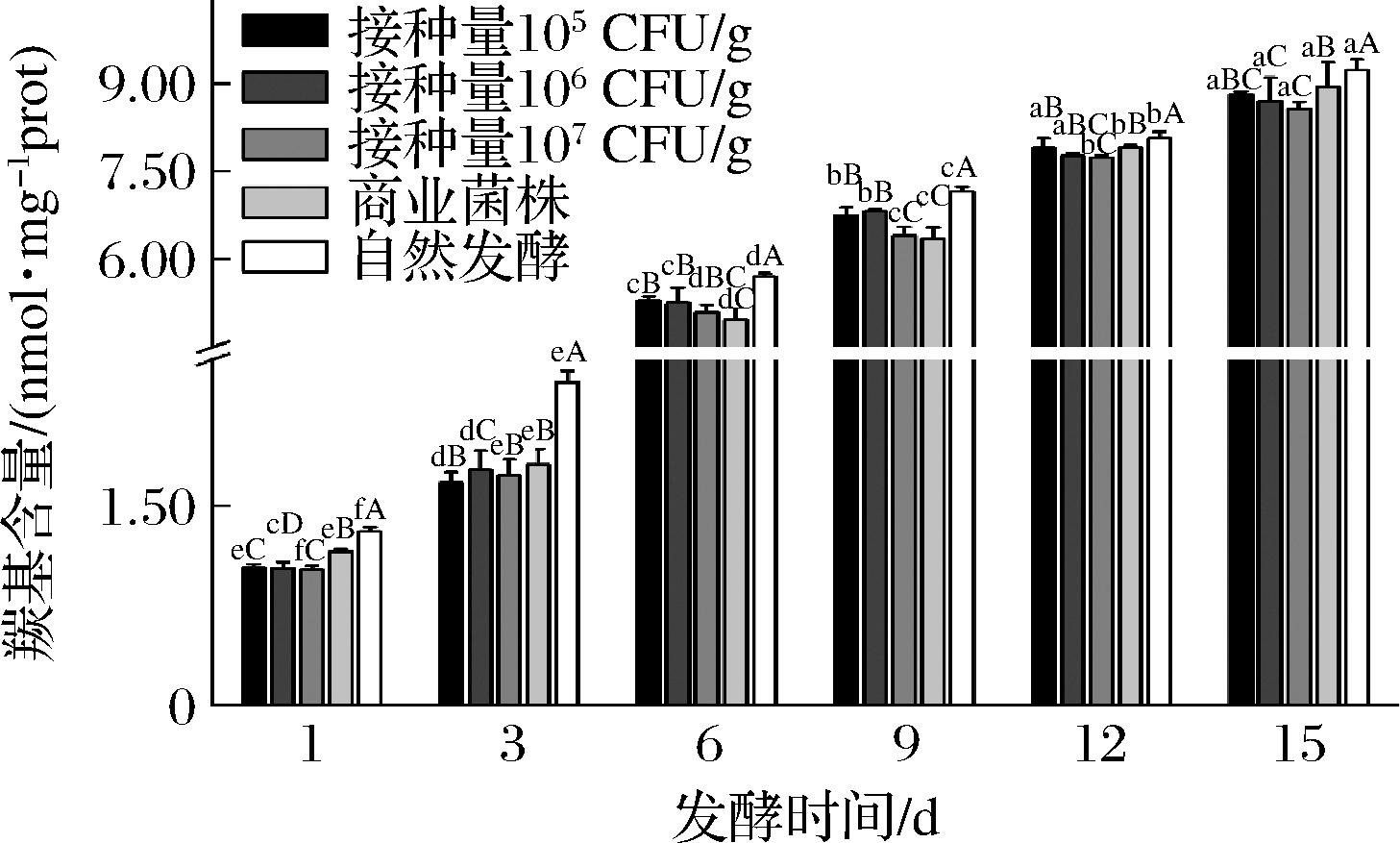
图6 牛肉香肠发酵过程中羰基含量的变化
Fig.6 The change of carbonyl content during fermentation of beef sausage
2.3.3 牛肉香肠发酵过程中巯基含量的变化
由图7可知,总巯基质量摩尔浓度随时间的延长而显著下降(P<0.05)。这是由于巯基被氧化成了二硫键,而巯基质量摩尔浓度下降的越多,说明蛋白被氧化的越严重[25]。自然发酵组的巯基含量明显低于其他4组(P<0.05),在发酵6 d前接种量为105组和接种量为106 CFU/g组的巯基含量低于接种量为107CFU/g组和商业菌株组,但在9 d后只有接种量为107 CFU/g组的巯基含量显著高于其他4组(P<0.05)。说明随着时间的延长,发酵牛肉香肠接种量多可以有效的降低蛋白的氧化程度。这与上文羰基质量摩尔浓度的结果是一致的。
图7 牛肉香肠发酵过程中巯基含量的变化
Fig.7 The change of sulfhydryl content during fermentation of beef sausage
2.4 牛肉香肠发酵过程中安全指标的变化
2.4.1 牛肉香肠发酵过程中亚硝酸盐含量的变化
亚硝酸盐拥有显色、改善风味、防止腐败及抑制有害微生物生长等多种作用,它经常被应用于肉制品加工中。亚硝酸盐会生成具有的致癌性亚硝基化合物,食品中残留的亚硝酸盐限值为30 mg/kg[26]。由图8可知,5组的亚硝酸盐含量在发酵过程中均显著(P<0.05)降低。复配菌株组和商业菌株组在9~15 d时逐渐稳定在2 mg/kg左右。自然发酵组在发酵过程中亚硝酸盐残留量的降低幅度较缓慢,在15 d时亚硝酸盐残留量显著(P<0.05)高于其余4组。这可能是因为发酵剂的添加使发酵牛肉香肠中形成了酸性的环境,较低的pH有利于亚硝酸钠的还原,使亚硝酸盐的残留量有所减少[27]。在发酵过程中各组的亚硝酸盐残留量均不超过的30 mg/kg安全标准。

图8 牛肉香肠发酵过程中亚硝酸盐残留量的变化
Fig.8 The change of nitrite residue during fermentation of beef sausage
2.4.2 牛肉香肠发酵过程中微生物数量的变化
2.4.2.1 牛肉香肠发酵过程中细菌总数的变化
由图9可知,5组的细菌总数在发酵1~3 d过程中均显著增加(P<0.05),3~9 d过程中细菌总数的增加趋势较为缓慢,在9 d时细菌总数达到最大值,且复配菌株组和商业菌株组的细菌总数显著高于自然发酵组(P<0.05)。发酵9 d之后,由于pH的下降导致有害微生物生长受到抑制,所以细菌总数缓慢下降。此外,水分含量和水分活度以及发酵条件会影响微生物的生长,使细菌总数下降,这与SWETWIWATHANA等[28]的研究结果相同。复配菌株组和商业菌株组的细菌总数在15 d时显著高于自然发酵组(P<0.05)。

图9 牛肉香肠发酵过程中细菌总数的变化
Fig.9 The change of total bacterial count during fermentation of beef sausage
2.4.2.2 牛肉香肠发酵过程中乳酸菌数量的变化
由图10可知,在发酵前期(0~3 d),5组乳酸菌数量均显著上升(P<0.05),在发酵3 d时乳酸菌数量达到最高,复配菌株组和商业菌株组的乳酸菌数量均显著高于自然发酵组(P<0.05)。这可能是因为在接种了优势乳酸菌后,乳酸菌在发酵期间快速生长繁殖。发酵后期,各组乳酸菌的生长趋势逐渐趋于平缓甚至数量上有所下降,可能是由于乳酸菌在繁殖的过程中产生的乳酸和有机酸抑制了自身的生长,另外也与发酵的温度、湿度条件的变化有关。不同接种量的发酵香肠乳酸菌的数量差异显著(P<0.05),其中接种量为107 CFU/g组数量最多,这可能与接入乳酸菌的数量有关。

图10 牛肉香肠发酵过程中乳酸菌数量的变化
Fig.10 The change of lactic acid bacteria during fermentation of beef sausage
2.4.2.3 牛肉香肠发酵过程中葡萄球菌数量的变化
由图11可知,在发酵过程中,葡萄球菌数量低于乳酸菌(图10),乳酸菌的生长代谢及pH值的降低会对葡萄球菌的生长繁殖产生一定的抑制作用[29]。自然发酵组在6~15 d中的葡萄球菌显著高于其余4组发酵香肠。另外各组葡萄球菌的数量在发酵一段时间上升后呈现下降趋势,可能是因为乳酸菌代谢产生的乳酸导致香肠内部的pH值下降,从而抑制了葡萄球菌的生长,另外由于水分含量减少及水分活度降低会不利于葡萄球菌的生长。葡萄球菌可以使香肠色泽红润、增加香肠中醇类等挥发性风味物质的含量起到提高香气的作用[30]。结合感官评价(图4)可知,自然发酵组中葡萄球菌数量最多,发酵终期感官总分显著高于接种量为105、106 CFU/g组(P<0.05),与接种量为107 CFU/g组差异不显著,可能是因为葡萄球菌在前期起了增加风味的作用。
2.4.2.4 牛肉香肠发酵过程中肠杆菌数量的变化
肠杆菌作为发酵肉制品的微生物安全性指示菌,肠杆菌的测定具有重要的公共学卫生意义[31]。如图12所示,在发酵第1天时,肠杆菌的数量在4.50 lg CFU/g左右,由于发酵的过程中水分含量和pH值以及水分活度的下降,导致了各组肠杆菌数量的降低。复配菌株组和商业菌株组在发酵过程中肠杆菌数量下降的速度更快,在发酵结束时,接种量为105 CFU/g组、106 CFU/g组、107 CFU/g组、商业菌株组和自然发酵组的肠杆菌数量分别为2.83 lg CFU/g、2.77 lg CFU/g、2.55 lg CFU/g、2.49 lg CFU/g、3.27 lg CFU/g,接入了菌株的发酵牛肉香肠中肠杆菌的数量显著低于自然发酵组(P<0.05),说明加入发酵剂对提高发酵牛肉香肠产品的安全性有积极作用。
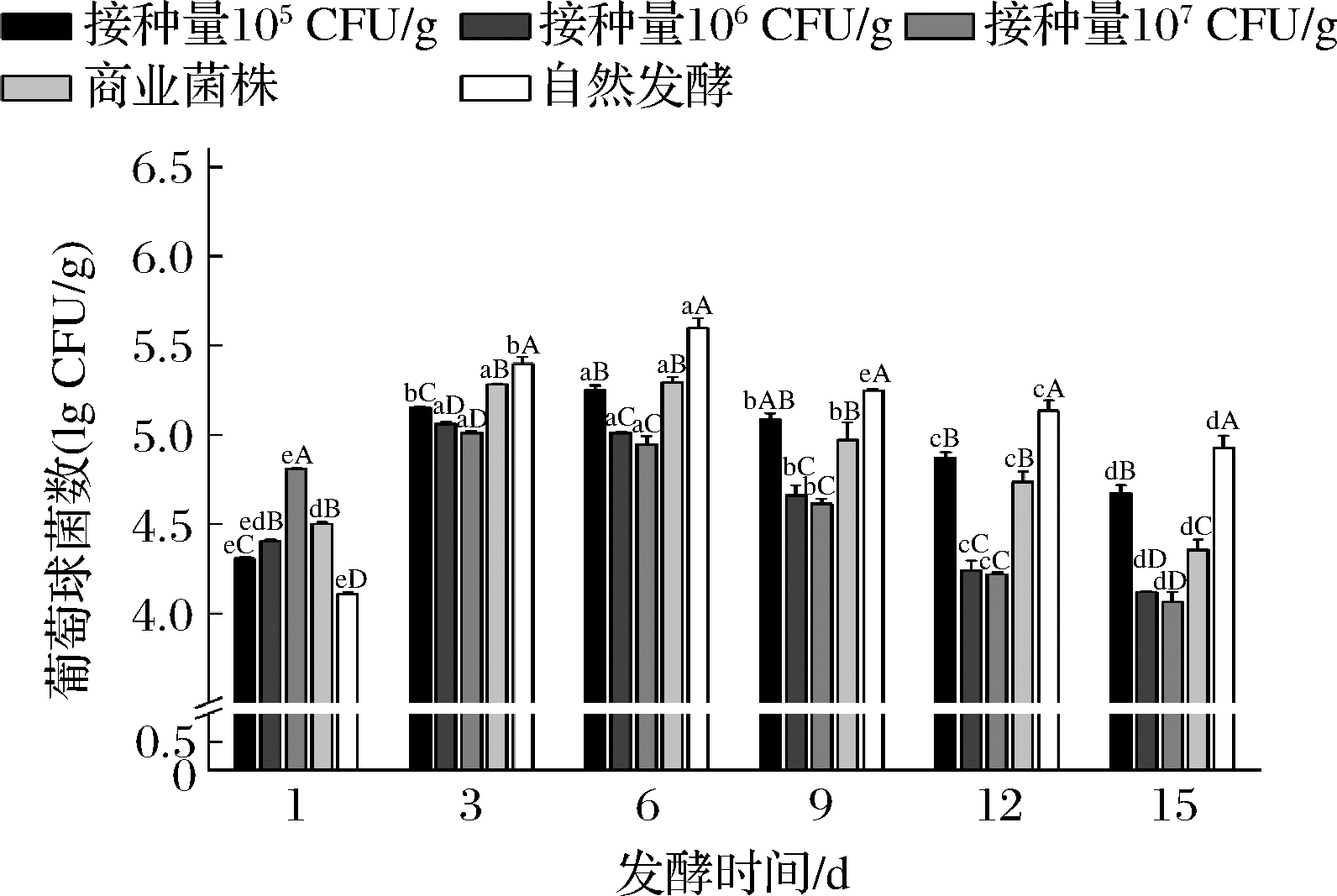
图11 牛肉香肠发酵过程中葡萄球菌的变化
Fig.11 The change of Staphylococcus during fermentation of beef sausage

图12 牛肉香肠发酵过程中肠杆菌数量的变化
Fig.12 The changes in the number of Enterobacteriaceae during the fermentation of beef sausage
3 结论
研究表明,在牛肉香肠发酵15 d时,pH值、水分活度及水分含量达到最低,其中接种量为107 CFU/g组的pH值和水分活度分别是4.7和0.87。随着pH值和水分活度的降低,亚硝酸盐的含量和肠杆菌的数量显著减少。接种量为106 CFU/g组在发酵15 d时亚硝酸盐含量最低,为1.8 mg/kg,接种量为107 CFU/g组肠杆菌数量最少,为2.49 lg CFU/g,而与自然发酵组相比,接种量为105 CFU/g组就可以有效降低亚硝酸盐含量和肠杆菌数量,说明发酵剂的添加有利于提高发酵香肠的安全性,另外该组也显著降低脂肪和蛋白质的氧化程度。在发酵终期(15 d),接种量为107 CFU/g组和商业菌株组与自然发酵在感官总分上差异不显著,说明两组可以基本达到与自然发酵组相同的风味。综上,在发酵15 d时,接种量为107 CFU/g的清酒乳杆菌和肉葡萄球菌(比例为1∶1)复配发酵剂的添加有利于提高发酵香肠的安全性,且在感官方面总体接受度较好,对香肠品质有明显的积极的影响,可以为后续进一步研究两菌发酵剂提供理论基础。
[1] 田建军. 传统发酵肉制品中微生物多样性、功能乳酸菌代谢产物及基因序列分析[D].呼和浩特:内蒙古农业大学, 2019.
TIAN J J.Microbial diversity, functional lactic acid bacteria metabolites and gene sequence analysis in traditional fermented meat products[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[2] WEN R X, LI X G, HAN G, et al.Fungal community succession and volatile compound dynamics in Harbin dry sausage during fermentation[J].Food Microbiology, 2021, 99:103764.
[3] 王俊钢, 李开雄, 韩冬印.国内外发酵香肠的研究现状及其展望[J].肉类工业, 2009(6):49-51.
WANG J G, LI K X, HAN D Y.Research status and prospect of fermentation sausage in domestic and foreign countries[J].Meat Industry, 2009(6):49-51.
[4] GE Q F, CHEN S, LIU R, et al.Effects of Lactobacillus plantarum NJAU-01 on the protein oxidation of fermented sausage[J].Food Chemistry, 2019, 295:361-367.
[5] YANG P, ZHONG G X, YANG J C, et al.Metagenomic and metabolomic profiling reveals the correlation between the microbiota and flavor compounds and nutrients in fermented sausages[J].Food Chemistry, 2022,375:131645.
[6] XIAO Y Q, LIU Y N, CHEN C G, et al. Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J]. Food Research International (Ottawa, Ont.), 2020, 135:109247.
[7] 蔡嘉铭, 王际辉, 陶冶, 等.霉菌发酵剂对干发酵香肠的理化指标、氧化程度及风味的影响[J].食品与发酵工业, 2020, 46(5):17-22.
CAI J M, WANG J H, TAO Y, et al.The effects of mould starter on the physicochemical parameters,oxidation degree and flavor of dry-cured sausage[J].Food and Fermentation Industries, 2020, 46(5):17-22.
[8] STAVROPOULOU D A, DE MAERE H, BERARDO A, et al.Pervasiveness of Staphylococcus carnosus over Staphylococcus xylosus is affected by the level of acidification within a conventional meat starter culture set-up[J].International Journal of Food Microbiology, 2018,274:60-66.
[9] 龚珏, 唐善虎, 李思宁, 等.乳酸菌对发酵牦牛肉灌肠理化性质及挥发性风味物质的影响[J].食品与发酵工业, 2020, 46(4):57-64.
GONG J,TANG S H,LI S N, et al.Effect of lactic acid bacteria on physicochemical properties and volatile flavor substances of fermented yak meat sausage[J].Food and Fermentation Industries, 2020, 46(4):57-64.
[10] 李龙祥, 赵欣欣, 夏秀芳, 等.食盐对调理重组牛肉制品品质及水分分布特性的影响[J].食品科学, 2017, 38(19):143-148.
LI L X, ZHAO X X, XIA X F, et al.Effect of salt on quality and water distribution characteris tics of ready-to-eat restructured beef products[J].Food Science, 2017, 38(19):143-148.
[11] 李珊珊. 传统发酵肉制品中发酵菌株的分离筛选及在牛肉发酵香肠中的应用初探[D].郑州:河南农业大学, 2021.
LI S S.Isolation and screening of fermented strains from traditional fermented meat products and its application in beef fermented sausage[D].Zhengzhou:Henan Agricultural University, 2021.
[12] 顾于滨. 金华火腿中优良菌株的筛选及其对发酵香肠品质与生物胺含量的影响研究[D].扬州:扬州大学.2017.
GU Y B.Screening of excellent strains in Jinhua ham and their effects on the quality and biogenic amine content of fermented sausage[D].Yangzhou:Yangzhou University, 2017.
[13] JAYAWARDANA B C, LIYANAGE R, LALANTHA N, et al.Antioxidant and antimicrobial activity of drumstick (Moringa oleifera) leaves in herbal chicken sausages[J].LWT-Food Science and Technology, 2015, 64(2):1 204-1 208.
[14] RUIZ-MOYANO S, MART N A, BENITO M J, et al.Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dry-fermented sausages[J].Food Microbiology, 2011, 28(5):839-847.
N A, BENITO M J, et al.Application of Lactobacillus fermentum HL57 and Pediococcus acidilactici SP979 as potential probiotics in the manufacture of traditional Iberian dry-fermented sausages[J].Food Microbiology, 2011, 28(5):839-847.
[15] HU Y J, XIA W S, GE C R.Effect of mixed starter cultures fermentation on the characteristics of silver carp sausages[J].World Journal of Microbiology and Biotechnology, 2007, 23(7):1 021-1 031.
[16] LORENZO J M, FRANCO D.Fat effect on physico-chemical, microbial and textural changes through the manufactured of dry-cured foal sausage Lipolysis, proteolysis and sensory properties[J].Meat Science, 2012, 92(4):704-714.
[17] GONZ LEZ-FERN
LEZ-FERN NDEZ C, SANTOS E M, ROVIRA J, et al.The effect of sugar concentration and starter culture on instrumental and sensory textural properties of chorizo-Spanish dry-cured sausage[J].Meat Science, 2006, 74(3):467-475.
NDEZ C, SANTOS E M, ROVIRA J, et al.The effect of sugar concentration and starter culture on instrumental and sensory textural properties of chorizo-Spanish dry-cured sausage[J].Meat Science, 2006, 74(3):467-475.
[18] 王泽, 张岩, 陈炼红.Edam牦牛干酪成熟过程中品质变化及蛋白质降解[J].食品科学, 2023,44(2):116-124.
WANG Z, ZHANG Y, CHEN L H.Quality change and protein degradation of Edam yak cheese during ripening[J].Food Science, 2023,44(2):116-124.
[19] BOZKURT H, ERKMEN O.Effects of some commercial additives on the quality of sucuk (Turkish dry-fermented sausage)[J].Food Chemistry, 2007, 101(4):1 465-1 473.
[20] BAKA A M, PAPAVERGOU E J, PRAGALAKI T, et al.Effect of selected autochthonous starter cultures on processing and quality characteristics of Greek fermented sausages[J].LWT-Food Science and Technology, 2011, 44(1):54-61.
[21] BARRI RE C, CENTENO D, LEBERT A, et al.Roles of superoxide dismutase and catalase of Staphylococcus xylosus in the inhibition of linoleic acid oxidation[J].FEMS Microbiology Letters, 2001, 201(2):181-185.
RE C, CENTENO D, LEBERT A, et al.Roles of superoxide dismutase and catalase of Staphylococcus xylosus in the inhibition of linoleic acid oxidation[J].FEMS Microbiology Letters, 2001, 201(2):181-185.
[22] 杨慧娟. 超高压处理改善低脂低盐猪肉糜制品乳化凝胶特性研究[D].南京:南京农业大学, 2017.
YANG H J.High Pressure Processing alters the emulsifying and gel properties of pork meat batters with low-fat and low-salt[D].Nanjing:Nanjing Agricultural University, 2017.
[23] 韦诚, 常荣, 段珍珍, 等.发酵时长对酸肉物理特性及食用安全性的影响[J].食品与发酵工业, 2019, 45(8):86-92.
WEI C, CHANG R, DUAN Z Z, et al.Effects of fermentation time on physical properties and food safety of sour meat[J].Food and Fermentation Industries, 2019, 45(8):86-92.
[24] 张培培. 不同氧化油脂对中式香肠中蛋白质氧化的影响[D].扬州:扬州大学, 2014.
ZHANG P P.Effect of different oxidizing oils on protein oxidation in Chinese style sausage[D].Yangzhou:Yangzhou University, 2014.
[25] 卢涵, 张香美, 彭澎, 等.混合发酵剂对发酵香肠脂肪酸败和蛋白质氧化的影响[J].西北农业学报, 2019, 28(9):1 552-1 560.
LU H, ZHANG X M, PENG P, et al.Effects of mixed culture starters on the fat rancidity and protein oxidation of fermented sausage[J].Acta Agriculturae Boreali-occidentalis Sinica, 2019, 28(9):1 552-1 560.
[26] 巩洋. 低酸度川式萨拉米香肠的工艺优化及其品质变化研究[D].雅安:四川农业大学, 2015.
GONG Y.Process Optimization of Low Acidity Sichuan-style Salami and Study on the Quality Changes in Processing[D].Ya′an:Sichuan Agricultural University, 2015.
[27] 张玉. 发酵牛肉干发酵工艺优化及品质特性研究[D].长春:吉林大学, 2021.
ZHANG Y.Study on fermentation process optimization and quality characteristics of fermented beef jerky[D].Changchun:Jilin University, 2021.
[28] SWETWIWATHANA A, VISESSANGUAN W.Potential of bacteriocin-producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J].Meat Science, 2015, 109:101-105.
[29] KAISER A L, MONTVILLE T J.Purification of the bacteriocin bavaricin MN and characterization of its mode of action against Listeria monocytogenes Scott A cells and lipid vesicles[J].Applied and Environmental Microbiology, 1996, 62(12):4 529-4 535.
[30] 于子洋. 复合发酵剂发酵香肠工艺优化及理化性质分析[D].沈阳:沈阳农业大学, 2018.
YU Z Y.Processing technology optimzation on compound starter cultures fermented sausages and its physical and chemical analysis[D].Shenyang:Shenyang Agricultural University, 2018.
[31] 陈曦, 许随根, 周彤, 等.贵州酸肉中的植物乳杆菌对发酵香肠风味和品质特性的影响[J].中国食品学报, 2018, 18(6):174-182.
CHEN X, XU S G, ZHOU T, et al.Effect of autochthonous Lactobacillus plantarum from Guizhou fermented meat (nanx wudl) on flavor and quality characteristics of fe ermented sausages[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(6):174-182.